四唑虫酰胺是由德国拜耳公司研发的新型邻甲酰氨基苯甲酰胺类杀虫剂[1-2],主要以鱼尼丁受体和γ-氨基丁酸受体为靶标通过胃毒方式发挥作用[3],兼具触杀活性,可快速使害虫停止取食,持续药效期长[4-5]。该杀虫剂低剂量就能高效且相对安全的防治多种农作物的虫害[6],且其在不同温度和酸碱环境下稳定性良好,未发现害虫对其具有抗药性[7-9]。该型农药已经于2020年在我国获得登记,并逐步开始应用[10]。虽然其靶向性好,对哺乳动物和鸟类为低毒性,但是其对水生无脊椎动物、底栖动物和蜜蜂等生物具有较高的危险性[11]。因此,有必要对其进行监测。
目前,加拿大和美国均发布了关于四唑虫酰胺食品中最大限量值的公告。国内对于四唑虫酰胺的研究主要集中于对其防治虫害效果和虫害抗性研究[2-4, 6-9, 12-13]。国内对其的检测方法的研究也主要是对其混悬剂及其代谢物的研究[14-16],余苹中等[16]研究了番茄中四唑虫酰胺及其代谢物的检测方法,汪庆屹等[17]研究了马铃薯中四唑虫酰胺的检测方法及消解动态。国外LI等[18]研究了试验田间水稻及其相应生长环境中四唑虫酰胺残留量的检测方法,但是针对水产品中该型农药的检测方法未见报道,且相对于家畜家禽需要通过食物链从原料到饲料再至其体内富集,水产品可由播撒了四唑虫酰胺的土壤经过雨水冲刷污染水体后直接在体内富集,相对更容易受到污染。因此有必要建立水产品中四唑虫酰胺的检测方法。
如今农药残留检测中主流的前处理方法主要为固相萃取法[5, 18-19]、分散液液微萃取法[20-21]、QuEChERS净化法[22-23]。多壁碳纳米管(multi-walled carbon nanotube,MWCNTs)是一种新型纳米吸附材料,其吸附能力和化学稳定性优异[23-26],且有相对传统石墨化炭黑(graphitized carbon black,GCB)吸附剂更强的进化能力和对平面结构的农药更小的吸附作用[23-27]。亲水-亲脂平衡反相小柱(Prime-HLB)固相萃取小柱无需活化可直接使用,且其对水产中的脂质和蛋白质类杂质有优秀的去除效果[28-30]。快速滤过型净化技术(m-PFC)是将改良型QuEChERS吸附剂填入固相萃取管内,无需活化淋洗,直接按压过滤净化的一种快速、高效的前沿农残前处理净化方法[31-33]。本研究以水产品为研究对象,通过优化液相色谱和质谱检测条件、提取方法,并对比传统固相萃取(SPE)净化(HLB柱)、改进型SPE净化(Prime HLB柱)、MWCNTs改进QuEChERS净化和m-PFC净化(Clean-up LPAS柱)的净化效果,建立了一种MWCNTs改进QuEChERS净化结合高效液相色谱串联质谱法快速测定水产品中四唑虫酰胺的分析方法,旨在为水产品中四唑虫酰胺的限量标准制定和检测方法提供技术支撑和理论参考。
1 材料与方法
1.1 材料与试剂
乙腈、甲醇、甲酸(均为色谱纯)、C18粉末(40~63 μm)、乙二胺-N-丙基硅烷化硅胶(ethylenediamine-N-propylsilane-silicagel,PSA)、HLB固相萃取小柱(60 mg/3 mL),上海安谱实验科技股份有限公司;四唑虫酰胺(Tetraniliprole)标准品,纯度98.1%,天津阿尔塔科技有限公司;超纯水,实验室纯水仪制备;检测样品,国家农副产品检测中心;NaCl、无水MgSO4,分析纯,国药集团上海有限公司;MWCNTs、Clean-up LPAS多功能净化柱(200 mg/6 mL),北京科德诺思技术有限公司;Prime HLB固相萃取小柱,60 mg/3 mL,沃特世科技(上海)有限公司。
1.2 仪器与设备
TSQ Quantis高效液相色谱质谱联用仪,Thermo Fisher Scientific公司;VXMNAL涡旋混匀器,OHAUS公司;YQ-1007A超声波清洗机,上海易净公司;Sorvall ST16高速离心机,Thermo Electron公司;ELIX3 Essential+Reference超纯水仪,Merck Millipore公司。
1.3 标准溶液配制
1.3.1 标准储备液配制
称取一定质量的四唑虫酰胺标准品,使用乙腈配制成1.0 mg/mL的标准储备液,于-18 ℃保存。
1.3.2 中间质量浓度标准溶液配制
精密量取1.0 mg/mL的标准储备液0.1 mL于10 mL容量瓶,用乙腈定容至刻度,配制成10 μg/mL的中间质量浓度标准溶液,于4 ℃下保存。
1.3.3 标准工作液配制
精密量取10 μg/mL的中间质量浓度标液1.0 mL 于10 mL容量瓶,用乙腈定容至刻度,配制成1.0 μg/mL 标准工作液,现配现用。
1.4 样品处理
取大于200 g水产品样品,切碎后用刀式研磨仪充分搅碎混匀,放入塑料袋中,于-20 ℃保藏。
1.5 样品处理
准确称取5 g(精确至0.01 g)样品于50 mL塑料离心管,加入5 mL水,充分混匀,加入20 mL乙腈,剧烈振摇1 min,超声波提取20 min,加入4 g无水MgSO4,4 g无水Na2SO4,涡旋1 min,11 000×g离心5 min,取上清液与另一50 mL离心管,重复上述提取步骤,合并提取液,取一定体积上清液于15 mL离心管,加入QuEChERS净化包(每毫升样液加入3 mg MWCNTs、60 mg PSA和50 mg C18),涡旋混匀1 min,11 000×g离心5 min,取上清液经0.22 μm有机滤膜过滤于进样瓶后供高效液相色谱质谱联用仪上机测定。
1.6 基质匹配标准曲线制备
取阴性样品,依照1.5节操作,制备成空白基质溶液,取适量混合标准工作液,用空白基质溶液配制成0.1、0.2、0.5、1.0、2.0、5.0、10、20 μg/L的基质匹配标准溶液,供高效液相色谱质谱/质谱联用仪上机测定。以测得目标物峰面积为纵坐标,对应的标准溶液质量浓度为横坐标,绘制标准曲线,求回归方程和相关系数。
1.7 仪器参数
1.7.1 液相色谱参数
色谱柱:Venusil MP C18柱,100 mm×2.1 mm,2.1 μm,美国Agilent公司;流速0.40 mL/min;柱温箱温度35 ℃;进样体积2 μL;A相为水,B相为甲醇(MS级),液相梯度洗脱程序:0~2.00 min:90% A~5% A;2.00~3.50 min:5% A;3.51~5.00 min:90% A。
1.7.2 质谱参数
离子源:电喷雾电离离子源(ESI 2800 V);扫描方式:负离子扫描;检测方式:多反应监测模式(SRM);离子传输管温度325 ℃;鞘气(N2)压力40 Arb;辅助气(N2)压力10 Arb;定性定量离子对及透镜电压和碰撞能见表1,定量离子用*标记。
表1 四唑虫酰胺质谱参数
Table 1 Mass spectrometric parameters of tetraniliprole

被测物质名称母离子(m/z)子离子(m/z)透镜电压/V碰撞能/eV四唑虫酰胺543274.06∗137.0421631639.1716.75
1.8 数据处理
图谱采集及数据处理采用Thermo Scientific Xcalibur软件,统计分析使用SPSS 24.0、SPSSAU和Statistix 9.0软件,图像处理采用OriginLab 2019软件。
2 结果与讨论
2.1 仪器条件的优化
2.1.1 色谱柱的选择
为优化四唑虫酰胺色谱峰的分离以及出峰峰型的改善,分别对比使用Thermo Hypersil GOLD C18柱(100 mm×2.1 mm,2.1 μm),Agilent Venusil MP C18(100 mm×2.1 mm,3 μm)和ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)3种色谱柱下四唑虫酰胺的出峰峰形和响应强度,发现四唑虫酰胺在Agilent Venusil MP C18的响应强度最优且峰型相较其他色谱柱更尖细,且无拖尾现象,认为其更适合四唑虫酰胺残留的检测,四唑虫酰胺在不同色谱柱下总离子流图见图1。
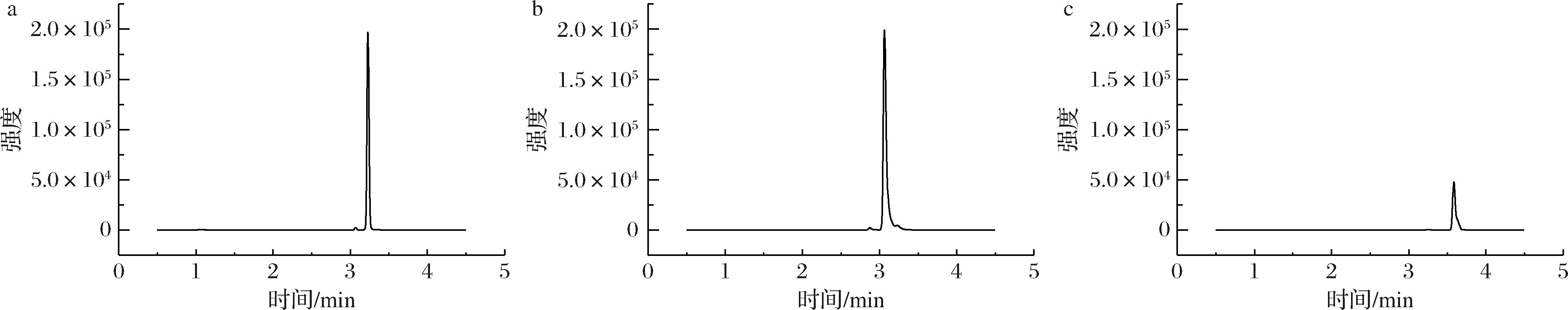
a-Agilent Venusil MP C18色谱柱;b-Thermo Hypersil GOLD C18色谱柱;c-ACQUITY UPLC BEH C18色谱柱
图1 不同色谱柱四唑虫酰胺总离子流图
Fig.1 Total ion chromatograms of tetraniliprole on different chromatographic columns
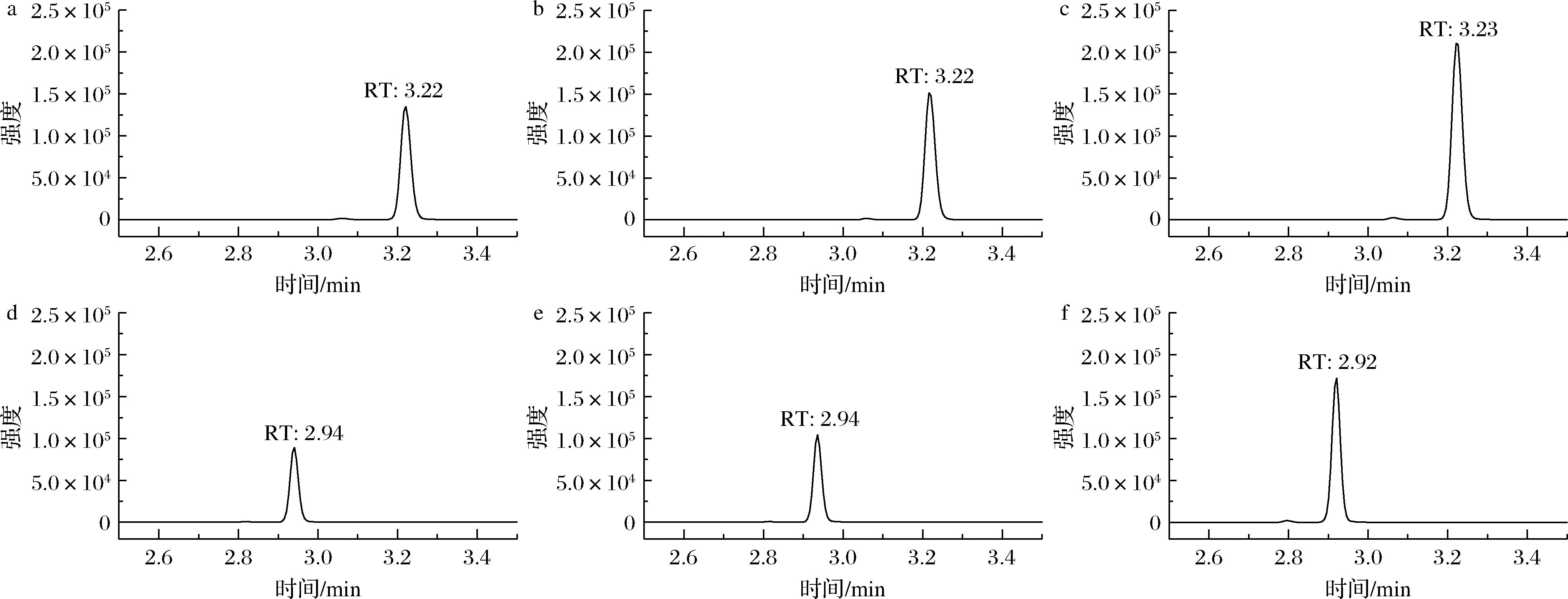
a-甲醇-0.1%甲酸水体系;b-甲醇-5 mmol/L甲酸铵体系;c-甲醇-水体系;d-乙腈-0.1%甲酸水体系;e-乙腈-5 mmol/L甲酸铵体系;f-乙腈-水体系
图2 不同流动相条件下四唑虫酰胺提取离子流图
Fig.2 Extraction ion chromatograms of tetraniliprole under varying mobile phase conditions
2.1.2 流动相条件的优化
本研究对比研究了相同浓度四唑虫酰胺在甲醇、乙腈、水、0.1%甲酸水、5 mmol/L甲酸铵下的色谱峰分离情况。结果见图2。可见在6种流动相体系下四唑虫酰胺色谱峰均对称且尖细,而甲醇-水流动相体系中四唑虫酰胺的响应强度明显优于其他体系,故最终确定其为检测四唑虫酰胺的流动相体系。梯度洗脱条件见1.7.1节。
2.2 样品前处理条件的优化
2.2.1 提取试剂、提取试剂体积和提取方法的的选择
LI等研究了田间稻谷及其生长环境中四唑虫酰胺的测定方法[18],其所使用的分类提取液中水相和有机相的试剂为2 g NaCl,然而本研究通过前期对稀释后的标准工作液中直接加入2 g NaCl的实验发现NaCl对四唑虫酰胺有显著的吸附作用,检测值不到标准工作液实际值的10%,故考虑使用无水MgSO4和无水Na2SO4代替,通过预实验并结合本实验室同类型双酰胺类农药检测方法的研究[5],决定使用4 g无水硫酸镁和4 g无水硫酸钠作为辅助分离试剂。
以阴性草鱼样品为研究对象,向待测样本中加入20 μL 10 μg/mL的四唑虫酰胺标准中间液,研究对比了9种不同提取试剂对草鱼中四唑虫酰胺加标回收率的影响,结果见图3。可见在乙腈和乙酸乙酯提取液体系中酸的加入会显著降低四唑虫酰胺的回收率,且下降幅度和酸的添加量成正比。甲醇提取液体系中酸的加入可以略微提升四唑虫酰胺的回收率,但是对回收率影响不显著。而纯乙腈作为提取试剂时回收率显著优于其他类型的提取试剂的结果,故选择乙腈作为水产品中四唑虫酰胺的提取溶剂。
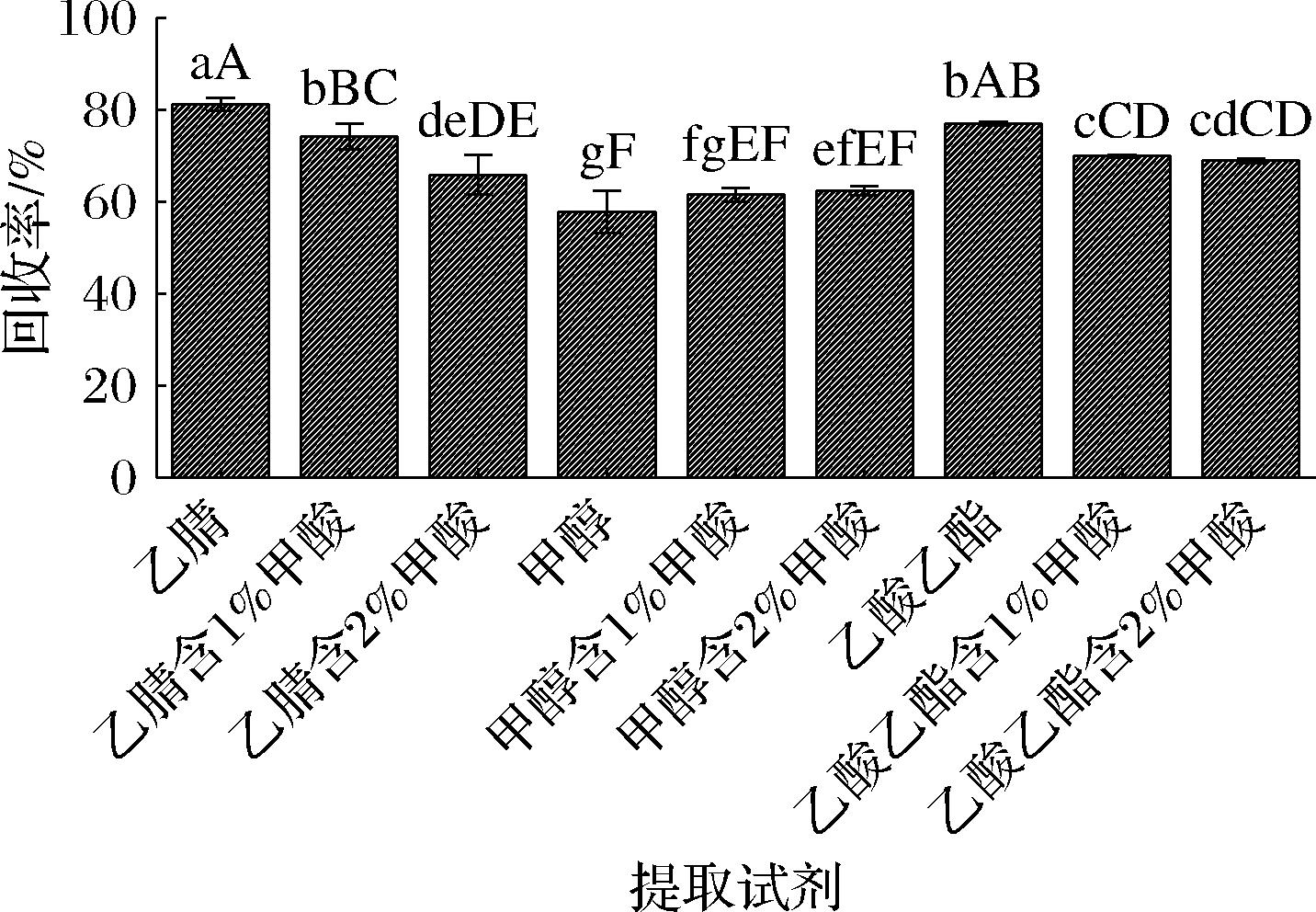
图3 不同提取试剂对四唑虫酰胺回收率的影响(n=3)
Fig.3 Effects of different extraction solvents on the recovery rate of tetraniliprole
注:同列上方不同小写字母表示具有显著性差异(P<0.05),同列上方不同大写字母表示具有极显著性差异(P<0.01)(下同)。
以阴性草鱼样品为研究对象对比了不同乙腈提取体积以及在最优提取体积下超声提取时间对四唑虫酰胺提取回收率的影响,结果见图4。首先固定超声波时间为20 min,当提取体积增大到20 mL目标物回收率已达最佳,再增加提取体积回收率无显著变化,故选择20 mL作为提取液加入体积。以上述提取体积为基础,优化超声波时间。当超声波时间达到20 min后目标物回收率达到最佳,超过20 min后回收率无显著变化。最终确定,使用20 mL乙腈超声波提取20 min提取作为水产品中四唑虫酰胺测定的前处理条件。
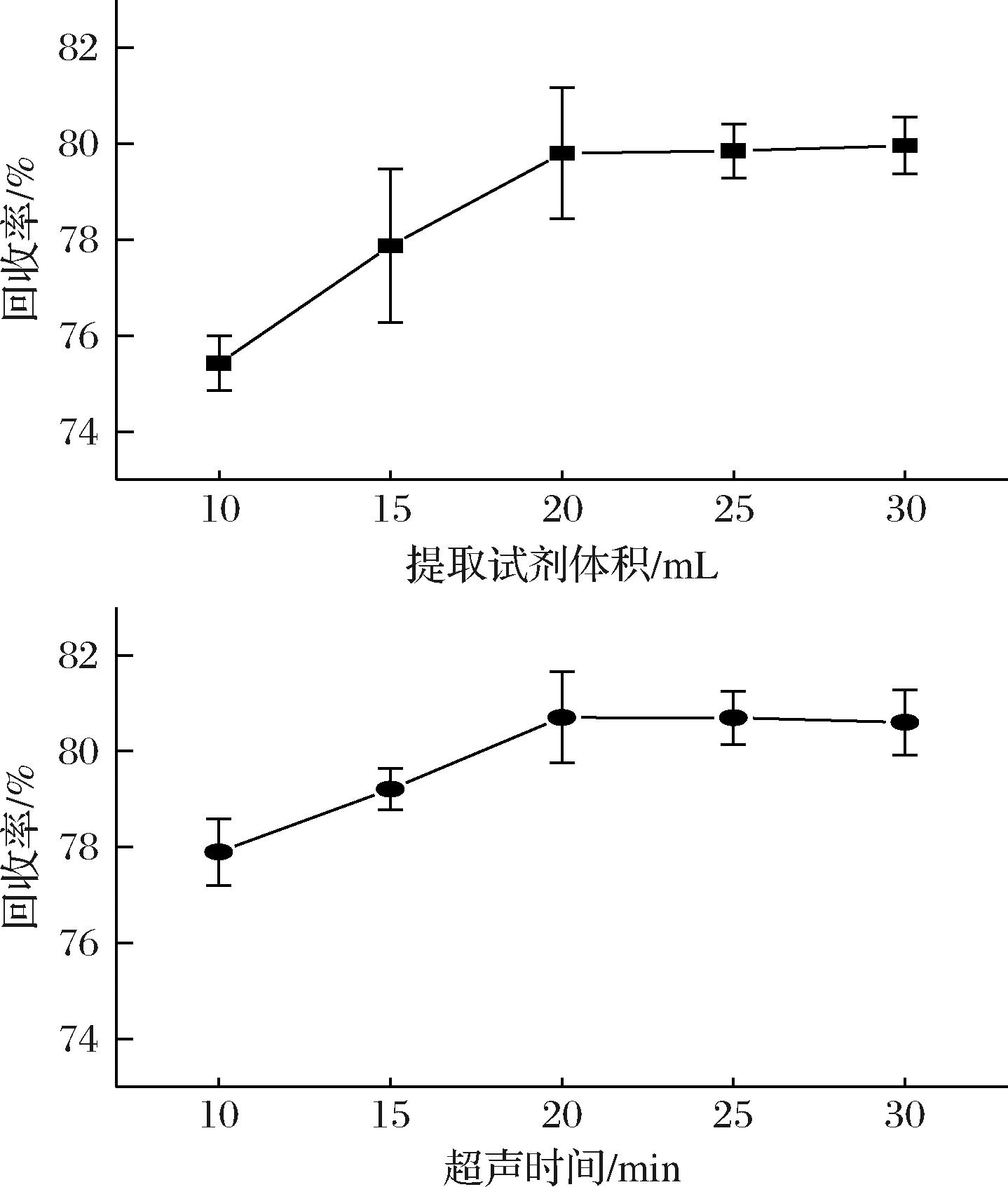
图4 不同提取体积和超声时间对四唑虫酰胺回收率的影响(n=3)
Fig.4 Effects of different extraction volumes and ultrasonic time on the recovery of tetraniliprole
2.2.2 净化条件的研究
2.2.2.1 净化吸附剂单因素实验
QuEChERS传统的吸附剂主要为PSA、C18和GCB。相较于LI等[18]以及汪庆屹等[17]分别使用10 mg 和20 mg GCB作为测定四唑虫酰的QuEChERS净化吸附剂,且回收率均能达到90%以上。本研究前期预实验通过向纯乙腈中加入一定量的标准工作液后加入20 mg GCB粉末的加标回收实验发现GCB会显著吸附四唑虫酰胺,导致回收率极显著降低,故考虑使用近年来新兴的MWCNTs来改进QuEChERS净化剂配方。
对MWCNTs、PSA、C18进行单因素实验以确定大致添加范围。以阴性草鱼样本为研究对象,以四唑虫酰胺回收率为评价指标,首先固定PSA和C18每毫升提取液添加量均为40 mg,通过添加不同质量的MWCNTs研究其对草鱼中四唑虫酰胺回收率的影响,结果如图5所示。随着MWCNTs添加量的增加,草鱼中四唑虫酰胺回收率呈现先上升后趋于平缓最后急剧下降的趋势,在其添加量为每毫升加入2 mg时四唑虫酰胺回收率达到最大值(90%),可见少量MWCNTs即可对草鱼基质有很好的净化效果,稍微过量即会对目标物有明显的吸附。固定MWCNTs和C18每毫升提取液添加量分别为2、40 mg,探究PSA的添加量对四唑虫酰胺回收率的影响。可见随着PSA添加量的增加,草鱼中四唑虫酰胺回收率呈现先上升后下降的趋势,在其添加量为每毫升加入40 mg时四唑虫酰胺回收率达到最大值(89%)。固定MWCNTs和PSA每毫升提取液添加量分别为2、40 mg,探究C18的添加量对四唑虫酰胺回收率的影响。可见随着C18添加量的增加,四唑虫酰胺回收率同样呈现先升后降的趋势,在C18的添加量为60 mg时回收率达到最大值(90%)。
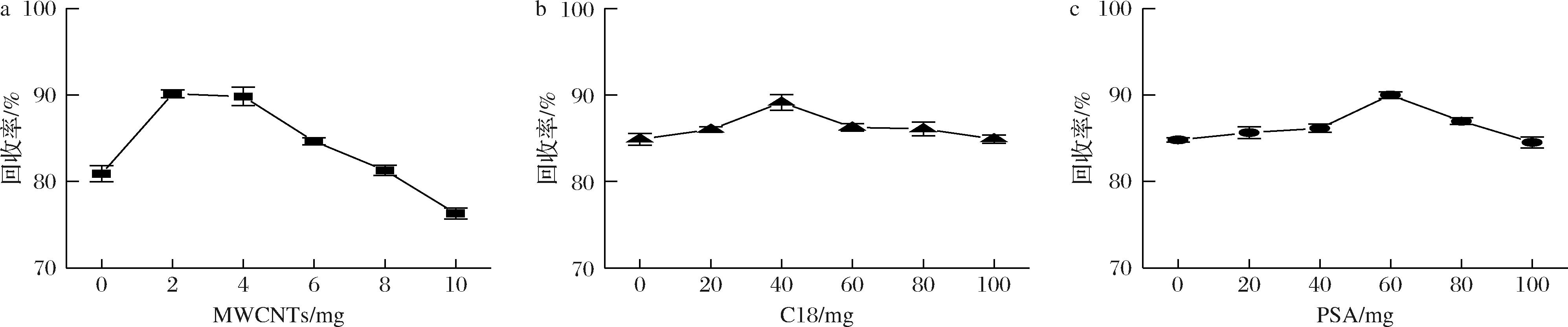
a-C18 40 mg PSA 40 mg;b-MWCNTs 2 mg PSA 40 mg;c-MWCNTs 2 mg C18 40 mg
图5 QuEChERS净化吸附剂单因素实验结果(n=3)
Fig.5 Results of single-factor experiment for QuEChERS purification adsorbent (n=3)
2.2.2.2 QuEChERS净化条件的研究
基于单因素实验的结果,对MWCNTs、PSA、C18在每毫升提取液中添加量分别设置4个水平,以阴性草鱼样品为研究对象,以加标回收率为评价指标,使用正交表L16.4.3设计正交实验,然后对实验结果进行三因素方差分析和极差分析。正交试验设计与结果及其极差分析见表2和图6,三因素方差分析结果见表3。结合表2和表3可知,对于四唑虫酰胺的回收率,MWCNTs、C18、PSA均呈现出显著性其F值分别为24.53、3.347、3.191,P值均小于0.05,说明主效应存在,MWCNTs、C18和PSA的添加量均会对四唑虫酰胺的回收率产生显著影响。这与余苹中等[16]和汪庆屹等[17]在研究番茄和马铃薯中四唑虫酰胺测定中认为PSA和C18能有效净化番茄基质,并使得回收率达到85%以上结论相同。具体影响大小为MWCNTs>C18>PSA,可能因为草鱼基质中杂质主要为蛋白质和脂肪,而C18对脂肪的去除效率要优于PSA,而MWCNTs则对多种类型的杂质均能高效吸附。由图6可知MWCNTs、C18和PSA对回收率的影响均为随着添加量的上升回收率出现先上升后下降的趋势,考虑可能是过量的MWCNTs、C18和PSA还是会对目标物产生一定的吸附作用所致。而MWCNTs变化幅度最大而C18和PSA的变化幅度相对较小,这也印证了方差分析的结果。结合方差分析和极差分析的结果,最终选择每毫升提取液中净化试剂的添加量为MWCNTs 3 mg;C18 60 mg;PSA 50 mg。
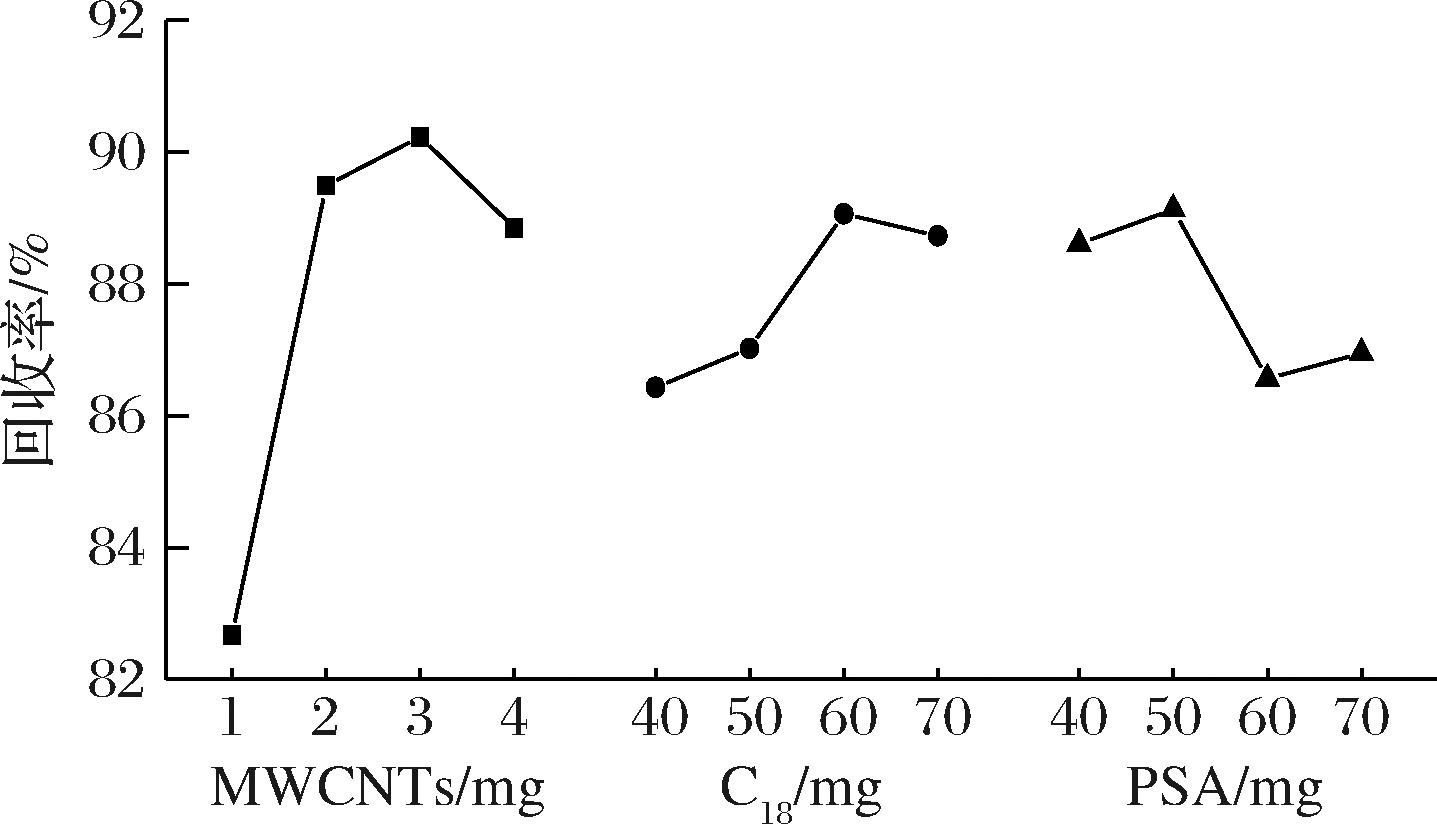
图6 草鱼中四唑虫酰胺QuEChERS净化试剂正交实验极差分析因子各水平均值图(n=3)
Fig.6 Figure of mean value of range analysis factors at each level in orthogonal experiment of tetraniliprole purification reagent QuEChERS in grass crap
表2 草鱼中四唑虫酰胺QuEChERS净化试剂正交实验和极差分析结果
Table 2 Orthogonal experiment and range analysis of tetraniliprole purification reagent QuEChERS in grass carp
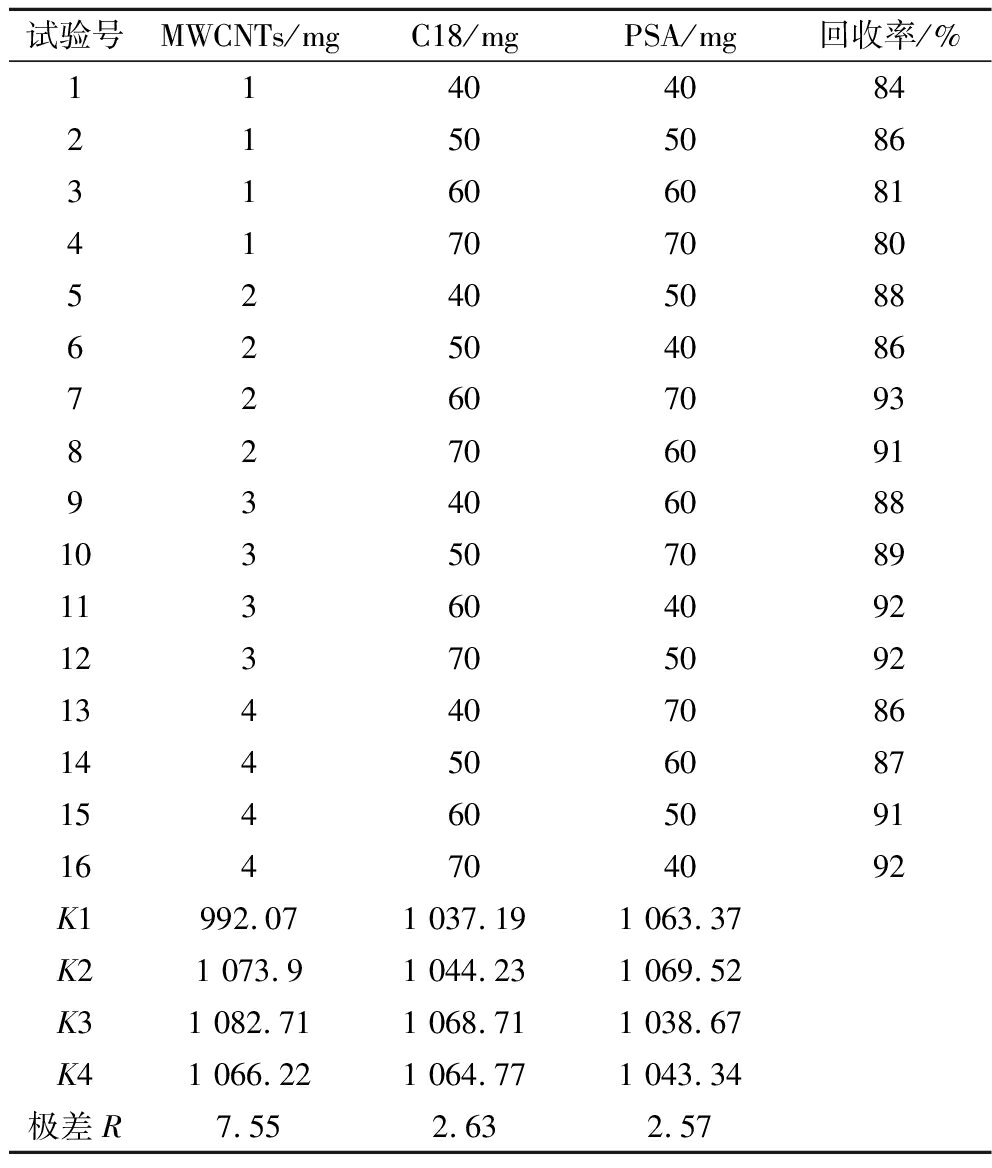
试验号MWCNTs/mgC18/mgPSA/mg回收率/%11404084 21505086 3160608141707080 5240508862504086 72607093 82706091 93406088 103507089 113604092 123705092 134407086 144506087 154605091 164704092 K1992.071 037.191 063.37K21 073.91 044.231 069.52K31 082.711 068.711 038.67K41 066.221 064.771 043.34极差R7.552.632.57
表3 草鱼中四唑虫酰胺QuEChERS净化试剂正交实验三因素方差分析结果
Table 3 Three-factor variance analysis results of orthogonal experiment on purification reagent of tetraniliprole in grass crap by QuEChERS

差异源平方和df均方FPIntercept370 112.1251370 112.12562 797.6110.000∗∗MWCNTs433.7193144.57324.530.000∗∗C1859.175319.7253.3470.029∗PSA56.417318.8063.1910.034∗Residual223.962385.894
注:R2为0.710,*表示P<0.05,**表示P<0.01。
可见相对比传统的QuEChERS净化而言,MWCNTs净化剂的引入能显著改善传统GCB净化剂对于农药本身的吸附问题,并且相较于LI等[18]以及汪庆屹等[17]研究每毫升提取液分别使用10 mg和20 mg GCB才能达到理想净化效果,本研究仅使用3 mg的MWCNTs就能对多种水产品基质进行有效的净化,能进一步节约成本。
2.2.2.3 不同净化方式的对比
以阴性草鱼样品为研究对象,研究对比了MWCNTs改进QuEChERS净化、mPFC净化(clean-up LPAS多功能柱)、HLB SPE净化、Prime-HLB SPE净化这些时下较新的快速净化方式和传统SPE净化方式对四唑虫酰胺回收率的影响。结果见图7。可见上述4种不同的净化方式都有80%以上的回收率,而MWCNTs改进QuEChERS净化后的的回收率要显著优于其他3种净化方式,故选择MWCNTs改进QuEChERS净化作为水产品中四唑虫酰胺测定的净化方式。

图7 不同净化方式对四唑虫酰胺回收率的影响(n=3)
Fig.7 Effects of different purification methods on the recovery rate of tetraniliprole
2.2.2.4 净化后不同水产品基质效应(matrix effects,ME)的研究
在农药检测过程中样品的ME普遍存在,为测试MWCNTs改进QuEChERS净化方式对不同水产品基质的净化效果,研究了7种常见的不同类别的水产品在经过1.5节中所述方法提取净化后的ME。以公式(1)为ME的计算方法。按照|ME-100%|>50%为强基质增强效应,20%≤|ME-100%|≤50%为中等基质效应,|ME-100%|<20%为弱基质效应来评价结果[22, 34]。
7种不同水产品经过净化后的ME结果见图8。可见,经过净化后的草鱼样品基本不存在ME(102%);带鱼、基围虾和小龙虾样品存在弱ME,其中带鱼和小龙虾为基质增强效应,基围虾为基质抑制效应;大闸蟹和花甲存在中等强度的基质增强效应;而梭子蟹为中等强度的基质抑制效应。其中花甲、大闸蟹和梭子蟹的ME要显著强于其他样品,且同为蟹类的大闸蟹和梭子蟹ME相反,考虑是因为花甲样品中含有一定量的泥沙等复杂的杂质导致其净化效果相对差,而蟹类中,本次使用的梭子蟹基本各个带有蟹黄,而大闸蟹基本没有蟹黄,蟹黄中含有丰富的油脂和蛋白质以及其他杂质,导致梭子蟹表现出的ME与大闸蟹相反。综上所述,由于不同类别的水产品ME差别大多达到显著水平,且部分表现为基质抑制部分表现为基质增强。为尽可能降低ME对结果定量准确性的影响,决定使用基质匹配标曲进行定量校正。
(1)
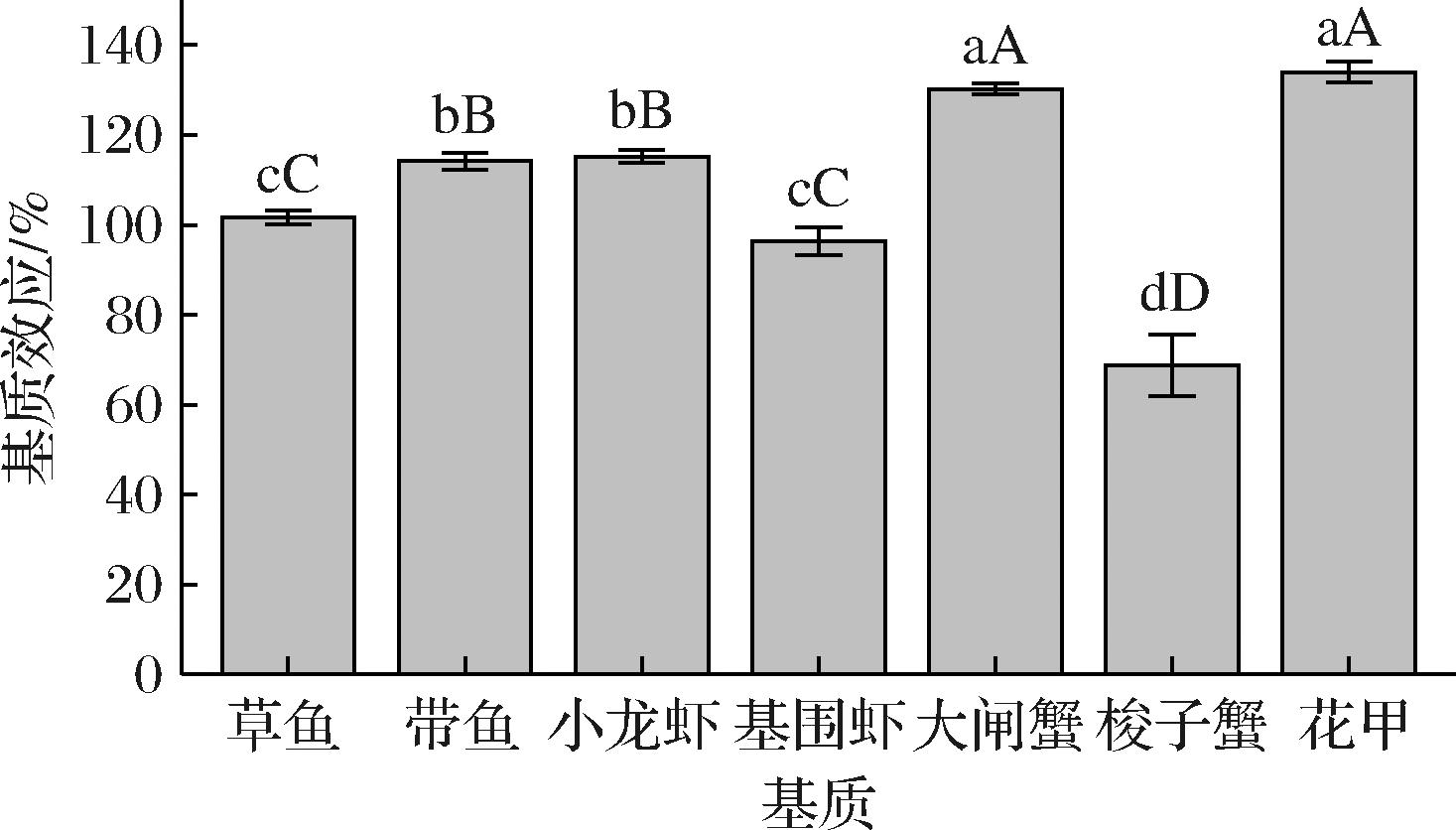
图8 不同水产品净化后四唑虫酰胺的基质效应(n=3)
Fig.8 Effects of matrix on the purified metabolites of tetraniliprole in different aquatic products
式中:ME,基质效应,%;A1,基质匹配标样峰面积;A2,纯溶剂标样峰面积。
2.3 方法学考察结果
2.3.1 基质标准工作曲线线性方程、定量限
按照1.5节方法制备上述7种水产品的空白基质溶液、配制成质量浓度为0.1、0.2、0.5、1.0、2.0、5.0、10、20 μg/L的基质标液,以四唑虫酰胺定量离子峰面积为纵坐标,质量浓度为横坐标绘制标准曲线,结果见表4。研究表明,四唑虫酰胺在0.1~20 μg/L范围内线性关系良好,其相关系数均大于0.999,满足GB/T 27404—2008《实验室质量控制规范 食品理化检测》中对于确证方法系数≥0.99的要求。
表4 不同水产品基质中四唑虫酰胺线性方程、线性范围、相关系数和定量限
Table 4 Linear equation, linear range, phase relationship constants, and quantitative limit of tetraniliprole in different aquatic product matrices
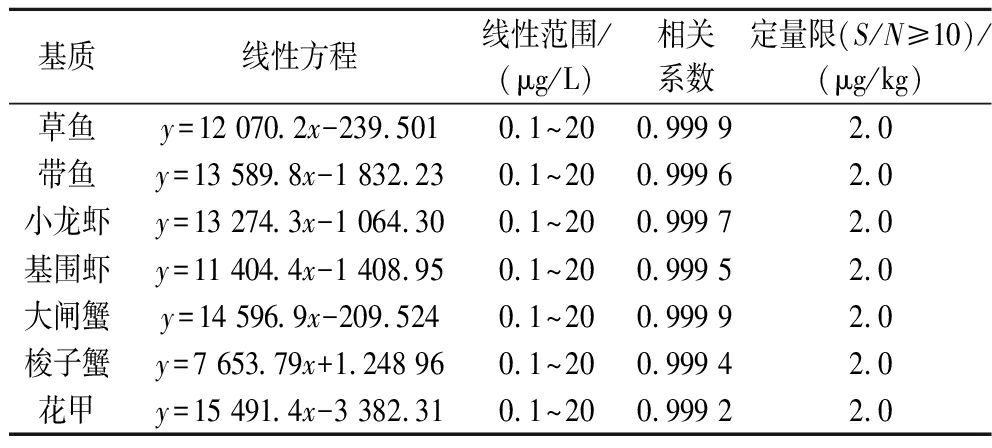
基质线性方程线性范围/(μg/L)相关系数定量限(S/N≥10)/(μg/kg)草鱼y=12 070.2x-239.5010.1~200.999 92.0带鱼y=13 589.8x-1 832.230.1~200.999 62.0小龙虾y=13 274.3x-1 064.300.1~200.999 72.0基围虾y=11 404.4x-1 408.950.1~200.999 52.0大闸蟹y=14 596.9x-209.5240.1~200.999 92.0梭子蟹y=7 653.79x+1.248 960.1~200.999 42.0花甲y=15 491.4x-3 382.310.1~200.999 22.0
于空白基质中加入一定量的四唑虫酰胺标准溶液,以10倍信噪比(S/N≥10)计算方法定量限,得到四唑虫酰胺的定量限和检出限如表4所示。方法定量限(2.0 μg/kg),均能满足加拿大卫生部PMRL2020-18号通知及美国环保署2020-27906号条例食品中四唑虫酰胺的最大残留限量(0.01 mg/kg)要求。
2.3.2 回收率和精密度
使用上述7种不同水产品作为基质样品进行加标回收和重复性试样。各基质分别加入一定量的四唑虫酰胺标准工作液,添加水平为2.0、4.0、20 μg/kg,依照1.5节进行前处理后上机测定,每个添加水平进行6次平行试验,实验结果见表5。在不同水产品基质中,四唑虫酰胺在2.0、4.0、20 μg/kg添加水平的回收率范围分别为82%~94%、90%~97%、90%~96%。批内相对标准偏差分别为0.77%~2.51%、0.66%~2.62%、0.80%~4.02%,批间相对偏差分别为0.88%~2.11%、1.00%~1.94%、1.01%~2.95%。符合GB/T 27404—2008《实验室质量控制规范 食品理化检测》中检测方法确认回收率和精密度要求。本方法可以满足检测需要。
表5 不同水产品基质四唑虫酰胺加标回收率和相对标准偏差(n=6)
Table 5 Recovery rates and relative standard deviations of fourazocourtiam in different aquatic product matrices

基质批次添加水平2.0 μg/kg添加水平4.0 μg/kg添加水平20 μg/kg回收率/%批内相对标准偏差/%批间相对标准偏差/%回收率/%批内相对标准偏差/%批间相对标准偏差/%回收率/%批内相对标准偏差/%批间相对标准偏差/%草鱼1921.08 2921.23 1.04 960.66 961.41 1.03 960.95 961.52 1.14 带鱼1931.93 2920.77 1.35961.17 971.60 1.38 952.33 951.61 1.79 小龙虾1831.00 2822.24 1.58 96 2.04 971.33 1.56 94 2.13 941.82 1.79 基围虾1881.55 2881.64 1.44 93 2.36 92 0.66 1.68 921.88 921.17 1.40 大闸蟹1910.96 2911.00 0.88 911.12 90 1.08 1.00 90 1.01 920.80 1.01 梭子蟹1942.51 2932.07 2.11 94 2.62 951.52 1.94 94 4.02 952.30 2.95 花甲1941.19 2931.94 1.46 962.10 95 1.85 1.79 961.69 963.03 2.20
2.4 实际样品测试结果
使用本方法对市售274份湖南、云南、江西、四川地区水产品样本中的四唑虫酰胺进行检测,发现,云南地区有一份鳊鱼样本有四唑虫酰胺检出(含量2.83 μg/kg),认为,四唑虫酰胺已在云南地区开始投入使用,已开始出现田间到水体再水产品的残留出现,需要引起重视。
3 结论与展望
本研究建立了一种MWCNTs改进QuEChERS净化(每毫升提取液中净化试剂的添加量为MWCNTs 3 mg;C18 60 mg;PSA 50 mg)结合高效液相色谱串联质谱法测快速定水产品中四唑虫酰胺残留的检测方法,方法快捷、高效、准确、灵敏度高,极大程度避免了传统QuEChERS净化吸附剂GCB对农药本身存在吸附的问题,且用量少节约成本,更能适用多种水产品复杂基质的净化。在添加量为2.0~20 μg/kg范围内方法回收率范围在82%~97%,批内相对标准偏差(n=6)范围在0.66%~4.02%,批间相对标准偏差(n=6)范围在0.88%~2.95%,回收率和精密度均能满足GB/T 27404—2008《实验室质量控制规范 食品理化检测》标准要求,可以为水产品中的四唑虫酰胺残留的监管以及相关检测标准的制定提供技术支撑。
双酰胺类杀虫剂是继拟除虫菊酯后在杀虫剂领域的又一次重大突破,也是近年来的研究热点。本研究只针对多种水产品基质中新型双酰胺类杀虫剂四唑虫酰胺的残留进行方法开发与研究,建立了多壁碳纳米管改进QuEChERS净化的高效液相色谱串联质谱分析方法,未对其他双酰胺类杀虫剂进行方法研究。因此,后续将进一步针对不同基质进行双酰胺类杀虫剂多残留方法的深入考察研究。
[1] 刘安昌, 徐勋鹏, 姚明秋, 等.四唑虫酰胺的合成方法[J].农药, 2022, 61(8):558-561.LIU A C, XU X P, YAO M Q, et al.The synthesis process of tetraniliprole[J].Agrochemicals, 2022, 61(8):558-561.
[2] 梁少茹, 赵丰华, 蒋双丰, 等.200 g/L四唑虫酰胺悬浮剂对灰茶尺蠖的田间防治效果[J].湖北农业科学, 2023, 62(12):89-93.LIANG S R, ZHAO F H, JIANG S F, et al.Field control effects of 200 g/L tetraniliprole SC on Ectropis grisescens Warren[J].Hubei Agricultural Sciences, 2023, 62(12):89-93.
[3] 陈冉, 高梦雪, 雒珺瑜, 等.2种双酰胺类杀虫剂对东方黏虫的室内生物活性测定及田间防效[J].农药, 2024, 63(1):67-72.CHEN R, GAO M X, LUO J Y, et al.Laboratory bioactivity and field control effect of two dicamide insecticides to Mythimna separata[J].Agrochemicals, 2024, 63(1):67-72.
[4] 王守明, 张志伟, 卢国彩, 等.四唑虫酰胺对番茄棉铃虫的室内生物活性和田间药效[J].农药, 2023, 62(11):856-858.WANG S M, ZHANG Z W, LU G C, et al.Bioactivity and field efficacy of tetraniliprole against Helicoverpa armigera on tomato[J].Agrochemicals, 2023, 62(11):856-858.
[5] 朱礼, 邓航, 薛敏敏, 等.固相萃取-气相色谱法测定果蔬中新型杀虫剂溴虫氟苯双酰胺残留[J].农药, 2023, 62(2):134-138.ZHU L, DENG H, XUE M M, et al.Determination of residues of new insecticide broflanilide in fruit and vegetables by solid phase extraction and gas chromatography[J].Agrochemicals, 2023, 62(2):134-138.
[6] 黄宁, 杨旭, 张翼飞, 等.四唑虫酰胺对大型溞的急性毒性和毒理[J].生态毒理学报, 2024, 19(2):272-282.HUANG N, YANG X, ZHANG Y F, et al.Acute toxicity and toxicology of tetraniliprole on Daphnia magna[J].Asian Journal of Ecotoxicology, 2024, 19(2):272-282.
[7] 郑先报, 孙俊铭.四唑虫酰胺防治水稻二化螟、稻纵卷叶螟效果研究[J].安徽农学通报, 2021, 27(23):109-110.ZHENG X B, SUN J M.Study on the control effect of tetrazolium on rice stem borer and rice leaf roller[J].Anhui Agricultural Science Bulletin, 2021, 27(23):109-110.
[8] 孔令鸿, 孙俊铭, 张向前, 等.四唑虫酰胺与阿维菌素混用对水稻二化螟的防效研究[J].现代农业科技, 2023(13):104-106;113.KONG L H, SUN J M, ZHANG X Q, et al.Study on the control effect of tetrazolamide mixed with avermectin on rice Chilo suppressalis[J].Modern Agricultural Science and Technology, 2023(13):104-106;113.
[9] 朱雅婷, 张雅蒙, 郭晓君, 等.番茄潜叶蛾对四唑虫酰胺的抗性选育及交互抗性研究[J].应用昆虫学报, 2024, 61(1):169-176.ZHU Y T, ZHANG Y M, GUO X J, et al.Resistance selection of Tuta absoluta(Meyrick) to tetraniliprole and cross-realistic analysis[J].Chinese Journal of Applied Entomology, 2024, 61(1):169-176.
[10] 白小宁, 李友顺, 杨锚, 等.2020年我国登记的新农药[J].农药, 2021, 60(2):79-82.BAI X N, LI Y S, YANG M, et al.New pesticides registered in China in 2020[J].Agrochemicals, 2021, 60(2):79-82.
[11] 盛祝波, 汪杰, 裴鸿艳, 等.新型杀虫剂四唑虫酰胺[J].农药, 2021, 60(1):52-56;60.SHENG Z B, WANG J, PEI H Y, et al.A new insecticide tetraniliprole[J].Agrochemicals, 2021, 60(1):52-56;60.
[12] 王磊, 姜婷, 张建云, 等.新型环境友好型杀虫剂-20%四唑虫酰胺防控玉米螟试验效果[J].新疆农业科技, 2023(6):39-40.WANG L, JIANG T, ZHANG J Y, et al.Experimental effect of a new environmentally friendly pesticide-20% tetrazolamide on controlling corn borer[J].Xinjiang Agricultural Science and Technology, 2023(6):39-40.
[13] 陈澄宇, 张学峰, 赵云霞, 等.甲氨基阿维菌素苯甲酸盐与四唑虫酰胺复配对草地贪夜蛾的联合生物活性及田间防效[J].农药, 2024, 63(2):147-151.CHEN C Y, ZHANG X F, ZHAO Y X, et al.Combined toxicity and field control efficacy of emamectin benzoate mixed with tetraniliprole against Spodoptera frugiperda[J].Agrochemicals, 2024, 63(2):147-151.
[14] 张静, 武鹏, 陈立萍, 等.四唑虫酰胺种子处理悬浮剂高效液相色谱分析方法研究[J].农药科学与管理, 2017, 38(5):48-51.ZHANG J, WU P, CHEN L P, et al.Analytical method of tetraniliprole FS by HPLC[J].Pesticide Science and Administration, 2017, 38(5):48-51.
[15] 李卫, 张月, 贾浩然, 等.18%四唑虫酰胺悬浮剂高效液相色谱串联质谱的分析方法[J].农药, 2019, 58(5):344-346.LI W, ZHANG Y, JIA H R, et al.Analytical method for tetraniliprole 18% SC by HPLC-MS[J].Agrochemicals, 2019, 58(5):344-346.
[16] 余苹中, 赵尔成, 张锦伟, 等.四唑虫酰胺及其代谢物BCS-CQ63359在番茄中的消解规律与储藏稳定性研究[J].食品安全质量检测学报, 2021, 12(24):9428-9435.YU P Z, ZHAO E C, ZHANG J W, et al.Study on digestion rule and storage stability of tetraniliprole and its metabolite BCS-CQ63359 in tomato[J].Journal of Food Safety &Quality, 2021, 12(24):9428-9435.
[17] 汪庆屹, 赵庆慧, 程志加, 等. 四唑虫酰胺在马铃薯上的残留及消解动态[J]. 农药, 2024, 63(06): 412-418.WANG Q Y, ZHAO Q H, CHENG Z J, et al. Residue and dissipation dynamics of tetraniliprole in potato[J]. Agrochemicals, 2024, 63(06): 412-418.
[18] LI W, ZHANG Y, JIA H R, et al.Residue analysis of tetraniliprole in rice and related environmental samples by HPLC/MS[J].Microchemical Journal, 2019, 150:104168.
[19] 潘晖, 吴丹丹, 王世双, 等.固相萃取结合液相色谱法测定蔬菜中杀虫剂及残留物的四种方法评估[J].中南农业科技, 2024(1):31-35.PAN H, WU D D, WANG S S, et al.Evaluation of four methods for determination of pesticides and residues in vegetables by solid phase extraction combined with liquid chromatography[J].South-Central Agricultural Science and Technology, 2024(1):31-35.
[20] MOKHTARI S, MARZI KHOSROWSHAHI E, ALI FARAJZADEH M, et al.Combination of nano-onion-based dispersive solid phase extraction combined with deep eutectic solvent-based dispersive liquid-liquid microextraction for trace analysis of pesticides[J].Microchemical Journal, 2022, 183:107983.
[21] MIYARDAN F N, AFSHAR MOGADDAM M R, ALI FARAJZADEH M, et al.Combining modified graphene oxide-based dispersive micro solid phase extraction with dispersive liquid-liquid microextraction in the extraction of some pesticides from zucchini samples[J].Microchemical Journal, 2022, 182:107884.
[22] 夏宝林, 张亚清, 殷晶晶, 等. QuEChERS-超高效液相色谱-串联质谱法同时测定枸杞子中65种农药残留[J]. 食品安全质量检测学报, 2024, 15(1): 110-119.XIA B L, ZHANG Y Q, YIN J J, et al. Simultaneous determination of 65 kinds of pesticide residues in Lycium barbarum by QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety and Quality, 2024, 15(1): 110-119.
[23] 李巧莲, 宣彤, 袁帅, 等.多壁碳纳米管QuEChERS-液相色谱-串联质谱法测定粮谷中14种酰胺类杀菌剂残留量[J].食品科技, 2023, 48(5):300-307.LI Q L, XUAN T, YUAN S, et al.Determination of 14 amide pesticides in cereals by multi-walled carbon nanotubes Qu ECh ERS-liquid chromatography-tandem mass spectrometry[J].Food Science and Technology, 2023, 48(5):300-307.
[24] 李巧莲, 罗景阳, 张宏宏, 等.多壁碳纳米管改进QuEChERS-液相色谱-串联质谱法测定豆类中12种酰胺类杀菌剂残留量[J].粮食与油脂, 2023, 36(1):157-162.LI Q L, LUO J Y, ZHANG H H, et al.Determination of 12 amide fungicides in legumes by multi-walled carbon nanotubes QuEChERS-liquid chromatography-tandem mass spectrometry[J].Cereals &Oils, 2023, 36(1):157-162.
[25] 乐渊, 刘春华, 尹桂豪, 等.多壁碳纳米管滤过型净化-超高效液相色谱-串联质谱法测定香蕉中氟唑菌酰胺和吡唑醚菌酯残留[J].分析科学学报, 2020, 36(6):874-878.LE Y, LIU C H, YIN G H, et al.Determination of fluxapyroxad and pyraclostrobin residues in banana by ultra-high performance liquid chromatography-tandem mass spectrometry coupled with multiplug filtration clean up with multiwalled carbon nanotubes[J].Journal of Analytical Science, 2020, 36(6):874-878.
[26] 乐渊, 李春丽, 刘春华, 等.多壁碳纳米管滤过型净化-气相色谱串联质谱法测定香蕉中5种拟除虫菊酯类杀虫剂残留[J].农药, 2019, 58(7):515-518;531.LE Y, LI C L, LIU C H, et al.Determination of 5 pyrethroid insecticide residues in banana using GC-MS/MS coupled with multiplug filtration clean up with multiwalled carbon nanotubes[J].Agrochemicals, 2019, 58(7):515-518;531.
[27] 易从圣, 刘瑞, 吴志鹏, 等.基于多壁碳纳米管改进QuEChERS法结合气相色谱-串联质谱法测定云木香中35种禁用农药残留[J].色谱, 2024, 42(3):282-290.YI C S, LIU R, WU Z P, et al.Determination of 35 prohibited pesticide residues in Saussurea costus by modified QuEChERS method based on multi-walled carbon nanotubes coupled with gas chromatography- tandem mass spectrometry[J].Chinese Journal of Chromatography, 2024, 42(3):282-290.
[28] 卞英芳, 侯广月, 张永菊, 等.PRiME HLB固相萃取结合液相色谱-串联质谱法快速测定谷物中氯虫苯甲酰胺残留量[J].粮食与油脂, 2023, 36(9):159-162.BIAN Y F, HOU G Y, ZHANG Y J, et al.Rapid determination of chlorantraniliprole residues in cereals by PRiME HLB solid-phase extraction combined with liquid chromatography-tandem mass spectrometry method[J].Cereals &Oils, 2023, 36(9):159-162.
[29] 武源, 覃慧丽, 黄婞焱, 等.PRiME HLB固相萃取柱结合气相色谱-串联质谱法快速测定茶叶中200种农药残留[J].食品安全质量检测学报, 2022, 13(2):650-656.WU Y, QIN H L, HUANG X Y, et al.Rapid determination of 200 kinds of pesticide residues in tea by PRiME HLB solid phase extraction column combined with gas chromatography-tandem mass spectrometry[J].Journal of Food Safety &Quality, 2022, 13(2):650-656
[30] 李斌. PRiME HLB结合气相色谱串联质谱法测定平菇中9种农药及基质效应评价[J].食品安全导刊, 2022(23):55-58.LI B.Determination of 9 pesticides in Pleurotus ostreatus by PRiME HLB combined with gas chromatography tandem mass spectrometry and evaluation of matrix effect[J].China Food Safety Magazine, 2022(23):55-58.
[31] 张鹏, 彭菲, 刘玮琦, 等.快速滤过型净化法应用于气相色谱-串联质谱检测大豆中农药残留[J].大豆科学, 2023, 42(4):466-472.ZHANG P, PENG F, LIU W Q, et al.Detection of pesticide residues in soybean by multi-plug filtration cleanup combined with gas chromatography-tandem mass spectrometry[J].Soybean Science, 2023, 42(4):466-472.
[32] 王子剑, 赵劲松, 郭晓宇, 等.滤过型萃取柱-超高效液相色谱-串联质谱法同时测定水果中11种农药残留[J].分析测试技术与仪器, 2023, 29(1):23-29.WANG Z J, ZHAO J S, GUO X Y, et al.Simultaneous determination of 11 pesticide residues in fruits by filtered extraction column-ultra performance liquid chromatography-tandem mass spectrometry[J].Analysis and Testing Technology and Instruments, 2023, 29(1):23-29.
[33] 陈兴连, 林涛, 方海仙, 等.快速滤过型净化结合超高效液相色谱-串联质谱法测定姬松茸中农药残留[J].农药, 2023, 62(9):657-663.CHEN X L, LIN T, FANG H X, et al.Determination of pesticide residues in Agaricus blazei Murill by multi-plug filtration cleanup method combined with high performance liquid chromatography-tandem mass spectrometry[J].Agrochemicals, 2023, 62(9):657-663.
[34] 刘柏林, 赵紫微, 詹子悦, 等.改进QuEChERS法结合超高效液相色谱-串联质谱法同时测定冷冻食品中7种季铵盐化合物[J].色谱, 2023, 41(3):233-240.LIU B L, ZHAO Z W, ZHAN Z Y, et al.Simultaneous determination of seven quaternary ammonium compounds in frozen food by ultra performance liquid chromatography-tandem mass spectrometry combined with modified QuEChERS method[J].Chinese Journal of Chromatography, 2023, 41(3):233-240.