泻剂结肠是一种慢传输型便秘,其由于长期服用刺激性泻药所致[1]。目前,对于泻剂结肠缺乏公认有效的治疗手段,主要集中在5-羟色胺(5-hydroxytryptamine, 5-HT)受体激动剂药物治疗[2]及中医疗法[3],而大部分严重患者最后发展成为结肠黑病变,只能行结肠切除术来缓解,这给患者带来严重的心理和身体的损伤,因此,寻找一种安全有效的缓解手段迫在眉睫。
应用益生菌缓解胃肠道疾病是目前研究的热点。一项纳入1 500多名功能性便秘儿童研究显示,服用益生菌能显著改善患者排便频率及大便失禁症状[4],动物实验也表明,益生菌可通过调节小鼠的微生物组成、神经递质分泌和短链脂肪酸来缓解洛哌丁胺诱导的便秘[5]。前期课题组研究也揭示,双歧杆菌对泻剂结肠具有一定的缓解作用[6],但其作用的具体机制仍不清晰。
与普通便秘有所不同,泻剂结肠除了存在便秘症状外,还存在严重的肠神经受损[6]及肠屏障损伤[7]。而多项研究表明,益生菌在修复肠道屏障损伤中发挥着有效的作用。例如在一项用益生菌干预坏死性结肠炎小鼠的研究中发现,双歧杆菌可增强结肠炎小鼠肠道屏障功能[8],KUNZE等[9]探究益生菌对大鼠结肠神经功能影响表明,罗伊氏乳杆菌可通过抑制钙依赖性钾通道的开放增强结肠神经元的兴奋性,调节肠道蠕动。基于上述研究现状,本研究拟从肠神经和肠屏障的角度解析长双歧杆菌HuNan2016 2810缓解泻剂结肠的可能机制,为泻剂结肠的治疗提供一种新的思路。
1 材料与方法
1.1 材料与试剂
番泻叶提取物,西安旭煌生物技术有限公司;琥珀酸普芦卡必利,江苏豪森药业集团有限公司;活性炭粉、伊文思蓝,美国Sigma-Aldrich公司;甲基纤维素,上海阿拉丁生化科技股份有限公司;脱脂乳粉,上海光明有限公司;粪便基因组提取试剂盒,美国MP Biomedicals公司;胶回收试剂盒,美国Biomiga公司;NaCl、氯仿、异丙醇、无水乙醇、无水乙醚、浓硫酸、NaOH、乙酸、丙酸、异丁酸,国药集团化学试剂有限公司;逆转录试剂盒、SYBR qPCR Master Mix试剂盒,南京诺唯赞生物科技有限公司;小鼠5-HT ELISA试剂盒、小鼠血管活性肠肽(vasoactive intestinal peptide, VIP)ELISA试剂盒、小鼠内皮型一氧化氮合成酶(endothelial nitric oxide synthase, eNOS)ELISA试剂盒、小鼠乙酰胆碱酯酶(acetylcholinesterase,AchE)ELISA试剂盒、小鼠P物质(substance P,SP)ELISA试剂盒,南京森贝伽生物科技有限公司;小鼠白细胞介素1β(interleukin-1beta, IL-1β)ELISA试剂盒,美国R&D Systems公司;引物序列合成,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
FreeZone®真空冷冻干燥机,美国LABCONCO公司;llumina M iSeq PE300高通量测序平台,美国Illumina公司;MultiskanTM FC 多功能酶标仪、PicoTM 21 超高速离心机,美国Thermo公司;QP2010 Ultra GCMS,日本岛津公司;SCIENTZ-48高通量组织研磨仪,宁波新芝生物科技有限公司;C100 TouchTM实时荧光定量基因扩增仪,Bio-Rad公司。
1.3 菌株培养活化
本实验所使用的长双歧杆菌(B.longum)HuNan2016 2810来源于江南大学食品学院生物技术中心菌种保藏库。
从-80 ℃冰箱取出保藏的菌液,用接种环蘸取少量菌液在添加含有半胱氨酸的MRS固体培养基上划线分离,37 ℃厌氧培养48 h;使用接种环挑单菌落接种于含有半胱氨酸的MRS液体培养基中,37 ℃厌氧培养20 h;按2%的接种体积将前述培养的菌液接种于含有半胱氨酸的MRS液体培养基中进行传代,37 ℃厌氧培养18 h,传代2次后进行扩培,37 ℃厌氧培养18 h。4 ℃下,以8 000 r/min离心15 min收集菌体,无菌生理盐水洗涤两遍后重悬于质量分数为10%的无菌脱脂乳中至菌体的浓度达到6×109 CFU/mL,分装于保菌管中,-80 ℃冷冻保藏。
1.4 动物实验设计
32只8周龄SPF级雄性C57BL/6J小鼠,北京维通利华实验动物技术中心有限公司,动物伦理编号:JN.No20220615c1201207[192]。动物饲养环境相对湿度(50±10)%、相对温度(23±2)℃,光照、黑夜12 h更替。小鼠随机分为4组,分别为空白组、模型组、阳性药物普芦卡必利组和长双歧杆菌HuNan2016 2810干预组,每组8只。适应1周后进行灌胃。除空白组外,其他组小鼠均灌胃番泻叶溶液建立泻剂结肠模型[6],具体的造模质量浓度及周期如图1-a所示,番泻叶溶液现用现配。模型造成功后,停药1周,13周开始进行为期两周的干预,空白组与模型组每天灌胃0.2 mL质量分数为10%的脱脂乳,普芦卡必利组每天灌胃0.2 mL 质量分数为10%的脱脂乳重悬的终质量浓度为0.28 mg/mL的普芦卡必利溶液,长双歧杆菌HuNan2016 2810 组每天灌胃0.2 mL质量分数为10%的脱脂乳重悬的菌浓度为6×109 CFU/mL的菌液。动物实验流程如图1-b所示。
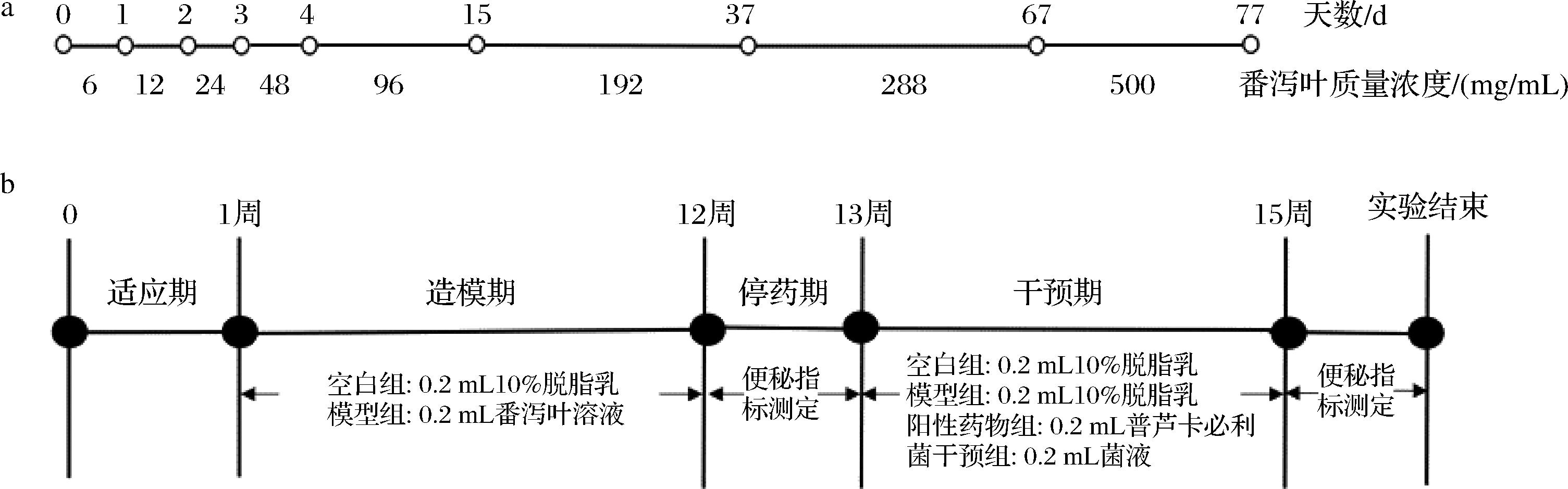
a-造模;b-动物实验方案
图1 动物实验流程
Fig.1 Animal experiment schedule
1.5 实验指标测定
1.5.1 便秘相关指标测定
排首粒蓝便时间。在动物实验结束前2 d进行此指标测定。为保证实验结果的准确性,测定前小鼠禁食不禁水12 h。每只小鼠灌胃0.2 mL伊文思蓝(质量分数为2.5%的伊文思蓝和质量分数为1%的甲基纤维素),小鼠从灌胃到开始排出首粒蓝便的时间间隔即为排首粒蓝便时间。
粪便含水率。在动物实验结束前1 d进行此指标的测定。将每只小鼠放入垫有吸水纸的盒子中收集粪便,记录冻干前后粪便的重量,粪便含水量按公式(1)计算:
粪便含水率![]()
(1)
5 h内粪便粒数。在动物实验结束前1 d测粪便含水率同时进行此指标的测定。将每只小鼠放入垫有吸水纸的盒子中,记录5 h内每只小鼠的排便粒数。
小肠推进率。小鼠处死采集组织前30 min每只灌胃0.2 mL墨汁,墨汁配制方法如下:称取100 g阿拉伯胶加入800 mL水中,加热煮沸直至溶液澄清透明,再加入50 g活性炭粉,煮沸3次,待溶液冷却,用水稀释定容至1 L,4 ℃保存。取其小肠段,测量活性炭推进长度与小肠总长度的比值即为小肠推进率,按照公式(2)计算:
小肠推进率![]()
(2)
1.5.2 小鼠结肠菌群测定分析
使用试剂盒从小鼠粪便中提取粪便基因组DNA,以提取所得的DNA为模板,通过PCR扩增16S rRNA的V3~V4区。反应结束后通过配制质量分数为1.5%的琼脂糖凝胶对PCR产物进行纯化,在紫外灯下快速进行目的条带的切胶,根据胶回收试剂盒说明书进行目的条带胶回收。按照Qubit Assay Tubes试剂盒说明书建立文库,通过Miseq Reagent Kit v3进行上机测序,获得文库数据。使用QIIME2平台进行数据处理和生物信息学分析。
1.5.3 酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)
将小鼠结肠组织按照1∶9质量比添加PBS,在高通量组织研磨仪中进行组织破碎,4 ℃下以6 000 r/min离心5 min,取上清液,测定样本总蛋白含量。按照试剂盒说明书提供的方法进行相关蛋白表达测定,使用Graphpad软件分析结果。
1.5.4 SCFAs检测
将冻干的小鼠粪便按照参考文献[10]中的方法进行浸泡、酸化和无水乙醚萃取前处理,经前处理后得到的样本经过GC-MS仪器测定,得到粪便中SCFAs含量数据,用Xcalibur软件进行结果分析。
1.5.5 实时聚合酶链式反应(real-time quantitative polymerase chain reaction, RT-qPCR)
采用RT-qPCR方法测定小鼠结肠组织中相关基因的表达水平。用Trizol法提取RNA,参照反转录试剂盒说明书将RNA逆转成cDNA。通过NCBI设计引物序列,由上海生工合成引物。通过BioRad-CFX384实时荧光定量基因扩增仪测定小鼠结肠组织中S100钙调蛋白β(S100 calcium binding protein-beta, S100β)、蛋白基因产物9.5(protein gene product, PGP9.5)、水通道蛋白(aquaporins, AQPs)、黏蛋白2(mucin2, MUC2)、TJ蛋白闭锁小带蛋白-1(zonulaocciudens-1, ZO-1)、紧密连接蛋白3(claudin 3 protein, claudin3)、Toll样受体2(toll-like receptor 2, TLR2)、肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白细胞介素-1β(interleukin-1beta, IL-1β)、白细胞介素6(interleukin-6, IL-6)的相对表达量。
表1 基因引物序列
Table 1 Gene primer sequence

目的基因引物序列(5′-3′)S100βF:5′-TGGTTGCCCTCATTGATGTCT -3′R:5′- CCCATCCCCATCTTCGTCC -3′PGP9.5F:5′-AGGGACAGGAAGTTAGCCCTA -3′R:5′- AGCTTCTCCGTTTCAGACAGA-3′AQP4F:5′- AGTCACCACGGTTCATGGAAA -3′R:5′-CATGCTGGCTCCAGTATAATTGA -3′AQP8F:5′-TGTGTAGTATGGACCTACCTGAG -3′R:5′-ACCGATAGACATCCGATGAAGAT -3′MUC2F:5′-AGGGCTCGGAACTCCAGAAA-3′R:5′- CCAGGGAATCGGTAGACATCG-3′ZO-1F:5′-GCCGCTAAGAGCACAGCAA -3′R:5′- GCCCTCCTTTTAACACATCAGA-3′Claudin-3F:5′-AACTGCGTACAAGACGAGACG-3′R:5′-ATCCCTGATGATGGTGTTGG-3′TLR-2F:5′- GCAAACGCTGTTCTGCTCAG-3′R:5′- AGGCGTCTCCCTCTATTGTATT-3′TNF-αF:5′-CCCTCACACTCAGATCATCTTCT -3′R:5′-GCTACGACGTGGGCTACAG -3′IL-1βF:5′-GAAATGCCACCTTTTGACAGTG -3′R:5′-TGGATGCTCTCATCAGGACAG -3′IL-6F:5′-TAGTCCTTCCTACCCCAATTTCC -3′R:5′- TTGGTCCTTAGCCACTCCTTC -3′mGAPDHF:5′- TGTGGATGGCCCCTCTGGAA -3′R:5′-TGACCTTGCCCACAGCCTTG-3′
1.5.6 组织病理学分析
进行结肠苏木素-伊红(hematoxylin and eosin, H&E)染色。收集远端结肠组织,立即用预冷的生理盐水冲洗,然后置于体积分数为4%多聚甲醛溶液中固定。将固定组织经过流水过夜冲洗后,依次在体积分数为70%、80%和90%乙醇溶液中冲洗脱水30 min,然后置于酒精和二甲苯各半的混合物中,并冲洗3次。再将切片转移到二甲苯和石蜡各半的混合物中进行蜡浸泡。石蜡包埋后,使用手动轮转切片机切出5 um的薄片,放入40 ℃的去离子水中进行展片,用载玻片将其捞出,并按照标准程序用H&E染色。最后,使用中性胶密封,待完全凝固后,在数字组织切片扫描仪中对切片进行扫描。
2 结果与分析
2.1 长双歧杆菌HuNan2016 2810可缓解泻剂结肠
泻剂结肠是一种慢传输型便秘,其症状表现为结肠转运能力下降、排便频率降低以及粪便干硬[11]。本研究应用排首粒蓝便时间、小肠推进率、5 h粪便粒数和粪便含水量指标评价长双歧杆菌HuNan2016 2810缓解泻剂结肠效果。
如图2所示,造模后,小鼠的排首粒蓝便时间显著延长,而小肠推进率无显著差异,说明造模小鼠结肠转运能力下降,且粪便含水量和5 h粪便粒数显著降低,表明泻剂结肠模型造模成功。而灌胃长双歧杆菌HuNan2016 2810后显著缩短了小鼠排首粒蓝便时间,显著增加粪便含水量和排便频率,且总体效果优于阳性药物普芦卡必利。根据《保健食品功能检验与评价方法(2023年版)》中润肠通便阳性结果判定标准,可知HuNan2016 2810具有缓解泻剂结肠的效果。
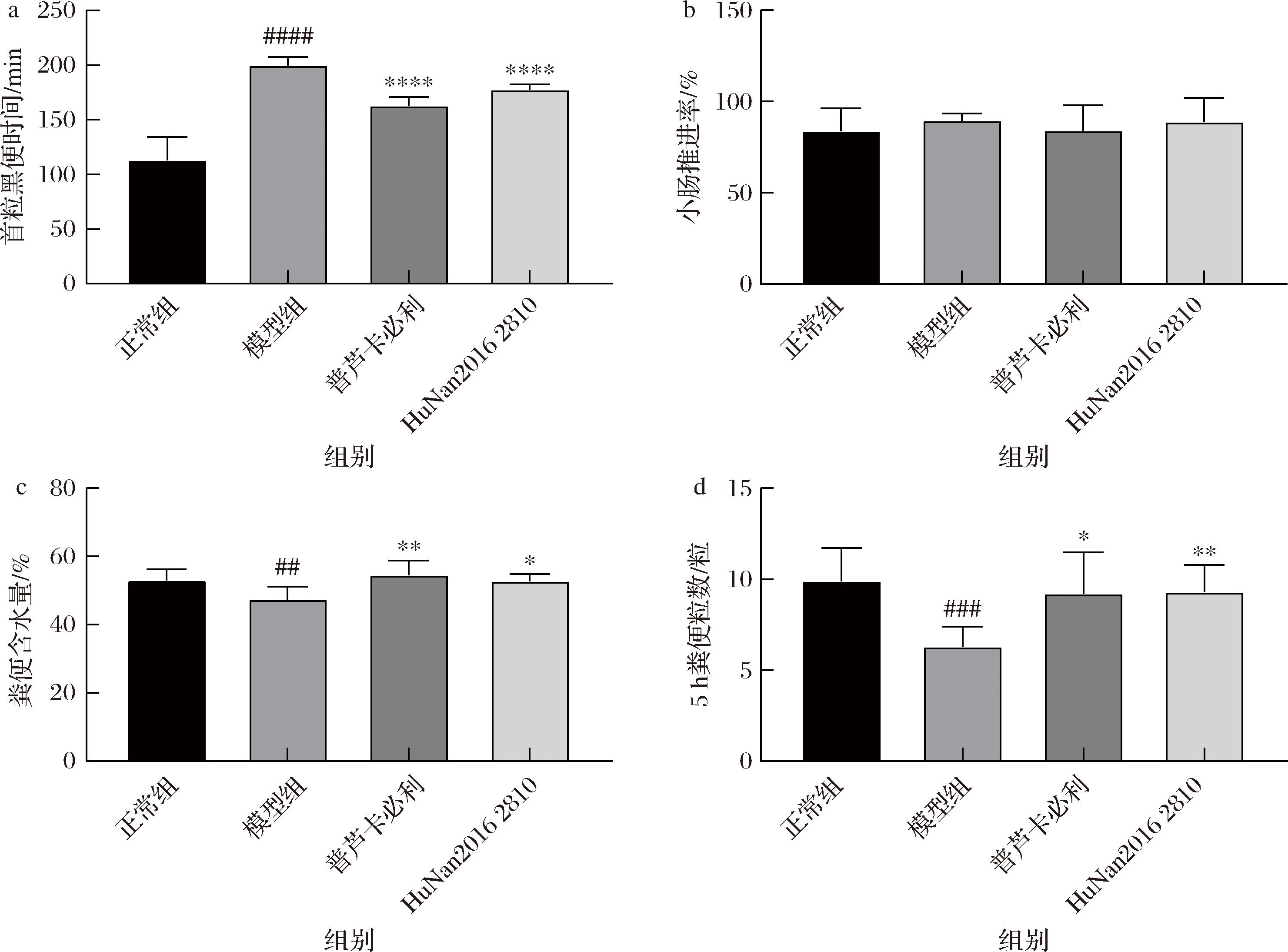
a-首粒黑便时间;b-小肠推进率;c-粪便含水量;d-5 h粪便粒数量
图2 长双歧杆菌对泻剂结肠小鼠表观指标的影响
Fig.2 Effects of B.longum on apparent indexes of cathartic colon mice
注:*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.0001(干预组与模型组比较);#表示P<0.05,##表示P<0.01,###表示P<0.001,####表示P<0.0001(模型组与空白组比较)(下同)。
2.2 长双歧杆菌HuNan2016 2810缓解泻剂结肠机制解析
2.2.1 长双歧杆菌HuNan2016 2810通过增加肠神经胶质细胞数量及调控神经递质分泌紊乱修复肠神经受损
肠神经系统(enteric nervous system, ENS)作为机体的“第二大脑”,由肠神经元及肠神经胶质细胞等构成,调控着肠道运动等各种功能[12]。研究表明,长期泻药刺激会导致肠神经系统受损[13]。PGP9.5是一种泛素化水解酶,存在于神经元组织中,在神经元分化过程中广泛表达[14],因此也常用于ENS中神经元的表征。S100β是肠神经胶质细胞特征标志物。如图3所示,长期泻药刺激会导致S100β及PGP9.5表达量降低,即存在肠神经系统的损伤,而菌株干预则显著上调S100β表达量,增加肠神经胶质细胞数量。
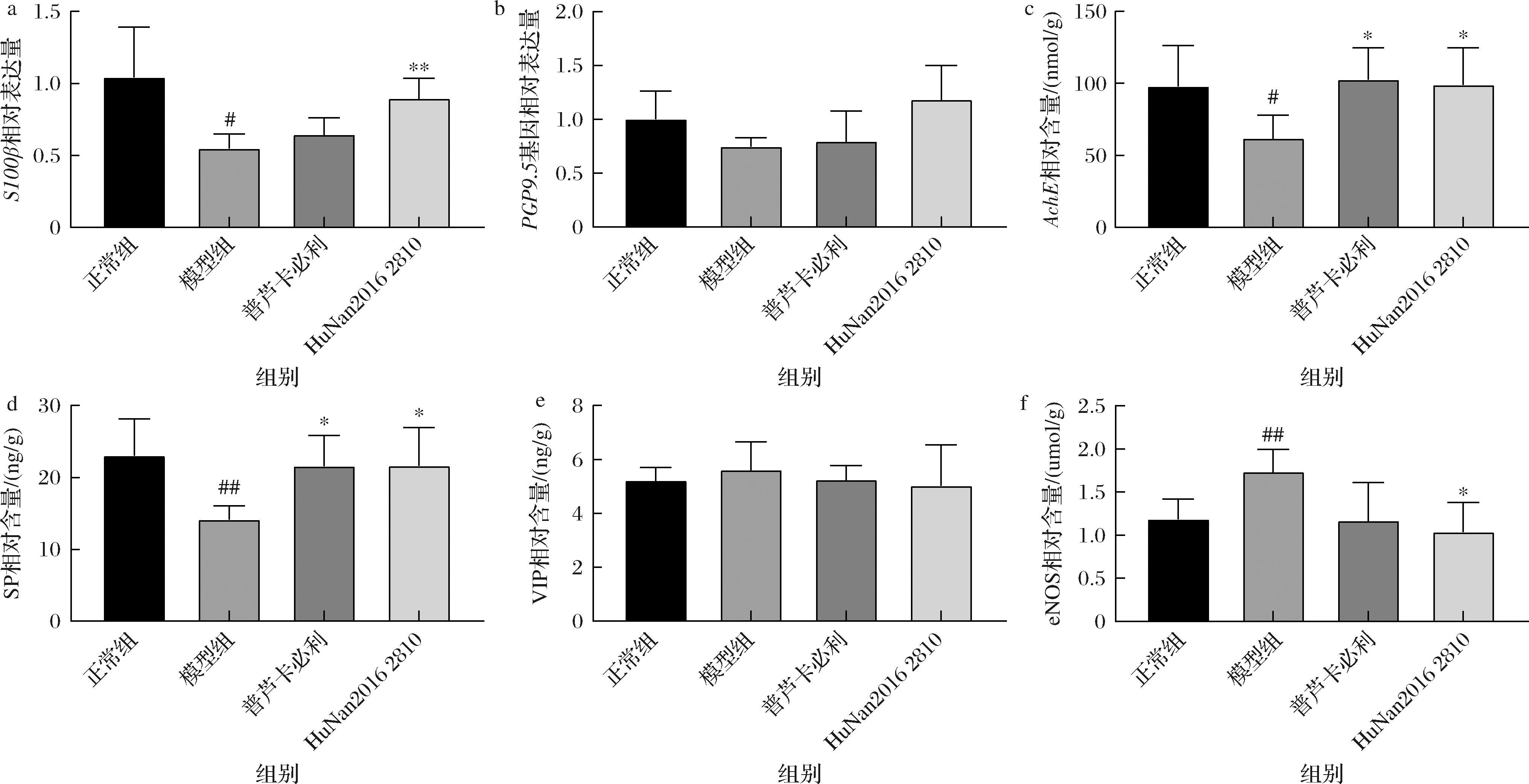
a-S100β基因表达量;b-PGP9.5基因表达量;c-AchE相对含量;d-SP相对含量;e-VIP相对含量;f-eNOS相对含量
图3 长双歧杆菌对泻剂结肠小鼠肠神经系统的影响
Fig.3 Effects of B.longum on ENS of cathartic colon mice
NO及VIP是一种抑制性神经递质,可抑制平滑肌收缩,而AchE和SP则是兴奋性神经递质[15],由于NO化学性质活跃,在体内容易被氧化,所以用eNOS表征NO水平。研究结果显示,造模会导致小鼠肠道内兴奋性神经递质AchE和SP显著降低、抑制性神经递质eNOS显著升高,有研究结果表明神经递质分泌失调会影响肠道蠕动[5]。而菌株干预后可逆转上述神经递质分泌失调,从而调控正常的肠道蠕动。
2.2.2 长双歧杆菌改善肠道微生态失调修复肠道生物屏障
研究表明,便秘患者与正常人的肠道菌群存在显著差异[16]。如图4所示,本研究也显示模型小鼠相较于正常小鼠肠道菌群发生显著改变。主要体现在α、β多样性及物种组成上:模型组小鼠肠道菌群Chao1指数和Shannon指数显著降低,而菌株干预能显著改善肠道菌群的丰富度和多样性;基于主坐标分析(principal coordinate analysis, PCoA),模型组与正常组肠道菌群组成具有显著差异,而菌干预相较于阳性药物组菌群组成更接近空白对照组;在门水平上,模型组小鼠肠道中厚壁菌门(Firmicutes)相对丰度显著下降,而拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria)相对丰度显著升高,且F/B比值显著降低,而有研究表明其比值降低与炎症相关[17]。
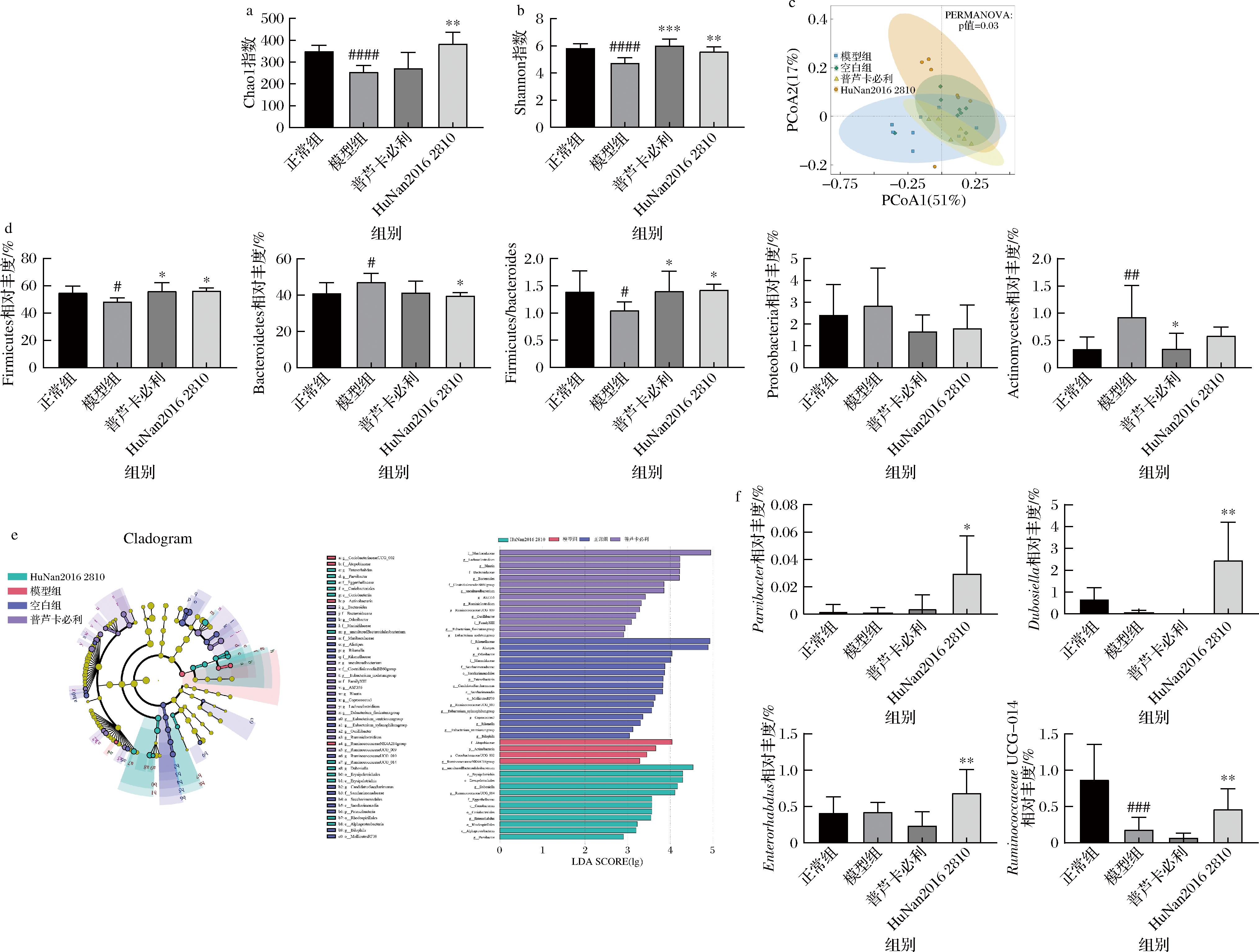
a-Chao1指数;b-Shannon指数;c-PCoA分析;d-门水平影响;e-LEfSe分析; f-菌干预组特征菌群分析
图4 长双歧杆菌对小鼠肠道菌群的影响
Fig.4 Effects of B.longum on intestinal microbiota in mice
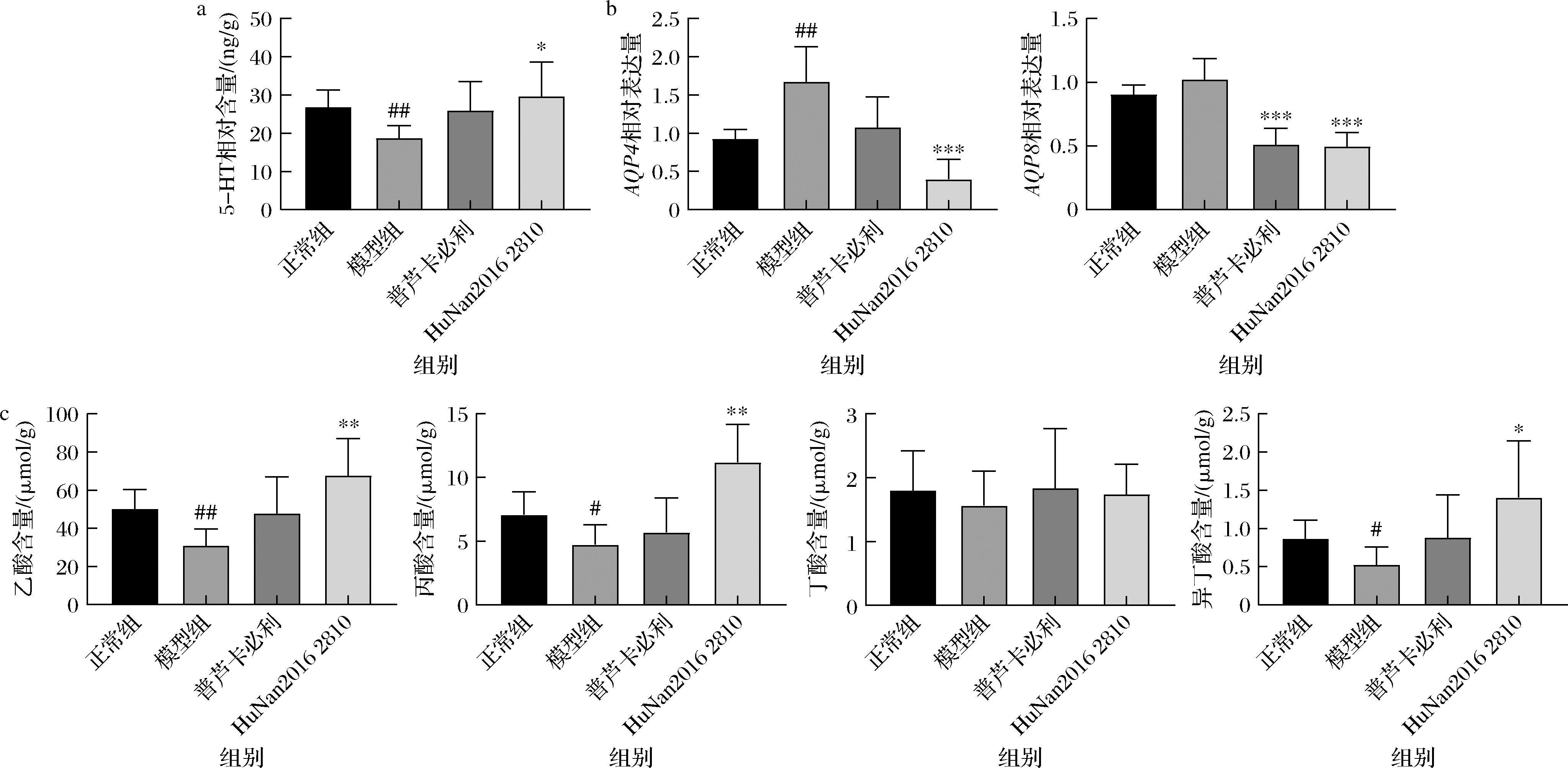
a-小鼠结肠中5-HT含量;b-小鼠结肠水通道蛋白基因表达量;c-小鼠粪便短链脂肪酸含量
图5 长双歧杆菌对小鼠化学屏障的影响
Fig.5 Effects of B.longum on chemical barriers in mice
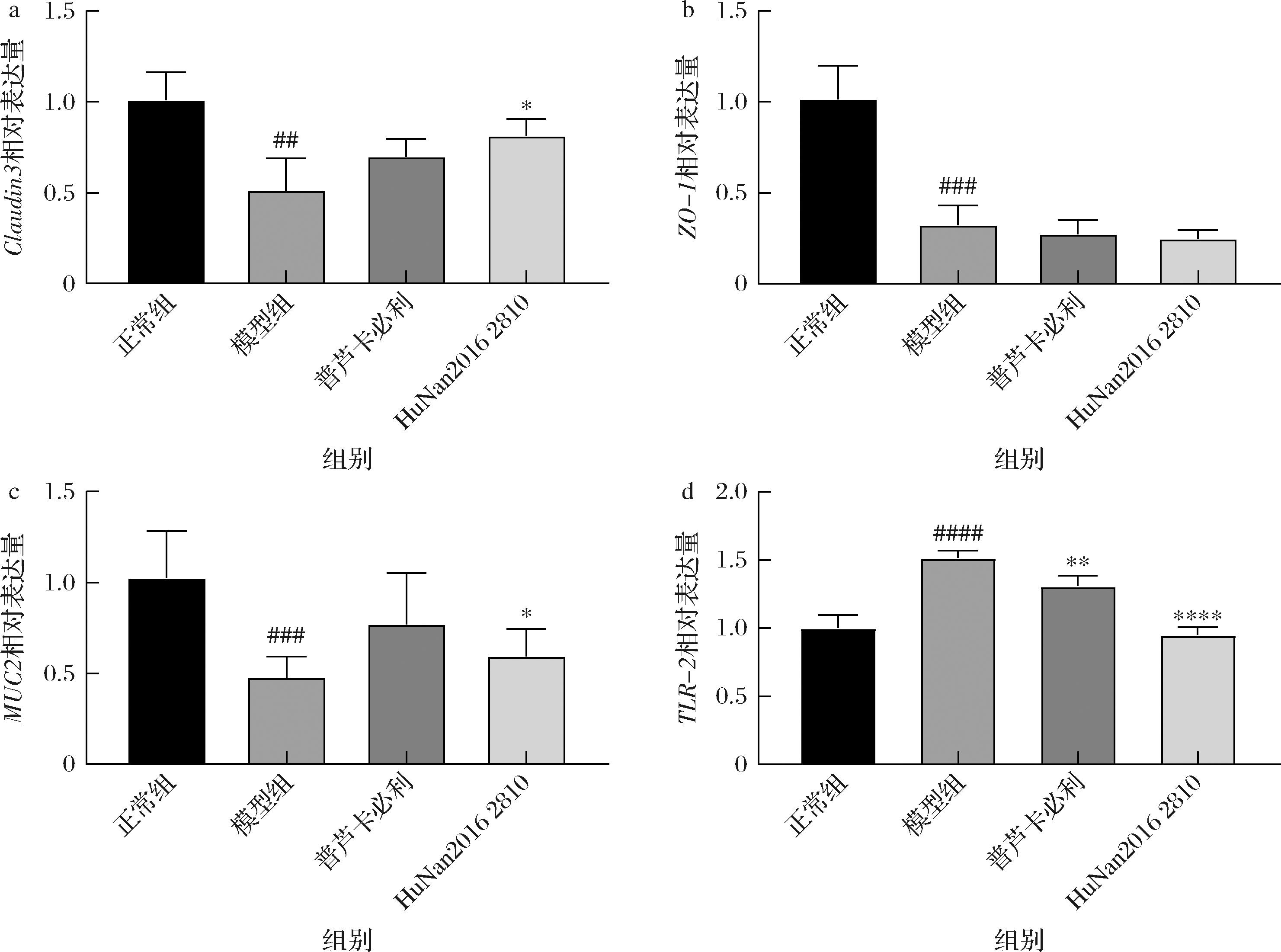
a-claudin3基因表达量;b-ZO-1基因表达量;c-MUC2基因表达量;d-TLR-2基因表达量
图6 长双歧杆菌对小鼠机械屏障的影响
Fig.6 Effects of B.longum on mechanical barriers in mice
进一步对小鼠肠道菌群进行LEfSe分析,结果表明菌干预组副拟杆菌属(Parvibacter)、Dubosiella、Enterorhabdus及瘤胃球菌属(Ruminococcaceae)UCG-014相对丰度显著升高,而有研究表明Ruminococcaceae UCG-014是瘤胃菌科中丰度较大的一个菌属,参与SCFAs产生。WAN等[18]发现Dubosiella与肠道内丁酸含量呈正相关。上述研究揭示,长双歧杆菌HuNan2016 2810可能是通过上调产SCFAs菌丰度,从而提高肠道中SCFAs的水平,继而发挥缓解泻剂结肠作用。
2.2.3 长双歧杆菌抑制水通道蛋白的表达和增加粪便中短链脂肪酸含量来调节肠道化学屏障
肠道化学屏障主要由胃肠道分泌的胃肠激素、溶菌酶、肠液以及肠道菌群产生的SCFAs等所构成[5]。如图5所示,造模后,泻剂结肠小鼠肠道AQPs表达量增加,水分过度吸收,从而导致大便干燥。而菌株干预后,能显著降低其表达水平,从而利于粪便排出。
SCFAs主要由肠道微生物菌群发酵产生,研究表明SCFAs可促进肠道运动[19]。本研究显示造模会导致粪便中SCFAs含量显著降低,而菌株干预后能显著增加其水平。有研究发现SCFAs能够调节肠液的分泌,刺激肠嗜铬细胞,调节肠道运动[20]。因此,猜测菌株发挥作用可能是通过提高粪便中SCFAs水平从而促进肠道内5-HT释放,进而影响肠道蠕动。通过对小鼠结肠中5-HT水平测定发现,模型组小鼠其含量显著降低,而菌株干预后显著增加,从而也证实了上述猜想。
2.2.4 长双歧杆菌调控肠道黏液蛋白及紧密链接蛋白表达调控肠道机械屏障
机械屏障作为肠道中的一道物理屏障,主要由肠上皮细胞和紧密连接蛋白等构成,在防止病原体、细菌等有害物质侵袭方面发挥着重要作用。有研究表明便秘会导致肠道屏障结构完整性破坏,肠道通透性增加,黏蛋白分泌减少,使机体抵抗外来病原体的能力下降,引起肠道组织损伤[21-22]。如图6所示,研究也显示泻剂结肠小鼠结肠内ZO-1、Claudin3、MUC2表达水平显著降低,TLR2表达水平显著升高,表明长期泻药刺激会影响肠道黏液分泌以及增加肠道通透性,导致肠道机械屏障损伤,影响正常的肠道功能。而长双歧杆菌HuNan2016 2810干预后能显著上调结肠组织中Claudin3及MUC2的表达。LEE等[21]动物实验研究表明,益生菌干预能显著上调便秘大鼠肠道组织中紧密连接蛋白表达,从而调控肠道通透性,缓解便秘。SHIMOTOYODOME等[23]也发现肠道内黏液分泌减少与便秘有关。因此,推测长双歧杆菌HuNan2016 2810干预可能通过上调肠道内紧密连接蛋白及黏蛋白表达从而调控肠道通透性和肠道蠕动,进而缓解泻剂结肠。
2.2.5 长双歧杆菌降低炎症水平及改善结肠病理损伤缓解肠道免疫屏障炎症
肠道是机体重要的免疫器官,肠道免疫屏障的稳态对宿主健康至关重要。有研究表明,长期的泻药刺激会导致结肠上皮细胞的超微结构损伤和微绒毛的改变及炎症的发生[7]。如图7所示,研究结果显示长期泻药刺激会导致泻剂结肠小鼠存在严重的结肠病理损伤,促炎细胞因子IL-1β、TNF-α和IL-6表达水平显著上调,而长双歧杆菌HuNan2016 2810干预能显著降低结肠炎症水平,缓解结肠病理损伤。KHALIF等[24]发现慢性便秘常带来严重的炎症反应,加重便秘程度。而相关研究报道益生菌可以减轻结肠炎小鼠肠道炎症水平,强化肠道屏障功能[25],因此,推测菌株长双歧杆菌HuNan2016 2810可能通过减轻结肠炎症水平,修复肠道免疫屏障,缓解泻剂结肠。

a-IL-1β基因表达量;b-IL-6基因表达量;c-IL-1β蛋白表达量;d-TNF-α基因表达量;e-结肠H&E
图7 长双歧杆菌对小鼠免疫屏障的影响
Fig.7 Effects of B.longum on immune barriers in mice

a-表观指标与生化指标相关性;b-短链脂肪酸与生化指标相关性
图8 表观指标与肠屏障指标相关性
Fig.8 Correlation between apparent index and intestinal barrier index
3 相关性分析
上述研究表明,长双歧杆菌HuNan2016 2810可能通过调控肠道神经及肠道屏障受损缓解泻剂结肠。为进一步分析各测量指标与各便秘缓解指标之间的联系,从而建立了便秘表观指标与检测指标的相关性分析。如图8-a所示,兴奋性神经递质及肠屏障测量指标与首粒蓝便时间呈显著负相关,与含水量及粪便粒数呈显著正相关;而炎症因子水平与首粒蓝便时间呈显著正相关,与含水量及粪便粒数呈显著负相关。SCFAs含量及PGP9.5与粪便粒数及含水量呈显著正相关;抑制性神经递质与粪便粒数及含水量呈显著负相关。S100β与粪便粒数呈显著正相关,与首粒蓝便时间呈显著负相关。
上述分析表明SCFAs与便秘缓解指标具有显著的相关性。而研究也显示长双歧杆菌HuNan20162810能显著上调粪便中产SCFAs菌株的相对丰度,且显著增加粪便中SCFA含量。因此,猜测菌株作用的物质基础可能是SCFAs。为进步探索SCFAs是如何发挥缓解作用,从而建立SCFAs与上述各测量指标的相关性。如图8-b所示,SCFAs的含量与兴奋性神经递质含量、肠神经系统测量指标、紧密连接蛋白表达及5-HT含量呈显著的正相关,与炎症因子表达、抑制性神经递质含量及水通道蛋白表达呈显著负相关,结合长双歧杆菌HuNan2016 2810对肠神经和肠屏障相关指标的影响情况可知:长双歧杆菌HuNan2016 2810通过上调肠道中产SCFAs菌的相对丰度,提高SCFAs含量,从而一方面通过调节神经递质分泌水平及肠神经胶质细胞数量修复肠神经,另一方面降低机体炎症水平,调控肠道屏障稳态,最终缓解泻剂结肠。
4 结论
本研究表明长双歧杆菌HuNan2016 2810对泻剂结肠具有缓解作用。通过对肠神经及肠屏障指标的检测,并进一步建立其与便秘表观指标及SCFAs指标之间的相关性,以解析HuNan2016 2810缓解泻剂结肠的可能途径。结果表明,长双歧杆菌HuNan2016 2810通过上调泻剂结肠小鼠体内产SCFAs菌的相对丰度,提高粪便中SCFAs含量,从而调节神经递质分泌,增加肠神经胶质细胞数量修复肠神经,降低机体炎症水平,强化肠道屏障功能,从而调控肠道稳态最终缓解泻剂结肠。
[1] WU J S, LIU B H, TONG W D, et al.Opioid receptors and associated regulator of G protein signaling are involved in the cathartic colon of rats[J].Experimental and Therapeutic Medicine, 2015, 9(4):1229-1234.
[2] WANG S Y, LIU Y P, FAN Y H, et al.Mechanism of aqueous fructus aurantii immaturus extracts in neuroplexus of cathartic colons[J].World Journal of Gastroenterology, 2015, 21(31):9358-9366.
[3] 张冰, 孙涛.谢晶日教授中医药治疗溃疡性结肠炎思路探讨[J].世界最新医学信息文摘, 2015, 15(53):137.ZHANG B, SUN T.Discussion on professor Xie jingri’s thinking of treating ulcerative colitis with traditional Chinese medicine[J].World Latest Medicine Information, 2015, 15(53):137.
[4] LIU L G, WANG A L, SHI H K, et al.Efficacy and safety of probiotics and synbiotics for functional constipation in children:A systematic review and meta-analysis of randomized clinical trials[J].Clinical Nutrition, 2023, 42(10):1817-1826.
[5] 柴茂. 双歧杆菌对便秘的缓解作用及其机制分析[D].无锡:江南大学, 2021.CHAI M.Alleviating effect of Bifidobacterium on constipation and its mechanism analysis[D].Wuxi:Jiangnan University, 2021.
[6] 李鑫萍. 乳酸菌对泻剂结肠的缓解作用探究[D].无锡:江南大学, 2021.LI X P.Study on the relieving effect of lactic acid bacteria on cathartic colon[D].Wuxi:Jiangnan University, 2021.
[7] RIEMANN J F, SCHENK J, EHLER R, et al.Ultrastructural changes of colonic mucosa in patients with chronic laxative misuse[J].Acta Hepato-Gastroenterologica, 1978, 25(3):213-218.
[8] BERGMANN K R, LIU S X L, TIAN R L, et al.Bifidobacteria stabilize claudins at tight junctions and prevent intestinal barrier dysfunction in mouse necrotizing enterocolitis[J].The American Journal of Pathology, 2013, 182(5):1595-1606.
[9] KUNZE W A, MAO Y K, WANG B X, et al.Lactobacillus reuteri enhances excitability of colonic AH neurons by inhibiting calcium-dependent potassium channel opening[J].Journal of Cellular and Molecular Medicine, 2009, 13(8b):2261-2270.
[10] 毛丙永. 功能性低聚糖对肠道细菌的影响及机制[D].无锡:江南大学, 2015.MAO B Y.Effect and mechanism of functional oligosaccharides on intestinal bacteria[D].Wuxi:Jiangnan University, 2015.
[11] MENG Y Y, LI Q D, FENG Y, et al.Animal models of cathartic colon[J].World Journal of Clinical Cases, 2021, 9(6):1251-1258.
[12] FURNESS J B.The enteric nervous system and neurogastroenterology[J].Nature Reviews.Gastroenterology &Hepatology, 2012, 9(5):286-294.
[13] LI H Y, YAN X, XUE Q L, et al.Effects of nociceptin/orphanin FQ on rats with cathartic colon[J].World Journal of Gastroenterology, 2007, 13(1):141-145.
[14] WANG Y B, WANG Q, KUERBAN K, et al.Colonic electrical stimulation promotes colonic motility through regeneration of myenteric plexus neurons in slow transit constipation beagles[J].Bioscience Reports, 2019, 39(5):BSR20182405.
[15] MAGGI C A, PATACCHINI R, MEINI S, et al.Comparison of tachykinin NK1 and NK2 receptors in the circular muscle of the Guinea-pig ileum and proximal colon[J].British Journal of Pharmacology, 1994, 112(1):150-160.
[16] MANCABELLI L, MILANI C, LUGLI G A, et al.Unveiling the gut microbiota composition and functionality associated with constipation through metagenomic analyses[J].Scientific Reports, 2017, 7(1):9879.
[17] STOJANOV S, BERLEC A,  TRUKELJ B.The influence of probiotics on the firmicutes/bacteroidetes ratio in the treatment of obesity and inflammatory bowel disease[J].Microorganisms, 2020, 8(11):1715.
TRUKELJ B.The influence of probiotics on the firmicutes/bacteroidetes ratio in the treatment of obesity and inflammatory bowel disease[J].Microorganisms, 2020, 8(11):1715.
[18] WAN F, HAN H, ZHONG R Q, et al.Dihydroquercetin supplement alleviates colonic inflammation potentially through improved gut microbiota community in mice[J].Food &Function, 2021, 12(22):11420-11434.
[19] DASS N B, JOHN A K, BASSIL A K, et al.The relationship between the effects of short-chain fatty acids on intestinal motility in vitro and GPR43 receptor activation[J].Neurogastroenterology &Motility, 2007, 19(1):66-74.
[20] WAN SAUDI W S, SJÖBLOM M.Short-chain fatty acids augment rat duodenal mucosal barrier function[J].Experimental Physiology, 2017, 102(7):791-803.
[21] LEE C S, TAN P L, EOR J Y, et al.Prophylactic use of probiotic chocolate modulates intestinal physiological functions in constipated rats[J].Journal of the Science of Food and Agriculture, 2019, 99(6):3045-3056.
[22] YANG X, GAO X C, LIU J, et al.Effect of EPEC endotoxin and bifidobacteria on intestinal barrier function through modulation of toll-like receptor 2 and toll-like receptor 4 expression in intestinal epithelial cell-18[J].World Journal of Gastroenterology, 2017, 23(26):4744-4751.
[23] SHIMOTOYODOME A, MEGURO S, HASE T, et al.Decreased colonic mucus in rats with loperamide-induced constipation[J].Comparative Biochemistry and Physiology Part A:Molecular &Integrative Physiology, 2000, 126(2):203-212.
[24] KHALIF I L, QUIGLEY E M M, KONOVITCH E A, et al.Alterations in the colonic flora and intestinal permeability and evidence of immune activation in chronic constipation[J].Digestive and Liver Disease, 2005, 37(11):838-849.
[25] 白云, 韩博, 栗楠, 等.表达鼠源GLP-2重组嗜酸乳杆菌的构建[J].中国兽医学报, 2015, 35(5):727-730.BAI Y, HAN B, LI N, et al.Construction of recombinant Lactobacillus acidophilus experessing mouse GLP-2[J].Chinese Journal of Veterinary Science, 2015, 35(5):727-730.