异麦芽酮糖,被称为帕拉金糖,是一种自然存在于甘蔗、蜂蜜等物质中的还原性二糖,但其含量极低。在食品工业中,异麦芽酮糖具有比蔗糖更好的功能特性,如低吸湿性,在潮湿环境中不易吸收水分,保证食品品质的稳定性;低致龋性,减少牙齿蛀坏的可能性,对口腔健康有益;低血糖指数,降低单糖和胰岛素在血液中的释放率帮助控制血糖,对糖尿病患者友好;能够选择性促进双歧杆菌在人体肠道菌群中的生长,有利于维持肠道微生态平衡;显示出极高的稳定性,即使在高温、高压或酸碱环境下,也能保持其结构和功能不受影响[1-2]。基于上述优点,异麦芽酮糖被广泛视为一种新型的功能性糖,美国FDA将其列为公认安全食品,并允许无限量添加到食品生产过程中。
由于天然的异麦芽酮糖含量极低,无法通过提取的方式来满足日渐庞大的市场需求,因此需要采用其他的方法来提高异麦芽酮糖的产量。目前,异麦芽酮糖的生产方式主要有4种:化学合成法、植物转基因法、微生物转化法及酶转化法。其中,植物转基因法和化学合成法工艺复杂,技术不够成熟,而且在操作过程中存在高能耗、高污染等问题,微生物转化法易受到微生物细胞活力以及底物浓度的限制,酶转化法是目前工业上主要采用的方法,主要是利用蔗糖异构酶(EC 5.4.99.11,sucrose isomerase, SIase)催化蔗糖生产异麦芽酮糖,该酶主要有两种功能(如图1),一是异构化,它能将蔗糖分子内的α-1,2-糖苷键转换成α-1,6-糖苷键的异麦芽酮糖和α-1,1-糖苷键的海藻酮糖,是蔗糖异构酶的主要产物;二是水解作用,蔗糖异构酶还能将蔗糖水解为少量的副产物,葡萄糖和果糖[3]。虽然酶转化法生产异麦芽酮糖效率高,但仍然需要解决酶的转化效率低、回收率低及副产物复杂等问题,以满足市场需求并降低生产成本。
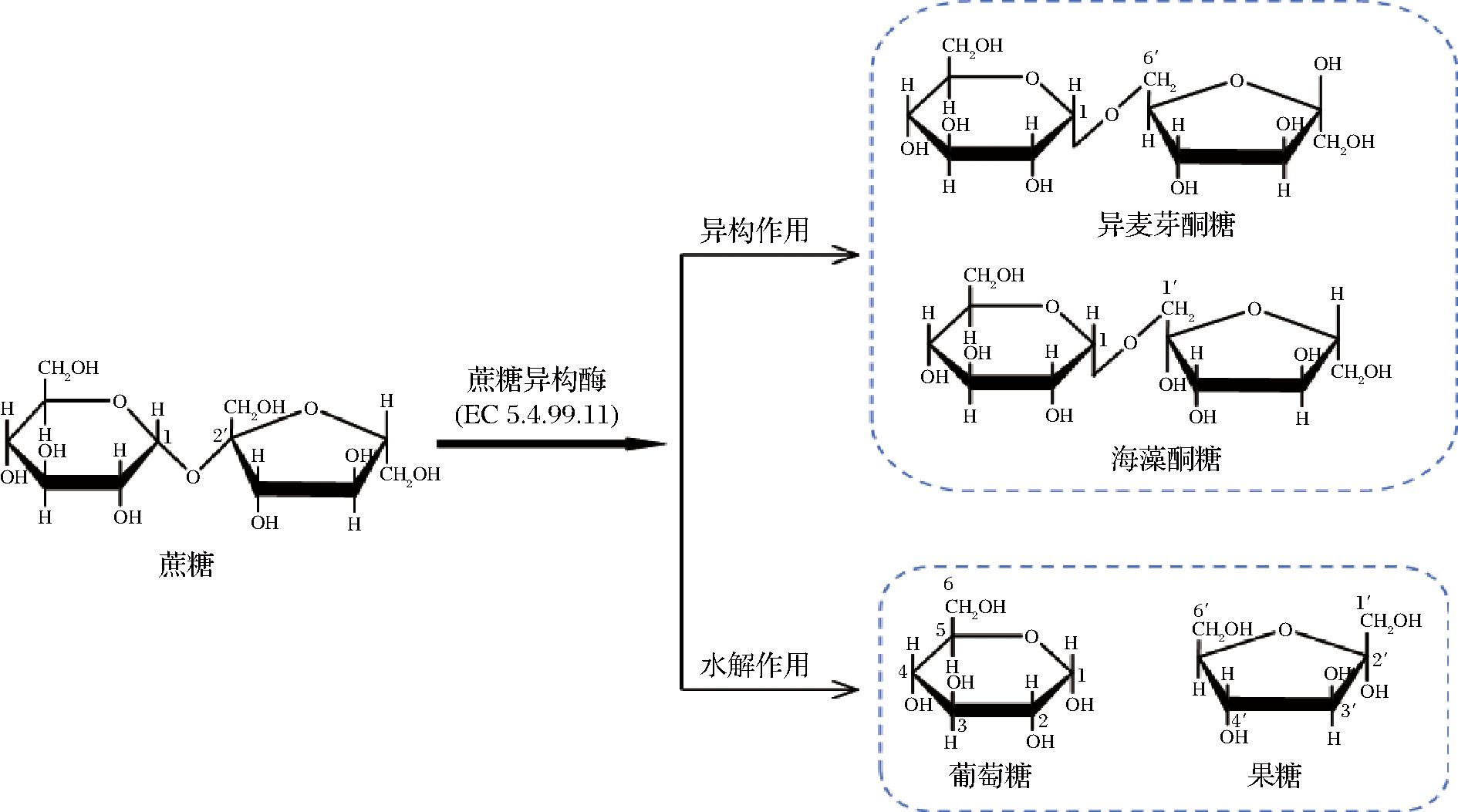
图1 蔗糖异构酶的催化作用
Fig.1 Catalytic action of sucrose isomerase
迄今为止,各国科研人员已经发现多种能够合成蔗糖异构酶的微生物,但大多数已报道的野生型蔗糖异构酶仍存在稳定性差、酶催化活性低、副产物复杂等问题。因此,研究者们已经证明将不同来源的蔗糖异构酶基因在大肠杆菌中表达可以显著提高产酶能力。鉴于蔗糖异构酶在食品工业中的广泛应用,使得它在食品安全菌株中的表达受到了越来越多的关注。根据近年来蔗糖异构酶的研究进展,本文系统概述了SIase的来源及性质、诱变育种、异源表达、分子改造以及酶的化学修饰等。
1 产蔗糖异构酶菌株的来源及性质
国内外关于蔗糖异构酶的研究已有70多年的历史,蔗糖异构酶主要来源于微生物。1950年,首次从甜菜厂的废水中筛选和分离出产蔗糖异构酶菌株红色精朊杆菌(Protaminobacter rubrum)[4]。近年来,各国科研人员已经发现多种微生物可产蔗糖异构酶,不同来源的蔗糖异构酶催化能力具有很大的区别,按照蔗糖异构酶催化蔗糖生成的主产物不同分为两类微生物,一类是异麦芽酮糖主产型(60%~91%):红色精朊杆菌属[5]、普城沙雷氏菌属[6]、克雷伯氏菌属[7]、分散泛菌属[8]、肠杆菌属[9]、大黄欧文氏菌属[10]、土生拉乌尔菌属[11]等菌株;另一类是海藻酮糖主产型(85%~89%):嗜中酸假单胞菌属和放射形土壤杆菌属[12-13],此外,SALVUCCI等[14]发现一种昆虫Silverleaf whitefly来源的蔗糖异构酶,与细菌产生的蔗糖异构酶不同,只能催化蔗糖生成海藻酮糖。自然界中筛选出的菌株在酶活力、酶稳定性等方面不具备优势,往往需要结合其他方法进一步完成产酶菌株的选育工作。
蔗糖异构酶绝大多数属于常温微生物,如表1所示,最适温度为20~40 ℃,而Enterobacter sp.FMB-1来源的酶最适温度为50 ℃,据文献报道,温度变化显著影响蔗糖异构化产物的比例,如VÉRON SE等[6]发现来源于Serratia.plymuthica的蔗糖异构酶在25 ℃时有利于海藻酮糖的生成,30 ℃时有利于异麦芽酮糖的生成,45 ℃有利于单糖的生成。此外,蔗糖异构酶属于酸性蛋白质,大多数pH<7.0,据文献报道,pH不仅影响蔗糖异构酶的酶活,还对异麦芽酮糖的转化率产生影响,蔗糖异构酶在偏碱性的条件下容易生成海藻酮糖,过酸的环境会使产物中葡萄糖和果糖的比例增加[15]。尽管大部分蔗糖异构酶在氨基酸序列上具有高度的相似性,不同来源的蔗糖异构酶在底物亲和力上存在显著差异,Km范围为19.2~280 mmol/L。
SE等[6]发现来源于Serratia.plymuthica的蔗糖异构酶在25 ℃时有利于海藻酮糖的生成,30 ℃时有利于异麦芽酮糖的生成,45 ℃有利于单糖的生成。此外,蔗糖异构酶属于酸性蛋白质,大多数pH<7.0,据文献报道,pH不仅影响蔗糖异构酶的酶活,还对异麦芽酮糖的转化率产生影响,蔗糖异构酶在偏碱性的条件下容易生成海藻酮糖,过酸的环境会使产物中葡萄糖和果糖的比例增加[15]。尽管大部分蔗糖异构酶在氨基酸序列上具有高度的相似性,不同来源的蔗糖异构酶在底物亲和力上存在显著差异,Km范围为19.2~280 mmol/L。
表1 不同来源蔗糖异构酶的性质
Table 1 Properties of sucrose isomerase from different sources
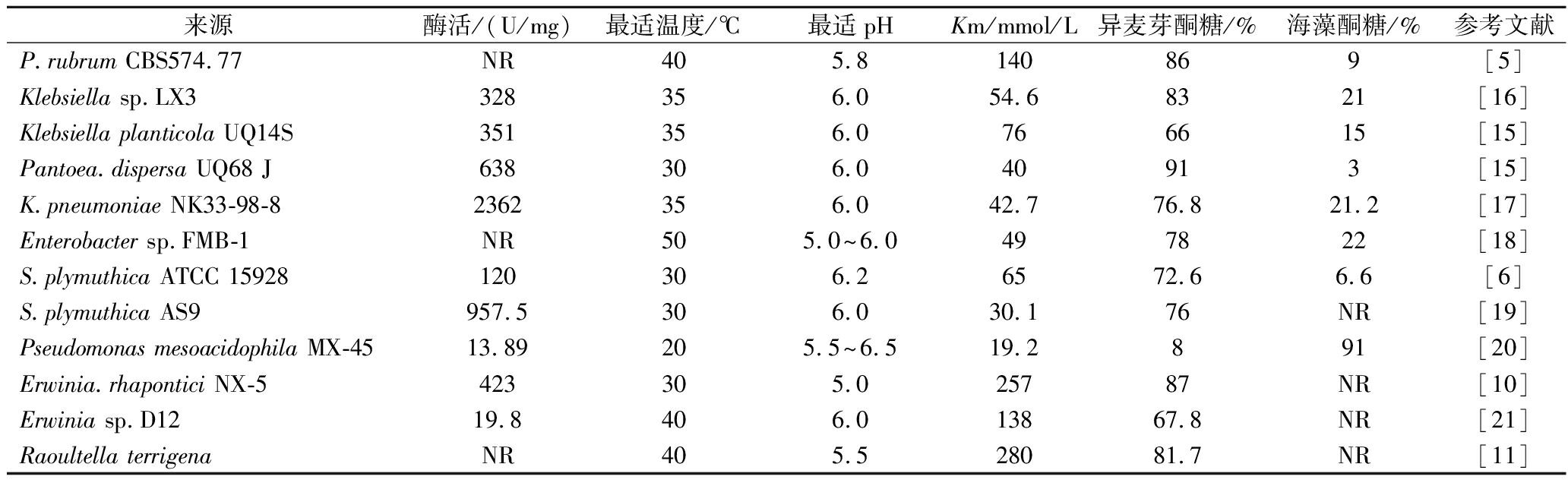
来源酶活/(U/mg)最适温度/℃最适pHKm/mmol/L异麦芽酮糖/%海藻酮糖/%参考文献P.rubrum CBS574.77NR405.8140869[5]Klebsiella sp.LX3328356.054.68321[16]Klebsiella planticola UQ14S351356.0766615[15]Pantoea.dispersa UQ68 J638306.040913[15]K.pneumoniae NK33-98-82362356.042.776.821.2[17]Enterobacter sp.FMB-1NR505.0~6.0497822[18]S.plymuthica ATCC 15928120306.26572.66.6[6]S.plymuthica AS9957.5306.030.176NR[19]Pseudomonas mesoacidophila MX-4513.89205.5~6.519.2891[20]Erwinia.rhapontici NX-5423305.025787NR[10]Erwinia sp.D1219.8406.013867.8NR[21]Raoultella terrigenaNR405.528081.7NR[11]
注:NR,未报道(下同)。
2 诱变育种
从自然界中分离筛选出来的产蔗糖异构酶菌株,其产酶活力普遍偏低,不宜用于异麦芽酮糖的工业化生产。因此,利用诱变技术提高菌株的产酶能力已成为一种普遍的方法。微生物诱变育种是利用物理或化学手段对菌株进行诱变,使其基因发生突变,从而筛选、鉴定和选育出满足要求的优良菌株。一般常用的物理诱变剂主要包括紫外线(ultraviolet, UV)、常压室温等离子体(atmospheric and room temperature plasma, ARTP)、γ射线、离子注入、重离子束等。化学诱变剂主要包括亚硝基胍(nitroso-guanidin, NTG)、甲基磺酸乙酯(ethyl methylsulfone, EMS)、硫酸二乙酯(diethyl sulfate, DES)和氯化锂(LiCl)等物质。表2中列举了研究人员对产蔗糖异构酶菌株进行诱变育种的具体情况。
表2 产蔗糖异构酶菌株诱变育种情况
Table 2 Mutation breeding of SIase producing strains

诱变方法菌株诱变效果遗传稳定性参考文献NTGP.rubrum诱变后菌株的酶活力提高1倍,异麦芽酮糖的产率比原始菌株提高7.48%5代稳定[22]ARTPKlebsiella sp.LX3诱变后菌株酶活力较原始菌提高了20.42%,异麦芽酮糖产量提高了41.87%6次传代[23]ARTPE.rhapontici YS-1筛选得到一株发酵液黏度低、酶活较原始菌株YS-1(1.34 U/mL)提高10.01倍的突变菌株5代稳定[24]NTGSerratia sp.KCTC2865诱变后菌株异麦芽酮糖的产量比野生菌株的产量(76.9%)高出约13%-[25]
注:-表示未报道(下同)。
研究人员主要采用亚硝基胍、常温常压等离子体等方法对产蔗糖异构酶菌株进行诱变育种,通过结合菌株的致死率及正突变率来确定最佳的诱变条件,从而筛选出酶活性高、遗传稳定性好的菌株。然而,单一诱变处理容易造成生长周期延长、代谢减缓等问题,因此,可采用多种诱变剂复合处理的方式进行诱变育种,以扩大突变位点并使诱变方式起到协同作用,更容易获得性能优良的菌株。如邓静等[26]通过单一及复合的诱变方式对米曲霉酶进行诱变,发现紫外-硫酸二乙酯复合诱变方式比仅利用紫外或硫酸二乙酯单一诱变方式更显著地影响酶活力。与传统的诱变育种方法相比,菌株产酶基因的异源表达在提高菌株产酶活力方面更具优势且高效便捷,也更能满足工业化生产的需求。
3 异源表达
蔗糖异构酶主要是由微生物发酵获得,目前大多数产SIase的野生菌株属于植物病原菌,产酶活低,转化液成分复杂,不利于下游分离,使得天然的蔗糖异构酶难以满足工业化生产的需求。为了提高蔗糖异构酶的表达效率以更好地应用于生产异麦芽酮糖,利用基因工程手段,实现蔗糖异构酶的克隆及高效表达,构建稳定而高效的工程菌,成为热门的研究方向。目前,研究者们克隆SIase至不同宿主细胞中进行异源表达,常用的宿主主要有大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus.subtilis)、乳酸乳球菌(Lactococcus lactis)、毕赤酵母(Pichia pastoris)、酿酒酵母(Saccharomyces cerevisiae)、解脂耶氏酵母(Yarrowia lipolytica)和谷氨酸棒状杆菌(Corynebacterium glutamicum)等。蔗糖异构酶的重组表达研究中,主要存在表达水平低及易形成不溶性包涵体等问题,较多学者研究可通过优化诱导条件(温度、IPTG浓度、培养时间)、培养基和表达宿主类型,也可使用弱启动子的载体(如pGEX系列)和使用促溶标签(如GST,NusA,MBP,Sumo等)等方法减少包涵体的形成。本文主要综述以下优化策略提高酶的高效异源表达:宿主菌株改造、启动子和信号肽优化、发酵条件优化等。
3.1 宿主菌株改造
蔗糖异构酶的表达宿主包括原核宿主和真核宿主。在原核表达系统中,大肠杆菌表达系统是研究最为成熟的表达系统,具有遗传背景简单、易于操作、繁殖迅速和表达量高等特点,是生产目标产品的理想工程菌株之一。目前,来源不同微生物的SIase已成功在大肠杆菌中克隆并实现了表达,显著增加了酶的生产水平(见表3)。1995年,MATTES等[4]首次将来源于P.rubrum CBS547.77的SIase基因在大肠杆菌(E.coli)中进行了表达,然后来自P.dispersa UQ68 J[8],Erwinia sp.D12[27],Enterobacter sp.FMB-1[18],Klebsiella sp.LX3[16],P.mesoacidophila MX-45[28]等不同微生物的SIase陆续在大肠杆菌中成功表达。然而,大肠杆菌中表达蔗糖异构酶易产生包涵体、胞外分泌效率差等问题。近年来的研究表明,通过将特定的标签序列与酶蛋白进行融合,可使其在胞内形成具有催化活性的包涵体,表达量大且易于分离纯化,在理论上改变了包涵体是完全无活性的蛋白聚集体。马志宇等[29]通过融合表达技术成功制备出融合卷曲螺旋结构域TdoT的SIase活性包涵体,TdoT-SI和SI-TdoT表达为具有催化活性的包涵体,而未融合TdoT的SIase包涵体则无催化活性。然而,对于大肠杆菌表达系统而言,能够产生内毒素不适用于异麦芽酮糖的合成。因此,将食品安全级菌株作为蔗糖异构酶表达宿主可解决热原和内毒素等安全问题。如表3所示,PARK等[30]将Enterobacter sp.FMB-1的SIase在L.lactis MG1363中进行表达,实现了酶的胞外分泌,异麦芽酮糖的转化率达到了72%,活性低于3.0 U/mL,远未到行业要求,WU等[31]将来自E.rhapontici NX-5的SIase基因通过穿梭质粒pHA01在B.subtilis WB800中表达,异麦芽酮糖的转化率为90%,随后ZHANG等[32]为了提高SIase的表达,以CotX作为锚定蛋白,E.rhapontici NX-5的SIase在B.subtilis 168中实现了表面展示,表现出优异的蔗糖异构酶活性,异麦芽酮糖的转化率达到了92%。
表3 蔗糖异构酶的原核宿主表达
Table 3 Prokaryotic host expression of SIase
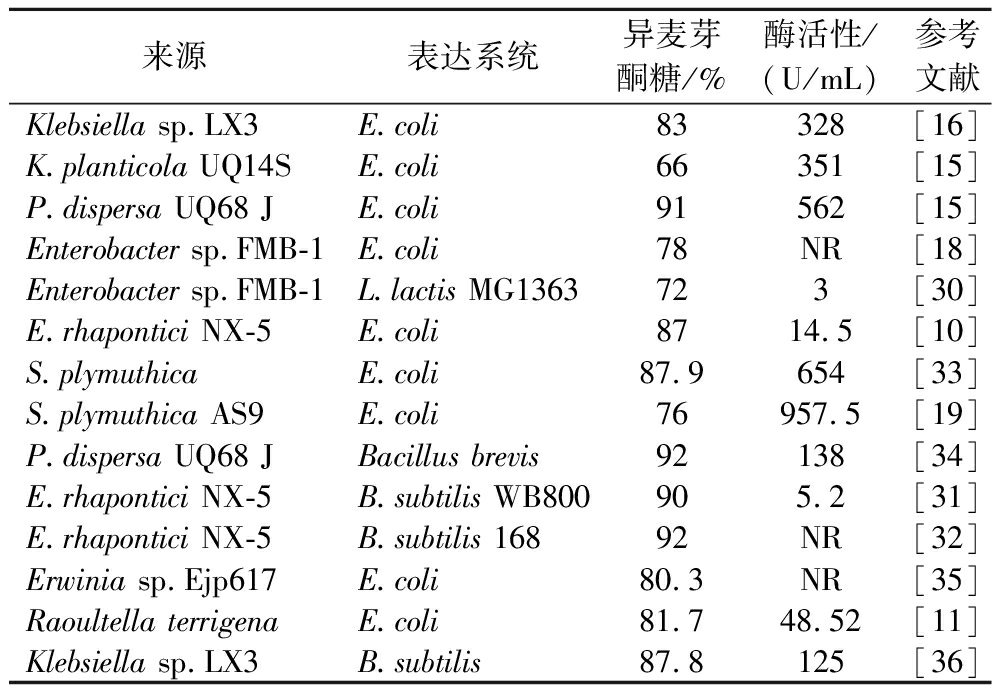
来源表达系统异麦芽酮糖/%酶活性/(U/mL)参考文献Klebsiella sp.LX3E.coli83328[16]K.planticola UQ14SE.coli66351[15]P.dispersa UQ68 JE.coli91562[15]Enterobacter sp.FMB-1E.coli78NR[18]Enterobacter sp.FMB-1L.lactis MG1363723[30]E.rhapontici NX-5E.coli8714.5[10]S.plymuthicaE.coli87.9654[33]S.plymuthica AS9E.coli76957.5[19]P.dispersa UQ68 JBacillus brevis92138[34]E.rhapontici NX-5B.subtilis WB800905.2[31]E.rhapontici NX-5B.subtilis 16892NR[32]Erwinia sp.Ejp617E.coli80.3NR[35]Raoultella terrigenaE.coli81.748.52[11]Klebsiella sp.LX3B.subtilis87.8125[36]
酵母属于真核生物,其表达系统遗传背景清晰、发酵工艺成熟、产物易分离纯化,在基因工程领域应用越来越广泛。目前常用的酵母主要为毕赤酵母、解脂耶氏酵母、酿酒酵母。据报道,LEE等[9]利用锚定蛋白的糖基磷脂酰肌醇,将来源于Enterobacter sp.FMB-1的SIase在酿酒酵母中成功表达并进行表面展示,仅获得6.4%~7.4%的异麦芽酮糖产率。对来源于Klebsiella sp.LX3的SIase在不同的酵母宿主中已成功表达,如宋蕾等[37]将来源于Klebsiella sp.LX3的SIase成功在解脂耶氏酵母宿主中表达,酶活力高达916.91 U/mg,CAO等[38]将来源于Klebsiella sp.LX3的SIase在毕赤酵母宿主中表达,酶活力为36.6 U/mL,在40%蔗糖溶液中94%的蔗糖转化为异麦芽酮糖。对来源于P.dispersa UQ68 J的SIase,LIU等[39]利用解脂耶氏酵母细胞壁锚定蛋白Pir1,成功地将SIase展示在解脂耶氏酵母细胞表面,异麦芽酮糖的转化率达到93%,ZHANG等[40]将P.dispersa UQ68 J中编码的SIase构建在解脂耶氏酵母中重组表达,酶活力最高为7.43 U/mL,异麦芽酮糖在最终发酵产物中纯度高达97.8%。
3.2 启动子和信号肽优化
除了表达宿主之外,研究发现启动子和信号肽对外源基因的表达水平同样具有重要影响,是提高酶表达或分泌的常用方法。2010年,PARK等[30]利用自身诱导性启动子(P170)和优化的信号肽(SP310 mut2)在L.lactis MG1363中表达来自Enterobacter sp.FMB-1的SIase基因。邹亮[41]探究了枯草芽孢杆菌来源的启动子Papr、Pnpr和Pamy以及巨大芽孢杆菌来源的启动子Pxyl对重组菌B.choshinensis/pNCMO2-SI的影响,其中启动子Papr介导的重组菌BCpNapr-SI的胞外上清液酶活力最高,为85.1 U/mL。含内含子的TEF启动子(TEFin)是解脂耶氏酵母中新表征的强组成型启动子,其表达量比传统启动子增加5倍[42],ZHANG等[43]将P.dispersa UQ68 J的SIase基因连接到携带TEFin强启动子的表达载体pM06上,并成功转入解脂耶氏酵母宿主中获得了高水平的分泌蔗糖异构酶,其酶活力达49.3 U/mL。GUO等[36]通过使用半理性策略优化信号肽(WapA),在枯草芽孢杆菌中实现了来自Klebsiella sp.LX3的SIase增强表达,在5L发酵罐中进行分批补料发酵,SIase酶活性增加到125 U/mL。
3.3 发酵条件优化对蔗糖异构酶异源表达的影响
蛋白表达条件的优化是最直接有效的提高异源蛋白表达的策略之一。良好的蛋白质生产过程需要考虑培养基组成和成本、发酵条件以及后续的放大过程。为了改善蔗糖异构酶的表达水平,研究人员在该方面进行了大量的研究。
LI等[44]为了开发一种经济的工业培养基,首次使用未处理的甘蔗糖蜜对来源于E.rhapontici NX-5的SIase表达在大肠杆菌中进行研究,通过响应面优化培养基,蔗糖异构酶的活性提高到14.5 U/mg·DCW,比LB培养基提高了3倍。WU等[31]在B.subtilis WB800中表达E.rhapontici NX-5的SIase,在摇瓶中优化培养基组分,最佳氮源和碳源为酵母提取物(15 g/L)和未处理的甘蔗糖蜜(20 g/L),在7.5 L发酵罐中进行SIase的表达,酶活达到5.2 U/mL。刘军彤[34]将SIase基因在B.brevis中表达,经摇瓶发酵后,重组菌株胞外酶活达到50 U/mL。经摇瓶培养基优化后,重组菌株的胞外酶活达到138 U/mL。在3 L发酵罐中,蔗糖异构酶的胞外酶活提升至190 U/mL。邹亮[41]通过在摇瓶和3 L发酵罐中考察了发酵条件对重组菌B.choshinensis/pNCMO2-SI酶分泌的影响,重组菌经摇瓶培养条件优化后测得胞外上清酶活为98.4 U/mL,进一步对重组菌进行3 L罐发酵培养条件优化,测得胞外上清酶活达到275 U/mL,是摇瓶优化后酶活的2.79倍。ZHANG等[43]将P.dispersa UQ68 J的SIase在解脂耶氏酵母中表达,经培养基优化后,蔗糖异构酶酶活达49.3 U/mL。宋蕾[45]将来自Klebsiella sp.LX3的蔗糖异构酶PalI编码基因构建于食品安全型菌种解脂耶氏酵母Yarrowia lipolytica Pog1中进行异源表达,对发酵培养基进行优化,酶活力提高了2.9倍。
4 蔗糖异构酶的分子改造
4.1 定向进化
非理性设计,又称“定向进化”,这种方法不需要了解目标酶的结构与功能等信息,从而对酶基因进行随机突变和基因片段的重组来创造突变文库,然后从大量突变库中筛选出所需特征的目标突变体。定向进化已成功应用于多种酶各方面的改造,可以提高酶的催化活性,增加热稳定性,提高表达量等。尽管这种方式未应用到蔗糖异构酶,但已成功地提高了GH13酶的热稳定性,如来自Thermus thermophilus TC11的α-葡萄糖苷酶和Bacillus licheniformis的α-淀粉酶[46]。
4.2 半理性设计
半理性设计是一种理性设计和非理性设计相结合的新型设计策略,这种方法基于同源蛋白序列比对、三维结构等信息,通过同源建模或分子动力学模拟选取若干个氨基酸残基作为改造靶点,同时结合氨基酸特点选择密码子构建小而有效的突变文库,进而筛选获得有益突变的过程[47]。例如,PILAK等[48]采用了类似“战舰”策略的半理性蛋白质工程策略,通过替换活性位点附近的氨基酸位置,对来源于S.plymuthica的蔗糖异构酶SmuA经过7个迭代循环,涉及55个点突变,获得了三重突变体Y219L/D398G/V465E,突变体的最适温度由30 ℃提高到35 ℃,海藻酮糖的比例仅为1.5%,同时具有较高的催化效率,有望替代现有的蔗糖异构酶PadU。LIU等[11]结合同源建模以及半理性设计,通过PCR对将来源Raoultella terrigena的SIase进行突变,获得8个定点突变的突变体。其中,突变体N498P、Q275R酶活分别提高了89.2%,42.2%。突变体Y246L、H287R、H481P异麦芽酮糖的转化率分别提高至89.1%、90.7%和92.4%。长期研究表明,结合非理性和理性改造的半理性改造策略,兼顾了序列、结构多样性和筛选工作量的问题,已成为应用非常广泛的蛋白质改造策略。
4.3 理性设计
理性设计需要深入了解酶分子的结构、功能以及催化机制等信息,结合氨基酸残基之间的相互作用,利用定点突变技术对氨基酸序列中关键氨基酸进行精确改造,利用计算机模拟等手段对突变前后的结构变化进行分析,从而获得催化性质显著改进的突变体。如表4所示,ZHANG等[16]将来源于Klebsiella sp.LX3菌株的SIase通过定点诱变对其进行分子改造,利用脯氨酸取代E498,产生突变体E498P,再将R310突变为脯氨酸,形成双突变体E498P/R310P,最适温度从35 ℃分别提高至40 ℃和45 ℃,所得双突变酶在50 ℃条件下的半衰期是天然酶(半衰期为1.8 min)的11倍,通过确定潜在的脯氨酸取代位点提高了酶的热稳定性,与此同时异麦芽酮糖的转化率提高了27%。LIPSKI等[49]采用随机突变的方式对来源于Rhizobium sp.的SIase进行改造,获得了F164L突变体,使得异麦芽酮糖的转化率提高了55.1%。同样鉴于S.plymuthica AS9的蔗糖异构酶不稳定,程胜等[50]通过基于B-factor对蔗糖异构酶进行改造,使用Rosetta Design数据库设计突变体,突变体E175 N、K576D和E175 N/K576D的最适温度35 ℃,略高于天然酶最适温度30 ℃,45 ℃下的半衰期分别是天然酶的2.30、1.78和7.65倍,异麦芽酮糖转化率分别比天然酶提高了1.8%、0.7%和1.6%。此外通过蛋白质结构、柔性变化、氢键和能量值的变化等分析了突变体热稳定性和催化效率提高的原因。SARDI A-PE
A-PE A等[51]为了提高E.rhapontici NX-5的蔗糖异构酶热稳定性,选择Pichia pastoris作为表达系统,基于B因子分析、氢键预测和活性位点的分子对接,确定蔗糖异构酶中发生突变的残基,在此基础上,报道了糖基化蔗糖异构酶的表达,设计的突变体K174Q、L202E和K174Q/L202E,最适温度提高了5 ℃,在40 ℃条件下半衰期分别增加了2.21、1.73和2.89倍,突变体的催化效率最高提高了16%。分析认为,热稳定性提高的原因可能是引入的突变或突变与分子糖基化结合所产生的简单效应。
A等[51]为了提高E.rhapontici NX-5的蔗糖异构酶热稳定性,选择Pichia pastoris作为表达系统,基于B因子分析、氢键预测和活性位点的分子对接,确定蔗糖异构酶中发生突变的残基,在此基础上,报道了糖基化蔗糖异构酶的表达,设计的突变体K174Q、L202E和K174Q/L202E,最适温度提高了5 ℃,在40 ℃条件下半衰期分别增加了2.21、1.73和2.89倍,突变体的催化效率最高提高了16%。分析认为,热稳定性提高的原因可能是引入的突变或突变与分子糖基化结合所产生的简单效应。
表4 蔗糖异构酶的分子改造研究情况
Table 4 Research on molecular modification of SIase
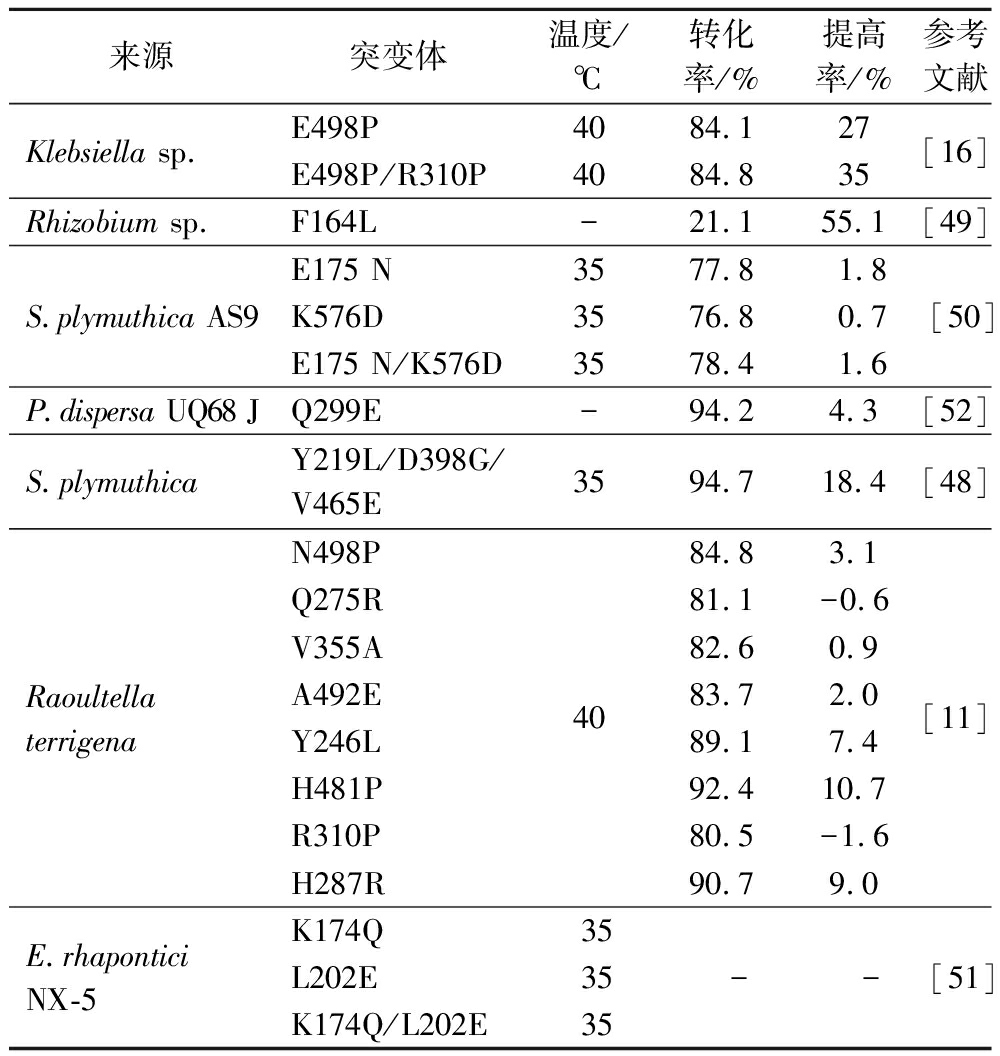
来源突变体温度/℃转化率/%提高率/%参考文献Klebsiella sp.E498P4084.127E498P/R310P4084.835[16]Rhizobium sp.F164L-21.155.1[49]S.plymuthica AS9E175 N3577.81.8K576D3576.80.7E175 N/K576D3578.41.6[50]P.dispersa UQ68 JQ299E-94.24.3[52]S.plymuthicaY219L/D398G/V465E3594.718.4[48]Raoultella terrigenaN498PQ275RV355AA492EY246LH481PR310PH287R4084.83.181.1-0.682.60.983.72.089.17.492.410.780.5-1.690.79.0[11]E.rhaponticiNX-5K174Q35L202E35K174Q/L202E35--[51]
5 酶的化学修饰
通过上述分子改造,酶的热稳定性和催化活性获得不同程度的提高。然而,基于基因工程的酶分子改造策略仅能使关键氨基酸位点产生20种主要的氨基酸更替,修饰程度有限。酶的化学修饰是指通过引入或者去除一些化学基团使得酶结构发生改变,进而改变其催化特性。目前,关于蛋白质化学修饰的位点选择大致可以分为两类,一类是天然的氨基酸侧链,如赖氨酸、半胱氨酸、丝氨酸及酪氨酸等天然氨基酸,另一类是通过基因编辑手段在目的蛋白中引入一些非天然的基团,如叠氮、炔基、四嗪等[53]。尽管研究人员对不同来源的蔗糖异构酶的酶学性质等开展了相关研究,但是关于蔗糖异构酶的化学修饰的研究却鲜见报道。酶蛋白分子中可被修饰的基团主要有氨基、羧基、巯基等,已被广泛应用于提高酶的稳定性、耐受性和催化活性。
5.1 氨基修饰
赖氨酸的侧链氨基是具有较高亲核反应活性的基团,可以直接与各种化学基团反应,如酸酐、聚乙二醇、共轭聚合物、糖基化、离子液体等。各种酸酐修饰的α-淀粉酶[54]、辣根过氧化物酶[55-56]、氯过氧化物酶[57]、木瓜蛋白酶[58]和α-胰凝乳蛋白酶[59]已被证实可以提高酶活力和热稳定性。酶的聚乙二醇化是最为典型的大分子共价结合修饰的酶化学修饰方法。据报道,研究人员利用活化后的mPEG5000对分离Bacillus velezensis的溶栓酶进行化学修饰,修饰酶活力是未修饰酶的7.3倍[60]。为了扩大蛋白质在实际工业生产中的应用,利用某些聚合物对蛋白质进行改造可以赋予蛋白质新的功能,通过偶联聚合物改善蛋白质性质的技术也成为蛋白质修饰领域的热点之一。将聚合物与蛋白质偶联主要有“grafting from”和“grafting to”两种方式。BAO等[61]通过铜介导的活性自由基聚合制备了漆酶-PEG和漆酶糖基聚合物偶联物,结果表明漆酶-PEG和漆酶糖基聚合物偶联物具有良好的分散稳定性和反应活性,糖基化漆酶也表现出相对较高的活性。KISLEY等[62]将超亲水性两性离子聚甲基丙烯酸磺酸基甜菜碱(pSB)通过“grafting from”的方法修饰到磷酸甘油酸激酶表面,可以发现偶联物的热稳定性随着pSB修饰度的上升而提高。ZHU等[63]通过“grafting to”的方法将疏水性聚合物聚苯乙烯偶联到α-糜蛋白酶和β-半乳糖苷酶两种水溶性酶上,接枝后的酶转化为界面结合酶,改善了酶在双相体系中的催化效率,其中接枝后的β-半乳糖苷酶的催化效率比接枝前高145倍。离子液体由于其理想的物理/化学性质、可操作性和热稳定性,被广泛应用于酶的催化领域[64]。采用咪唑、胆碱、脯氨酸等不同类型功能化离子液体对脂肪酶进行修饰改造,结果表明,离子液体作为改性剂可以同时提高酶的水解活性、稳定性和选择性等催化性能[65-69]。
5.2 羧基修饰
酶蛋白分子上的羧基修饰主要针对蛋白质中天冬氨酸、谷氨酸等氨基酸残基的羧基侧链进行修饰。羧基能够与水溶性碳化二亚胺类及醇类发生反应,生成酯类或酰胺类化合物[70]。常用的修饰试剂有1-乙基-3-(3-(二甲基氨基)丙基)碳二亚胺(n-(3-dimethylaminopropyl)-n′-ethylcarbodiimide hydrochloride,EDAC)[71]、乙二胺(ethylenediamine,EDA)[72]、四亚乙基戊二胺[73]、聚合物(多聚赖氨酸,丙烯酰胺类聚合物)[74-75]等。KRISHNAMURTHY等[71]采用EDAC对来源于Serratia marcescens subsp.sakuensis的纤溶酶的羧基基团进行修饰,与未修饰的酶相比,酶活性提高了219倍,Km降低了507倍。通过EDAC偶联法形成的酶酰胺键网络可提供与底物特异性相互作用的结构域,这可能是纤溶酶酶活性提高的原因。BHATTI等[76]用EDA对来自Fusarium solani的葡萄糖淀粉酶末端羧基进行修饰,改造后的酶表现出更好的热稳定性和催化活力。TONG等[74]通过EDAC/多聚赖氨酸偶联修饰暴露在肌氨酸氧化酶表面的羧基,修饰后的酶降低了Km值,在pH 5.0~10.0,改性酶保持了90%的初始活性,贮存稳定性也得到了提高。因此,多聚赖氨酸对酶表面的保护稳定了酶的三维结构。这种创新性的修饰大大提高了肌氨酸氧化酶的稳定性,可作为具有类似性质的其他酶的模型。
5.3 巯基修饰
酶蛋白分子中巯基的含量较低,但具有很强的亲核性,在含半胱氨酸的酶分子中是最容易反应的侧链基团。巯基修饰手段主要包括两类:一是与不饱和羰基化合物共轭形成稳定的硫醚键;二是与活化固体表面中二硫键发生交换反应。目前最常用的巯基修饰剂为不饱和羰基类化合物、硫醇类化合物、定制聚合物、定制多肽等。DARBY等[77]利用N-(喹啉-2-基)丙烯酰胺对糖苷水解酶进行修饰,与未修饰酶相比酶活提高了35倍。目前,关于巯基修饰应用于脂肪酶研究较多,如GODOY等[78]利用定制聚合物对来源于Geobacillus thermocatenulatus的脂肪酶进行了修饰,提高对各种非天然底物的催化活性。ROMERO等[79]利用定制钛对脂肪酶进行位点特异性标记,与未修饰酶相比,合成的肽脂肪酶生物催化剂具有高度的稳定性、活性、特异性和对不同底物的选择性。
6 展望
异麦芽酮糖作为一种安全理想的蔗糖替代品,市场需求迅速增长。蔗糖异构酶酶制剂催化蔗糖生产异麦芽酮糖已取得重大进展。本文详细综述了近几年产蔗糖异构酶菌株的诱变育种、异源表达及优化策略、酶分子改造的3类设计等方面所取得的进展,然而,在催化过程中仍存在一些问题,如热稳定性差、催化效率低、转化率低以及与食品安全有关的问题。为解决上述问题,首先可以从自然界中筛选性状优良的野生菌株,结合新型高效的诱变育种方法和契合异源表达宿主菌的优化策略,从而完成产蔗糖异构酶菌株的选育。其次,仍需进一步研究单位点及多位点突变引起的相互作用力变化和蔗糖异构酶结构的改变情况,以及这些变化对酶学性质的影响,从而更全面地分析蔗糖异构酶结构与功能之间的关系,提高酶工业化运用范围。最后,部分蔗糖异构酶的热稳定性差,除了利用蛋白质工程,基于化学修饰的策略也可被应用于提高蔗糖异构酶的活力及热稳定性。
[1] SCHIWECK H, MUNIR M, RAPP K M, et al.New developments in the use of sucrose as an industrial bulk chemical[J].Sugar Industry, 1990, 115(7):555-565.
[2] LIU L N, BILAL M, LUO H Z, et al.Studies on biological production of isomaltulose using sucrose isomerase:Current status and future perspectives[J].Catalysis Letters, 2021, 151(7):1868-1881.
[3] ZHANG D H, LI N, LOK S M, et al.Isomaltulose Synthase (PalI) of Klebsiella sp.lx3 crystal structure and implication of mechanism[J].Journal of Biological Chemistry, 2003, 278(37):35428-35434.
[4] MATTES R, KLEIN K, SCHIWECK H, et al. DNA’s encoding sucrose isomerase and palatinase[P]. US19950374155,1998-07-28.
[5] LEE H C, KIM J H, KIM S Y, et al.Isomaltose production by modification of the fructose-binding site on the basis of the predicted structure of sucrose isomerase from “Protaminobacter rubrum”[J].Applied and Environmental Microbiology, 2008, 74(16):5183-5194.
[6] VÉRON SE T, PERLOT P.Mechanism of sucrose conversion by the sucrose isomerase of Serratia plymuthica ATCC 15928[J].Enzyme and Microbial Technology, 1999, 24(5-6):263-269.
SE T, PERLOT P.Mechanism of sucrose conversion by the sucrose isomerase of Serratia plymuthica ATCC 15928[J].Enzyme and Microbial Technology, 1999, 24(5-6):263-269.
[7] LI X, ZHAO C, AN Q, et al.Substrate induction of isomaltulose synthase in a newly isolated Klebsiella sp.LX3[J].Journal of Applied Microbiology, 2003, 95(3):521-527.
[8] WU L, BIRCH R G.Characterization of Pantoea dispersa UQ68 J:Producer of a highly efficient sucrose isomerase for isomaltulose biosynthesis[J].Journal of Applied Microbiology, 2004, 97(1):93-103.
[9] LEE G Y, JUNG J H, SEO D H, et al.Isomaltulose production via yeast surface display of sucrose isomerase from Enterobacter sp.FMB-1 on Saccharomyces cerevisiae[J].Bioresource Technology, 2011, 102(19):9179-9184.
[10] LI S, CAI H, QING Y J, et al.Cloning and characterization of a sucrose isomerase from Erwinia rhapontici NX-5 for isomaltulose hyperproduction[J].Applied Biochemistry and Biotechnology, 2011, 163(1):52-63.
[11] LIU L, YU S H, ZHAO W.A novel sucrose isomerase producing isomaltulose from Raoultella terrigena[J].Applied Sciences, 2021, 11(12):5521.
[12] NAGAI-MIYATA Y, TSUYUKI K I, SUGITANI T, et al.Isolation and characterization of a trehalulose-producing strain of Agrobacterium[J].Bioscience, Biotechnology, and Biochemistry, 1993, 57(12):2049-2053.
[13] RAVAUD S, ROBERT X, WATZLAWICK H, et al.Trehalulose synthase native and carbohydrate complexed structures provide insights into sucrose isomerization[J].Journal of Biological Chemistry, 2007, 282(38):28126-28136.
[14] SALVUCCI M E.Distinct sucrose isomerases catalyze trehalulose synthesis in whiteflies, Bemisia argentifolii, and Erwinia rhapontici[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2003, 135(2):385-395.
[15] WU L G, BIRCH R G.Characterization of the highly efficient sucrose isomerase from Pantoea dispersa UQ68 J and cloning of the sucrose isomerase gene[J].Applied and Environmental Microbiology, 2005, 71(3):1581-1590.
[16] ZHANG D H, LI X Z, ZHANG L H.Isomaltulose synthase from Klebsiella sp.strain LX3 gene cloning and characterization and engineering of thermostability[J].Applied and Environmental Microbiology, 2002, 68(6):2676-2682.
[17] LIU J T, WU J, CHEN S.Expression and production optimization of sucrose isomerase from Pantoea dispersa in Escherichia coli[J].Chinese Journal of Biotechnology, 2016, 32(8):1070-1080.
[18] CHA J, JUNG J H, PARK S E, et al.Molecular cloning and functional characterization of a sucrose isomerase (isomaltulose synthase) gene from Enterobacter sp.FMB-1[J].Journal of Applied Microbiology, 2009, 107(4):1119-1130.
[19] DUAN X G, CHENG S, AI Y X, et al.Enhancing the thermostability of Serratia plymuthica sucrose isomerase using B-factor-directed mutagenesis[J].PLoS One, 2016, 11(2):e0149208.
[20] NAGAI Y, SUGITANI T, TSUYUKI K.Characterization of alpha-glucosyltransferase from Pseudomonas mesoacidophila MX-45[J].Bioscience, Biotechnology, and Biochemistry, 1994, 58(10):1789-1793.
[21] KAWAGUTI H Y, CELESTINO É M, MORAES A L L, et al.Characterization of a glucosyltransferase from Erwinia sp.D12 and the conversion of sucrose into isomaltulose by immobilized cells[J].Biochemical Engineering Journal, 2010, 48(2):211-217.
[22] 卢汉浪, 许黎明, 吕军, 等.亚硝基胍诱变选育高转化率异麦芽酮糖菌株[J].中国食品添加剂, 2012, 23(6):102-106.LU H L, XU L M, LV J, et al.Screening of high isomaltulose-conversion rate Protaminobacter rubrum strain by NTG mutation[J].China Food Additives, 2012, 23(6):102-106.
[23] 张洪达. 高产异麦芽酮糖菌的诱变及性质研究[D].大连:大连工业大学, 2017.ZHANG H D.Mutagenesis and properties of isomaltulose-producing bacteria[D].Dalian:Dalian Polytechnic University, 2017.
[24] 彭丹丹, 刘亚楠, 汪佳人, 等.蔗糖异构酶产生菌的常压室温等离子体诱变育种及发酵条件优化[J].河南工业大学学报(自然科学版), 2022, 43(2):63-69;78.PENG D D, LIU Y N, WANG J R, et al.Atmospheric and room temperature plasma breeding and fermentation conditions optimization of sucrose isomerase producing strains[J].Journal of Henan University of Technology (Natural Science Edition), 2022, 43(2):63-69; 78.
[25] KIM Y, KOO B S, LEE H C, et al.Improved production of isomaltulose by a newly isolated mutant of Serratia sp.cells immobilized in calcium alginate[J].Canadian Journal of Microbiology, 2015, 61(3):193-199.
[26] 邓静, 吴华昌.不同诱变方法对米曲霉酶系的影响[J].中国酿造, 2005, 24(12):39-42.DENG J, WU H C.Effect of different mutation methods on enzyme system of Aspergillus oryzame[J].China Brewing, 2005, 24(12):39-42.
[27] KAWAGUTI H Y, HARUMI SATO H.Effect of concentration and substrate flow rate on isomaltulose production from sucrose by Erwinia sp.cells immobilized in calcium-alginate using packed bed reactor[J].Applied Biochemistry and Biotechnology, 2010, 162(1):89-102.
[28] RAVAUD S, ROBERT X, WATZLAWICK H, et al.Insights into sucrose isomerization from crystal structures of the Pseudomonas mesoacidophila MX-45 sucrose isomerase, MutB[J].Biocatalysis and Biotransformation, 2008, 26(1-2):111-119.
[29] 马志宇, 高向红, 庞焦, 等.融合卷曲螺旋结构域的蔗糖异构酶活性包涵体异源表达及其酶学性质[J].中国生物制品学杂志, 2023, 36(7):793-799.MA Z Y, GAO X H, PANG J, et al.Heterologous expression and enzymatic properties of active inclusion bodies of sucrose isomerase fused with coiled-coil domain[J].Chinese Journal of Biologicals, 2023, 36(7):793-799.
[30] PARK J Y, JUNG J H, SEO D H, et al.Microbial production of palatinose through extracellular expression of a sucrose isomerase from Enterobacter sp.FMB-1 in Lactococcus lactis MG1363[J].Bioresource Technology, 2010, 101(22):8828-8833.
[31] WU L T, WU S S, QIU J J, et al.Green synthesis of isomaltulose from cane molasses by Bacillus subtilis WB800-pHA01-PalI in a biologic membrane reactor[J].Food Chemistry, 2017, 229:761-768.
[32] ZHAN Y J, ZHU P, LIANG J F, et al.Economical production of isomaltulose from agricultural residues in a system with sucrose isomerase displayed on Bacillus subtilis spores[J].Bioprocess and Biosystems Engineering, 2020, 43(1):75-84.
[33] 程胜, 段绪果, 吴敬.重组蔗糖异构酶的制备及应用条件优化[J].食品与发酵工业, 2015, 41(5):41-47.CHENG S, DUAN X G, WU J.Studies on the preparation of sucrose isomerase and its application for the production of isomaltulose[J].Food and Fermentation Industries, 2015, 41(5):41-47.
[34] 刘军彤. Pantoea dispersa蔗糖异构酶的重组表达及应用研究[D].无锡:江南大学, 2016.LIU J T.Recombinant expression and application of Pantoea dispersa sucrose isomerase[D].Wuxi:Jiangnan University, 2016.
[35] ZHANG F, CHENG F, JIA D X, et al.Characterization of a recombinant sucrose isomerase and its application to enzymatic production of isomaltulose[J].Biotechnology Letters, 2021, 43(1):261-269.
[36] GUO D, LI M Y, JIANG M T, et al.Enhanced extracellular production and characterization of sucrose isomerase in Bacillus subtilis with optimized signal peptides[J].Foods, 2022, 11(16):2468.
[37] 宋蕾, 李宪臻, 郭小宇.蔗糖异构酶PalI在解脂耶氏酵母中的高水平表达及酶学性质表征[J].大连工业大学学报, 2022, 41(2):79-85.SONG L, LI X Z, GUO X Y.High expression and characterization of sucrose isomerase PalI in Yarrowia lipolytica[J].Journal of Dalian Polytechnic University, 2022, 41(2):79-85.
[38] BACH C X, THI KIM ANH D, THANH THUY N, et al.Cloning of sucrose isomerase encoding gene from Klebsiella singaporensis ISB-36 and its expression in Pichia pastoris[J].Vietnam Journal of Biotechnology, 2020, 17(4):749-756.
[39] LI L J, WANG H W, CHENG H R, et al.Isomaltulose production by yeast surface display of sucrose isomerase from Pantoea dispersa on Yarrowia lipolytica[J].Journal of Functional Foods, 2017, 32:208-217.
[40] ZHANG P, WANG Z P, SHENG J, et al. High and efficient isomaltulose production using an engineered Yarrowia lipolytica strain[J]. Bioresource Technology, 2018, 265: 577-580.
[41] 邹亮. Pantoea dispersa蔗糖异构酶在芽孢杆菌中的表达及发酵优化[D]. 无锡: 江南大学, 2019.ZOU, L. Expression and fermentation optimization of Pantoea dispersa sucrose isomerase in Bacillus subtilis[D]. Wuxi: Jiangnan University, 2019.
[42] TAI M, STEPHANOPOULOS G.Engineering the push and pull of lipid biosynthesis in oleaginous yeast Yarrowia lipolytica for biofuel production[J].Metabolic Engineering, 2013, 15:1-9.
[43] ZHANG P, WANG Z P, LIU S, et al.Overexpression of secreted sucrose isomerase in Yarrowia lipolytica and its application in isomaltulose production after immobilization[J].International Journal of Biological Macromolecules, 2019, 121:97-103.
[44] LI S, XU H, YU J G, et al.Enhancing isomaltulose production by recombinant Escherichia coli producing sucrose isomerase:Culture medium optimization containing agricultural wastes and cell immobilization[J].Bioprocess and Biosystems Engineering, 2013, 36(10):1395-1405.
[45] 宋蕾. 蔗糖异构酶的异源表达及其酶学性质表征[D].大连:大连工业大学, 2021.SONG L.Heterologous expression of sucrose isomerase and characterization of its enzymatic properties[D].Dalian:Dalian Polytechnic University, 2021.
[46] SARDI A-PE
A-PE A A J, MESA-RAMOS L, IGLESIAS-FIGUEROA B F, et al.Analyzing current trends and possible strategies to improve sucrose isomerases’ thermostability[J].International Journal of Molecular Sciences, 2023, 24(19):14513.
A A J, MESA-RAMOS L, IGLESIAS-FIGUEROA B F, et al.Analyzing current trends and possible strategies to improve sucrose isomerases’ thermostability[J].International Journal of Molecular Sciences, 2023, 24(19):14513.
[47] CHICA R A, DOUCET N, PELLETIER J N.Semi-rational approaches to engineering enzyme activity:Combining the benefits of directed evolution and rational design[J].Current Opinion in Biotechnology, 2005, 16(4):378-384.
[48] PILAK P, SCHIEFNER A, SEIBOTH J, et al.Engineering a highly active sucrose isomerase for enhanced product specificity by using a “battleship” strategy[J].ChemBioChem, 2020, 21(15):2161-2169.
[49] LIPSKI A, WATZLAWICK H, RAVAUD S, et al.Mutations inducing an active-site aperture in Rhizobium sp.sucrose isomerase confer hydrolytic activity[J].Acta Crystallographica Section D, 2013, 69(2):298-307.
[50] 程胜. Serratia plymuthica蔗糖异构酶的重组表达、热稳定性改造及应用研究[D]. 无锡: 江南大学, 2015.CHENG S. Expression, thermostability modification and application of sucrose isomerase from Serratia plymuthica[D]. Wuxi: Jiangnan University,2015.
[51] SARDI A-PE
A-PE A A J, BALLINAS-CASARRUBIAS L, SIQUEIROS-CEND
A A J, BALLINAS-CASARRUBIAS L, SIQUEIROS-CEND N T S, et al.Thermostability improvement of sucrose isomerase PalI NX-5:A comprehensive strategy[J].Biotechnology Letters, 2023, 45(7):885-904.
N T S, et al.Thermostability improvement of sucrose isomerase PalI NX-5:A comprehensive strategy[J].Biotechnology Letters, 2023, 45(7):885-904.
[52] LIU H J, XING X Y, LU F P, et al.Functional Modification of the Substrate-Binding Site for Isomaltulose Production Based on Predicted Structure of Sucrose Isomerase from Pantoea dispersa UQ68 J[M].Lecture Notes in Electrical Engineering.Singapore:Springer Singapore, 2017:59-68.
[53] XU L J, KUAN S L, WEIL T.Contemporary approaches for site-selective dual functionalization of proteins[J].Angewandte Chemie International Edition, 2021, 60(25):13757-13777.
[54] SHAW B F, SCHNEIDER G F, BILGIÇER B, et al.Lysine acetylation can generate highly charged enzymes with increased resistance toward irreversible inactivation[J].Protein Science, 2008, 17(8):1446-1455.
[55] O’BRIEN A M, SMITH A T,  ’F
’F G
G IN C.Effects of phthalic anhydride modification on horseradish peroxidase stability and activity[J].Biotechnology and Bioengineering, 2003, 81(2):233-240.
IN C.Effects of phthalic anhydride modification on horseradish peroxidase stability and activity[J].Biotechnology and Bioengineering, 2003, 81(2):233-240.
[56] NAVAPOUR L, MOGHARRAB N.Structural insights into the effects of charge-reversal substitutions at the surface of horseradish peroxidase[J].Molecular Biology Research Communications, 2016, 5(3):175-192.
[57] LIU J Z, WANG M.Improvement of activity and stability of chloroperoxidase by chemical modification[J].BMC Biotechnology, 2007, 7:23.
[58] 熊亚红, 吴巧儿, 苏健鸿.化学修饰木瓜蛋白酶的酶学性质研究[J].分子催化, 2010, 24(6):529-536.XIONG Y H, WU Q E, SU J H.Study on the enzymatic property of chemical modification papain[J].Journal of Molecular Catalysis, 2010, 24(6):529-536.
[59] MATSUMOTO M, NAKAGAWA T, UCHIDA Y, et al.Effect of modification of citraconic anhydrides on catalytic activity and thermostability of enzymes[J].Journal of Chemical Technology &Biotechnology, 2016, 91(1):59-64.
[60] LU M Y, GAO Z X, XING S Q, et al.Purification, characterization, and chemical modification of Bacillus velezensis SN-14 fibrinolytic enzyme[J].International Journal of Biological Macromolecules, 2021, 177:601-609.
[61] BAO C Y, ZHANG Q.Modulation of protein activity and assembled structure by polymer conjugation:PEGylation vs glycosylation[J].European Polymer Journal, 2019, 112:263-272.
[62] KISLEY L, MILLER K A, DAVIS C M, et al.Soluble zwitterionic poly (sulfobetaine) destabilizes proteins[J].Biomacromolecules, 2018, 19(9):3894-3901.
[63] ZHU G Y, WANG P.Polymer-enzyme conjugates can self-assemble at oil/water interfaces and effect interfacial biotransformations[J].Journal of the American Chemical Society, 2004, 126(36):11132-11133.
[64] WEING RTNER H, CABRELE C, HERRMANN C.How ionic liquids can help to stabilize native proteins[J].Physical Chemistry Chemical Physics, 2012, 14(2):415-426.
RTNER H, CABRELE C, HERRMANN C.How ionic liquids can help to stabilize native proteins[J].Physical Chemistry Chemical Physics, 2012, 14(2):415-426.
[65] JIA R, HU Y, LIU L, et al.Enhancing catalytic performance of porcine pancreatic lipase by covalent modification using functional ionic liquids[J].ACS Catalysis, 2013, 3(9):1976-1983.
[66] LI X J, ZHANG C, LI S, et al.Improving catalytic performance of Candida rugosa lipase by chemical modification with polyethylene glycol functional ionic liquids[J].Industrial &Engineering Chemistry Research, 2015, 54(33):8072-8079.
[67] XU C, SUO H B, XUE Y, et al.Experimental and theoretical evidence of enhanced catalytic performance of lipase B from Candida Antarctica acquired by the chemical modification with amino acid ionic liquids[J].Molecular Catalysis, 2021, 501:111355.
[68] XU C, YIN X H, ZHANG C, et al.Improving catalytic performance of burkholderiacepacia lipase by chemical modification with functional ionic liquids[J].Chemical Research in Chinese Universities, 2018, 34(2):279-284.
[69] 张晓光, 裴新华, 伍慧兰, 等.疏水性脯氨酸离子液体化学修饰提升猪胰脂肪酶催化性能[J].高校化学工程学报, 2023, 37(2):268-275.ZHANG X G, PEI X H, WU H L, et al.Improving catalytic performance of porcine pancreatic lipase by chemical modification using hydrophobic proline ionic liquid[J].Journal of Chemical Engineering of Chinese Universities, 2023, 37(2):268-275.
[70] SHANNON D A, WEERAPANA E.Covalent protein modification:The current landscape of residue-specific electrophiles[J].Current Opinion in Chemical Biology, 2015, 24:18-26.
[71] KRISHNAMURTHY A, MUNDRA S, BELUR P D.Improving the catalytic efficiency of fibrinolytic enzyme from Serratia marcescens subsp.sakuensis by chemical modification[J].Process Biochemistry, 2018, 72:79-85.
[72] GALVIS M, BARBOSA O, RUIZ M, et al.Chemical amination of lipase B from Candida Antarctica is an efficient solution for the preparation of crosslinked enzyme aggregates[J].Process Biochemistry, 2012, 47(12):2373-2378.
[73] CHOWDHURY R, STROMER B, POKHAREL B, et al.Control of enzyme-solid interactions via chemical modification[J].Langmuir, 2012, 28(32):11881-11889.
[74] TONG Y J, XIN Y, YANG H L, et al.Efficient improvement on stability of sarcosine oxidase via poly-lysine modification on enzyme surface[J].International Journal of Biological Macromolecules, 2014, 67:140-146.
[75] BROGAN A P S, SHARMA K P, PERRIMAN A W, et al.Enzyme activity in liquid lipase melts as a step towards solvent-free biology at 150 ℃[J].Nature Communications, 2014, 5:5058.
[76] BHATTI H N, RASHID M H, ASGHER M, et al.Chemical modification results in hyperactivation and thermostabilization of Fusarium solani glucoamylase[J].Canadian Journal of Microbiology, 2007, 53(2):177-185.
[77] DARBY J F, ATOBE M, FIRTH J D, et al.Increase of enzyme activity through specific covalent modification with fragments[J].Chemical Science, 2017, 8(11):7772-7779.
[78] GODOY C A, DE LAS RIVAS B, FILICE M, et al.Enhanced activity of an immobilized lipase promoted by site-directed chemical modification with polymers[J].Process Biochemistry, 2010, 45(4):534-541.
[79] ROMERO O, DE LAS RIVAS B, LOPEZ-TEJEDOR D, et al.Effect of site-specific peptide-tag labeling on the biocatalytic properties of thermoalkalophilic lipase from Geobacillus thermocatenulatus[J].ChemBioChem, 2018, 19(4):369-378.