颜色是红葡萄酒最直接被感知到的特征,也是最重要的感官评价指标之一[1]。红葡萄酒的颜色能体现其酿造工艺、浸渍强度和陈酿潜力[2-3]。贮藏时间较短的红葡萄酒中颜色的主要来源于游离花色苷,游离态的花色苷颜色鲜艳但结构稳定性差,易受到外界环境因素的影响而发生氧化、降解或转化等,致使红葡萄酒中游离态的花色苷含量逐渐减少,在红葡萄酒陈酿过程中形成的聚合色素含量低导致颜色逐渐消退,色泽品质下降[4]。
研究人员探索了许多方法来稳定红葡萄酒的颜色,例如调节pH和贮藏温度,以及添加辅色素(辅色素分为多酚类辅色素和非多酚类辅色素)[5]。这些手段对不同时期的葡萄酒颜色均能起到积极的稳定作用,添加辅色素对葡萄酒辅色作用效果显著,已成为本领域研究热点。然而,最近的研究表明,使用这些技术可能会对红葡萄酒的感官特性产生有害影响。例如,过度脱酸会削弱葡萄酒的骨架,可能导致离子含量升高,进而引起葡萄酒质量下降[6]。目前研究发现,添加非酚类物质(糖类、有机酸类、金属离子类、氨基酸类等)不会对葡萄酒感官品质带来负面影响[7]。
非酚类辅色素相对酚类辅色素的研究结果较少,而在这些结果中,多糖类研究较为多样和深入[8]。多糖是一种天然、无甜味、无致癌、无毒的化合物,在葡萄酒中添加多糖可以有效地稳定葡萄酒的颜色,同时对红葡萄酒的口感具有积极作用,是最有潜力的辅色因子。
本文从红葡萄酒中多糖的种类、多糖对红葡萄酒颜色的影响以及多糖与花色苷相互作用等方面,系统阐述了近年来国内外学者对多糖影响红葡萄酒颜色的研究进展,以期为利用多糖稳定葡萄酒颜色的研究和相关工艺开发提供参考。
1 葡萄酒中的多糖
多糖是存在于葡萄酒中的一大类复杂大分子,其种类多样且具有复杂的结构。在葡萄酒中含量最多的是由阿拉伯糖和半乳糖 (polysaccharides rich in arabinose and galactose,PRAG)、鼠李半乳糖醛酸聚糖(rhamnogalacturonan,RG)(I型鼠李半乳糖醛酸聚糖(rhamnogalacturonan I,RG I)和II型鼠李半乳糖醛酸聚糖(rhamnogalacturonan II,RG II))等组成的果胶多糖和甘露糖蛋白(mannoprotein, MP),约占葡萄酒中总多糖的40%、23%(4%和19%)和35%。它们分别来源于葡萄细胞壁和酵母细胞壁,除此之外还有少量的多糖来源于细菌和葡萄酒辅料(图1)[9-10]。

图1 葡萄酒中多糖的来源
Fig.1 Sources of polysaccharides in wine
起初研究者们发现,添加外源多糖可以使葡萄酒的口感更柔顺[11],随着研究的深入发现多糖还可以稳定红葡萄酒的颜色,对于陈酿型红葡萄酒品质的影响具有重要意义[8]。研究人员通过提取果胶多糖和酵母多糖与葡萄酒中花色苷在模拟酒中的结合研究,证明多糖对花色苷具有积极的影响。此外,葡萄酒中的多糖对葡萄酒的香气、起泡性、口感等感官品质和稳定性均起到重要作用[12]。因此,多糖被广泛应用于调节葡萄酒的感官品质[13]。
1.1 果胶多糖对红葡萄酒颜色的影响
果胶是植物细胞壁的主要成分之一,在细胞壁早期生长过程中不断积累,主要存在于细胞壁的中间层、初生和次生细胞壁中[14]。在葡萄酒中,大部分多糖主要来源于葡萄果实的细胞壁。在之前的研究中,花色苷已被证明可以与植物细胞壁中的多糖相结合,其中与果胶多糖的结合更高。如,添加可溶性果胶多糖可以提高葡萄酒总色素含量[15]。花色苷与果胶多糖相互作用后,花色苷的颜色、可提取性和化学稳定性均得到显著改善[16]。一些学者研究发现,花色苷和果胶多糖的结合是由于类辅色作用导致红色增强,增加了花青素的稳定性[17]。研究人员分别在酒精发酵结束时和在瓶中6个月后加入可溶性果胶多糖,通过检测色度参数得出,在不同时期添加可溶性果胶多糖后葡萄酒的颜色强度均有明显提高,且葡萄酒中的总花色苷含量显着增加[18]。许多学者发现葡萄酒中的多糖与多酚间的相互作用可以防止花色苷和衍生色素沉淀,对稳定红葡萄酒的颜色具有积极影响[19]。在同时含有果胶多糖与酵母多糖的情况下,发现果胶多糖与花色苷的结合高于酵母多糖,这可能与葡萄酒中果胶多糖含量丰富有关[20]。
WEILACK等[17]在研究中发现,葡萄细胞壁碎片可以促进花色苷自缔合从而增强花色苷光谱吸光度,产生辅色效应。低分子质量和低酯化度的果胶(RG II和多聚半乳糖醛酸)通过与花色苷结合形成可溶性复合物,减少了6%~13%单宁的蛋白沉淀。另一方面,果胶及其组分可以阻止花色苷-金属螯合物的沉淀,从而增加花色苷的颜色强度和稳定性[21]。FERNANDES等[22]从葡萄皮中提取了果胶多糖,与葡萄酒中提取出的花色苷在模拟酒溶液下进行反应,发现果胶多糖可以促进花色苷的颜色稳定。结果表明,果胶多糖在弱酸性条件下能够有效地保护花色苷的颜色。之后研究人员从葡萄皮中分别提取的两种多糖(可溶性多糖和不溶性多糖)添加到葡萄酒中,通过检测葡萄酒的花色苷含量,发现添加可溶性多糖的葡萄酒中总色素含量高于对照葡萄酒,这表明可溶性多糖对花色苷有一定的保护作用[15]。在从葡萄皮中提取果胶多糖与锦葵素-3-O-葡萄糖苷在不同温度下相互作用,结果表明,果胶多糖与花色苷相结合后可以有效地防止花色苷因温度而降解,从而对花色苷的颜色起到保护作用,这进一步说明了果胶多糖可以改善花色苷的热稳定性和颜色特征[23]。此外,果胶多糖与花色苷紧密结合,并增强其颜色起到了共色素化合物的作用,从而稳定了葡萄酒的颜色[24]。
1.2 酵母多糖对红葡萄酒颜色的影响
从酵母中提取的多糖包括甘露聚糖、葡聚糖和MP,它们来源于酵母细胞壁,占细胞壁干重的90%[10]。在酵母多糖对葡萄酒颜色稳定性的研究中,甘露聚糖和葡聚糖研究结果较少,但是结果表明二者的添加都能促进葡萄酒颜色稳定性,在发酵结束和瓶储后增加了酚类物质含量[18]。
MP是葡萄酒中含量第二丰富的多糖,并且具有改善肠道环境、提高免疫力、降血糖、降血脂等生物活性[25-28],是一种高附加值的葡萄酒辅料,在葡萄酒生产中应用较广,同时也对其辅色作用进行了大量研究。OY N-ARDOIZ等通过提取不同酵母中富含MP的提取物添加到葡萄酒中,与未添加的葡萄酒相比,促进了色素聚合物的形成,使葡萄酒颜色在陈酿过程中有较好的稳定性。此外,研究发现添加MP的葡萄酒在一定程度上可以避免在葡萄酒酿造过程的不同阶段使用SO2而导致的颜色损失,更好地提高葡萄酒的抗氧化能力和色泽稳定性[29]。
N-ARDOIZ等通过提取不同酵母中富含MP的提取物添加到葡萄酒中,与未添加的葡萄酒相比,促进了色素聚合物的形成,使葡萄酒颜色在陈酿过程中有较好的稳定性。此外,研究发现添加MP的葡萄酒在一定程度上可以避免在葡萄酒酿造过程的不同阶段使用SO2而导致的颜色损失,更好地提高葡萄酒的抗氧化能力和色泽稳定性[29]。
在酒精发酵过程中和结束后添加MP对葡萄酒颜色的影响具有差异性,在酒精发酵中添加具有更好的颜色稳定性作用[30]。研究人员在葡萄酒酿造过程中于酒精发酵前和酒精发酵结束后分别添加MP,发现在酒精发酵前添加MP,其与葡萄酒中的单体花色苷迅速反应、聚集,形成了平衡的聚合胶体,显著提高了花色苷和酚酸的含量[31],使葡萄酒的颜色更加稳固、酒体协调度增加。ALCALDE-EON等[29]也提出在葡萄酒发酵过程中添加MP对花色苷衍生物色素具有稳定作用,可能是由于多糖的胶体稳定性,防止了色素的降解和沉淀。RINALDI等[32]在研究中发现,发酵中添加MP的葡萄酒,其在陈酿期间可以促进色素聚合体的形成,使葡萄酒颜色保持稳定。在葡萄酒苹乳发酵后添加MP,试验期间葡萄酒的颜色参数随时间的变化相似,表明添加的多糖对所研究的葡萄酒的颜色稳定没有影响[33]。
尽管MP的护色作用在许多研究中都有报道,然而,有研究发现MP产品的应用破坏了葡萄酒的颜色品质。有研究表明,在酒精发酵前添加MP不仅对葡萄酒色泽没有积极作用还会对葡萄酒的口感产生负面影响[34]。RODRIGUES等在研究MP对葡萄酒颜色和单宁稳定性的影响时,在葡萄酒乳酸发酵后添加了 MP,并观察到葡萄酒的颜色参数在实验期间保持一致。这表明添加的多糖对所研究葡萄酒的颜色稳定性没有影响,添加MP对葡萄酒中单体花色苷的颜色以及单体酚的含量没有影响[35]。故而,酵母多糖对葡萄酒颜色的积极作用仍存在争议[35]。一些观点认为,可能是由于MP的高分子质量特性导致了花色苷化合物的减少。高分子质量的MP含有过多的结合位点,可以与葡萄酒中的多酚类物质发生相互作用形成沉淀,降低了花色苷和非花色苷酚类化合物的含量,从而导致葡萄天然花色苷的减少,影响葡萄酒的色度品质或颜色稳定性[36]。
1.3 葡萄酒中的其他多糖对葡萄酒颜色的影响
在葡萄酒中除上述的主要多糖外,还存在来自灰霉菌和细菌少量的多糖[37]。灰霉菌通过侵染葡萄浆果,分泌出少量的β-葡聚糖。而细菌中的乳酸菌在进行苹果酸-乳酸发酵时,能分泌出少量的胞外多糖[19]。这类多糖因其在葡萄酒中含量极低,对葡萄酒的颜色没有显著影响,因此研究较少。此外,葡萄酒中含有的来自于国际葡萄少量外源性多糖与葡萄酒组织允许添加到葡萄酒中的添加剂(如:羧甲基纤维素、阿拉伯胶等)[38]。外源多糖主要用于稳定葡萄酒酒体,对葡萄酒的颜色无显著影响。羧甲基纤维素(carboxymethyl cellulose,CMC)是一种有效的红葡萄酒稳定剂。研究表明,在红葡萄酒中添加CMC不会明显影响葡萄酒中的酚类物质、总色素、单体和聚合花青素含量[39]。而阿拉伯树胶在葡萄酒生产过程中,也被广泛用于保护胶体物质、防止着色物质在红葡萄酒中沉淀,并提高葡萄酒的泡沫稳定性。研究表明,在酿酒过程中添加阿拉伯树胶对葡萄酒的酚类物质含量有显著影响,不仅能提高酚类物质的含量还能在陈酿过程中保持葡萄酒的颜色特征[40]。这是因为阿拉伯树胶的大分子可以通过氢键和疏水作用与多酚或蛋白质相互作用[41],阻止多酚和蛋白质在葡萄酒中沉淀,从而稳定葡萄酒的酒体和颜色。
2 多糖对葡萄酒颜色影响的作用机理
在葡萄酒中颜色是判断其品质的重要指标,游离花色苷则是贮藏较短的红葡萄酒中颜色的主要来源[42]。葡萄酒中花色苷的种类和含量各不相同,它们在一定程度上决定了葡萄酒的颜色和陈酿潜能[43]。在贮藏较短的红葡萄酒中常见的6种单体游离花青素中,锦葵色素-3-O-葡萄糖苷及其衍生物是贮藏较短葡萄酒中含量最丰富的游离花色苷,也是葡萄酒中红色的主要来源,而天竺葵色素-3-O-葡萄糖苷的含量低且难以检测[44]。在葡萄酒中的花色苷因其不稳定性而发生许多化学反应,例如,酒中的花色苷会与其他的花色苷相互作用,称为自缔合,或者与其他酚类化合物发生分子内或分子间共色素沉着,它们之间相互作用,形成分子复合物,从而稳定黄酮类化合物[45],这些反应使花色苷的化学结构更加稳定,不会因降解而导致褪色,在一定程度上维持了葡萄酒的颜色的稳定[13],这是葡萄酒中颜色变化中一个最重要的因素。
研究发现,花色苷与多糖大分子之间的相互作用(图2-a)[46]在很大的程度上决定了食品在加工和贮藏过程中花色苷的稳定性。多糖对花色苷的保护作用与多糖的构象有关,因为多糖的种类、离子强度和pH会影响花色苷的结合[47]。多糖与葡萄酒中的花色苷主要通过非共价键和氢键的方式相结合,形成垂直或水平层叠的复合物(图2-b)[8],从而提高了葡萄酒中花色苷的稳定性。
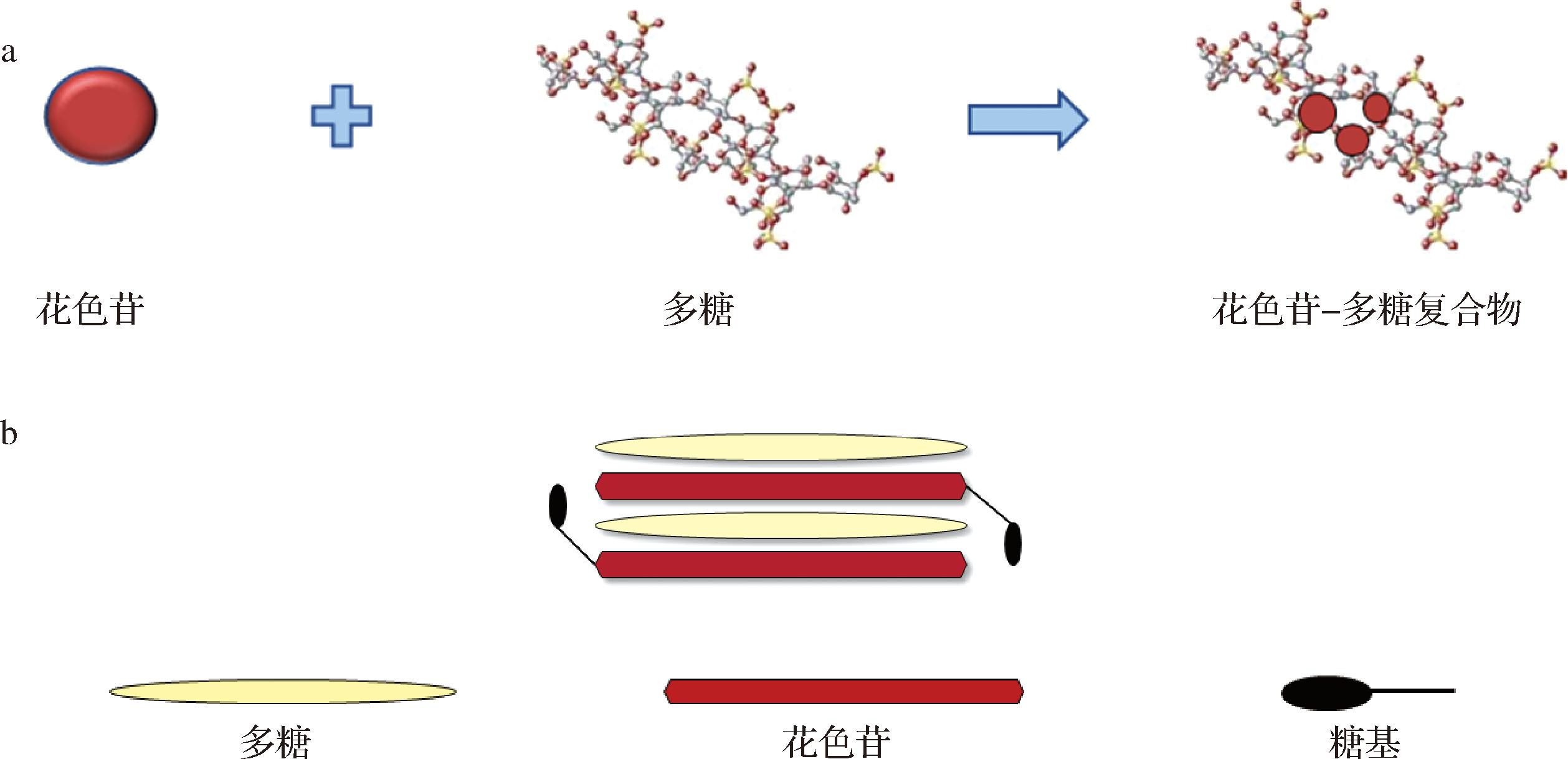
a-多糖与花色苷之间的相互作用;b-葡萄酒辅色化反应类型
图2 多糖与花色苷相互作用
Fig.2 Polysaccharide and anthocyanin interactions
2.1 果胶多糖与葡萄酒中花色苷的相互作用
近年来,国内外对果胶多糖与花色苷的相互作用以及对复合物稳定性的影响及其作用机制进行了广泛的研究。研究表明,葡萄果胶多糖可以改善花色苷热稳定性和颜色特征,果胶多糖-花色苷结合后其颜色稳定性比单体花色苷更高[48]。这是由于花色苷与果胶之间存在疏水相互作用,果胶的聚半乳糖醛酸中的羧基和花色苷的羟基之间的氢键作用,以及果胶分子上带负电的羧酸基团与花色苷的黄盐阳离子之间的静电相互作用。果胶与花色苷之间相互作用均能对花色苷起到有效的保护作用[13]。
果胶对花色苷的亲和力及其对吸光度的影响取决于它们的结构和组成,pH也会影响到果胶多糖与花色苷的结合,特别是葡萄酒pH,不仅影响花色苷还会影响果胶多糖的构象[45]。有研究表明,在模拟胃肠消化的实验过程中,水溶性果胶仅保护矢车菊素- 3 -葡萄糖苷不被降解。因此,可以通过有选择性地提取果胶,根据果胶的结构与花色苷相结合,可以优化花色苷的相互作用和功能[49]。根据果胶多糖的分子结构不同[低酯化酰胺化(low esterified amidated,AM)、低甲氧基化(low methoxylated,LM)和高甲氧基化(high methoxylated,HM)]对花色苷稳定性影响也不同,研究发现,AM、LM、HM这3种果胶均能提高花色苷的稳定性,其中AM果胶的稳定性最好,其次是LM和HM果胶[50]。不同类型果胶中的羧基与花色苷之间存在分子间相互作用,从而提高了花色苷的稳定性。KOPJAR等[51]的研究也证明了不同酯化程度和浓度的果胶多糖对花色苷稳定性的影响。果胶多糖的甲基酯化度不同,果胶多糖与花色苷相互的机制也不同。甲酯化反应的程度越低,果胶多糖与花色苷的结合亲和力更高,说明花色苷优先与低酯化果胶结合,其次是高酯化果胶。研究人员在不同温度下对花青素与果胶多糖复合物的热稳定性进行评价,通过HPLC-DAD检测花青素的降解情况。结果表明,果胶多糖与花色苷通过静电作用和疏水作用相结合,提高了花色苷的热稳定性[23],防止了花色苷因温度而降解,从而稳定了花色苷的颜色。
通过碱溶液提取的果胶多糖中含有同型半乳糖醛酸结构域和少量中性糖侧链,主要通过疏水作用与花色苷相结合。在pH 3.5的条件下,能够有效改善花色苷黄酮阳离子的稳定性,并提高整体表观平衡常数和水合常数,从而可以在弱酸性条件下提供有效的颜色保护[22]。在pH 4.0时,果胶与花色苷的结合量会随着花色苷上羟基数目的增加而增加,这表明果胶和花色苷之间的氢键作用有助于果胶与花色苷的结合[52]。多糖由于在相同条件下比小分子糖具有更高的热稳定性,对花色苷表现出更强的保护作用,尤其是在高温条件下。
2.2 酵母多糖与葡萄酒中花色苷的相互作用
酵母多糖与花色苷相互作用机制与果胶多糖类似,酵母多糖与花色苷复合物也是通过静电相互作用和疏水相互作用来保护花色苷不被降解。近年来,酵母多糖被广泛的应用到葡萄酒酿造过程中以改善葡萄酒的色泽与口感。
不同类型的酵母多糖对葡萄酒的颜色的影响具有显著差异,这可能与酵母的来源、多糖的组成或结构的不同有关[53]。不同类型的酵母多糖添加量对红葡萄酒颜色的影响也各不相同,研究人员发现葡萄酒中总花色苷的浓度随着酵母多糖添加量的增加呈上升趋势,在某一最适添加量浓度达到峰值,这可能是由于酵母多糖与葡萄酒中的单体花色苷相结合形成聚合色素,从而减少了花色苷的聚集沉淀[54],使葡萄酒的颜色的稳定性增强。
有研究表明,添加酵母多糖可有效地稳定葡萄酒颜色的胶体,酿酒酵母通过释放大量的多糖与葡萄酒中易发生氧化反应的酚类物质相互作用,从而阻止或降低了酚类物质的氧化程度,对葡萄酒的颜色有积极的影响[55]。此外,酵母多糖的添加还可能会使得葡萄酒中花色苷的化学稳定性更高,更有利于花色苷转化为衍生色素[53]。酵母多糖不仅可以作为辅色素与花色苷相互作用,还可以保护其他辅色素不被沉淀,从而提高辅色素与花色苷的结合率,稳定葡萄酒的色泽。例如,黄烷醇一般作为辅色素与花色苷相结合,可以保护花色苷不被水解从而稳定了葡萄酒的颜色[44],有学者认为黄烷醇在葡萄酒中易被沉淀,酵母多糖则可以通过空间位阻来保护黄烷醇不被沉淀,并稳定与花色苷的相互作用[32]。OY N等[53]模拟了红葡萄酒的氧化条件,探索了加速老化条件下葡萄酒的颜色演变,发现MP的存在有利于稳定的花色苷衍生物如葡萄素和黄烷醇-乙基-花色苷复合物的形成,从而稳定了葡萄酒的颜色。
N等[53]模拟了红葡萄酒的氧化条件,探索了加速老化条件下葡萄酒的颜色演变,发现MP的存在有利于稳定的花色苷衍生物如葡萄素和黄烷醇-乙基-花色苷复合物的形成,从而稳定了葡萄酒的颜色。
2.3 多糖与葡萄酒颜色相互作用测定方法
为了确定多糖对葡萄酒颜色的影响,许多研究通过在模型酒中添加多糖来研究多糖与花色苷的相互作用及添加多糖后花色苷的稳定性。氢键和疏水相互作用是多糖与花色苷结合的主要驱动力,有大量研究方法被用来分析花色苷-多糖相互作用稳定性。表1总结了当前应用于多糖与花色苷相互作用的研究方法的原理及其优缺点。其中,多光谱和分子计算模拟是研究多糖与花色苷相互作用机理的主要工具。
表1 多糖与葡萄酒颜色相互作用测定方法
Table 1 Determination of polysaccharide-wine colour interactions

研究方法原理及介绍优缺点参考文献紫外-可见吸收光谱(uv absorption spectroscopy,UV-VIS)UV-VIS通过分子对光谱紫外可见区辐射的吸收来分析。这种吸收光谱是由于分子中的某些基团吸收紫外可见辐射光时发生电子能级跃迁而产生的。UV-VIS是研究多糖与花色苷相互作用最常用的方法之一。用UV-VIS分析添加多糖时花色苷颜色的变化,通过分析花色苷的吸光度和波长,观测出其是否出现增色效应或红移效应。出现的红移效应和增色效应一般与多糖和花色苷的相互作用有关优点:灵敏度高、选择性好、准确度高、应用范围广、使用浓度范围宽、分析成本低、操作简便、分析速度快缺点:只能证明分子之间相互作用,无法阐明相互作用机制[22, 46, 56]傅里叶变换红外光谱(Fourier transform infrared spec-troscopy,FTIR)红外光谱是通过测量干涉图并对干涉图进行傅里叶变换来确定的。傅里叶变换是红外光谱的强度h(δ) 和形成该光的两束相干光之间的光程差δ的函数。通过伸缩振动谱带的位置(如O—H组的拉伸振动峰值的移动)和强度来分析多糖与花色苷之间的相互作用。FTIR光谱可以表明多糖与花色苷之间是否通过氢键或疏水相互作用作为主要驱动力优点:检测灵敏度高、测量精度高、分辨率高、测量速度快、散光小和带宽宽缺点:可以阐明分子的存在,但无法阐明相互作用的机制[46, 56-59]核磁共振谱图(nuclear magnetic resonance,NMR)主要是由原子核的自旋运动引起的,不同的原子核,自旋运动的情况不同。通过核磁共振谱图可以分析出花色苷黄盐阳离子质子化学位移变化和多糖-花色苷复合物的解离常数。区分溶液中存在的各种花色苷平衡形式的结合相互作用。这些形式包括黄素阳离子和半金属平衡形式优点:具有高速、高精度和高分辨率等优点,被广泛应用于有机结构鉴定领域缺点:对样品的纯度要求较高,数据采集时间长,检测灵敏度较低[46, 56]显微镜扫描电子显微镜(scanning electron microscopy,SEM)SEM的电子枪发出的电子束经过聚焦后汇聚到一个点光源。在加速电压的作用下,电子束被加速,形成高能电子束。然后,电子束通过偏转线圈以光栅模式在样品上扫描,激发出各种电子信号。这些信号由探测器收集,经电信号放大器放大后在显示系统上成像。二次电子的图像信号以动态方式形成三维图像。SEM主要通过观察到花色苷添加后多糖的微观结构优点:分辨率高、成像直观、立体感强、放大倍数范围广,不会损坏或污染原始样品,可同时获得形态、结构、成分和晶体学信息等缺点:人为因素易影响样品的制备,通常需要固体透射电子显微镜(transmission elec-tron microscopy,TEM)经过加速和聚合的电子束被投射到一个非常薄的样品上,电子与样品中的原子碰撞后改变方向,产生了立体角散射。散射角的大小与样品的密度和厚度有关,因此可以形成不同的明暗图像。通过TEM观察到花色苷添加后多糖的微观结构优点:放大倍率高、景深大、视场大、立体成像和标本制备简单缺点:分辨率受制于样品制备技术,只能观察非常薄的样本原子力显微镜(atomic force mi-croscopy,AFM)AFM主要通过微悬臂用于感应和放大悬臂上的尖刺探针与被测样品原子之间的作用力,从而实现原子级分辨率的样品检测,显示分子的微观结构和表面形貌。使用原子力显微镜可以观察到含有和不含等量多糖的花青素的形貌特征优点:空间分辨率高、测试对象范围广、样品制备方法简便和测试环境多样缺点:成像范围不够宽广,采集过程太慢,结果受探头的影响太大[46, 56, 58-59]
续表1
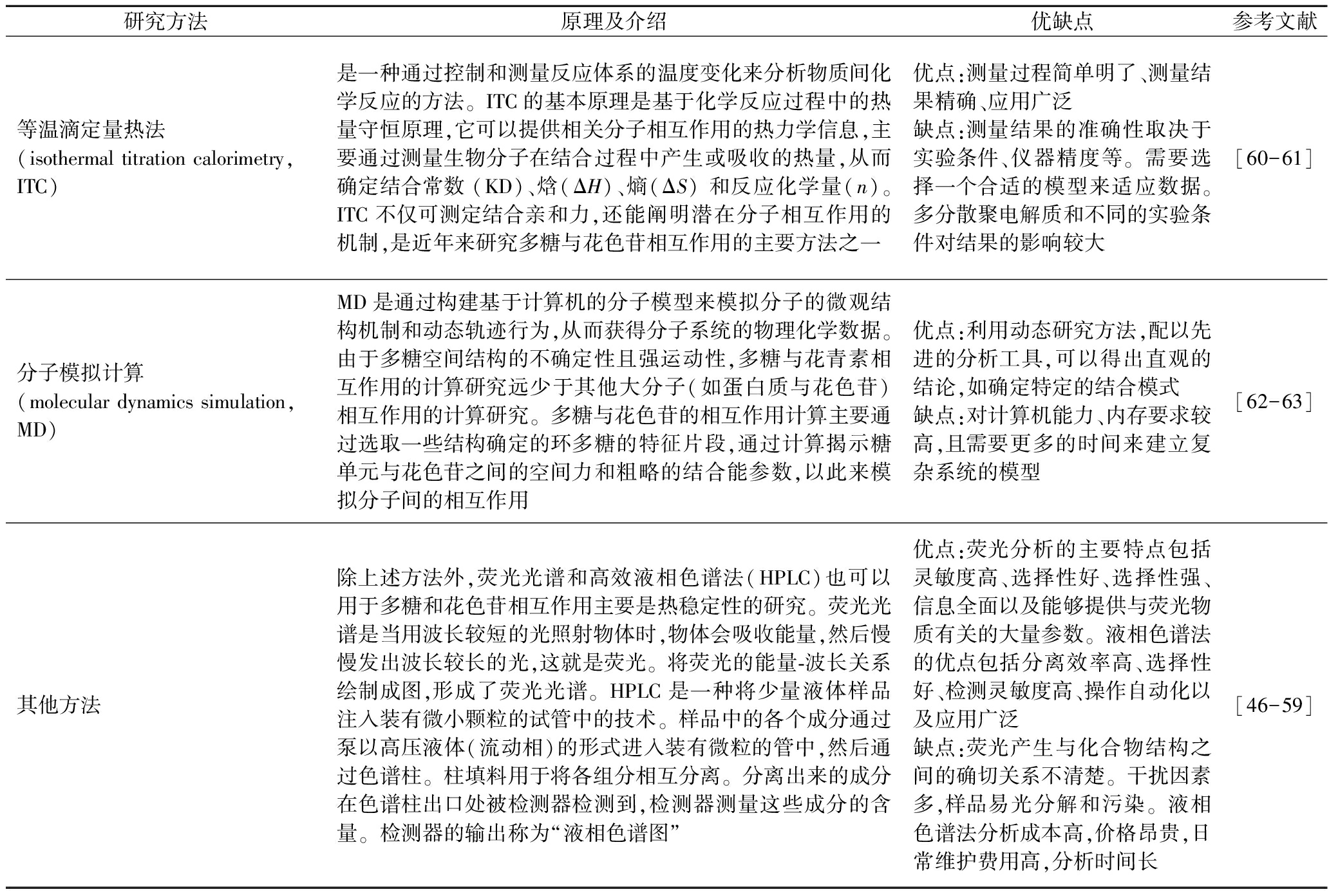
研究方法原理及介绍优缺点参考文献等温滴定量热法(isothermal titration calorimetry,ITC)是一种通过控制和测量反应体系的温度变化来分析物质间化学反应的方法。ITC的基本原理是基于化学反应过程中的热量守恒原理,它可以提供相关分子相互作用的热力学信息,主要通过测量生物分子在结合过程中产生或吸收的热量,从而确定结合常数 (KD)、焓(ΔH)、熵(ΔS) 和反应化学量(n)。ITC 不仅可测定结合亲和力,还能阐明潜在分子相互作用的机制,是近年来研究多糖与花色苷相互作用的主要方法之一优点:测量过程简单明了、测量结果精确、应用广泛缺点:测量结果的准确性取决于实验条件、仪器精度等。需要选择一个合适的模型来适应数据。多分散聚电解质和不同的实验条件对结果的影响较大[60-61]分子模拟计算(molecular dynamics simulation,MD)MD是通过构建基于计算机的分子模型来模拟分子的微观结构机制和动态轨迹行为,从而获得分子系统的物理化学数据。由于多糖空间结构的不确定性且强运动性,多糖与花青素相互作用的计算研究远少于其他大分子(如蛋白质与花色苷)相互作用的计算研究。多糖与花色苷的相互作用计算主要通过选取一些结构确定的环多糖的特征片段,通过计算揭示糖单元与花色苷之间的空间力和粗略的结合能参数,以此来模拟分子间的相互作用优点:利用动态研究方法,配以先进的分析工具,可以得出直观的结论,如确定特定的结合模式缺点:对计算机能力、内存要求较高,且需要更多的时间来建立复杂系统的模型[62-63]其他方法除上述方法外,荧光光谱和高效液相色谱法(HPLC)也可以用于多糖和花色苷相互作用主要是热稳定性的研究。荧光光谱是当用波长较短的光照射物体时,物体会吸收能量,然后慢慢发出波长较长的光,这就是荧光。将荧光的能量-波长关系绘制成图,形成了荧光光谱。HPLC是一种将少量液体样品注入装有微小颗粒的试管中的技术。样品中的各个成分通过泵以高压液体(流动相)的形式进入装有微粒的管中,然后通过色谱柱。柱填料用于将各组分相互分离。分离出来的成分在色谱柱出口处被检测器检测到,检测器测量这些成分的含量。检测器的输出称为“液相色谱图”优点:荧光分析的主要特点包括灵敏度高、选择性好、选择性强、信息全面以及能够提供与荧光物质有关的大量参数。液相色谱法的优点包括分离效率高、选择性好、检测灵敏度高、操作自动化以及应用广泛缺点:荧光产生与化合物结构之间的确切关系不清楚。干扰因素多,样品易光分解和污染。液相色谱法分析成本高,价格昂贵,日常维护费用高,分析时间长[46-59]
3 结论与展望
目前,多糖作为辅料添加已经在葡萄酒生产中得到了广泛的应用,其在葡萄酒品质中发挥的作用引起研究者的普遍关注和研究。在葡萄酒酿造过程中添加多糖能够对葡萄酒的品质起到积极的影响,例如稳定葡萄酒的颜色、提升葡萄酒的香气品质、改善葡萄酒的口感等。然而,多糖在葡萄酒酿造中对颜色的作用机制研究不够深入。目前,针对于多糖对葡萄酒颜色的作用机制的研究主要在模拟酒中进行,还未有在葡萄酒中进行研究分析。且多糖的来源、种类、结构和分子量均会影响与花色苷的结合。同时,过量使用多糖可能会导致葡萄酒酒体不稳定,影响葡萄酒的品质。基于以上,未来可以从以下几个方面展开研究:①多糖与花色苷大分子在葡萄酒中相互作用机理研究;②不同多糖对葡萄酒颜色稳定性的影响,多糖种类与结构对葡萄酒颜色产生的影响;③不同多糖在葡萄酒中最适添加浓度;④寻找不同葡萄酒最适的多糖种类,增加葡萄酒独特性。对此,需要对多糖在葡萄酒酿造中的作用机制及最适添加量进行深入研究,为多糖在葡萄酒酿造中的应用提供化学基础和理论知识,以供酿酒师更合理地使用多糖来稳定葡萄酒颜色并提升葡萄酒品质。
多糖不仅对葡萄酒的颜色具有影响,对果汁类饮料和果酒类的颜色也有影响。例如在饮料热加工和蓝莓酒酿造过程中稳定其颜色。未来可以将多糖对花色苷的稳定性的研究拓展至食品的各个领域中,为食品领域发展提供更多的支持。
[1] FANZONE M, GONZ LEZ-MANZANO S, PÉREZ-ALONSO J, et al. Evaluation of dihydroquercetin-3-O-glucoside from Malbec grapes as copigment of malvidin-3-O-glucoside[J]. Food Chemistry, 2015, 175:166-173.
LEZ-MANZANO S, PÉREZ-ALONSO J, et al. Evaluation of dihydroquercetin-3-O-glucoside from Malbec grapes as copigment of malvidin-3-O-glucoside[J]. Food Chemistry, 2015, 175:166-173.
[2] 黄小晶,李阿波,沈甜,等.贺兰山东麓红葡萄酒颜色差异分析[J].食品与发酵工业,2024,50(10):180-186.HUANG X J, LI A B, SHEN T, et al. Analysis of colour differences in red wines from the eastern foot of Helan Mountains [J]. Food and Fermentation Industry,2024,50(10):180-186.
[3] 马懿,喻康杰,赖晓琴,等.单宁添加对赤霞珠葡萄酒颜色和花色苷含量变化的影响及其相关性研究[J].食品工业科技,2024,45(5):81-88.MA Y,YU K J,LAI X Q,et al. Effects of tannin addition on changes in color and anthocyanin content of cabernet sauvignon wine and their correlation[J].Science and Technology of Food Industry,2024,45(5):81-88.
[4] ENARU B, DRE\U021BCANU G, POP T D, et al. Anthocyanins: Factors affecting their stability and degradation[J]. Antioxidants, 2021, 10(12):1967.
[5] LIU C Y, WU L L, FAN S Y, et al. The protective effect of cyclodextrin on the color quality and stability of Cabernet Sauvignon red wine[J]. Journal of Integrative Agriculture, 2024, 23(1):310-323.
[6] TIAN M B, HU R Q, LIU Z L, et al. The pH adjustment of Vitis amurensis dry red wine revealed the evolution of organic acids, volatomics, and sensory quality during winemaking[J]. Food Chemistry, 2024, 436:137730.
[7] 张扬, 彭晶晶, 李坤一, 等. 发酵前添加有机酸对西拉红葡萄酒颜色和感官质量的影响[J]. 食品与发酵工业, 2023, 49(7):90-98.ZHANG Y, PENG J J, LI K Y, et al. Effects of organic acid added before fermentation on color and sensory quality of Syrah red wine[J]. Food and Fermentation Industries, 2023, 49(7):90-98.
[8] 刘霞, 邢佳雨, 冯敬雯, 等. 红葡萄酒辅助呈色作用研究进展[J]. 中国酿造, 2023, 42(11):9-14.LIU X, XING J Y, FENG J W, et al. Research progress on copigmentation of red wine[J]. China Brewing, 2023, 42(11):9-14.
[9] VIDAL S, WILLIAMS P, DOCO T, et al. The polysaccharides of red wine: Total fractionation and characterization[J]. Carbohydrate Polymers, 2003, 54(4):439-447.
[10] JONES-MOORE H R, JELLEY R E, MARANGON M, et al. The polysaccharides of winemaking: From grape to wine[J]. Trends in Food Science &Technology, 2021, 111:731-740.
[11] JONES-MOORE H R, JELLEY R E, MARANGON M, et al. The interactions of wine polysaccharides with aroma compounds, tannins, and proteins, and their importance to winemaking[J]. Food Hydrocolloids, 2022, 123:107150.
[12] CANALEJO D, MART NEZ-LAPUENTE L, AYESTAR
NEZ-LAPUENTE L, AYESTAR N B, et al. Potential use of grape and wine polysaccharide extracts as fining agents to modulate the volatile composition of Viura wines[J]. Food Chemistry, 2024, 430:137047.
N B, et al. Potential use of grape and wine polysaccharide extracts as fining agents to modulate the volatile composition of Viura wines[J]. Food Chemistry, 2024, 430:137047.
[13] WANG J D, ZHAO Y Q, SUN B, et al. The structure of anthocyanins and the copigmentation by common micromolecular copigments: A review[J]. Food Research International, 2024, 176:113837.
[14] VORAGEN A G J, COENEN G J, VERHOEF R P, et al. Pectin, a versatile polysaccharide present in plant cell walls[J]. Structural Chemistry, 2009, 20(2):263-275.
[15] MANJ N E, LI S Y, DUE
N E, LI S Y, DUE AS M, et al. Effect of the addition of soluble polysaccharides from red and white grape skins on the polyphenolic composition and sensory properties of Tempranillo red wines[J]. Food Chemistry, 2023, 400:134110.
AS M, et al. Effect of the addition of soluble polysaccharides from red and white grape skins on the polyphenolic composition and sensory properties of Tempranillo red wines[J]. Food Chemistry, 2023, 400:134110.
[16] FERNANDES A, OLIVEIRA J, FONSECA F, et al. Molecular binding between anthocyanins and pectic polysaccharides-Unveiling the role of pectic polysaccharides structure[J]. Food Hydrocolloids, 2020, 102:105625.
[17] WEILACK I, MEHREN L, SCHIEBER A, et al. Grape-derived pectic polysaccharides alter the tannin and pigment composition of Cabernet Sauvignon red wines[J]. Current Research in Food Science, 2023, 6:100506.
[18] OSETE-ALCARAZ A, BAUTISTA-ORT N A B, G
N A B, G MEZ-PLAZA E. The role of soluble polysaccharides in tannin-cell wall interactions in model solutions and in wines[J]. Biomolecules, 2019, 10(1):36.
MEZ-PLAZA E. The role of soluble polysaccharides in tannin-cell wall interactions in model solutions and in wines[J]. Biomolecules, 2019, 10(1):36.
[19] 王升楠, 王晓宇, 赵鹏涛, 等. 葡萄酒多糖的演变及影响因素研究概述[J]. 食品与发酵工业, 2021, 47(1):309-316.WANG S N, WANG X Y, ZHAO P T, et al. Advances on the evolution of wine polysaccharides and its influencing factors[J]. Food and Fermentation Industries, 2021, 47(1):309-316.
[20] GONÇALVES F J, FERNANDES P A R, WESSEL D F, et al. Interaction of wine mannoproteins and Arabinogalactans with anthocyanins[J]. Food Chemistry, 2018, 243:1-10.
[21] GENÇDA E, ÖZDEMIR E E, DEMIRCI K, et al. Copigmentation and stabilization of anthocyanins using organic molecules and encapsulation techniques[J]. Current Plant Biology, 2022, 29:100238.
E, ÖZDEMIR E E, DEMIRCI K, et al. Copigmentation and stabilization of anthocyanins using organic molecules and encapsulation techniques[J]. Current Plant Biology, 2022, 29:100238.
[22] FERNANDES A, RAPOSO F, EVTUGUIN D V, et al. Grape pectic polysaccharides stabilization of anthocyanins red colour: Mechanistic insights[J]. Carbohydrate Polymers, 2021, 255:117432.
[23] FERNANDES A, BRAND O E, RAPOSO F, et al. Impact of grape pectic polysaccharides on anthocyanins thermostability[J]. Carbohydrate Polymers, 2020, 239:116240.
O E, RAPOSO F, et al. Impact of grape pectic polysaccharides on anthocyanins thermostability[J]. Carbohydrate Polymers, 2020, 239:116240.
[24] FERNANDES A, BR S N F, OLIVEIRA J, et al. Impact of a pectic polysaccharide on oenin copigmentation mechanism[J]. Food Chemistry, 2016, 209:17-26.
S N F, OLIVEIRA J, et al. Impact of a pectic polysaccharide on oenin copigmentation mechanism[J]. Food Chemistry, 2016, 209:17-26.
[25] 赵梓含, 张爱忠, 徐凡婷, 等. 酵母细胞壁多糖的结构及生物功能[J]. 黑龙江畜牧兽医, 2023(4):25-29;127.ZHAO Z H, ZHANG A Z, XU F T, et al. Structure and biological function of yeast cell wall polysaccharide[J]. Heilongjiang Animal Science and Veterinary Medicine, 2023(4):25-29;127.
[26] LIU Y, HUANG G L, LV M J. Extraction, characterization and antioxidant activities of mannan from yeast cell wall[J]. International Journal of Biological Macromolecules, 2018, 118:952-956.
[27] 李振慧, 刘龙, 单昊书, 等. 酵母多糖生物学调控机制及其在畜禽上的应用[J]. 饲料研究, 2022, 45(12):139-143.LI Z H, LIU L, SHAN H S, et al. Biological regulation mechanism of yeast polysaccharide and its application in livestock and poultry[J]. Feed Research, 2022, 45(12):139-143.
[28] 马文锦. 两株胶红酵母菌的胞外多糖结构、生物活性及转录组表达差异分析 [D].西安:陕西科技大学, 2018.MA W J. Differential analysis of extracellular polysaccharide structure, bioactivity and transcriptome expression of two strains of Gum Red Yeast [D].Xian:Shaanxi University of Science and Technology, 2018.
[29] ALCALDE-EON C, PÉREZ-MESTRE C, FERRERAS-CHARRO R, et al. Addition of mannoproteins and/or seeds during winemaking and their effects on pigment composition and color stability[J]. Journal of Agricultural and Food Chemistry, 2019, 67(14):4031-4042.
[30] 牛育林, 何旺庄. ‘黑比诺’干红葡萄酒酿造工艺优化及探讨[J]. 中外葡萄与葡萄酒, 2020(3):45-49.NIU Y L, HE W Z. Optimization and discussion about winemaking technology of ‘Pinot Noir’ dry red wine[J]. Sino-Overseas Grapevine &Wine, 2020(3):45-49.
[31] YUE X F, JING S S, NI X F, et al. Anthocyanin and phenolic acids contents influence the color stability and antioxidant capacity of wine treated with mannoprotein[J]. Frontiers in Nutrition, 2021, 8:691784.
[32] RINALDI A, GONZALEZ A, MOIO L, et al. Commercial mannoproteins improve the mouthfeel and colour of wines obtained by excessive tannin extraction[J]. Molecules, 2021, 26(14):4133.
[33] RODRIGUES A, RICARDO-DA-SILVA J M, LUCAS C, et al. Effect of commercial mannoproteins on wine colour and tannins stability[J]. Food Chemistry, 2012, 131(3):907-914.
[34] 荆思思, 倪小凡, 王庶, 等. 甘露糖蛋白对‘赤霞珠’葡萄酒中糖酸和香气的影响[J]. 中国酿造, 2022, 41(1):143-148.JING S S, NI X F, WANG S, et al. Effect of mannoproteins on sugar, acid and aroma of ‘Cabernet Sauvignon’ wine[J]. China Brewing, 2022, 41(1):143-148.
[35] 赵越凡, 王升楠, 赵鹏涛, 等. 酵母多糖对葡萄酒品质的影响机理研究进展[J]. 食品与发酵工业, 2023, 49(17):316-323.ZHAO Y F, WANG S N, ZHAO P T, et al. Research progress on the mechanism of wine quality by yeast polysaccharides[J]. Food and Fermentation Industries, 2023, 49(17):316-323.
[36] LI S Y, ZHAI H Y, MA W, et al. Yeast mannoproteins: Organoleptic modulating functions, mechanisms, and product development trends in winemaking[J]. Food Frontiers, 2023, 4(3):1091-1126.
[37] 张烨, 孙玉梅, 俞志敏, 等. 糖分对葡萄酒发酵的影响[J]. 食品与发酵工业, 2017, 43(4):280-285.ZHANG Y, SUN Y M, YU Z M, et al. Effects of saccharides on wine fermentation[J]. Food and Fermentation Industries, 2017, 43(4):280-285.
[38] LETICIA M L, ZENAIDA G, BELéN A. Properties of Wine Polysaccharides [M]. IntechOpen, 2019.
[39] FILIPE-RIBEIRO L, MILHEIRO J, GUISE R, et al. Efficiency of carboxymethylcellulose in red wine tartaric stability: Effect on wine phenolic composition, chromatic characteristics and colouring matter stability[J]. Food Chemistry, 2021, 360:129996.
[40] BENUCCI I. Impact of post-bottling storage conditions on colour and sensory profile of a rosé sparkling wine[J]. LWT, 2020, 118:108732.
[41] WANG S N, MA Z Q, ZHAO P T, et al. The role of Arabic gum on astringency by modulating the polyphenol fraction-protein reaction in model wine[J]. Food Chemistry, 2023, 417:135927.
[42] ZHANG X K, LAN Y B, HUANG Y, et al. Targeted metabolomics of anthocyanin derivatives during prolonged wine aging: Evolution, color contribution and aging prediction[J]. Food Chemistry, 2021, 339:127795.
[43] 曹鹏, 张波, 张欣珂, 等. 陈酿前添加咖啡酸对干红葡萄酒颜色品质及多酚构成的影响[J]. 中国食品学报, 2019, 19(7):153-160.CAO P, ZHANG B, ZHANG X K, et al. The influence of caffeic acid addition before aging on the chromatic quality and phenolic composition of dry red wines[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(7):153-160.
[44] HE F, LIANG N N, MU L, et al. Anthocyanins and their variation in red wines I. Monomeric anthocyanins and their color expression[J]. Molecules, 2012, 17(2):1571-1601.
[45] ASSUNÇ O BICCA S, PONCET-LEGRAND C, ROI S, et al. Exploring the influence of S. cerevisiae mannoproteins on wine astringency and color: Impact of their polysaccharide part[J]. Food Chemistry, 2023, 422:136160.
O BICCA S, PONCET-LEGRAND C, ROI S, et al. Exploring the influence of S. cerevisiae mannoproteins on wine astringency and color: Impact of their polysaccharide part[J]. Food Chemistry, 2023, 422:136160.
[46] ZANG Z H, TANG S Y, LI Z Y, et al. An updated review on the stability of anthocyanins regarding the interaction with food proteins and polysaccharides[J]. Comprehensive Reviews in Food Science and Food Safety, 2022, 21(5):4378-4401.
[47] TANG R, HE Y, FAN K. Recent advances in stability improvement of anthocyanins by efficient methods and its application in food intelligent packaging: A review[J]. Food Bioscience, 2023, 56:103164.
[48] VELOSO M I, COELHO E, TRABULO O, et al. Elderberry concentrate juice industrial by-products characterization and valorisation[J]. Applied Sciences, 2022, 12(19):9463.
[49] LIN Z, FISCHER J, WICKER L. Intermolecular binding of blueberry pectin-rich fractions and anthocyanin[J]. Food Chemistry, 2016, 194:986-993.
[50] BUCHWEITZ M, SPETH M, KAMMERER D R, et al. Impact of pectin type on the storage stability of black currant (Ribes nigrum L.) anthocyanins in pectic model solutions[J]. Food Chemistry, 2013, 139(1-4):1168-1178.
[51] KOPJAR M, PILI OTA V, NEDI
OTA V, NEDI TIBAN N, et al. Strawberry Jams: Influence of different pectins on colour and textural properties[J]. Czech Journal of Food Sciences, 2009, 27(1):20-28.
TIBAN N, et al. Strawberry Jams: Influence of different pectins on colour and textural properties[J]. Czech Journal of Food Sciences, 2009, 27(1):20-28.
[52] KOH J, XU Z M, WICKER L. Blueberry pectin and increased anthocyanins stability under in vitro digestion[J]. Food Chemistry, 2020, 302:125343.
[53] OY N-ARDOIZ M, MANJ
N-ARDOIZ M, MANJ N E, ESCRIBANO-BAIL
N E, ESCRIBANO-BAIL N M T, et al. Effect of mannoproteins from different oenological yeast on pigment composition and color stability of red wine[J]. LWT, 2022, 172:114219.
N M T, et al. Effect of mannoproteins from different oenological yeast on pigment composition and color stability of red wine[J]. LWT, 2022, 172:114219.
[54] 尹宁宁, 许引虎, 李敏, 等. 不同酵母多糖对蛇龙珠干红葡萄酒品质的影响[J]. 食品与生物技术学报, 2018, 37(6):646-654.YIN N N, XU Y H, LI M, et al. Effect of yeast polysaccharide on the quality of wine cabernet gernischt dry red[J]. Journal of Food Science and Biotechnology, 2018, 37(6):646-654.
[55] DEL BARRIO GAL N R,
N R,  BEDA C, GIL M, et al. Different application dosages of a specific inactivated dry yeast (SIDY): Effect on the polysaccharides, phenolic and volatile contents and color of sauvignon Blanc wines[J]. OENO One, 2018, 52(4).
BEDA C, GIL M, et al. Different application dosages of a specific inactivated dry yeast (SIDY): Effect on the polysaccharides, phenolic and volatile contents and color of sauvignon Blanc wines[J]. OENO One, 2018, 52(4).
[56] ZHAO L, PAN F, MEHMOOD A, et al. Improved color stability of anthocyanins in the presence of ascorbic acid with the combination of rosmarinic acid and xanthan gum[J]. Food Chemistry, 2021, 351:129317.
[57] ZHAO L, PAN F, MEHMOOD A, et al. Protective effect and mechanism of action of xanthan gum on the color stability of black rice anthocyanins in model beverage systems[J]. International Journal of Biological Macromolecules, 2020, 164:3800-3807.
[58] ZHAO X, ZHANG X D, TIE S S, et al. Facile synthesis of nano-nanocarriers from chitosan and pectin with improved stability and biocompatibility for anthocyanins delivery: An in vitro and in vivo study[J]. Food Hydrocolloids, 2020, 109:106114.
[59] WANG L, XIANG D, LI C A, et al. Effects of lyophilization and low-temperature treatment on the properties and conformation of xanthan gum[J]. Food Hydrocolloids, 2021, 112:106352.
[60] WATRELOT A A, LE BOURVELLEC C, IMBERTY A, et al. Neutral sugar side chains of pectins limit interactions with procyanidins[J]. Carbohydrate Polymers, 2014, 99:527-536.
[61] FERNANDES P A R, LE BOURVELLEC C, RENARD C M G C, et al. Interactions of Arabinan-rich pectic polysaccharides with polyphenols[J]. Carbohydrate Polymers, 2020, 230:115644.
[62] XIAO Z Y, ZHOU W X, ZHANG Y X. Fungal polysaccharides[M]. Amsterdam: Elsevier, 2020:277-299.
[63] WANG Y Q, WANG Y, LUO Q, et al. Molecular characterization of the effects of Ganoderma Lucidum polysaccharides on the structure and activity of bovine serum albumin[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2019, 206:538-546.