恶臭假单胞菌(Pseudomonas putida)是一种革兰氏阴性菌,在自然环境中分布广泛且能降解多种有毒化学污染物,当面临内源性或外源性化学应激时,恶臭假单胞菌KT2440表现出了强大的耐受性[1]。由于其在代谢途径和对环境的适应性上的优势[2-4],以及具有对复杂有机物的降解能力和生物安全、有机化合物耐受性强而成为合成有机化合物的典型潜力微生物[5-7]。该菌作为生物有机化合物的底盘细胞具有巨大潜力,其在耐受有机化合物上包含多种因素,如细胞膜屏障、外膜囊泡、氧化还原代谢、损伤修复、信号转导调控等[8]。其中,冷休克蛋白(cold shock protein, Csp)在有机溶剂的耐受性上具有较多研究,P.putida DOT-T1E受甲苯胁迫时CspAⅡ表达上调,缺失导致耐受性降低[9],肉毒梭菌CspB和CspC在NaCl和乙醇耐受性中起重要作用[10],冷休克蛋白耐受有机化合物的机制值得研究。
原核生物中,温度急剧降低,一组小分子(约7 kDa)的酸性应激蛋白表达上调,这组蛋白称为冷休克蛋白[11]。冷休克蛋白是一类在生物体中起到重要作用的蛋白质,它们参与调节生物体对温度变化的应对和适应[12]。这些蛋白质通常在面临低温或其他环境应激的情况下被激活或表达,有助于维持细胞结构及功能的稳定性和其他关键蛋白质的活性[13-14]。由于其对温度变化的敏感性和调控细胞稳定性的能力,冷休克蛋白在生物技术领域中也具有一定潜在的应用[15-16],随着对冷休克蛋白的研究越来越深入,冷休克蛋白除了调控冷休克反应外,还参与调控生物体的多个性状,比如细胞的正常生长和分化、病原菌的侵袭力和致病性以及对多种外源压力情况下(高渗透压、饥饿、抗生素、有机溶剂等)的应答[17]。冷休克蛋白的这些优点也使其在理论研究和实际应用上具有积极的作用。
实验室前期利用恶臭假单胞菌KT2440生产紫苏醇(perilla alcohol, POH)的过程中发现,恶臭假单胞菌KT2440对柠檬烯和POH显示出较高的耐受性[18]。POH是一种单萜类的天然产物,来源于植物甲羟戊酸代谢途径[19]。为无色较黏稠液体,气味略带木香和花香,不易挥发,溶于甲醇、乙醇和乙腈等有机溶剂[20]。能抑菌、抗氧化、抗应激等。虽然POH存在于多种天然的植物精油中,但由于含量较低,分离较难且成本较高等原因,化学合成POH就显得尤为重要,从分子结构来看,柠檬烯与POH具有相同的分子骨架结构,在适当的反应条件下柠檬烯可经氧化转化成POH[21]。
本研究以恶臭假单胞菌KT2440为出发菌株,研究冷休克蛋白CspAⅠ(major cold shock protein)、CspAⅡ(nucleic acid cold-shock chaperone),具体通过构建CspAⅠ、CspAⅡ过表达及敲除菌株,并在POH胁迫下,测定细胞生长状态及其半抑制浓度,最后引入P450酶,以柠檬烯为底物产POH,从中验证POH对细胞的生长影响以及在细胞受POH胁迫时冷休克蛋白对细胞的耐受性的调控。
1 材料与方法
1.1 材料与试剂
1.1.1 主要试剂
2×Taq PCR Mastermix、2×PrimeStar,日本Takara公司;2×Multif Seamless Assembly Mix,Abclonal公司;引物,苏州金唯智生物科技有限公司。
1.1.2 菌株与质粒
本研究中所使用的质粒与菌株如表1所示,所使用引物如表2所示。
表1 本研究中使用的菌株与质粒
Table 1 Strains and plasmids used in this study

菌株与质粒表型来源菌株大肠杆菌JM109F′ (traD36, proAB+, lacIq, lacZ-M15),endA1, recA1, hsdR17, (rk-, mk+), mcrA, supE44, e-gyrA96,relA1, -(lac-proAB)Lab stock恶臭假单胞菌KT2440野生型Lab stockPpΔcspAⅠP.putida KT2440 knockout cspA ⅠThis studyPpΔcspAⅡP.putida KT2440 knockout cspA ⅡThis studyPpcspAⅠKT2440 harboring pBBR1MCS-2-Ptrc-cspA ⅠThis studyPpcspAⅡKT2440 harboring pBBR1MCS-2-Ptrc-cspA ⅡThis studyPpcP450KT2440 harboring pBBR1-cymR-Ptac-2CuO1-P450Lab stock质粒pBBR1MCS-2-pTrc99aBBR1 ori.KanR,PtrcLab stockpBBR1MCS-2-pTrc99a-cspAⅠBBR1 ori.KanR,Ptrc,cspA ⅠThis studypBBR1MCS-2-pTrc99a-cspAⅡBBR1 ori.KanR,Ptrc,cspA ⅡThis studypK18 mobsacBMB1 ori.KanR, sacBLab stockpK18 mobsacB-cspAⅠMB1 ori.KanR, sacB, cspA Ⅰ homologous arms This studypK18 mobsacB-cspAⅡMB1 ori.KanR, sacB, cspA Ⅱ homologous arms This studypBBR1-cymR-Ptac-2CuO1- P450BBR1 ori, KanR, cymR, Ptac, 2×operator CuO1, P450Lab stock
表2 本研究中使用的引物
Table 2 Primers used in this study

引物序列(5′-3′)pBBR1MCS-2-pTrc99a-vector-FAAGCTTGGCTGTTTTGGCGGATGAGAGpBBR1MCS-2-pTrc99a-vector-RGAATTCCATGGTCTGTTTCCTGcspAⅠ-FGGAAACAGACCATGGAATTCAAGGAGATATACCATGTCGTCTCGTGAGACTGcspAⅠ-RCTCTCATCCGCCAAAACAGCCAAGCTTTCAGAGGCCCACTACGTCTTCcspAⅡ-FCATGGAATTCAAGGAGATATACCATGTCCAATCGCCAACAcspAⅡ-RTCTCATCCGCCAAAACAGCCAAGCTTTTACTCCGGACGAACCTGTGCAGpK18 mobsacB-vector-FAAGCTTGGCACTGGCCGTCGpK18 mobsacB-vector-RGAATTCGTAATCATGGTCATAGCTGcspAⅠ-up-FATGACCATGATTACGAATTCTAGCGCAGTGCCTGGcspAⅠ-up-RGGCTTGAAACCAGAGGCCTGAACTACTCCGGATTTTTATTGTcspAⅠ-down-FACAATAAAAATCCGGAGTAGTTCAGGCCTCTGGTTTCAAGCCcspAⅠ-down-RAACGACGGCCAGTGCCAAGCTTCTGGACATCTCCCGCGcspAⅡ-up-FCAGCTATGACCATGATTACGAATTCTCATCTTTAGGGGTGATGATCTGcspAⅡ-up-RTTTACAGCTATCCGAAGGGTGAATCTCCAGAACATcspAⅡ-down-FATGTTCTGGAGATTCACCCTTCGGATAGCTGTAAAcspAⅡ-down-RAACGACGGCCAGTGCCAAGCTTCGTCTGGCGCGATT
1.1.3 培养基与抗生素
LB培养基(g/L):酵母提取物5,蛋白胨5,NaCl 10,主要用于质粒构建菌株及发酵种子液培养。LB固体培养基为上述液体培养基中添加1%(质量分数)的琼脂粉。
抗生素:卡那霉素终质量浓度50 mg/L。
1.1.4 仪器与设备
ETC821 PCR基因扩增仪,杭州朗基科学仪器有限公司;411BR8608 MicroPulser电转仪,Bio-Rad Laboratories公司;StepOnePlus实时荧光定量PCR仪,Applied Biosystem公司;759S21023 UV-Vis Spectrophotometer紫外可见分光光度计,上海棱光技术有限公司;高效液相色谱,UV-VIS检测器(SPD-20A/20AV),Shimadzu公司。
1.1.5 标准品
POH标准品:CAS编号536-59-4,分子式C10H16O,分子质量152.23,规格及纯度为 90%,室温储存。购于上海阿拉丁生化科技股份有限公司。
1.2 实验方法
1.2.1 基因克隆和质粒构建
使用引物pBBR1MCS-2-pTrc99a-vector-F/pBBR1MCS-2-pTrc99a-vector-R,以广宿主载体pBBR1MCS-2-pTrc99a为模板扩增线性化载体片段;使用引物cspAⅠ-F/cspAⅠ-R、cspAⅡ-F/cspAⅡ-R,以恶臭假单胞菌KT2440基因组为模板,扩增获得cspA I、cspA Ⅱ基因DNA片段。分别使用Gibson组装法连接载体和片段,构成质粒pBBR1MCS-2-pTrc99a-cspAⅠ和pBBR1MCS-2-pTrc99a-cspAⅡ。
使用引物pK18 mobsacB-vector-F/pK18 mobsacB-vector-R以pK18 mobsacB为模板扩增线性化载体片段;使用引物cspAⅠ-up-F/cspAⅠ-up-R、cspAⅠ-down-F/cspAⅠ-down-R,cspAⅡ-up-F/cspAⅡ-up-R、cspAⅡ-down-F/cspAⅡ-down-R以恶臭假单胞菌KT2440基因组为模板扩增含有cspA I-up、cspA I-down和cspA Ⅱ-up、cspA Ⅱ-down基因的DNA片段。分别使用Gibson组装法连接载体和片段,构成质粒pK18 mobsacB-cspAⅠ-up-down和pK18 mobsacB-cspAⅡ-up-down用于cspA I、cspA Ⅱ基因敲除。
1.2.2 生长曲线测定
原始菌KT2440,敲除菌ΔcspAⅠ、ΔcspAⅡ,过表达菌株cspAⅠ、cspAⅡ通过划线培养后,挑取各3个菌落接种到10 mL LB培养基的50 mL离心管中,在30 ℃下培养作为种子液。转接在10 mL密封小瓶中,在LB培养基中分别添加15 mmol/L POH,30 ℃培养,每隔3 h取一次样品,用分光光度计检测细胞的生长(OD600值),绘制生长曲线。
1.2.3 半抑制浓度测定
原始菌KT2440、敲除菌ΔcspAⅠ、回补菌株ΔcspAⅠ/cspAⅠ通过划线培养后,挑取各3个菌落接种到10 mL LB培养基的50 mL离心管中,在30 ℃下培养作为种子液。后转接在含0、1、5、15、30、60 mmol/L POH LB培养基分别培养,用分光光度计检测细胞的生长(OD600值),用各添加POH的OD比不添加POH的OD计算结合率,绘制POH浓度对结合率的曲线,当结合率为50%时对应的POH浓度为半抑制浓度。
1.2.4 菌株培养
将pBBR1-cymR-Ptac-2CuO1-P450质粒转化至恶臭假单胞菌KT2440中。PCR验证为阳性后于平板上挑取3个菌落,接种至装有10 mL LB培养基的50 mL离心管中,于220 r/min恒温培养箱培养,30 ℃培养15 h后转接至装有5 mL LB培养基的20 mL摇瓶中,当OD600值至0.6~0.8时添加5 mmol/L的柠檬烯作为底物、以及1 mmol/L异丙基β-D-1-硫代吡喃半乳糖苷(isopropyl-beta-D-thiogalactopyranoside, IPTG)诱导表达和600 mg/L 4-异丙基苯甲酸(p-cumate),于30 ℃培养24 h取样进行检测。
1.2.5 POH检测
取上述发酵液6 000 r/min离心10 min,收集上清液,经0.22 μm膜过滤后,吸取200 μL注入液相小瓶待检。高效液相色谱检测法:色谱柱:C18(4.6 mm×150 mm,5 μm),流动相:无水甲醇-水(60∶40,体积比);流动相流速为1.0 mL/min,检测波长210 nm,柱温40 ℃[22]。通过与已知浓度的POH标品绘制的标准曲线比较,将峰面积转换为POH浓度进行定量。
2 结果与分析
2.1 冷休克蛋白对细胞生长的影响
CspA最初是大肠杆菌中的主要冷休克蛋白,由70个氨基酸残基组成。它形成具有5条反平行 链的
链的 桶结构,并充当RNA伴侣。其在转录、mRNA稳定性和翻译水平上受到调节[23]。为了寻找冷休克蛋白CspAⅠ、CspAⅡ是否与高耐受性相关,本文利用RT-PCR技术分析了15 mmol POH胁迫24 h的恶臭假单胞菌KT2440样品和无胁迫菌株中冷休克蛋白的转录水平。从结果来看,应激菌株中cspA I基因的转录水平是无胁迫菌株的4.49倍。这意味着冷休克蛋白CspA I在15 mmol POH胁迫的菌株中显著上调,也可证实冷休克蛋白与有机化合物的耐受性有联系。后续构建了敲除菌株PpΔcspAⅠ、PpΔcspAⅡ、过表达菌株PpcspAⅠ、PpcspAⅡ,加上野生菌株KT2440分别在添加、不添加15 mmol/L POH的情况下进行培养,24 h后测定细胞生长状态OD600值,根据实验结果可知在添加POH的情况下,所有的细胞的生长相较于没有添加POH的细胞均有一定程度的降低,表明细胞受到了POH的毒性刺激,且敲除基因的细胞的OD600值均低于野生菌株,过表达菌株的细胞的OD600值均高于野生菌株。野生菌株KT2440在添加POH时相较于没有添加POH的OD600值降低了1.57倍;在POH存在的情况下PpΔcspAⅠ、PpΔcspAⅡ的OD600值相较于野生菌株分别降低了17.61%、11.09%。PpcspAⅠ的OD600值最高达到2.58,相较于野生菌株提高了15.11%(图1-a)。在添加15 mmol/L POH的情况下培养细胞,测定细胞生长曲线,根据曲线能观察到细胞生长过程稳定,且与24 h检测时的结果具有一致性(图1-b)。此结果可以证明,冷休克蛋白对有机化合物的耐受性具有一定的作用。
桶结构,并充当RNA伴侣。其在转录、mRNA稳定性和翻译水平上受到调节[23]。为了寻找冷休克蛋白CspAⅠ、CspAⅡ是否与高耐受性相关,本文利用RT-PCR技术分析了15 mmol POH胁迫24 h的恶臭假单胞菌KT2440样品和无胁迫菌株中冷休克蛋白的转录水平。从结果来看,应激菌株中cspA I基因的转录水平是无胁迫菌株的4.49倍。这意味着冷休克蛋白CspA I在15 mmol POH胁迫的菌株中显著上调,也可证实冷休克蛋白与有机化合物的耐受性有联系。后续构建了敲除菌株PpΔcspAⅠ、PpΔcspAⅡ、过表达菌株PpcspAⅠ、PpcspAⅡ,加上野生菌株KT2440分别在添加、不添加15 mmol/L POH的情况下进行培养,24 h后测定细胞生长状态OD600值,根据实验结果可知在添加POH的情况下,所有的细胞的生长相较于没有添加POH的细胞均有一定程度的降低,表明细胞受到了POH的毒性刺激,且敲除基因的细胞的OD600值均低于野生菌株,过表达菌株的细胞的OD600值均高于野生菌株。野生菌株KT2440在添加POH时相较于没有添加POH的OD600值降低了1.57倍;在POH存在的情况下PpΔcspAⅠ、PpΔcspAⅡ的OD600值相较于野生菌株分别降低了17.61%、11.09%。PpcspAⅠ的OD600值最高达到2.58,相较于野生菌株提高了15.11%(图1-a)。在添加15 mmol/L POH的情况下培养细胞,测定细胞生长曲线,根据曲线能观察到细胞生长过程稳定,且与24 h检测时的结果具有一致性(图1-b)。此结果可以证明,冷休克蛋白对有机化合物的耐受性具有一定的作用。
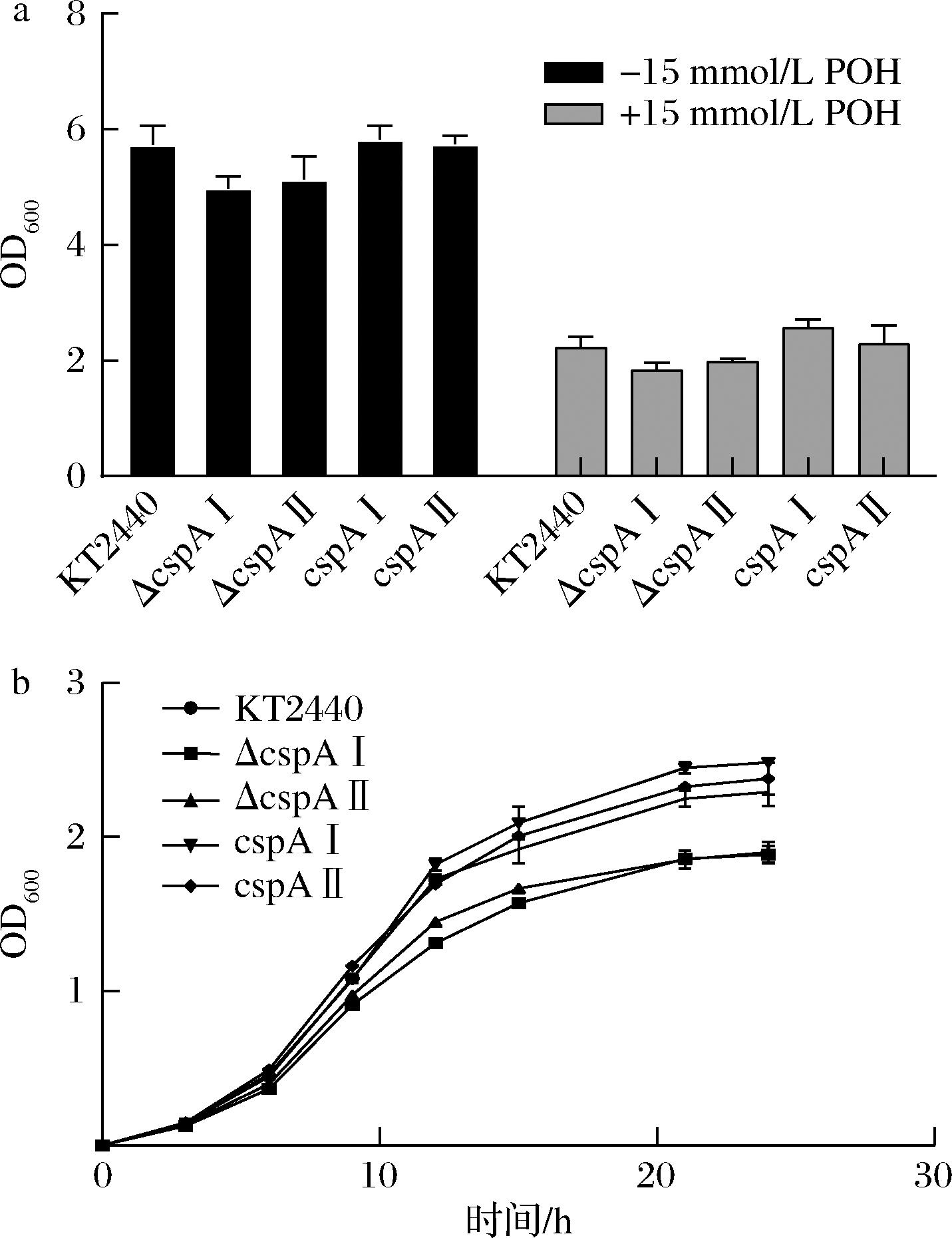
a-OD600值;b-生长曲线
图1 菌株分别在有无POH胁迫下的OD600情况,有POH存在时的生长曲线
Fig.1 The OD600 of the strains with or without perilla alcohol stress was detected, growth curve in the presence of perilla alcohol
a-KT2440;b-PpΔcspAⅠ;c-PpΔcspAⅠ/cspAⅠ
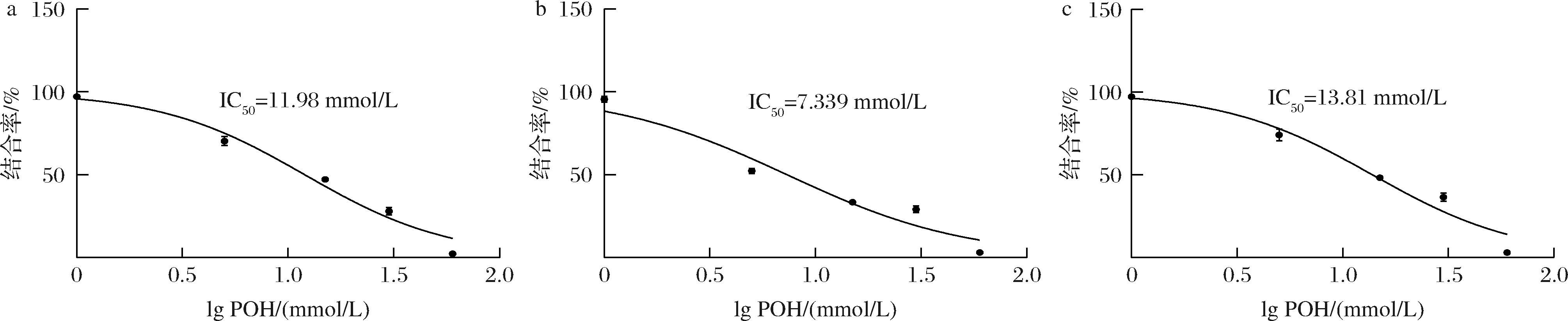
图2 添加POH胁迫下培养细胞测定半抑制浓度
Fig.2 Determination of semi-inhibitory concentration in cultured cells under the stress of adding perilla alcohol
2.2 冷休克蛋白对细胞半抑制浓度的影响
根据上述实验结果,能看到冷休克蛋白对细胞的生长有一定程度上的影响,均在冷休克蛋白敲除时细胞的OD600值低于野生菌株,过表达菌株的OD600值均高于野生菌株,并且无论是在添加还是不添加POH胁迫时,冷休克蛋白CspAⅠ的效果最为明显,因此将着重研究基因cspA I。为了进一步研究基因cspA I在受有机化合物POH胁迫的情况下对细胞生长状态的影响。在以上敲除菌和过表达菌的基础上,我们又构建了回补菌株PpΔcspAⅠ/cspAⅠ,KT2440、PpΔcspAⅠ、PpΔcspAⅠ/cspAⅠ在POH存在的情况下测定细胞的半抑制浓度,KT2440的IC50=11.98 mmol/L(图2-a),PpΔcspAⅠ的IC50=7.339 mmol/L,相较于野生菌株半抑制浓度降低了38.74%(图2-b),PpΔcspAⅠ/cspAⅠ的IC50=13.81 mmol/L,相较于野生菌株的半抑制浓度提高了15.28%,且是敲除菌株的1.88倍(图2-c)。
因此当基因cspA I敲除后,细胞的半抑制浓度降低,对细胞的毒性增加,使细胞的生长状态降低,而当过表达基因cspA I后细胞的半抑制浓度提高了,表示对细胞的毒性降低,更加印证了冷休克蛋白cspAⅠ对细胞对有机化合物的耐受性具有一定的调节作用。
2.3 冷休克蛋白与POH产量关系
细胞色素P450(CYP450),又称P450酶,Mycobacterium sp.HXN-1500来源的P450酶,即CYP153A6,可氧化C6~C11正烷烃,也可以解构较为复杂的烃类作底物,能得到高度区域选择性烃化的产物[24-25]。当底物为柠檬烯时,CYP153A6可将其特异性氧化为POH,目前已在多种宿主中得到应用。
基于上述实验都更加印证着冷休克蛋白CspAⅠ对细胞的耐受性有影响。后续将在原始菌株KT2440、敲除菌株PpΔcspAⅠ和过表达PpcspAⅠ菌株中引入质粒pBBR1-cymR-Ptac-2CuO1-P450,添加柠檬烯为底物,使其转化为POH。根据实验结果能观察到,添加5 mmol/L柠檬烯后细胞的生长也受到了某种程度上的抑制,且敲除菌株的生长抑制最为明显,OD600值为3.82(图3-a),此结果更加证实了冷休克蛋白可提高细胞对有机化合物的耐受性。PpΔcspAⅠ产生的POH质量浓度最低为128.66 mg/L,菌株PpcspAⅠ产生的POH质量浓度最高为156.49 mg/L,相较于敲除菌株提高了21.64%。单位OD600下也是菌株PpcspAⅠ产生的POH质量浓度最高为36.79 mg/L。此结果也说明了冷休克蛋白可提高细胞对有机化合物的耐受性,维持细胞正常生长状态及其代谢能力,为其作为生产有机化合物的底盘细胞提供一定的科学依据。
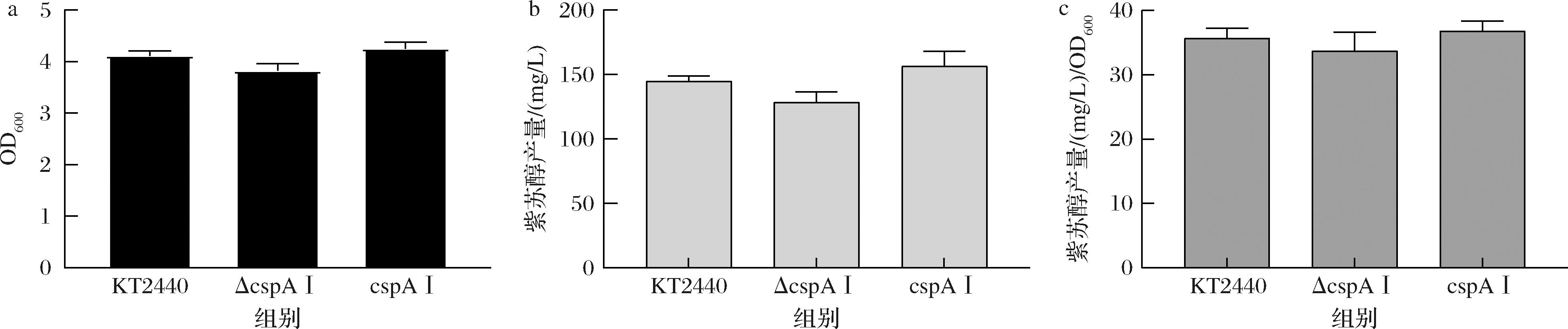
a-OD600结果;b-POH产量结果;c-POH产量/OD600结果
图3 KT2440、PpΔcspAⅠ、PpcspAⅠ的OD600和POH产量结果
Fig.3 OD600 and perilla alcohol yields of the original strain KT2440, PpΔcspAI, PpcspAI
3 讨论
恶臭假单胞菌KT2440具有较强的环境适应性和天然的降解有机化合物的优点,使其成为合成有机化合物广泛使用的底盘细胞。在工业生产有机化合物时,由于大量积累的有机化合物对细胞的毒性大大增强,这导致细胞负担过重,进而无法正常生长。因此,为了确保细胞能够在这种有机化合物丰富的环境中正常生长,提高细胞的耐受性显得非常必要。通过本实验可以看到,在柠檬烯或POH胁迫下,恶臭假单胞菌表现出对有机化合物的强大耐受性,为将其作为工业菌株用于有机化合物生产提供了可靠的依据。
同时,冷休克蛋白在此研究中也证明了其在外源应激的情况下的调控能力。在POH胁迫下PpcspAⅠ的OD600值最高达到2.58,相较于野生菌株提高了15.11%,PpΔcspAⅠ的IC50=7.339 mmol/L,相较于野生菌株半抑制浓度降低了38.74%,PpΔcspAⅠ/cspAⅠ的IC50=13.81 mmol/L,相较于野生菌株的半抑制浓度提高了15.28%,且是敲除菌株的1.88倍。在引入P450酶生产POH中,PpΔcspAⅠ产生的POH质量浓度最低为128.66 mg/L,菌株PpcspAⅠ产生的POH质量浓度最高为156.49 mg/L,相较于敲除菌株提高了21.64%。这不仅是一次有力的验证,更加突显了冷休克蛋白在细胞应对外界压力和有机化合物胁迫时的关键作用。这种调控机制为细胞在复杂的环境中适应和生存提供了一种高效的应对策略,为其生存环境的变化提供了有力的支持。冷休克蛋白的耐受性不仅表现在其调控能力,还体现在其协助细胞对抗外部压力的能力。通过帮助维持细胞内环境的稳定,冷休克蛋白成为微生物在不同环境条件下生存和繁殖的关键因素。这种耐受性的表现对于微生物的生存至关重要,使它们能够适应并克服外部环境的多样性。
在微生物合成有机化合物的工业过程中,其耐受性是限制底盘生产效益的关键瓶颈之一,而提高细胞耐受性是一个复杂而多方面的问题。在过去的研究中,为了增强细胞对外界压力的适应能力,研究人员通常采用优化培养条件、减少氧化应激、进行应激适应训练等方法。然而,鲜有过针对细胞耐受性进行基因表达调控的报道,特别是针对冷休克蛋白的调控。本文首次提出了冷休克蛋白作为一种调控蛋白,能够提高细胞的耐受性。这一发现为探索新的细胞耐受性调控机制开辟了新的途径,并为相关领域的进一步研究提供了重要的理论基础。
基于本研究结果,冷休克蛋白对细胞的耐受性具有一定的调控作用,然而,目前对其具体的调控方式以及涉及的调控基因仍不清楚。这为后续的研究提供了一个有待深入探讨的课题。了解冷休克蛋白如何调控细胞的耐受性,以及它与其他相关基因的交互作用,将有助于揭示这一调控机制的详细机理。这方面的深入研究将有助于拓展对细胞应对外界压力的认识,为更有效地利用这种调控机制提供理论基础。
4 结论
本研究通过在POH胁迫下测定冷休克蛋白对细胞生长状态的影响和半抑制浓度。在POH胁迫条件下,敲除冷休克蛋白时,细胞的生长抑制颇为显著;相反,过表达冷休克蛋白的细胞在POH胁迫时生长好于野生菌株,PpcspAⅠ的OD600值最高达到2.58,相较于野生菌株提高了15.11%。同时,在POH胁迫下,敲除菌株的半抑制浓度明显降低,细胞的毒性显著增强,而过表达菌株的半抑制浓度相较于敲除菌株提高了88.17%。这些结果强烈支持了冷休克蛋白在一定程度上影响细胞的耐受性的假设。后续我们引入了P450酶产POH。过表达冷休克蛋白CspAⅠ的产量最高,可达到156.49 mg/L,此结果进一步说明了冷休克蛋白的作用,不仅可以提高细胞的耐受性,还能稳定细胞的代谢水平。这为冷休克蛋白在生产有机化合物方面发挥作用提供了一定的理论依据。这一发现不仅有助于深化对冷休克蛋白调控细胞功能的认识,同时为提高底盘细胞对有机化合物的适应性提供了更为详实的理论基础。
[1] NIKEL P I, DE LORENZO V.Pseudomonas putida as a functional chassis for industrial biocatalysis:From native biochemistry to trans-metabolism[J].Metabolic Engineering, 2018, 50:142-155.
[2] 杨运文, 蒋伏欢, 宋杰, 等.重组工程法敲除恶臭假单胞菌KT2440的染色体基因[J].南京师大学报(自然科学版), 2011, 34(4):96-101.YANG Y W, JIANG F H, SONG J, et al.Recombineering mediated chromosal gene knockout of Pseudomonas putida KT2440[J].Journal of Nanjing Normal University (Natural Science Edition), 2011, 34(4):96-101.
[3] SILBY M W, WINSTANLEY C, GODFREY S A C, et al.Pseudomonas genomes:Diverse and adaptable[J].FEMS Microbiology Reviews, 2011, 35(4):652-680.
[4] NELSON K E, WEINEL C, PAULSEN I T, et al.Complete genome sequence and comparative analysis of the metabolically versatile Pseudomonas putida KT2440[J].Environmental Microbiology, 2002, 4(12):799-808.
[5] POBLETE-CASTRO I, BECKER J, DOHNT K, et al.Industrial biotechnology of Pseudomonas putida and related species[J].Applied Microbiology and Biotechnology, 2012, 93(6):2279-2290.
[6] PUCHA KA J, OBERHARDT M A, GODINHO M, et al.Genome-scale reconstruction and analysis of the Pseudomonas putida KT2440 metabolic network facilitates applications in biotechnology[J].PLoS Computational Biology, 2008, 4(10):e1000210.
KA J, OBERHARDT M A, GODINHO M, et al.Genome-scale reconstruction and analysis of the Pseudomonas putida KT2440 metabolic network facilitates applications in biotechnology[J].PLoS Computational Biology, 2008, 4(10):e1000210.
[7] BELDA E, VAN HECK R G A, JOSÉ LOPEZ-SANCHEZ M, et al.The revisited genome of Pseudomonas putida KT2440 enlightens its value as a robust metabolic chassis[J].Environmental Microbiology, 2016, 18(10):3403-3424.
[8] BITZENHOFER N L, KRUSE L, THIES S, et al.Towards robust Pseudomonas cell factories to harbour novel biosynthetic pathways[J].Essays in Biochemistry, 2021, 65(2):319-336.
[9] SEGURA A, GODOY P, VAN DILLEWIJN P, et al.Proteomic analysis reveals the participation of energy- and stress-related proteins in the response of Pseudomonas putida DOT-T1E to toluene[J].Journal of Bacteriology, 2005, 187(17):5937-5945.
[10] DERMAN Y, SÖDERHOLM H, LINDSTRÖM M, et al.Role of csp genes in NaCl, pH, and ethanol stress response and motility in Clostridium botulinum ATCC 3502[J].Food Microbiology, 2015, 46:463-470.
[11] CRAIG K, JOHNSON B R, GRUNDEN A.Leveraging Pseudomonas stress response mechanisms for industrial applications[J].Frontiers in Microbiology, 2021, 12:660134.
[12] YAMANAKA K.Cold shock response in Escherichia coli[J].Journal of Molecular Microbiology and Biotechnology, 1999, 1(2):193-202.
[13] 张雪, 张华方, 刘晴, 等.微生物冷休克蛋白的生理功能及其潜在应用[J].生物技术进展, 2015, 5(4):279-284.ZHANG X, ZHANG H F, LIU Q, et al.Physiological function and potential applications of cold shock proteins in microbes[J].Current Biotechnology, 2015, 5(4):279-284.
[14] PHADTARE S, ALSINA J, INOUYE M.Cold-shock response and cold-shock proteins[J].Current Opinion in Microbiology, 1999, 2(2):175-180.
[15] BEHL A, KUMAR V, SHEVTSOV M, et al.Pleiotropic roles of cold shock proteins with special emphasis on unexplored cold shock protein member of Plasmodium falciparum[J].Malaria Journal, 2020, 19(1):382.
[16] HORN G, HOFWEBER R, KREMER W, et al.Structure and function of bacterial cold shock proteins[J].Cellular and Molecular Life Sciences, 2007, 64(12):1457-1470.
[17] ERMOLENKO D N, MAKHATADZE G I.Bacterial cold-shock proteins[J].Cellular and Molecular Life Sciences CMLS, 2002, 59(11):1902-1913.
[18] 底心怡, 刘春立, 刘秀霞, 等.恶臭假单胞菌F1表达P450酶催化柠檬烯生物合成紫苏醇[J].食品与发酵工业, 2024, 50(2):34-40.DI X Y, LIU C L, LIU X X, et al.Biosynthesis of perillyl alcohol using limonene catalyzed by cytochrome P450 in Pseudomonas putida F1[J].Food and Fermentation Industries, 2024, 50(2):34-40.
[19] 秦泽华, 张汝兵, 郁建平.大肠杆菌通过甲羟戊酸途径合成紫苏醇[J].生物工程学报, 2018, 34(5):722-730.QIN Z H, ZHANG R B, YU J P.Perillyl alcohol production by engineered heterologous mevalonate pathway in Escherichia coli[J].Chinese Journal of Biotechnology, 2018, 34(5):722-730.
[20] 马娟. 天然活性单萜-紫苏醇研究进展[J].广州化工, 2014, 42(19):16-18;28.MA J.Recent advances on perillyl alcohol of a natural and active monoterpene[J].Guangzhou Chemical Industry, 2014, 42(19):16-18;28.
[21] 李谦和, 詹小雄, 冯真真, 等.紫苏醇的合成研究进展[J].林产化学与工业, 2007, 27(1):121-126.LI Q H, ZHAN X X, FENG Z Z, et al.Progress in synthesis of perillyl alcohol[J].Chemistry and Industry of Forest Products, 2007, 27(1):121-126.
[22] 刘春立, 郝云鹏, 白仲虎, 等.一种菌株发酵液中紫苏醇的高效液相色谱检测方法:CN116559307A[P].2023-08-08.
[23] BAE W, XIA B, INOUYE M, et al.Escherichia coli CspA-family RNA chaperones are transcription antiterminators[J].Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(14):7784-7789.
[24] WANG X L, CHEN J, MA N N, et al.Selective hydroxylation of alkanes catalyzed by cytochrome P450 enzymes[J].Acta Chimica Sinica, 2020, 78(6):490.
[25] CANNAZZA P, RABUFFETTI M, DONZELLA S, et al.Whole cells of recombinant CYP153A6-E.coli as biocatalyst for regioselective hydroxylation of monoterpenes[J].AMB Express, 2022, 12(1):48.