高尿酸血症(hyperuricemia, HUA)表现为血清异常升高的尿酸水平。HUA不仅可诱发痛风,还与肾脏疾病、心血管疾病以及糖尿病、高血压等疾病的发生与发展紧密相关[1-2]。目前高尿酸血症的治疗药物主要分为排尿酸药和抑制尿酸生成药[3]。排尿酸药物主要包括苯溴马隆和丙磺舒。它们的作用是抑制肾小管重吸收作用,从而促进尿酸的排泄。抑制尿酸生成药物主要包括别嘌醇和非布司他。它们通过降低黄嘌呤氧化酶活性,使次黄嘌呤和黄嘌呤无法反应生成尿酸,从而降低尿酸含量。以及其他增强尿酸降解的药物,如拉布立酶是一种重组尿酸酶抑制剂,它可以将尿酸分解为可溶性产物排出。虽然这些药物可有效降低尿酸,但可能会引起各种副作用,例如过敏、超敏反应、胃肠道疾病和肝肾功能障碍[4]。而服用益生菌是一种安全有效缓解HUA的方法。最近的研究表明,益生菌可以促进嘌呤和尿酸分解代谢,调节转运蛋白对尿酸的吸收或分泌,代谢物促成尿酸分解和排泄以及改善HUA引起的肠道炎症反应等[5]。一株从鸡肠道微生物群中分离的L.aviarius CML180,可以通过降解嘌呤核苷(肌苷和鸟苷)来预防HUA的发生[6];此外,在高果糖诱导的HUA动物模型中,短乳杆菌DM9218能够降低血尿酸水平和提高肝脏黄嘌呤氧化酶(xanthine oxidase, XOD)活性,其机制是通过降解肌苷,调节肠道菌群失衡以及相关的LPS炎症反应来实现的[7]。乳酸菌通过促进短链脂肪酸产生,抑制血清和肝脏XOD活性,促进肠道中UA的分解排泄[8]。菌株嗜黏蛋白阿克曼菌通过调节肾脏和肠道中尿酸盐转运蛋白1(urate anion transporter 1, URAT1)、葡萄糖转运蛋白(glucose transporter 9, GLUT9)和ATP结合盒亚家族G成员2(ATP-binding cassette subfamily G member 2, ABCG2)的表达来促进HUA模型小鼠尿酸的排泄[9]。目前为止,格氏乳杆菌如何发挥抗高尿酸血症作用仍未得到有效探索。因此,本研究以高尿酸血症小鼠模型为例,研究了活菌和巴氏杀菌对高尿酸血症小鼠尿酸水平的影响,并通过尿酸合成和排泄、肾脏炎症的变化探讨了可能的机制。
1 材料与方法
1.1 材料
1.1.1 菌株来源
实验所用的格氏乳杆菌CCFM1346由江南大学食品微生物菌种保藏中心(Culture Collection of Food Microorganisms, CCFM)提供。
1.1.2 药品及试剂
MRS培养基,青岛海博生物技术有限公司;XOD活性检测试剂盒、UOX活性检测试剂盒,北京索莱宝科技有限公司;尿酸ELISA试剂盒,上海酶联生物技术有限公司;BCA蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;逆转录试剂盒、qPCR试剂盒,南京诺唯赞生物科技有限公司。
1.2 仪器与设备
Multiscan Go多功能酶标仪、ZHJH_C1115B超净工作台,上海智诚有限公司;HWS-150恒温恒湿培养箱,上海森信有限公司;UV-1800紫外分光光度器,苏州岛津公司;EL3002分析天平、FE-20pH计,上海梅特勒公司;542R高速离心机,德国艾本德公司;MLS-3750蒸汽灭菌锅,日本三洋公司;高通量组织研磨机,宁波新芝生物科技股份有限公司;切片电子扫描仪,匈牙利3DHISTECH公司;PCR扩增仪T100、实时荧光定量PCR仪、PCR仪,美国Bio-Rad公司。
1.3 实验方法
1.3.1 细菌培养和制备
格氏乳杆菌CCFM1346在MRS培养基中有氧培养。通过平板计数计算格氏乳杆菌的细菌浓度。为了制备巴氏杀菌形式,离心后的细菌沉淀用PBS洗涤两次,在70 ℃下灭菌30 min,随后冻干,-80 ℃储存备用。
1.3.2 动物实验
40只4周龄的健康雄性ICR小鼠饲养于江南大学动物实验中心SPF级别屏障环境,保持温度20~26 ℃、相对湿度40%~60%。动物方案通过江南大学实验动物伦理委员会批准(合格编号:JN.编号:JN.No20230415i1360531[135])。小鼠适应性喂养1周后,随机分为5组(空白组、模型组、阳参组、活菌组和死菌组),每组8只小鼠。为了诱发高尿酸血症,模型组、阳参组和给药组每天上午7:00灌胃给予氧嗪酸钾(280 mg/kg),空白组接受体积分数为0.9%的生理盐水。同天上午9:00,模型组和空白组接受体积分数为0.9%生理盐水治疗;阳参组接受10 mg/kg别嘌醇治疗;活菌组接受5×109 CFU/g格氏乳杆菌CCFM1346活菌;死菌组接受5×109 CFU/g格氏乳杆菌CCFM1346灭活菌。造模3周后,对小鼠进行眼部静脉丛取血,采集肝脏和肾脏。取小鼠的左肾固定在4%多聚甲醛溶液中。组织样本在液氮中迅速冷冻,-80 ℃保存。血液样本离心(3 500×g,15 min)取上清液,-80 ℃保存。
1.3.3 肾脏病理学切片和生化分析
肾脏样本进行苏木精-伊红(hematoxylin-eosin, HE)染色,通过Pannoramic MIDI数字切片扫描仪扫描成片,观察评估肾脏切片病理学特征。小鼠肾脏的器官指数为小鼠肾脏质量与小鼠体重的比值。小鼠血清和尿液中尿酸水平通过ELISA试剂盒进行定量。小鼠肝脏XOD和UOX酶活力的表达按照试剂盒的方法进行。
1.3.4 实时荧光定量PCR
使用TRIzol试剂提取肾脏样本的RNA,按照逆转录试剂盒说明反转录得到cDNA。肾脏mRNA水平以GAPDH进行统一标准。实验检测基因包括URAT1、GLUT9、ABCG2、NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)、半胱天冬酶-1前体(cysteinyl aspartate specific proteinase-1, Caspase-1)、肿瘤坏死因子(tumor necrosis factor, TNF-α)、白介素-1β(interleukin-1β, IL-1β)、白介素-6(interleukin-6, IL-6)和GAPDH。对应的引物序列见表1。
表1 基因引物序列
Table 1 Primer sequence of genes

目的基因基因序列(5′-3′)基因序列(3′-5′)URAT1GACCTTGGACCCGATGTTCTTCTGCGTGGCGTTGGACTCTGTAAGCGLUT9ATGTGGACTCAATGCGATCTGGTTCTGTTTCAATTCCTCCCGTGCTCAGABCG2TAAATGGAGCACCTCAACCTGAGATGCCACGGATAAACTGCaspase1AACCACTCGTACACGTCTTGCCCCAGATCCTCCAGCAGCAACTTCASCAGACCACCAGCCAAGACAAGCTCCAGGTCCATCACCAAGTNLRP3AGCCTCAGGGCACCAAAGGGATGAAGCACATAGTAAACATNF-αTGGAACTGGCAGAAGAGGCACTAGAGGCTGAGACATAGGCACCGIL-1βACCTGGGCTGTCCTGATGAGAGTGT TGATGTGCTGCTGCGAGATIL-6GTTCTCTGGGAAATCGTGGAGGAAATTGGGGT AGGAAGGAGAPDHGTGAAGGTCGGTGTGAACGGGTGATGGCATGGACTGTGGTC
1.3.5 数据分析
两组间的差异采用t值检验;两组以上的差异采用单因素方差分析。利用GraphPad Prism 9.0软件进行统计分析。P<0.05被认为具有统计学意义。
2 结果与分析
2.1 格氏乳杆菌对小鼠体重和肾脏的影响
通过肾脏指数评估小鼠肾脏受损状况。如图1-a所示,与空白组相比,模型组小鼠肾脏指数显著升高(P<0.01),提示肾脏增生和肥大的可能性。而活的和巴氏杀菌的格氏乳杆菌CCFM1346可以缓解肾脏指数的增加(P<0.05)。如图1-b所示,与空白组相比,模型组小鼠体重骤升,摄入格氏乳杆菌CCFM1346可以缓解小鼠体重的增加。
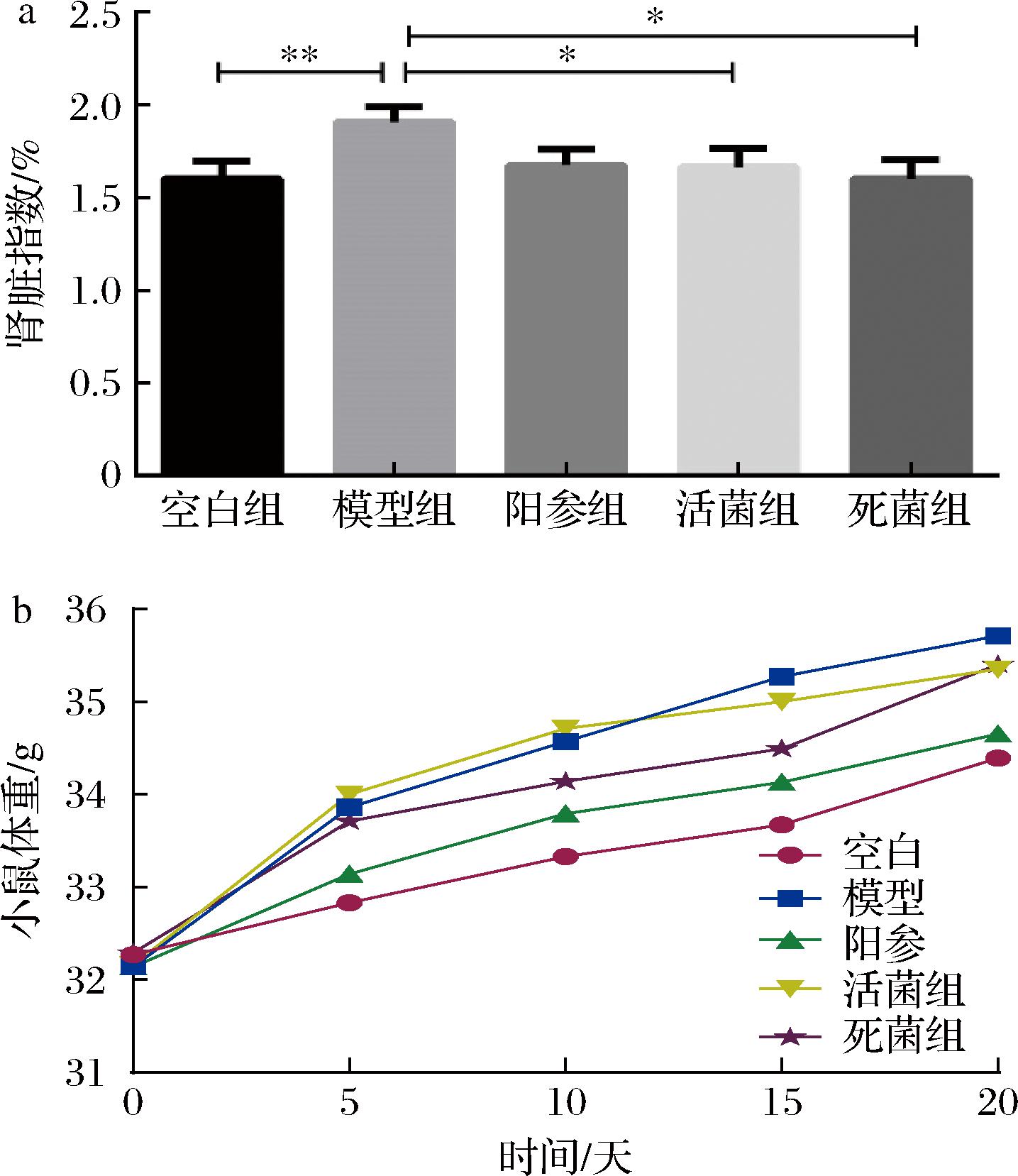
a-小鼠肾脏指数;b-小鼠体重变化
图1 小鼠肾脏指数和体重
Fig.1 Mice kidney index and body weight
注:**表示P<0.01,*表示P<0.05(下同)。
如图2所示,空白组小鼠肾脏无病理学损伤。相比于空白组,模型组小鼠肾脏切片出现明显肾小管上皮细胞水样变性,细胞肿胀,胞质疏松、淡染等症状(黑色箭头所示)。与模型组相比,活菌组以及死菌组的肾损伤均有不同程度改善。
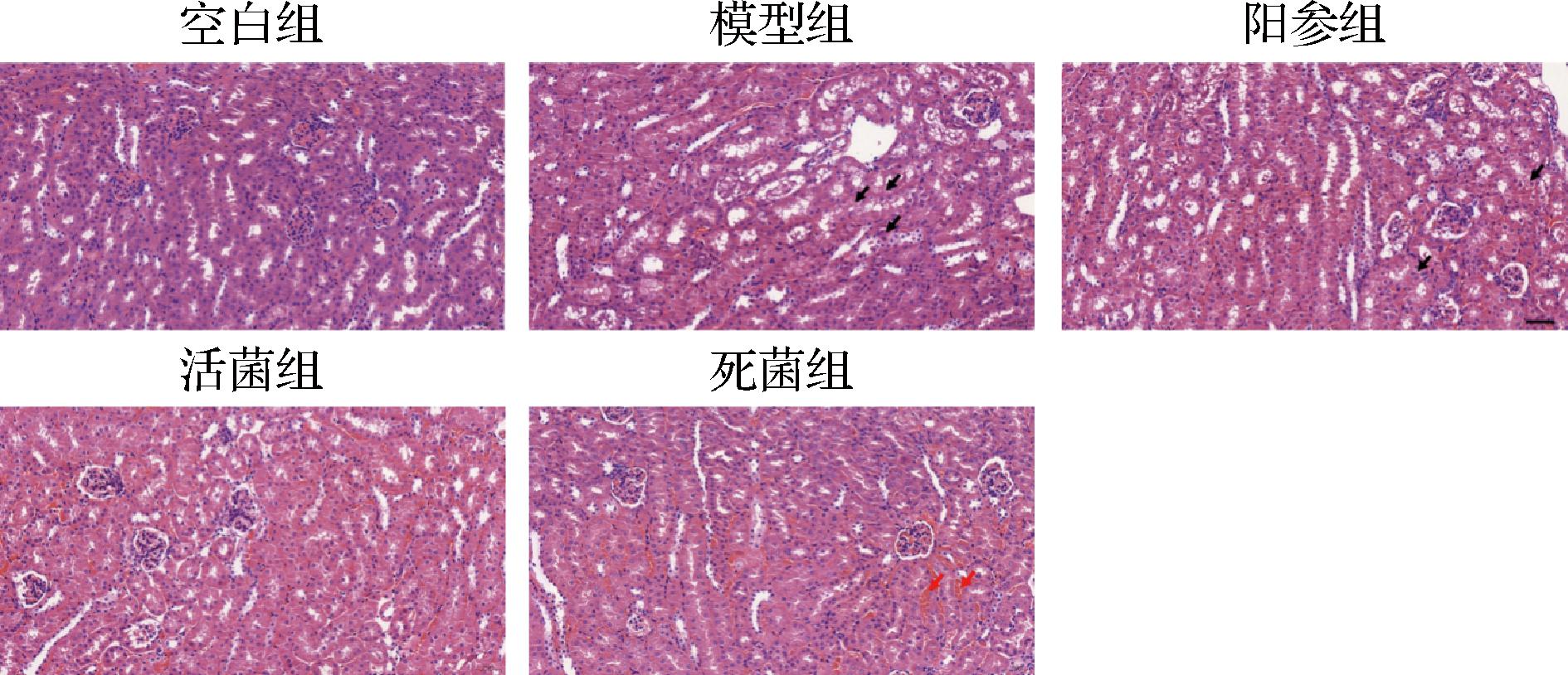
图2 肾脏HE染色
Fig.2 HE staining of the kidneys
注:最终放大倍率为200×。
2.2 格氏乳杆菌对小鼠血清和尿液UA水平的影响
如图3-a所示,模型组小鼠血清UA水平较空白组小鼠显著升高(86.47%,P<0.000 1),表明高尿酸血症模型建立成功。与模型组小鼠相比,阳参组、活菌组和死菌组分别使高尿酸血症小鼠血清尿酸浓度显著降低了82.62%、82.19%和77.45%,并接近空白组(P<0.000 1)。
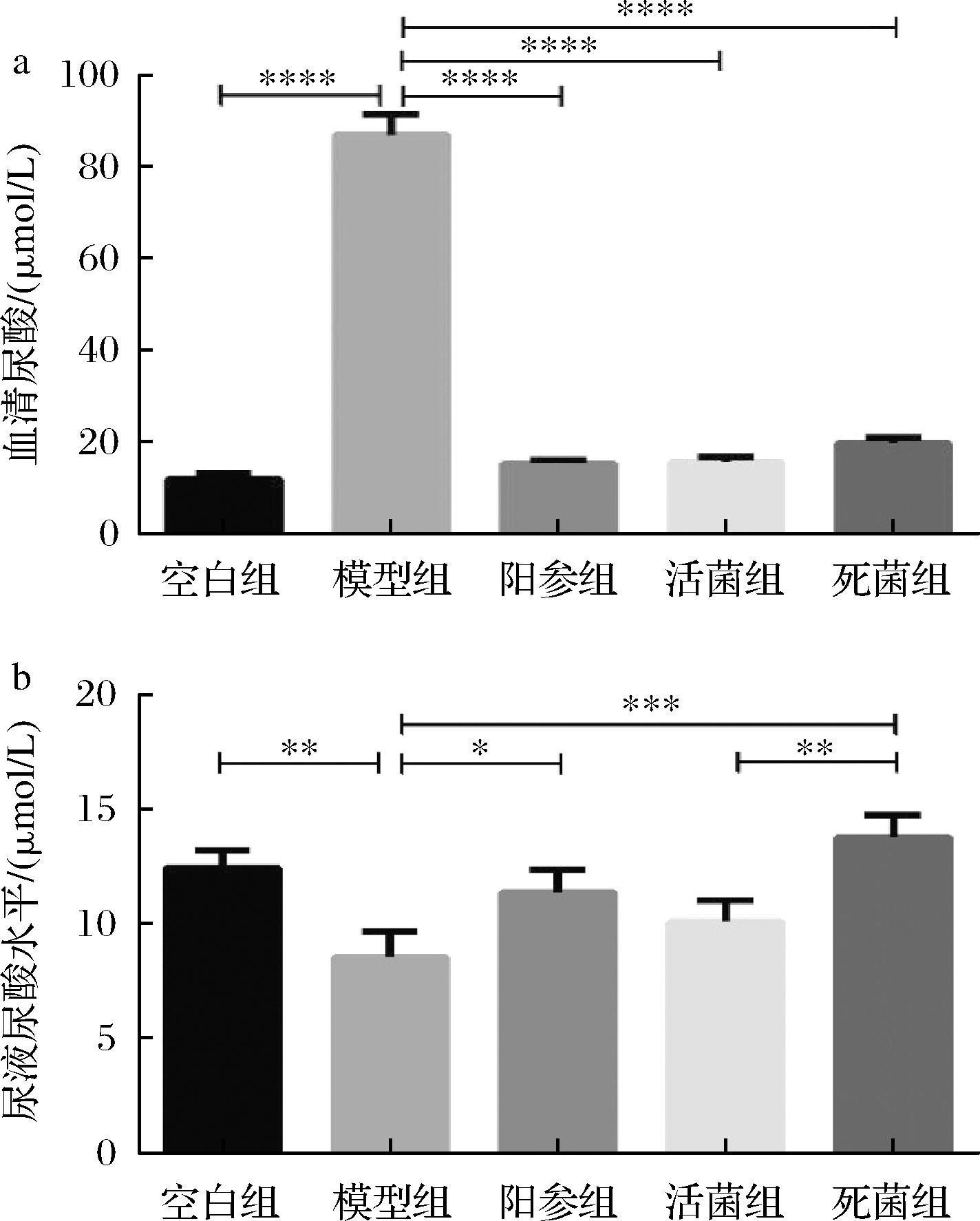
a-血清尿酸水平;b-尿液尿酸水平
图3 小鼠血清以及尿液中UA水平
Fig.3 UA levels in serum and urine of mice
注:****表示P<0.000 1,***表示P<0.001(下同)。
通过检测尿液中的UA来确定小鼠UA的排泄。如图3-b所示,与模型组小鼠相比,阳参组和死菌组分别使模型小鼠尿液中UA浓度显著增加了24.86%(P<0.05)和38.09%(P<0.001)。相比于活菌组,死细菌对UA排泄表现出更好的促进作用。这些结果表明,格氏乳杆菌CCFM1346活菌和死菌均可以有效降低HUA小鼠血清UA水平,促进尿液中UA的排泄。
2.3 格氏乳杆菌对小鼠肝脏的影响
XOD对体内尿酸的合成很重要。如图4-a所示,模型组肝脏XOD活性明显高于空白组(P<0.000 1)。与模型组相比,阳参组、活菌组和死菌组小鼠肝脏XOD活性受到了抑制,分别降低了66.96%、45.72%和75.35%(P<0.000 1)。死细菌对XOD抑制活性优于活细菌,并且和药物别嘌醇治疗效果接近。表明格氏乳杆菌CCFM1346可以通过抑制肝脏XOD的表达来减少UA的生成。
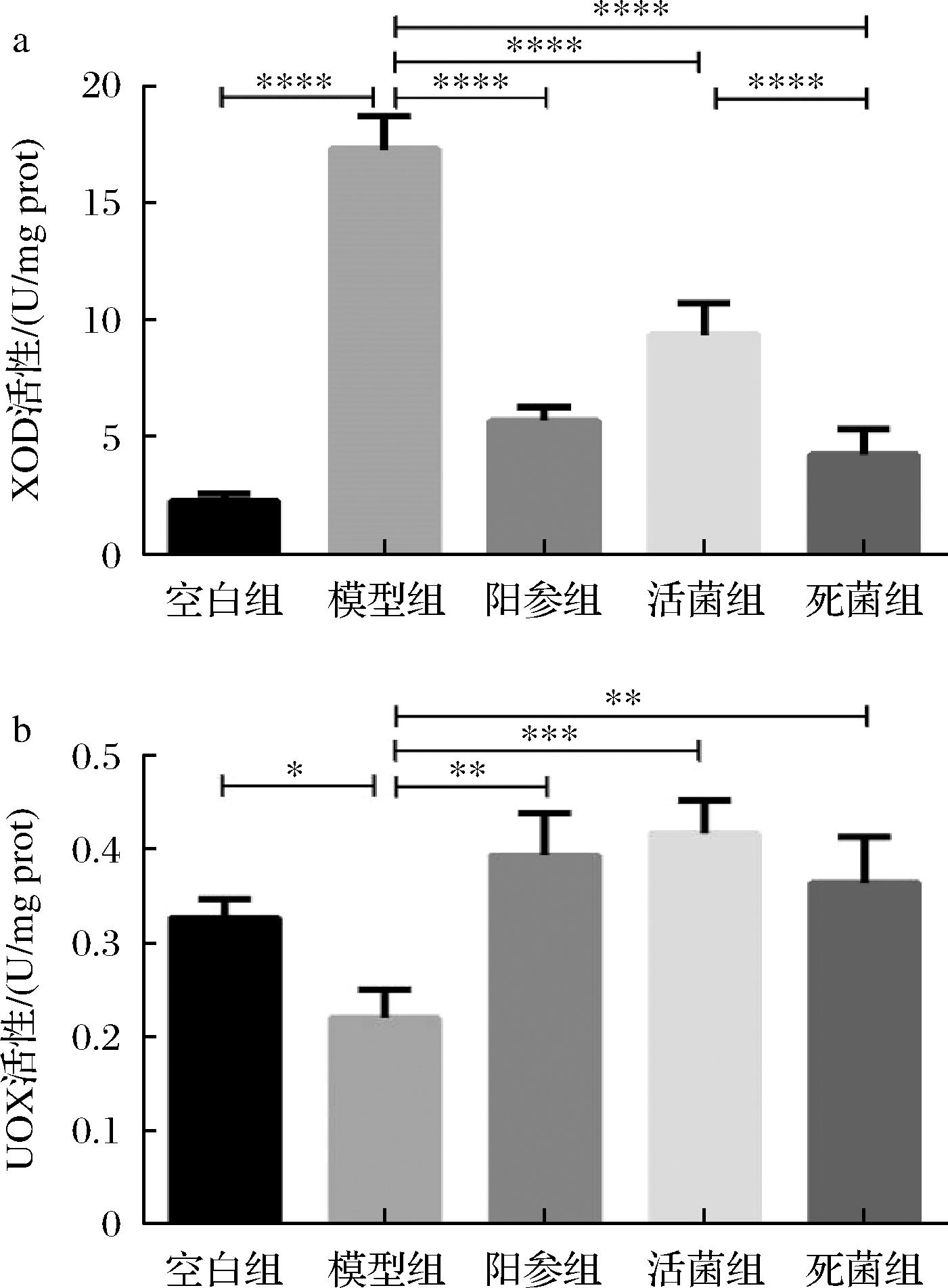
a-肝脏XOD活性;b-肝脏UOX活性
图4 小鼠肝脏XOD和UOX活性
Fig.4 XOD and UOX activities in kidney of mice
UOX可以进一步促进尿酸的降解。如图4-b所示,与模型组相比,阳参组、活菌组和死菌组小鼠肝脏UOX活性得到了显著提高,分别升高了44.07%(P<0.01)、47.20%(P<0.001)和39.45%(P<0.01)。表明格氏乳杆菌CCFM1346可以通过促进UOX的表达来增加UA的排泄。
2.4 格氏乳杆菌对小鼠肾脏转运蛋白的表达的影响
UA在肾脏的重吸收和分泌取决于各种尿酸转运蛋白。如图5-a~图5-c所示,相比于空白组,模型组小鼠肾脏尿酸重吸收转运蛋白GLUT9和URAT1 mRNA表达显著增高(P<0.000 1),尿酸排泄蛋白ABCG2 mRNA表达显著降低(P<0.01)。与模型组相比,阳参组、活菌组和死菌组显著降低了肾脏中GLUT9(94.12%、85.33%和92.29%,P<0.000 1)和URAT1(25.43%、78.96%和84.02%,P<0.01)的表达。与模型组相比,阳参组和死菌组显著升高了肾脏中ABCG2(52.32%和58.38%,P<0.01)的表达,并且死菌组促进ABCG2的表达能力优于活菌组(P<0.001)。这些结果表明,格氏乳杆菌CCFM1346可以通过下调肾脏尿酸重吸收转运蛋白URAT1和GLUT9的表达以及上调尿酸排泄蛋白ABCG2的表达,来促进肾脏UA的重吸收与排泄。
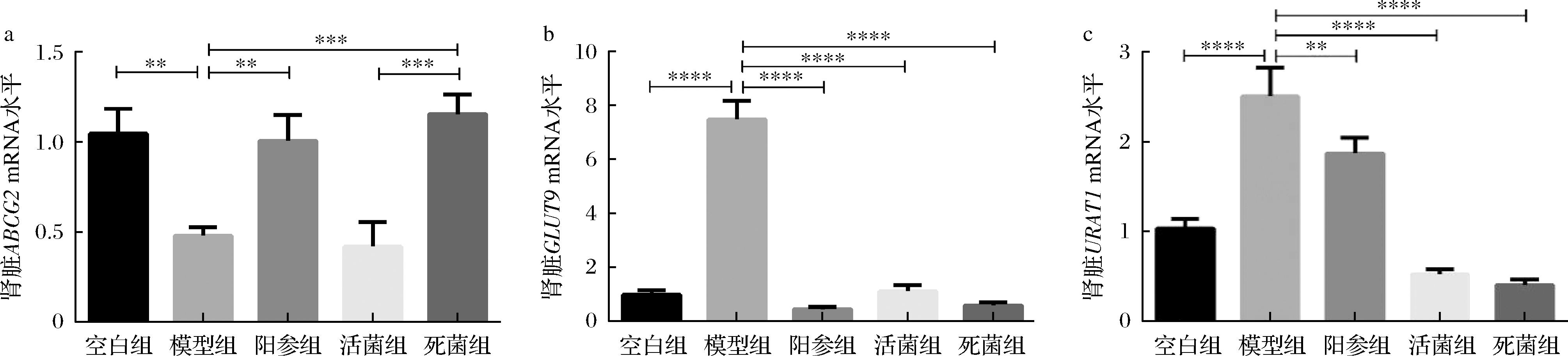
a-肾脏ABCG2表达水平;b-肾脏GLUT9表达水平;c-肾脏URAT1表达水平
图5 小鼠肾脏转运蛋白表达水平
Fig.5 Expression levels of kidney transporters in mice
2.5 格氏乳杆菌对小鼠肾脏炎症小体和炎症因子表达的影响
HUA已被证明与炎症密切相关。如图6-a~图6-c所示,在小鼠肾脏组织中,炎症小体NLRP3、ASC和Caspase1基因表达较空白组显著增强(P<0.001),促炎因子IL-1β、IL-6和TNF-α的基因表达较空白组显著提高(P<0.01)。与模型组相比,阳参组、活菌组和死菌组分别降低了小鼠肾脏中NLRP3(33.66%、32.68%和47.06%)、ASC(64.65%、14.33%和55.81%)和Caspase1(72.55%、38.41%和77.10%)的基因表达。其中,死菌组对ASC和Caspase1基因下调能力显著优于活菌组(P<0.001)。与模型组相比,阳参组、活菌组和死菌组显著降低了小鼠肾脏中IL-1β(75.78%、67.43%和72.86%)、IL-6(21.07%、67.43%和72.16%)和TNF-α(40.98%、50.50%和51.88%)的基因表达。表明格氏乳杆菌CCFM1346通过抑制TXNIP/NLRP3信号通路,降低炎症小体NLRP3、ASC和Caspase-1以及肾脏炎症因子IL-1β、IL-6和TNF-α的mRNA表达,从而改善肾脏炎症。

a-肾脏炎症小体NLRP3表达水平;b-肾脏炎症小体ASC表达水平;c-肾脏炎症小体Caspase1表达水平;d-肾脏炎症因子IL-1β表达水平;e-肾脏炎症因子IL-6表达水平;f-肾脏炎症因子TNF-α表达水平
图6 小鼠肾脏炎症小体和炎症因子表达
Fig.6 Expression of inflammasome and inflammatory factors in mice kidney
3 结论
氧嗪酸钾可竞争性抑制尿酸酶的活性,从而阻碍尿酸分解,升高小鼠体内尿酸水平。采用口服强饲法给予氧嗪酸钾持续3周,建立HUA模型[10]。本研究中模型组小鼠血清尿酸水平显著升高,肝脏XOD水平显著升高,说明造模成功,具有参考价值。
HUA发生的主要原因是尿酸在肝脏合成过多和在肾脏(2/3)及肠道(1/3)中排泄减少[11]。其中,XOD是尿酸分解代谢中重要的酶,催化次黄嘌呤转变成黄嘌呤,最终生成UA[12]。梁圆等[13]发现抑制XOD活性能够显著降低小鼠UA水平。本研究结果显示,格氏乳杆菌活菌和死菌显著降低血清尿酸水平,抑制肝脏中的黄嘌呤氧化酶以及促进尿酸氧化酶活性,并且死细菌对XOD抑制活性表现出额外的有益作用。
UA在肾脏和肠道中的排泄取决于各种尿酸转运蛋白,包括重吸收交换蛋白URAT1、GLUT9和排泄转运蛋白ABCG2[14]。WANG等[14]研究表明,通过下调尿酸重吸收交换蛋白URAT1和GLUT9的表达,可以有效促进HUA小鼠尿酸排泄,这与本研究的结果一致。本研究发现,死菌组小鼠尿液中尿酸排泄水平显著提高,这与肾脏重吸收交换蛋白URAT1和GLUT9下调,以及尿酸排泄蛋白ABCG2上调有关。
高于生理浓度的尿酸主要以晶体形式沉积在机体组织或器官中,诱导体内炎症,刺激炎症小体激活,产生IL-1β、TNF-α等炎症因子[15]。研究表明,NLRP3炎症小体可以作为治疗HUA相关肾脏炎症的治疗靶点[16]。本研究结果亦显示,格氏乳杆菌活菌和死菌都可以抑制TXNIP/NLRP3信号通路,降低炎症小体ASC、Caspase-1以及肾脏炎症因子(IL-1β、IL-6和TNF-α)的mRNA表达,改善了肾脏炎症,推测格氏乳杆菌CCFM1346可能通过产生一些代谢产物或某些细胞成分进入循环系统对HUA表现出额外的有益作用。
综上所述,格氏乳杆菌CCFM1346活菌和死菌可以抑制XOD活性减少尿酸的产生;降低URAT1和GLUT9的表达来抑制尿酸的重吸收;增强ABCG2的表达以及肝脏UOX活性来促进UA排泄。此外,活菌和死菌可降低肾脏炎症小体和促炎因子的表达,缓解肾脏炎症。这些发现表明,格氏乳杆菌CCFM1346活菌和死菌可以调节尿酸代谢,并且有效缓解肾脏炎症。
[1] RODDY E, ZHANG W Y, DOHERTY M.The changing epidemiology of gout[J].Nature Clinical Practice.Rheumatology, 2007, 3(8):443-449.
[2] ZHU Y Y, PANDYA B J, CHOI H K.Prevalence of gout and hyperuricemia in the US general population:The national health and nutrition examination survey 2007-2008[J].Arthritis and Rheumatism, 2011, 63(10):3136-3141.
[3] HAO S J, ZHANG C L, SONG H Y.Natural products improving hyperuricemia with hepatorenal dual effects[J].Evidence-Based Complementary and Alternative Medicine, 2016, 2016:7390504.
[4] PASCART T, RICHETTE P.Investigational drugs for hyperuricemia, an update on recent developments[J].Expert Opinion on Investigational Drugs, 2018, 27(5):437-444.
[5] 刘银辉, 李明, 段丽丽, 等.肠道菌群失调与高尿酸血症关系的研究进展[J].中国微生态学杂志, 2023, 35(2):229-233.LIU Y H, LI M, DUAN L L, et al.Dysbiosis of gut microbiota in hyperuricemia:Research progress[J].Chinese Journal of Microecology, 2023, 35(2):229-233.
[6] LI D P, ZHANG M H, TENG ZHU LA A L, et al.Quercetin-enriched Lactobacillus aviarius alleviates hyperuricemia by hydrolase-mediated degradation of purine nucleosides[J].Pharmacological Research, 2023, 196:106928.
[7] WANG H N, MEI L, DENG Y, et al.Lactobacillus brevis DM9218 ameliorates fructose-induced hyperuricemia through inosine degradation and manipulation of intestinal dysbiosis[J].Nutrition, 2019, 62:63-73.
[8] NI C X, LI X, WANG L L, et al.Lactic acid bacteria strains relieve hyperuricaemia by suppressing xanthine oxidase activity via a short-chain fatty acid-dependent mechanism[J].Food &Function, 2021, 12(15):7054-7067.
[9] ZHANG L H, LIU J X, JIN T, et al.Live and pasteurized Akkermansia muciniphila attenuate hyperuricemia in mice through modulating uric acid metabolism, inflammation, and gut microbiota[J].Food &Function, 2022, 13(23):12412-12425.
[10] SONG D N, ZHAO H H, WANG L L, et al.Ethanol extract of Sophora Japonica flower bud, an effective potential dietary supplement for the treatment of hyperuricemia[J].Food Bioscience, 2023, 52:102457.
[11] MAIUOLO J, OPPEDISANO F, GRATTERI S, et al.Regulation of uric acid metabolism and excretion[J].International Journal of Cardiology, 2016, 213:8-14.
[12] JANKOWSKA D A, TRAUTWEIN-SCHULT A, CORDES A, et al.A novel enzymatic approach in the production of food with low purine content using Arxula adeninivorans endogenous and recombinant purine degradative enzymes[J].Bioengineered, 2015, 6(1):20-25.
[13] 梁圆, 蔡毅, 朱意麟, 等.桑寄生提取物对黄嘌呤氧化酶抑制活性及对高尿酸症小鼠的降尿酸作用[J].时珍国医国药, 2022, 33(1):75-78.LIANG Y, CAI Y, ZHU Y L, et al.Inhibitory effect of extracts of Taxillus chinensis on xanthine oxidase activities and their uric acid-lowering effect on hyperuricemia in mice[J].Lishizhen Medicine and Materia Medica Research, 2022, 33(1):75-78.
[14] WANG C P, WANG X, ZHANG X, et al.Morin improves urate excretion and kidney function through regulation of renal organic ion transporters in hyperuricemic mice[J].Journal of Pharmacy &Pharmaceutical Sciences, 2010, 13(3):411-427.
[15] JHANG J J, LIN J H, YEN G C.Beneficial properties of phytochemicals on NLRP3 inflammasome-mediated gout and complication[J].Journal of Agricultural and Food Chemistry, 2018, 66(4):765-772.
[16] CUI J, HONG P P, LI Z Z, et al.Chloroquine inhibits NLRP3 inflammasomes activation and alleviates renal fibrosis in mouse model of hyperuricemic nephropathy with aggravation by a high-fat-diet[J].International Immunopharmacology, 2023, 120:110353.