铅(Pb)是一种常见的食物链污染物,对生物体的健康产生不利影响,被认为是严重的重金属污染物[1]。近年来,铅及其化合物被广泛运用于包装、建筑、石化等行业[2],铅可以被呼吸道和消化道的上皮吸收,通过体液循环致神经、免疫、肾脏、肝脏、血液、骨骼等系统或器官产生不可逆的负面影响[3]。2016年,全球约54万死亡案例与铅中毒有关[4],接触铅进而产生不良反应已被确定为全球公共卫生问题。相关研究表明,重金属铅在生物体内破坏氧化剂与抗氧化剂的平衡并引起不同组织的炎症是主要原因[5-6],铅通过活性氧(reactive oxygen species,ROS)的显著增加改变了血液学和生物化学特征,引发肾脏和肝脏损伤,导致组织中的氧化应激。氧化应激被认为是氧化和抗氧化防御系统之间的不平衡,铅会抑制抗氧化酶活性,增加脂质过氧化,对抗氧化系统产生不利影响,诱发活细胞死亡。因此,探究铅中毒过程中生物体的抗氧化指标具有重要意义。
传统的治疗方法通常包括药物治疗,如螯合剂和钙剂[7]等,然而,这些药物可能会产生不良反应,包括肾脏损伤、消化道不适等[8]。寻找安全的膳食补充剂来减轻铅造成的有害影响十分必要。益生菌是活的微生物,已被证明对人类有许多健康益处,包括改善胃肠道紊乱、炎症和氧化应激,以及帮助维持健康的肠道微生物平衡[9]。乳酸菌是一组安全的革兰氏阳性微生物,广泛用于各种发酵食品。乳酸菌也是人体肠道菌群的重要组成部分,具有多种生理功能,包括免疫细胞平衡、代谢产物调节和肠道菌群[10]。植物乳植杆菌是一种重要的乳酸菌,能够在体外和体内结合或螯合各种致癌物质,是一种安全且具有成本效益的干预方法[11-12]。研究表明,植物乳植杆菌能够通过调节小鼠肠道菌群,提高短链脂肪酸的产量减轻苯并芘诱导的毒性作用[13]。植物乳植杆菌Y44能够调节肠道菌群和肠道屏障功能改善D-半乳糖(D-galactose,D-gal)注射诱导的Balb/C小鼠氧化应激反应[14]。总的来说,植物乳植杆菌已经被证明是一种优良的抗氧化保护剂。然而,其对重金属铅中毒的缓解效果尚不清楚,因此探究植物乳植杆菌对铅中毒的保护作用十分必要。
本研究以醋酸铅水溶液灌胃的小鼠作为模型,植物乳植杆菌CCFM8661为研究对象,通过抗氧化指标、组织病理学及组织含铅量综合评估其对重金属铅中毒的缓解作用。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性6周龄BALB/c小鼠,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006;植物乳植杆菌CCFM8661菌粉,微康生物科技有限公司;醋酸铅(分析纯),上海沪试化工有限公司;超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、总抗氧化能力 (total antioxidant capacity,T-AOC)检测试剂盒、苏木素伊红(hematoxylineosin,HE)染色试剂盒,北京诚林生物科技有限公司。
1.2 仪器与设备
Infinite M NANO TECAN酶标仪,南京深华公司;CPA225D电子分析天平,美国Sartorius公司;Centrifuge5702 RH-低速离心机,德国Eppendorf公司;SW-CJ-1FD 超净工作台,苏州安泰空气技术有限公司;Hula Dan-cer basic漩涡振荡器,德国IKA公司;Milli-QEQ 7000超纯水机,法国Millipore公司;UV-4802紫外可见分光光度计,尤尼柯仪器有限公司;GI54DW高压灭菌锅,美国Zealway公司;DHG-9003电热恒温鼓风干燥箱,上海一恒科技有限公司;NU-9483E超低温冰箱,美国Nuaire公司;切片机、展片机、摊片机,徕卡显微系统上海贸易有限公司。
1.3 实验方法
1.3.1 动物分组与饲养
60只BALB/c小鼠饲养于动物房中,温度22 ℃,湿度10%~60%,12 h明暗交替照明,由标准饲料喂养,适应性喂养1周,自由饮水。适应性喂养1周后,将实验动物随机分成5组,每组12只,即对照组(NC)、模型组(MC)、CCFM8661低剂量组(LP)、CCFM8661中剂量组(MP)、CCFM8661高剂量组(HP)。实验期间,在模型对照组、受试样品各剂量组饮用醋酸铅水溶液(质量浓度为1 g/L)的同时,各剂量组灌胃给予受试样品,灌胃剂量是参考HU等[15]的方法,并略做修改。其中正常对照组小鼠灌胃等体积的生理盐水,受试样品给予时间4周(具体分组见表1)。实验结束,进行麻醉,腹动脉放血处死,收集血液、肝脏等组织器官,置于-80 ℃冰箱保存备后续使用,尸体无害化统一处理。本研究经过东北农业大学实验动物伦理委员会的批准,伦理审批号为NEAUEC20230423。
表1 小鼠实验分组
Table 1 Experimental grouping of mice
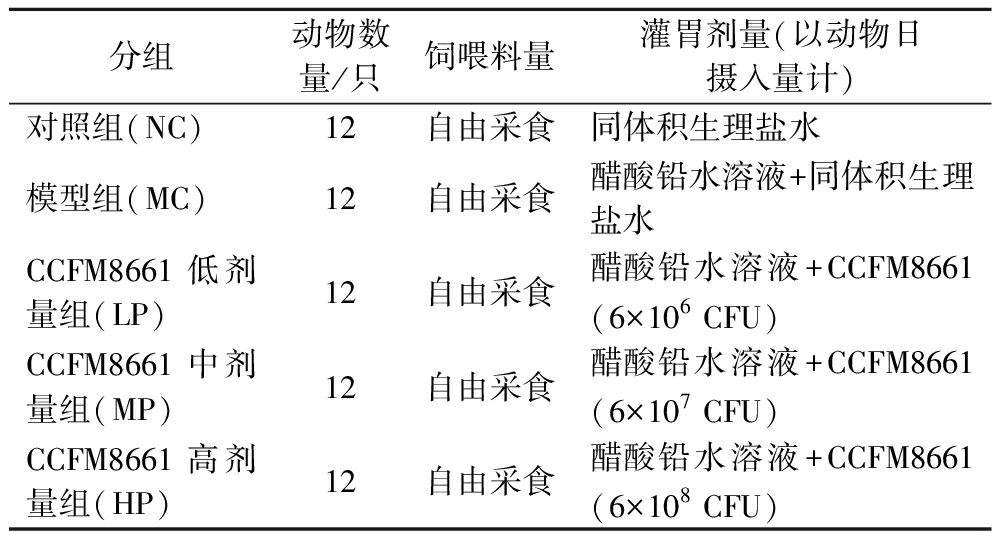
分组动物数量/只饲喂料量灌胃剂量(以动物日摄入量计)对照组(NC)12自由采食同体积生理盐水模型组(MC)12自由采食醋酸铅水溶液+同体积生理盐水CCFM8661低剂量组(LP)12自由采食醋酸铅水溶液+CCFM8661(6×106 CFU)CCFM8661中剂量组(MP)12自由采食醋酸铅水溶液+CCFM8661(6×107 CFU)CCFM8661高剂量组(HP)12自由采食醋酸铅水溶液+CCFM8661(6×108 CFU)
1.3.2 体重变化
动物初始体重、实验结束时空腹体重,干预期内每周测1次空腹体重。
1.3.3 抗氧化指标
严格按照说明书要求进行酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测SOD、CAT、MDA、T-AOC的含量。
1.3.4 组织病理学
将肝脏、肾脏保存在100 g/L的生理盐水中,所有组织标本都经过处理并用H&E染色,然后进行显微镜检查,并在显微镜装置中由相机拍摄,观察病理结构。
1.3.5 铅含量的测定
于末次给予动物受试样品24 h后,称量动物体重。放血并处死动物,取适量血、肝、股骨样品,硝化后使用石墨炉原子吸收分光光度计测定铅含量。
1.4 数据处理
采用SPSS 26.0软件对试验数据进行统计分析,实验数据以“平均数±标准差(x±SD)”表示,应用单因素方差分析进行多组数据之间的比较,P<0.05为差异显著。采用GraphPad Prism 8.0软件对数据分析并绘制图表。
2 结果与分析
2.1 植物乳植杆菌CCFM8661对小鼠体重的影响
小鼠体重变化如表2所示,适应期结束后进行随机分组,所有组别小鼠未显示出体重差异。实验结束后最后一次测量,与空白组相比,模型组的体重显著下降(P<0.001)。与模型组相比,CCFM8661低剂量(6×106 CFU)的补充并没有影响小鼠的体重(P>0.05),值得注意的是,CCFM8661中、高剂量(6×107 CFU~6×108 CFU)的补充显著增加了小鼠体重(P<0.01)。以上数据表明,本研究建模方法是可行的,且植物乳植杆菌对铅中毒小鼠的体重恢复有积极影响。
表2 不同剂量的植物乳杆植菌CCFM8661对小鼠体重的影响 单位:g
Table 2 Effect of different doses of Lactiplantibacillus plantarum CCFM8661 on body weight of mice
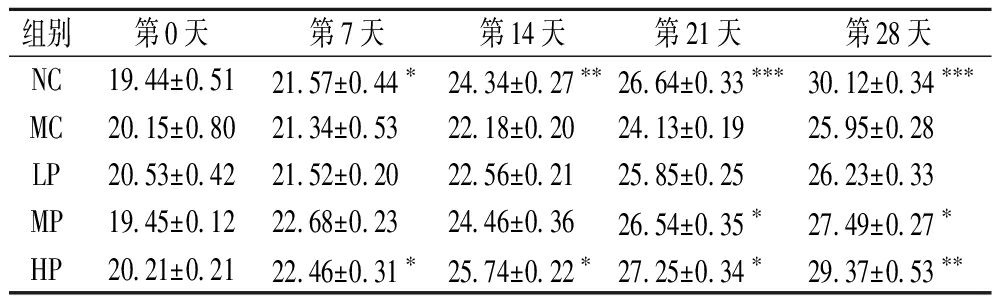
组别第0天第7天第14天第21天第28天NC19.44±0.5121.57±0.44∗24.34±0.27∗∗26.64±0.33∗∗∗30.12±0.34∗∗∗MC20.15±0.8021.34±0.5322.18±0.2024.13±0.1925.95±0.28LP20.53±0.4221.52±0.2022.56±0.2125.85±0.2526.23±0.33MP19.45±0.1222.68±0.2324.46±0.3626.54±0.35∗27.49±0.27∗HP20.21±0.2122.46±0.31∗25.74±0.22∗27.25±0.34∗29.37±0.53∗∗
注:*表示与模型组比,P<0.05;**表示与模型组比,P<0.01;***表示与模型组比,P<0.001。
2.2 植物乳植杆菌CCFM8661对小鼠抗氧化能力的影响
为了评价植物乳植杆菌CCFM8661对铅中毒所引发的氧化应激的保护作用,使用酶联免疫反应检测了肝脏和肾脏组织的抗氧化能力。SOD、CAT、T-AOC和MDA是常用的抗氧化评价指标,SOD是清除自由基的重要酶类,CAT主要清除过氧化氢,T-AOC综合考量了多种抗氧化物质的总体活性,MDA是脂质过氧化产物的代表,可以反映细胞膜的氧化损伤程度[16],这些指标可以全面、客观地评估机体内的抗氧化能力以及氧化损伤程度。在肝脏组织中,模型组的SOD、CAT和T-AOC较空白组均显著降低,MDA水平显著提高(图1-a~图1-d,P<0.01),这说明重金属Pb的摄入严重降低了肝脏组织中的抗氧化能力。与模型组相比,补充植物乳植杆菌CCFM8661中、高剂量的小鼠显著提高了SOD、CAT和T-AOC的水平(P<0.05),降低了MDA的水平(P<0.01),并且这种抗氧化水平的能力随剂量增加而增加,说明补充植物乳植杆菌CCFM8661能够缓解Pb中毒引发的氧化应激反应。在肾脏组织中,表现出与肝脏组织相似的结果,重金属Pb引发了肾脏组织内的氧化应激反应,表现为SOD、CAT和T-AOC水平的显著下降与MDA的显著提高,而植物乳植杆菌CCFM8661中、高剂量的补充改善了这种高应激水平(图2-a~图2-d,P<0.01)。
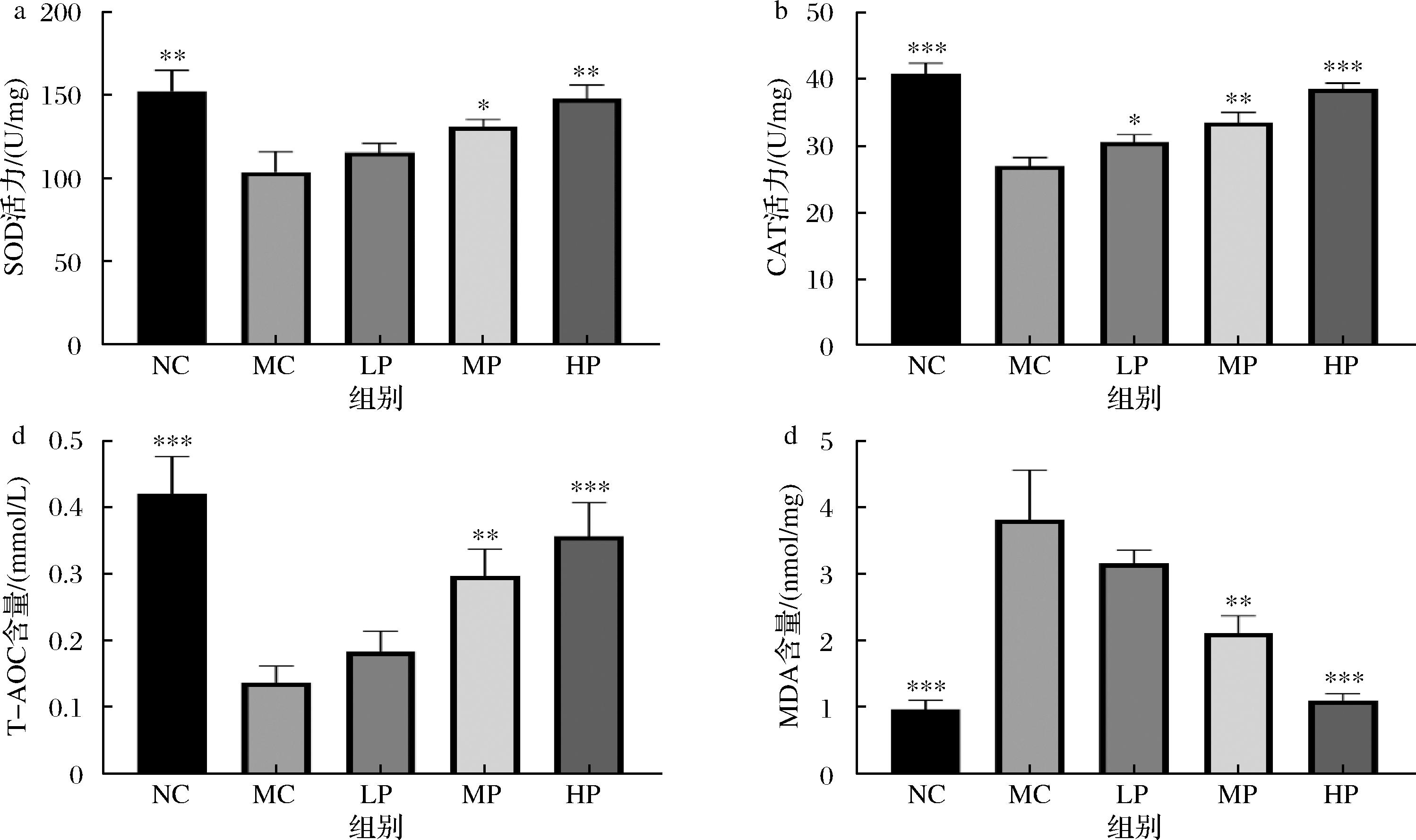
a-SOD;b-CAT;c-T-AOC;d-MDA
图1 不同剂量的植物乳植杆菌CCFM8661对小鼠肝脏组织抗氧化能力的影响
Fig.1 Effect of different doses of L. plantarum CCFM8661 on the antioxidant capacity of mouse liver tissue
注:ns表示与模型无显著差异,P>0.05;*表示与模型组比,P<0.05;**表示与模型组比,P<0.01;***表示与模型组比,P<0.001(下同)。
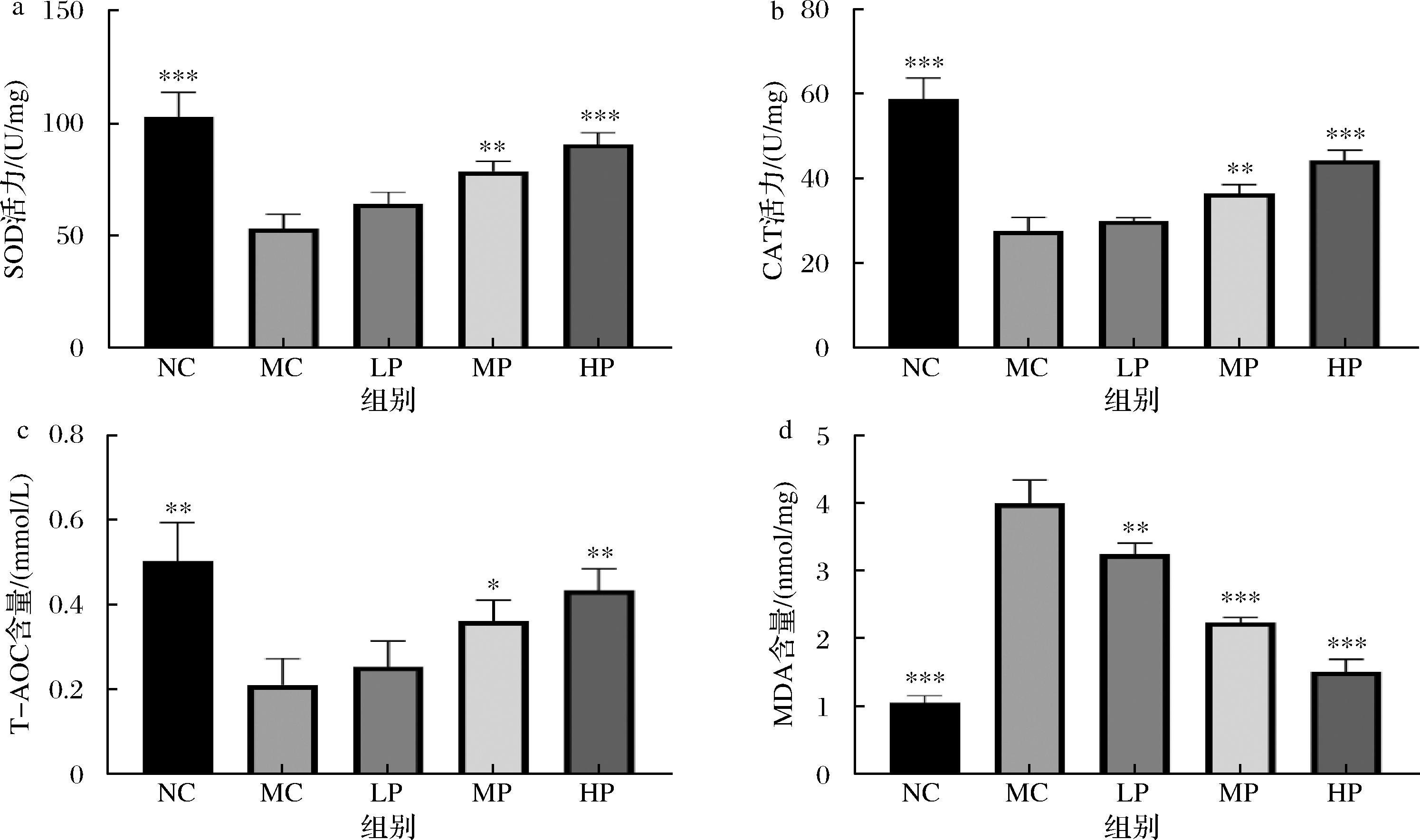
a-SOD;b-CAT;c-T-AOC;d-MDA
图2 不同剂量的植物乳植杆菌CCFM8661对小鼠肾脏组织抗氧化能力的影响
Fig.2 Effect of different doses of L. plantarum CCFM8661 on the antioxidant capacity of mouse kidney tissues
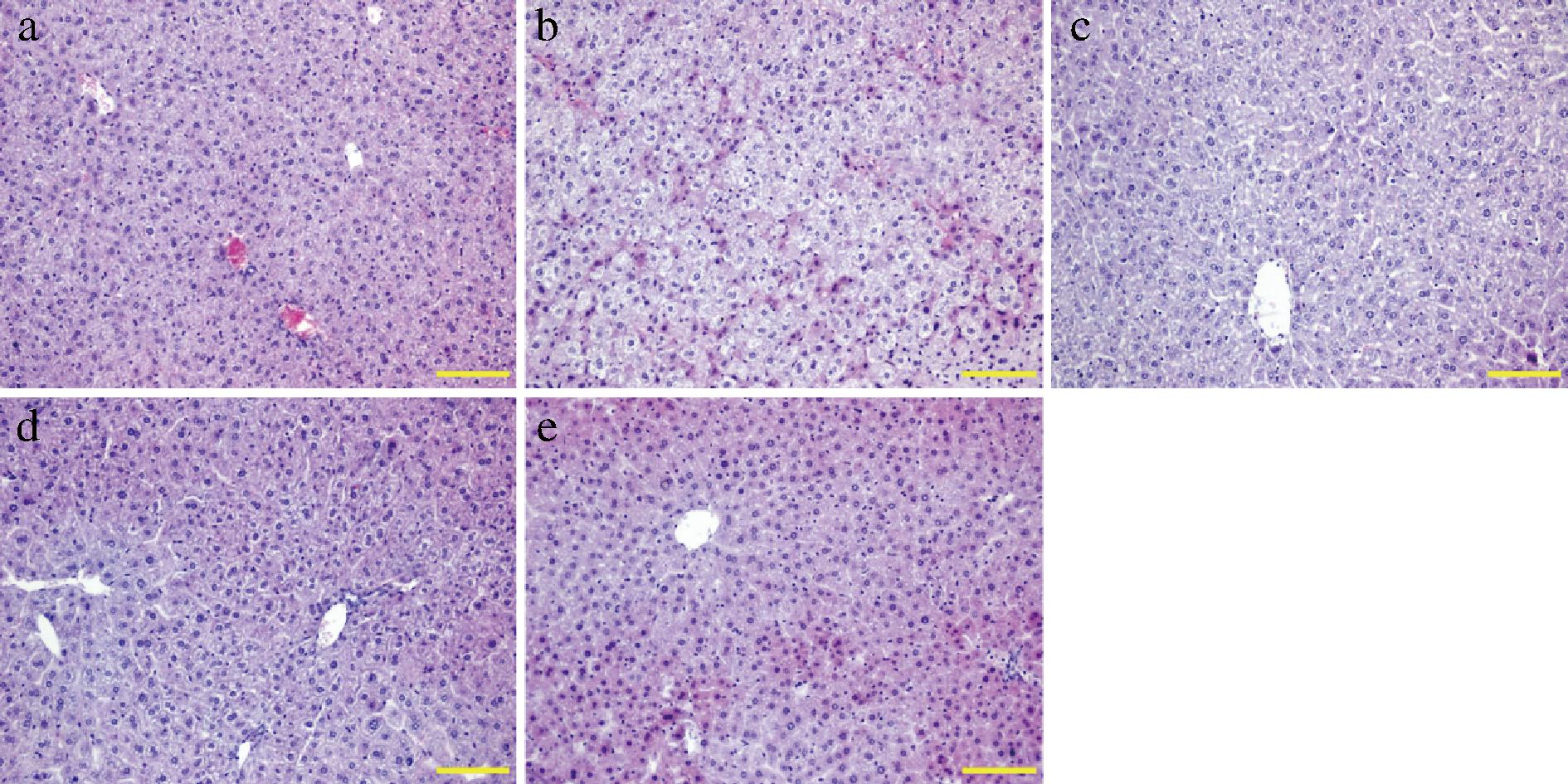
a-空白组;b-模型组;c-低剂量组;d-中剂量组;e-高剂量组
图3 不同剂量植物乳植杆菌CCFM8661对小鼠肝脏组织病理学分析
Fig.3 Histopathological analysis of mouse hepatic by different doses of L. plantarum CCFM8661
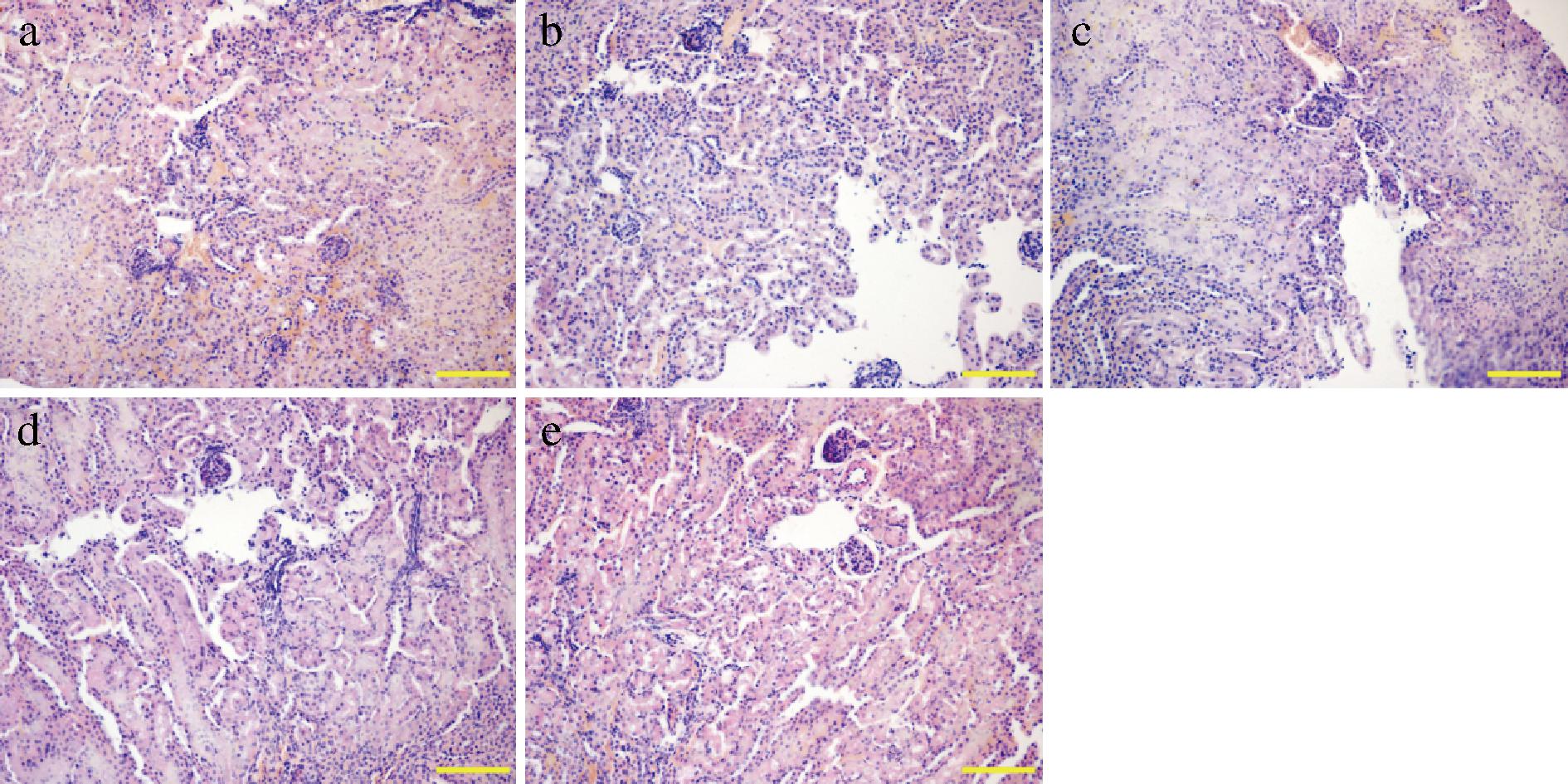
a-空白组;b-模型组;c-低剂量组;d-中剂量组;e-高剂量组
图4 不同剂量植物乳植杆菌CCFM8661对小鼠肾脏组织病理学分析
Fig.4 Histopathological analysis of mouse kidney by different doses of L. plantarum CCFM8661
2.3 组织病理学分析
图3显示了肝脏组织HE染色情况,对照组小鼠肝脏组织细胞总体上排列规律,肝细胞大小均匀,细胞结构和细胞边界完整。与空白对照组比较,模型组小鼠肝细胞发生颗粒变性,细胞体肿胀,少量的肝细胞胞核固缩、破裂或溶解,胞质疏松,四周可见少许炎性细胞浸润现象。值得注意的是,在植物乳植杆菌CCFM88661干预后,肝脏组织病理状况都得剂量依赖性的改善。
肾脏病理变化主要在肾小管、肾小球、肾小囊等皮质区域。如图4所示,对照组肾脏组织形态正常。模型组中出现少量炎性细胞浸润,肾小球充血且体积明显变大,肾小囊狭窄,有少量肾小球重度充血,肾小管上皮细胞肿胀的现象。与模型组相比,所有实验组的症状,包括炎性细胞、肿胀的肾小管上皮细胞和颗粒变性以及肾小球充血都得到了一定程度的改善。
2.4 植物乳植杆菌CCFM8661对小鼠血、肝、股骨组织含Pb量的影响
组织中含Pb量的测定能直接反应小鼠体内的Pb中毒情况,血液可迅速反映Pb中毒的早期阶段,肝脏可反映Pb代谢和清除能力,骨中的Pb含量则反映了长期Pb积累的情况[17],本研究检测了小鼠血、肝以及股骨组织中的含Pb量,结果如图5所示。在血、肝以及股骨中,与空白组相比,模型组的含Pb量显著高于空白组,差异呈极显著水平(P<0.001),这表明,本研究的建模方法是有效的。在补充不同剂量的植物乳植杆菌CCFM8661后,所有不同剂量的组别均显示出降低血、肝以及股骨中的含Pb量水平,高剂量摄入的降低效果最显著。
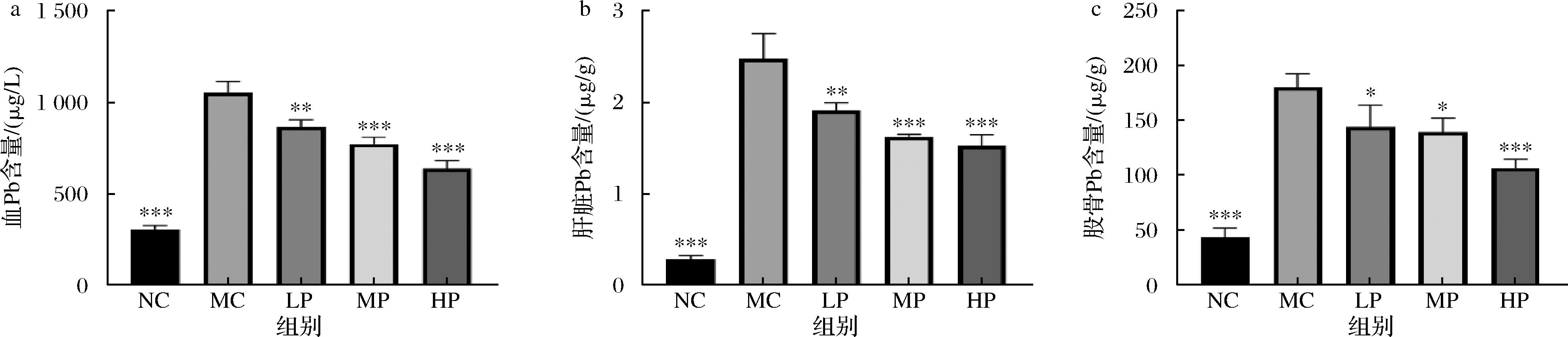
a-血Pb含量;b-肝脏Pb含量;c-股骨Pb含量
图5 不同剂量植物乳植杆菌CCFM8661对小鼠血、肝、股骨组织含Pb量的影响
Fig.5 Effect of different doses of L. plantarum CCFM8661 on lead content in blood, liver, and femur tissues of mice
3 讨论
Pb是工业产品中含量丰富的重金属,会对宿主的健康产生不良影响[18]。中国、印度和泰国等发展中国家在过去10年中面临着严重的Pb暴露问题。Pb一旦在宿主体内蓄积,就很难排出体外,从而对肝脏、肾脏等组织产生毒性作用,引起炎症、自噬、细胞坏死、凋亡,最终引起肝脏疾病[19]。肝脏是最重要的解毒器官,一旦受损,会引发多种代谢性疾病。越来越多的证据表明,益生菌可以在生物体内促进重金属Pb排泄,缓解Pb中毒带来的氧化应激反应[20]。本研究为植物乳植杆菌CCFM8661缓解小鼠Pb中毒毒性提供了理论基础。
为了模拟Pb中毒带来的毒性作用,通过醋酸铅水溶液灌胃小鼠来建立Pb中毒模型,灌胃浓度是根据污染地区的平均人类Pb摄入量,并根据体表面积转化法选择的。体重是评价生物体健康的重要因素,在整个实验过程中,模型组体重的平均值为所有组别中最低的组别,在实验结束后,其与空白组相比显著降低,这表明所构建的Pb中毒模型是有效的。
本研究重点关注了Pb中毒过程中,生物体内的氧化应激水平。氧化应激是指在细胞内外产生过量的活性氧化物(如·O2-、H2O2等),这些物质可以损伤细胞内的脂质、蛋白质和核酸等重要分子[21]。氧化应激会导致细胞膜的脂质过氧化、蛋白质的氧化和DNA的损伤,从而引发细胞损伤、炎症、衰老以及多种慢性疾病的发展[22]。许多研究表明,Pb中毒会增加氧化应激的程度,而氧化应激则可能加剧Pb中毒引发的损伤。向大鼠灌胃乙酸铅诱导了肝组织氧化应激反应,Pb还可以通过调节细胞凋亡相关基因的表达来影响Leydig细胞的增殖。过量的Pb也会对间质细胞造成氧化应激,并激活NRF2途径以改善细胞抗氧化状态[23]。在本研究中,发现使用植物乳植杆菌CCFM8661能够缓解Pb中毒所带来的高氧化应激水平,并直接降低血液、肝脏及股骨中的含Pb量。XU等[24]发现,乳酸菌能够降低组织和血液中Pb浓度、改善抗氧化保护机制的酶促作用和缓解氧化创伤方面的特性,这与本实验结果一致。导致这种结果的原因可能是因为在肠道中,菌株与重金属Pb结合,降低其代谢能力,从而减轻其毒性作用。ZHANG等[25]最近的工作表明,发酵乳杆菌HNU312能够在体外发挥对Pb的吸附性,并具有良好的耐受性,通过体内实验表明益生菌能够减轻Pb摄入对大脑的毒性。本研究的局限性在于未能研究植物乳植杆菌CCFM8661缓解Pb中毒小鼠毒性作用的内在机制,未来需进一步通过基因组学与代谢组学联用分析研究植物乳植杆菌CCFM8661对肠道菌群及其代谢物的影响,进而明确其缓解Pb中毒小鼠毒性作用机制。
4 结论
本研究表明补充植物乳植杆菌CCFM8661可以逆转Pb中毒小鼠带来的体重抑制效果,提高肝脏和肾脏组织中SOD、CAT与T-AOC水平,降低MDA水平,改善Pb中毒小鼠的氧化应激反应,缓解肝脏及肾脏的组织病理变化,降低血、肝脏和股骨中的含Pb量。本研究对开发针对慢性Pb中毒的益生菌治疗方法提供了理论依据。
[1] RIASATIAN M, MAZLOOMI S M, AHMADI A, et al.Benefits of fermented synbiotic soymilk containing Lactobacillus acidophilus, Bifidobacterium lactis, and inulin towards lead toxicity alleviation[J].Heliyon, 2023, 9(6):e17518.
[2] SHUKLA V, SHUKLA P, TIWARI A.Lead poisoning [J].Indian Journal of Medical Specialities, 2018, 9(3):146-149.
[3] BHATTACHARYA S.Probiotics against alleviation of lead toxicity:Recent advances[J].Interdisciplinary Toxicology, 2019, 12(2):89-92.
[4] MU Y, YU J Q, JI W H, et al.Alleviation of Pb2+ pollution-induced oxidative stress and toxicity in microglial cells and zebrafish larvae by chicoric acid[J].Ecotoxicology and Environmental Safety, 2019, 180:396-402.
[5] LIU K S, HAO J H, ZENG Y, et al.Neurotoxicity and biomarkers of lead exposure:A review[J].Chinese Medical Sciences Journal, 2013, 28(3):178-188.
[6] TINKOV A A, GRITSENKO V A, SKALNAYA M G, et al.Gut as a target for cadmium toxicity[J].Environmental Pollution, 2018, 235:429-434.
[7] MARKOWITZ M E, SINNETT M, ROSEN J F.A randomized trial of calcium supplementation for childhood lead poisoning[J].Pediatrics, 2004, 113(1):34-39.
[8] WALTER K.What is lead poisoning?[J].JAMA, 2023, 329(12):1040.
[9] MUHAMMAD Z, RAMZAN R, ZHANG R F, et al.Assessment of in vitro and in vivo bioremediation potentials of orally supplemented free and microencapsulated Lactobacillus acidophilus KLDS strains to mitigate the chronic lead toxicity[J].Frontiers in Bioengineering and Biotechnology, 2021, 9:698349.
[10] SEDDIK H A, BENDALI F, GANCEL F, et al.Lactobacillus plantarum and its probiotic and food potentialities[J].Probiotics and Antimicrobial Proteins, 2017, 9(2):111-122.
[11] LIU Y W, LIONG M T, TSAI Y C.New perspectives of Lactobacillus plantarum as a probiotic:The gut-heart-brain axis[J].Journal of Microbiology, 2018, 56(9):601-613.
[12] 张亮, 于哲, 张慧敏, 等.具有吸附重金属铅能力乳酸菌的安全性评价[J].中国乳品工业, 2022, 50(6):33-38.ZHANG L, YU Z, ZHANG H M, et al.Safety evaluation of lactic acid bacteria capable of adsorbing heavy metal lead[J].China Dairy Industry, 2022, 50(6):33-38.
[13] YU L L, ZHANG L Y, DUAN H, et al.The protection of Lactiplantibacillus plantarum CCFM8661 against benzopyrene-induced toxicity via regulation of the gut microbiota[J].Frontiers in Immunology, 2021, 12:736129.
[14] GAO Y, LIU Y J, MA F L, et al.Lactobacillus plantarum Y44 alleviates oxidative stress by regulating gut microbiota and colonic barrier function in Balb/C mice with subcutaneous d-galactose injection[J].Food &Function, 2021, 12(1):373-386.
[15] HU L H, ZHAO Y, YOU T, et al.Lactiplantibacillus plantarum P101 alleviated lead-induced more severe hepatic injury in obese mice, by promoting fecal lead excretion and enhancing antioxidative defense system[J].Journal of Applied Microbiology, 2023, 134(4):lxad061.
[16] HALLIWELL B.Understanding mechanisms of antioxidant action in health and disease[J].Nature Reviews.Molecular Cell Biology, 2024, 25(1):13-33.
[17] KLOTZ K, GÖEN T.6.human biomonitoring of lead exposure[M].Metal Ions in Life Sciences, 2017:17.
[18] REHMAN K, FATIMA F, WAHEED I, et al.Prevalence of exposure of heavy metals and their impact on health consequences[J].Journal of Cellular Biochemistry, 2018, 119(1):157-184.
[19] FU Z S, XI S H.The effects of heavy metals on human metabolism[J].Toxicology Mechanisms and Methods, 2020, 30(3):167-176.
[20] LI Y T, LIU A F, CHEN L X, et al.Lactobacillus plantarum WSJ-06 alleviates neurobehavioral injury induced by lead in mice through the gut microbiota[J].Food and Chemical Toxicology, 2022, 167:113308.
[21] SIES H.Oxidative stress:A concept in redox biology and medicine[J].Redox Biology, 2015, 4:180-183.
[22] SIES H.Hydrogen peroxide as a central redox signaling molecule in physiological oxidative stress:Oxidative eustress[J].Redox Biology, 2017, 11:613-619.
[23] SHI L, WANG X L, DUAN Y L, et al.Antagonistic effects of selenium on lead-induced oxidative stress and apoptosis of Leydig cells in sheep[J].Theriogenology, 2022, 185:43-49.
[24] XU X W, LIU S J, ZHAO Y, et al.Combination of Houttuynia cordata polysaccharide and Lactiplantibacillus plantarum P101 alleviates acute liver injury by regulating gut microbiota in mice[J].Journal of the Science of Food and Agriculture, 2022, 102(15):6848-6857.
[25] ZHANG Z, LI J H, JIANG S M, et al.Lactobacillus fermentum HNU312 alleviated oxidative damage and behavioural abnormalities during brain development in early life induced by chronic lead exposure[J].Ecotoxicology and Environmental Safety, 2023, 251:114543.