保宁醋是中国传统的酸性调味品,距今已有三四百年历史,是四川麸醋的典型代表,并且是四大名醋中唯一的药醋,因其独特的风味和口感而深受广大消费者喜爱[1-2]。
中药醋曲传承古法制曲工艺,是保宁醋的一大特色。其采用麸皮、玉米、大米、小麦等为原料,并添加砂仁、川芎、杜仲、甘草等20余种药食同源的中草药,原料经粉碎后,加水拌料、压制成“曲块”,经自然固态发酵成熟(约50 d)后投产使用[3-5]。传统食醋大曲在制作过程中会引入原料、环境以及器具中的微生物,微生物菌系复杂[6-8]。不同的大曲可能存在独特的微生物菌群,并作为其生物标记物有利于形成食醋独特的风味[9]。对于食醋大曲微生物菌群的探究多集中在陕西岐山醋、山西老陈醋和天津独流醋等[10-14],而针对理化指标与微生物菌群关联性的研究仅限于岐山醋大曲[11]。
目前,针对保宁醋中药醋曲的研究主要集中于功能菌株筛选和发酵过程中理化指标的测定,处于探索阶段[2,7,15-16]。本研究以保宁醋中药醋曲为研究对象,对不同季节成品曲的微生物菌群和理化指标进行分析,确定中药醋曲的独特生物标记物,阐明醋曲的理化指标与微生物菌群的关联性,为优化保宁醋中药醋曲制曲工艺提供数据基础。
1 材料与方法
1.1 材料
1.1.1 不同季节中药醋曲样品
采样地点:四川保宁醋有限公司制曲车间。
采样时间:冬季:2019年1月;春季:2019年4月;夏季:2019年8月;秋季:2019年11月。
1.1.2 主要试剂
NaOH、邻苯二甲酸氢钾、酚酞、盐酸、KI、碘、乙酸铅、Na2SO4、CuSO4·5H2O、亚甲蓝等均为国产分析纯,成都浩搏优科技有限公司。
DL-15000 DNA Marker、DL-2000 DNA Marker、Megabase 琼脂糖、Taq PCR MasterMix、GoldviewTM核酸染料,上海生工生物工程股份有限公司;引物合成,成都擎科梓熙生物技术有限公司;OMEGA Soil DNA Kit,成都欣亿维生物科技有限公司。
1.1.3 仪器与设备
C1000 Thermal Cycler PCR仪、Gel Doc XR+凝胶成像系统,美国Bio-Rad公司;Milli-Q Gradient超纯水仪,美国Millipore公司;1300 Series A2生物安全柜,美国Thermo Fisher Scientific公司。
1.2 试验方法
1.2.1 样品采集
在春季、夏季、秋季、冬季分别收集保宁醋“中药醋曲”成品曲样品于无菌均质袋中(分别标记为CC、XC、QC、DC),每个季节收集3份平行样品,收集完后装入泡沫箱,于低温状态下24 h内运回实验室进行处理。
1.2.2 中药醋曲的微生物菌群分析
1.2.2.1 总DNA的提取
采用OMEGA Soil DNA Kit进行中药醋曲样品DNA的提取(将3个平行样本分别提取DNA后混合备用),将提取好的DNA对应做好标记,置于有干冰的泡沫盒中低温下送上海派森诺生物技术公司进行高通量测序分析。
1.2.2.2 微生物菌群多样性解析
采用Nanodrop对DNA进行定量,并通过12 g/L琼脂糖凝胶电泳检测DNA提取质量。分别对细菌的16S rDNA V3~V4区(338F:ACTCCTAC-GGGAGGCAGCA;806R:GGACTACHVGGGTWTCTAAT)和真菌的ITS1区(ITS5F:GGAAGTAAAAGTCGTAACAAGG;ITS1R:GCTGCGTTCTTCATCGATGC)进行PCR扩增,然后对扩增产物进行磁珠纯化回收并对回收产物进行荧光定量,对各样本按相应比例进行混合,采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库,构建好的文库在Agilent Bioanalyzer上进行质检并采用Quant-iT PicoGreen dsDNA Assay Kit在Promega QuantiFluor荧光定量系统定量,将合格的文库梯度稀释后按所需测序量相应比例混合,并经NaOH变性为单链进行Illumina NovaSeq双端测序,得到原始下机序列。
1.2.3 理化性质分析
1.2.3.1 水分含量的测定
采用水分快速测定仪进行样品水分含量测定,每份样品重复测定3次。
1.2.3.2 pH值的测定
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》,每份样品重复测定3次。
1.2.3.3 还原糖含量的测定
参照GB/T 5009.7—2016《食品安全国家标准 食品中还原糖的测定》,每份样品重复测定3次。
1.2.3.4 淀粉含量的测定
参照GB/T 5009.9—2016《食品安全国家标准 食品中淀粉的测定》,每份样品重复测定3次。
1.2.3.5 其他指标的测定
糖化力、液化力和酯化力均参照QB/T 4257—2011《酿酒大曲通用分析方法》进行测定,每份样品重复测定3次。
1.2.4 数据处理及分析
高通量数据下机数据通过质量初筛后,将原始序列按照Index和Barcode信息,进行文库和样本划分,并去除Barcode序列;按照QIIME2 dada2分析流程进行序列去噪,选用Greengenes和UNITE数据库对物种进行分类学注释,基于QIIME2软件和R语言对操作分类单位(operational taxonomic unit,OTU)抽平后绘制各样本在门水平和属水平分类水平上的花瓣图或韦恩图以及物种组成柱形图,选取属水平相对丰度前20的物种绘制热图,并对样本(基于欧式距离)及物种(基于Pearson相关性系数)实现双聚类;基于α多样性指数中的Observed otus绘制样品稀疏曲线;对物种数据进行算法降维后采用Bray-Curtis距离绘制热图,进一步重新排序后基于Bray-Curtis距离绘制主坐标分析(principal coordinates analysis,PCoA)二维排序图,以此进行β-多样性分析。
理化数据的平均值和标准偏差采用Excel 2016进行计算,利用Origin 2017和GraphPad Prism 9软件绘图,通过SPSS 25软件进行显著性分析(P<0.05显著,P>0.05不显著)及计算Spearman相关性系数。
2 结果与分析
2.1 不同季节保宁醋中药醋曲微生物菌群分析
2.1.1 稀疏曲线
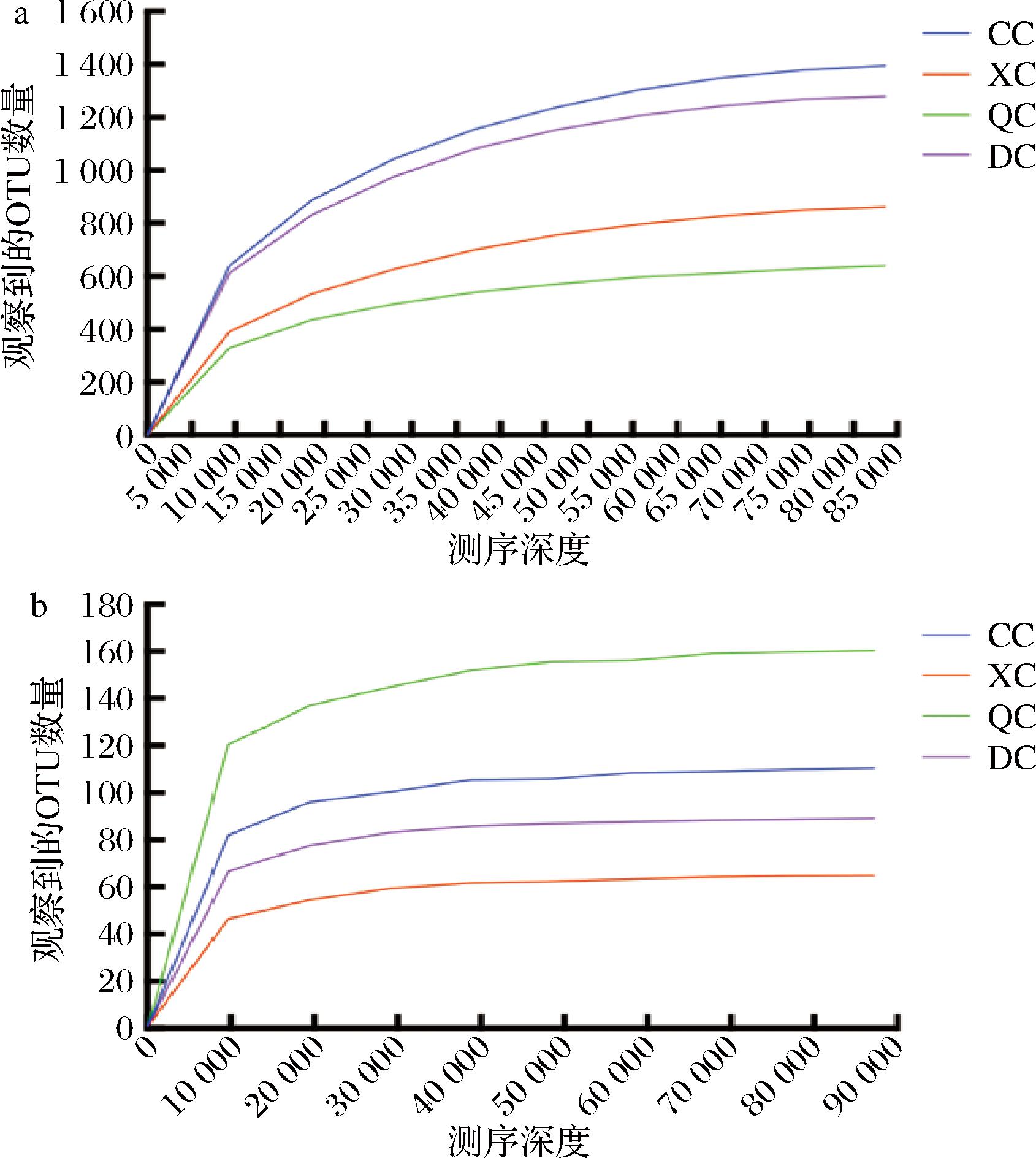
稀疏曲线是指从每个样本中随机抽取一定数量的序列,可以预测样本在一系列测序深度下,可能包含的物种总数及其中每个物种的相对丰度,以此表征测序量是否足够[17-18]。由图1可知,随着测序深度的加大,稀释曲线趋于平坦,表明测序结果足够反映当前样本多样性,继续增加测序深度已无法检测到大量尚未发现的OTU。
a-细菌;b-真菌
图1 Illumina Novaseq sequencing稀疏曲线
Fig.1 Rarefaction curves by Illumina Novaseq sequencing
2.1.2 韦恩图
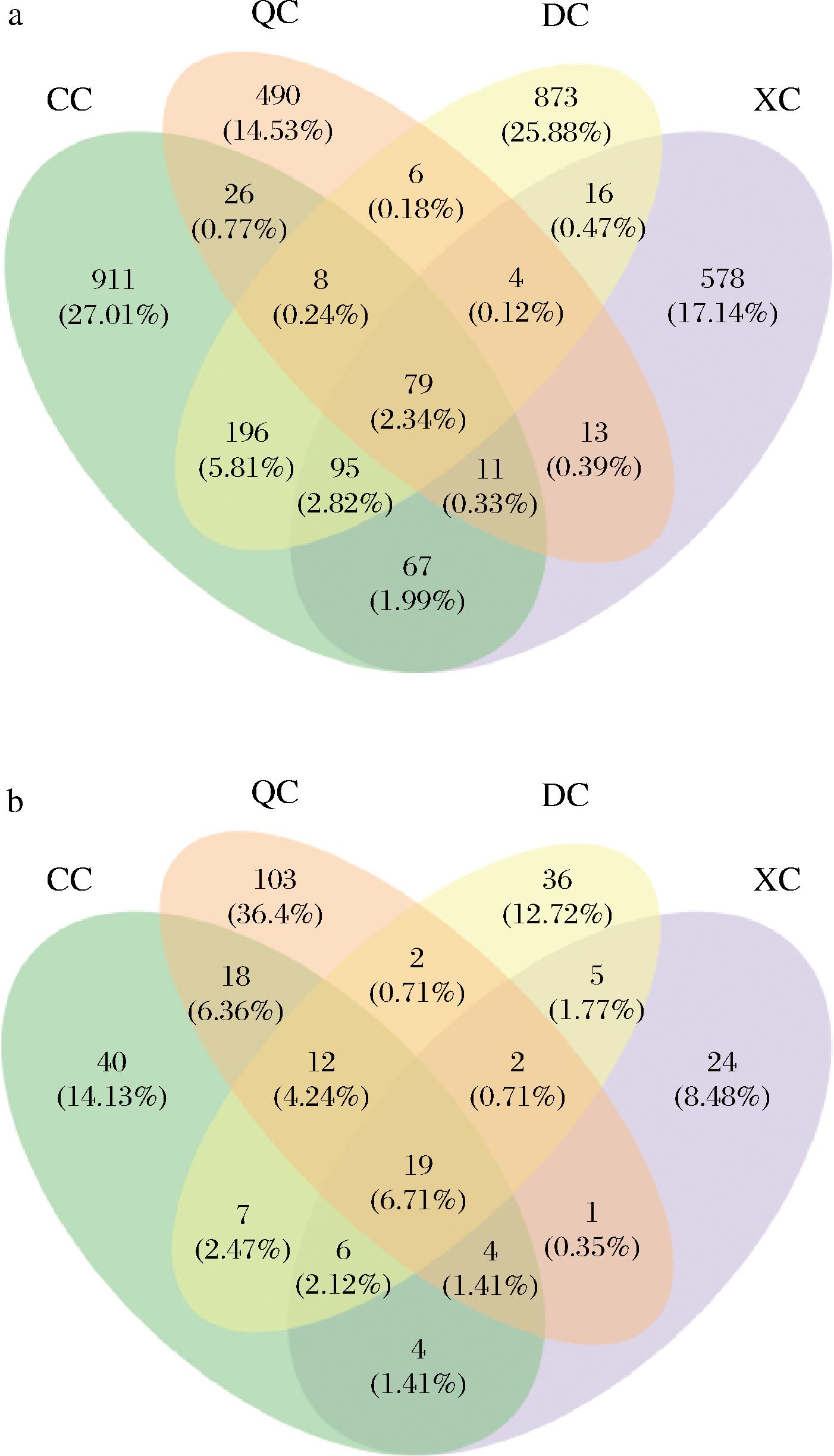
为探究4个季节成品曲样品的共有和独有物种数,分别基于细菌和真菌(属水平)层面绘制样品的韦恩图(图2),4个季节成品曲细菌共有物种79个,真菌共有物种19个,各样品还有较多独有物种,需要进一步深入挖掘物种信息。
a-细菌;b-真菌
图2 中药醋曲样品韦恩图
Fig.2 Venn diagram of the herb Daqu
a-细菌;b-真菌
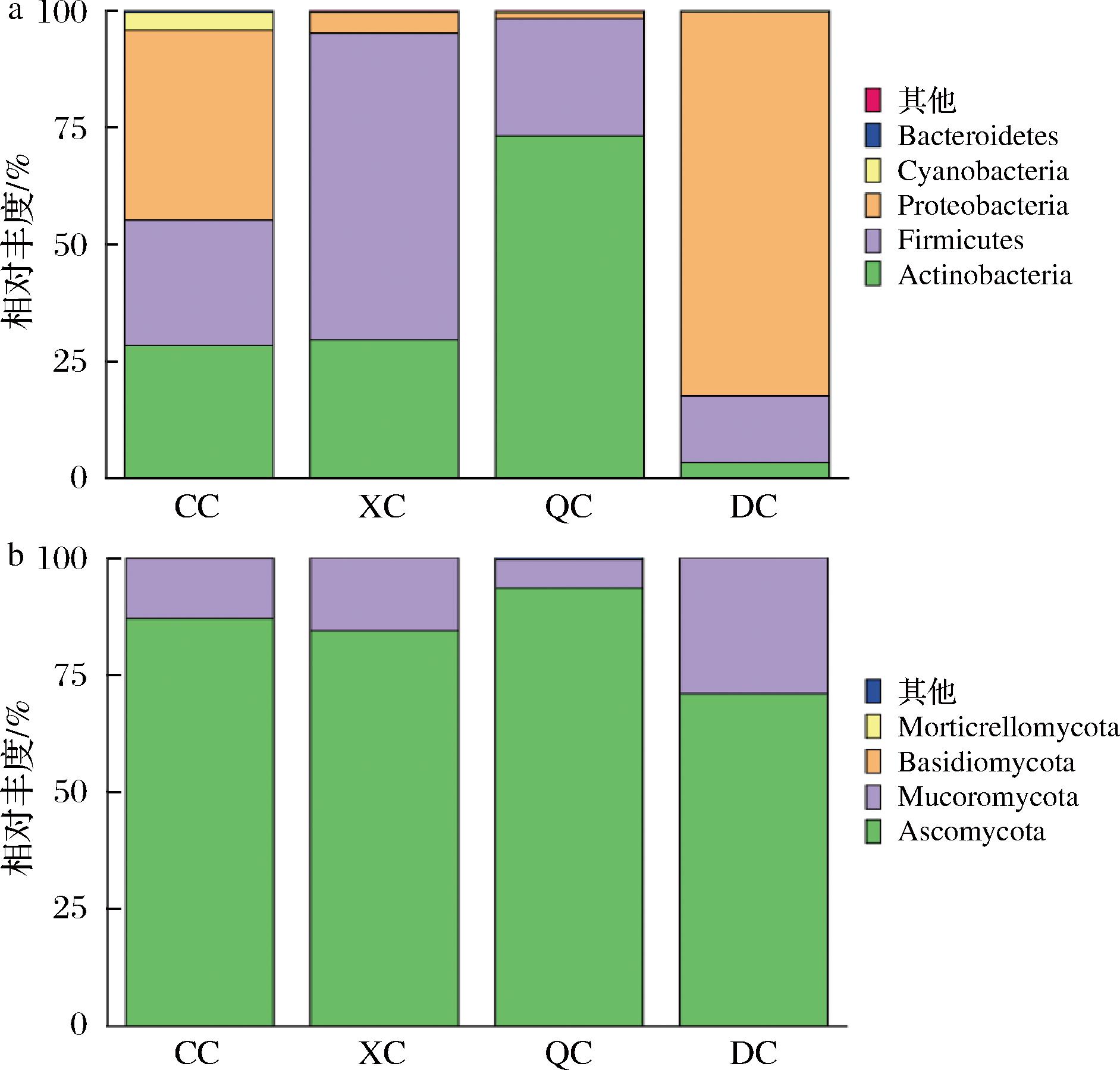
图3 中药醋曲细菌门水平
Fig.3 Phylum-level bacteria in the herb Daqu
2.1.3 不同季节保宁醋中药醋曲微生物菌群比较
基于对样品细菌和真菌共有物种和独有物种数量的了解,进一步通过柱形图展示在门水平和属水平不同季节样本物种的详细分布情况。
2.1.3.1 门水平上的比较
根据物种的注释结果,分别选取细菌和真菌门水平上相对丰度前5的物种绘制柱形图,结果如图3所示。由图3-a可知,从门水平来看,4个季节成品曲中主要的细菌为放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)。其中,放线菌门的相对丰度在秋季样中最高(73.19%),在冬季样中的最低(29.48%);厚壁菌门的相对丰度在夏季样中最高(65.59%),在冬季样中最低(14.35%);变形菌门的相对丰度在冬季样中最高(82.76%),在秋季样中最低(1.08%)。
由图3-b可知,从门水平来看,4个季节成品曲中主要的真菌为子囊菌门(Ascomycota)和毛霉亚门(Mucoromycota)。其中,子囊菌门在4个季节样品中相对丰度均>70%,为中药醋曲的绝对优势门,在秋季样品中相对最高,达93.47%;而对于毛霉亚门,其相对丰度在冬季样中最高(29.04%),在秋季样中最低(6.14%)。
对不同季节成品曲的优势菌进行对比分析可知,真菌在门水平上的优势菌均为子囊菌门和毛霉亚门。而不同季节细菌在门水平上的优势菌存在些许差异,其中,春季优势门为放线菌门、厚壁菌门和变形菌门;夏、秋两季优势门均为放线菌门和厚壁菌门;冬季优势门为厚壁菌门和变形菌门。
2.1.3.2 属水平上的比较
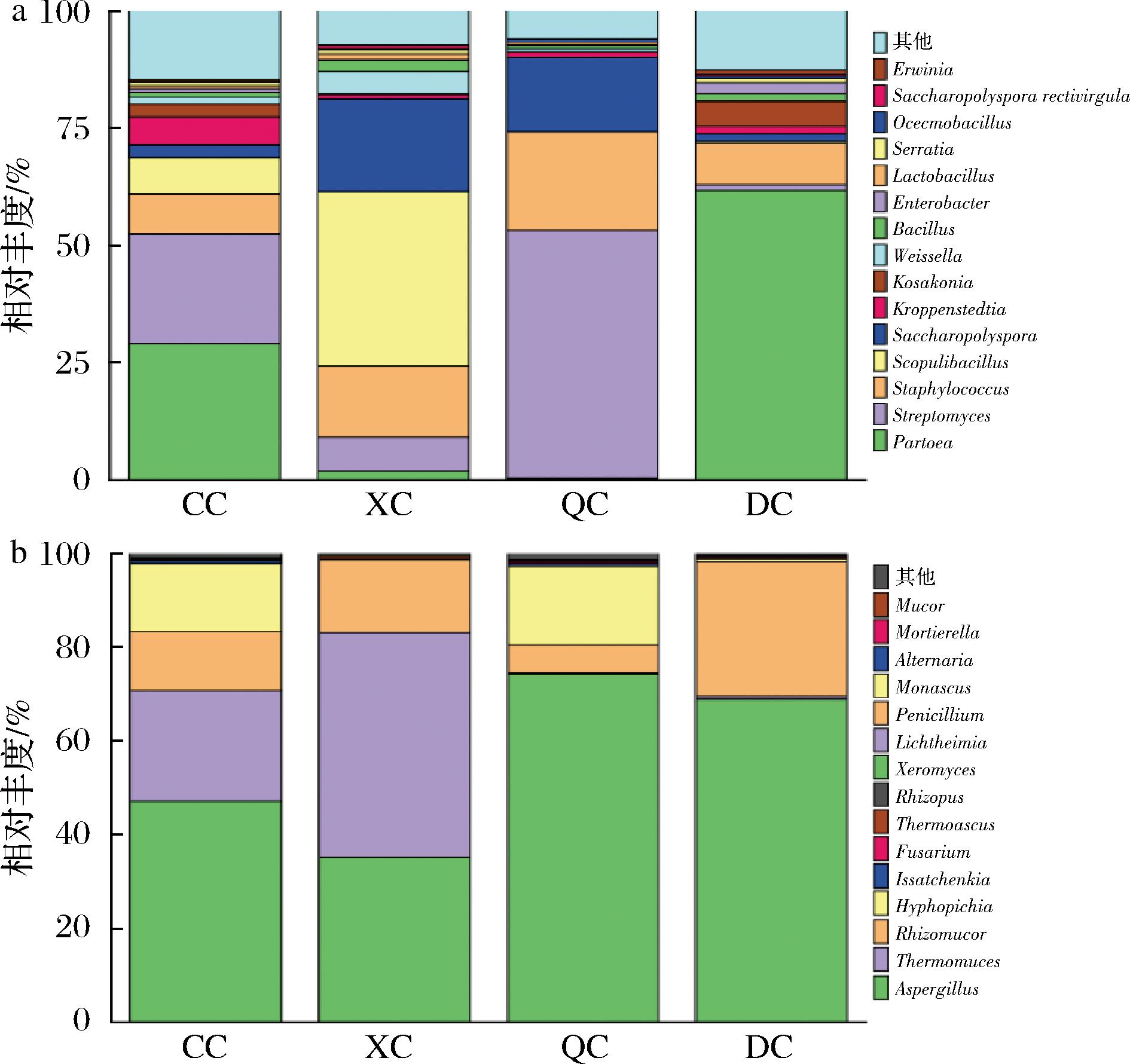
根据物种的注释结果,分别选取细菌和真菌属水平上相对丰度前15的物种绘制柱形图,结果如图4所示。由图4-a可知,从属水平来看,4个季节成品曲中主要的细菌主要包括链霉菌属(Streptomyces)、泛菌属(Pantoea)、葡萄球菌属(Staphylococcus)、火山渣芽孢杆菌属(Scopulibacillus)、糖多孢菌属(Saccharopolyspora)、克罗彭斯特菌属(Kroppenstedtia)、科萨克氏菌属(Kosakonia)、魏斯氏菌属(Weissella)、芽孢杆菌属(Bacillus)、肠杆菌属(Enterobacter)等。其中,链霉菌属的相对丰度在秋季样中最高(52.88%),在冬季样中最低(1.19%);泛菌属的相对丰度在冬季样中最高(61.78%),在秋季样中最低(0.35%);葡萄球菌的相对丰度在秋季样中最高(21.02%),在春季样中最低(8.82%);火山渣芽孢杆菌属的相对丰度在夏季样中最高(37.28%),在冬季和秋季样品中相对丰度均在一个极低的水平;糖多孢菌的相对丰度在夏季样中最高(19.72%),在冬季样中最低(1.66%);其他属水平的细菌在不同季节的样品中均存在相对丰度的差异,但无多样性上的差异。
a-细菌;b-真菌
图4 中药醋曲细菌、真菌属水平
Fig.4 Genus and fungal-level bacteria in the herb Daqu
由图4-b可知,从属水平来看,4个季节成品曲中主要的真菌包括曲霉菌属(Aspergillus)、嗜热真菌属(Thermomyces)、根毛霉属(Rhizomucor)、毕赤酵母属(Hyphopichia)等。其中4个季节成品曲中曲霉菌属的相对丰度均>35%,且秋季样品的相对丰度最高,为74.42%,相关研究报道,曲霉菌属与大曲糖化力呈正相关,是常见的产糖化酶功能菌[19];嗜热真菌属的相对丰度在夏季样品中最高(47.78%),在冬季和秋季样品中均处于极低水平;根毛霉属的相对丰度在冬季样中最高(28.64%),在秋季样中最低5.93%;毕赤酵母属在春、秋两季样品中相对丰度均为15%,而在秋、冬两个季节中相对丰度在一个较低的水平。
对不同季节成品曲的优势菌进行对比分析可知,从属水平上看,春季曲的优势菌包括链霉菌属、泛菌属、葡萄球菌属、火山渣芽胞杆菌属、科萨克氏菌属、曲霉菌属、嗜热真菌属、根毛霉属和毕赤酵母属;夏季曲的优势菌包括泛菌属、葡萄球菌属、曲霉菌属、嗜热真菌属、根毛霉属;秋季曲的优势菌包括链霉菌属、葡萄球菌属、糖多孢菌属、曲霉菌属、根毛霉属、毕赤酵母属;冬季曲的优势菌包括链霉菌属、葡萄球菌属、火山渣芽胞杆菌属、糖多孢菌属、曲霉菌属、根毛霉属。相较于其他食醋大曲(表1),保宁醋中药醋曲与山西老陈醋大曲共有细菌为葡萄球菌属、芽孢杆菌属、魏斯氏菌属、泛菌属、肠杆菌属、糖多孢菌属和链霉菌属,真菌群落具有较大差异[20];与陕西岐山醋大曲共有芽孢杆菌属、泛菌属、和曲霉菌属[10-11];与天津独流醋大曲共有细菌为魏斯氏菌属、链霉菌属和芽孢杆菌属[14]。相较于以上所述醋曲,火山渣芽孢杆菌属、克罗彭斯特菌属、科萨克氏菌属、嗜热真菌属和毕赤酵母属是保宁醋中药醋曲独有菌属,可作为保宁醋中药醋曲独特的生物标记物,以区别于其他食醋大曲。
表1 不同食醋大曲中微生物群落情况
Table 1 Microbial community in different vinegar Daqu

大曲名称微生物群落参考文献山西陈醋大曲乳酸菌属、葡萄球菌属、海洋杆菌属、芽孢杆菌属、魏斯氏菌属、泛菌属、肠杆菌属、糖多孢菌属和链霉菌属等[20]陕西岐山醋大曲芽孢杆菌属、乳酸菌属、醋酸菌属、威克汉姆酵母属、复膜孢酵母属、肠杆菌属、魏斯氏菌属、片球菌属、曲霉属和泛菌属等[6,10-11]天津独流醋大曲魏斯氏菌属、乳酸菌属、乳球菌属、链霉菌属和芽孢杆菌属等[14]四川麸醋曲曲霉属、根毛霉属、嗜热子囊菌属、葡萄球菌属、魏斯氏菌属、糖多孢菌和链霉菌属等[21]
2.1.3.3 统计分析
α-多样性分析是指局部均匀生境下物种在丰富度、多样性和均匀度等方面的指标,可用于分析样品内的微生物多样性[22-23]。对4个季节成品曲的细菌和真菌α-多样性指数进行对比分析可知(表2),基于Shannon指数,细菌多样性:冬季>春季>夏季>秋季,真菌多样性:春季>冬季>秋季>夏季。相关的研究表明,季节引起的气候变化中,温度是决定微生物组成和功能的关键季节性因素[21,24],春、冬季气温较低,湿度较大,有利于菌群富集、生长和繁殖,从而在春曲、冬曲中真菌和细菌类群相对更多。
表2 α-多样性指数
Table 2 α-diversity index
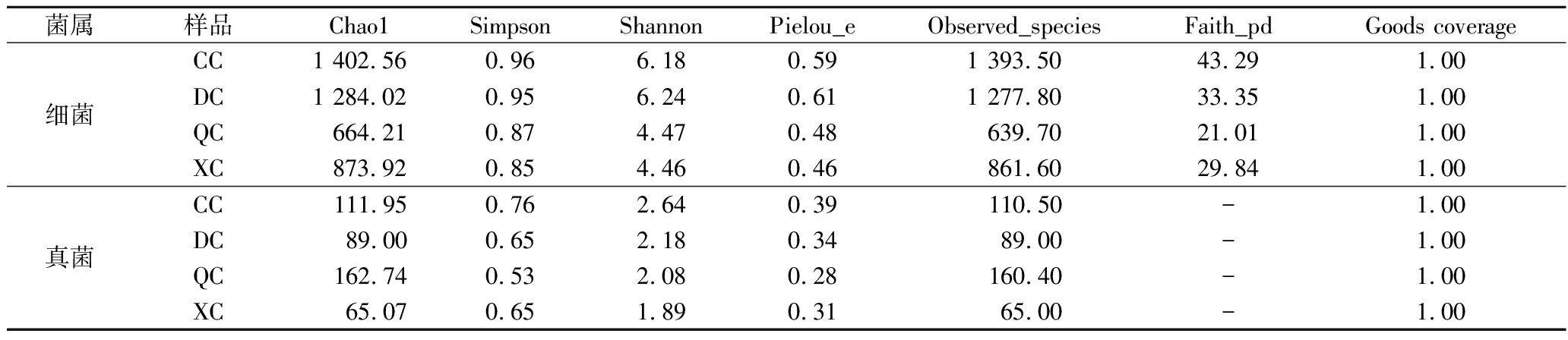
菌属样品Chao1SimpsonShannonPielou_eObserved_speciesFaith_pdGoods coverage细菌CC1 402.560.966.180.591 393.5043.291.00DC1 284.020.956.240.611 277.8033.351.00QC664.210.874.470.48639.7021.011.00XC873.920.854.460.46861.6029.841.00真菌CC 111.950.762.640.39 110.50-1.00DC89.000.652.180.3489.00-1.00QC162.740.532.080.28160.40-1.00XC65.070.651.890.3165.00-1.00
β-多样性分析是对两个或多个样品的微生物群落以及功能特性等方面进行比较,强调群落之间的相似度、差异性等。分别对不同季节样品细菌和真菌的Bray-Curtis距离[25]进行列表分析可知(表3),冬季和秋季的细菌群落组成和相对丰度差异最大,冬季和春季的差异最小;对于真菌多样性,夏季和秋季的差异最大,春季和秋季的差异最小。
表3 群落Bray-Curtis距离
Table 3 The Bray-Curtis distance of community
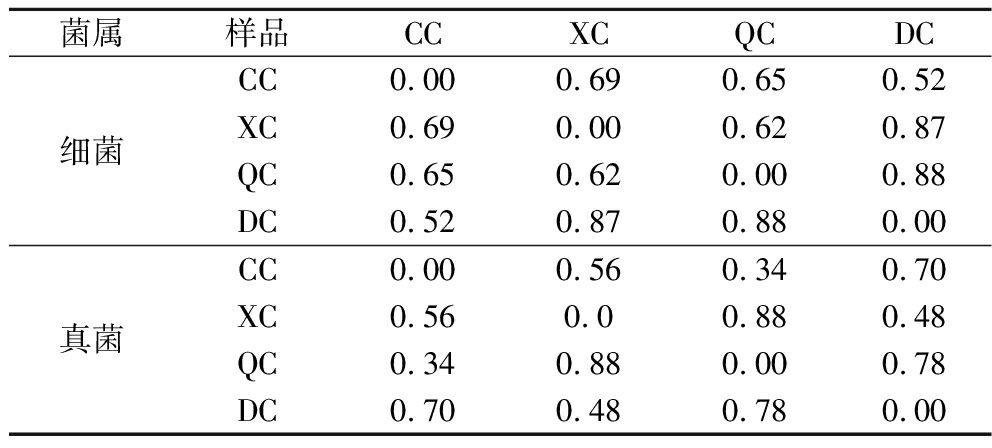
菌属样品CCXCQCDC细菌CC0.000.690.650.52XC0.690.000.620.87QC0.650.620.000.88DC0.520.870.880.00真菌CC0.000.560.340.70XC0.560.00.880.48QC0.340.880.000.78DC0.700.480.780.00
基于Bray-Curtis距离绘制4个季节成品曲微生物菌群的PCoA图(图5),由图可知,对于细菌群落,第1主成分得分为61.5%,第2主成分得分为25.7%,对于真菌群落,第1主成分得分为73.5%,第2主成分得分为26.5%;前两轴对不同季节样品的差异结果的解释率较高。4个季节的细菌群落以及真菌群落均具有明显的季节性差异,可能是因为不同季节环境因子扰动微生物菌群变化所致。
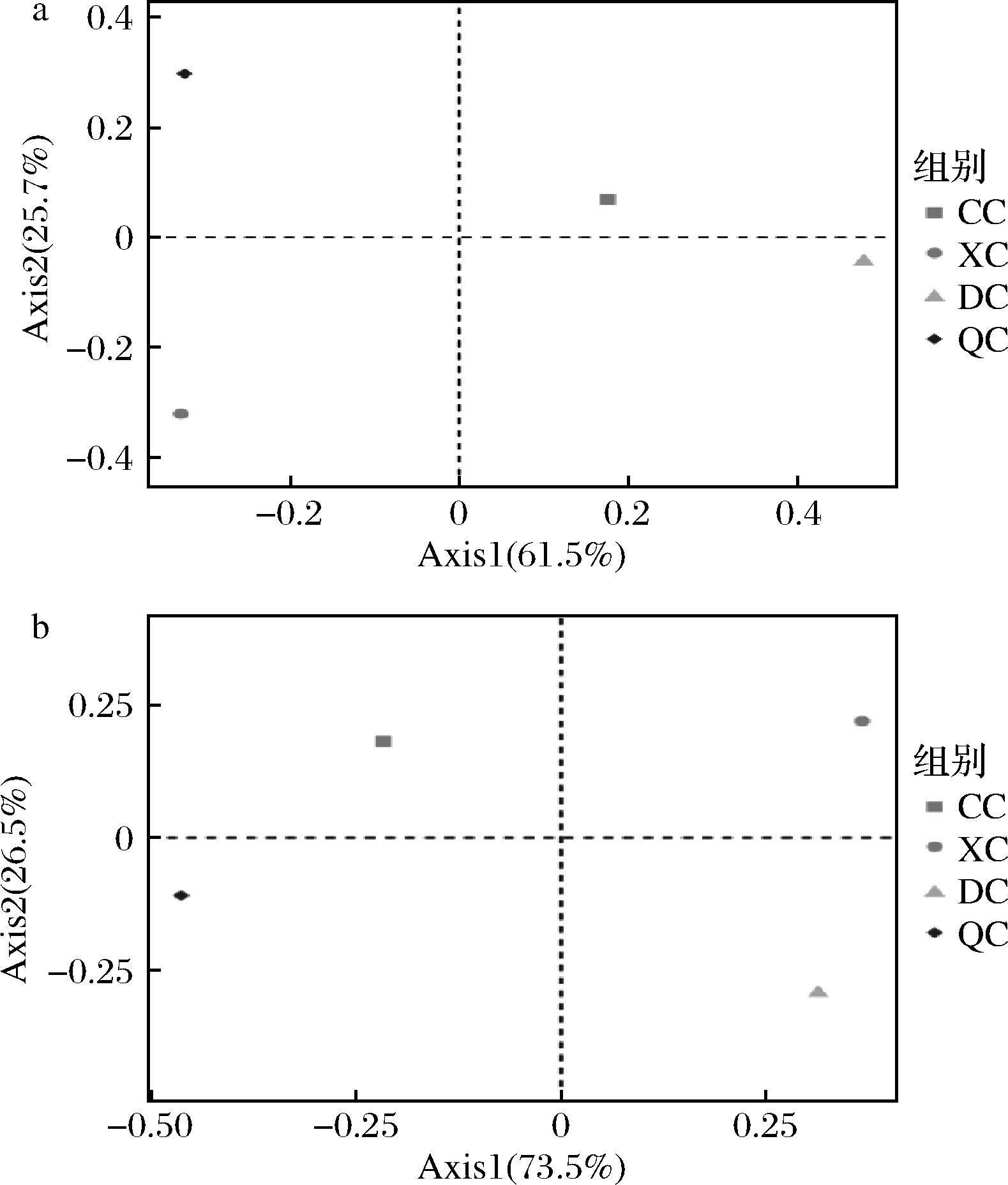
a-细菌;b-真菌
图5 中药醋曲微生物群落结构PCoA分析
Fig.5 PCoA analysis of microbial communities in herb Daqu
2.1.4 不同季节中药醋曲理化指标
对不同季节中药醋曲的理化指标进行监测并与浓香大曲的行业标准进行对比,结果如表4所示。由表可知,不同季节样品的所有理化指标均存在显著性差异。不同季节成品曲的pH值均在7附近波动;对水分含量的比较可知,水分含量为夏季<秋季<春季<冬季,4个季节的水分含量均在15%的左右,但春、冬季大曲水分高于夏、秋季,这可能是因为春、冬季温度较低以致水分散失较弱;淀粉含量在70 g/100 g左右,相较于行业标准偏高,且夏季淀粉含量最高,可能是因为夏季的高温导致大曲中淀粉水解酶活性下降;还原糖含量在春季最高,秋季次之,夏季最低;糖化力大小为春季>冬季>秋季>夏季,除夏季样品外均稍高于行业标准,这可能与中药醋曲采用的原料、发酵过程微生物的生长以及工艺等有关,同时更能加强食醋后期生料固态发酵过程中的糖化作用;液化力大小为冬季>春季>夏季>秋季,均高于行业标准[26];酯化力为冬季最高,夏季次之,秋季最低,4个季节酯化力均大于150 mg/(50 g·7 d),成品曲较高的酯化力可对后续保宁醋成品食醋样品中较高含量的乳酸乙酯、呋喃-2-基乙酸甲酯、3-氧代丁烷-2-基乙酸酯以及2-乙酸乙酯等有较大贡献[27]。对于成品曲理化指标的测定及长期持续的监测结果可促进保宁醋中药醋曲的成品曲质量标准的建立。综合考虑糖化力、液化力、酯化力等重要因素对大曲品质影响,认为春、冬季是最适合制曲的季节。
表4 不同季节成品曲的理化性质监测结果及参考标准
Table 4 The monitoring results of physicochemical properties of matured Daqu in different seasons and its reference standards
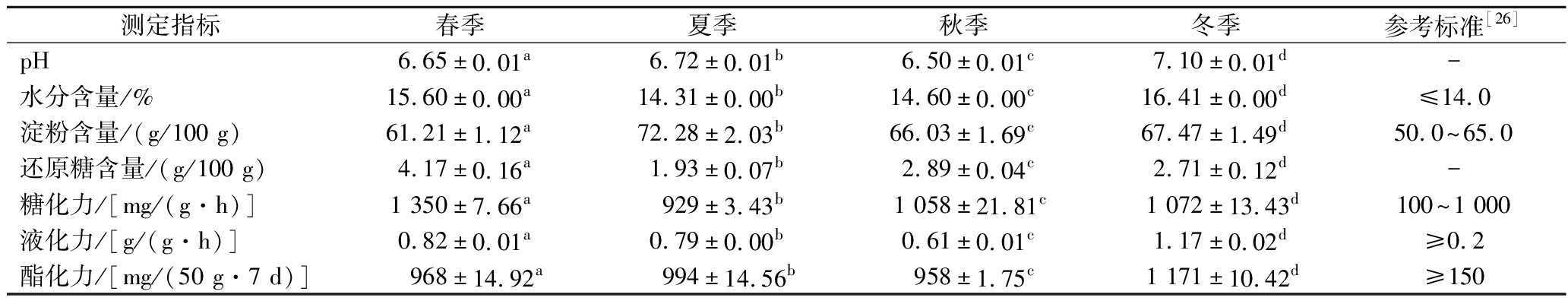
测定指标春季夏季秋季冬季参考标准[26]pH6.65±0.01a6.72±0.01b6.50±0.01c7.10±0.01d-水分含量/%15.60±0.00a14.31±0.00b14.60±0.00c16.41±0.00d≤14.0淀粉含量/(g/100 g)61.21±1.12a72.28±2.03b66.03±1.69c67.47±1.49d50.0~65.0还原糖含量/(g/100 g)4.17±0.16a1.93±0.07b2.89±0.04c2.71±0.12d-糖化力/[mg/(g·h)]1 350±7.66a929±3.43b1 058±21.81c1 072±13.43d100~1 000液化力/[g/(g·h)]0.82±0.01a0.79±0.00b0.61±0.01c1.17±0.02d≥0.2酯化力/[mg/(50 g·7 d)]968±14.92a994±14.56b958±1.75c1 171±10.42d≥150
注:同一行上标字母相同则差异不显著(P>0.05),字母不相同则差异显著(P<0.05)。-表示未有参考数值。
2.1.5 不同季节中药醋曲微生物菌群与理化指标的相关性
对4个季节的优势微生物与理化指标计算Spearman相关性系数可知(图6),水分含量与泛菌属、葡萄球菌属和克罗彭斯特菌属强相关;pH值与泛菌属、链霉菌属、根毛霉属和毕赤酵母属强相关,其中,与泛菌属、根毛霉属呈正相关,链霉菌属、毕赤酵母属呈负相关,这可能与泛菌属、根毛霉属在代谢过程中可发酵多种糖类产生酸类物质等有关;淀粉含量与链霉菌属、克罗彭斯特菌属和毕赤酵母属呈负相关,根毛霉属呈正相关,这可能与根毛霉属代谢产生糖化酶等水解酶有相关[28];除根毛霉属之外,还原糖含量与链霉菌属、克罗彭斯特菌属和毕赤酵母属呈正相关。分析说明,某种微生物在多种环境因子的共同主导作用下,在不同季节的成品曲中形成差异。
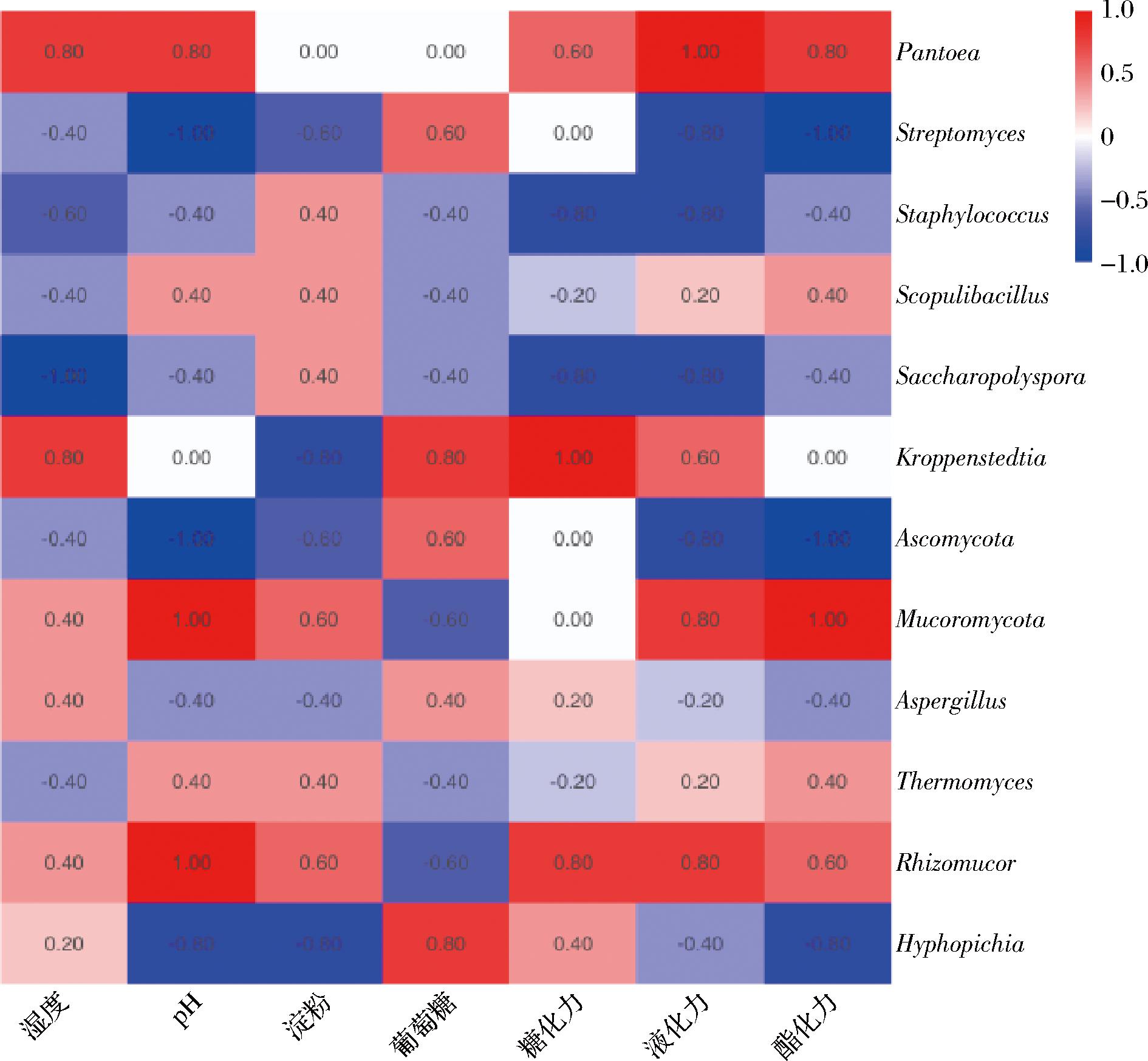
图6 不同季节中药醋曲微生物菌群与理化性质相关性热图
Fig.6 Heatmap of microbiota and physicochemical properties of herb Daqu in different seasons
针对酶活性指标和微生物菌群的相关性可知,糖化力与泛菌属、克罗彭斯特菌属、根毛霉属呈正相关,与葡萄球菌属、糖多孢菌属呈负相关;液化力与泛菌属、克罗彭斯特菌属和根毛霉属呈正相关,与链霉菌属、葡萄球菌和糖多孢菌负相关;酯化力与泛菌属和根毛霉属呈正相关,与链霉菌属和毕赤酵母属呈负相关。随着环境因子的扰动,不同季节成品曲的微生物菌群产生差异,进而可能造成样品酶活性的差异。
3 结论
不同季节中药醋曲的细菌和真菌均存在相对丰度差异。其共有优势细菌为:泛菌属、链霉菌属、葡萄球菌属、火山渣芽孢杆菌属、糖多孢菌属和克罗彭斯特菌属;优势真菌为:曲霉菌属、嗜热真菌属、根毛霉属和毕赤酵母属。火山渣芽孢杆菌属、克罗彭斯特菌属、科萨克氏菌属、嗜热真菌属和毕赤酵母属可作为保宁醋中药醋曲独特的生物标记物,以区别于其他食醋大曲。不同季节中药醋曲的理化指标均存在显著性差异。其pH值均约为7.0;水分含量、淀粉含量均>浓香大曲行业标准;还原糖含量在春季最高;春季的糖化力水平最高,除夏季样品外,中药醋曲糖化力均高于1 000 mg/(g·h),而4个季节样品的液化力均符合标准;秋季酯化力水平最低。在多个环境因子的共同作用下,不同季节中药醋曲的微生物菌群存在差异,从而可能对其他理化指标和酶活产生影响。
根据本研究的结果,结合工厂长期的监测情况、工厂实际情况及浓香白酒大曲行业标准,对保宁醋中药醋曲成品曲的理化性质初步建议如下:pH值在6.5~7.5;水分含量在14%以下;淀粉含量60.00~70.00 g/100 g;还原糖含量在2.00~4.00 g/100 g;糖化力在600~1 200 mg/(g·h);液化力>0.2 g/(g·h);酯化力≥150 mg/(50 g·7 d)。
[1] 刘军, 朱文优, 杨勇.保宁醋固态发酵理化指标的动态分析[J].中国酿造, 2006, 25(5):45-47.LIU J, ZHU W Y, YANG Y.Dynamic analysis of physiochemical index of Baoning vinegar with solid-state fermentation[J].China Brewing, 2006, 25(5):45-47.
[2] 钟正丹, 吴华昌, 邓静, 等.保宁醋醋曲中产香酵母的鉴定及挥发性成分研究[J].食品工业科技, 2015, 36(24):206-210;225.ZHONG Z D, WU H C, DENG J, et al.Identification and study of fermentation metabolites of aroma-producing yeast strains from Baoning vinegar[J].Science and Technology of Food Industry, 2015, 36(24):206-210;225.
[3] ZHENG X W, TABRIZI M R, ROBERT NOUT M J, et al.Daqu—a traditional Chinese liquor fermentation starter[J].Journal of the Institute of Brewing, 2011, 117(1):82-90.
[4] ZHENG X W, HAN B Z.Baijiu, Chinese liquor:History, classification and manufacture[J].Journal of Ethnic Foods, 2016, 3(1):19-25.
[5] ZHENG X W, YAN Z, HAN B Z, et al.Complex microbiota of a Chinese “Fen” liquor fermentation starter (Fen-Daqu), revealed by culture-dependent and culture-independent methods[J].Food Microbiology, 2012, 31(2):293-300.
[6] 黎攀. 环境因子胁迫下传统岐山醋大曲固态发酵过程中微生物群落演变规律的研究[D].广州:华南理工大学, 2017.LI P.Study on the evolution of microbial community during solid-state fermentation of traditional Qishan vinegar Daqu under environmental stress[D].Guangzhou:South China University of Technology, 2017.
[7] 刘阳, 邓静, 姜元华, 等.保宁醋醋曲中产多糖乳酸菌的筛选及其代谢产物分析[J].现代食品科技, 2018, 34(3):184-190.LIU Y, DENG J, JIANG Y H, et al.Screening of polysaccharide-producing lactic acid bacteria in baoning vinegar koji and analysis of its metabolites[J].Modern Food Science and Technology, 2018, 34(3):184-190.
[8] ZHENG X W.Daqu-a traditional fermentation starter in China:Microbial ecology and functionality[D].Wageningen:Wageningen University, 2015.
[9] LIU X, GUO K L, ZHANG H X.Determination of microbial diversity in Daqu, a fermentation starter culture of Maotai liquor, using nested PCR-denaturing gradient gel electrophoresis[J].World Journal of Microbiology &Biotechnology, 2012, 28(6):2375-2381.
[10] LI P, LIANG H B, LIN W T, et al.Microbiota dynamics associated with environmental conditions and potential roles of cellulolytic communities in traditional Chinese cereal starter solid-state fermentation[J].Applied and Environmental Microbiology, 2015, 81(15):5144-5156.
[11] LI P, AFLAKPUI F W K, YU H, et al.Characterization of activity and microbial diversity of typical types of Daqu for traditional Chinese vinegar[J].Annals of Microbiology, 2015, 65(4):2019-2027.
[12] GAN X, TANG H L, YE D D, et al.Diversity and dynamics stability of bacterial community in traditional solid-state fermentation of Qishan vinegar[J].Annals of Microbiology, 2017, 67(10):703-713.
[13] NIE Z Q, ZHENG Y, XIE S K, et al.Unraveling the correlation between microbiota succession and metabolite changes in traditional Shanxi aged vinegar[J].Scientific Reports, 2017, 7(1):9240.
[14] NIE Z Q, ZHENG Y, WANG M, et al.Exploring microbial succession and diversity during solid-state fermentation of Tianjin duliu mature vinegar[J].Bioresource Technology, 2013, 148:325-333.
[15] 刘阳, 邓静, 吴华昌.保宁醋醋曲中醋酸菌筛选及其代谢产物分析[J].食品研究与开发, 2018, 39(17):145-152.LIU Y, DENG J, WU H C.Screening of acetic acid bacteria in baoning vinegar koji and analysis of its metabolites[J].Food Research and Development, 2018, 39(17):145-152.
[16] 严唯玮, 黄静, 肖蕾, 等.保宁醋“中药醋曲” 发酵过程中微生物数量及理化性质动态分析[J].食品与发酵工业, 2021, 47(20):83-89.YAN W W, HUANG J, XIAO L, et al.Dynamic analysis of microbial population and physicochemical properties during traditional fermentation of “herb Daqu starter” for Baoning vinegar[J].Food and Fermentation Industries, 2021, 47(20):83-89.
[17] HECK JR K L, VAN BELLE G, SIMBERLOFF D.Explicit calculation of the rarefaction diversity measurement and the determination of sufficient sample size[J].Ecology, 1975, 56(6):1459-1461.
[18] KEMP P F, ALLER J Y.Bacterial diversity in aquatic and other environments:What 16S rDNA libraries can tell us[J].FEMS Microbiology Ecology, 2004, 47(2):161-177.
[19] 刘敏芳, 王昊乾, 唐艺婧, 等.后火曲制作过程中理化、生化指标和微生物菌群变化及其相关性分析[J].中国酿造, 2023, 42(5):70-77.LIU M F, WANG H Q, TANG Y J, et al.Changes of physicochemical and biochemical indexes and microbial community and analysis during the preparation of Houhuoqu[J].China Brewing, 2023, 42(5):70-77.
[20] NIE Z Q, ZHENG Y, DU H F, et al.Dynamics and diversity of microbial community succession in traditional fermentation of Shanxi aged vinegar[J].Food Microbiology, 2015, 47:62-68.
[21] 周楠, 黄钧, 文平, 等.季节及制曲工艺对麸醋曲微生物群落结构及代谢组分的影响[J].食品工业科技, 2022, 43(1):155-162.ZHOU N, HUANG J, WEN P, et al.Effects of seasons and Daqu- making process on the microbial community structure and metabolites of bran cuqu[J].Science and Technology of Food Industry, 2022, 43(1):155-162.
[22] WHITTAKER R H.Vegetation of the Siskiyou Mountains, Oregon and California[J].Ecological Monographs, 1960, 30(4):407.
[23] WHITTAKER R H.Evolution and measurement of species diversity[J].Taxon, 1972, 21(2-3):213-251.
[24] WANG S L, XIONG W, WANG Y Q, et al.Temperature-induced annual variation in microbial community changes and resulting metabolome shifts in a controlled fermentation system[J].mSystems, 2020, 5(4):e00 555-20.
[25] BRAY J R, CURTIS J T.An ordination of the upland forest communities of southern Wisconsin[J].Ecological Monographs, 1957, 27(4):325-349.
[26] 中华人民共和国工业和信息化部. QB/T 4259—2011浓香大曲[S].北京:中国轻工业出版社, 2011.Ministry of Industry and Information Technology of the people’s Republic of China.QB/T 4259—2011 Luzhou-flavor Daqu[S].Beijing:China Light Industry Press, 2011.
[27] 唐玉明, 任道群, 姚万春, 等.酱香型酒糟醅堆积过程温度和微生物区系变化及其规律性[J].酿酒科技, 2007(5):54-58.TANG Y M, REN D Q, YAO W C, et al.The change rules of temeprature and microflora during the stacking of Maotai-flavor fermenting grains[J].Liquor-Making Science &Technology, 2007(5):54-58.
[28] ZHAO L N, WANG Y, XING J L, et al.Distinct succession of abundant and rare fungi in fermented grains during Chinese strong-flavor liquor fermentation[J].LWT, 2022, 163:113502.