L-丝氨酸是一种不带电、非极性氨基酸,参与蛋白质合成、细胞增殖和发育等多种细胞生理活动,具有重要的生理功能,在医药、食品和化妆品等领域具有广泛的应用[1-2]。研究表明,L-丝氨酸作为最主要的中间代谢产物之一参与生物体内多种生理代谢途径,参加了胸腺嘧啶、嘌呤、胆碱和一碳单位的代谢过程,因此常被添加至氨基酸输液中为病患提供营养,维持机体的代谢活动。L-丝氨酸还参与了中枢神经系统中鞘脂的形成[3-4],在治疗各种神经系统疾病和神经退行性疾病上有巨大的潜力[5]。作为一种重要的保湿因子,L-丝氨酸可以锁住皮肤角质层的水分,是高级化妆品的重要保湿物质,具有美肤、抗菌、延缓衰老等作用[6]。此外,L-丝氨酸和葡萄糖在高温时会形成2-羟基乙醛,具有特殊的枫糖浆香味,常被用于改善食品的风味[7]。随着L-丝氨酸终端应用的不断开发,L-丝氨酸的市场需求量不断扩大。目前L-丝氨酸的主要生产方法包括化学合成法[8]、蛋白水解法[9]、酶催化法[10]以及微生物发酵法[11]。相比之下,微生物发酵法因底物廉价、环境友好、反应条件温和、生产成本低等优势,在生产L-丝氨酸方面具有极大的应用潜力,受到广泛关注。
目前,生物体内L-丝氨酸的生物合成途径已经阐明,其合成起始于糖酵解途径的中间代谢产物3-磷酸甘油酸,然后依次由3-磷酸甘油酸脱氢酶(3-phosphoglycerate dehydrogenase, PGDH, 编码基因serA)、磷酸丝氨酸转氨酶(phosphoserine aminotransferase, PSAT, 编码基因serC)和磷酸丝氨酸磷酸化酶(phosphoserine phosphatase, PSP, 编码基因serB)催化生成L-丝氨酸。其中,PGDH是L-丝氨酸生物合成途径的重要限速酶,其活性受到L-丝氨酸的反馈抑制[12]。近年来通过研究PGDH的晶体结构,对其关键位点进行改造,获得了一系列的解反馈的酶突变体[13-14]。研究发现,PGDH的第344位点和第346位点的氨基酸突变为可减弱L-丝氨酸的反馈抑制的丙氨酸[15];国内学者金雪霞[16]研究发现,通过截除谷氨酸棒杆菌中PGDH的编码基因serA基因C-末端的591个碱基可明显解除L-丝氨酸的反馈抑制,并且过表达解反馈抑制的PGDH的基因serA△197可以显著提高L-丝氨酸的积累量[17]。尽管如此,目前关于提高PGDH催化活性的研究仍然较少。因此,本研究以谷氨酸棒杆菌(Corynebacterium glutamicum)中的PGDH(Cg-PGDH)为研究对象,利用蛋白质工程技术对Cg-PGDH进行定向进化和筛选,致使Cg-PGDH突变体酶活性和热稳定性显著提高,为发酵法生产L-丝氨酸提供了重要的功能元件和基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
大肠杆菌(Escherichia coli)DH5α、BL21(DE3)来源于中国科学院天津工业生物技术研究所。pET21b由本实验室保藏。研究所用菌株与质粒见表1。
表1 本研究所用菌株与质粒
Table 1 Strains and plasmids used in this study

菌株和质粒相关描述来源DH5α质粒构建宿主实验室保存BL21质粒表达宿主实验室保存pET21b-Cg-PGDHpET21b contains serA gene from C.glutamicum本研究pET21b-P85Q/A183VpET21b contains serAP85Q/A183V gene本研究pET21b-P85Q/I231VpET21b contains serAP85Q/I231V gene本研究pET21b-P85Q/D365YpET21b contains serAP85Q/D365Y gene本研究pET21b-P85Q/A389TpET21b contains serAP85Q/A389T gene本研究pET21b-A183V/I231VpET21b contains serAA183V/I231V gene本研究pET21b-A183V/D365YpET21b contains serAA183V/D365Y gene本研究pET21b-A183V/A389TpET21b contains serAA183V/A389T gene本研究pET21b-I231V/D365YpET21b contains serAI231V/D365Y gene本研究pET21b-A389T/I231VpET21b contains serAA389T/I231V gene本研究pET21b-D365Y/A389TpET21b contains serAD365Y/A389T gene本研究
1.1.2 试剂
Dpn I消化酶,北京擎科生物公司;3-磷酸甘油酸二钠盐、NADP+/NAD+,上海源叶生物试剂有限公司;氨苄青霉素(ampicillin,Amp)、异丙基-β-D-硫代吡喃半乳糖苷(isopropyl-beta-D-thiogalactopyranoside, IPTG),索莱宝生物科技有限公司;溶菌酶,上海西格玛奥德里奇贸易有限公司;牛血清蛋白,北京纽英伦生物技术有限公司。
Protein Ladder、Phusion DNA聚合酶、T4 DNA连接酶,Thermo Fisher公司;Plus II DNA Marker,北京全式金生物技术有限公司;2×Rapid Taq Master Mix,南京诺唯赞生物科技有限公司;Ni SepharoseTM 6 Fast Flow填料,上海拜力生物科技有限公司;质粒提取试剂盒、胶回收试剂盒,天根生物公司;联胺标准溶液,上海阿拉丁生化科技有限公司;盐酸,鑫盛化工有限公司;NaCl、Na2CO3、NaHCO3、咪唑、TRIS,天津市凯通化学试剂有限公司。
1.1.3 培养基与溶液
LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,氨苄青霉素(Ampicillin, Amp)0.1 g/L。固体培养基加20琼脂粉。
1.1.4 仪器与设备
Synergy NEO2多功能酶标仪,美国Biotek公司;ZWY-211C恒温摇床,美国精骐公司;Scientz-IID超声破碎仪,宁波新芝公司;5810R台式冷冻离心机,德国Eppendoff公司;Agilent 1260高效液相色谱仪,美国Agilent公司。SX-700高压灭菌锅,天美(中国)科学仪器有限公司;HPX-9082MBE恒温培养箱,上海一恒科学仪器有限公司;TC-XP-D基因扩增仪,赛默飞世尔科技公司;H2O3-100C加热制冷型金属浴,卡尤迪生物科技有限公司;JY-SPCT核酸电泳仪、JY-SCZ2+蛋白电泳仪,北京君意东方电泳设备有限公司;Nano DSC差式扫描量热仪,TA Instruments公司。
1.2 实验方法
1.2.1 PGDH表达质粒的构建
以C.glutamicum的基因组和质粒pET-21b为模板,分别使用引物对CgserA-F/CgserA-R和21b-F/21b-R进行PCR扩增,获得Cg-PGDH基因片段和pET-21b骨架。随后将上述DNA片段采用Golden Gate的方式连接起来,构建PGDH的重组表达质粒pET21b-Cg-PGDH,转化到E.coli BL21感受态细胞中。
1.2.2 PGDH的诱导表达和纯化
将含有pET21b-Cg-PGDH质粒的BL21菌株于含有100 μg/mL Amp的LB固体板上进行活化,挑取单菌落接种至含有100 μg/mL Amp液体的试管中,37 ℃过夜培养,后按1%的接种量接种至含有100 μg/mL Amp液体的摇瓶中,37 ℃培养至OD600值为0.5~0.6,加入终浓度为0.4 mmol/L的IPTG,25 ℃诱导10~12 h,4 ℃的条件下离心收集菌体。利用裂解缓冲液(50 mmol/L Tris,200 mmol/L NaCl,pH值为7.5)重悬菌体,超声波破碎处理15 min,4 ℃的条件下收集上清液。将收集的上清液置于镍柱中,采用镍柱亲和层析方法进行蛋白纯化,将纯化后的蛋白置于保藏缓冲液[50 mmol/L Tris溶液,5%(体积分数)甘油,pH值为7.5],-80 ℃保存。
1.2.3 PGDH酶活性测定方法
PGDH的酶活性是通过检测340 nm处吸光度的变化测定的[18],反应体系为50 mmol/L Tris-HCl缓冲液(pH值为8.8),5 mmol/L 3-磷酸甘油酸二钠盐,5 mmol/L NAD+,5 mmol/L EDTA,5 mmol/L联胺,1 mmol/L二硫苏糖醇。PGDH的酶活单位定义为单位时间内每生成1 μmol NADH所消耗的酶量。
1.2.4 PGDH的突变体库的建立和筛选
本研究采用易错PCR技术构建Cg-PGDH的突变体文库。易错PCR体系包括(50 μL):10×buffer 5 μL,50 mmol/L Mg2+ 10 μL,10 mmol/L Mn2+ 5 μL,2.5 mmol/L dNTP 10 μL,引物2 μL,模板1 μL,TaKaRa rTaq 1 μL,ddH2O 22 μL。利用易错PCR体系获得Cg-PGDH片段,连接至pET21b上,构建质粒突变体库。将构建的质粒文库转化至BL21中。
从Cg-PGDH突变体文库平板上挑单菌落,接种于含有LB培养基的96孔板中,在37 ℃条件下培养5 h,加入0.4 mmol/L IPTG,25 ℃条件下继续诱导培养12 h。离心收菌,加入500 μL ddH2O洗菌,离心弃上清液后加入含有溶菌酶的裂解液(50 mmol/L Tris,200 mmol/L NaCl,pH 7.5,3 mg/mL溶菌酶)在37 ℃条件下孵育3 h,再次离心取上清粗酶液测定酶活性。采用上述方法进行酶活性测定分析,筛选具有高催化活性的Cg-PGDH突变体。
1.2.5 PGDH酶学性质测定
1.2.5.1 Cg-PGDH最适pH值测试分析。
将Cg-PGDH置于不同缓冲液体系中,测定在不同pH条件下的酶活性。其中,0.1 mol/L MOPS缓冲溶液适用于pH值区间6.5~8.0,0.1 mol/L Tris-HCl缓冲溶液适用于pH区间8.0~9.2,0.1 mol/L Na2CO3-NaHCO3缓冲溶液适用于pH值区间9.5~10.5。
1.2.5.2 Cg-PGDH最适温度和温度稳定性测试。
将Cg-PGDH置于25~65 ℃下,测定在不同温度下的酶活性和最适催化温度。为测定酶的温度稳定性,将Cg-PGDH分别在30~60 ℃条件下孵育10 min,然后测定残余酶活性。
1.2.5.3 Cg-PGDH动力学分析
3-磷酸甘油酸二钠盐浓度为10 mmol/L时,测定酶在不同NAD+(0.1~3 mmol/L)浓度下的酶活性;同样的,NAD+浓度为10 mmol/L时,测试在不同3-磷酸甘油酸二钠盐(0.435~4.5 mmol/L)浓度下的酶活性。绘制动力学曲线,计算获得野生型酶和突变体对不同底物的动力学参数。
2 结果和分析
2.1 PGDH的表达纯化与酶催化活性分析
以C.glutamicum为模板,PCR扩增出相应基因片段,采用Golden Gate的方法连接至pET21b表达载体上,经金唯智测序正确转化至E.coli BL21(DE3)中。挑取单菌落接种至试管活化培养,转接至新的培养基中37 ℃条件下培养至OD600=0.6,加入IPTG至终浓度为0.4 mmol/L,于25 ℃条件下培养12 h后,收集菌体。采用镍亲和层析的方法进行蛋白纯化,经SDS-PAGE检测,所获蛋白大小在56.1 kDa且条带单一(图1-a),符合预期结果。

a-C.glutamicum来源的PGDH蛋白表达和SDS-PAGE分析(1代表破碎上清液;2代表400 mmol/L咪唑洗脱液);b-pH对Cg-PGDH酶活性的影响;c-温度对Cg-PGDH酶活性的影响;d-Cg-PGDH酶的热稳定性测定
图1 野生型Cg-PGDH的纯化及催化活性研究
Fig.1 Purification and catalytic activity of wild-type Cg-PGDH
本研究对上述获得的来源于C.glutamicum的Cg-PGDH蛋白进行酶活性测定。在37 ℃,pH值为8.8的条件下,测定Cg-PGDH的催化活性,比酶活为1.98 U/mg。随后本研究对Cg-PGDH的最适pH进行测定,结果表明Cg-PGDH的最适pH值为9.5(图1-b)。因此,弱碱条件更适合Cg-PGDH,而强酸条件容易使酶变性失活。通过在不同温度条件下测试Cg-PGDH的催化特性发现,Cg-PGDH的最适反应温度为30 ℃(图1-c)。然而,温度稳定性测试结果表明,30 ℃条件下处理10 min后Cg-PGDH剩余酶活为80%,在40 ℃条件下热处理10 min后Cg-PGDH的剩余酶活仅为8%,并且在50 ℃和60 ℃条件下热处理10 min 后Cg-PGDH完全失去催化活性,上述结果说明Cg-PGDH的热稳定性较差,可能是限制其催化活性的重要因素(图1-d)。酶的热稳定性和催化活性是影响途径通量的关键因素,而Cg-PGDH较低的酶活性和热稳定性可能是影响L-丝氨酸生物合成的关键因素。针对这一问题,本研究对拟对Cg-PGDH进行定向进化和筛选,以提高Cg-PGDH的催化活性和热稳定性。
2.2 PGDH的定向进化和高通量筛选
为进一步提高Cg-PGDH的酶活性,本研究采用易错PCR策略构建了Cg-PGDH的突变体文库。通过调整体系中Mg2+和Mn2+的浓度,控制突变率保证每kb基因片段含有1~3个碱基突变。将易错PCR片段整合至pET21b表达质粒上,构建Cg-PGDH的突变体文库,并转化至E.coli BL21(DE3)中。在突变体文库中,挑取单菌落接种至含有LB培养基的96孔板中,在37 ℃条件下培养6 h,加入0.4 mmol/L IPTG,25 ℃条件下继续诱导培养12 h,离心收集菌液。利用含有溶菌酶的裂解液重悬菌体,37 ℃条件下孵育4 h,再次离心收集上清液,获得粗酶液。然后测定粗酶液中Cg-PGDH的催化活性。通过多轮筛选,最终从10 000个突变体中筛选获得了5个酶活性显著提高的突变体,分别为P85Q、A183V、I231V、D365Y、A389T。随后本研究进一步对获得的Cg-PGDH突变体进行表达纯化和活性测定。结果表明,在30 ℃,pH值为8.8的条件下测定P85Q、A183V、I231V、D365Y、A389T的比酶活力分别为5.3、2.7、3.2、4.1、3.3 U/mg,分别是野生型的2.55、1.29、1.54、1.97、1.61倍(图2-a)。
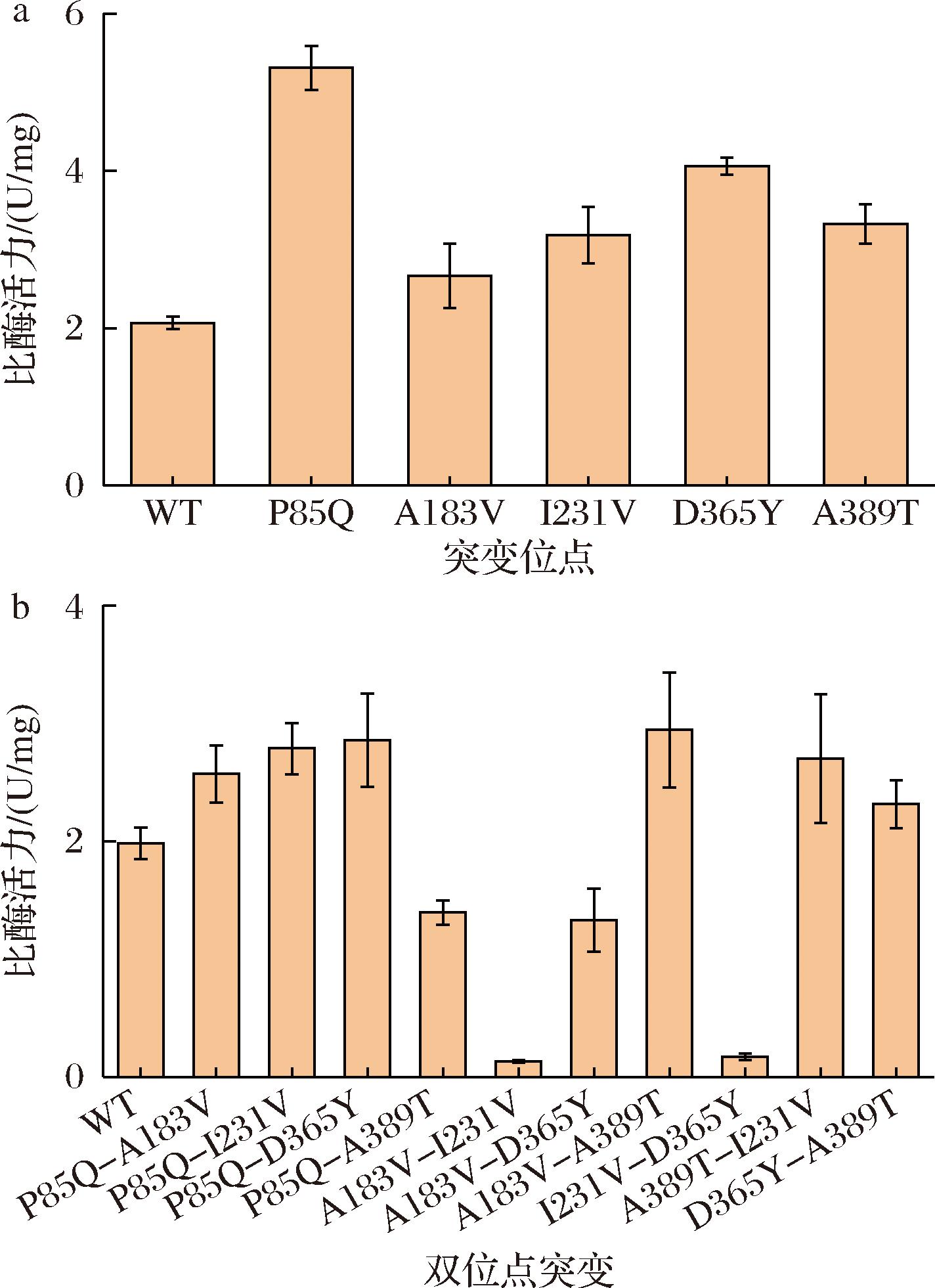
a-Cg-PGDH及其单突变体酶活性测定;b-Cg-PGDH及其双位点组合突变体酶活性测定
图2 Cg-PGDH及突变体酶的酶活性测定
Fig.2 Enzymatic activity assay of Cg-PGDH and mutant enzymes
为进一步研究Cg-PGDH突变体对酶活性的影响,本研究利用定点突变技术对上述获得的P85Q、A183V、I231V、D365Y、A389T等5个突变体的突变位点进行组合突变,共计构建了10个突变体,分别为P85Q-A183V、P85Q-I231V、P85Q-D365Y、P85Q-A389T、A183V-I231V、A183V-D365Y、A183V-A389T、I231V-D365Y、A389T-I231V、D365Y-A389T。随后本研究对获得的10个突变体进行蛋白纯化和酶活性测定。结果表明,P85Q-I231V、P85Q-D365Y、A183V-A389T表现出较高的酶活力,比野生型提高了38%、43%、47%(图2-b)。由表2可知本研究获得的突变体酶活性高于目前已知的突变体酶活性。
表2 相关研究获得的PGDH突变体
Table 2 PGDH mutants obtained from related studies
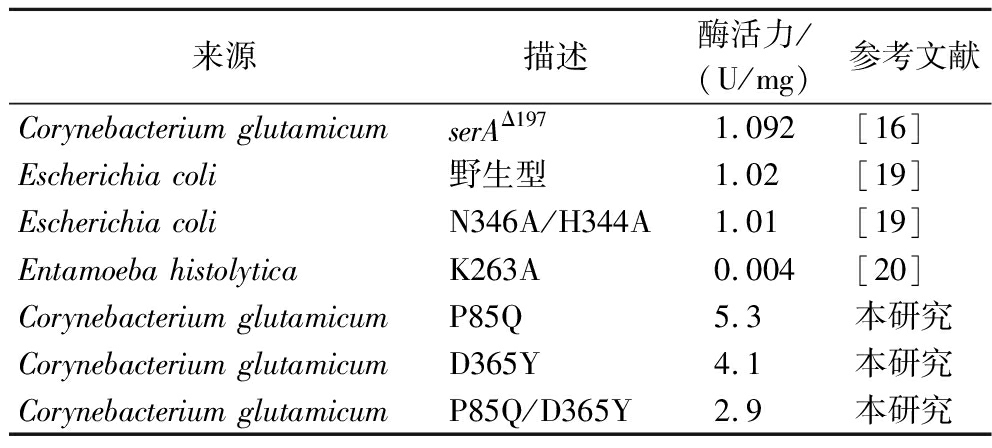
来源描述酶活力/(U/mg)参考文献Corynebacterium glutamicumserAΔ1971.092[16]Escherichia coli野生型1.02[19]Escherichia coliN346A/H344A1.01[19]Entamoeba histolyticaK263A0.004[20]Corynebacterium glutamicumP85Q5.3本研究Corynebacterium glutamicumD365Y4.1本研究Corynebacterium glutamicumP85Q/D365Y2.9本研究
2.3 Cg-PGDH及其突变体的催化特性研究
2.3.1 Cg-PGDH及其突变体的温度稳定性分析
如图3-a所示,突变体P85Q的最适反应温度为60 ℃,I231V、D365Y、A389T的最适反应温度为40 ℃,皆显著高于野生型的最适反应温度,说明突变体P85Q、I231V、D365Y、A389T的突变位点均有助于提高温度稳定性。考虑到在40 ℃条件下,野生型Cg-PGDH处理10 min后几乎丧失活性,所以本研究在40 ℃条件下,对上述突变体的温度稳定性进行测定。结果发现,P85Q、D365Y的残余酶活为53%和34%,I231V、A389T的残余酶活为26%和25%,表明本研究获得的Cg-PGDH突变体酶活性和温度稳定性显著提高(图3-b)。此基础上,本研究还对构建的组合突变体的温度稳定性进行测试,结果表明双重突变体的热稳定性显著提高,其中P85Q-D365Y热稳定性提高最为显著,其残余酶活达到94%(图3-b)。结合图2-b以及图3-b可知,尽管双重突变体对酶活性的贡献有限,但是提高了酶的温度稳定性。因此,本研究获得的Cg-PGDH突变体的酶活性和温度稳定性显著提高,是具有广泛应用潜力的酶催化元件。
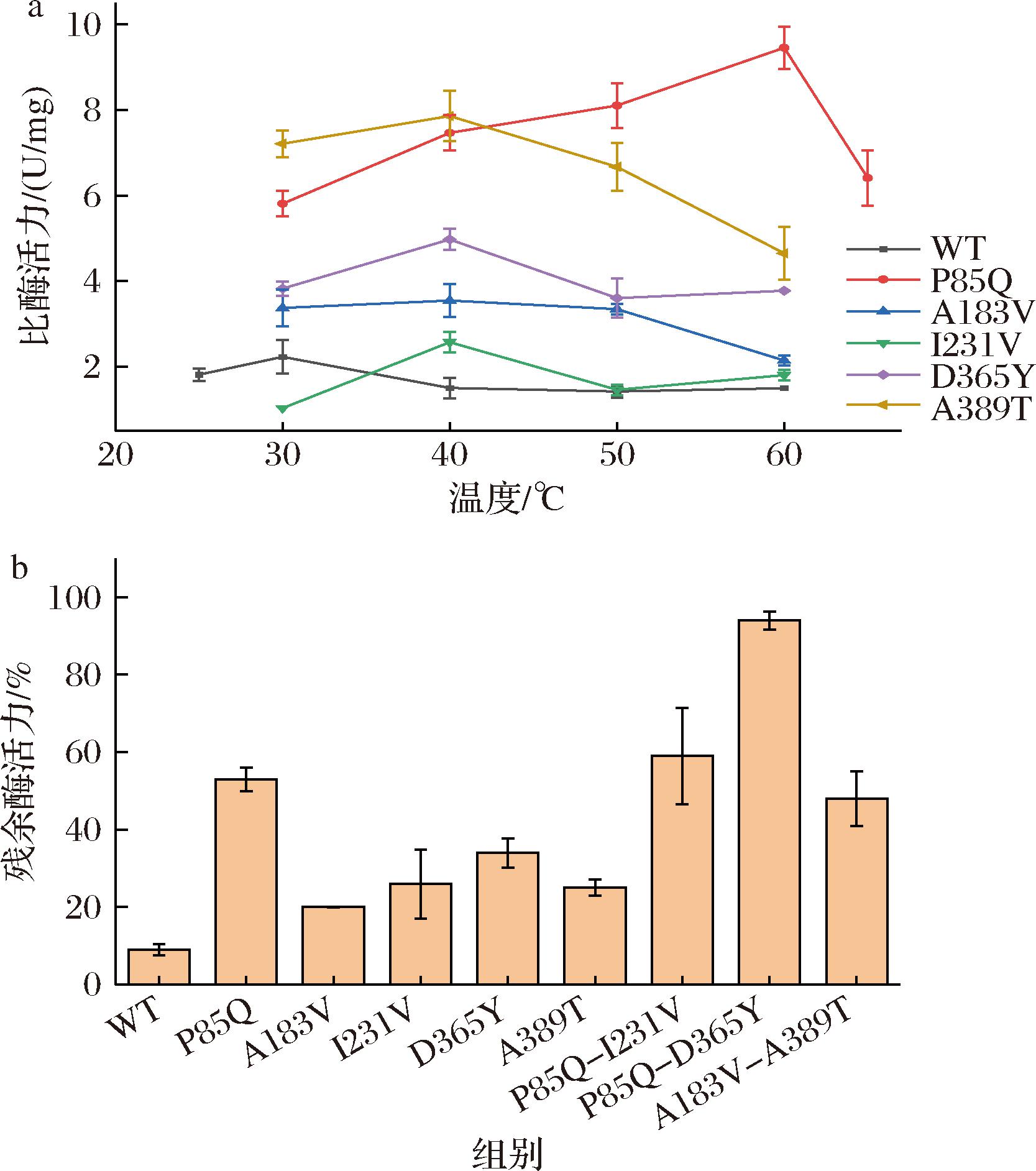
a-Cg-PGDH的及其突变体酶最适温度测定;b-40 ℃条件下处理10 min对Cg-PGDH的及其突变体酶活性的影响
图3 Cg-PGDH突变体酶的催化特性研究
Fig.3 Catalytic characterization of the Cg-PGDH mutant enzyme
2.3.2 酶动力学分析
为进一步探究Cg-PGDH及突变体酶的酶学性质,本研究对其酶催化动力学参数进行分析测定。结果如表3所示,突变体P85Q对底物NAD+和3-磷酸甘油酸具有更高的亲和力,其kcat/Km值相较于野生型酶分别提高了5.67倍和5.36倍。而且在P85Q基础上构建的其他突变体P85Q-I231V和P85Q-D365Y均表现出对底物较高的亲和性和反应速率,其中P85Q-I231V对底物NAD+和3-磷酸甘油酸的kcat/Km值分别是野生型的4.33和1.19倍,而P85Q-D365Y对底物NAD+和3-磷酸甘油酸的kcat/Km值分别是野生型1.44倍和4.43倍。此外,其他突变体对底物的催化特性均有不同程度的提高。结果表明,本研究获得的突变体能显著提高底物的亲和性和催化效率,进而提高酶的催化活性。
表3 Cg-PGDH及突变体酶的动力学参数测定
Table 3 Determination of kinetic parameters of Cg-PGDH and mutant enzymes
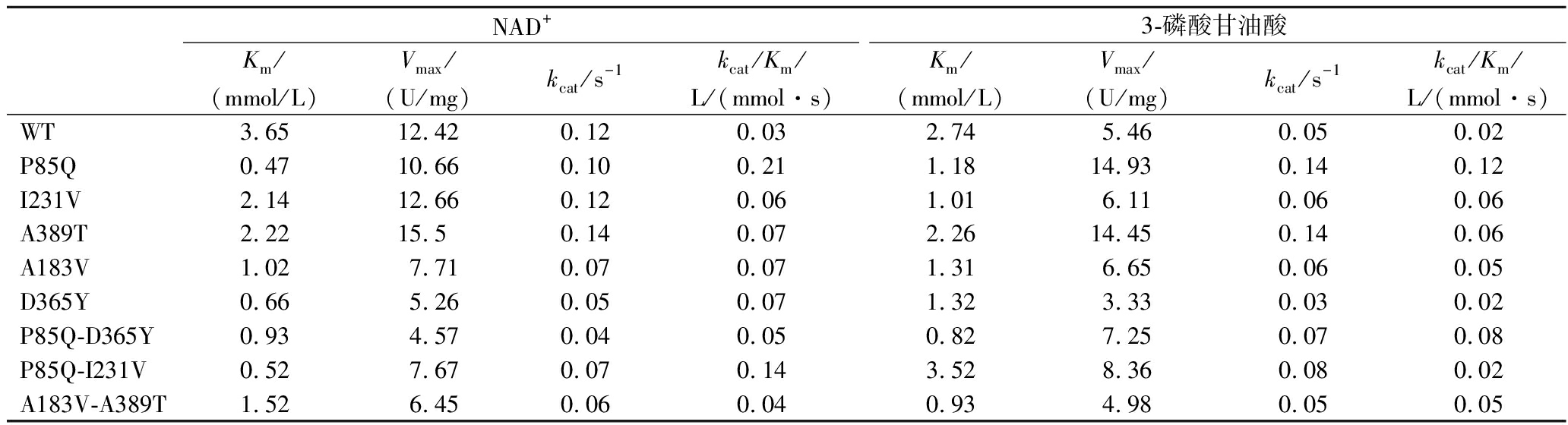
NAD+3-磷酸甘油酸Km/(mmol/L)Vmax/(U/mg)kcat/s-1kcat/Km/L/(mmol·s)Km/(mmol/L)Vmax/(U/mg)kcat/s-1kcat/Km/L/(mmol·s)WT3.6512.420.120.032.745.460.050.02P85Q0.4710.660.100.211.1814.930.140.12I231V2.1412.660.120.061.016.110.060.06A389T2.2215.50.140.072.2614.450.140.06A183V1.027.710.070.071.316.650.060.05D365Y0.665.260.050.071.323.330.030.02P85Q-D365Y0.934.570.040.050.827.250.070.08P85Q-I231V0.527.670.070.143.528.360.080.02A183V-A389T1.526.450.060.040.934.980.050.05
2.3.3 蛋白热变性中点温度(Tm)测试
Tm是评价蛋白热稳定性的重要指标。蛋白在热变性过程中,会发生蛋白解折叠,从而改变蛋白的空间构象和催化性能[21]。在这一过程中,Tm表示蛋白解折叠50%时的温度,能够衡量变温过程中蛋白构象的改变趋势,表明蛋白的热稳定性。差示扫描量热法是评估蛋白热变性过程的重要方法,通过分析蛋白随温度变化发生的焓变,计算蛋白变性过程的吸热效应,从而获得热变性与蛋白构象变化的热信息。因此,本研究利用差式扫描量热法测试Cg-PGDH突变体的热稳定性。结果如图4所示,野生型Cg-PGDH的Tm值为48.5 ℃,而大部分Cg-PGDH突变体的Tm值比野生型有不同程度的提高,其中突变体P85Q、I231V、D365Y、A389T的Tm分别为49.5、49.0、50.9、47.8 ℃。结果表明Cg-PGDH突变体的热稳定性显著提高,该结果与图3-b的温度稳定测试结果基本趋势一致。
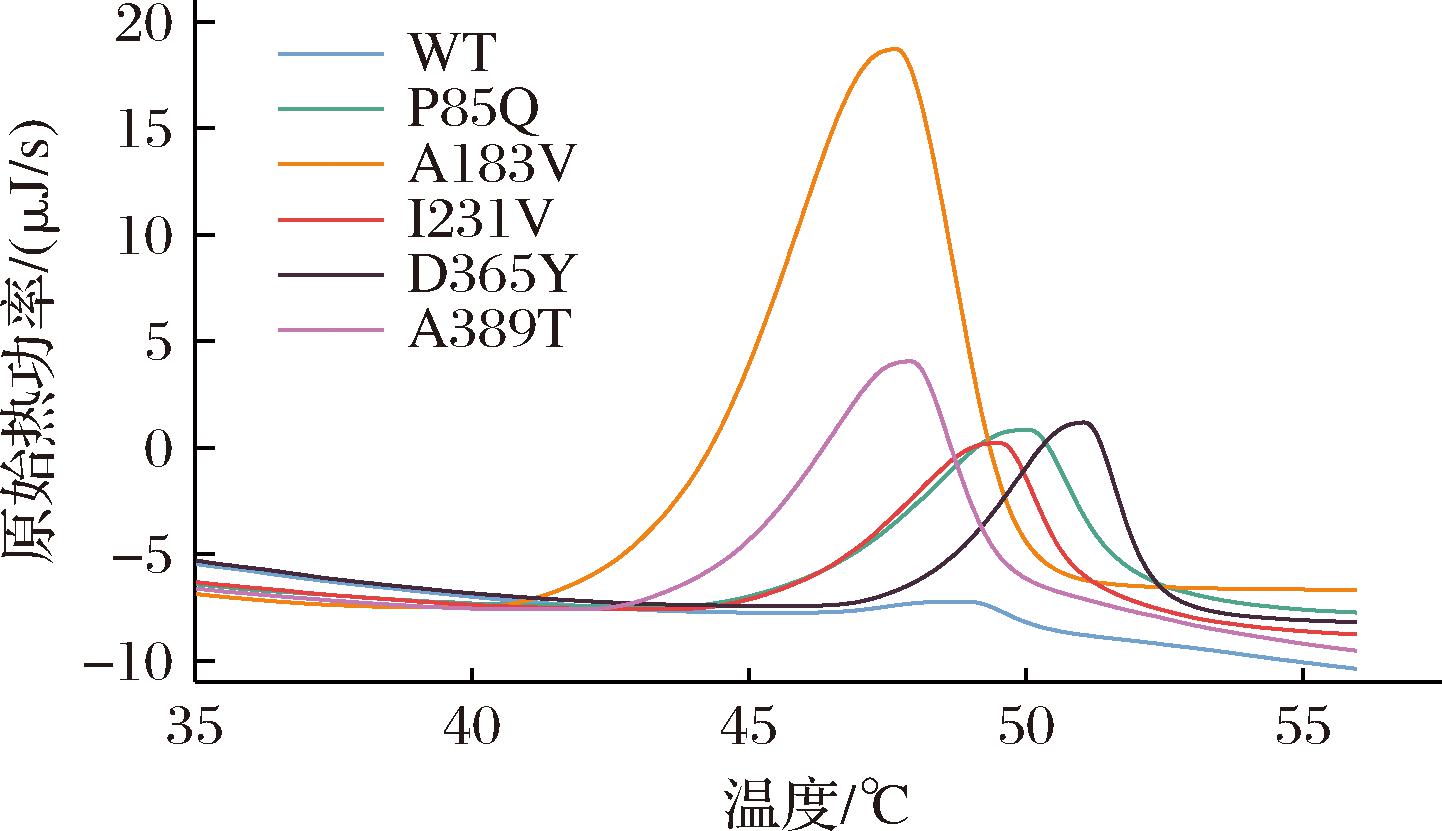
图4 差式扫描量热仪测试解链温度结果
Fig.4 Differential scanning calorimeter test results for unchaining temperature
2.3.4 Cg-PGDH突变位点的结构解析
为进一步探究Cg-PGDH突变位点对蛋白质结构的影响,本研究利用AlphaFold在线分析软件对Cg-PGDH蛋白进行结构预测。如图5-a所示。本研究以来源于Mycobacterium tuberculosis的PGDH多聚体的晶体结构1YGY作为模板,构建了Cg-PGDH的四聚体结构。由于1YGY结构中缺乏与底物和辅酶的共结晶结构,因此选择与1YGY结构的辅酶结合结构域近似度较高的来源于Escherichia coli的PGDH(1YBA)晶体结构域为模版,将底物NAD+以及产物结构近似物α-酮戊二酸的分子映射入Cg-PGDH的结构中,最终确定辅酶与底物的结合区域。

a-Cg-PGDH的四聚体结构;b-野生型Cg-PGDH和突变体酶的RMSF比较;c-Cg-PGDH 120~140残基空间位置;d-Cg-PGDH 120~140残基概率分布
图5 Cg-PGDH突变位点的结构解析
Fig.5 Structural elucidation of the Cg-PGDH mutation site
在前期研究结果中发现,突变体P85Q与D365Y的突变位点突变能有效增强Cg-PGDH酶的催化活性和稳定性,但是从结构来看两个突变点距离催化反应中心都较远。因此,为进一步探究P85Q、D365Y两个突变位点增强Cg-PGDH稳定性和活性的关键机制,本研究对上述两个突变体结构进行了100 ns的分子动力学模拟实验,以分析突变位点对Cg-PGDH的结构波动影响,解析突变位点P85Q和D365Y的催化机制。结果如图5-b所示,P85Q突变位点对其附近区域的结构稳定性的影响较小,但是对130~140区间这个野生型结构波动较大的位置起到了一定的稳定作用。有趣的是,D365Y突变位点同样没有对其周围的结构稳定性发挥作用,但是对130~140区间的稳定性也有一定程度的提升作用。由此可见,130~140区间可能是影响Cg-PGDH热稳定性和催化活性的重要结构域。通过结构分析发现,130~140区间所在loop区域位于酶的活性中心位置,与产物类似物α-酮戊二酸(AKG)存在潜在的结合(图5-c)。在此基础上,通过序列分析,对比了1 000条3-PGDH的同源序列发现,134位点为R残基的概率为100%,说明R134位点是高度保守的(图5-d)。R134位点能够与3-磷酸甘油酸的磷酸基团发生相互作用,是决定底物结合和催化效率的关键残基。上述结果表明,尽管P85Q与D365Y突变位点并未影响其附近区域的结构稳定性,但是对底物结合处的结构稳定性有重要促进作用,稳定了底物结合的关键氨基酸残基,增加了底物的亲和性和酶催化结构域的稳定性,从而提升了Cg-PGDH在该温度下的催化活性。本研究结果为进一步解析Cg-PGDH的催化机制,提高Cg-PGDH的催化活性提供了重要的研究基础和方向。
3 结论
PGDH是L-丝氨酸生物合成途径的关键限速酶,是影响L-丝氨酸高效合成的关键。本研究以来源于C.glutamicum中的PGDH为研究对象,通过蛋白表达纯化和酶活测定,分析了PGDH的催化特性。在此基础上,为进一步提高Cg-PGDH的催化活性,本研究对Cg-PGDH进行定向进化和高通量筛选,最终获得了5个催化活性显著提升的突变体,P85Q、D365Y、A389T、A183V、I231V。其中,P85Q突变体的酶活性提升了1.55倍,酶活性可高达5.3 U/mg,并且显著提高了酶的温度稳定性,最适催化温度达到60 ℃。随后本研究对突变体P85Q、D365Y、A389T、A183V和231V的突变位点进行组合突变,获得的突变体P85Q-D365Y的催化活性和温度稳定性进一步提高。随后本研究进一步利用差示扫描量热法和结构解析了Cg-PGDH突变位点的催化作用机制,结果表明P85Q与D365Y突变位点能够显著提高Cg-PGDH底物结合中心的结构稳定性,从而增加了底物亲和性和结构稳定性,进而提高了酶的催化活性。相关研究成果为L-丝氨酸的高效合成提供了高性能的酶元件,同时本研究对PGDH的催化机制研究为进一步提高PGDH的催化活性提供了重要的研究基础和方向。
[1] MITSUHASHI S.Current topics in the biotechnological production of essential amino acids, functional amino acids, and dipeptides[J].Current Opinion in Biotechnology, 2014, 26:38-44.
[2] 卢发, 张伟国.L-丝氨酸产生菌的分离筛选及发酵条件[J].食品与生物技术学报, 2005, 24(2):46-49; 54.LU F, ZHANG W G.Screening of L-serine producer and the fermentation conditions in shake-flask culture[J].Journal of Food Science and Biotechnology, 2005, 24(2):46-49; 54.
[3] EAGLE H.Amino acid metabolism in mammalian cell cultures[J].Science, 1959, 130(3373):432-437.
[4] FAN W, TANG S, FAN X J, et al.SIRT1 regulates sphingolipid metabolism and neural differentiation of mouse embryonic stem cells through c-Myc-SMPDL3B[J].eLife, 2021, 10:e67452.
[5] PHONE MYINT S M M, SUN L Y.L-serine:Neurological implications and therapeutic potential[J].Biomedicines, 2023, 11(8):2117.
[6] 杨帆. 利用重组大肠杆菌生产L-丝氨酸的研究[D].济南:山东大学, 2013.YANG F.Production of L-serine in recombinant Escherichia coli[D].Jinan:Shandong University, 2013.
[7] 克丽凤, 张伟国, 钱和.L-丝氨酸的生产及其应用[J].江苏食品与发酵, 2001(2):19-22.KE L F, ZHANG W G, QIAN H.Production and application of L-serine[J].Jiangsu Food and Fermentation, 2001(2):19-22.
[8] EFFENBERGER F, ZOLLER G.Amino acids;13 Investigations on the synthesis of dl-serine from α-haloacrylic acid derivatives[J].Tetrahedron, 1988, 44(17):5573-5582.
[9] ZHU G Y, ZHU X, WAN X L, et al.Hydrolysis technology and kinetics of poultry waste to produce amino acids in subcritical water[J].Journal of Analytical and Applied Pyrolysis, 2010, 88(2):187-191.
[10] JIANG W, XIA B Z, LIU Z D.A serine hydroxymethyltransferase from marine bacterium Shewanella algae:Isolation, purification, characterization and L-serine production[J].Microbiological Research, 2013, 168(8):477-484.
[11] 朱林江, 李崎.L-丝氨酸的微生物法制备研究进展[J].食品与发酵工业, 2015, 41(1):181-185.ZHU L J, LI Q.Microbial production of L-serine[J].Food and Fermentation Industries, 2015, 41(1):181-185.
[12] XU G Q, JIN X X, GUO W, et al.Characterization, modification, and overexpression of 3-phosphoglycerate dehydrogenase in Corynebacterium glutamicum for enhancing L-serine production[J].Annals of Microbiology, 2015, 65(2):929-935.
[13] BELL J K, PEASE P J, BELL J E, et al.De-regulation of D-3-phosphoglycerate dehydrogenase by domain removal[J].European Journal of Biochemistry, 2002, 269(17):4176-4184.
[14] GRANT G A.Transient kinetic analysis of L-serine interaction with Escherichia coli D-3-phosphoglycerate dehydrogenase containing amino acid mutations in the hinge regions[J].Biochemistry, 2011, 50(14):2900-2906.
[15] GRANT G A, XU X L, HU Z.Role of an interdomain Gly-Gly sequence at the regulatory-substrate domain interface in the regulation of Escherichia coli D-3-phosphoglycerate dehydrogenase[J].Biochemistry, 2000, 39(24):7316-7319.
[16] 金雪霞. 基因serA及sdaA对谷氨酸棒杆菌SYPS-062积累L-丝氨酸的影响分析[D].无锡:江南大学, 2011.JIN X X.Effects of genes serA and sdaA on accumulation of L-serine in Corynebacterium glutamicum SYPS-062[D].Wuxi:Jiangnan University, 2011.
[17] 来书娟, 张芸, 刘树文, 等.产L-丝氨酸谷氨酸棒杆菌的代谢工程改造和代谢流分析[J].中国科学:生命科学, 2012, 42(4):295-303.LAI S J, ZHANG Y, LIU S W, et al.Metabolic engineering and metabolic flux analysis of L-serine-producing Corynebacterium glutamicum[J].Scientia Sinica (Vitae), 2012, 42(4):295-303.
[18] PETERS-WENDISCH P, NETZER R, EGGELING L, et al.3-phosphoglycerate dehydrogenase from Corynebacterium glutamicum:The C-terminal domain is not essential for activity but is required for inhibition by L-serine[J].Applied Microbiology and Biotechnology, 2002, 60(4):437-441.
[19] 邓辉, 陈存武, 孙传伯, 等.大肠杆菌磷酸甘油酸脱氢酶突变体的构建及抗反馈抑制效应[J].生物工程学报, 2016, 32(4):468-477.DENG H, CHEN C W, SUN A, et al.Construction and characterization of Escherichia coli D-3-phosphoglycerate dehydrogenase mutants with feedback-inhibition relief[J].Chinese Journal of Biotechnology, 2016, 32(4):468-477.
[20] SINGH R K, RAJ I, PUJARI R, et al.Crystal structures and kinetics of Type III 3-phosphoglycerate dehydrogenase reveal catalysis by lysine[J].The FEBS Journal, 2014, 281(24):5498-5512.
[21] 周翠燕, 俞敏达, 李文奇.三种测定蛋白质热稳定性方法的比较[J].分析测试技术与仪器, 2021, 27(4):252-259.ZHOU C Y, YU M D, LI W Q.Comparation of three measuring methods for thermodynamic stability of protein[J].Analysis and Testing Technology and Instruments, 2021, 27(4):252-259.