马铃薯是全球第四大粮食作物之一,其地位仅次于水稻、玉米和小麦[1]。马铃薯晚疫病是由致病疫霉菌(Phytophthora infestans)侵染马铃薯(Solanum tuberosum L.)引起的,会导致马铃薯块茎腐烂和叶茎死亡,给马铃薯种植产业带来巨大的经济损失。目前防治马铃薯晚疫病的主要药剂是化学农药,但大量使用化学农药很容易使致病疫霉菌的抗药性增强,还会带来农药残留超标等食品安全问题。近年来,通过植物、动物、微生物中的有效活性成分抑制植物病原菌的生长与繁殖已经成为研究热点[2]。
芽孢杆菌是一类能产生芽孢的革兰氏阳性细菌,具有易繁殖、生长快、抗逆性强等特点[3-4],芽孢杆菌能产生脂肽类物质、拮抗蛋白和聚酮类化合物等丰富的抗菌活性物质,能够抑制植物病原菌的生长,提高植株的抗病性,在食品抑菌保鲜和农业生物防治领域应用广泛[5-6]。近年来利用芽孢杆菌作为绿色果蔬保鲜剂成为一种趋势,研究表明,芽孢杆菌能够有效抑制多种果蔬病原菌,例如梨黑腐皮壳菌(Valsa mali var.pyri)[7]、葡萄座腔菌(Botryosphaeria dothidea)[7]、灰葡萄孢菌(Botrytis cinerea)[8]等。本研究以自主分离获得的两株芽孢杆菌为研究对象,探究其脂肽粗提物对马铃薯致病疫霉的抑菌作用,研究结果为预防马铃薯晚疫病及开发天然食品防腐剂提供一定的数据参考。
1 材料与方法
1.1 实验材料
1.1.1 菌种
芽孢杆菌:多粘类芽孢杆菌HL11和卡氏芽孢杆菌ST-1[9],由本实验室自主分离并保存。
供试病原真菌:致病疫霉菌(P.infesfans),由湖北省生物农药工程技术研究中心提供。
1.1.2 试剂
酵母浸粉、蛋白胨、葡萄糖、DMSO、NaCl(均为生化试剂),国药集团化学试剂有限公司;乙酸异戊酯,上海麦克林科技股份有限公司;甘油明胶封片剂、Gluta固定液(电镜专用,体积分数2.5%),北京索莱宝科技有限公司;赫斯特染料(Hoechst stains,Hoechst 33258),上海源叶生物科技有限公司;碘化丙啶(propidium iodide,PI),金克隆(北京)生物技术有限公司;2,7-二氯二氢荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH2-DA),阿拉丁试剂(上海)有限公司。
1.1.3 培养基
PDA培养基(g/L):马铃薯200、葡萄糖20、琼脂18。
PD培养基(g/L):马铃薯200、葡萄糖20。
LB(luria broth)固体培养基(g/L):酵母浸粉5.0、蛋白胨10.0、NaCl 5.0、琼脂粉18,pH自然。
1.1.4 主要仪器与设备
BZ-X810一体化荧光显微成像系统,日本基恩士公司;SU8010高分辨场发射扫描电镜,日本Hitachi公司;ZHWY-2102C恒温摇床,上海智城分析仪器制造有限公司;DNP-9022生化培养箱,上海精宏分析仪器制造有限公司;EYELA N-1300旋转蒸发仪,东京理化器械株式会社;Modulyod-230真空冷冻干燥机,美国热力公司;牛津杯钢管6 mm×8 mm×10 mm、封口膜3 cm、打孔器0.5 cm,市售。
1.2 实验方法
1.2.1 菌种活化
分别挑取HL11、ST-1单菌落接种于装有100 mL LB液体培养基的锥形瓶中,在30 ℃、200 r/min条件下摇床培养16 h。将上述已活化的菌液转接于LB液体培养基,在30 ℃、200 r/min条件下培养24 h,可得种子液。
将HL11、ST-1活化的种子液按照2%接种量分别接种于装有1 000 mL LB液体培养基的2 L锥形瓶中,30 ℃,200 r/min摇床培养48 h。
1.2.2 脂肽粗提物制备
酸沉淀法[10]提取发酵液中的脂肽粗提物,取48 h的细菌发酵液于烧杯中,用6 mol/L的盐酸溶液调节pH值至2.0左右后放置于4 ℃冰箱中静置过夜,8 000 r/min离心10 min,弃去上清液,用甲醇溶液反复浸提沉淀,直至甲醇溶液变为无色,收集溶有脂肽粗提物的甲醇溶液。用1 mol/L的NaOH溶液调节pH值至7.0左右后用旋转蒸发仪40 ℃下蒸干提取液,经冷冻干燥获得脂肽粗提物粉末,置于4 ℃冰箱中保存备用。
用甲醇溶解脂肽粗提物,配成10 mg/mL的母液,使用0.22 μm无菌滤膜过滤获得无菌的脂肽粗提物溶液,使用甲醇将脂肽粗提物母液依次稀释至1、0.1、0.01、0.001、0.000 1 mg/mL等质量浓度,备用。
1.2.3 抑菌率测定
以致病疫霉菌为指示菌,挑取斜面真菌菌丝,接种于PDA培养基上生长7 d。用打孔器(0.5 cm)打孔致病疫霉真菌,将真菌菌饼0.5 cm接种于9 cm PDA平板中央,在距离菌饼2 cm处对称放置两个牛津杯,每个牛津杯吸取100 μL脂肽粗提物溶液,空白对照组加入100 μL甲醇溶液,每个处理有3组平行。将PDA平板放置在28 ℃培养箱中黑暗培养7 d,每隔24 h测量各处理致病疫霉真菌生长的菌落直径,直至空白对照组的真菌菌丝长满平板,按照公式(1)计算各浓度粗提物对致病疫霉的抑菌率,通过软件拟合得到回归方程,计算两种芽孢杆菌脂肽粗提物作用于致病疫霉菌的半最大效应浓度(concentration for 50% of maximal effect,EC50)。
抑菌率![]()
(1)
1.2.4 致病疫霉菌丝经脂肽粗提物处理后的形态变化
1.2.4.1 致病疫霉菌丝体的制备
制备致病疫霉菌孢子悬浮液,使其浓度达到106 CFU/mL,将其转接到装液量为100 mL/250 mL的锥形瓶中,在28 ℃、200 r/min的摇床里培养2 d;吸取培养好的真菌菌悬液10 mL转移至100 mL的无菌锥形瓶中,分别添加不同处理的芽孢杆菌脂肽粗提物溶液,添加浓度为EC50浓度,空白对照组添加等量无菌的甲醇溶液,继续培养12~24 h。
1.2.4.2 扫描电镜观察脂肽处理对菌丝形态的影响
分别吸取1 mL上述脂肽粗提物溶液和甲醇处理的真菌菌丝,10 000 r/min条件下离心5 min,弃上清液,加入1 mL灭菌的PBS重悬、吹打、离心,重复操作3次,最后吸取菌丝均匀涂抹在锡纸上,铺平风干,在锡纸上加入2.5%的戊二醛溶液,使其样品都浸泡在溶液中,在4 ℃环境固定3 h。使用PBS反复冲洗锡纸样品2次,每次15 min。依次使用50%、60%、70%、80%、90%、95%、100%(体积分数)的乙醇脱水,每次脱水10 min。最后,使用100%的乙酸异戊酯溶液置换2次,每次15 min。喷金后用扫描电镜在12 kV下观察。
1.2.5 脂肽粗提物处理真菌菌丝后的形态变化
分别将Hoechest 33258、PI、DCFH2-DA稀释至合适浓度备用。制备致病疫霉菌悬液,方法同1.2.4.1节。将真菌菌悬液在4 ℃,10 000 r/min条件下离心20 min,弃上清液,用PBS洗涤3次菌丝后,将菌丝重悬10 mmol/L PBS中,分别加入10 μg/mL Hoechest 33258、20 μg/mL PI、50 μmol/L DCFH2-DA试剂,在28 ℃条件下避光反应30 min,在荧光显微镜下观察。
1.2.6 MALDI-TOF-MS鉴定HL11脂肽粗提物成分
称取0.01 g脂肽类物质送至e测试武汉分公司平台鉴定。
检测仪器与条件[11]:基质辅助激光解吸电离飞行时间质谱(matrixassisted laser desorption ionization-time of flight mass spectrometry,MALDI-TOF-MS)为德国BRUKER microflex LRF-MALDI-TOF-MS检测器,使用337 nm氮激光源解吸附电离,基质为α-氰基-4-羟基肉桂酸,0.1%三氟乙酸+50%乙腈,采用正离子检测和反射模式,样品粗检测范围为0~3 000 Da,进一步检测范围为800~1200 Da。
1.2.7 数据统计
使用Excel进行数据处理,SPSS数据软件进行方差分析,软件Origin 2019b作图。
2 结果与分析
2.1 不同浓度的脂肽粗提物对致病疫霉菌的抑制作用
由图1、图2可得,两株芽孢杆菌的脂肽粗提物对致病疫霉菌落生长均有明显的抑制作用,且随着脂肽类物质浓度的增加,抑菌率逐渐增大。如图3所示,多粘芽孢杆菌HL11的脂肽粗提物浓度为0.1、1、10 mg/mL,抑菌率分别为(38.43±0.23)%、(57.02±0.74)%和(74.79±0.52)%,卡氏芽孢杆菌ST-1的脂肽粗提物质量浓度为0.1 mg/mL,其对致病疫霉的抑菌率即可达到(74.48±0.53)%,与多粘芽孢杆菌相比,两者存在显著性差异(P<0.05)。当脂肽粗提物质量浓度提高到10 mg/mL时,ST-1对致病疫霉的抑菌率为(79.5±0.54)%。研究表明,卡氏芽孢杆菌ST-1脂肽粗提物对致病疫霉的抑菌效果优于多粘芽孢杆菌HL11。
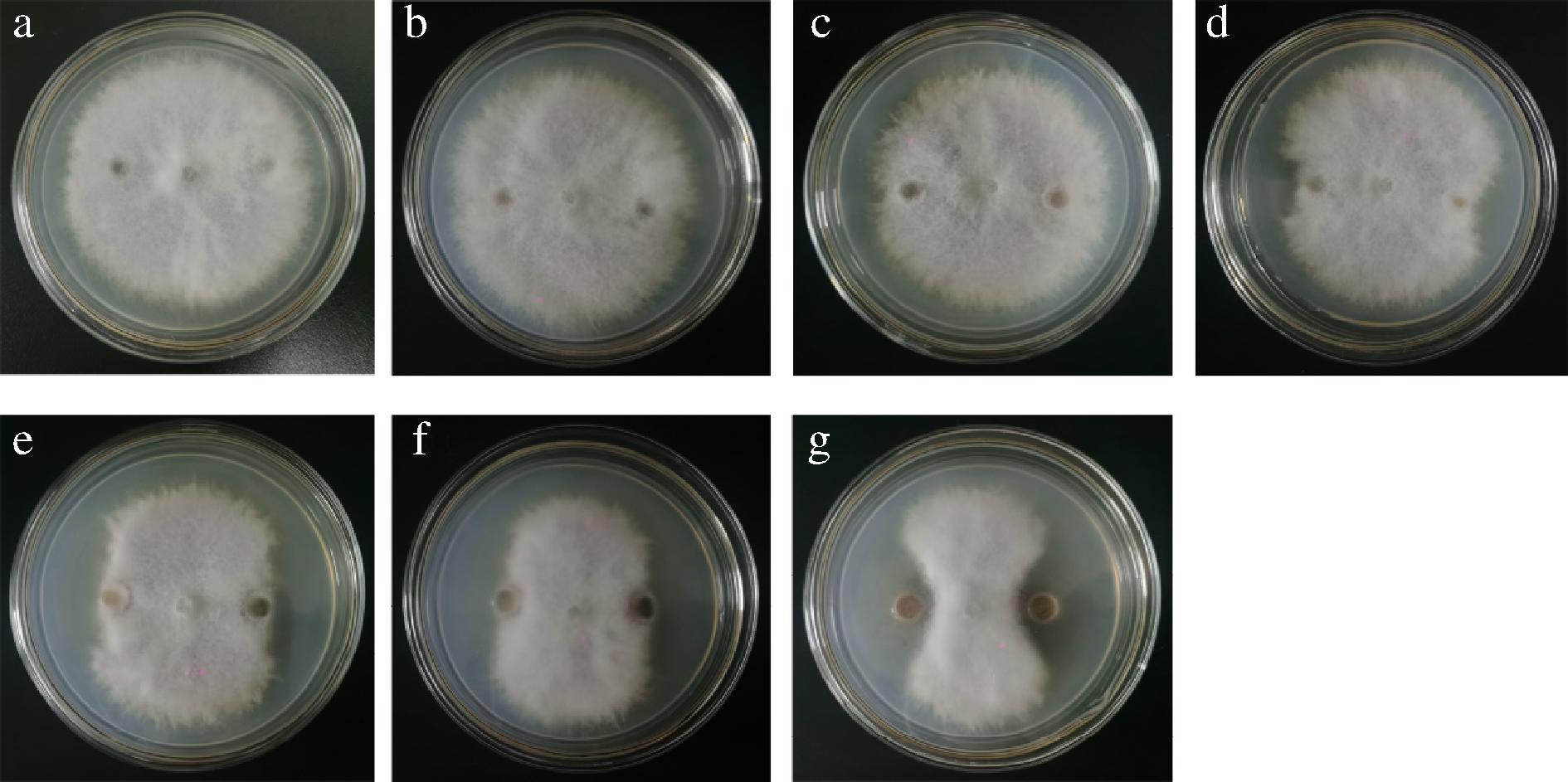
图1 不同质量浓度的HL11脂肽粗提物对致病疫霉菌的抑制作用
Fig.1 Inhibitory effect of crude extracts of HL11 lipopeptides at different concentrations on P.infesfans
注:a为空白对照,b~g的脂肽粗提物溶液质量浓度分别为
0.000 1、0.001、0.01、0.1、1 mg/mL和10 mg/mL(图2同)。
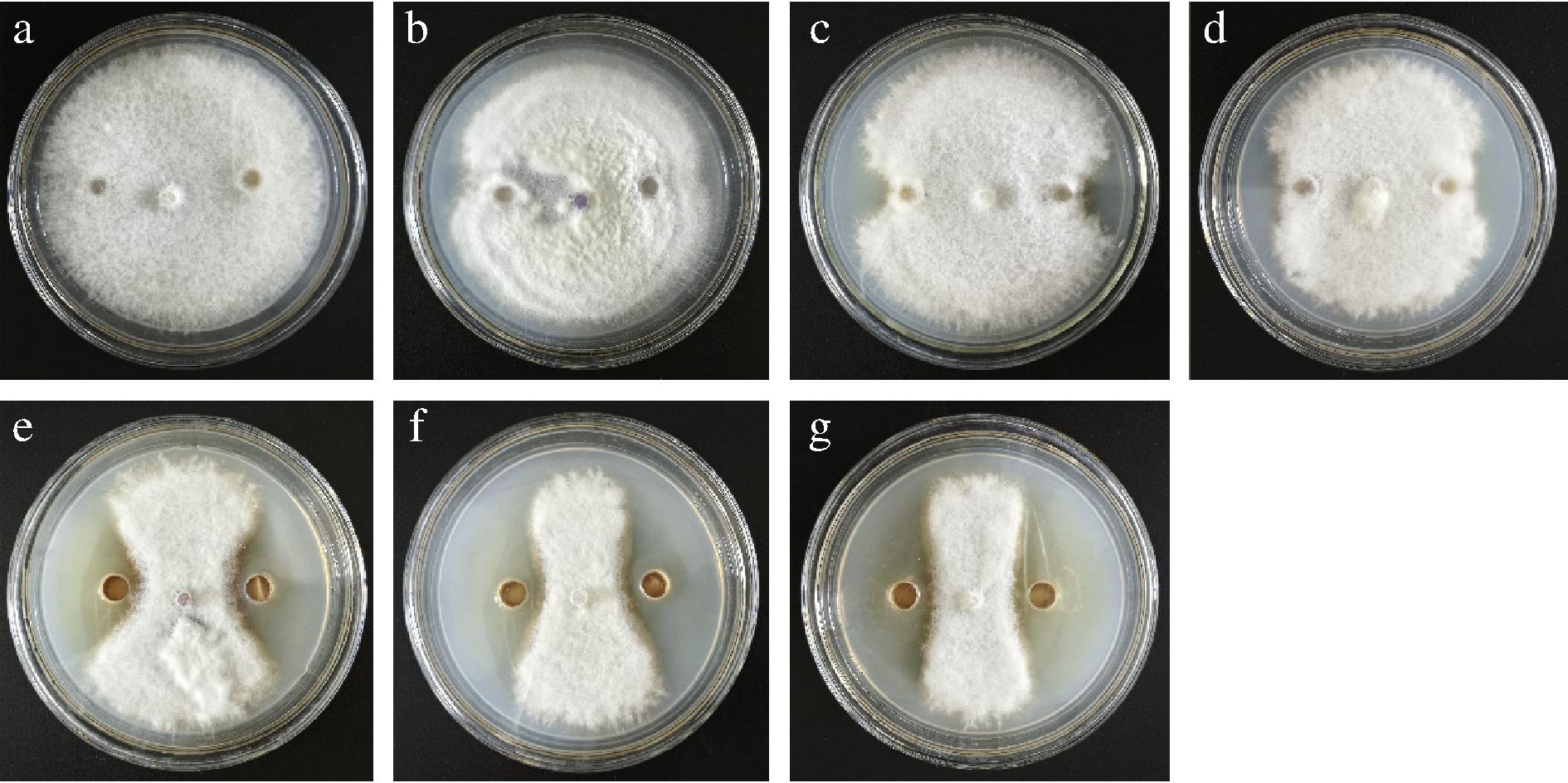
图2 不同质量浓度的ST-1脂肽粗提物对致病疫霉菌的抑制作用
Fig.2 Inhibitory effect of crude extracts of ST-1 lipopeptides at different concentrations on P.infesfans
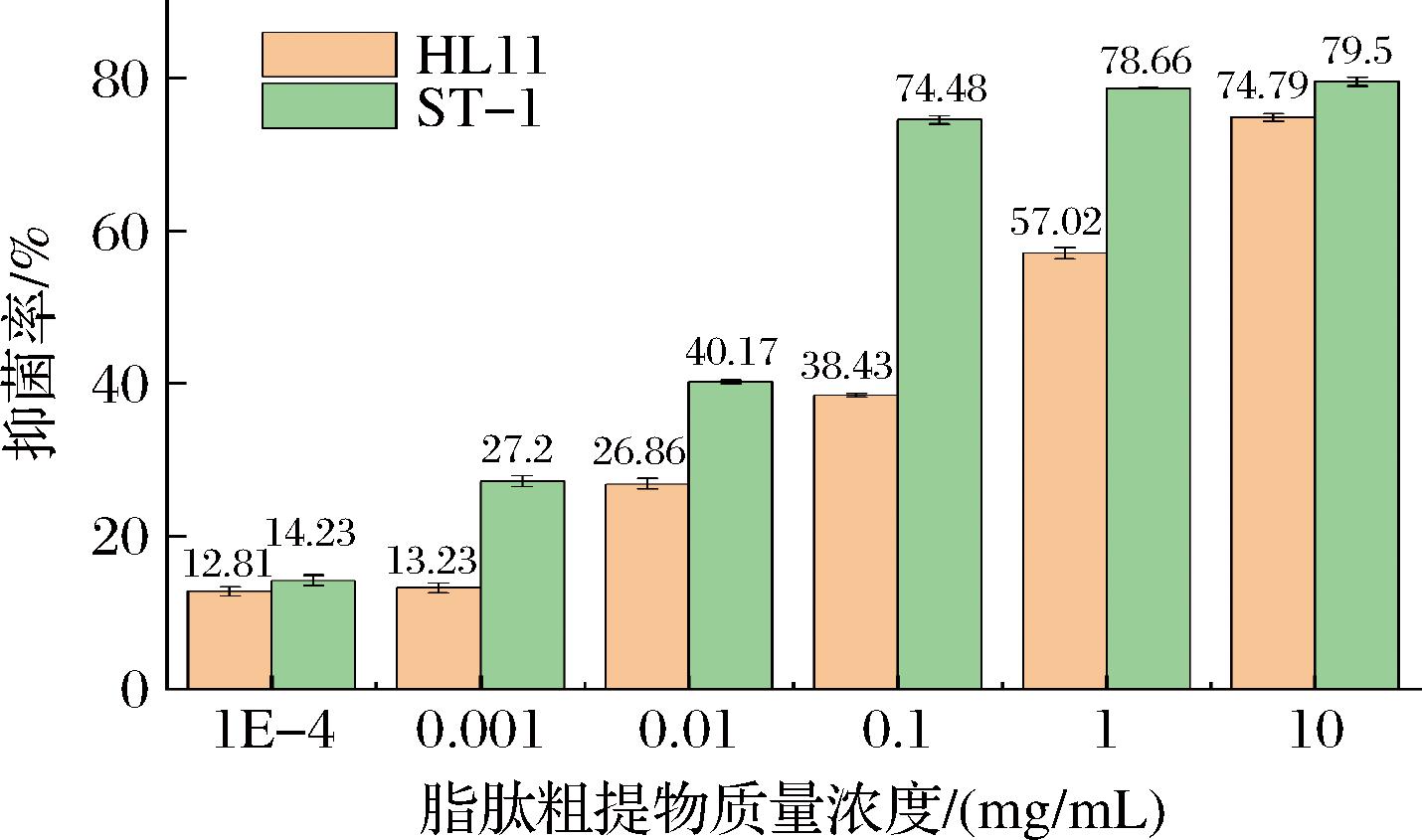
图3 不同质量浓度的脂肽粗提物对致病疫霉的抑菌率
Fig.3 The inhibition rate of different concentrations of lipopeptide crude extracts on P.infestans
为了确定脂肽粗提物对致病疫霉的浓度,对HL11和ST-1的脂肽粗提物的EC50进行测定,如图4所示,多粘芽孢杆菌HL11和卡氏芽孢杆菌ST-1对致病疫霉的EC50分别为0.56 mg/mL和0.021 mg/mL,两者之间存在显著性差异(P<0.05),且HL11和ST-1的脂肽粗提物质量浓度在0.001~1 mg/mL时,两者的抑菌率相差较大;当脂肽粗提物质量浓度为0.000 1、10 mg/mL时,HL11和ST-1对致病疫霉的抑菌效果相差不大。
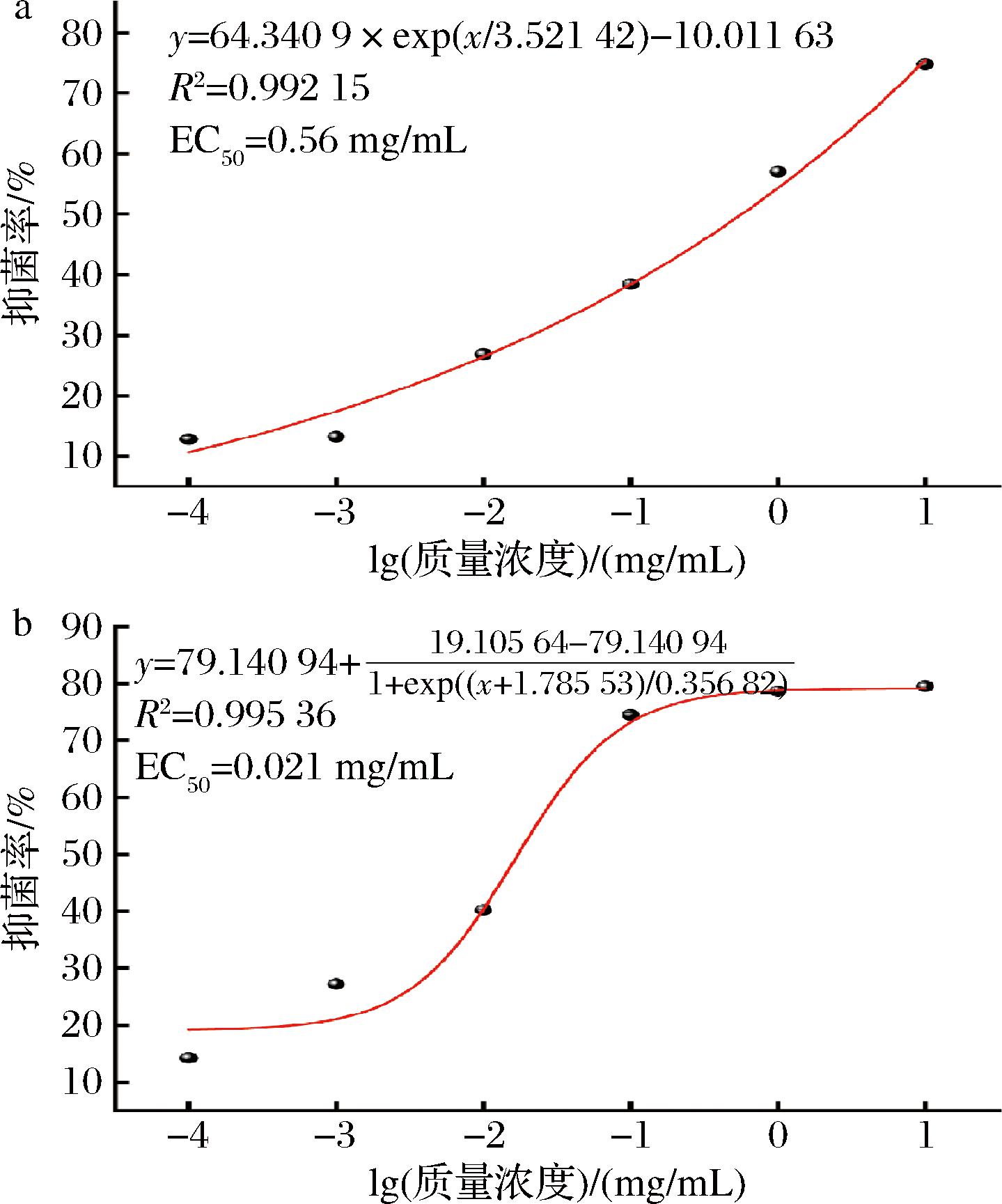
a-HL11的拟合曲线图;b-ST-1的拟合曲线图
图4 脂肽粗提物质量浓度与抑菌率的拟合曲线图
Fig.4 The fitting curve of lipopeptide crude extract concentration and antibacterial rate
注:横坐标中的-4、-3、-2、-1、0、1分别代表脂肽粗提物浓度为0.000 1、0.001、0.01、0.1、1 mg/mL和10 mg/mL。

a-甲醇处理组;b-HL11脂肽粗提物处理组;c-ST-1脂肽粗提物处理组
图5 脂肽粗提物处理对致病疫霉菌菌丝形态的影响
Fig.5 Effect of lipopeptide crude extract treatment on mycelial morphology of P.infestans
2.2 脂肽粗提物对致病疫霉菌菌丝形态的影响
在扫描电镜下观察,经甲醇处理的空白对照组真菌菌丝形态完整,菌丝纤细表面光滑、结构完整呈现细条状,表面无明显凹陷或者出现突起;经脂肽粗提物EC50浓度处理组真菌菌丝粘连缠绕在一起,出现了不规则膨胀变形,菌丝表面出现凹陷变形或者突起等现象。
2.3 脂肽粗提物对致病疫霉菌菌丝细胞的凋亡作用
2.3.1 脂肽粗提物对致病疫霉菌菌丝细胞染色质的作用
由图6可见,经过Hoechest 33258荧光染色处理后,甲醇对照组在荧光显微镜下观察到微弱的蓝光或者无色(图6-d),而处理组的菌丝呈现出强亮蓝色(图6-e、图6-f),而且真菌菌丝呈现强亮蓝色的位置主要是膨大变形的部位,说明真菌细胞经过脂肽粗提物处理后出现了染色质凝聚现象。
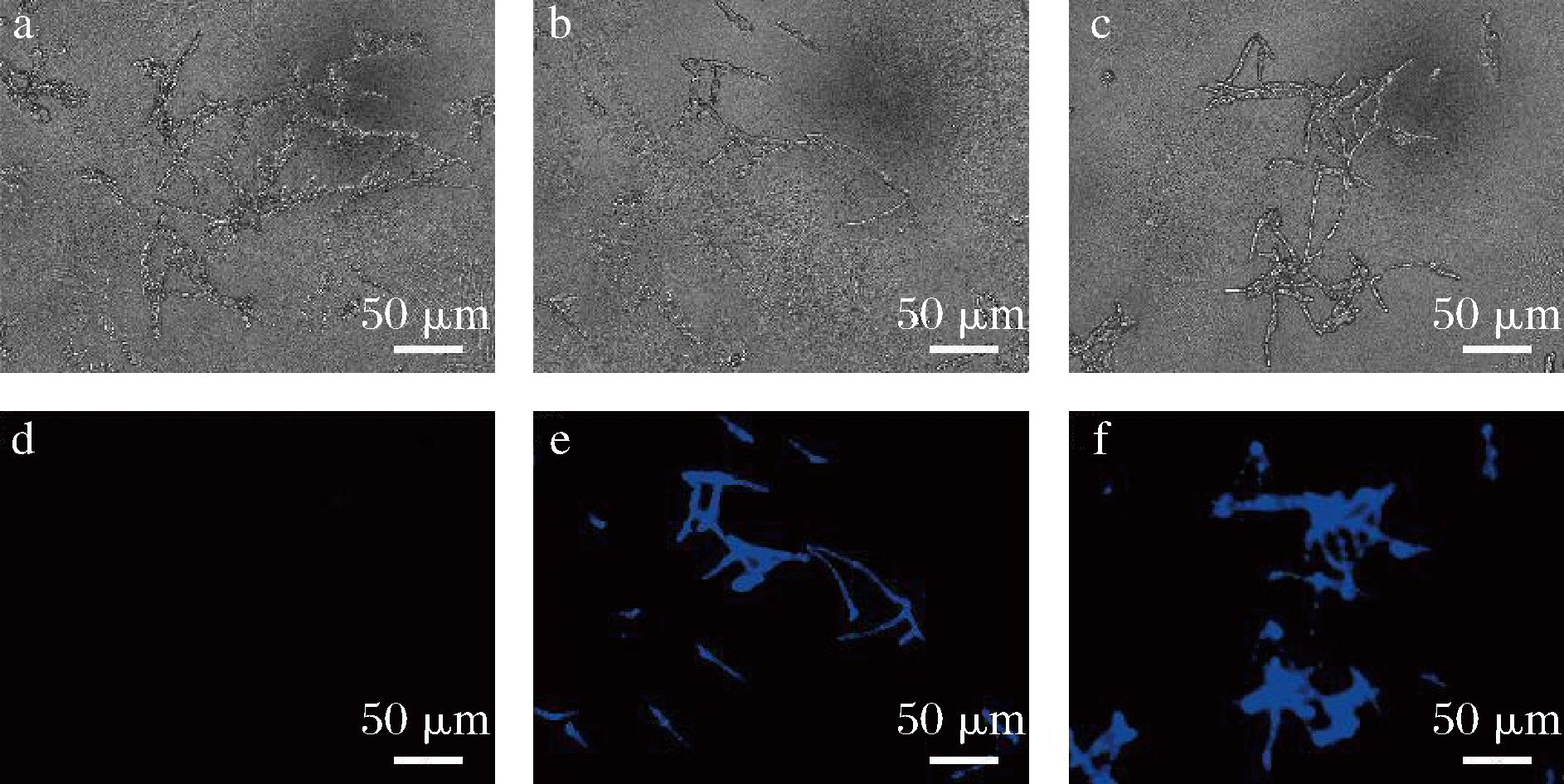
图6 脂肽粗提物对致病疫霉菌菌丝形态的影响
Fig.6 Effect of lipopeptide crude extract on mycelial morphology of P.infestans
注:a、b和c为光学显微镜观察图;d、e和f为荧光显微镜观察图;a和d为甲醇处理组;b和e为HL11脂肽粗提物处理组;c和f为ST-1脂肽粗提物处理组(图7~图8同)。
2.3.2 脂肽粗提物对致病疫霉菌丝细胞细胞膜完整性作用检测
由图7可见,甲醇对照组菌丝细胞经过PI染色后在荧光显微镜下可以观察到微弱的红色或者无色(图7-d),而处理组的真菌菌丝细胞呈现出亮红色(图7-e、图7-f),且红色发光位置主要集中在菌丝膨大变形的部位。表明致病疫霉菌菌丝细胞膜完整性也遭到了破坏。
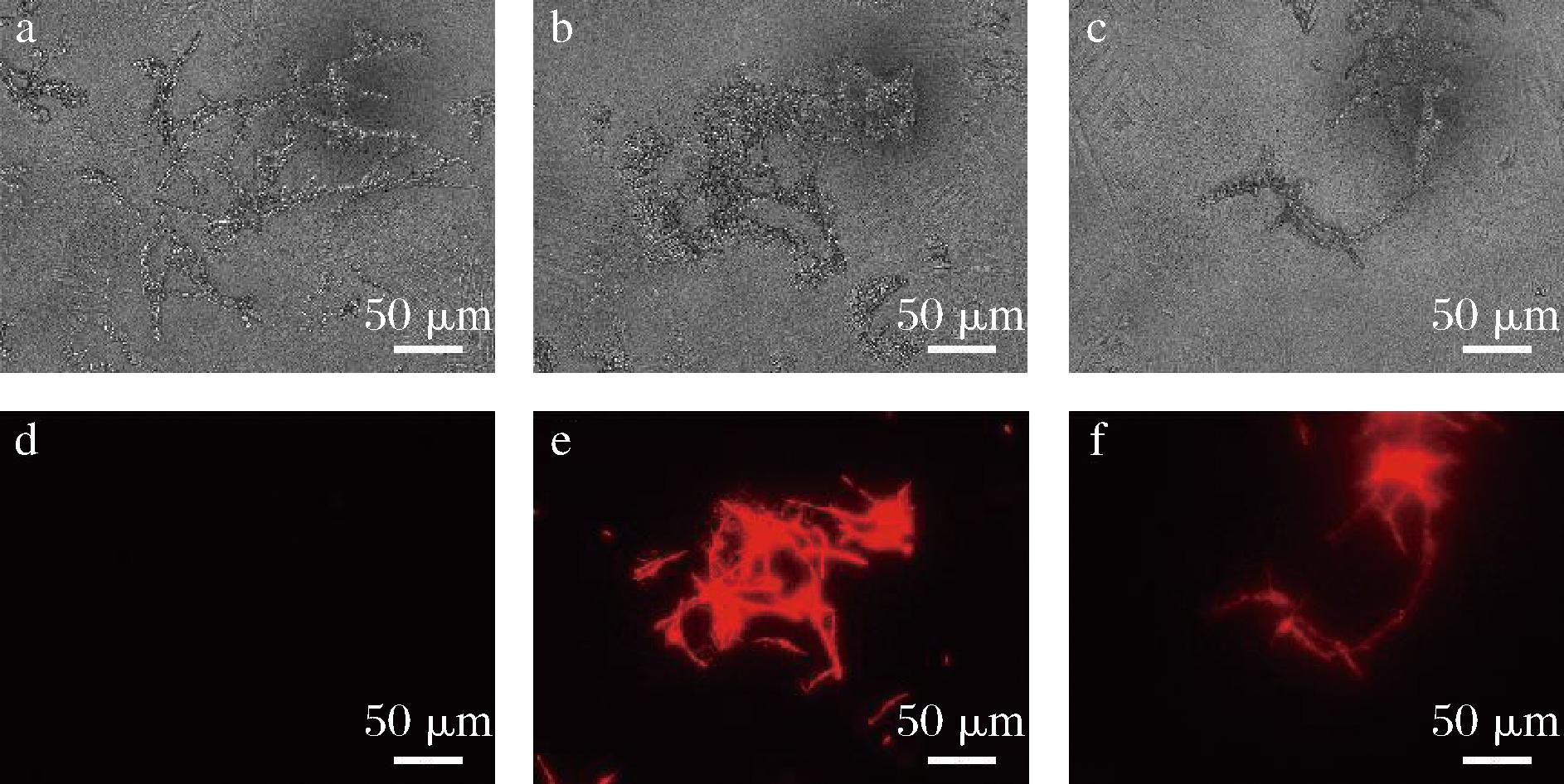
图7 脂肽粗提物对致病疫霉菌菌丝形态的影响
Fig.7 Effect of lipopeptide crude extract on mycelial morphology of P.infestans
2.3.3 脂肽粗提物处理后致病疫霉菌菌丝细胞内活性氧(reactive oxygen species,ROS)的检测
ROS对细胞有害,能够导致真菌菌丝细胞凋亡[12-14]。本研究使用DCFH2-DA染剂对真菌菌丝细胞进行染色。结果显示,经过脂肽粗提物处理组的菌丝细胞均呈现出绿色荧光(图8-e、图8-f),而甲醇对照组在荧光显微镜下呈现微弱的绿光或者无色(图8-d)。结果表明,脂肽粗提物处理过的真菌菌丝细胞会出现ROS激增现象。
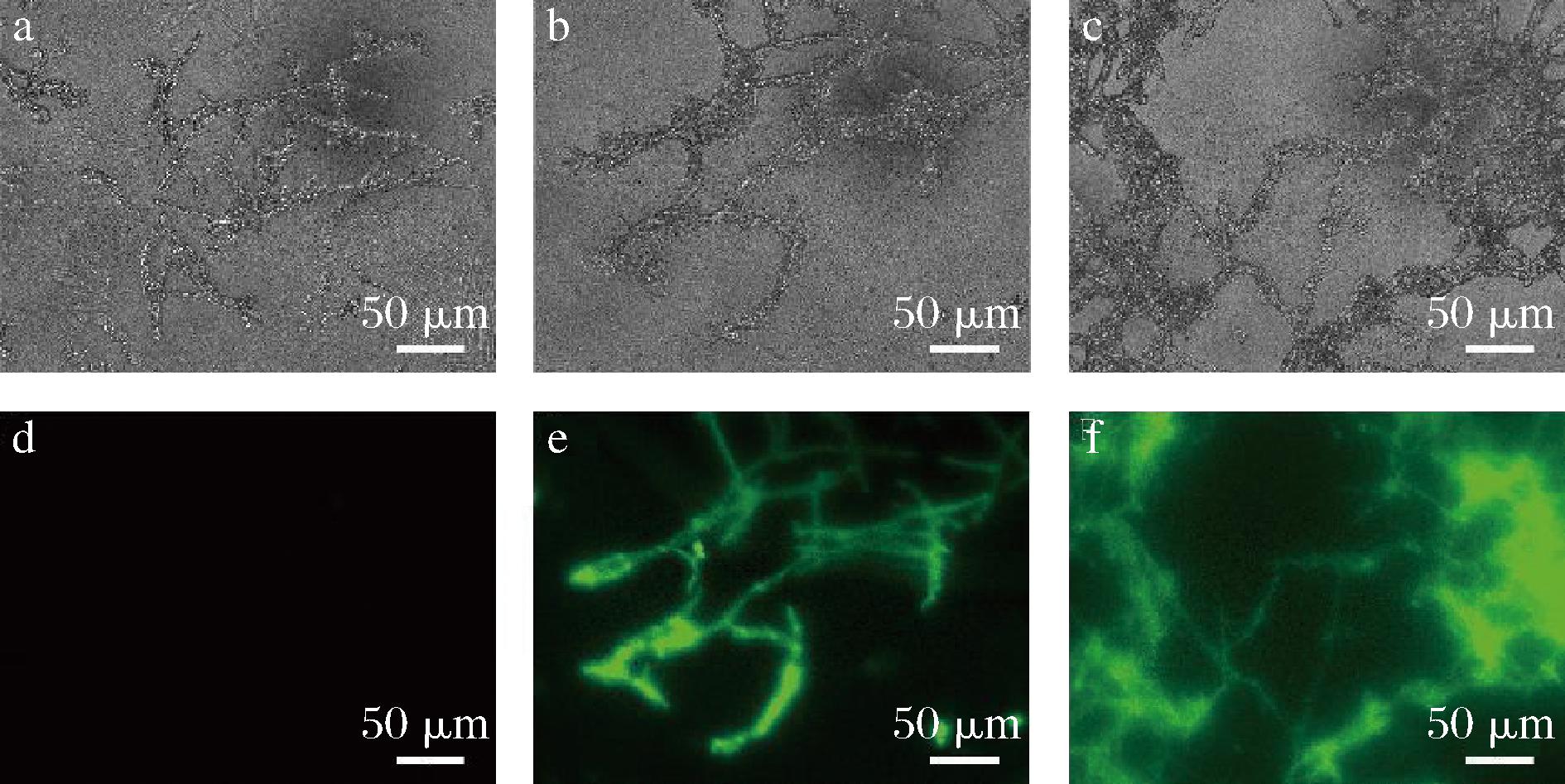
图8 脂肽粗提物对致病疫霉菌菌丝形态的影响
Fig.8 Effect of lipopeptide crude extract on mycelial morphology of P.infestans
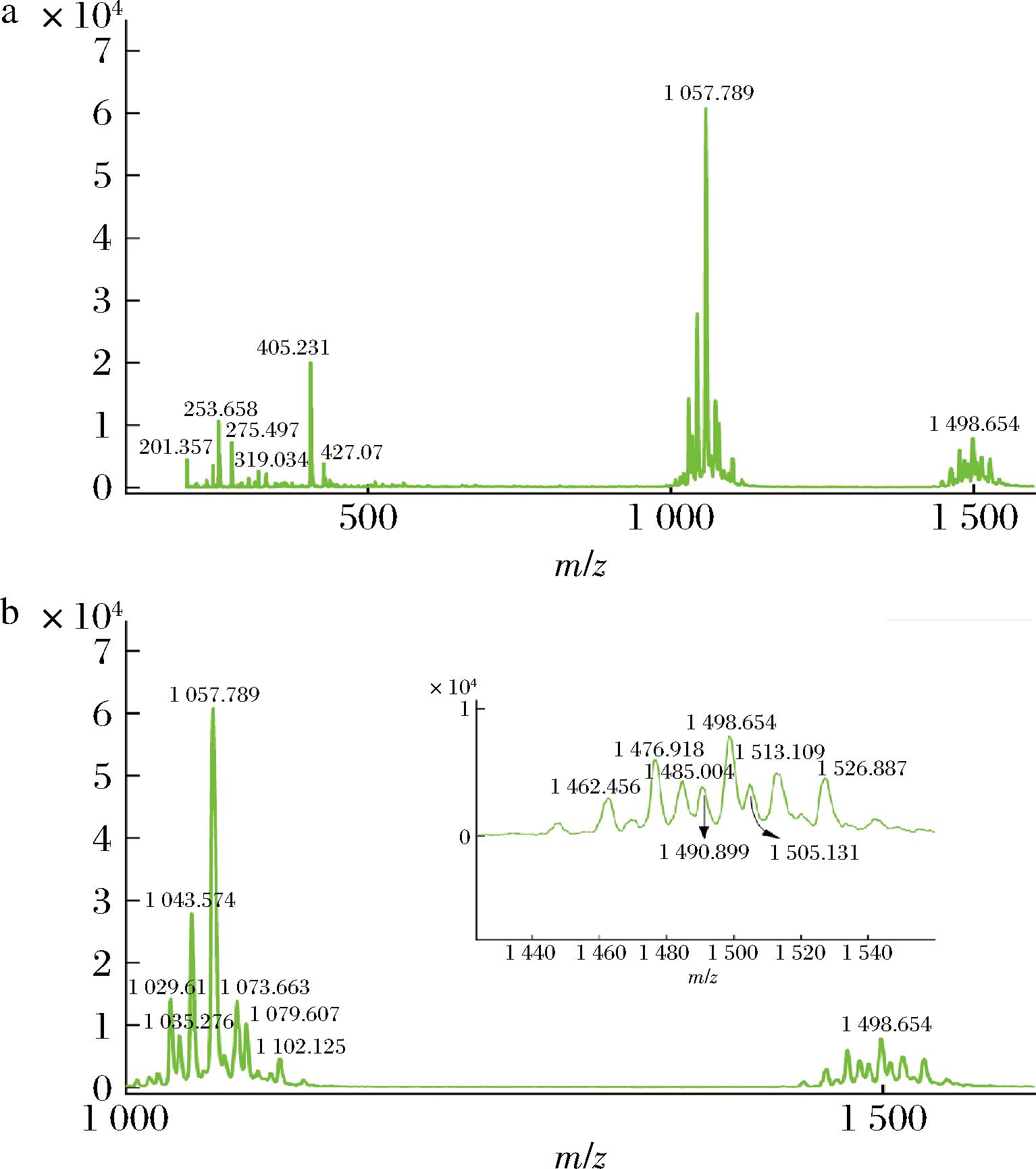
a-整体分离峰;b-局部分离峰(有目标产物)
图9 脂肽粗提物的MALDI-TOF-MS分析结果
Fig.9 The results of MALDI-TOF-MS analysis of lipopeptide crude extract
通过荧光显微镜观察,经芽孢杆菌脂肽粗提物处理过的致病疫霉菌,其菌丝细胞出现变大变形、细胞内的物质有溢出现象,在荧光显微镜下可观察到明显的蓝光、红光和绿光,经过脂肽粗提物处理过的致病疫霉菌菌丝细胞完整性受到了破坏,染色质出现染色质凝聚和ROS激增,这些都会使真菌菌丝生长受到抑制。
2.4 MALDI-TOF-MS鉴定脂肽粗提物
本研究通过MALDI-TOF-MS对芽孢杆菌的脂肽化合物进行检测和分析。结果发现,脂肽类物质有20多处出峰,其中质荷比为1 029.61、1 043.574、1 057.789和1 079.607是C14-Iturin A[M+Na]+[15]系列同系物,分别相差1个亚甲基,1 073.506是C16-Surfactin[M+H,Na]+[16];1 512.923和1 527.261是Val-6 C17-Fengycin B[M+Na,K]+[17]系列同系物,两者相差1个亚甲基。1 035.276与C15-Surfactin [M+H]+[18]相差一个H+,1 462.456和1 484.636与Ala-6 C16-Fengycin A[17]相差一个H+,1 498.654与Val-6 C16-Fengycin B[17]相差一个H+。1 076.551、1 101.967、1 490.53 和1 504.761为未见报道的脂肽化合物。经MALDI-TOF-MS分析和数据比对,芽孢杆菌的脂肽类物质主要为伊枯草菌素(turin)A、表面活性素(surfactin)和丰原素(fengycin)。
3 结论与讨论
有研究学者利用拮抗微生物及其代谢产物抑制致病疫霉,吴艳清等[19]研究发现的枯草芽孢杆菌WL2脂肽粗提物,当其质量浓度为25 μg/mL时对致病疫霉菌丝体抑菌圈直径为5.9 mm;本研究中,当ST-1脂肽粗提物质量浓度为0.1 mg/mL时,致病疫霉菌丝在PDA培养基上的直径为2.53 cm。BENGTSSON等[20]研究发现一株荧光假单胞菌(Pseudomonas koreensis 2.74)产生的表面活性剂能够强烈抑制致病疫霉,1 mg/mL表面活性剂在1 min可使致病疫霉菌的游动孢子裂解,裂解率为60%以上。本实验研究了多粘芽孢杆菌HL11和卡氏芽孢杆菌ST-1的脂肽粗提物对致病疫霉菌丝生长有显著的抑制作用,且抑菌率与脂肽粗提物浓度呈现明显的正相关,这一结果与吴艳清等[19]、陈梅春等[21]和钱常娣[22]的研究结果一致。此外,卡氏芽孢杆菌抑菌效果要更好,差异极显著。分析原因,主要是多粘芽孢杆菌HL11的脂肽粗提物黏稠性高,导致高浓度处理组溶解性较差,使抑菌率检测受限。本研究中,扫描电镜观察到,脂肽使致病疫霉菌丝卷曲、畸形、异常膨大,菌丝细胞完整性受到了破坏。RODRIGUEZ等[23]和TAKEMOTO等[24]研究发现,细胞内的ROS过多积累将会导致细胞的氧化损伤,最终导致细胞死亡,与本研究结果相符。
目前报道芽孢杆菌所分泌的脂肽类物质大致分成3个大家族:Iturin、Fengycin和Surfactin,这些脂肽类物质在抑菌方面有一定的差异性[25]。伊枯草菌素具有较强的溶血性,对真菌、细菌和病毒均有一定的抑制能力[25-26]。表面活性素也有很强的溶血性,对病毒和支原体都有很强的抑制效果,且抑菌谱广,但对植物病原真菌抑菌效果不明显[25-26]。而丰原素只对丝状真菌具有一定抑菌活性和溶血性[27]。本研究利用酸沉淀和有机溶剂抽提法,得到两株芽孢杆菌脂肽粗提物,经MALDI-TOF-MS分析和数据比对,其主要有Iturin A、Surfactin和Fengycin。GRAU等[28]和MAGET-DANA等[29]提出,Iturin可以诱导细胞膜结构发生改变,使细胞的离子通透性增大,细胞质泄露,最终导致细胞死亡[28-29]。HL11和ST-1产生的Fengycin和Surfactin很有可能诱导真菌细胞出现ROS积累导致致病疫霉细胞出现凋亡,与TANG等[30]报道的Fengycin和Surfactin通过诱导真菌细胞内的ROS积累使真菌细胞出现凋亡相似。此外,本研究中,提取的脂肽物质是一种混合物,还有多种未知组分需要进一步分析,脂肽类物质的抑菌机制仍有待进一步深入研究。本研究为后续HL11和ST-1的开发利用提供了理论基础。
[1] 屈冬玉, 谢开云, 金黎平, 等.中国马铃薯产业与现代农业[J].农业技术与装备, 2007(7):4-7.QU D Y, XIE K Y, JIN L P, et al.Potato industry and modern agriculture in China[J].Agricultural Technology &Equipment, 2007(7):4-7.
[2] 朱燕莉, 王正莉, 王卫, 等.天然食品防腐剂的抑菌机理研究进展[J].中国调味品, 2021, 46(9):176-180.ZHU Y L, WANG Z L, WANG W, et al.Research progress on antibacterial mechanism of natural food preservatives[J].China Condiment, 2021, 46(9):176-180.
[3] 赵新林, 赵思峰.枯草芽孢杆菌对植物病害生物防治的作用机理[J].湖北农业科学, 2011, 50(15):3025-3028.ZHAO X L, ZHAO S F.Research advance in controlling plant diseases by Bacillus subtilis[J].Hubei Agricultural Sciences, 2011, 50(15):3025-3028.
[4] 魏倩, 张娜, 张平, 等.四种芽孢杆菌对蒜薹灰葡萄孢霉抑制作用的时效性研究[J].生物技术通报, 2017, 33(6):112-120.WEI Q, ZHANG N, ZHANG P, et al.Timeliness of four Bacillus strains against Botrytis cinerea of garlic sprouts[J].Biotechnology Bulletin, 2017, 33(6):112-120.
[5] 陈志谊. 芽孢杆菌类生物杀菌剂的研发与应用[J].中国生物防治学报, 2015, 31(5):723-732.CHEN Z Y.Research and application of bio-fungicide with Bacillus spp[J].Chinese Journal of Biological Control, 2015, 31(5):723-732.
[6] 范三红, 李静, 施俊凤.拮抗菌Burkholderia contaminans对玫瑰香葡萄采后灰霉病的抗性诱导[J].食品科学, 2016, 37(2):266-270.FAN S H, LI J, SHI J F.Induction of disease resistance against Botrytis cinerea in postharvest Muscat grape by antagonistic bacterium Burkholderia contaminans[J].Food Science, 2016, 37(2):266-270.
[7] 赵锦芳, 李敏, 龙同, 等.一株卡氏芽孢杆菌ST-1及其在香梨病害防治或贮藏保鲜中的应用:CN115109723A[P].2022-09-27.ZHAO J F, LI M, LONG T, et al. A strain of Bacillus cabrialesii ST-1 and its application in disease control or storage and preservation of fragrant pears: China, CN115109723A[P]. 2022-09-27.
[8] 段军娜, 黄海, 罗晶, 等.皮尔瑞俄类芽胞杆菌BC-39对番茄灰霉病的防治效果及防腐保鲜作用[J].植物保护学报, 2014, 41(1):61-66.DUAN J N, HUANG H, LUO J, et al.The control efficacy of Peanibacillus peoriae BC-39 to tomato gray mold and its bioantisepsis-preservation on tomato fruits[J].Journal of Plant Protection, 2014, 41(1):61-66.
[9] 李敏, 黄满, 邱炜玥, 等.响应面法优化卡氏芽孢杆菌ST-1产芽孢发酵培养基[J].中国酿造, 2023, 42(2):193-198.LI M, HUANG M, QIU W Y, et al.Optimization of fermentation medium for spore production by Bacillus cabrialesii ST-1 with response surface method[J].China Brewing, 2023, 42(2):193-198.
[10] 邵天蔚, 张晓云, 丁万隆, 等.三株甲基营养型芽孢杆菌抑菌活性物质初探[J].中国现代中药, 2018, 20(2):189-194.SHAO T W, ZHANG X Y, DING W L, et al.Preliminary analysis of active substances from three Bacillus methylotrophicus strains[J].Modern Chinese Medicine, 2018, 20(2):189-194.
[11] YANG H, LI X, LI X, et al.Identification of lipopeptide isoforms by MALDI-TOF-MS/MS based on the simultaneous purification of iturin, fengycin, and surfactin by RP-HPLC[J].Analytical and Bioanalytical Chemistry, 2015, 407(9):2529-2542.
[12] WANG Y Y, ZHANG C Y, LIANG J, et al.Iturin a extracted from Bacillus subtilis WL-2 affects Phytophthora infestans via cell structure disruption, oxidative stress, and energy supply dysfunction[J].Frontiers in Microbiology, 2020, 11:536083.
[13] KOHANSKI M A, DWYER D J, HAYETE B, et al.A common mechanism of cellular death induced by bactericidal antibiotics[J].Cell, 2007, 130(5):797-810.
[14] DWYER D J, KOHANSKI M A, HAYETE B, et al.Gyrase inhibitors induce an oxidative damage cellular death pathway in Escherichia coli[J].Molecular Systems Biology, 2007, 3:91.
[15] GONG M, WANG J D, ZHANG J, et al.Study of the antifungal ability of Bacillus subtilis strain PY-1 in vitro and identification of its antifungal substance (iturin a)[J].Acta Biochimica et Biophysica Sinica, 2006, 38(4):233-240.
[16] PATHAK K V, KEHARIA H.Identification of surfactins and iturins produced by potent fungal antagonist, Bacillus subtilis K1 isolated from aerial roots of banyan (Ficus benghalensis) tree using mass spectrometry[J].3 Biotech, 2014, 4(3):283-295.
[17] WANG J, LIU J, WANG X, et al.Application of electrospray ionization mass spectrometry in rapid typing of fengycin homologues produced by Bacillus subtilis[J].Letters in Applied Microbiology, 2004, 39(1):98-102.
[18] VATER J, KABLITZ B, WILDE C, et al.Matrix-assisted laser desorption ionization:Time of flight mass spectrometry of lipopeptide biosurfactants in whole cells and culture filtrates of Bacillus subtilis C-1 isolated from petroleum sludge[J].Applied and Environmental Microbiology, 2002, 68(12):6210-6219.
[19] 吴艳清, 王游游, 王畅, 等.枯草芽孢杆菌WL2脂肽粗提物对致病疫霉的抑制作用及其分离鉴定[J].河北大学学报(自然科学版), 2018, 38(6):632-639.WU Y Q, WANG Y Y, WANG C, et al.Inhibitory effect of lipopeptide crude extract produced by Bacillus subtilis WL2 on Phytophthora infestans and its isolation and identification[J].Journal of Hebei University (Natural Science Edition), 2018, 38(6):632-639.
[20] BENGTSSON T, HOLEFORS A, LILJEROTH E, et al.Biosurfactants have the potential to induce defence against Phytophthora infestans in potato[J].Potato Research, 2015, 58(1):83-90.
[21] 陈梅春, 王阶平, 肖荣凤, 等.地衣芽胞杆菌FJAT-4脂肽结构鉴定及其对尖孢镰刀菌的抑制作用[J].微生物学报, 2017, 57(12):1924-1934.CHEN M C, WANG J P, XIAO R F, et al.Characterization of lipopeptides produced by Bacillus licheniformis FJAT-4 and their effect on Fusarium oxysporum[J].Acta Microbiologica Sinica, 2017, 57(12):1924-1934.
[22] 钱常娣. 枯草芽孢杆菌BAB-1脂肽类物质的分离鉴定及性质分析[D].保定:河北农业大学, 2010.QIAN C D.Isolation, identification and property analysis of lipopeptides from Bacillus subtilis BAB-1[D].Baoding:Hebei Agricultural University, 2010.
[23] RODRIGUEZ R, REDMAN R.Balancing the generation and elimination of reactive oxygen species[J].Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(9):3175-3176.
[24] TAKEMOTO D, TANAKA A, SCOTT B.NADPH oxidases in fungi:Diverse roles of reactive oxygen species in fungal cellular differentiation[J].Fungal Genetics and Biology, 2007, 44(11):1065-1076.
[25] ONGENA M, JACQUES P.Bacillus lipopeptides:Versatile weapons for plant disease biocontrol[J].Trends in Microbiology, 2008, 16(3):115-125.
[26] NIHORIMBERE V, CAWOY H, SEYER A, et al.Impact of rhizosphere factors on cyclic lipopeptide signature from the plant beneficial strain Bacillus amyloliquefaciens S499[J].FEMS Microbiology Ecology, 2012, 79(1):176-191.
[27] YAO S Y, GAO X W, FUCHSBAUER N, et al.Cloning, sequencing, and characterization of the genetic region relevant to biosynthesis of the lipopeptides iturin A and surfactin in Bacillus subtilis[J].Current Microbiology, 2003, 47(4):272-277.
[28] GRAU A, ORTIZ A, DE GODOS A, et al.A biophysical study of the interaction of the lipopeptide antibiotic iturin A with aqueous phospholipid bilayers[J].Archives of Biochemistry and Biophysics, 2000, 377(2):315-323.
[29] MAGET-DANA R, PTAK M.Iturin lipopeptides:Interactions of mycosubtilin with lipids in planar membranes and mixed monolayers[J].Biochimica et Biophysica Acta, 1990, 1023(1):34-40.
[30] TANG Q Y, BIE X M, LU Z X, et al.Effects of fengycin from Bacillus subtilis fmbJ on apoptosis and necrosis in Rhizopus stolonifer[J].Journal of Microbiology, 2014, 52(8):675-680.