慢性肾病(chronic kidney disease,CKD)是一种全球范围内影响广泛的慢性疾病,通常与代谢和心血管合并症相关[1]。由于CKD进展机制复杂,缺乏有效的特异性治疗措施,目前,CKD的治疗主要在于延缓疾病进展以及相关并发症的管理[2]。
近年来,随着肠道菌群在疾病中的作用被逐渐发现,研究者也将目光聚焦到了靶向肠道菌群来干预宿主疾病的新策略上[3]。现有研究表明,CKD会导致肠道菌群及代谢紊乱, 肠道菌群组成和代谢功能的异常与CKD疾病进展密切相关[4]。肠道菌群失调以及尿毒症毒素的蓄积会破坏慢性肾病患者的肠屏障功能,此外肠屏障受损会进一步加重菌体及毒素的异位,加重患者的全身性炎症[5]。
褐藻多糖硫酸酯(fucoidan,FPS)是从多种褐藻中提取的富含岩藻糖的硫酸化多糖,主要由L-岩藻糖、硫酸基和一定比例的D-木糖、D-甘露糖、D-半乳糖、L-鼠李糖、葡萄糖、D-葡萄糖醛酸和乙酰基组成[6]。FPS具有多种生物学功能,如抑制癌细胞生长、抗炎、抗氧化[7]、抗凝血等[8],同时也是临床上治疗慢性肾衰竭中成药海昆肾喜胶囊的有效成分。尽管如此,FPS对于CKD相关的肠屏障功能障碍以及肠道微生物在FPS减轻肾损伤中所起到的作用仍然知之甚少。
为了进一步探究FPS减轻肾脏损伤的作用机制,本研究通过构建腺嘌呤诱导的CKD小鼠模型,并结合小鼠粪便菌群宏基因组结果,着重研究了FPS在修复CKD小鼠肠屏障损伤方面的作用,以及其对肠道菌群组成和代谢功能的影响,旨在揭示FPS改善肾脏病理的具体机制,为筛选具有肾脏保护作用的膳食因子及其作用机制研究提供有益参考。
1 材料与方法
1.1 试剂与仪器
褐藻多糖硫酸酯,吉林省辉南长龙生化药业股份有限公司;肌酐、尿素氮试剂盒,南京建成生物工程研究所;腺嘌呤(纯度98%),上海阿拉丁试剂有限公司;羧甲基纤维素(黏度800 cps),北京百灵威科技有限公司;HiScript Ⅲ All-in-one RT SuperMix Perfect for qPCR、ChamQ Universal SYBR qPCR Master Mix,诺维赞生物科技股份有限公司;qRT-PCR引物,生工生物工程(上海)股份有限公司。
SX-500高温高压灭菌锅,日本Tomy Digital Biology公司;5804R高速冷冻离心机,德国Eppendorf公司;T100 PCR热循环仪、CFX384实时定量基因扩增仪,美国Bio-Rad公司;C-MAG加热磁力搅拌器,德国IKA公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司。
1.2 动物实验方案
实验动物选择雄性SPF级C57BL/6 J小鼠15只,6周龄,购自北京维通利华实验动物技术有限公司。本实验全程严格遵守国家标准中实验动物福利伦理学的要求,动物实验方案经江南大学实验动物伦理委员会批准(JN.No20230315c1200710[085])。小鼠饲养在江南大学实验动物中心屏障内,恒定温度20~26 ℃,湿度40%~70%,12 h明暗循环,噪声≤60 dB。经过7 d适应性饲养后,将小鼠随机分为3组,分别为空白组(Control组)、CKD模型组(Model组)、褐藻多糖硫酸酯组(FPS组)。除空白组仅灌胃0.5%羧甲基纤维素钠水溶液外,另2组进行持续4周的腺嘌呤诱导的CKD模型造模,腺嘌呤剂量为50 mg/kg,溶于5 g/L灭菌羧甲基纤维素钠水溶液中,小鼠每日灌胃体积为0.1 mL/10 g;造模结束后,静养7 d;干预阶段,Control和Model组每日灌胃生理盐水,FPS组每日灌胃剂量为150 mg/kg FPS的生理盐水溶液,灌胃体积为0.1 mL/10 g,连续灌胃4周。动物实验方案如图1所示。
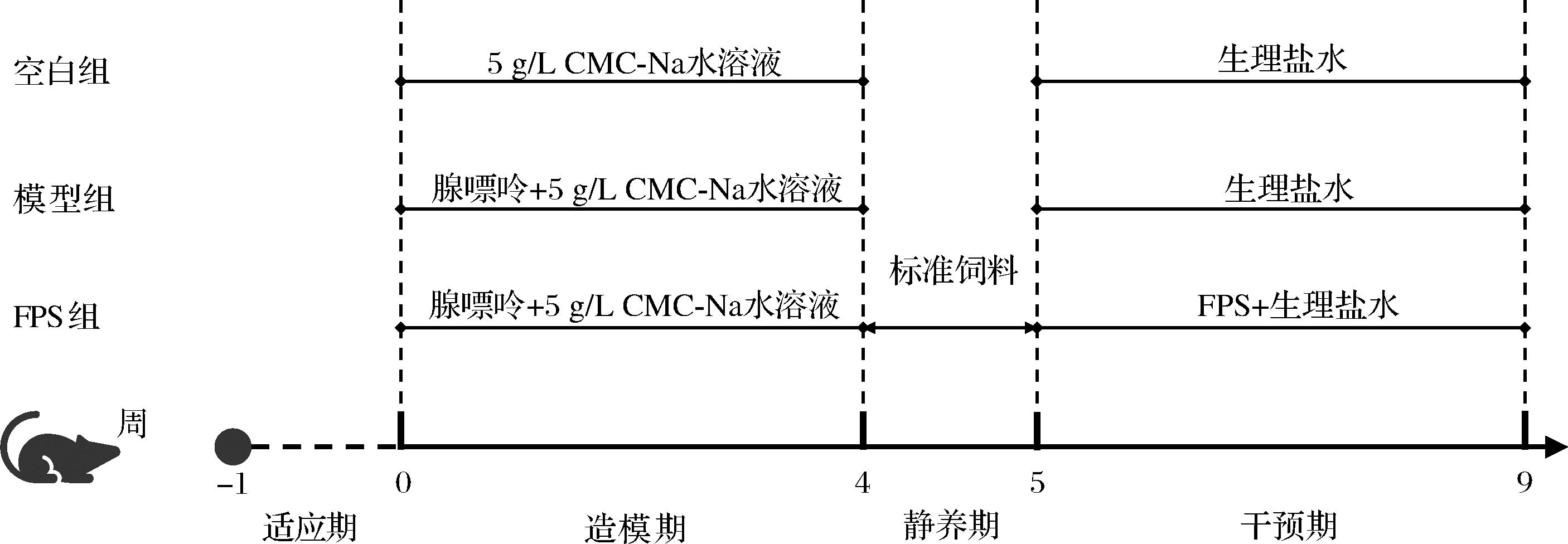
图1 动物实验方案
Fig.1 Design for animal experiments
注:CMC-Na:羧甲基纤维素钠(carboxymethylcellulose sodium)
1.3 血清肌酐及尿素氮水平测定
严格按照说明书采用肌氨酸氧化酶法检测小鼠血清中肌酐(creatinine,Cr)水平,采用脲酶法检测小鼠血清中尿素氮(blood urea nitrogen,BUN)水平。
1.4 小鼠肾脏及结肠组织切片及病理染色
待测的肾脏组织以及结肠组织(取结肠远端无内容物部分0.5 cm)于40 g/L多聚甲醛固定,委托上海赛维尔生物科技有限公司进行石蜡包埋切片,苏木精和伊红(hematoxylin-eosin staining,H&E)染色以及肾脏组织马松(Masson)染色。观察FPS对腺嘌呤诱导的CKD小鼠肾脏组织病理学变化,纤维化程度,以及结肠组织病理的影响。
1.5 小鼠结肠组织中炎症因子及紧密连接蛋白基因表达水平测定
取-80 ℃冻存结肠组织20~50 mg,采用TRIzol法提取总RNA,检测各样本RNA浓度后,遵循反转录试剂盒说明书进行逆转录,得到cDNA,按照ChamQ Universal SYBR qPCR Master Mi说明书配制反应体系,在荧光定量扩增仪器上进行实时定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)和检测。β-肌动蛋白(β-actin)基因作为内参基因,每个样本设置3个平行孔,采用2-ΔΔCt阈值循环法对其他基因进行相对定量,引物信息如表1所示。
表1 引物序列
Table 1 Primer sequence
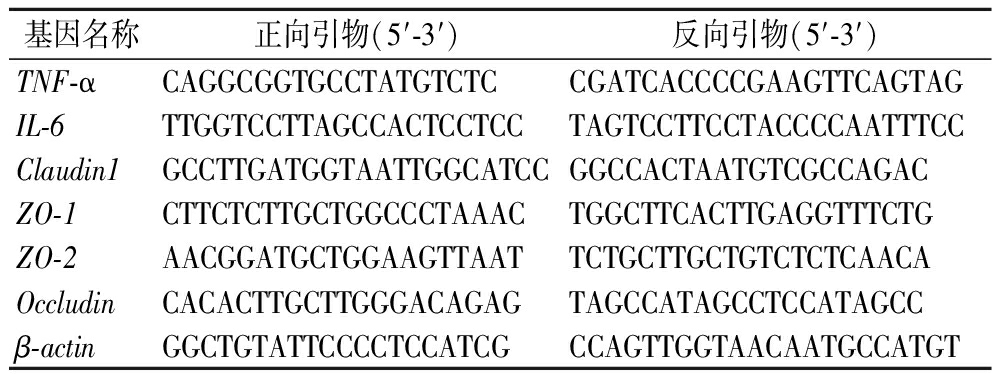
基因名称正向引物(5′-3′)反向引物(5′-3′)TNF-αCAGGCGGTGCCTATGTCTCCGATCACCCCGAAGTTCAGTAGIL-6TTGGTCCTTAGCCACTCCTCCTAGTCCTTCCTACCCCAATTTCCClaudin1GCCTTGATGGTAATTGGCATCCGGCCACTAATGTCGCCAGACZO-1CTTCTCTTGCTGGCCCTAAACTGGCTTCACTTGAGGTTTCTGZO-2AACGGATGCTGGAAGTTAATTCTGCTTGCTGTCTCTCAACAOccludinCACACTTGCTTGGGACAGAGTAGCCATAGCCTCCATAGCCβ-actinGGCTGTATTCCCCTCCATCGCCAGTTGGTAACAATGCCATGT
1.6 小鼠肠道菌群宏基因组测序及数据分析
于实验结束前一天收集各组小鼠粪便,-80 ℃冻存。宏基因组测序在北京诺禾致源科技股份有限公司的DNBSEQ-T7平台上进行,每组5只小鼠,共计15份样品。原始序列的预处理包括以下步骤:首先使用Trimmomatic(版本0.39)软件过滤低质量序列[9],对平均碱基质量分数<30的序列进行修剪,并保留长于60 bp的序列作为质量控制输出。随后,使用BWA(版本0.7.17)、Samtools(版本1.9)和BEDTools(版本2.30.0)将质控后的序列与小鼠参考基因组(genome reference consortium mouse build 39,GRCm39)进行比对,去除样本中宿主来源的基因[10-12]。使用MetaPhlAn3和HUMAnN3进行肠道菌群物种及代谢功能注释[13]。
1.7 小鼠肠道菌群宏基因组差异物种及差异代谢功能分析
根据物种丰度信息表计算肠道菌群α多样性指数。基于Bray-Curtis距离计算各组小鼠肠道菌群的β多样性。线性判别效应大小(linear discriminant analysis effect size,LEfSe)用于识别模型组与FPS组间驱动差异的肠道菌群物种[14]。基于代谢功能相对丰度信息表使用R语言的Wilcox.test函数进行Wilcoxon秩和检验,分析模型组与FPS组间具有显著差异的肠道菌群代谢功能,并计算与模型组相比FPS组肠道菌群代谢功能的log2Foldchange,最后仅保留P<0.05,log2Foldchange>1,以确定显著变化的关键肠道微生物群代谢途径。
1.8 统计分析
数值表示为“平均值±标准误差”(mean±SEM),采用Prism 9.0进行单因素方差分析(one-way ANOVA)和图形绘制。P<0.05代表数据具有显著差异。其中*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1。
2 结果与分析
2.1 FPS缓解腺嘌呤诱导的CKD模型小鼠的肾脏病理
小鼠经过4周的腺嘌呤灌胃造模后,静养1周,灌胃FPS 4周,检测小鼠血清中肌酐及尿素氮水平,结果发现与空白组相比,模型组小鼠血清Cr和BUN水平显著升高(P<0.000 1),FPS可显著降低CKD小鼠血清中Cr、BUN水平(P<0.01,图2-a、图2-b)。H&E及Masson染色结果发现(图2-c),空白组小鼠肾小球分布均匀,肾小球中细胞数量以及基质均匀,肾小管上皮细胞圆润、饱满,未见明显的炎性改变。而模型组小鼠肾脏出现大面积纤维化,并伴有少量的淋巴细胞浸润,大量的肾小管扩张,管腔形状不规则,较多的肾小管上皮细胞变性,胞质疏松淡染。FPS干预后,肾小管损伤得到一定程度恢复,肾纤维化程度下降(P<0.01,图2-d)。以上结果说明FPS能够一定程度减轻肾脏损伤缓解肾间质纤维化和肾脏细胞凋亡。

a-血清Cr水平;b-血清BUN水平;c-肾脏组织H&E染色及Masson染色结果(×200);d-Masson染色肾纤维化面积百分比
图2 FPS对腺嘌呤诱导的CKD小鼠肾脏病理的影响
Fig.2 Effect of FPS on adenine-induced CKD mice renal pathology
注:**表示P<0.01,****表示P<0.000 1(下同)。
2.2 FPS对CKD小鼠肠道屏障及结肠炎症因子表达的影响
先前的研究表明,FPS通过调节肠道微生物群和胆汁酸代谢改善溃疡性结肠炎小鼠的肠道屏障[15],并通过调节膳食纤维缺陷小鼠的肠道微生物群,防止肠道屏障破坏、炎症和脂质异常[16]。因此推测FPS能够通过改善CKD小鼠肠道屏障功能及结肠炎症,影响肾脏病理。
结肠组织H&E染色结果显示,空白组小鼠的黏膜层呈现规则的结构,黏膜和肌肉层的厚度均正常,隐窝结构完整,没有出现炎症细胞浸润和杯状细胞缺失。而模型组的结肠组织中,存在明显的炎症细胞浸润和杯状细胞缺失,并且黏膜下层可以观察到部分增厚。FPS干预后虽然仍可见部分炎症细胞浸润的情况,但杯状细胞缺失及黏膜下层增厚的现象得到明显改善。
受尿毒症毒素累积影响,CKD患者普遍存在肠道屏障功能障碍及结肠炎症,本研究中,模型组小鼠结肠组织中紧密连接蛋白ZO-1、ZO-2、Occludin、Claudins-1的基因相对表达均出现下降(图3-b~图3-e),其中ZO-2的基因相对表达量显著降低(P<0.05),FPS显著增加了Claudin1的表达(P<0.05),但对其他紧密连接蛋白基因的表达没有出现改善,说明FPS对CKD小鼠结肠紧密连接蛋白表达的改善效果有限。先前的研究表明,FPS干预能够显著提升结直肠炎小鼠结肠组织中Occludin、ZO-1和Claudin1的相对表达[16],而本研究中CKD小鼠经FPS干预后,仅Claudin1基因相对量显著提升,ZO-1的相对表达量相较于模型组小鼠有所提升,但没有显著性差异,Occludin的相对表达则相较于模型组小鼠有所下降,这可能与CKD的病理特征相关,FPS对于CKD状态下的结肠紧密连接蛋白表达的影响仍需进一步研究。

a-结肠组织H&E染色;b-Claudin1;c-Occludin;d-ZO-1;e-ZO-2;f-IL-6;g-TNF-α
图3 FPS对CKD小鼠肠道屏障及结肠炎症因子表达的影响
Fig.3 Effects of FPS on intestinal barrier and colonic inflammatory factor expression in CKD mice
注:b~g数值为β-actin相对表达量; *表示P<0.05(下同)。
结肠组织中炎症因子表达的结果显示,模型组小鼠结肠组织中IL-6、TNF-α基因的相对表达量显著升高(P<0.01),FPS干预后能够显著降低结肠组织中IL-6(P<0.05)和TNF-α(P<0.01)的表达量,表明FPS能够显著减轻CKD小鼠的结肠炎症。此前的研究已广泛报道了FPS的抗炎活性[7],如LI等[17]的研究结果显示,不同浓度的FPS可以逆转人结肠上皮细胞中脂多糖诱导的炎症,此外FPS干预后结直肠癌小鼠结肠组织中炎症因子如TNF-α、IL-6和IL-1β的表达水平下降。本研究结果进一步确认了FPS对于CKD状态下的结肠炎症仍具有改善作用。
2.3 FPS改善CKD小鼠的肠道微生态失调
近期研究表明,肠道菌群失衡与CKD进程相关,肠道菌群可以通过内毒素累积、炎症反应以及尿毒症毒素及毒素前体的生成来影响肾脏代谢[3]。肠道菌群芳香族氨基酸代谢生成的吲哚、苯酚、对甲酚、苯乙酸等物质通过肠屏障进入循环后会进一步生成尿毒症毒素,导致肾毒性并与心血管疾病等其他并发症风险相关[18]。在CKD小鼠及大鼠模型中,通过调节肠道菌群能够降低血清中硫酸吲哚酚、对甲酚硫酸盐、马尿酸等尿毒症毒素的水平,减轻肾脏纤维化[4]。为了深入解析肠道菌群在FPS缓解CKD小鼠肾脏病理中所起的作用,本研究使用宏基因组测序技术对小鼠肠道微生物组物种组成及代谢功能进行探究。
采用α-多样性指数,包括Shannon指数、Simpson指数、Peilou指数和observed OTUs指数,量化各组小鼠肠道微生物组的微生态多样性。如图4-a所示,模型组与FPS组小鼠之间Shannon指数、Simpson指数、Peilou指数测量没有显著变化,说明模型组与FPS组小鼠的肠道菌群物种丰富度和均匀度相当。然而,FPS组中反映群落内物种种类丰富度的observed OTUs指数明显低于模型组,表明FPS处理导致物种种类总数下降。对于肠道微生物组的β多样性,进行了主坐标分析(principal co-ordinates analysis,PCoA)。如图4-b所示,FPS组小鼠的肠道微生物群与模型组小鼠的肠道微生物群物种组成存在显著差异(P=0.001,R2=0.52),说明FPS干预显著改变了CKD小鼠的肠道菌群结构。相对丰度排名前20物种的相对丰度堆积图进一步说明了2组之间物种丰度的差异,其中Lactobacillus murinus、Bifidobacterium pseudclongum是2组小鼠肠道微生物群中的主要物种,FPS干预后Akkermansia muciniphila相对丰度明显增加(图4-c),其相对丰度明显高于模型组的优势物种L.murinus和B.pseudclongum,以上结果表明FPS组小鼠α-多样性指数下降的原因可能与FPS定向增殖A.muciniphila相关,此前的研究显示,FPS能够通过增加A.muciniphila相对丰度从而改善代谢综合征[19]。值得注意的是,A.muciniphila与肠道屏障完整性密切相关,其补充能够增加杯状细胞的数量和抗菌肽,临床研究显示补充A.muciniphila能够降低肥胖人群血清脂多糖水平[20]。因此,FPS干预后CKD小鼠结肠病理特征及炎症的改善可能与A.muciniphila相对丰度增加有关。

a-α多样性;b-β多样性;c-物种水平相对丰度;d-物种水平LEfSe分析;e~h-Akkermansia muciniphila、Bacteroides caecimuris、 Enterorhabdus caecimuris、Staphylococcus lentus相对丰度
图4 小鼠粪便菌群宏基因组物种组成分析
Fig.4 Analysis of the metagenomic species composition of mouse fecal microbiota
注:图中不同小写字母表示差异显著(P<0.05)。
通过LEfSe分析,进一步揭示与CKD的缓解和肾脏功能的改善密切相关的差异物种。如图4-d所示,FPS干预后,与模型组相比A.muciniphila、Bacteroides caecimuris相对丰度显著增加,Lachnospiraceae属、Aerococcaceae属、以及Enterorhabdus caecimuris、Corynebacterium stationis、Aerococcus urinaeequi、Aerococcus viridans、Staphylococcus lentus物种相对丰度显著下降(LDA>2,图4-d)。WEISS等[21]发现,B.caecimuris中存在编码菊糖和木聚糖降解关键酶的基因,能够降解菊糖产生琥珀酸、丙酸等酸性物质,显著降低培养基的pH,进而抑制病原体的生长,此外在缺失B.caecimuris的小鼠中其结肠内容物中的丙酸、丁酸、戊酸、异戊酸、异丁酸和 2-甲基丁酸等短链脂肪酸水平明显减少,FPS干预导致的B.caecimuris富集可能影响了肠道菌群短链脂肪酸的生成,从而对慢性肾病产生一些积极的调节作用。此外研究发现,A.muciniphila具有抗炎及肠道上皮的保护作用[22],WANG等[23]的研究结果显示A.muciniphila的定植减少了肾间质纤维化(unilateral uretera obstruction,UUO)小鼠肾脏中的胶原沉积及细胞凋亡,与本研究结果类似。在FPS干预后显著减少的物种中,E.caecimuris与克罗恩病和自闭症谱系障碍的生态失调有关, 是在炎症条件下出现过多的潜在病原体,并在菊粉喂养的小鼠体内相对丰度下降[24]。S.lentus则会抑制白藜芦醇对肝纤维化的有益作用,且其培养物还会增强肠道通透性[25]。
以上结果进一步证明了FPS通过调节肠道菌群物种组成,富集有益菌B.caecimuris,A.muciniphila,抑制潜在有害菌E.caecimuris、S.lentus相对丰度,减轻肾脏损伤及结肠炎症,进一步突显了其对肾脏健康的积极影响。
2.4 FPS对肠道菌群代谢功能的影响
为了进一步了解 FPS改变的肠道菌群代谢功能,本研究通过HUMAnN3对宏基因组测序结果进行基于MetaCyc数据库的代谢功能注释。如图5所示,FPS干预后,CKD小鼠肠道菌群的氨基酸生物合成、碳水化合物生物合成、核苷酸生物合成、维生素生物合成、能量产生能力显著富集,而次级代谢物的生物合成能力显著下降。
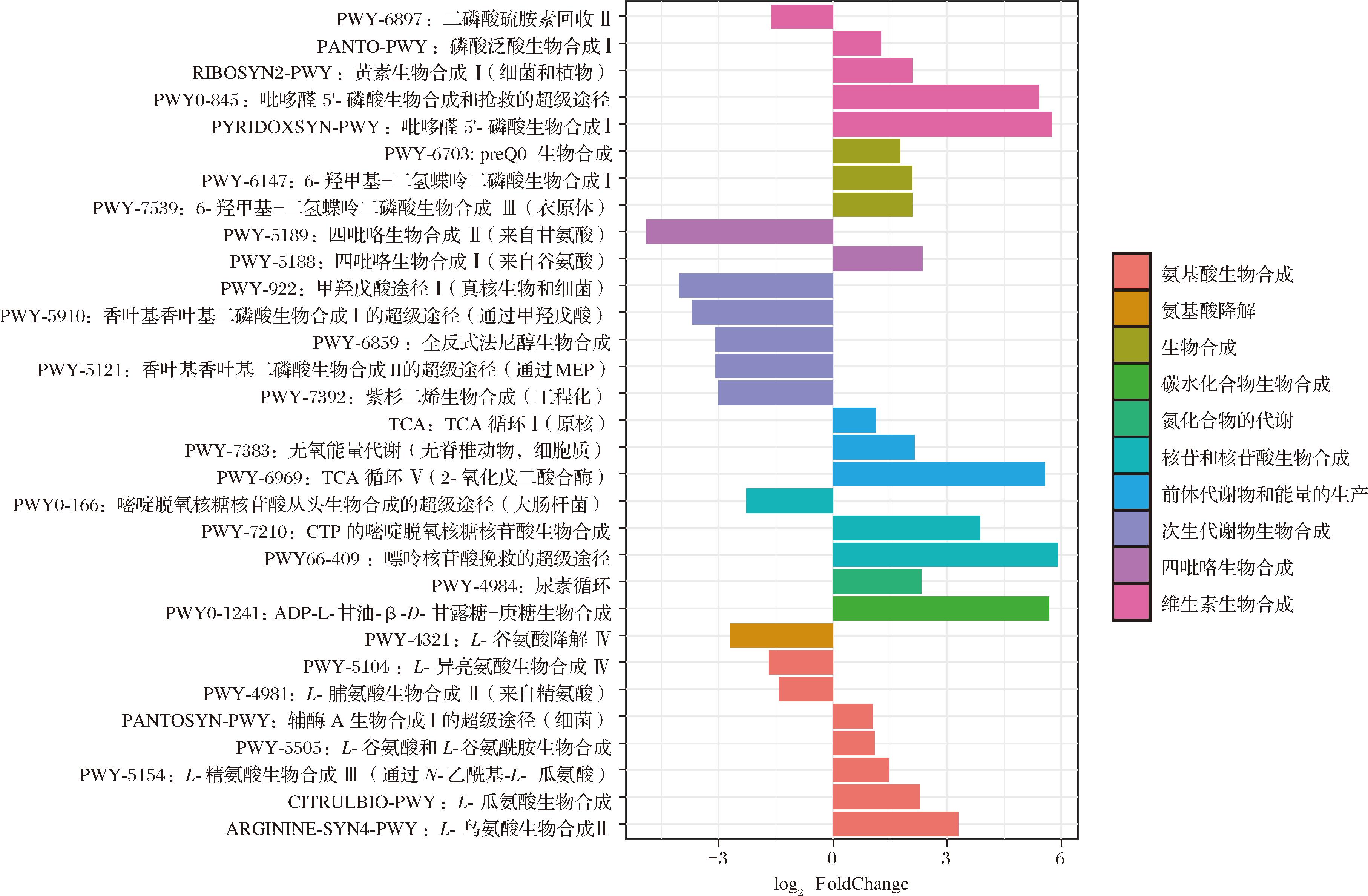
图5 小鼠粪便菌群差异代谢功能分析
Fig.2 Analysis of differential metabolic functions of mouse fecal microbiota
值得注意的是,维生素生物合成途径中与维生素B6合成相关的代谢通路(PYRIDOXSYN-PWY、PWY0-845),以及维生素B2生物合成通路(RIBOSYN2-PWY)、维生素B5生物合成通路(PANTO-PWY)在FPS组中显著富集,而维生素B1生物合成相关通路PWY-6897的相对丰度则显著下降。现有研究表明,维生素B6缺乏在血液透析患者中很常见,可能导致骨代谢异常和贫血,晚期CKD和慢性透析患者的维生素B6摄入量较低,目前尚未报道CKD患者出现与体内低泛酸水平相关的特定综合征[26];氨基酸生物合成通路中,观察到L-鸟氨酸生物合成(ARGININE-SYN4-PWY)、L-瓜氨酸生物合成(CITRULBIO-PWY)、L-精氨酸生物合成(PWY-5154)、L-谷氨酸和L-谷氨酰胺生物合成(PWY-5505)通路在FPS组中显著富集,而支链氨基酸合成相关通路PWY-5104和PWY-4981,以及谷氨酸降解通路(PWY-4321)则在模型组中显著富集。ARGININE-SYN4-PWY代谢通路涉及谷氨酸向鸟氨酸的转化,并进一步参与到尿素循环以及NO生物合成中,而一氧化氮产生减少或生物利用度降低导致的内皮功能障碍是CKD患者中心血管疾病发展发展的已知因素[27]。此外,研究发现慢性肾病患者内源性精氨酸合成减少[28]。精氨酸作为一种半必需氨基酸,是一氧化氮生物合成的专性底物[29]。FPS干预后导致肠道菌群富集精氨酸、鸟氨酸以及瓜氨酸的生物合成,可能进一步影响NO生物合成过程。这一结果为FPS在调节慢性肾脏疾病进程中的作用提供了新的认识。
3 结论
本研究进一步确认了FPS对腺嘌呤诱导的慢性肾病小鼠肾纤维化和功能障碍的保护作用,并探究了FPS对于慢性肾病相关肠道屏障损伤和结肠炎症的修复作用。基于宏基因组测序技术,深入探究了FPS对肠道菌群物种组成及代谢功能的影响。结果表明,FPS不仅减轻了肾脏损伤,还改善了与慢性肾病相关的肠道屏障损伤和结肠炎症。FPS通过富集有益菌A.muciniphila、B.caecimuris,抑制潜在有害菌E.caecimuris、S.lentus的相对丰度,维持肠道菌群的稳态,减轻结肠炎症及肾脏损伤。此外,FPS干预还增加了肠道菌群氨基酸和维生素的生物合成相关通路的相对丰度,其中鸟氨酸、精氨酸、谷氨酸生物合成通路与CKD的血管疾病的发展密切相关。以上作用机制共同展现了FPS在CKD治疗中的全面潜力,为深入研究FPS在慢性肾病治疗中的作用机制提供新的见解。
[1] WANG L M, XU X, ZHANG M, et al.Prevalence of chronic kidney disease in China:Results from the sixth China chronic disease and risk factor surveillance[J].JAMA Internal Medicine, 2023, 183(4):298-310.
[2] STEVENS P E, LEVIN A.Evaluation and management of chronic kidney disease:Synopsis of the kidney disease:Improving global outcomes 2012 clinical practice guideline[J].Annals of Internal Medicine, 2013, 158(11):825-830.
[3] KRUKOWSKI H, VALKENBURG S, MADELLA A-M, et al.Gut microbiome studies in CKD:Opportunities, pitfalls and therapeutic potential[J].Nature Reviews.Nephrology, 2023, 19(2):87-101.
[4] WANG X F, YANG S T, LI S H, et al.Aberrant gut microbiota alters host metabolome and impacts renal failure in humans and rodents[J].Gut, 2020, 69(12):2131-2142.
[5] HOLLE J, BARTOLOMAEUS H, LÖBER U, et al.Inflammation in children with CKD linked to gut dysbiosis and metabolite imbalance[J].Journal of the American Society of Nephrology, 2022, 33(12):2259-2275.
[6] ZHAO D, XU J, XU X.Bioactivity of fucoidan extracted from Laminaria japonica using a novel procedure with high yield[J].Food Chemistry, 2018, 245:911-918.
[7] YU H Y, ZHANG Q B, AHMAO FAROOQI A, et al.Opportunities and challenges of fucoidan for tumors therapy[J].Carbohydrate Polymers, 2024, 324:121555.
[8] WIJESINGHE W A J P, ATHUKORALA Y, JEON Y J.Effect of anticoagulative sulfated polysaccharide purified from enzyme-assistant extract of a brown seaweed Ecklonia cava on Wistar rats[J].Carbohydrate Polymers, 2011, 86(2):917-921.
[9] BOLGER A M, LOHSE M, USADEL B.Trimmomatic:A flexible trimmer for Illumina sequence data[J].Bioinformatics, 2014, 30(15):2114-2120.
[10] LI H.Aligning sequence reads, clone sequences and assembly contigs with BWA-MEM[J].arXiv e-prints, 2013, arXiv:1303.3997.
[11] LI H, HANDSAKER B, WYSOKER A, et al.The sequence alignment/map format and SAMtools[J].Bioinformatics, 2009, 25(16):2078-2079.
[12] QUINLAN A R, HALL I M.BEDTools:A flexible suite of utilities for comparing genomic features[J].Bioinformatics, 2010, 26(6):841-842.
[13] BEGHINI F, MCIVER L J, BLANCO-M GUEZ A, et al.Integrating taxonomic, functional, and strain-level profiling of diverse microbial communities with bioBakery 3[J].eLife, 2021, 10:e65088.
GUEZ A, et al.Integrating taxonomic, functional, and strain-level profiling of diverse microbial communities with bioBakery 3[J].eLife, 2021, 10:e65088.
[14] SEGATA N, WALDRON L, BALLARINI A, et al.Metagenomic microbial community profiling using unique clade-specific marker genes[J].Nature Methods, 2012, 9(8):811-814.
[15] LIU X X, ZHANG Y H, LI W H, et al.Fucoidan ameliorated dextran sulfate sodium-induced ulcerative colitis by modulating gut microbiota and bile acid metabolism[J].Journal of Agricultural and Food Chemistry, 2022, 70(47):14864-14876.
[16] JIA J H, ZHENG W Y, ZHANG C X, et al.Fucoidan from Scytosiphon lomentaria protects against destruction of intestinal barrier, inflammation and lipid abnormality by modulating the gut microbiota in dietary fibers-deficient mice[J].International Journal of Biological Macromolecules, 2023, 224:556-567.
[17] LI X, XIN S J, ZHENG X Q, et al.Inhibition of the occurrence and development of inflammation-related colorectal cancer by fucoidan extracted from Sargassum fusiforme[J].Journal of Agricultural and Food Chemistry, 2022, 70(30):9463-9476.
[18] NEMET I, LI X S, HAGHIKIA A, et al.Atlas of gut microbe-derived products from aromatic amino acids and risk of cardiovascular morbidity and mortality[J].European Heart Journal, 2023, 44(32):3085-3096.
[19] DENG Z Z, WU N, WANG J, et al.Low molecular weight fucoidan fraction LF2 improves metabolic syndrome via up-regulating PI3K-AKT-mTOR axis and increasing the abundance of Akkermansia muciniphila in the gut microbiota[J].International Journal of Biological Macromolecules, 2021, 193:789-798.
[20] PAONE P, CANI P D.Mucus barrier, mucins and gut microbiota:The expected slimy partners?[J].Gut, 2020, 69(12):2232-2243.
[21] WEISS A S, NIEDERMEIER L S, VON STREMPEL A, et al.Nutritional and host environments determine community ecology and keystone species in a synthetic gut bacterial community[J].Nature Communications, 2023, 14(1):4780.
[22] KIM S, SHIN Y C, KIM T Y, et al.Mucin degrader Akkermansia muciniphila accelerates intestinal stem cell-mediated epithelial development[J].Gut Microbes, 2021, 13(1):1-20.
[23] WANG J, GUO X Z, ZOU Z Y, et al.Ootheca mantidis mitigates renal fibrosis in mice by the suppression of apoptosis via increasing the gut microbe Akkermansia muciniphila and modulating glutamine metabolism[J].Biomedicine &Pharmacotherapy, 2023, 166:115434.
[24] WEI W C, WONG C C, JIA Z J, et al.Parabacteroides distasonis uses dietary inulin to suppress NASH via its metabolite pentadecanoic acid[J].Nature Microbiology, 2023, 8(8):1534-1548.
[25] LI Z Q, DONG J X, WANG M, et al.Resveratrol ameliorates liver fibrosis induced by nonpathogenic Staphylococcus in BALB/c mice through inhibiting its growth[J].Molecular Medicine, 2022, 28(1):52.
[26] K![]() DZIERSKA-KAPUZA K, SZCZUKO U,
DZIERSKA-KAPUZA K, SZCZUKO U, ![]() H, et al.Demand for water-soluble vitamins in a group of patients with CKD versus interventions and supplementation-a systematic review[J].Nutrients, 2023, 15(4):860.
H, et al.Demand for water-soluble vitamins in a group of patients with CKD versus interventions and supplementation-a systematic review[J].Nutrients, 2023, 15(4):860.
[27] TAIN Y L, HSU C N.The NOS/NO system in renal programming and reprogramming[J].Antioxidants, 2023, 12(8):1629
[28] BAYLIS C.Arginine, arginine analogs and nitric oxide production in chronic kidney disease[J].Nature Clinical Practice.Nephrology, 2006, 2(4):209-220.
[29] POPOLO A, ADESSO S, PINTO A, et al.L-Arginine and its metabolites in kidney and cardiovascular disease[J].Amino Acids, 2014, 46(10):2271-2286.