5-羟基色氨酸(5-hydroxytryptophan, 5-HTP)是一种非蛋白质氨基酸,是神经递质血清素及胺类激素褪黑素的生物合成前体[1]。在医疗保健领域,5-HTP作为精神调节剂被广泛应用于临床治疗,包括缓解头痛[2]、促进睡眠[3]、调节食欲[4]及治疗抑郁[5]等,展现了显著的治疗能力,获得了广泛关注,其市场需求量巨大[1]。
目前,从加纳籽中提取5-HTP是商业生产的主流方法,但加纳籽完全依赖进口,又面临季节性和地域性限制,导致原料短缺和生产成本难以控制[6]。化学合成法由于其复杂的工艺流程、高昂的成本及潜在的环境污染风险,并不适合规模化生产。因此,近年来研究人员转向高效、低成本且环境友好的微生物发酵法。ZHANG等[7]通过在大肠杆菌中构建色氨酸羟化模块、辅因子再生模块和色氨酸合成模块,在5 L生物反应器中实现了8.58 g/L的5-HTP积累,为目前报道的以葡萄糖为碳源从头合成5-HTP的最高产量。尽管如此,微生物发酵生产5-HTP仍面临诸多挑战,如5-HTP合成涉及多个代谢途径的平衡,高强度表达途径基因影响细胞生长,阻碍了细胞高效合成;异源辅因子合成和再生途径的引入使菌株改造过程繁琐等[8]。酶催化法以其清洁、高转化率和可控的反应条件等优点,成为另一有前景的生产方法。
色氨酸羟化酶(tryptophan hydroxylase, TPH)是生物催化合成5-HTP的关键酶。如图1所示,L-色氨酸(L-tryptophan, L-Trp)和氧气在TPH的催化下生成5-HTP,并需要Fe2+和四氢生物蝶呤(tetrahydrobiopterin,BH4)作为辅助因子[9]。TPH主要存在于哺乳动物中,在原核生物中未发现天然的TPH。研究人员发现,通过对原核生物中的苯丙氨酸羟化酶(phenylalanine hydroxylase,PAH)[10]和芳香族氨基酸羟化酶(CtAAAH)[11]进行突变改造,可赋予这些酶对L-Trp的催化活力,但其底物特异性较差,转化效率仅50%。哺乳动物来源的TPH包含2个亚型:TPH1和TPH2,它们对L-Trp具有高底物特异性和催化活力[9]。WANG等[12]开发了一种体外多酶联级系统,将TPH和辅因子循环与再生途径中的5个酶分别进行表达和纯化,然后加入同一反应器中进行酶法催化,16 h后50 mmol/L的L-Trp转化得到36.9 mmol/L的5-HTP,转化率为73.8%。然而,酶蛋白的纯化过程复杂且成本高昂。据报道,蛋白纯化成本占总生产成本的比例可高达50%[13]。因此,尽管酶法催化绿色高效,但仍需改进创新,降低生产成本,从而推进工业化生产。
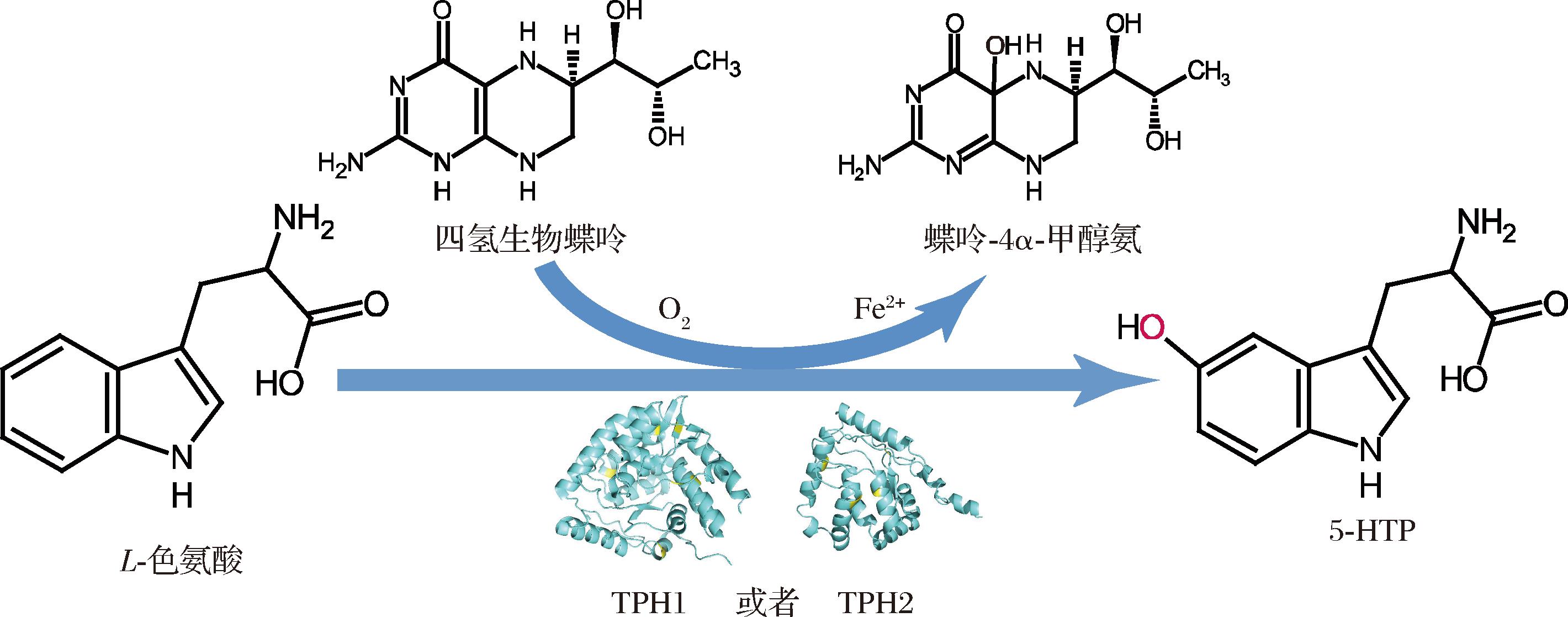
图1 TPH催化合成5-HTP的示意图
Fig.1 Schematic diagram of synthesis of 5-HTP catalyzed by TPH
针对上述问题,本研究通过强化TPH的表达和催化效率,并促进菌株高效胞外分泌酶蛋白,采用胞外分泌粗酶液实现5-HTP的生物转化,从而有望降低酶法催化的操作成本。首先,通过敲除大肠杆菌W3110 (DE3)中涉及底物和产物降解的关键基因,阻断L-Trp和5-HTP的降解途径,提升目标产物的稳定性。然后,对TPH的可溶性表达进行优化,并通过调整催化体系参数,确立了最佳催化条件,提高了酶的催化效率。最后,结合绿色荧光蛋白变体与促释放化学试剂蔗糖和甘氨酸,建立了一种高效胞外分泌蛋白的策略,实现了胞外分泌粗酶液生物合成5-HTP,节省了传统纯酶催化的操作成本,为5-HTP的工业化生产提供了可行的新策略。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
大肠杆菌Escherichia coli W3110 (DE3)、质粒pET28a、质粒pTargetF-sgRNA和质粒pEcCas9均由作者所在实验室保藏。菌株W0-W13和质粒pET00-13由本研究构建。
1.1.2 主要试剂
氯化钠、六水合硫酸亚铁铵、4-羟乙基哌嗪乙磺酸(2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid,HEPES)、二硫苏糖醇(dithiothreitol,DTT)、蔗糖、甘氨酸、氢氧化钠、L-Trp和5-HTP等,国药集团化学试剂有限公司;氨苄青霉素、酵母粉和蛋白胨等,生工生物工程(上海)有限公司;过氧化氢酶,上海麦克林生化科技股份有限公司;BH4,上海易恩化学技术有限公司。
1.1.3 培养基和缓冲溶剂
LB培养基(g/L):蛋白胨10,酵母提取物5,氯化钠10,121 ℃高温灭菌20 min。
LBSG培养基(g/L):蛋白胨10,酵母提取物5,氯化钠10,蔗糖50,甘氨酸10,过滤除菌。
LBSGT培养基(g/L):蛋白胨10,酵母提取物5,氯化钠10,蔗糖50,甘氨酸10,Triton X-100 1% (体积分数),过滤除菌。
缓冲溶液:50 mmol/L HEPES,用氢氧化钠调节pH值至7.5。
1.2 仪器与设备
恒温培养箱,上海新苗医疗器械有限公司;恒温摇床,上海知楚仪器有限公司;台式高速离心机,德国Eppendorf公司;Agilent 1260液相色谱仪,美国Agilent公司;Cytation3酶标仪,美国BioTec公司;UV-245型紫外-可见分光光度计,日本Shimadzu公司;超声波细胞破碎仪,美国SONICS公司。
1.3 实验方法
1.3.1 质粒构建
编码TPH1(NC_000011.9)和TPH2(NC_000012.11)的基因进行密码子优化后,由苏州安升达生物科技有限公司合成。利用生物信息数据库网站Kyoto Encyclopedia of Genes and Genomes (KEGG, https://www.kegg.jp/kegg/)查找基因tnaA及其上下游的基因序列,并以其为依据设计获得基因重组片段。利用CRISPR-sgRNA Design Tool Benchling 网站(https://benchling.com)获取目标基因tnaA的sgRNA序列。
以基因lacIq和质粒pET28a为模板,用引物LacIq-F/LacIq-R和pET28a-F/pET28a-R分别克隆获得基因片段,最后使用一步克隆的方法组装成质粒pET00。以同样的方式构建表达质粒pET01-pET13和工具质粒pTargetF-sgtnaA。
1.3.2 菌株构建
利用电转化方式将pEcCas9质粒导入到菌株E.coli W3110 (DE3)中,获得菌株WpEcCas9;将菌株WpEcCas9中的Cas9蛋白诱导表达后,利用电转化方式将质粒pTargetF-sgtnaA和重组片段导入到菌株WpEcCas9中;挑选敲除成功的阳性转化子并将质粒pEcCas9和pTargetF-sgtnaA消除,获得菌株W0。利用化学转化法将质粒pET01-pET13导入到菌株W0中,获得表达菌株W1~W13。
1.3.3 蛋白表达
将保存在-80 ℃冰箱中的菌株取出,在具有氨苄青霉素抗性的固体平板上划线,37 ℃恒温培养箱中过夜培养,挑取平板上的单菌落转接至装有3 mL LB培养基的10 mL摇菌管中,37 ℃,220 r/min培养8 h。将活化后的种子液以2%(体积分数)的接种量接种至装有25 mL LB培养基的250 mL摇瓶中,37 ℃,220 r/min培养OD600值为0.4~0.6时,加入终浓度为0.2 mmol/L的IPTG进行诱导,25 ℃,220 r/min继续培养18 h (初始诱导条件)。
培养结束后,取2 mL菌液离心收集菌体,用1 mL HEPES缓冲液重悬,用超声波细胞破碎仪进行破碎。细胞破碎液离心取上清液,沉淀用1 mL HEPES缓冲液重悬,将上清液和沉淀蛋白样品进行处理后跑SDS-PAGE。凝胶先用考马斯亮蓝染色液轻柔振荡染色30 min,后用清水轻柔振荡脱色过夜。将脱好色的凝胶放置在凝胶成像仪白光模式下观察,用软件ImageJ进行图像处理分析,用积分灰度值代表目标区域所含蛋白的总表达量,并通过灰度比值将数据标准化,以便定量分析比较目标蛋白的相对表达量,具体计算如公式(1)所示:
灰度比值![]()
(1)
1.3.4 酶促反应
2 mL的催化反应体系(初始条件)包括:50 mmol/L HEPES (pH 7.5)、0.2 g/L L-Trp、0.4 g/L BH4、0.2 g/L过氧化氢酶、100 μmol/L Fe2+和2.5 mmol/L DTT,30 ℃催化2 h。
1.3.5 检测方法
菌体浓度检测:用超纯水稀释菌液至合适倍数,使用紫外-可见分光光度计在600 nm波长下测定OD值。
5-HTP和L-Trp浓度检测:采用HPLC检测,以Agilent C18 (5 μL,250 mm ×4.6 mm)为分离柱,流速1.0 mL/min,柱温40 ℃,检测波长278 nm,流动相为纯水和乙腈:10%乙腈-0 min、60%乙腈-10 min、10%乙腈-20 min。
2 结果与分析
2.1 5-HTP的有效积累
在使用粗酶液进行生物催化过程中,首先需要消除非目标蛋白对反应的干扰。为了优化产物的积累,通常采取的策略包括敲除参与底物和产物降解途径的关键酶基因。在大肠杆菌中,由基因tnaA编码的色氨酸酶可以将L-Trp和5-HTP分解为吲哚和5-羟基吲哚,从而影响目标产物的积累。因此,本研究以野生大肠杆菌E.coli W3110 (DE3)为出发菌株(W),考察敲除tnaA,减少对L-Trp和5-HTP的影响。运用CRISPR/Cas9基因编辑技术针对基因tnaA进行敲除,获得表达菌株W0。结果如图2所示,4 h后菌株W中的L-Trp降解了72%,5-HTP降解了20%。而L-Trp和5-HTP在菌株W0中可以稳定存在。综上所述,基因tnaA的敲除,可以抑制L-Trp和5-HTP的降解,实现5-HTP的有效积累。
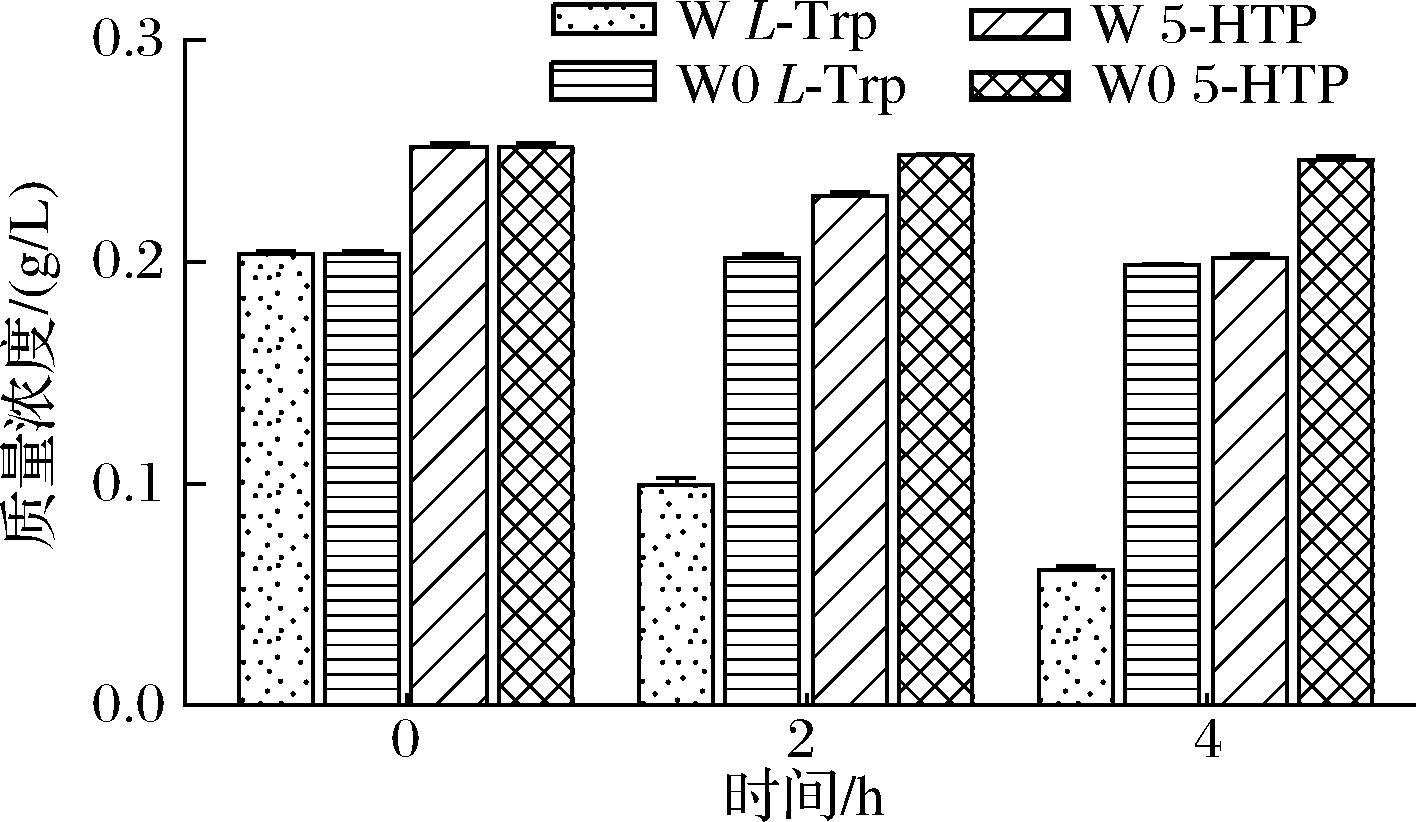
图2 菌株W和W0对L-Trp和5-HTP的积累情况
Fig.2 Accumulation of L-Trp and 5-HTP by strains W and W0
2.2 TPH的可溶性表达及活性检测
2.2.1 TPH的可溶性表达
在大肠杆菌中,天然形态的色氨酸羟化酶TPH1和TPH2在大肠杆菌主要以包涵体形式表达,显著影响了5-HTP的生物转化效率[9]。MCKINNEY等[14]发现将麦芽糖结合蛋白(maltose binding protein,MBP)和TPH融合表达,可以促进其可溶性表达且酶活性提高了3倍。CARKACI-SALLI等[15]对TPH2进行了截短,仅保留其中心催化域,将TPH2可溶蛋白占比从6.9%提升至97.5%,活性提高了6倍。本研究对TPH1和TPH2进行了二硫键预测分析(图3-a、图3-b)[16],发现2个蛋白均含有多个二硫键。二硫键的正确形成对于许多蛋白质可溶性表达和发挥生物活性是必不可少的[17]。研究表明,将硫氧还蛋白(recombinant thioredoxin,Trx)与目标蛋白融合可以促进目标蛋白正确折叠和二硫键正确形成[18]。基于此,对TPH进行了截短,获得了TPH11 (NΔ99/CΔ24)和TPH21 (NΔ145/CΔ24)。将MBP和Trx与全长和截短的TPH进行融合表达,以探究其对目标蛋白可溶性表达和催化活性的影响。共构建了12种表达质粒,并将其转化至表达菌株W0,获得表达菌株W1~W12和酶蛋白M1~M12 (图3-c)。

a-TPH1亚基的二硫键预测;b-TPH2亚基的二硫键预测;c-质粒构建示意图
图3 TPH的二硫键分析和改造
Fig.3 Disulfide bond prediction and modification of TPH
注:预测出的二硫键位置用黄色标出。
在初始条件下(25 ℃,0.2 mmol/L)对菌株W1~W12进行了蛋白诱导表达,图4-a、图4-b展示了12种蛋白在上清液和沉淀中的分布情况。利用图像分析软件和计算公式(1),将SDS-PAGE图中目标条带转换成灰度比值,用于定量分析蛋白表达量(图4-c)。结果表示,全长的M1和M7在大肠杆菌中主要存在于不可溶组分中,在全长基础上引入Trx (M2和M8),该情况也未见明显改善;而引入MBP (M3和M9),虽然不可溶蛋白量明显减少,但是可溶蛋白量未有明显增加。分析认为,MBP虽然能在一定程度上减少不可溶蛋白的形成,但其分子质量较大,影响了融合蛋白的整体表达量。截短的M4和M10的总体蛋白表达量较全长有所下降,但可溶蛋白占比提升至90%左右,可见截短能明显提高蛋白的可溶表达占比。但在截短蛋白上引入MBP (M6和M12),不可溶蛋白占比反而增加。在截短蛋白上引入Trx (M5和M11),虽然不可溶蛋白占比提升,但是总体蛋白表达量较截短蛋白增加了1倍。单从可溶蛋白表达量上看,M11的可溶表达量是M10的1.2倍,蛋白可溶表达量得到了进一步的提升。比较分析可知,Trx能辅助截短的TPH中二硫键的正确形成,从而改善蛋白的可溶性表达情况。综上所述,利用Trx与TPH21融合表达(M11),在提高单位菌体中可溶蛋白量方面表现最佳。
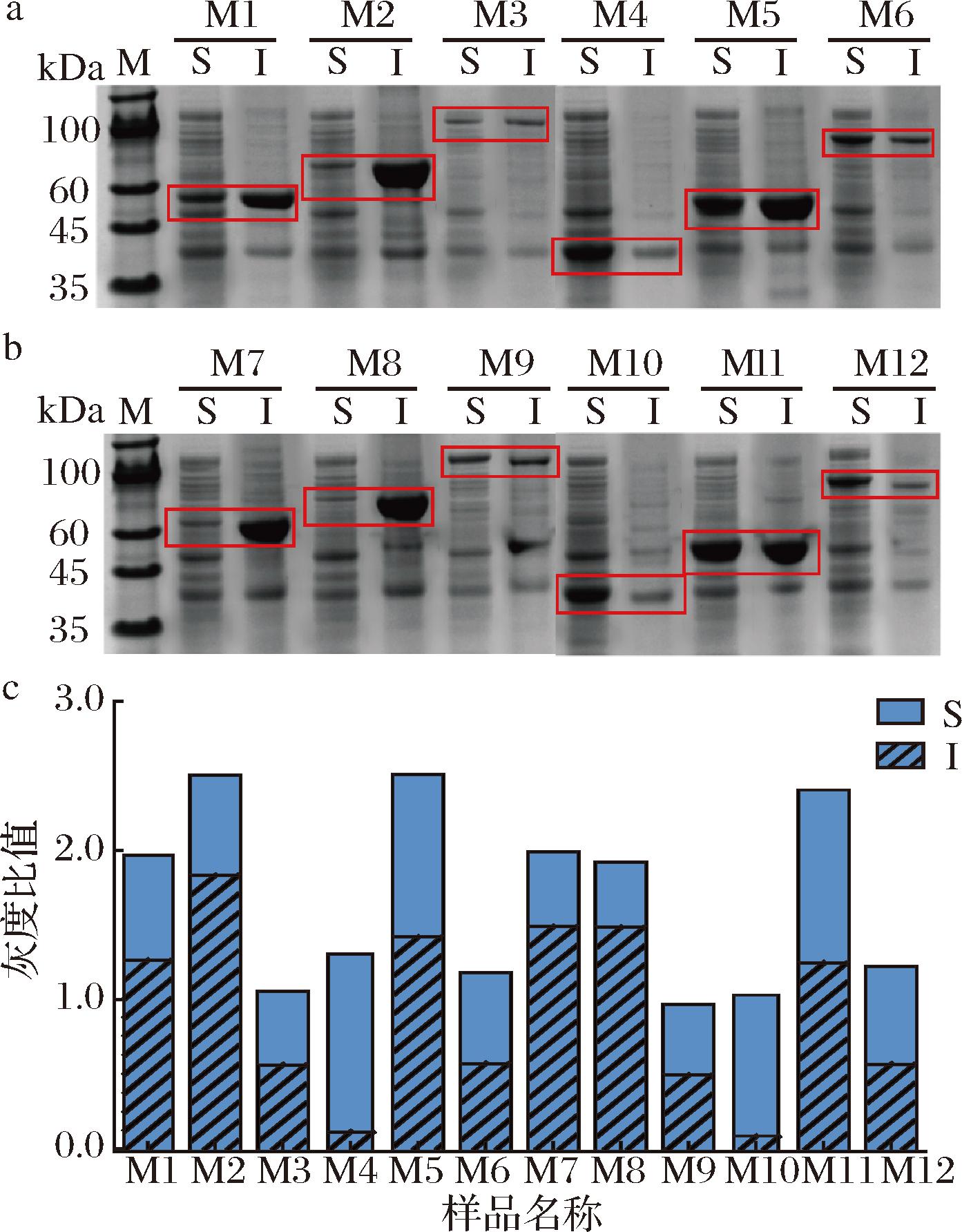
a-M1~M6蛋白表达的SDS-PAGE;b-M7~M12蛋白表达的 SDS-PAGE;c-M1~M12蛋白表达量的灰度分析
图4 M1~M12蛋白的表达情况
Fig.4 Expression of M1-M12 protein
注:红色矩形框表示目标蛋白条带; S-可溶部分;I-不可溶部分;M-Marker(下同)。
诱导温度和IPTG浓度是调控异源蛋白在宿主细胞中可溶性表达的关键参数。首先评估不同诱导温度(30、25、20 ℃)对M11可溶性表达的影响。结果表明,降低诱导温度显著提高了蛋白的表达量,其中在20 ℃下诱导18 h后,蛋白的可溶表达量达到最高(图5)。
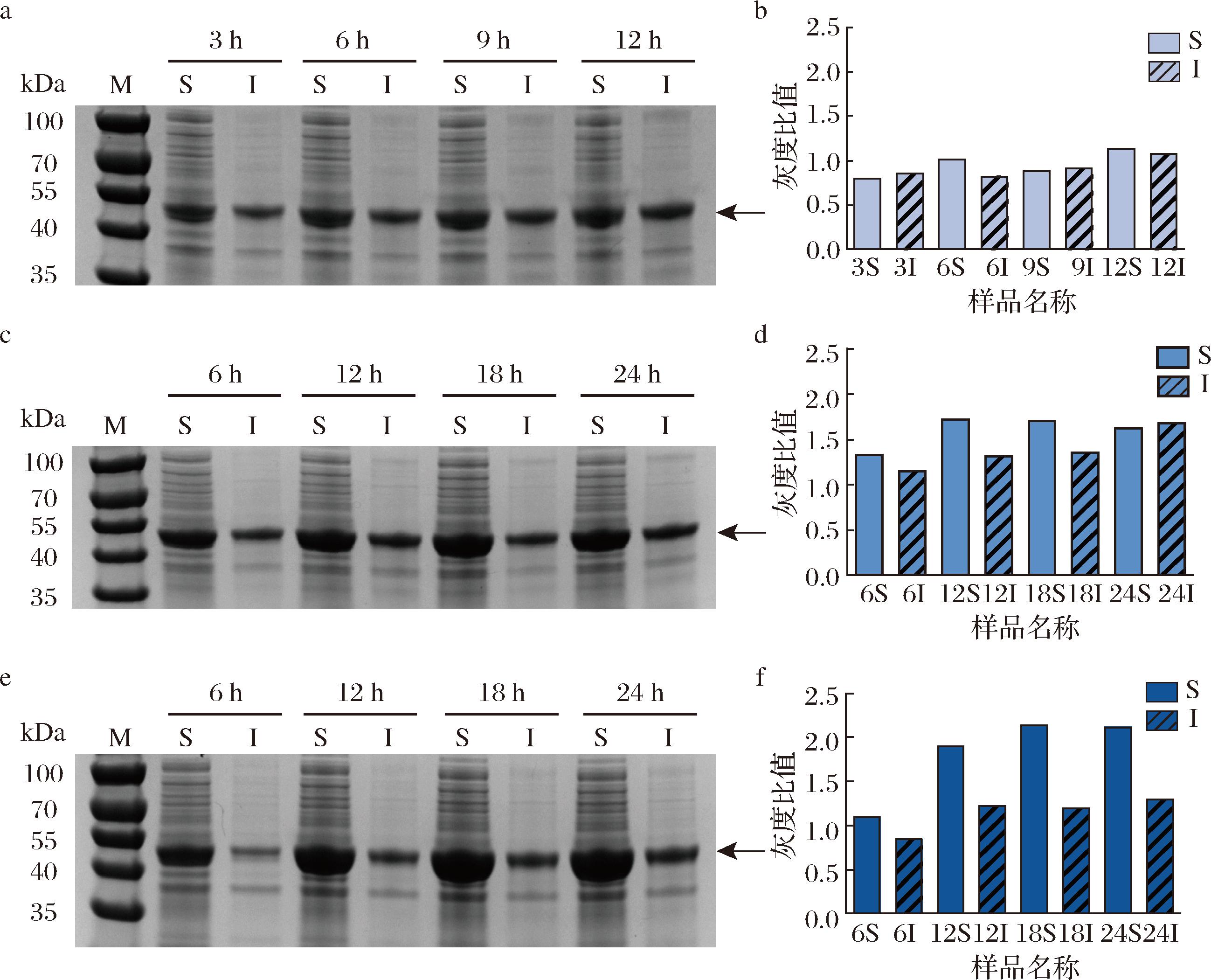
a-30 ℃诱导蛋白表达SDS-PAGE;b-30 ℃诱导蛋白表达量灰度分析;c-25 ℃诱导蛋白表达SDS-PAGE;d-25 ℃诱导蛋白表达量灰度 分析;e-20 ℃诱导蛋白表达SDS-PAGE;f-20 ℃诱导蛋白表达量灰度分析
图5 诱导温度对M11可溶性表达的影响
Fig.5 Effect of induction temperature on soluble expression of M11
注:黑色箭头表示目标蛋白条带(下同)。
这一现象可归因于哺乳动物源酶的折叠和形成本身较为复杂,低温条件下细胞代谢速率减缓,蛋白质合成速度降低,有利于蛋白质正确折叠,减少错误折叠蛋白质形成包涵体的风险[19]。此外,考虑到TPH中二硫键的存在,低温有助于二硫键的正确形成,从而使酶蛋白正确折叠[17]。
在20 ℃诱导温度下,研究了不同IPTG浓度(0.3、0.2、0.1、0.05 mmol/L)对M11可溶性表达的影响。结果如图6所示,0.05 mmol/L IPTG浓度条件下的蛋白表达效果最佳。研究表明使用高诱导剂浓度可导致新生蛋白质浓度过高,以至于蛋白质在折叠前就聚集[20]。因此,适当降低诱导剂浓度,可以允许新合成的蛋白质在聚集和形成包涵体之前正常折叠,从而促进可溶性表达。综上,考虑到TPH的复杂折叠特性以及二硫键的形成要求,在20 ℃和0.05 mmol/L IPTG下诱导蛋白能有效促进其正确折叠,提高蛋白的可溶性表达。
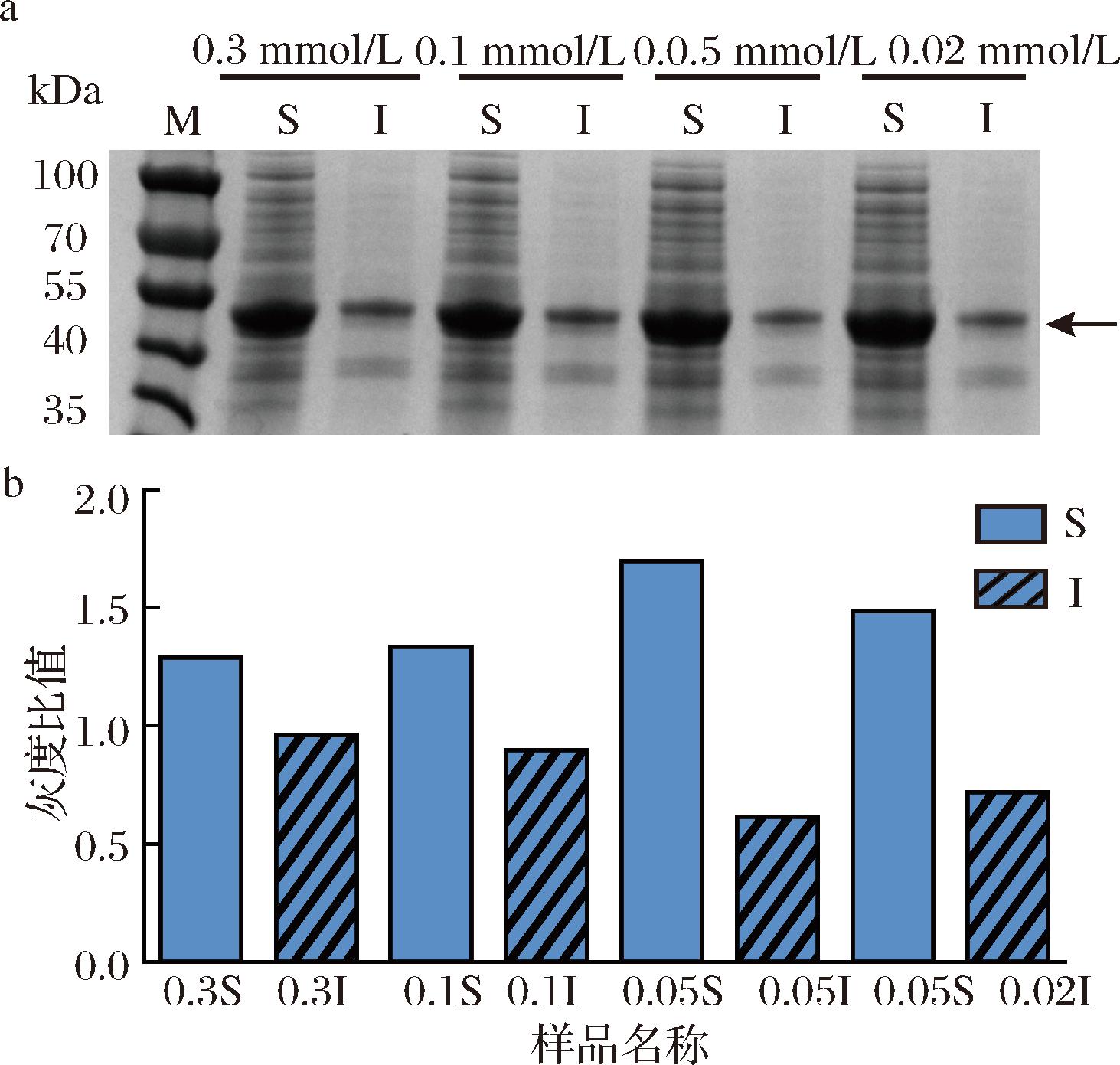
a-不同诱导剂浓度下蛋白表达的SDS-PAGE; b-不同诱导剂浓度下蛋白表达量的灰度分析
图6 诱导剂浓度对M11可溶性表达的影响
Fig.6 Effect of concentration of inducer on soluble expression of M11
2.2.2 TPH的活力检测
变体酶蛋白M4、M5、M10和M11展示了较高的可溶表达水平,为了评估各变体酶蛋白的催化活性,将其在初始催化体系下进行5-HTP的生物转化。如图7所示,TPH2系列酶蛋白的催化活性高于TPH1系列。其中,M11显示出最佳的催化效率,产生了0.12 g/L的5-HTP,转化率达到60%。Trx的引入不仅提高了TPH21的可溶性表达水平,还提高了蛋白的酶促催化活性。
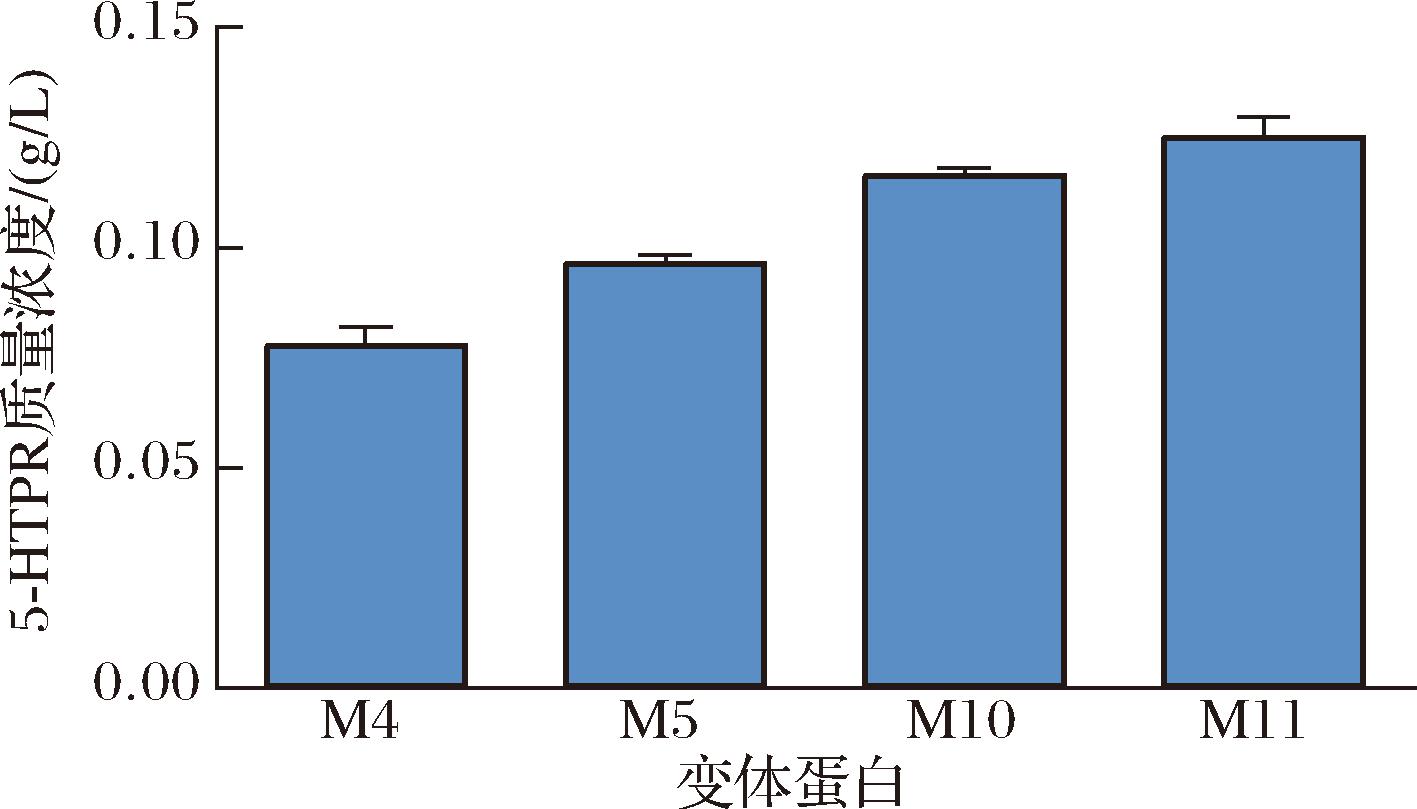
图7 各变体蛋白催化合成5-HTP产量
Fig.7 Production of 5-HTP catalyzed by various mutant protein
2.3 酶催化体系的优化
为了提升5-HTP的产率,采用了控制单一变量法来优化5个关键反应参数。TPH催化的反应过程会产生对酶有害的过氧化氢[9],通过加入过氧化氢酶来迅速分解过氧化氢,避免其对酶的损害。不同过氧化氢酶质量浓度(50~400 mg/L)对催化效率的影响如图8-a所示,在100 mg/L过氧化氢酶下催化效率最高。作为辅助因子的Fe2+浓度对催化效率也有显著影响,100 μmol/L的Fe2+提供了最佳的催化效果(图8-b)。此外,评估了不同浓度的HEPES缓冲液(50、100、150、200 mmol/L)对反应的影响,结果表明100 mmol/L HEPES条件下观测到的催化性能最佳(图8-c)。

a-过氧化氢酶质量浓度;b-Fe2+浓度;c-HEPES浓度值;d-pH;e-温度对催化的影响
图8 催化条件优化
Fig.8 Optimization of catalytic conditions
另外,考虑到pH值可能影响酶的三维结构以及底物和产物的离子状态,探讨了pH值在6.5~9.5对5-HTP合成的影响。结果表明,在pH值 7.5条件下酶活力最高,5-HTP产量达到峰值(图8-d)。温度对酶催化活力的影响是双重的:一方面影响反应速率,另一方面影响酶的构象稳定性。在25~40 ℃温度时初步探究温度对反应的影响,发现5-HTP的产量随温度升高而增加,未观察到产量减少的转折点(图8-e)。进一步以5 ℃为间隔提升反应温度,直至65 ℃时5-HTP产量开始下降,最终确定最佳反应温度为60 ℃。WANG等[12]在其研究中表明截短的TPH21最佳反应温度为35 ℃,其他相关的文献报道也表明在同一温度范围内波动[10-11,21]。有研究表明,二硫键通常被认为通过降低其构象熵来提高蛋白质的稳定性[22]。据此分析认为,TPH21中具有一定数量的二硫键,本研究通过Trx的引入和诱导条件的优化,促进了二硫键形成与蛋白质折叠,从而显著提升了酶蛋白的热稳定性。
综上所述,酶催化的最佳反应体系为:在100 mmol/L HEPES (pH 7.5)缓冲溶液中加入0.2 g/L L-Trp、0.4 g/L BH4、0.1 g/L过氧化氢酶、100 μmol/L Fe2+和2.5 mmol/L DTT,且催化温度为60 ℃。将M11变体蛋白在最佳反应体系中催化,2 h后获得0.17 g/L的5-HTP,转化率达85% (图9)。与WANG等[12]的研究相比(16 h,73.8%),本研究大大缩短了反应时间,提高了转化效率。
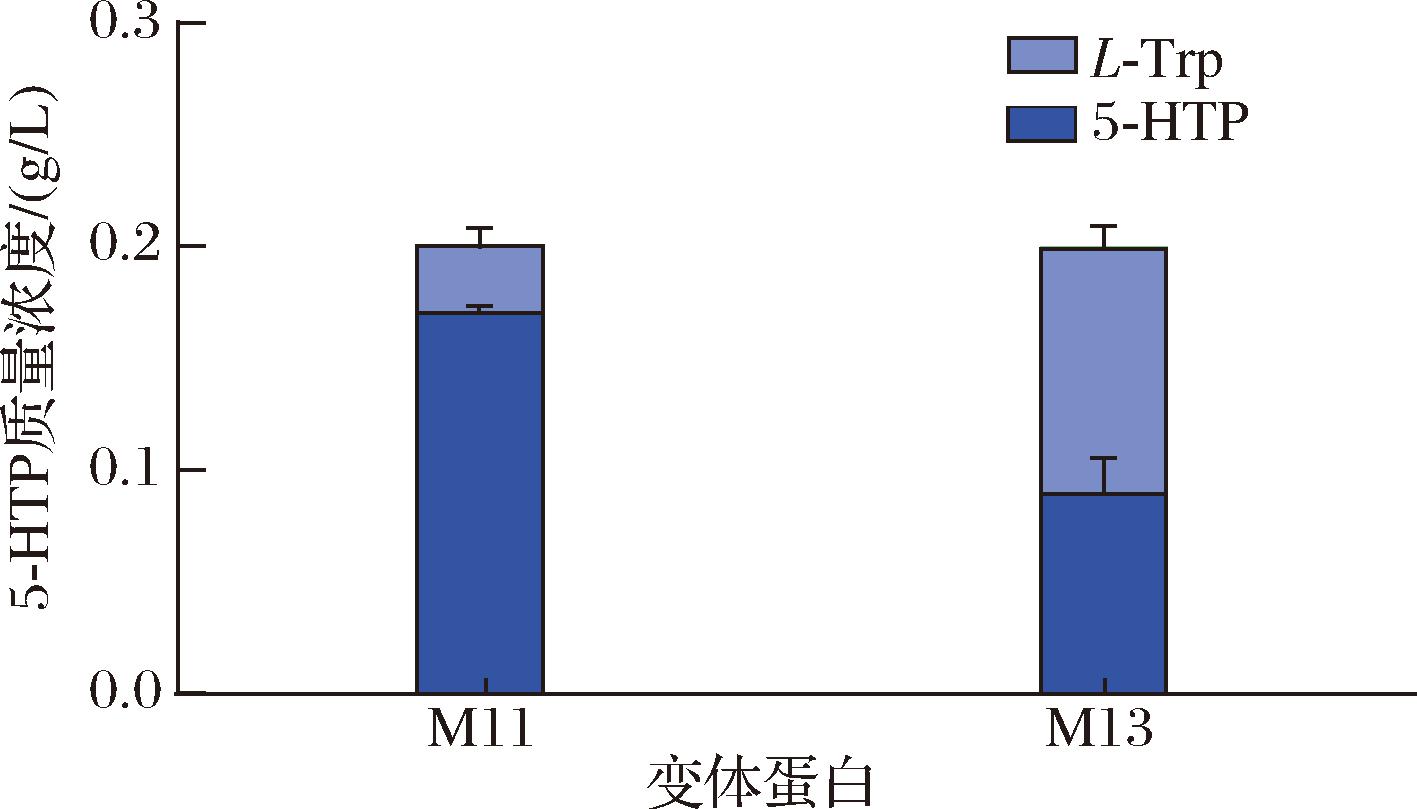
图9 M11与M13催化合成5-HTP的比较分析
Fig.9 Comparative Analysis of 5-HTP Synthesis catalyzed by M11 and M13
2.4 胞外分泌蛋白催化合成5-HTP
2.4.1 菌株胞外分泌系统的效率分析
酶催化法因其高转化率和反应条件可控而备受青睐,然而高昂的纯化成本极大地增加了生产成本,限制了其商业化生产。本研究旨在通过菌株改造促进酶蛋白的胞外分泌,以简化蛋白纯化过程,降低生产成本。研究发现,绿色荧光蛋白突变体(sfGFP*)可以促进大肠杆菌中异源蛋白的自动胞外分泌,多种蛋白包括简单多肽和复杂多聚体蛋白等均成功利用该方法实现了胞外分泌[23]。但是,该系统的分泌效率因蛋白而异,人精氨酸酶1、抗菌肽和内切-N-乙酰氨基葡萄糖酶H用该方法进行胞外分泌,分泌效率分别为10%、30%和60%。基于此,本研究将sfGFP*与M11融合表达,构建了变体蛋白M13及表达菌株W13,并评估其胞外分泌酶蛋白的效率。结果如图10-a所示,表达菌株W13培养30 h后,胞外蛋白只占蛋白总量的16%,表明仅使用sfGFP*对本研究目标蛋白的分泌效果有限。考虑到sfGFP*的自动胞外分泌路径:从细胞质空间跨过内膜到周质空间,再跨过外膜分泌到胞外[23]。除了sfGFP*对目标蛋白的特异性,细胞内外膜的影响也是不可忽视的。

a-LB培养基中M13分泌情况;b-LBSG培养基中M13分泌情况;c-LBSGT培养基中M13分泌情况;d-W13在3种培养基中的生长情况
图10 W13菌株在不同培养基中的胞外分泌效果和生长情况
Fig.10 Secretion and growth of strain W13 in different media
研究表明,在培养基中加入蔗糖可以扩大细胞周质空间,从而降低分泌蛋白的局部浓度,减少聚集[24]。甘氨酸和 Triton X-100能影响大肠杆菌细胞最外层的完整性,使周质空间中的蛋白渗漏到培养基中[25-26]。本研究设计了2种分泌培养基(LBSG和LBSGT),评估W13菌株在其中的生长情况和目标蛋白的分泌情况。图10-b表明,菌株W13在LBSG培养基中生长18 h,可实现高达90%的蛋白胞外分泌效率,且总体蛋白表达量仅略低于对照条件下的蛋白表达量(图10-a)。在LBSGT培养基中,尽管大部分蛋白质分泌至胞外,但由于菌体过早死亡,蛋白质的表达积累量较低(图10-c、图10-d)。该结果表明,促释放试剂蔗糖和甘氨酸的加入能很好地平衡细胞生长和胞外分泌,再累加使用Triton X-100反而对细胞破坏严重。综合考虑,将sfGFP*与目标蛋白进行融合表达,并且在LBSG培养基中诱导表达,能展现出最优的蛋白胞外分泌效果。
2.4.2 胞外分泌对酶活力的影响研究
为了确认sfGFP*的引入是否对酶活力产生严重不良影响,考察了M11和M13两种变体蛋白在最优反应条件下对L-Trp向5-HTP的催化转化情况。结果如图10所示,M13变体在最优条件下产生的5-HTP质量浓度为0.09 g/L,比M11变体低了35%,表明sfGFP*的引入对酶的催化活力产生了一定影响。这可能是由于融合表达在一定程度上增加了融合蛋白的空间位阻,影响了底物与酶活力中心的接触。尽管该策略在一定程度上降低了酶的活力,但与传统的纯酶催化相比,该方法省去了细胞破碎和纯化蛋白的步骤,其带来的成本降低效应也是显著的。
3 讨论
5-HTP作为神经递质血清素及胺类激素褪黑素的前体,具有重要的医用价值和广阔的市场需求。针对目前酶法催化存在的转化率不高和纯化成本较高等问题,本研究致力于提升TPH的表达、催化和分泌效率,以实现5-HTP的高效生物转化。首先通过基因工程手段阻断了L-Trp和5-HTP的降解途径,使产物有效积累。然后,通过截短、促融标签的引入和诱导条件优化等手段,提升了TPH的可溶蛋白表达量。并优化了催化体系参数,2 h后获得0.17 g/L的5-HTP,转化率达85%。与目前已报道的酶法催化方法相比,变体蛋白M11的热稳定性大大提高,催化温度可达60 ℃,大大缩短了催化时间,提高了催化效率。最后,构建了一种高效胞外分泌酶蛋白的策略,蛋白分泌效率高达90%,大大简化了传统纯酶的工艺流程,降低了操作成本。但目前还存在一些问题,如融合蛋白的引入一定程度上影响了酶的催化活力;外源辅因子的添加增加了原料成本等。后续可以针对这些问题进行改进,如引入蛋白酶切位点,使融合蛋白胞外分泌后再分割催化;改造TPH使其可以利用内源辅因子进行催化等,实现酶活力与成本效益的平衡,为5-HTP的工业化生产提供一个具有潜力的新途径。
[1] LIU X X, ZHANG B, AI L Z.Advances in the microbial synthesis of 5-hydroxytryptophan[J].Frontiers in Bioengineering and Biotechnology, 2021, 9:624503.
[2] BONO G, CRISCUOLI M, MARTIGNONI E, et al.Serotonin precursors in migraine prophylaxis[J].Advances in Neurology, 1982, 33:357-363.
[3] WYATT R J, ZARCONE V, ENGELMAN K, et al.Effects of 5-hydroxytryptophan on the sleep of normal human subjects[J].Electroencephalography and Clinical Neurophysiology, 1971, 30(6):505-509.
[4] CECI F, CANGIANO C, CAIRELLA M, et al.The effects of oral 5-hydroxytryptophan administration on feeding behavior in obese adult female subjects[J].Journal of Neural Transmission, 1989, 76(2):109-117.
[5] ZMILACHER K, BATTEGAY R, GASTPAR M.L-5-hydroxytryptophan alone and in combination with a peripheral decarboxylase inhibitor in the treatment of depression[J].Neuropsychobiology, 1988, 20(1):28-35.
[6] MAFFEI M E.5-Hydroxytryptophan (5-HTP):Natural occurrence, analysis, biosynthesis, biotechnology, physiology and toxicology[J].International Journal of Molecular Sciences, 2020, 22(1):181.
[7] ZHANG Z, YU Z C, WANG J D, et al.Metabolic engineering of Escherichia coli for efficient production of L-5-hydroxytryptophan from glucose[J].Microbial Cell Factories, 2022, 21(1):198.
[8] XU D, FANG M J, WANG H J, et al.Enhanced production of 5-hydroxytryptophan through the regulation of L-tryptophan biosynthetic pathway[J].Applied Microbiology and Biotechnology, 2020, 104(6):2481-2488.
[9] FITZPATRICK P F.Tetrahydropterin-dependent amino acid hydroxylases[J].Annual Review of Biochemistry, 1999, 68:355-381.
[10] HARA R, KINO K.Enhanced synthesis of 5-hydroxy-l-tryptophan through tetrahydropterin regeneration[J].AMB Express, 2013, 3(1):70.
[11] MORA-VILLALOBOS J A, ZENG A P.Protein and pathway engineering for the biosynthesis of 5-hydroxytryptophan in Escherichia coli[J].Engineering in Life Sciences, 2017, 17(8):892-899.
[12] WANG B B, LIU S, WANG H D, et al.Efficient biosynthesis of high-value 5-hydroxytryptophan using a multienzyme cascade[J].Molecular Catalysis, 2023, 546:113274.
[13] FARID S S.Process economics of industrial monoclonal antibody manufacture[J].Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2007, 848(1):8-18.
[14] MCKINNEY J, KNAPPSKOG P M, PEREIRA J, et al.Expression and purification of human tryptophan hydroxylase from Escherichia coli and Pichia pastoris[J].Protein Expression and Purification, 2004, 33(2):185-194.
[15] CARKACI-SALLI N, FLANAGAN J M, MARTZ M K, et al.Functional domains of human tryptophan hydroxylase 2 (hTPH2)[J].The Journal of Biological Chemistry, 2006, 281(38):28105-28112.
[16] YANG J, HE B J, JANG R, et al.Accurate disulfide-bonding network predictions improve ab initio structure prediction of cysteine-rich proteins[J].Bioinformatics, 2015, 31(23):3773-3781.
[17] BULAJ G.Formation of disulfide bonds in proteins and peptides[J].Biotechnology Advances, 2005, 23(1):87-92.
[18] STEWART E J, ASLUND F, BECKWITH J.Disulfide bond formation in the Escherichia coli cytoplasm:An in vivo role reversal for the thioredoxins[J].The EMBO Journal, 1998, 17(19):5543-5550.
[19] SØRENSEN H P, MORTENSEN K K.Soluble expression of recombinant proteins in the cytoplasm of Escherichia coli[J].Microbial Cell Factories, 2005, 4(1):1.
[20] FRANCIS D M, PAGE R.Strategies to optimize protein expression in E.coli[J].Current Protocols in Protein Science, 2010,5(1):5.24.1-5.24.5.24.29.
[21] KINO K, HARA R, NOZAWA A.Enhancement of L-tryptophan 5-hydroxylation activity by structure-based modification of L-phenylalanine 4-hydroxylase from Chromobacterium violaceum[J].Journal of Bioscience and Bioengineering, 2009, 108(3):184-189.
[22] ZHANG L, CHOU C P, MOO-YOUNG M.Disulfide bond formation and its impact on the biological activity and stability of recombinant therapeutic proteins produced by Escherichia coli expression system[J].Biotechnology Advances, 2011, 29(6):923-929.
[23] ZHANG Z, TANG R X, ZHU D W, et al.Non-peptide guided auto-secretion of recombinant proteins by super-folder green fluorescent protein in Escherichia coli[J].Scientific Reports, 2017, 7(1):6990.
[24] KIPRIYANOV S M, MOLDENHAUER G, LITTLE M.High level production of soluble single chain antibodies in small-scale Escherichia coli cultures[J].Journal of Immunological Methods, 1997, 200(1-2):69-77.
[25] ARISTIDOU A A, YU P, SAN K-Y.Effects of glycine supplement on protein production and release in recombinant Escherichia coli[J].Biotechnology Letters, 1993, 15(4):331-336.
[26] SIMMONS L C, YANSURA D G.Translational level is a critical factor for the secretion of heterologous proteins in Escherichia coli[J].Nature Biotechnology, 1996, 14(5):629-634.