熊果苷是一种广泛存在于熊果叶、虎耳草和越橘叶等植物组织中的天然产物[1],具有抑制黑色素形成的功效,因此常应用于美容领域[2]。熊果苷分为α-熊果苷和β-熊果苷,其中α-熊果苷的美白[3]、淡化色斑[4-5]、保湿和抗衰老功效显著优于β-熊果苷。α-熊果苷通过抑制酪氨酸酶活性减少黑色素生成,从而改善肤色不均和减少色斑。同时,α-熊果苷的保湿性质有助于维持皮肤水分。此外,其还具有抗衰老的特性,通过减少自由基生成提供皮肤抗氧化保护[6],延缓皮肤老化。这些美容功效使得α-熊果苷成为护肤品中不可或缺的主要活性成分之一。最新研究表明,α-熊果苷还具有抗炎和抗癌作用[7],进一步扩大了α-熊果苷的应用范围。因此,α-熊果苷满足现代美容需求,有望为未来的护肤产品和美容治疗提供更多可能性。
当前,α-熊果苷的工业生产主要通过微生物发酵以及酶催化合成2种方法实现[8]。其中,微生物发酵法需要依托产α-熊果苷的天然或人工微生物细胞工厂,其主要是通过代谢工程和合成生物学或诱变等技术重构微生物体内的代谢途径,从而实现由葡萄糖等廉价碳源合成α-熊果苷的目标。LIU等[9]的研究采用紫外诱变,筛选了一株具有高α-异位选择性糖基化活性的嗜麦芽黄单胞菌BT-112,优化发酵条件后,α-熊果苷的产量达到30.6 g/L,转化率为93.6%。相较于天然产α-熊果苷的菌株,以模式微生物为底盘细胞,经过代谢工程改造强化α-熊果苷的合成也备受关注。SHANG等[10]在解脂耶氏酵母中强化了莽草酸合成途径,同时过表达了分支酸丙酮酸裂解酶、对羟基苯甲酸1-羟化酶和氢醌葡萄糖苷转移酶,最终以葡萄糖为碳源的α-熊果苷产量达到8.6 g/L。此外,在以绿针假单胞菌P3位底盘细胞,WANG等[11]利用了相似的代谢途径改造方法,以葡萄糖为碳源的α-熊果苷产量达到6.79 g/L。然而,由于以葡萄糖为碳源利用微生物发酵合成α-熊果苷的产量较低,导致其难以实现工业化生产。相较于微生物发酵法,酶催化合成法通过使用糖基转移酶作为催化剂,将葡萄糖基转移至对苯二酚(hydroquinone,HQ)来生产α-熊果苷,这一过程更加简单[12]。MATHEW等[13]利用环糊精葡聚糖转移酶(CGTase)催化转糖基化反应,以对苯二酚和麦芽糖糊精为受体,合成α-熊果苷,摩尔转化率达到30%。酶催化法在生产α-熊果苷时需要对大量的酶进行表达和纯化,且在几轮反应后酶活力会显著下降,这不仅使得生产过程复杂,且增加了生产成本。与此相对,全细胞或固定化细胞催化技术在生产α-熊果苷时,避免了纯化酶的步骤,细胞提供稳定的反应环境,使催化次数增多,简化了反应过程,显示出更多的优势和前景。
近期,AGARWAL等[14]从温泉宏基因组中发现的新型支链淀粉酶As-met具有催化合成α-熊果苷的应用潜力。通过携带As-met的全细胞催化,24 h内对苯二酚向α-熊果苷的最大转化率可达70%。国内科研人员AO等[15]采用了厌氧工艺,在枯草芽孢杆菌中敲除lytC、sdpC和skfA基因,从而增强了细胞对高浓度对苯二酚的耐受性,通过全细胞催化最终获得了129.6 g/L的α-熊果苷产量。尽管如此,目前α-熊果苷的产量仍难以满足市场的快速增长需求,当前急需建立高效的α-熊果苷生产方法,进一步提高产量。
本研究将肠膜明串珠菌(Leuconostoc mesenteroides) ATCC 12291的蔗糖磷酸化酶基因导入大肠杆菌,构建了一种可转化对苯二酚和蔗糖产α-熊果苷的工程菌株(图1-a)。以此为基础,建立并优化了全细胞催化和固定化细胞催化合成α-熊果苷的方法,显著提高了α-熊果苷的产量。在最佳反应条件下α-熊果苷产量达到323.9 g/L。此外,该催化过程的简便性、生产成本低、原料易得、反应条件温和、易于控制、产物纯度高、生产效率高等一系列优势,也有助于推动α-熊果苷的工业化生产。
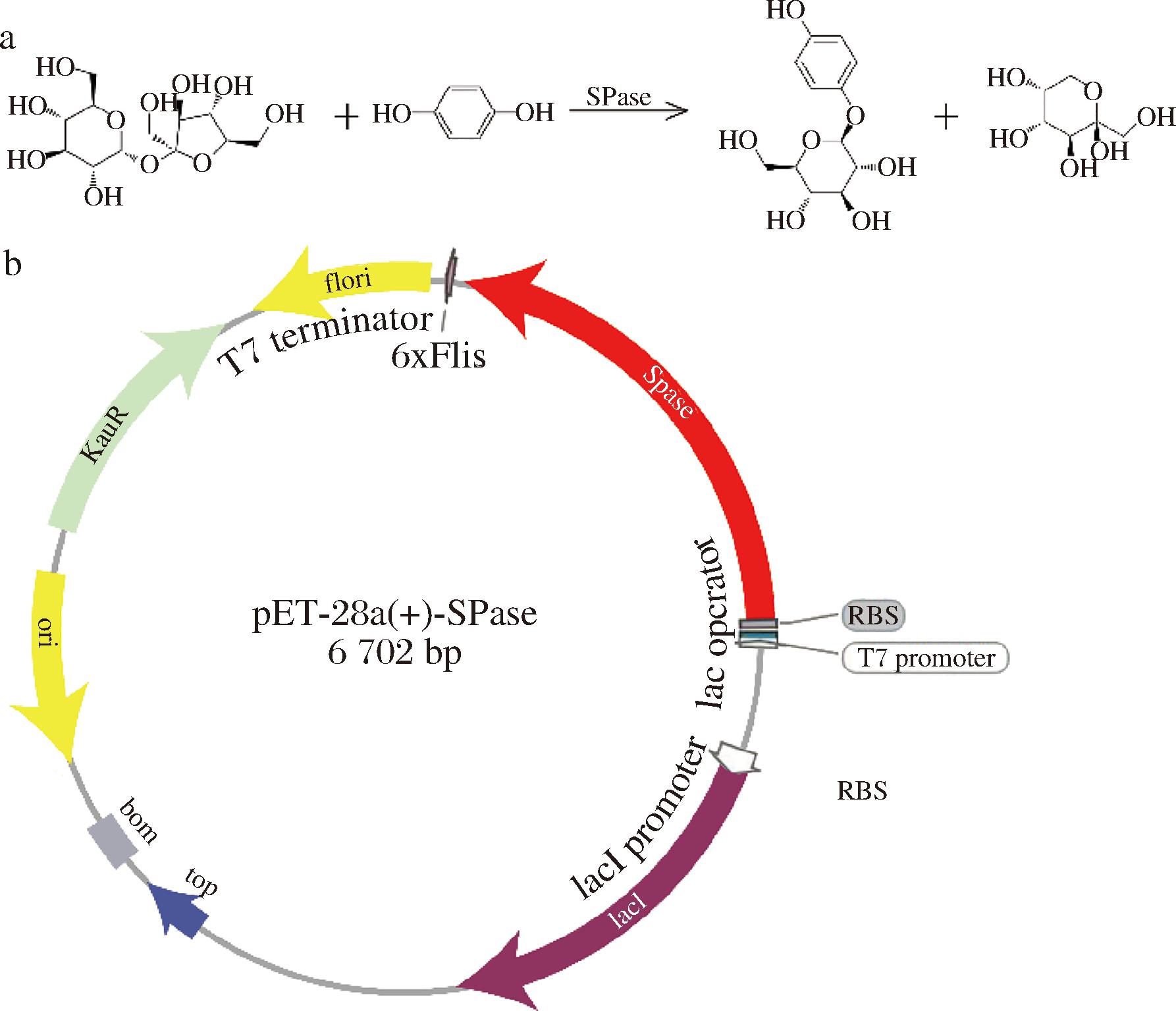
a-SPase催化蔗糖和HQ产α-熊果苷的反应; b-用于编码SPase的pET-28a质粒
图1 SPase催化反应式和质粒图
Fig.1 SPase catalytic reaction and plasmid diagram
1 材料与方法
1.1 材料与试剂
1.1.1 菌种和质粒
本研究所用宿主是大肠杆菌BL21 (DE3)。表达质粒为pET-28a(图1-b),其中spase基因由苏州金唯智生物科技有限公司合成并克隆到pET-28a载体的Xba I和Xho I位点之间,用于编码蔗糖磷酸化酶(sucrose phosphorylase,SPase)。
1.1.2 实验试剂
蔗糖、HQ、咪唑,国药集团化学试剂有限公司;α-熊果苷,上海阿拉丁生化科技股份有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG),上海麦克林生化科技有限公司;硫酸卡那霉素、改良型Bradford蛋白浓度测定试剂盒,生工生物工程 (上海)股份有限公司;DNS显色液,福州飞净生物科技有限公司。
1.1.3 培养基
LB培养基(g/L):酵母提取物5,蛋白胨10,氯化钠10。
TB培养基(g/L):酵母提取物24,蛋白胨12,甘油4 mL/L,磷酸二氢钾2.31,三水合磷酸氢二钾16.43。
2种培养基均需在121 ℃下灭菌20 min。
1.2 仪器与设备
UV-2450紫外可见分光光度计,日本Shimadzu公司;SYNERGY H1多功能酶标仪,美国Bio-Tek有限公司;1260 Infinity II高效液相色谱,美国安捷伦有限公司;ST-16R高速冷冻离心机,赛默飞世尔科技(中国)有限公司;HYL-C3恒温培养箱,太仓市强乐实验设备有限公司。
1.3 实验方法
1.3.1 检测方法
1.3.1.1 OD600值、α-熊果苷和对苯二酚测定
将发酵液用超纯水稀释至适宜的浓度后,利用分光光度计在600 nm波长处测定菌体的光学密度(OD600值),以评估菌体的浓度。取1 mL发酵液,12 000 r/min离心10 min后取上清液过滤膜(0.22 μm)。过滤后的上清液经过HPLC,对HQ和α-熊果苷的质量浓度进行检测[16]。检测使用紫外检测器,流动相由95%水和5%甲醇组成,含有0.1%(体积分数)乙酸。色谱条件设置为:检测波长282 nm、进样量10 μL、柱温30 ℃、流速0.5 mL/min。
1.3.1.2 蔗糖磷酸化酶活力测定
重组蔗糖磷酸化酶的N端带有His标签,因此本研究采用镍亲和层析柱进行蛋白纯化[17]。纯化过程中,首先将发酵液在4 ℃、12 000 r/min条件下离心10 min,以收集细胞。接着,使用超声破碎仪进行细胞破碎,离心后取上清液通过0.22 μm的滤膜过滤,去除菌体碎片。随后,使用不同浓度的咪唑(100~500 mmol/L)作为洗脱液,对蔗糖磷酸化酶进行梯度洗脱。最后,通过脱盐柱移除多余的咪唑,得到浓缩的酶液。蛋白质的浓度使用Bradford法进行测定[18]。蔗糖磷酸化酶的酶活性采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid, DNS)法测定[19]。酶活力定义:在50 ℃反应条件下,1 min内酶水解蔗糖产生1 μmol的果糖所需要的酶量定义为1个酶活力单位(U)。
1.3.2 蔗糖磷酸化酶诱导表达条件的优化
首先,将重组菌株接种到含100 μg/mL卡那霉素的LB固体培养基上进行划线培养。经过一夜培养后,从中挑选单菌落接种到含50 μg/mL卡那霉素的LB液体培养基中,在37 ℃和250 r/min的条件下过夜培养。随后,将这些菌液以1%的接种量转移到含有相同浓度卡那霉素的TB液体培养基中,并继续在37 ℃和250 r/min的条件下培养至菌液的OD600值达到0.6。此时,向培养基中加入终浓度为0.5 mmol/L的IPTG作为诱导剂,并在37 ℃、250 r/min的条件下继续培养24 h以诱导目标蛋白的表达。诱导完成后收集菌液测量OD600值。为了进行后续的酶活力测定和蛋白质分析,收集的菌液首先被稀释至OD600值为2,然后通过超声波破碎处理直至澄清。最后,这些处理过的样品用于SDS-PAGE分析,以便比较和分析目标蛋白的表达量。
优化最佳产酶温度时设置了不同的诱导温度,包括20、25、30、37 ℃。不同培养基对蔗糖磷酸化酶表达的影响方面,比较了TB培养基、LB培养基、SOB培养基和MOPS培养基对产酶效率的影响。此外,IPTG的诱导终浓度设置为0.05、0.1、0.5、1.0、1.5 mmol/L,诱导OD600值设置为0.6、0.9、1.2和1.6;种子液接种量优化条件设置为0.5%、1%、1.5%和2%;产酶时间梯度优化设置为10、18、24、34 h。
1.3.3 全细胞催化合成α-熊果苷的条件优化
产酶后的菌液在4 ℃、5 500 r/min条件下离心10 min,从而去除上清液收集细胞。离心完成后,将细胞重新悬浮在PBS中。并调整PBS的量,以使最终溶液体积达到20 mL,并通过分光光度计测量确保OD600值达到20。随后,按照1∶1的摩尔比加入HQ和蔗糖,分别加入0.5 g HQ和1.6 g蔗糖。最后放置在20 mL摇瓶中,在30 ℃和250 r/min的条件下进行全细胞催化24 h。整个过程中,定期取样并通过高效液相色谱监测反应进度和产物的形成。
考虑到催化反应通常依赖特定的温度环境,本研究设定了催化温度梯度(20、25、30、37 ℃)来评估温度对大肠杆菌催化合成α-熊果苷的影响。此外,pH值对酶活力和稳定性有直接影响,进而影响催化反应的效率。因此,设定了不同的缓冲液pH值(6.0、6.5、7.0、7.5),以确定最适pH条件。HQ和蔗糖转化为α-熊果苷是一个可逆过程,且高含量HQ对细胞有害,因此优化了HQ与蔗糖比例(1∶1、1∶2、1∶3、1∶4)。全细胞催化的菌体浓度OD600值梯度设置为(10、20、30、40)。
1.3.4 固定化细胞催化产α-熊果苷的条件优化
在5 500 r/min、4 ℃条件下离心10 min收集细胞,随后称取2 g细胞并与5 mL生理盐水混合均匀。向混合物中加入15 mL海藻酸钠溶液并充分混合,然后将其缓慢滴入3%(质量分数)氯化钙溶液中,静置6 h以形成海藻酸钠包埋体。为制备海藻酸钠-活性炭包埋体,在含2 g细胞的5 mL生理盐水中加入0.5 g活性炭,混合均匀后在4 ℃下静置4 h,以保证均匀分布。随后,将此混合物与15 mL海藻酸钠溶液合并混匀,然后将其缓慢滴入3%氯化钙溶液中,静置6 h以形成海藻酸钠包埋体。为了制备海藻酸钠-壳聚糖包埋体,将已形成的海藻酸钠包埋体转移到pH 5.4的2%壳聚糖溶液中,并在4 ℃下静置30 min,从而在包埋体表面形成壳聚糖层,得到海藻酸钠-壳聚糖包埋体。
利用不同湿重的细胞(1、2、3、4、5 g)制备包埋体,从而优化细胞量;考虑到pH值对固定化细胞催化效率的影响,调控反应缓冲液pH值梯度为(6.0、6.5、7.0、7.5、8.0、8.5)。最后,为了确定最佳HQ浓度,设置不同的HQ质量浓度(25、35、45、55 g/L)进行固定化细胞催化。
2 结果与分析
2.1 蔗糖磷酸化酶的表达优化及酶活力测定
蔗糖磷酸化酶是生产α-熊果苷的核心(图1-a,图1-b),其可溶性表达水平和酶活力与α-熊果苷的产量息息相关[20]。因此,本研究首先聚焦于影响大肠杆菌表达蔗糖磷酸化酶的生长条件进行优化,以期实现最高酶可溶性表达水平、最高酶活力和最高细胞生长OD600值。细胞生长和产酶过程中温度对于酶的表达速率、细胞生长活性和酶的折叠都至关重要[21]。因此,首先考察了不同产酶阶段温度对细胞生长、酶活力和酶表达水平的影响。根据SDS-PAGE胶图灰度值,利用软件ImageJ计算蔗糖磷酸化酶的表达水平,结果表明(图1-a)在IPTG诱导后的产酶阶段,细胞培养维持在20 ℃时,蔗糖磷酸化酶的表达水平、酶活力和最终OD600值均处于最高水平,分别是37 ℃培养时的2.8、2.2、1.5倍,随着产酶阶段培养温度的提高酶活力、酶表达水平和细胞生长逐渐降低。除温度外,大肠杆菌在不同的培养基中生长状态和产酶能力显著不同,因此对比了不同培养基对细胞生长和蔗糖磷酸化酶表达的影响。通过对比菌株在LB、SOB、MOPS和TB培养基中的细胞生长状态、蔗糖磷酸化酶的表达水平和酶活力(图2-b),发现TB培养基是细胞生长和表达蔗糖磷酸化酶的最适培养基。在TB培养基中的细胞生长状态、蔗糖磷酸化酶的表达水平和酶活力分别达到了LB培养基中的1.7、1.3、1.3倍。接种量直接影响细胞在培养基中的生长周期,以及细胞在产酶阶段的细胞活性。因此在0.5%~2%范围内优化了接种量(图2-c),发现以2%的种子液作为接种量时细胞生长OD600值、蔗糖磷酸化酶的表达水平和酶活力均处于最高状态。对比全细胞和细胞破碎上清液中的蔗糖磷酸化酶含量,发现所表达的蛋白95%以上都是可溶性蛋白。然而,在37 ℃的高温培养条件和TB丰富培养基中分别有33.7%和15.1%在包涵体中,表明高温培养和快速的细胞生长不利于可溶性蔗糖磷酸化酶的表达。
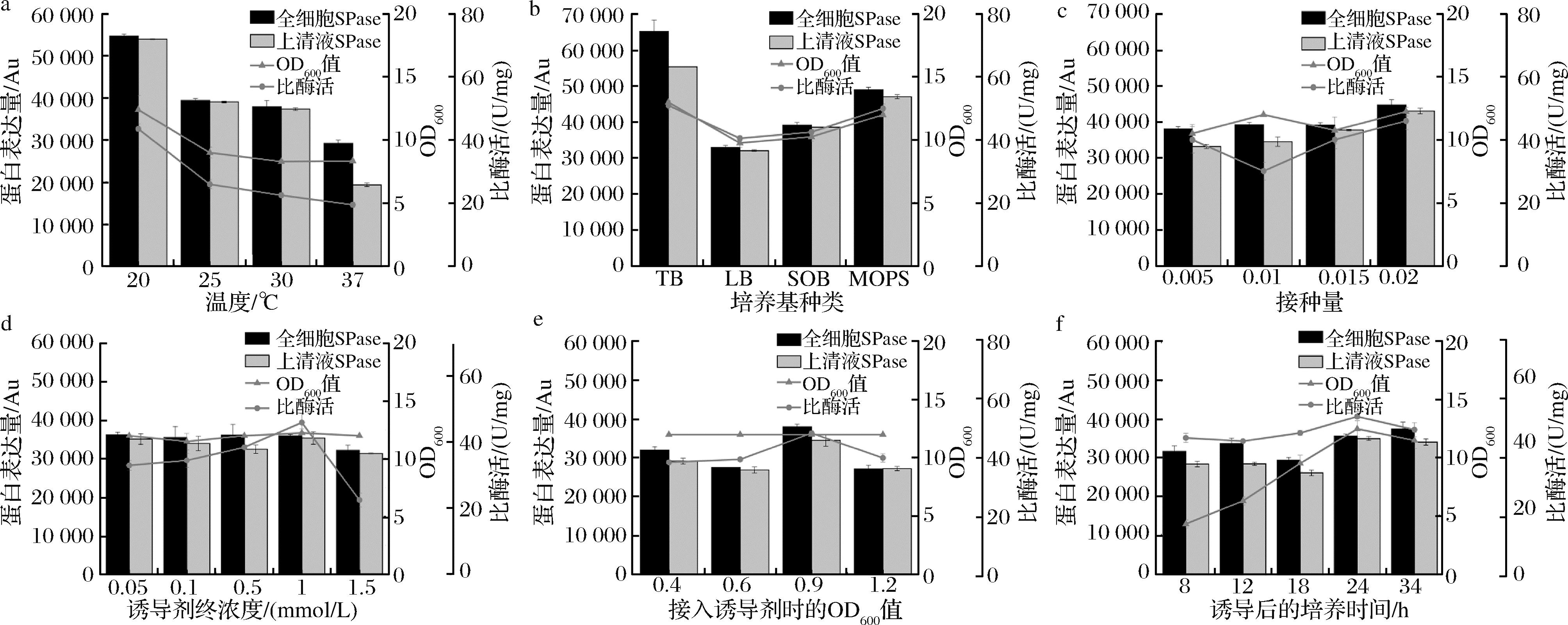
a-产酶温度优化;b-培养基种类优化;c-诱导剂终浓度优化;d-接入诱导剂时的OD600优化;e-接种量优化;f-诱导后的培养时间优化
图2 蔗糖磷酸化酶的产酶条件和诱导表达条件优化
Fig.2 Optimization of production and induction conditions for sucrose phosphorylase
除了温度、接种量和培养基影响菌株产酶和成长外,诱导条件也直接影响菌株的产酶效果[22]。因此本研究针对诱导剂浓度、诱导OD600值和诱导产酶时长进行了系统优化。发现(图2-d、图2-e)添加终浓度为1 mmol/L IPTG在OD600值为0.9时诱导细胞产酶,诱导时长为24 h的条件下细胞生长、产酶量和产酶活性均达到最优状态。研究发现,IPTG浓度对酶的表达水平和细胞生长影响不明显,但是对酶活力影响显著。当IPTG诱导浓度高于1 mmol/L时酶活力显著下降,这可能是由于酶的表达折叠速率过快,从而影响了正确的构象,最终使酶活力降低。诱导时间对细胞生长最终OD600值的影响显著(图2-f),在培养24 h内,随着时间的延长最终OD600值迅速增加,最高达到12.5,在此期间酶表达水平和酶活力也相应增加。而培养时间超过24 h后最终OD600值并未增加,说明诱导产酶24 h是最佳的产酶时间。
综上所述,经过系统的产酶条件优化确定了影响蔗糖磷酸化酶在大肠杆菌中表达的关键因素,包括温度、培养基类型、IPTG浓度、接种时菌体密度、接种量以及诱导后的培养时间。通过这些单因素优化研究发现在20 ℃、使用TB培养基、1 mmol/L IPTG诱导、OD600值为0.9的接种条件、2%的接种量以及诱导后继续培养24 h的情况下,细胞生长状态、蔗糖磷酸化酶的表达水平及活力达到最高。
2.2 全细胞催化合成α-熊果苷的条件优化
为了提高α-熊果苷的产量和生产效率,探究了多种因素对其产量及转化率的影响,包括不同pH条件、供受体比例、温度、菌体浓度和催化时间。研究发现[23],酶作为生物催化剂,在一定的pH范围内展现出最优活性,因为pH值能显著影响酶的结构和电荷状态,进而影响酶与底物的结合亲和力以及催化反应速率。研究结果显示(图3-a),在pH值为7.0的缓冲液条件下,α-熊果苷的产量和转化率分别达到最高,为13.6 g/L和22.1%。比pH值为6.5时,产量和转化率分别提高了3.5 g/L和4.9%。这表明,中性环境是全细胞催化过程中最佳的条件,且合成α-熊果苷过程中涉及的酶对pH值敏感。
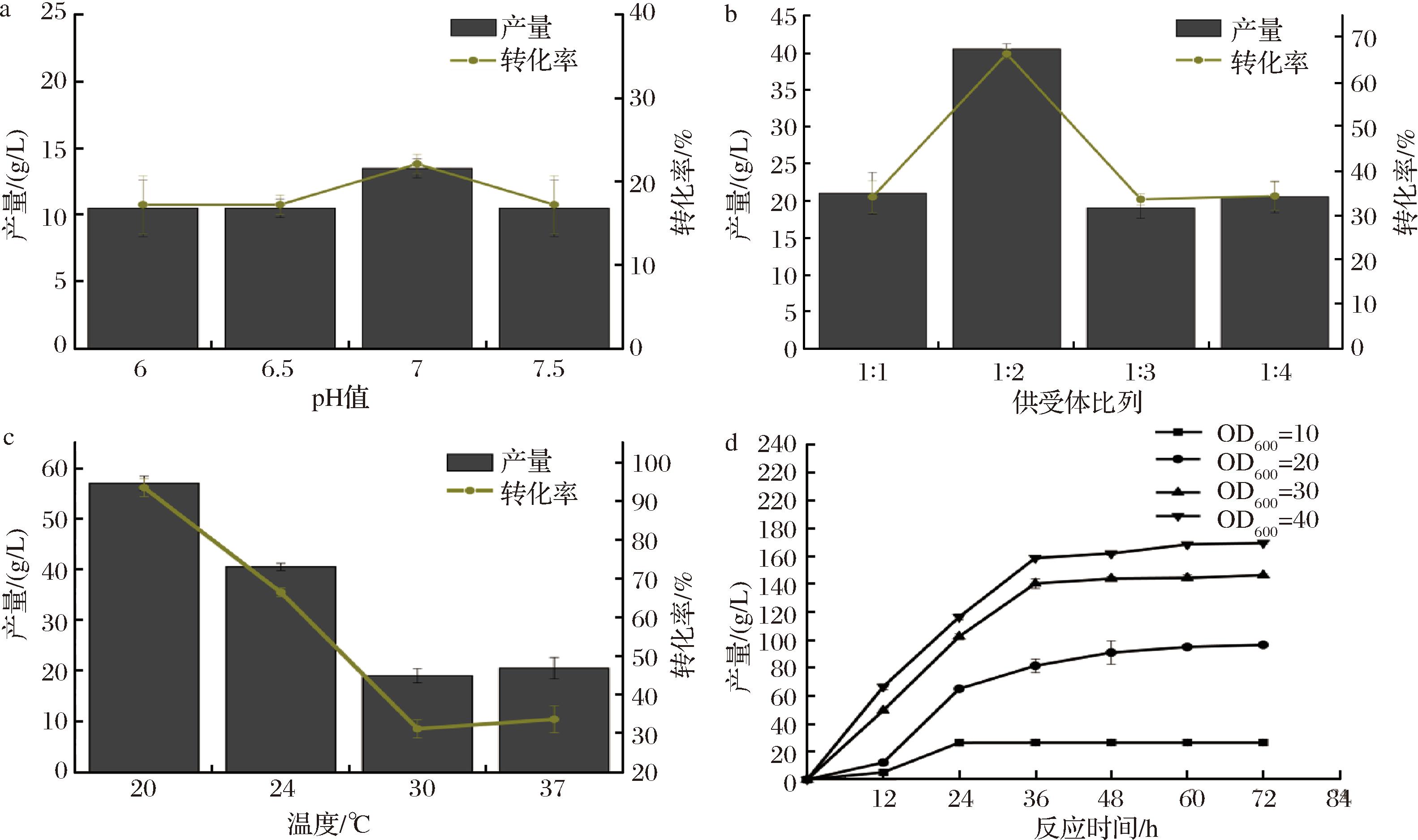
a-全细胞催化的pH条件优化;b-全细胞催化的供受体比例优化;c-全细胞催化的温度优化;d-全细胞催化的细胞浓度和反应时间
图3 全细胞催化合成α-熊果苷的反应条件优化
Fig.3 Optimization the whole cell catalyzation conditions for α-arbutin biosynthesis
蔗糖磷酸化酶催化蔗糖和HQ产α-熊果苷的反应是可逆反应[24],调整供受体比例有助于推动反应向产物方向进行,提高α-熊果苷的产量。结果表明(图3-b)当蔗糖与HQ的摩尔比达到2∶1,达到最高的转化率67%,此时产物的质量浓度达到了40.5 g/L。这表明,适当调整供受体比可以有效控制反应的平衡点,最大化产物的产量。此外,在工业生产过程中,能源消耗是一个重要的成本因素。优化反应温度不仅可以提高反应效率和产物转化率,还可以减少能源消耗,实现更高的经济效益。本研究发现(图3-c)在20 ℃的条件下进行反应时,α-熊果苷的转化率得到显著提升,达到93.4%,相应的产物质量浓度增至57.0 g/L。比起在37 ℃条件下,产量提高36.7 g/L,产率提高59.8%。低温可能有助于维持酶的正确折叠状态,进而保持其活性。
高菌体浓度意味着有更多的细胞可参与反应,进而提供更多的酶来催化该反应。这样可以直接提高反应的速率和效率,因为更多的催化剂有助于更快地将底物转换成目标产物,而且还能通过合理调控菌体浓度来分散全细胞催化反应对宿主细胞造成的代谢负担。此外,高浓度的底物可能对细胞造成额外负担,而且特定底物(如HQ)对细胞具有毒性。为了保持反应的连续性和效率,实验采取了每12 h进行1次细胞清洗和底物重新添加的方法。这种操作旨在确保细胞的活性和反应的持续进行,同时减轻由于高浓度底物和毒性物质累积导致的负面影响。研究结果(图3-d)进一步证明了提高菌体浓度的有效性。当菌体浓度(OD600值)达到40,并在循环催化36 h后,α-熊果苷的产量增加至158.8 g/L,转化率达到86.8%。比起菌体浓度(OD600值)为10时,产量提高132.1 g/L,产率提高72.2%。然而,36 h之后产量的增长放缓,这表明经过一段时间后,细胞活性开始下降,无法继续大量生产α-熊果苷。
总之,本研究通过考察不同pH条件、供受体比例、温度、菌体浓度和催化时间对α-熊果苷的产量及转化率的影响,揭示了酶在特定pH值(7.0)下活性最高,且优化蔗糖与HQ的比例至2∶1显著提升了产物转化率至67%。在20 ℃下进行反应能有效提高转化率至93.4%。高菌体浓度通过提供更多催化剂加快反应速率,同时,每12 h进行1次细胞清洗和底物添加以保持细胞活性。综合这些策略,α-熊果苷的产量显著提升至158.8 g/L,转化率达86.8%,展现了通过系统优化反应条件提高生产效率和经济效益的可能。
2.3 包埋体固定化细胞
为进一步增加全细胞催化的反应次数,可以通过固定化技术处理全细胞,利用固定化载体的保护作用来增加反应细胞的完整性。首先评估了3种不同的包埋材料对固定化大肠杆菌在α-熊果苷生产中的影响。选择的材料包括海藻酸钠、海藻酸钠-活性炭复合材料,以及海藻酸钠-壳聚糖复合材料。通过比较这些固定化细胞在循环催化过程中的表现,本研究发现海藻酸钠-活性炭复合材料因其提供的物理保护,能够增强细胞的稳定性和催化效率,从而在连续催化过程中显示出最佳性能。在进行了14次循环催化后,使用该复合材料固定化的细胞产量高达244.9 g/L,显著优于其他比较组(图4-a)。随后,探究了不同包埋细胞量对催化效率的影响。优化包埋细胞的量有助于在固定化颗粒内实现最高的活性细胞密度,同时确保营养物质和底物的传输能力不受影响。实验设置了1~5 g的不同包埋细胞量,结果表明(图4-b)当包埋量为4 g时,单次反应产量和转化率最高分别为36.5 g/L和59.8%,表明在此条件下细胞的活性和底物的可用性达到了最佳平衡。
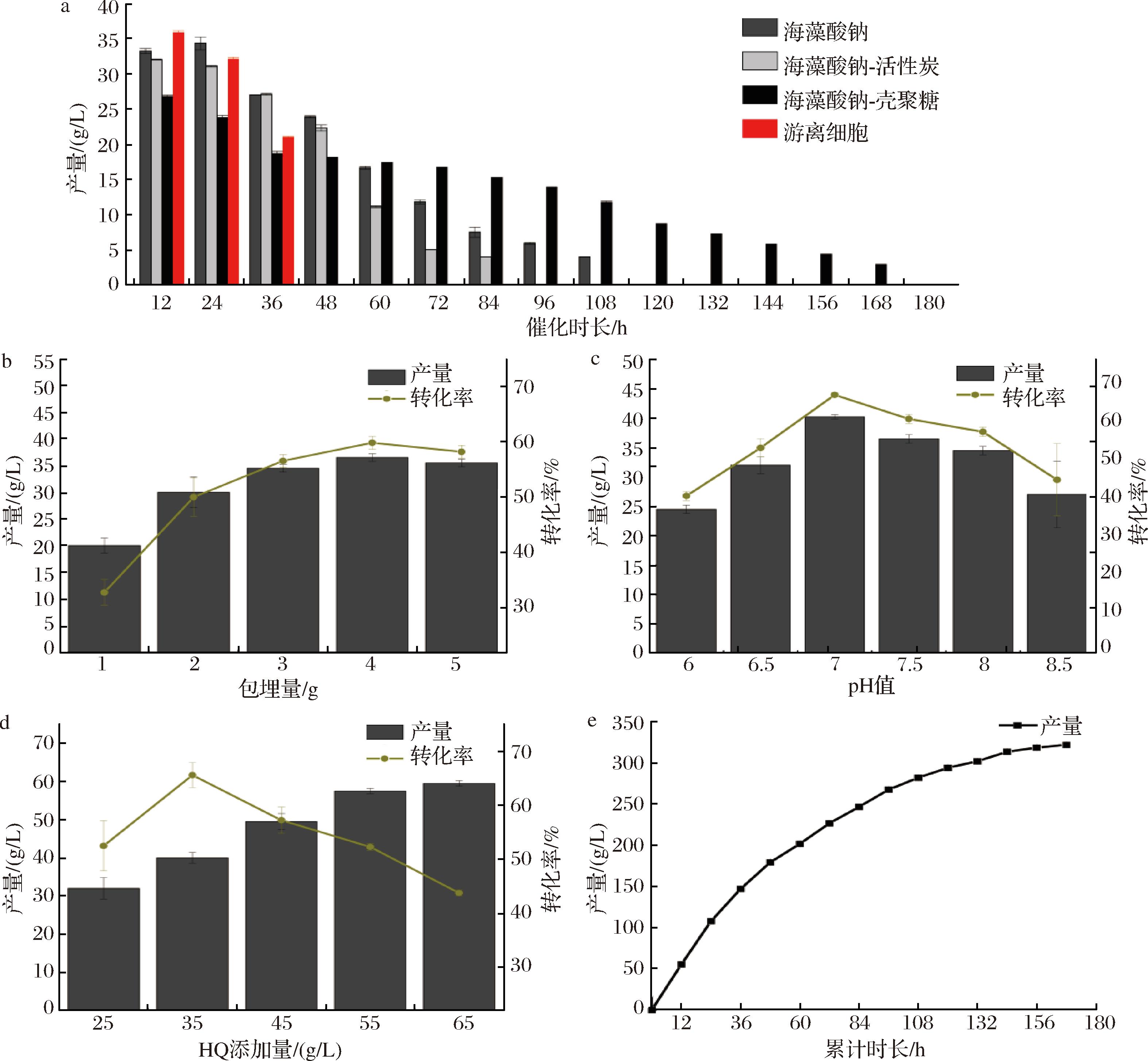
a-包埋材料;b-包埋量;c-pH;d-HQ添加量;e-累计产量
图4 固定化细胞催化产α-熊果苷的条件优化
Fig.4 Optimization of conditions for immobilized cell-catalyzed production of α-arbutin
固定化细胞所处环境中的pH值显著影响细胞的完整性和酶的构象与活力,以及底物的溶解度和反应速率。本研究发现(图4-c)在pH 7.0的条件下,单次催化反应的产量和转化率达到最高,分别为40.3 g/L和66.0%。这可能是因为此pH值接近大部分细胞内酶的最适pH,从而促进了高效的底物转化。此外,根据酶动力学原理,提高底物浓度到一定程度可以增加反应速率,直至达到酶的饱和点。因此,为了确定最佳的HQ浓度,优化了HQ添加量,发现当HQ质量浓度为55 g/L时,单次催化产量达到57.5 g/L,相较于45 g/L的HQ质量浓度,这一条件下的产量增加了8.1 g/L(图4-d)。表明在该浓度下酶的活性得到了充分利用,同时避免了过高的底物浓度可能导致的抑制效应。
综上所述,通过综合考量包埋材料的特性、最优包埋细胞量、pH值的优化以及底物浓度的优化,本研究建立了一套高效的固定化细胞催化系统。该系统利用海藻酸钠-活性炭复合材料,并以4 g的最佳包埋细胞量,pH值控制在7.0,以及55 g/L的HQ质量浓度,实现了高效的催化反应。在最佳条件下进行实验(图3-e),在14次催化循环后总产量累计达到323.9 g/L,展现了该方法在提高α-熊果苷产量和可持续性方面的潜力。
3 结论
α-熊果苷凭借其在美白、消炎及抗氧化等方面的显著效能,在医药保健、食品及化妆品领域获得了广泛应用。本研究致力于通过全细胞催化技术提升α-熊果苷的产量,对产酶条件、全细胞催化条件以及固定化细胞催化条件进行了全面的优化,旨在建立一个高效的α-熊果苷生产体系。经优化,最佳的诱导产酶条件为:诱导温度20 ℃、使用TB培养基、1 mmol/L IPTG诱导、接种密度OD600值为0.9、2%的接种量以及诱导后续培养24 h。而最优的全细胞催化条件为:缓冲液pH值7.0、蔗糖与HQ比例为2∶1、催化温度20 ℃、细胞浓度OD600值为40,且在这些条件下进行12 h的循环反应3次。此外,选用海藻酸钠-活性炭复合材料作为固定化细胞载体,以4 g为最佳包埋细胞量,pH值维持在7.0,以及55 g/L的HQ质量浓度,构成了最优的固定化细胞催化条件。经过这一系列的优化,全细胞催化和固定化细胞催化所产α-熊果苷的总量分别达到158.8 g/L和323.9 g/L。本研究不仅深化了对蔗糖磷酸化酶的表达和α-熊果苷的生产工艺的理解,而且为α-熊果苷的规模化生产提供了实用的技术参考。这对于优化α-熊果苷生产流程的经济性与可持续性、减少生产成本并简化产品纯化步骤,具有重要的实践意义,有助于满足市场对α-熊果苷不断增长的需求。
[1] ROH J S, HAN J Y, KIM J H, et al.Inhibitory effects of active compounds isolated from safflower (Carthamus tinctorius L.) seeds for melanogenesis[J].Biological &Pharmaceutical Bulletin, 2004, 27(12):1976-1978.
[2] PARVEZ S, KANG M, CHUNG H S, et al.Survey and mechanism of skin depigmenting and lightening agents[J].Phytotherapy Research: PTR, 2006, 20(11):921-934.
[3] BANG S H, HAN S J, KIM D H.Hydrolysis of arbutin to hydroquinone by human skin bacteria and its effect on antioxidant activity[J].Journal of Cosmetic Dermatology, 2008, 7(3):189-193.
[4] MAEDA K, FUKUDA M.Arbutin:Mechanism of its depigmenting action in human melanocyte culture[J].The Journal of Pharmacology and Experimental Therapeutics, 1996, 276(2):765-769.
[5] CALLENDER V D, ST SURIN-LORD S, DAVIS E C, et al.Postinflammatory hyperpigmentation:Etiologic and therapeutic considerations[J].American Journal of Clinical Dermatology, 2011, 12(2):87-99.
[6] MPHAHLELE R R, FAWOLE O A, MAKUNGA N P, et al.Effect of drying on the bioactive compounds, antioxidant, antibacterial and antityrosinase activities of pomegranate peel[J].Bmc Complementary and Alternative Medicine, 2016, 16:143.
[7] SAEEDI M, KHEZRI K, SEYED ZAKARYAEI A, et al.A comprehensive review of the therapeutic potential of α-arbutin[J].Phytotherapy Research: PTR, 2021, 35(8):4136-4154.
[8] ZHU X T, TIAN Y Q, ZHANG W L, et al.Recent progress on biological production of α-arbutin[J].Applied Microbiology and Biotechnology, 2018, 102(19):8145-8152.
[9] LIU C Q, DENG L, ZHANG P, et al.Screening of high α-arbutin producing strains and production of α-arbutin by fermentation[J].World Journal of Microbiology &Biotechnology, 2013, 29(8):1391-1398.
[10] SHANG Y Z, WEI W P, ZHANG P, et al.Engineering Yarrowia lipolytica for enhanced production of arbutin[J].Journal of Agricultural and Food Chemistry, 2020, 68(5):1364-1372.
[11] WANG S W, FU C, BILAL M, et al.Enhanced biosynthesis of arbutin by engineering shikimate pathway in Pseudomonas chlororaphis P3[J].Microbial Cell Factories, 2018, 17(1):174.
[12] YU S H, WANG Y C, TIAN Y Q, et al.Highly efficient biosynthesis of α-arbutin from hydroquinone by an amylosucrase from Cellulomonas carboniz[J].Process Biochemistry, 2018, 68:93-99.
[13] MATHEW S, ADLERCREUTZ P.Regioselective glycosylation of hydroquinone to α-arbutin by cyclodextrin glucanotransferase from Thermoanaerobacter sp[J].Biochemical Engineering Journal, 2013, 79:187-193.
[14] AGARWAL N, RAI A K, SINGH S P.Biotransformation of hydroquinone into α-arbutin by transglucosylation activity of a metagenomic amylosucrase[J].3 Biotech, 2021, 11(8):362.
[15] AO J W, PAN X W, WANG Q, et al.Efficient whole-cell biotransformation for α-arbutin production through the engineering of sucrose phosphorylase combined with engineered cell modification[J].Journal of Agricultural and Food Chemistry, 2023, 71(5):2438-2445.
[16] WANG Y H, AVONTO C, AVULA B, et al.Quantitative determination of α-arbutin, β-arbutin, kojic acid, nicotinamide, hydroquinone, resorcinol, 4-methoxyphenol, 4-ethoxyphenol, and ascorbic acid from skin whitening products by HPLC-UV[J].Journal of AOAC International, 2015, 98(1):5-12.
[17] FRANCEUS J, DESMET T.Sucrose phosphorylase and related enzymes in glycoside hydrolase family 13:Discovery, application and engineering[J].International Journal of Molecular Sciences, 2020, 21(7):2526.
[18] KASPEROWICZ A, STAN-GLASEK K, GUCZYNSKA W, et al.β-Fructofuranosidase and sucrose phosphorylase of rumen bacterium Pseudobutyrivibrio ruminis strain 3[J].World Journal of Microbiology &Biotechnology, 2012, 28(3):1271-1279.
[19] CHOI H C, SEO D H, JUNG J H, et al.Development of new assay for sucrose phosphorylase and its application to the characterization of Bifidobacterium longum SJ32 sucrose phosphorylase[J].Food Science and Biotechnology, 2011, 20(2):513-518.
[20] ZHOU X, ZHENG Y T, WEI X M, et al.Sucrose isomerase and its mutants from Erwinia rhapontici can synthesise α-arbutin[J].Protein and Peptide Letters, 2011, 18(10):1028-1034.
[21] CERDOBBEL A, DE WINTER K, DESMET T, et al.Sucrose phosphorylase as cross-linked enzyme aggregate:Improved thermal stability for industrial applications[J].Biotechnology Journal, 2010, 5(11):1192-1197.
[22] KOGURE M, MORI H, ARIKI H, et al.Determination of sucrose using sucrose phosphorylase in a flow-injection system[J].Analytica Chimica Acta, 1997, 337(1):107-111.
[23] YANG C Y, FAN W M, ZHANG R J, et al.Study on transglucosylation properties of amylosucrase from Xanthomonas campestris pv.Campestris and its application in the production of α-arbutin[J].Catalysts, 2018, 9(1):5.
[24] NOMURA K, SUGIMOTO K, NISHIURA H, et al.Glucosylation of acetic acid by sucrose phosphorylase[J].Bioscience, Biotechnology, and Biochemistry, 2008, 72(1):82-87.