糖肽/蛋白是由寡糖-肽或寡糖-蛋白质分子组成的复合物,其中肽链/蛋白与寡糖链共价键合。糖肽来源广泛,且具有抗炎、抗氧化、抗肿瘤等多种生物学活性[1]。如从牛奶κ-酪蛋白中提取的富含唾液酸的糖巨肽(glycomacropeptide,GMP)能对已激活的人巨噬细胞发挥抗炎和抗氧化作用[2];LUO等[3]从灵芝子实体中分离得到水溶性糖肽(GL-PWQ3)在NRK-52E细胞中表现出很强的抗氧化活性。但从乳酸菌发酵液中有关于糖肽的提取及其结构和功能的研究相对较少。
蛋白质糖基化作为细胞中最普遍和重要的翻译后修饰之一,它对蛋白质/肽的活性、构象、折叠、热力学性质、生物学功能具有重要的作用,对于不同的糖肽/蛋白来说,这些作用是不一致的[4]。YANG等[5]使用PNGase F酶有效去除了大豆7S球蛋白的聚糖部分,显著改变了蛋白质结构,并降低了其潜在的过敏性。KAR等[6]研究发现N-连接聚糖的去除影响了PRGH1酶的构象,但未显著影响酶的功能。向媛嫄等[7]使用β-消除法去除了澳洲坚果糖肽的O-糖链后,发现其热稳定性和抗氧化活性都有所降低。因此,阐明糖基化对糖肽的结构和生物活性的影响不仅能够深入了解其构效关系,而且对于充分利用自然资源也具有重要意义。
本文采用的菌株屎肠球菌(Enterococcus faecium)AS8分离自内蒙古自治区锡林郭勒盟地区的传统发酵奶油制品,此菌株及其发酵产物具有一定的抗氧化能力及免疫功能特性[8-9]。β-消除是化学释放O-糖链常用的方法之一,相对使用酶法去除O-糖链,β-消除法在大批量处理样品和降低使用试剂的成本等方面更具有优势,而且β-消除后也能够保持蛋白和肽骨架的完整性[10]。故本实验采用β-消除法对AS8乳发酵液中纯化的糖肽进行了去O-糖基化,对比分析了去糖基化前后AS8糖肽的二级结构、三级结构、微观结构,以及热稳定性和抗氧化活性的变化,为深入了解糖基化对糖肽结构和生物活性的作用以及对天然糖肽资源的开发利用提供一定的研究基础。
1 材料与方法
1.1 材料与方法
1.1.1 材料与试剂
Enterococcus faecium AS8,实验室从内蒙古锡林郭勒盟传统发酵乳制品中分离获得;脱脂乳粉,丹麦Arla Foods乳品公司;Sephadex G-100、Sephadex G-50 MEDIUM,美国GE公司;SDS-PAGE凝胶制备试剂盒,北京酷来搏科技有限公司;4×蛋白上样缓冲液、彩虹180广谱蛋白Marker、透析袋MD34、考马斯亮蓝R250,北京索莱宝科技有限公司;DPPH、ABTS,上海麦克林生化科技股份有限公司;硫酸铵、溴化钾、水杨酸,天津汇杭化工科技有限公司。
1.2 仪器与设备
LGJ-25C/25E型冷冻干燥机,四环福瑞科仪科技发展有限公司;SYNERGY H1多功能微孔板检测仪,美国伯腾仪器有限公司;TM4 000扫描电镜,日立高新技术那珂事业所;DSC-Q20差式扫描量热分析仪,美国TA仪器公司;FL970Plus荧光分光光度计,上海天美有限公司;IRSpirit-T傅里叶变换红外光谱仪,日本岛津公司。
1.3 实验方法
1.3.1 菌株发酵乳上清液的制备
将-80 ℃贮存的AS8乳酸菌活化3代后,菌液浓度调节至108 CFU/mL,以4%的接种量于灭菌脱脂乳培养基中培养,培养温度37 ℃,发酵至发酵终点(pH 4.6)。经过离心(8 000 r/min,10 min,4 ℃),去掉沉淀,收集到的上清液即为菌株的发酵乳上清液。
1.3.2 AS8糖肽的提取工艺优化
单因素试验:以粗糖肽提取率为指标,向上清液中加入的硫酸铵溶液调节饱和度分别至40%、50%、60%、70%、80%、90%、100%;硫酸铵溶液体积倍数为1、2、3、4、5;铵沉时间为6、12、18、24、30、36 h进行提取。
响应面优化试验:根据单因素试验的结果,选择硫酸铵体积倍数、硫酸铵饱和度、铵沉时间为自变量,以粗糖肽提取率为响应值,利用Box-Behnken进行响应面优化试验。提取率的计算如公式(1)所示:
提取率![]()
(1)
式中:X、Y,由标准曲线计算出的提取液中多糖和可溶性蛋白的含量,mg/mL;V,提取液的体积,mL;M,同体积发酵液冻干后的质量,mg。
发酵乳上清液中AS8糖肽的提取工艺如下:
发酵乳上清液→旋蒸浓缩→硫酸铵溶液沉淀(4 ℃)→离心(8 000 r/min,10 min,4 ℃)→沉淀复溶→透析12 h(4 ℃)→冷冻干燥
1.3.3 AS8糖肽的纯化
用超纯水配制5 mg/mL的粗糖肽溶液,经0.22 μm一次性水系过滤器过滤后,每次上样1 mL到Sephadex G-100葡聚糖凝胶层析柱进行层析,洗脱液为去离子水,每隔3 min收集1管,使用紫外检测仪在280 nm处测定洗脱液中蛋白峰,苯酚-硫酸法在490 nm处测定糖峰,收集蛋白和糖重叠部分的峰,进行旋蒸浓缩后,取适量样品液到Sephadex G-50葡聚糖凝胶层析柱进行进一步层析,方法同Sephadex G-100葡聚糖凝胶层析,收集糖和蛋白重叠峰,冷冻干燥。
1.3.4 SDS-PAGE凝胶电泳及纯度鉴定
参照李成等[11]的方法,采用15%分离胶和5%浓缩胶的SDS-PAGE凝胶电泳。将30 μL样品(10 mg/mL)加入10 μL上样缓冲液(4×),100 ℃水浴加热3~5 min,冷却离心后上样。样品和标准蛋白Marker(分子质量11~180 kDa),上样量每孔10 μL。电泳条件:浓缩胶电压为60 V,分离胶电压为100 V。电泳结束后,凝胶分别采用考马斯亮蓝法和高碘酸希夫法(periodate Schiff process,PAS)染色,脱色液脱色后拍照分析。
通过高效凝胶渗透色谱(high-performance gel permeationchromatography,HPGPC)测定糖肽纯度,设置条件为流动相:0.05 mol/L NaCl溶液;色谱柱:BRT105-103-101串联凝胶柱(8 mm×300 mm);流速0.8 mL/min;柱温40 ℃;样品溶液5 mg/mL;进样量5 μL;检测器:示差检测器RID-20A;分析时间60 min。
1.3.5 糖肽键特征测定
采用文献[12]的β-消除法,略作修改。取4 mg/mL的样品溶液50 mL,加入等体积0.4 mol/L的NaOH溶液,于45 ℃水浴3 h后,透析12 h,冷冻干燥得到AS8糖肽去糖基化产物(deglycosylated AS8 glycopeptide,dAGP)。使用紫外分光光度计对2种样品进行波长扫描,扫描波长为220~350 nm。
1.3.6 荧光光谱测定
内源性荧光光谱测定:配制2 mg/mL样品溶液放入专用比色皿,使用荧光分光光度计测定,条件为:激发波长295 nm,扫描范围310~500 nm,扫描速率1 200 nm/min,采样间隔1 nm。
外源性荧光光谱测定[13]:配制样品质量浓度为0.5 mg/mL,8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)为8 mmol/L,取4 mL的样品溶液放入离心管中,加入15 μL的ANS,涡旋20 s,避光静置15 min后放入专用比色皿,测定条件为:激发波长390 nm,扫描范围400~600 nm,扫描速率1 200 nm/min,采样间隔1 nm。
1.3.7 傅里叶变换红外光谱
将1 mg样品与100 mg溴化钾混匀,在研钵中充分研磨后,压制成片,采用日本岛津IRSpirit-T傅里叶变换红外光谱仪,在400~4 000 cm-1区间扫描,扫描32次,分辨率为4 cm-1。使用Peakfit 4.12软件对红外光谱酰胺I带(1 600~1 700 cm-1)进行处理,确定各子峰对应的不同二级结构,根据峰面积求出相对含量。
1.3.8 差示扫描量热法(differential scanning calorimeter,DSC)测定
取一定量的样品固体冻干粉置于铝盒中压片,氮气流速为20 mL/min,扫描范围为-50~200 ℃,升温速度10 ℃/min,进行DSC测定。使用TA Universal Analysis 2000热分析软件进行数据处理分析。
1.3.9 扫描电子显微镜(scanning electron microscope,SEM)
用碳导电胶带将冷冻干燥样品固定在样品台上,减压喷金后,用扫描电子显微镜对其微观结构进行分析,在15 kV的加速电压下记录样品的微观形态。
1.3.10 抗氧化活性的测定
ABTS阳离子自由基清除能力的测定参照文献[14];DPPH自由基和羟自由基(·OH)清除能力测定参照文献[15]。
1.4 数据处理及分析
用Excel 2016、SPSS 26和Origin 2021进行数据处理与作图,“平均值±标准差”表示重复实验的结果。
2 结果与分析
2.1 AS8糖肽提取工艺优化
硫酸铵溶液沉淀是提取糖肽的常用方法之一,不但操作简单,得率较高,而且能够保护糖肽的完整性和生物活性。硫酸铵溶液的饱和度、与发酵液的体积比以及沉淀时间等因素对糖肽的提取量和纯度具有一定的影响,故采用单因素和响应面试验对硫酸铵溶液沉淀法提取粗糖肽进行优化。
2.1.1 单因素试验
以粗糖肽提取率为指标,硫酸铵体积倍数、硫酸铵饱和度、铵沉时间作为影响因素进行单因素试验,结果如图1所示,3个因素均对糖肽的提取率有显著影响(P<0.05),其最佳提取条件分别为硫酸铵体积倍数3倍,硫酸铵饱和度90%,铵沉时间24 h。对应的提取率最高值分别为(12.63±0.06)%、(11.27±0.23)%、(12.42±0.14)%。
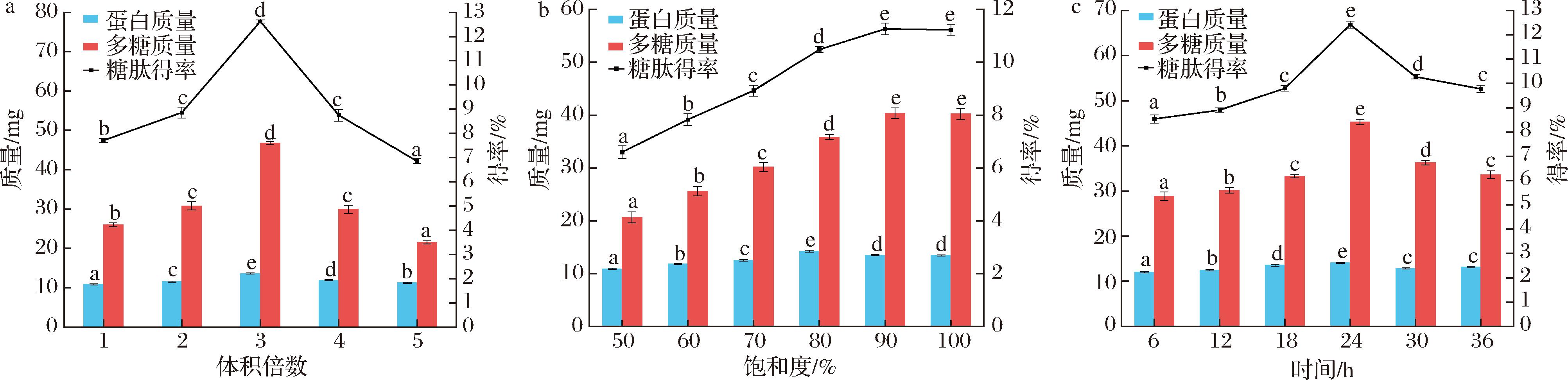
a-硫酸铵体积倍数;b-硫酸铵饱和度;c-铵沉时间
图1 硫酸铵体积倍数、硫酸铵饱和度、铵沉时间对糖肽提取率的影响
Fig.1 Effect of ammonium sulfate volume times, ammonium sulfate saturation, and ammonium settling time on glycopeptide extraction rate
注:不同字母表示同一样品在不同处理条件下具有显著差异(P<0.05)。
2.1.2 响应面试验
响应面试验因素水平见表1,试验结果见表2,回归模型方差分析结果见表3。以提取率为响应值,对表2实验数据运用Design expert数据分析软件对试验数据进行多元回归拟合,得到二次多项回归方程:Y(提取率)=13.06+0.54A-0.22B+0.45C-1.12AB-0.14AC+0.5BC-1.55A2-1.3B2-1.41C2。
表1 三因素三水平响应面分析实验设计表
Table 1 Three-factor three-level response surface analysis experimental design table

水平因素A(体积倍数)B(饱和度)/%C(时间)/h-1280180390241410030
表2 响应面实验设计与结果
Table 2 Response surface experimental design and results
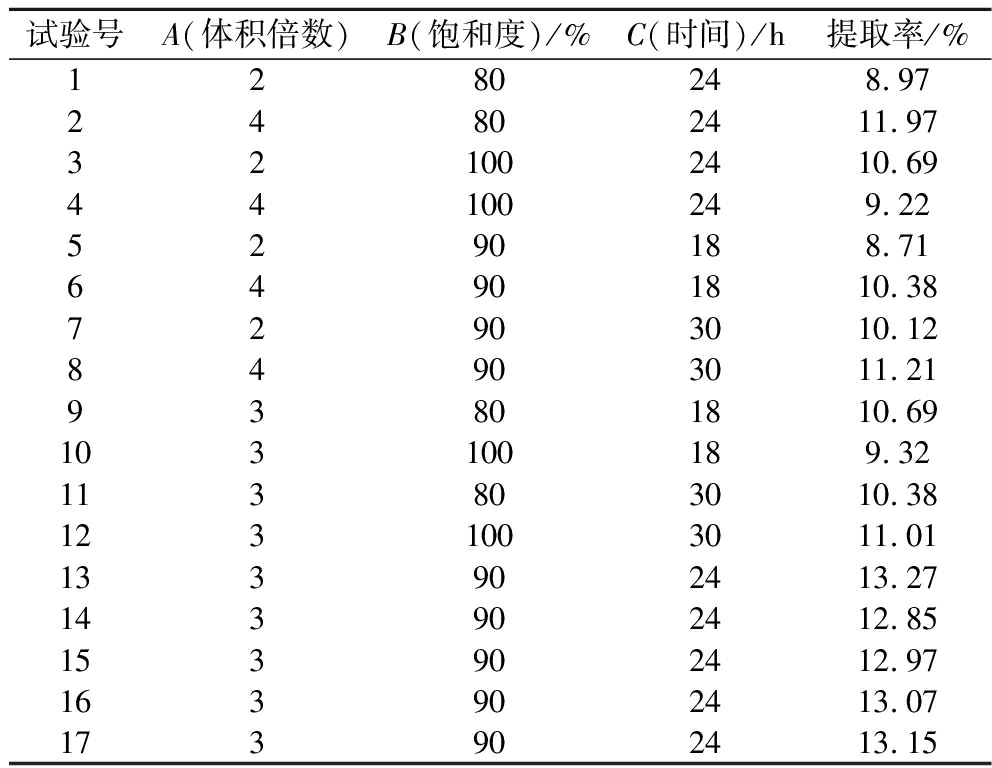
试验号A(体积倍数)B(饱和度)/%C(时间)/h提取率/%1280248.9724802411.97321002410.6944100249.225290188.7164901810.3872903010.1284903011.2193801810.69103100189.32113803010.381231003011.01133902413.27143902412.85153902412.97163902413.07173902413.15
表3 回归模型方差分析
Table 3 Regression model analysis of variance
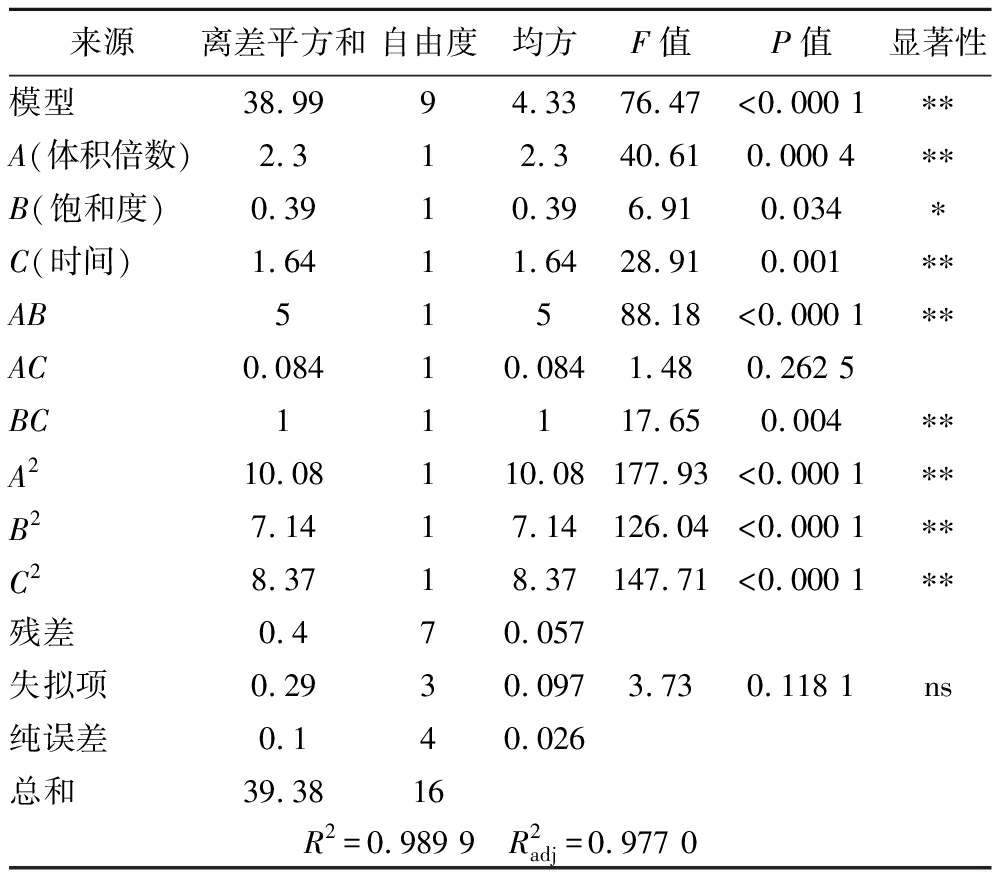
来源离差平方和自由度均方F值P值显著性模型38.9994.3376.47<0.000 1∗∗A(体积倍数)2.312.340.610.000 4∗∗B(饱和度)0.3910.396.910.034∗C(时间)1.6411.6428.910.001∗∗AB51588.18<0.000 1∗∗AC0.08410.0841.480.262 5BC11117.650.004∗∗A210.08110.08177.93<0.000 1∗∗B27.1417.14126.04<0.000 1∗∗C28.3718.37147.71<0.000 1∗∗残差0.470.057失拟项0.2930.0973.730.118 1ns纯误差0.140.026总和39.3816R2=0.989 9 R2adj=0.977 0
注:P<0.01为极显著,用**表示;P<0.05为显著,用*表示;P>0.05为不显著,用ns表示。
由表3可以看出该回归模型P<0.000 1(极显著),其失拟项P=0.118 1>0.05(不显著),模型回归系数![]() 说明模型拟合程度良好,能有效的体现出提取率与三因素间的相互关系。通过P值可以看出,一次项体积倍数、时间对提取率具有极显著影响(P<0.01),饱和度对提取率具有显著影响(P<0.05)。根据F值,分析各因素的主效应关系为:A>C>B,即体积倍数>时间>饱和度。其二次项A2、B2、C2对提取率具有极显著影响(P<0.01),交互项AB、BC对提取率具有极显著的影响(P<0.01),AC对提取率的影响不显著(P>0.05)。根据回归方程模型,以提取率最大值为优化目标,得到预测的最优条件为:体积倍数为3.22、饱和度为88.41%、时间为24.73 h,根据实验实际条件,将条件修正为体积倍数为3、饱和度为88%、时间为25 h,在此最优条件下经3次平行试验,得到提取率为(13.25±0.35)%,与预测值相差在5%范围内,证实了该模型的可靠性。
说明模型拟合程度良好,能有效的体现出提取率与三因素间的相互关系。通过P值可以看出,一次项体积倍数、时间对提取率具有极显著影响(P<0.01),饱和度对提取率具有显著影响(P<0.05)。根据F值,分析各因素的主效应关系为:A>C>B,即体积倍数>时间>饱和度。其二次项A2、B2、C2对提取率具有极显著影响(P<0.01),交互项AB、BC对提取率具有极显著的影响(P<0.01),AC对提取率的影响不显著(P>0.05)。根据回归方程模型,以提取率最大值为优化目标,得到预测的最优条件为:体积倍数为3.22、饱和度为88.41%、时间为24.73 h,根据实验实际条件,将条件修正为体积倍数为3、饱和度为88%、时间为25 h,在此最优条件下经3次平行试验,得到提取率为(13.25±0.35)%,与预测值相差在5%范围内,证实了该模型的可靠性。
2.2 纯化结果分析
如图2-a所示,粗糖肽经Sephadex G-100纯化后,分离得到3个组分,其中组分F1和F2均在280 nm和苯酚硫酸490 nm下有重叠,收集主要组分F2第16-26管的洗脱液透析浓缩后,再经Sephadex G-50纯化,由图2-b所示经纯化后,只有一个既含有蛋白又含糖的组分(F4),收集F4组分第14-21管的洗脱液,冷冻干燥,得到纯化后糖肽(AS8 glycopeptide,AGP)。
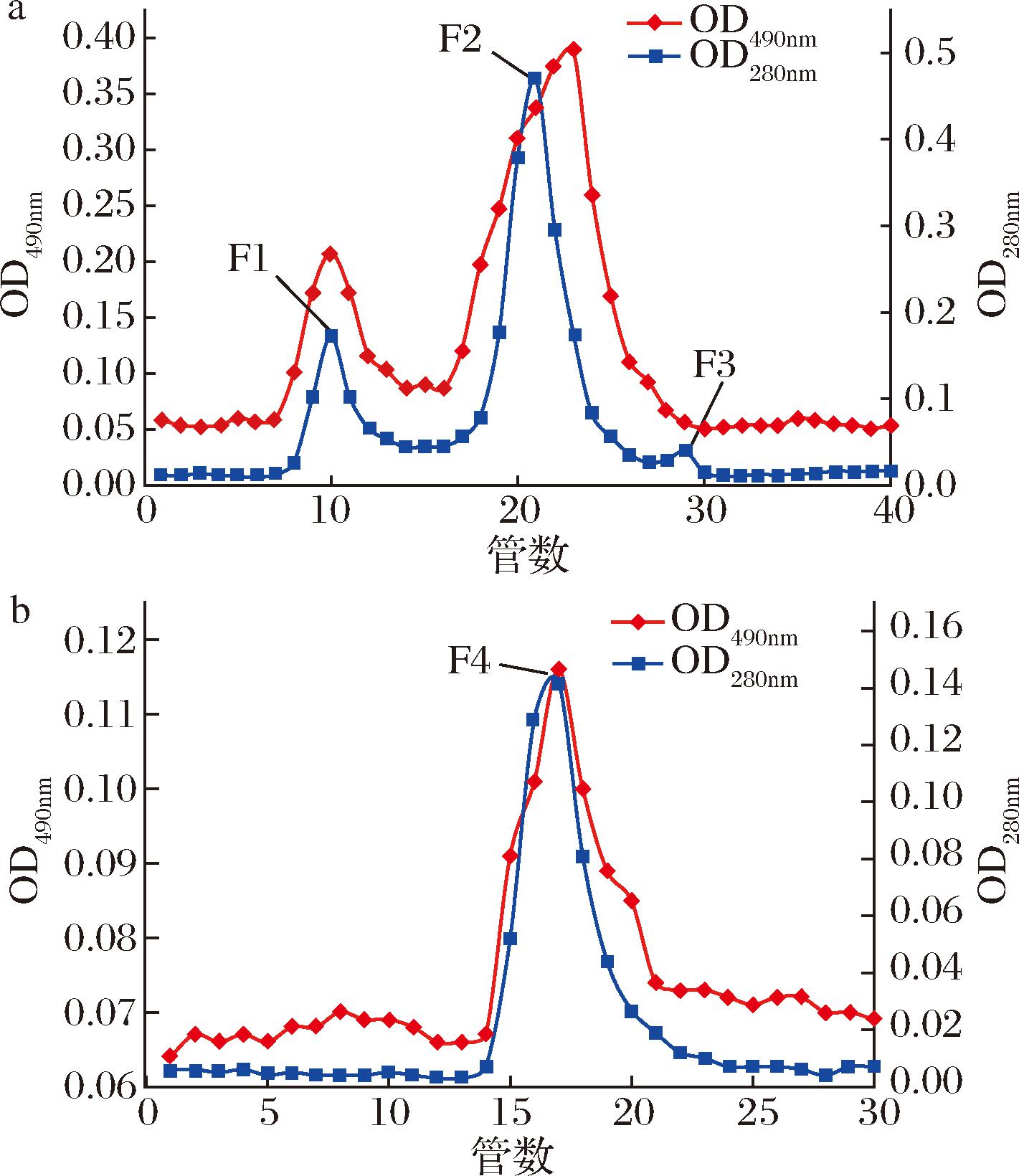
a-Sephadex G-100凝胶柱洗脱曲线; b-Sephadex G-50凝胶柱洗脱曲线
图2 AGP分离纯化图
Fig.2 AGP isolation and purification diagram
2.3 SDS-PAGE凝胶电泳及纯度鉴定结果
粗糖肽经2种不同方法染色的电泳结果如图3-a和图3-b所示,考马斯亮蓝染色显色两条主要条带A、B与PAS染色的条带C、D分别显示在同一位置,表明其含有糖肽类物质。粗糖肽经柱层析纯化得到的AGP,其电泳结果如图3-c可知,电泳后只出现一条染色带(E),表明所得到的AGP已达到电泳纯,AGP的分子质量约为17 kDa。进一步对AGP纯度的鉴定如图4所示,除去溶剂峰,HPGPC图谱在保留时间35.18 min处显现出单一峰,表明AGP为均一组分。
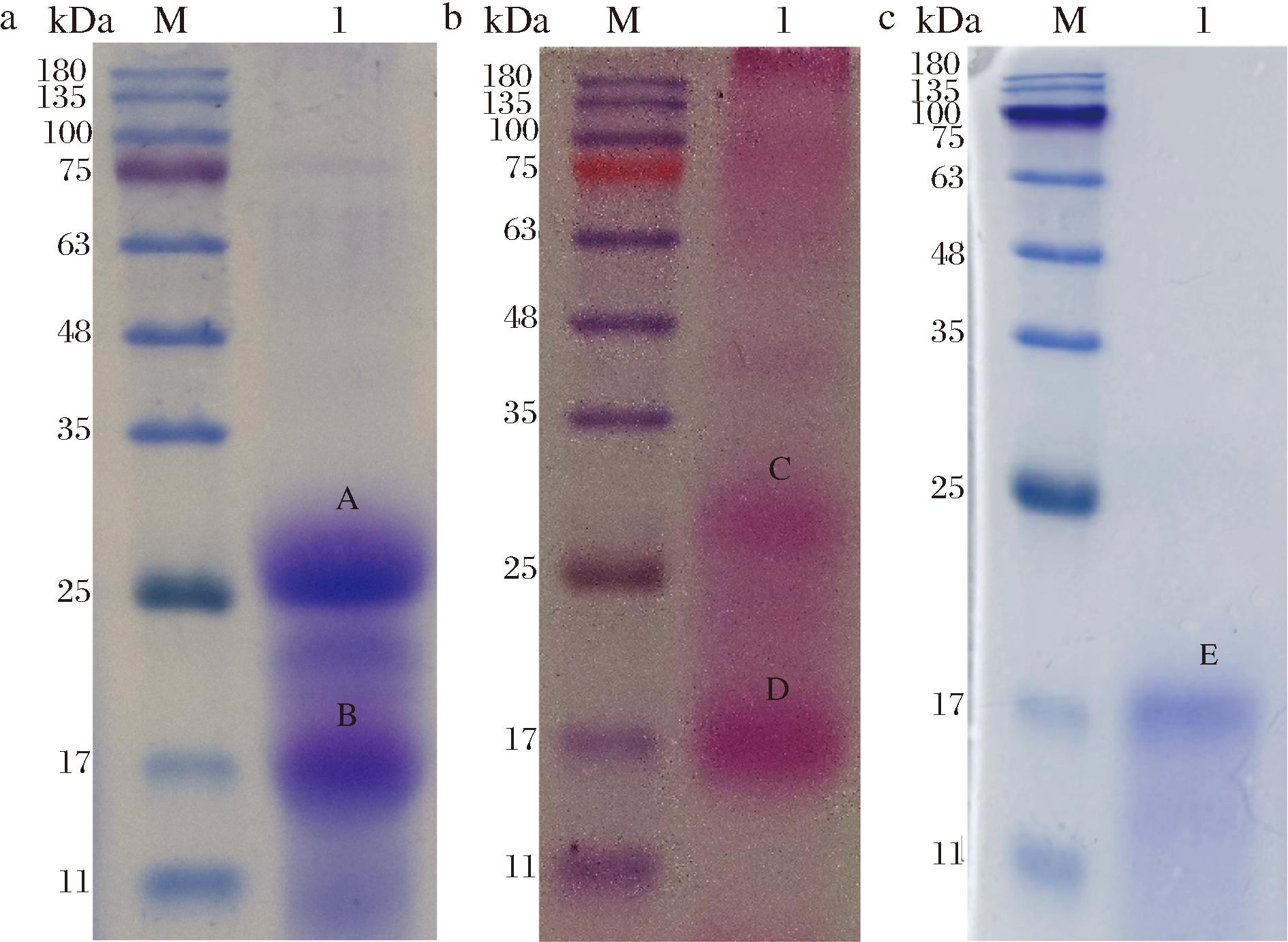
a-粗糖肽考马斯亮蓝染色;b-粗糖肽PAS染色; c-AGP考马斯亮蓝染色
图3 粗糖肽和AGP的SDS-PAGE电泳图谱
Fig.3 SDS-PAGE pattern of crude glycopeptides and AGP

图4 AGP的HPGPC图谱
Fig.4 HPGPC chromatogram of AGP
2.4 糖肽键特征分析
糖肽的主要的糖肽键类型有O-糖肽键和N-糖肽键。N-糖肽键对碱性稳定,而O-糖肽键在氢氧化钠存在下可以进行β-消除反应,糖肽链上的丝氨酸和色氨酸分别转化为α-氨基丙烯酸和α-氨基丁烯酸,在240 nm处存在特征吸收[16]。因此可以通过比较稀碱处理前后样品在240 nm处是否有吸光度变化,来确定此糖肽中是否存在O-糖肽键。AGP经碱处理前后的紫外扫描图如图5所示,AGP未经稀碱处理之前在240 nm 的吸光度值明显低于β-消除反应处理后的吸光值,有明显的特征吸收,表明AGP存在O-糖肽键。
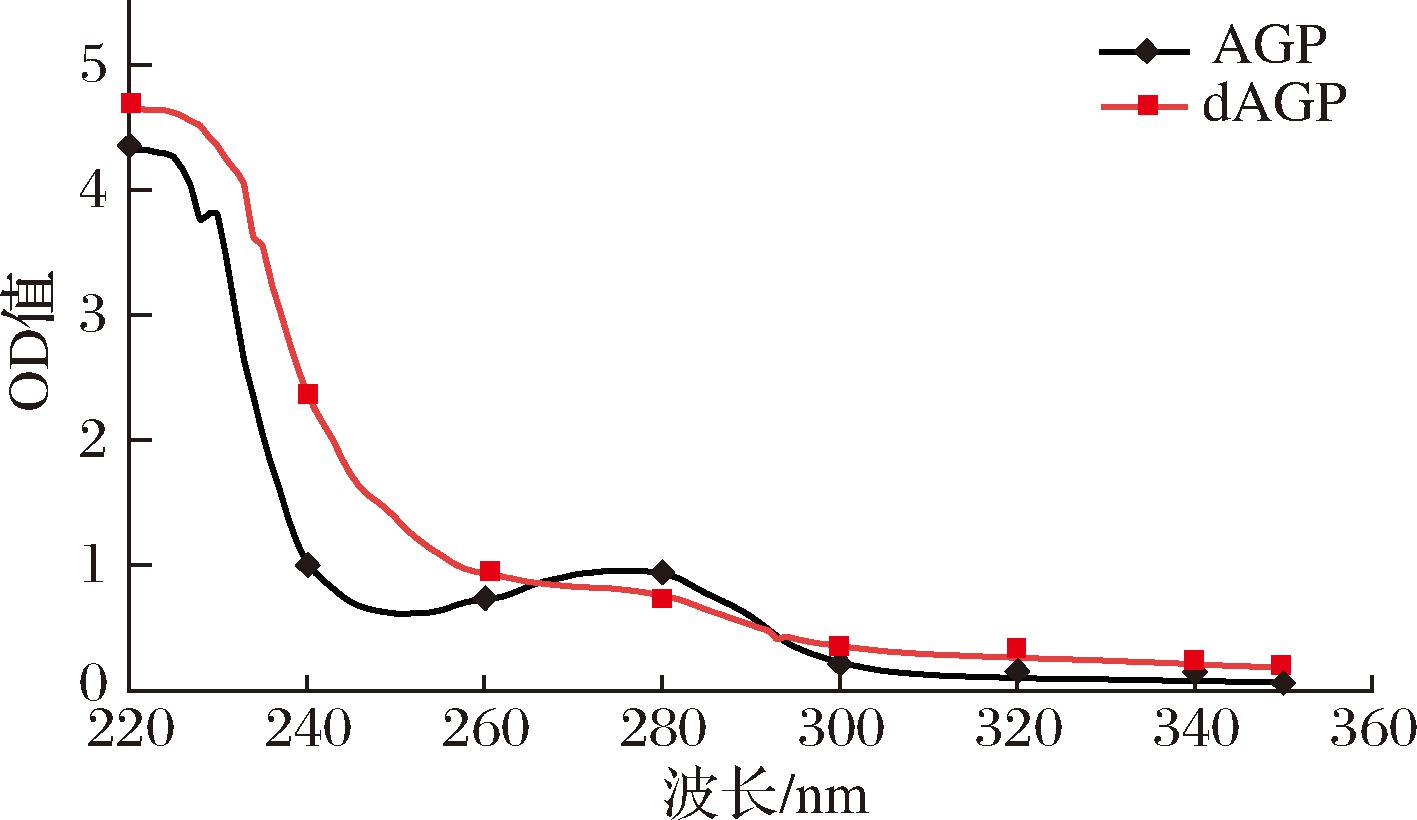
图5 NaOH孵育前后β-消除的紫外光谱
Fig.5 UV spectra of β-Elimination before or after incubation with NaOH
2.5 荧光光谱分析
基于荧光光谱分析,可以反映蛋白质三级结构的变化。蛋白的内源荧光主要是由芳香族氨基酸残基形成的,色氨酸因其荧光强度最高常被用作内源荧光探针来反应蛋白质构象变化[17]。ANS是一种阴离子疏水探针,对其所处微环境的极性非常敏感,能够与蛋白分子中的疏水基团结合而使蛋白的荧光强度增强,可根据ANS探针外源荧光光谱的最大荧光强度来表征蛋白的表面疏水性[13]。
图6-a显示了AGP和dAGP的内源荧光光谱,与AGP相比,dAGP的最大发射波长(λmax)发生了红移(344 nm到349 nm),且最大荧光强度也显著增加。AGP和dAGP的外源荧光光谱如图6-b所示,dAGP的最大荧光强度明显低AGP,即去糖基化后,AGP的表面疏水性降低。以上结果说明,去糖基化引起AGP的结构改变,导致部分被掩埋的亲水性氨基酸残基侧链基团暴露,使得AGP表面疏水性降低,AGP分子内部色氨酸残基暴露在更亲水的环境中,因此λmax发生红移,内源荧光强度的增加也与糖链的去除减轻了对色氨酸残基的屏蔽作用有关[18]。
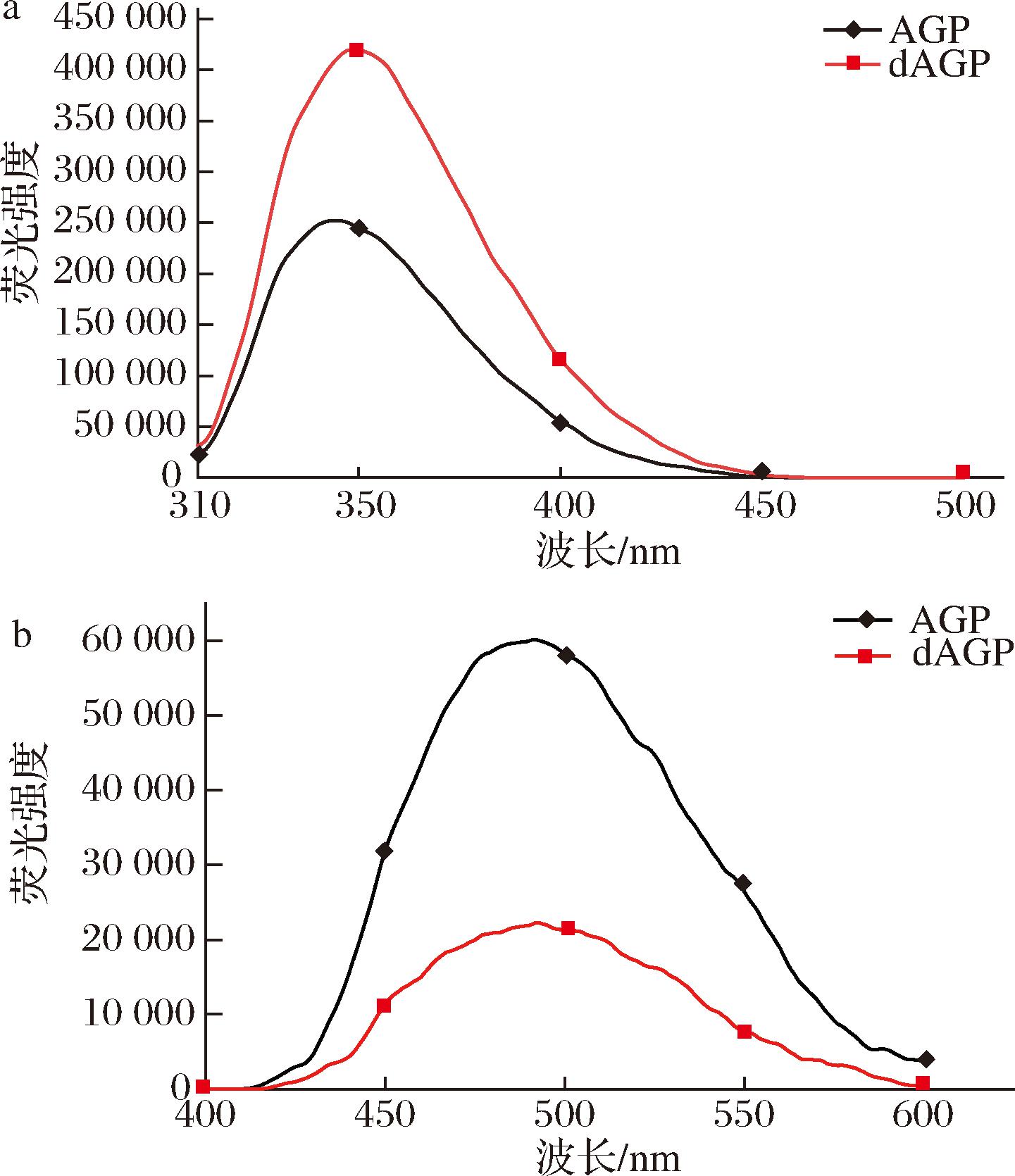
a-内源性荧光光谱;b-外源性荧光光谱
图6 AGP和dAGP 的荧光光谱图
Fig.6 Fluorescence spectra of AGP and dAGP
2.6 红外光谱测定结果
如图7所示,AGP与dAGP的吸收光谱表现出相似的特征。在3 600~3 000 cm-1处的宽峰归因于O—H或N—H伸缩振动,且存在分子内或分子间氢键,这是多糖或蛋白质分子的特征吸收[19]。3 000~2 850 cm-1 处的吸收峰是多糖的甲基和亚甲基中C—H的伸缩振动引起的[20]。1 700~1 600 cm-1产生的吸收峰由羧基或酰胺羰基的C![]() O伸缩振动以及N—H弯曲振动引起的,为肽键(—CO—NH—)的特征吸收峰[21]。1 600~1 400 cm-1的吸收峰主要是由于AGP内部含有的双键,主要是由N
O伸缩振动以及N—H弯曲振动引起的,为肽键(—CO—NH—)的特征吸收峰[21]。1 600~1 400 cm-1的吸收峰主要是由于AGP内部含有的双键,主要是由N![]() O和N
O和N![]() N的伸缩振动、C—N的伸缩振动以及C—H的变角振动引起的,均为蛋白质的特征吸收峰[22]。以上分析结果进一步证实AGP是糖肽复合物。
N的伸缩振动、C—N的伸缩振动以及C—H的变角振动引起的,均为蛋白质的特征吸收峰[22]。以上分析结果进一步证实AGP是糖肽复合物。

图7 AGP和dAGP的红外光谱图
Fig.7 Infrared spectra of AGP and dAGP
AGP去糖基化后,其在酰胺I带的吸收峰向高波数段蓝移了7 cm-1(1 635 cm-1~1 642 cm-1),表明去糖基化使AGP肽链之间的氢键减少,二级结构发生转变。在1 200~900 cm-1波段的谱带强度存在显着差异,该谱带代表蛋白质中相关糖链的特征吸收。与AGP相比,去糖基化产物dAGP在该波段的谱带强度急剧降低,这可能是由于AGP中O-糖链的去除所致,这与SHENG等[23]的研究结果一致。
参考文献[24],利用PeakFit 4.12软件对红外光谱酰胺I带(1 600~1 700 cm-1)进行基线校正、去卷积和二阶导数分峰拟合处理后,得到AGP和dAGP二级结构的相对含量,如表4所示,AGP的二级结构主要以β-折叠为主,相对含量为(44.23±0.12)%。对比α-螺旋、β-转角和无规卷曲来说,β-折叠结构相对稳定,高水平的β-折叠有序结构有助于蛋白结构的稳定[25]。去糖基化后,AGP的β-折叠相对含量显著降低,减少了5.14%,α-螺旋、β-转角、无规卷曲含量均有增加。而去糖基化使得AGP有序结构减少,导致二级结构变得松散,说明了O-糖基化有助于AGP形成稳定有序的二级结构,从而提高AGP的稳定性。
表4 酰胺I带拟合AGP和dAGP二级结构组成
Table 4 Amide I band fitting AGP and dAGP secondary structure composition
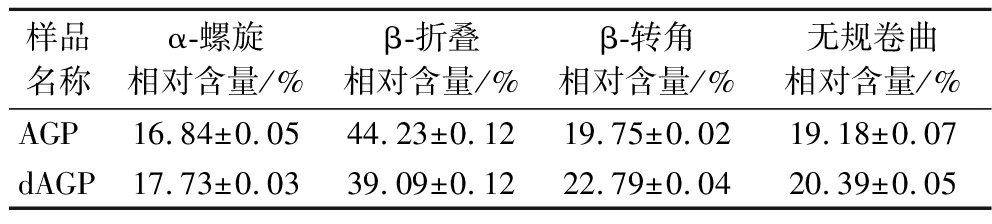
样品名称α-螺旋相对含量/%β-折叠相对含量/%β-转角相对含量/%无规卷曲相对含量/%AGP16.84±0.0544.23±0.1219.75±0.0219.18±0.07dAGP17.73±0.0339.09±0.1222.79±0.0420.39±0.05
2.7 DSC结果分析
DSC是研究蛋白质折叠和稳定性的一种非常有效的工具。蛋白热变性出现的峰值所对应的温度和峰面积即它们的热变性温度(Td)和焓变值(ΔH),它们的变化可以反映蛋白质结构的变化,Td和ΔH越高,蛋白质的热稳定性越强[26]。AGP和dAGP的DSC曲线如图8所示,去糖基化前后,AGP的热变性温度Td由108 ℃下降到102 ℃,焓变值(ΔH)由228.3 J/g下降到179.4 J/g,表明AGP的热稳定性高于去糖基化的dAGP。这可能是结合的寡糖链能在温度诱导的变性过程中稳定AGP的结构[6],即O-糖基化能够稳定和提高AGP肽类物质的热稳定性。
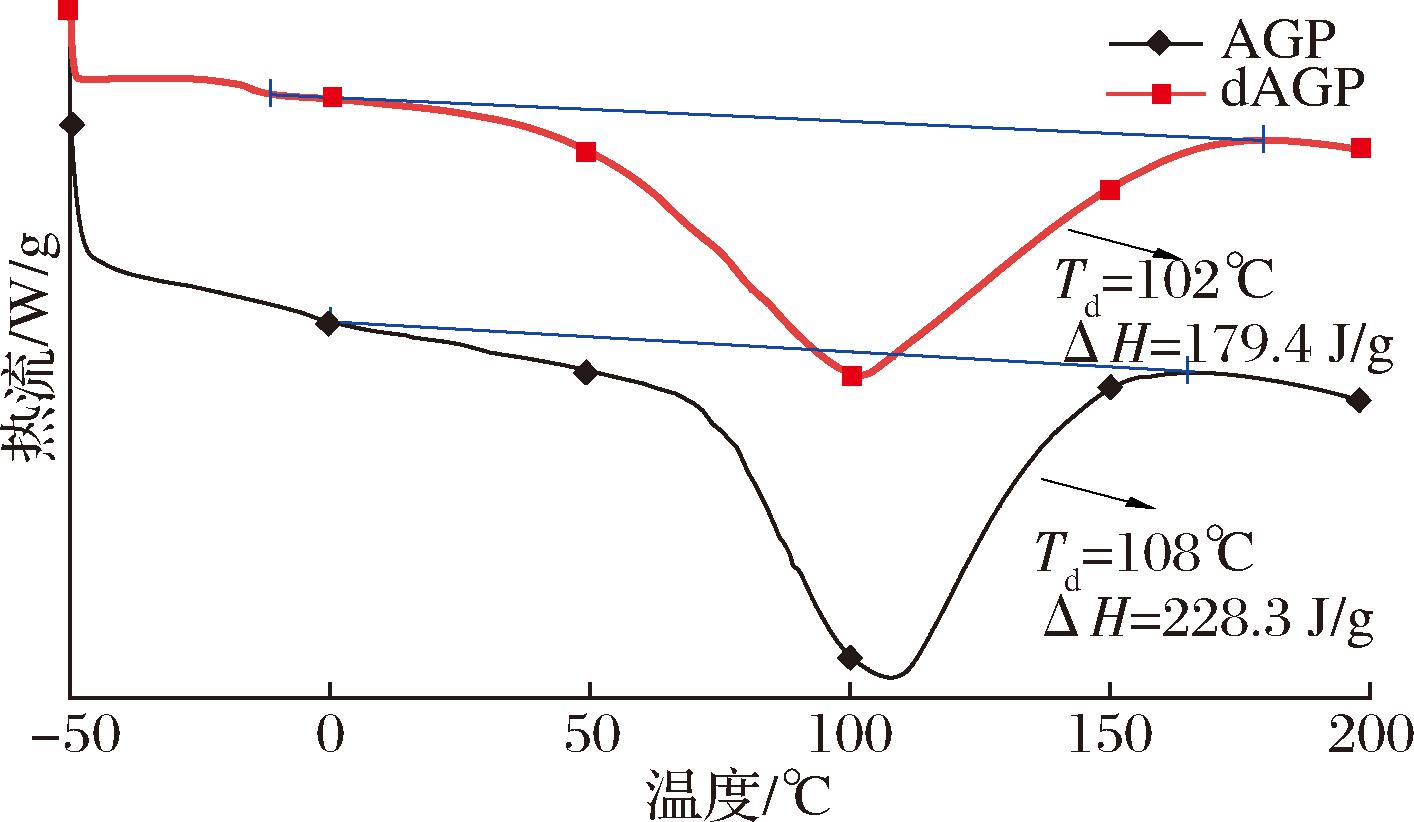
图8 AGP和dAGP的差热扫描图谱
Fig.8 DSC spectra of AGP and dAGP
2.8 扫描电镜结果分析
AGP及dAGP冷冻干燥后的扫描电镜图如图9所示,AGP放大300倍(图9-a)和800倍(图9-b)微观结构呈现出紧密光滑的,有少许褶皱的片层结构,dAGP(图9-c、图9-d)的表面结构粗糙破碎,出现了很多不规则的大孔洞。O-糖链的去除可能导致AGP分子间相互作用力减弱,表面张力增大,从而不能在真空冷冻环境下维持稳定的网络状结构,使得冻干后微观结构发生了明显变化,变得疏松无序、粗糙多孔。

a-AGP(×300);b-AGP(×800);c-dAGP(×300);d-dAGP(×800)
图9 AGP和dAGP的扫描电镜图
Fig.9 Scanning electron microscopy of AGP and dAGP
2.9 抗氧化结果分析
ABTS阳离子自由基是带正电荷的自由基,其清除主要原理是电子的转移。如图10-a所示,样品质量浓度在2~10 mg/mL时,AGP的ABTS阳离子自由基清除率均低于dAGP,在质量浓度为10 mg/mL时,AGP和dAGP的ABTS阳离子自由基清除率分别为(97.01±1.01)%和(100±0.26)%。说明去糖基化后,AGP的ABTS阳离子自由基清除率有所提高。王岸娜等[27]切除猕猴桃糖蛋白O-糖链后,其ABTS阳离子自由基清除能力明显升高,这与本实验结果相似。CHEN等[28]指出,肽中色氨酸和酪氨酸对亲水性ABTS阳离子自由基表现出较强的清除活性,而AGP内源荧光结果显示,去糖基化后其λmax发生红移,意味色氨酸和酪氨酸更加暴露于周围溶剂中,这可能是AGP去糖基化后ABTS阳离子自由基清除率提高的原因之一。
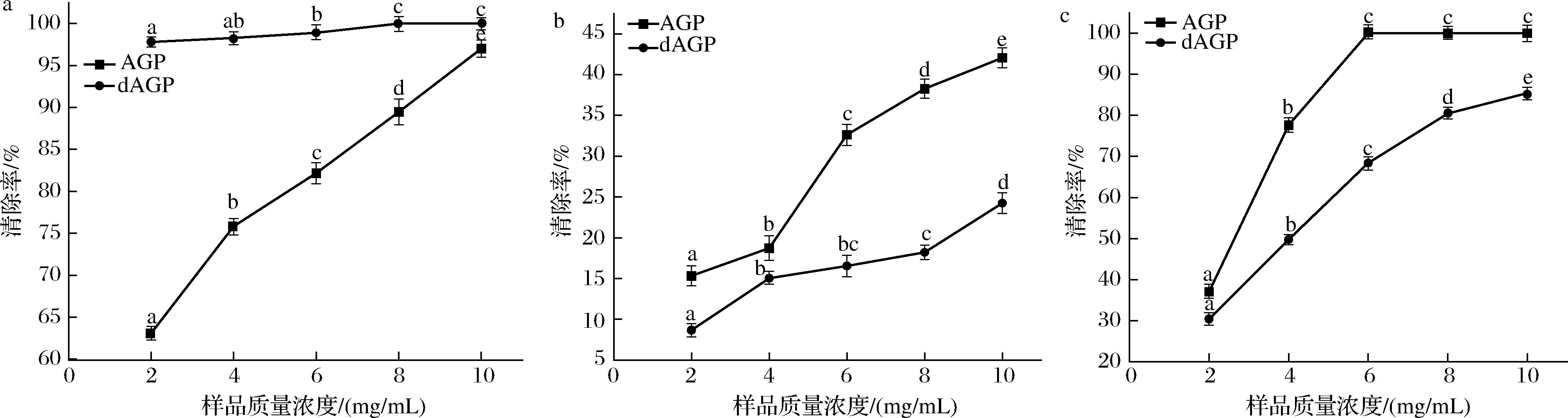
a-ABTS阳离子自由基清除能力;b-DPPH自由基清除能力;c-·OH清除能力
图10 AGP和dAGP对DPPH自由基、ABTS阳离子自由基、·OH的清除能力
Fig.10 Scavenging capacity of AGP and dAGP for DPPH free radicals, ABTS cationic radicals, and ·OH
注:不同小写字母代表差异显著,P<0.05。
DPPH自由基是一种稳定的以氮为中心的亲脂性自由基,是评价抗氧化剂清除自由基活性的有效试剂。由图10-b可以看出,AGP的DPPH自由基清除能力随着浓度的增加而增强,10 mg/mL时的清除率为(42.06±0.55)%,具有一定的DPPH自由基清除能力。与AGP相比,dAGP的清除率显著下降,在10 mg/mL时的清除率下降至(24.24±1.26)%,可能能是因为去糖基化后,使得AGP更多的亲水性基团暴露出来,表面疏水性下降,难与脂溶性DPPH自由基反应生成稳定的物质[29],其次,去除的O-糖链中部分寡糖作为氢供体,能与DPPH自由基反应,终止自由基链式反应。
·OH是活性氧(reactive oxygen species,ROS)中危害最大的自由基之一,可通过破坏体内生物大分子(如DNA、脂质和蛋白质)对机体造成损害[30]。由图10-c可以看出,AGP的·OH清除率从(37.06±0.71)%(2 mg/mL)增加到(100±0.26)%(6 mg/mL)并逐渐稳定,表明AGP具有很强的清除羟基自由基的能力。dAGP在质量浓度2~10 mg/mL时·OH清除率均低于AGP,在10 mg/mL时的清除率为(85.43±0.52)%。AGP中葡萄糖、半乳糖、木糖等单糖能通过电子螯合促进金属离子的氧化,且与Fe2+具有较强的螯合能力,因此抑制·OH的生成[28]。O-糖链的去除导致AGP中这些单糖减少,所以·OH清除率下降。高含量的β-折叠二级结构对肽和蛋白的抗氧化能力也有着积极的作用[22,31],从红外分析结果可知,AGP主要的二级结构就是β-折叠,去糖基化后AGP的β-折叠含量下降,也可能是导致AGP的·OH清除率下降的原因之一。
3 结论
本文通过β-消除反应对AS8乳发酵液中提取纯化的AGP进行去O-糖基化,得到dAGP。与dAGP相比,AGP有序结构β-折叠减少了5.14%;内源荧光强度增加,最大发射波长红移了3 nm,表面疏水性降低;热变性温度Td由108 ℃下降到102 ℃,热稳定性降低;微观结构由光滑平整变得疏松无序;·OH和DPPH自由基清除能力显著降低,ABTS阳离子自由基清除能力有所提高。综上所述,O-糖链的去除改变了AGP的二、三级结构,由于结构的改变,进一步影响了AGP的热稳定性和抗氧化活性。本实验为糖肽AGP更好地在功能食品中应用和开发提供了数据基础,但由于糖肽结构的复杂性,后续将继续开展LC-MS/MS、核磁共振分析及细胞活性等实验,更深入地研究AGP的构效关系。
[1] ZHANG M, OU X Z, SHI H, et al.Isolation, structures and biological activities of medicinal glycoproteins from natural resources:A review[J].International Journal of Biological Macromolecules, 2023, 244:125406.
[2] C RDOVA-D
RDOVA-D VALOS L E, CERVANTES-GARC
VALOS L E, CERVANTES-GARC A D, BALLONA-ALBA M F, et al.Protective effect of glycomacropeptide on the inflammatory response of U937 macrophages[J].Foods, 2023, 12(7):1528.
A D, BALLONA-ALBA M F, et al.Protective effect of glycomacropeptide on the inflammatory response of U937 macrophages[J].Foods, 2023, 12(7):1528.
[3] LUO H J, ZHANG Y K, WANG S Z, et al.Structural characterization and anti-oxidative activity for a glycopeptide from Ganoderma lucidum fruiting body[J].International Journal of Biological Macromolecules, 2024, 261(Pt 2):129793.
[4] MOREMEN K W, TIEMEYER M, NAIRN A V.Vertebrate protein glycosylation:Diversity, synthesis and function[J].Nature Reviews Molecular Cell Biology, 2012, 13(7):448-462.
[5] YANG A S, DENG H, ZU Q Q, et al.Structure characterization and IgE-binding of soybean 7S globulin after enzymatic deglycosylation[J].International Journal of Food Properties, 2018, 21(1):171-182.
[6] KAR B, VERMA P, DEN HAAN R, et al.Effect of N-linked glycosylation on the activity and stability of a β-glucosidase from Putranjiva roxburghii[J].International Journal of Biological Macromolecules, 2018, 112:490-498.
[7] 向媛嫄, 王文林, 宋海云, 等.去糖基化对水溶澳洲坚果糖肽结构和抗氧化性的影响[J].食品与发酵工业, 2021, 47(11):98-103.XIANG Y Y, WANG W L, SONG H Y, et al.Effect of deglycosylation on the structure and antioxidant activity of water-soluble macadamia glycopeptide[J].Food and Fermentation Industries, 2021, 47(11):98-103.
[8] 刘立杰. 三株乳酸菌对小鼠肝脏抗氧化能力及肠道粘膜免疫的影响[D].呼和浩特:内蒙古农业大学, 2017.LIU L J.Effects of three lactic acid bacteria on liver antioxidant capacity and intestinal mucosa immunity of mice[D].Hohhot:Inner Mongolia Agricultural University, 2017.
[9] 石雅彤, 白英.模拟消化对副干酪乳杆菌LX5和屎肠球菌AS8发酵液抗氧化活性的影响[J/OL].食品与发酵工业, 2023.https://doi.org/10.13995/j.cnki.11-1802/ts.036844.SHI Y T, BAI Y.Effect of simulated digestion on antioxidant activity of Lactobacillus paracasei LX5 and Enterococcus faecalis AS8 fermentation broth[J/OL].Food and Fermentation Industries, 2023.https://doi.org/10.13995/j.cnki.11-1802/ts.036844.
[10] ALLEY W R Jr, MANN B F, NOVOTNY M V.High-sensitivity analytical approaches for the structural characterization of glycoproteins[J].Chemical Reviews, 2013, 113(4):2668-2732.
[11] 李成, 王承健, 晋万军, 等.银杏种子糖蛋白的 SDS-PAGE 分离及N-糖链的质谱分析[J].高等学校化学学报, 2019, 40(1):69-75.LI C, WANG C J, JIN W J, et al.Mass spectrometric analysis of N-glycans of glycoprotein separated by SDS-PAGE gel from ginkgo seed[J].Chemical Journal of Chinese Universities, 2019, 40(1):69-75.
[12] LI T T, WU C E, MENG X Y, et al.Structural characterization and antioxidant activity of a glycoprotein isolated from Camellia oleifera Abel seeds against D-galactose-induced oxidative stress in mice[J].Journal of Functional Foods, 2020, 64:103594.
[13] 邓雯, 廖雅如, 黄丽衡, 等.异黄酮与β-伴大豆球蛋白的相互作用及其对蛋白结构和潜在致敏性的影响[J/OL].食品科学, 2024.http://kns.cnki.net/kcms/detail/11.2206.TS.20240126.1101.002.html.DENG W, LIAO Y R, HUANG L H, et al.Interaction of isoflavones with β-conglycinin and its effect on the structure of the complex and potential allergenicity[J/OL].Food Science, 2024.http://kns.cnki.net/kcms/detail/11.2206.TS.20240126.1101.002.html.
[14] ZHANG H, ZOU P, ZHAO H T, et al.Isolation, purification, structure and antioxidant activity of polysaccharide from pinecones of Pinus koraiensis[J].Carbohydrate Polymers, 2021, 251:117078.
[15] 李宁宁, 王正荣, 孙春晓, 等.牛蒡多糖对发酵乳品质和抗氧化性的影响[J].食品与发酵工业, 2019, 45(10):97-103.LI N N, WANG Z R, SUN C X, et al.Burdock polysaccharides enhanced the quality and antioxidative activity of fermented milk[J].Food and Fermentation Industries, 2019, 45(10):97-103.
[16] ZHANG X, WANG C, HAN Q, et al.Highly sialylated mucin-type glycopeptide from porcine intestinal mucosa after heparin extraction:O-glycan profiling and immunological activity evaluation[J].Glycoconjugate Journal, 2021, 38(5):527-537.
[17] LI Y, LIU B H, JIANG L Z, et al.Interaction of soybean protein isolate and phosphatidylcholine in nanoemulsions:A fluorescence analysis[J].Food Hydrocolloids, 2019, 87:814-829.
[18] JIN H, ZHAO Q S, FENG H Y, et al.Changes on the structural and physicochemical properties of conjugates prepared by the Maillard reaction of black bean protein isolates and glucose with ultrasound pretreatment[J].Polymers, 2019, 11(5):848.
[19] ZHANG H Q, HAN L W, SUN X M, et al.A glycoprotein from mountain cultivated ginseng:Insights into their chemical characteristics and intracellular antioxidant activity[J].International Journal of Biological Macromolecules, 2022, 217:761-774.
[20] WANG Y, ZOU T T, XIANG M H, et al.Purification and characterization of a soluble glycoprotein from garlic (Allium sativum) and its in vitro bioactivity[J].Preparative Biochemistry and Biotechnology, 2016, 46(7):709-716.
[21] ZENG H J, LIU Z, WANG Y P, et al.Studies on the anti-aging activity of a glycoprotein isolated from Fupenzi (Rubus chingii Hu.) and its regulation on klotho gene expression in mice kidney[J].International Journal of Biological Macromolecules, 2018, 119:470-476.
[22] GAO J Y, LI X, JIA S T, et al.Structural characterization and antioxidant activity of a glycoprotein isolated from shiitake mushrooms[J].Food Bioscience, 2023, 53:102608.
[23] SHENG L, HE Z J, CHEN J H, et al.The impact of N-glycosylation on conformation and stability of immunoglobulin Y from egg yolk[J].International Journal of Biological Macromolecules, 2017, 96:129-136.
[24] 张永金, 胡艳红, 葛武鹏, 等.母乳、牛乳与主要小品种乳蛋白质组成及乳清蛋白二级结构比较[J].食品安全质量检测学报, 2022, 13(15):4779-4786.ZHANG Y J, HU Y H, GE W P, et al.Comparative study on the composition of protein and secondary structure of whey protein in human milk, milk and main small varieties of milk[J].Journal of Food Safety and Quality, 2022, 13(15):4779-4786.
[25] YONG Y H, YAMAGUCHI S, MATSUMURA Y.Effects of enzymatic deamidation by protein-glutaminase on structure and functional properties of wheat gluten[J].Journal of Agricultural and Food Chemistry, 2006, 54(16):6034-6040.
[26] 李颖畅, 师丹华, 赵淞民, 等.超声波辅助没食子酸对鲈鱼肌原纤维蛋白结构特性的影响[J].中国食品学报, 2023, 23(7):88-98.LI Y C, SHI D H, ZHAO S M, et al.Effect of gallic acid on structural properties of Lateolabrax japonicas myofibrillar protein under ultrasonic treatment[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(7):88-98.
[27] 王岸娜, 苏子豪, 吴立根, 等.O-糖链对猕猴桃糖蛋白抗氧化能力及构象的影响[J].河南工业大学学报(自然科学版), 2016, 37(2):79-85.WANG A N, SU Z H, WU L G, et al.The impact of O-glycan on the antioxidant activity and secondary structure of glycoprotein extracted from kiwi fruit[J].Journal of Henan University of Technology (Natural Science Edition), 2016, 37(2):79-85.
[28] CHEN Y J, LIN Q L, WANG J Q, et al.Proteins, polysaccharides and their derivatives as macromolecular antioxidant supplements:A review of in vitro screening methods and strategies[J].International Journal of Biological Macromolecules, 2023, 224:958-971.
[29] 石嘉怿, 张太, 梁富强.体外模拟消化对大米谷蛋白结构及水解产物生物活性的影响[J].食品科学, 2021, 42(1):59-66.SHI J Y, ZHANG T, LIANG F Q.Effect of in vitro simulated digestion on the structure of rice glutelin and the biological activity of hydrolysates[J].Food Science, 2021, 42(1):59-66.
[30] WU Y T, HUO Y F, XU L, et al.Purification, characterization and antioxidant activity of polysaccharides from Porphyra haitanensis[J].International Journal of Biological Macromolecules, 2020, 165:2116-2125.
[31] YANG R W, WANG J, LIN S Y, et al.In vitro antioxidant activities of the novel pentapeptides Ser-His-Glu-Cys-Asn and Leu-Pro-Phe-Ala-Met and the relationship between activity and peptide secondary structure[J].Journal of the Science of Food and Agriculture, 2017, 97(6):1945-1952.