婴儿的生长、免疫系统和认知发展都极其依赖于早期蛋白质和脂肪的摄入[1]。然而,与成人相比,婴儿的消化系统存在明显差异。婴儿胃pH值较高,更适合脂肪分解而不利于蛋白质分解,同时肠道中脂肪酶活性和胆盐浓度较低[2]。这些差异导致婴儿消化系统不够成熟,消化酶分泌不足,活动量较低,易出现消化不良、吸收障碍、不耐受、过敏和便秘等问题[3]。当母亲无法提供母乳喂养时,婴儿配方奶粉成为最佳选择。然而,由于母乳和配方奶粉成分差异,婴儿更容易出现消化问题[4]。因此,寻找与母乳成分相近的替代品对婴儿的有效消化和吸收以及预防消化系统疾病具有重要意义。
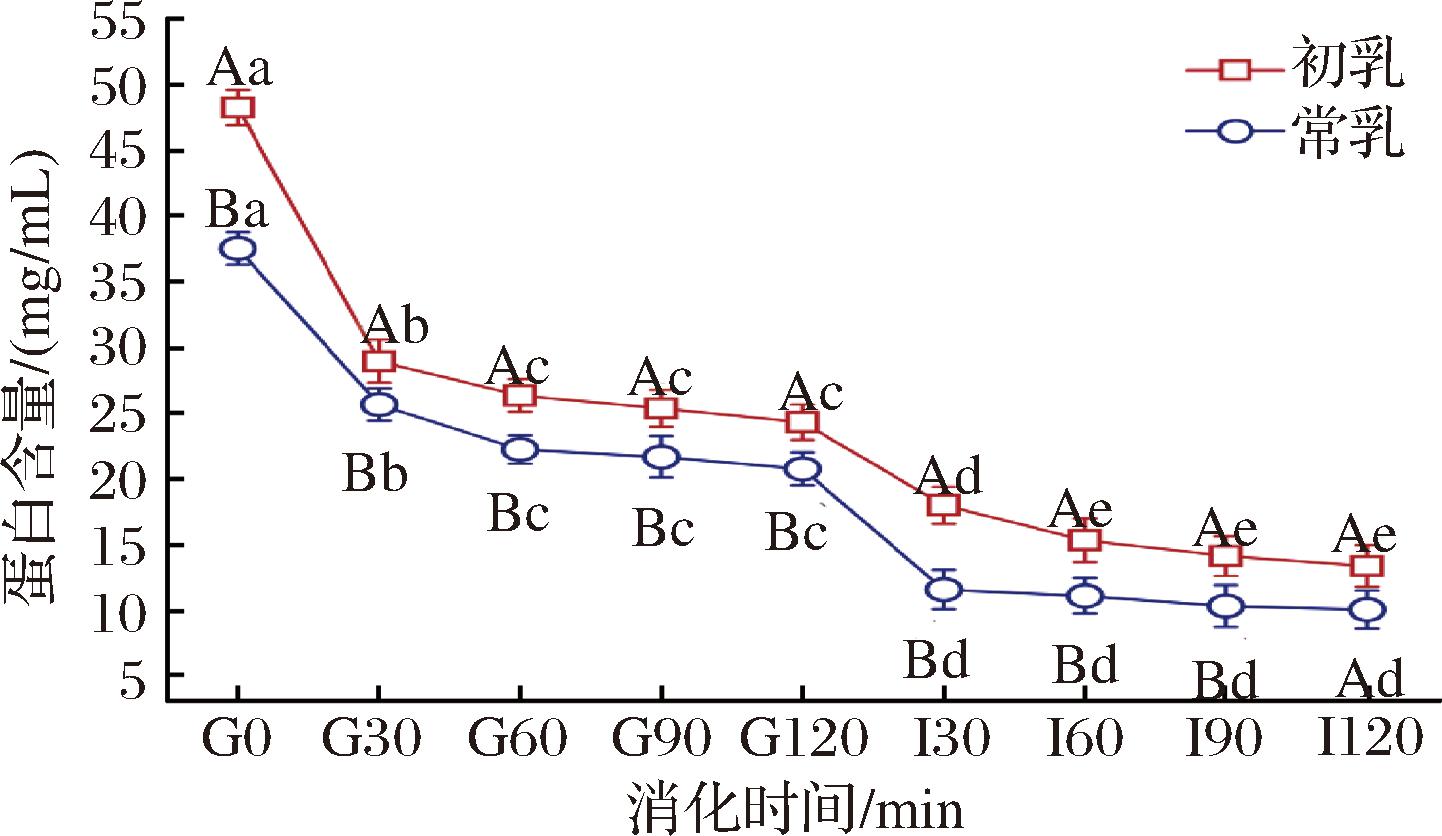
图1 驼初乳和常乳各阶段消化产物蛋白质含量的变化
Fig.1 Changes of protein content in digestion products of camel colostrum and mature milk at different stages
注:G表示胃消化,I表示肠消化;不同大写字母表示不同消化 时间样品间存在显著差异(P<0.05);不同小写字母表示 同一样品不同消化时间存在显著差异(P<0.05); 误差棒表示为标准偏差(下同)。
驼乳以其独特的营养价值和药用特性被誉为“沙漠的白金”[5]。与牛乳相比,驼乳中酪蛋白(casein,CN)/乳清蛋白(whey protein,WP)比率较低,更接近母乳的成分。研究表明,这种较低比例的酪蛋白与乳清蛋白更有利于婴儿配方奶粉中乳蛋白的快速消化[6]。此外,驼乳中β-CN与αS1-CN的比例较高,而αS2-CN和κ-CN的含量相对较低,与牛乳和母乳的蛋白质组成有所不同[7]。驼乳还含有一些具有免疫调节、抗病毒和抗菌特性的功能性保护性蛋白,如免疫球蛋白(immunoglobulins,Igs)、N-乙酰-β-葡糖苷酶(N-acetylglucosaminidase,NAGase)、乳铁蛋白(lactoferrin,LF)、乳过氧化物酶(lactoperoxidase,LP)和溶菌酶(lysozyme,LZ)[8]。此外,驼乳中还含有对婴儿健康有益的肽聚糖识别蛋白1(peptidoglycan recognition protein 1, PGRP1)和乳清酸蛋白(whey acidic protein, WAP)[7],而不含过敏原β-乳球蛋白(β-lactoglobulin, β-LG),这些都与牛乳[9]和母乳的成分有所不同。此外,驼乳中脂肪球的平均直径较小,这可能影响胰脂肪酶的活性,促使乳液更快地消化[10]。这些独特的性质使驼乳在婴幼儿配方奶粉的开发中具有潜力。
然而,目前对于驼乳体外消化的研究较为有限。ZOU等[7]对比了驼乳、母乳和牛乳蛋白质的可消化性。在胃消化过程中,驼乳形成了单个凝块,这减缓了对酪蛋白的消化,但在肠道阶段,蛋白质被快速、广泛地水解。MAQSOOD等[11]研究发现,与牛乳相比,驼乳蛋白具有较低的吸水能力,含有较低比例的饱和脂肪酸和较高比例的不饱和脂肪酸,其蛋白水解产物具有更高的抗氧化和血管紧张素转换酶(angiotensin-converting enzyme, ACE)抑制特性。JIANG等[3]研究表明,驼乳粉的蛋白质在婴儿消化模型中显示出更高的水解度和更快的消化率,消化产物具有较小粒径和较低分子质量肽,这有助于它们被身体吸收和利用。此外,MEENA等[12]研究发现,山羊和骆驼的乳脂消化速率高于奶牛和水牛,而山羊乳和驼乳之间没有显著差异。然而,目前还没有对驼初乳的消化进行研究,初乳被称为“液体黄金”,因为它提供被动免疫[13],与常乳相比,初乳在蛋白质浓度方面存在显著差异,包括免疫球蛋白、酶、生长因子和激素[14],因而更有必要揭示其生物可及性。为此,本研究将建立婴儿体外胃肠道消化模型,比较和分析驼初乳和常乳蛋白质和脂肪的消化行为以及微观结构特征,揭示2种乳成分在婴儿体内的分解和营养释放情况,为驼乳的进一步开发及其在婴幼儿配方乳粉的应用提供参考。
1 材料与方法
1.1 材料与试剂
选取内蒙古阿拉善盟的30峰健康母驼采集乳样,初乳于产后0~7 d采集,常乳于产后35~40 d采集,每峰驼采集100 mL,等量混合分装至500 mL灭菌瓶中置于冰盒保存运输至实验室,-80 ℃保存备用。
米根脂肪酶(≥30 U/mg)、胃蛋白酶(≥2 500 U/mg)、脂肪酶(≥125 U/mg)、胰蛋白酶(13 000~20 000 U/mg),Sigma公司;猪胆汁,Coolaber(中国北京);BCA蛋白质分析试剂盒、SDS-PAGE凝胶制备试剂盒,北京索莱宝科技有限公司;其他材料均为标准分析级。
1.2 仪器与设备
TS-211B型全温摇床,常州金坛良友仪器有限公司;PowerPacTMBasic型电泳仪,伯乐生命医学产品(上海)有限公司;Essentia LC-16AAA型氨基酸分析仪,日本岛津公司;1290 Infinity LC型超高效液相色谱仪、7890B型气相色谱仪、5977B MSD型质谱仪,美国Agilent公司;AB SCIEX Triple TOF 6600型质谱仪,美国SCIEX公司。
1.3 实验方法
1.3.1 模拟婴儿体外消化
参考MINEKUS等[15]的方法配制胃液(simulated gastric fluid,SGF)与肠液(simulated intestinal fluid,SIF),根据MÉNARD等[16]的方法建立静态婴儿体外胃肠消化模型,并参考PAN等[17]的方法确定脂肪酶的添加量。首先,取20 mL驼乳样品与SGF(体积比5∶4)在37 ℃下混合,加入米根脂肪酶(19 U/mL)和胃蛋白酶(268 U/mL)并将pH值调整到5.3,以120 r/min的速度在恒温摇床连续摇动120 min,将胃内容物与SIF(体积比5∶4)混合,加入脂肪酶(90 U/mL)、胰蛋白酶(16 U/mL)和胆盐(3 mmol/L),将pH值调整为6.6并以120 r/min在恒温摇床连续摇动120 min。将胃消化产物调节pH值至7使酶灭活,将肠消化产物在100 ℃下加热10 min使酶灭活,待温度降至室温后置-20 ℃备用。
1.3.2 蛋白含量的测定
根据BCA蛋白质分析试剂盒说明书对各阶段消化产物的蛋白含量进行测定。
1.3.3 SDS-PAGE
根据SDS-PAGE凝胶制备试剂盒说明书配制凝胶,采用12%(质量分数)SDS-PAGE在常温下以恒定电压(80 V)进行表征,取出凝胶后,使用考马斯亮蓝染色后拍照分析。
1.3.4 游离氨基酸的测定
按照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》采用氨基酸分析仪进行测定。
1.3.5 LC-MS非靶代谢脂质组学测定
各阶段消化产物分别取适量加入1 mL V(甲醇)∶V(乙腈)∶V(水)=2∶2∶1进行充分涡旋混匀,低温下进行超声破碎,-20 ℃孵育1 h沉淀蛋白质,13 000 r/min、4 ℃离心15 min,取上清冻干,用超高效液相色谱系统(ultra high performance liquid chromatography,UHPLC)分离,柱温25 ℃,流速0.5 mL/min,进样量2 μL,流动相组成A:水+25 mmol/L乙酸铵+25 mmol/L氨水,B:乙腈,进行梯度洗脱。后加入100 μL乙腈水溶液[V(乙腈)∶V(水)=1∶1]复溶,涡旋,14 000×g 4 ℃离心15 min,取上清液分别采用电喷雾电离(electrospray ionization,ESI)正离子和负离子模式进行质谱仪分析。ESI源设置参数如下:雾化气辅助加热气1(Gas1):60,辅助加热气2(Gas2):60,气帘气:30 psi,离子源温度:600 ℃,喷雾电压±5 500 V(正负2种模式)。原始数据经ProteoWizard转换成.mzML格式,然后采用XCMS程序进行峰对齐、保留时间校正和提取峰面积。脂解度(degree of lipolysis,LD)的计算如公式(1)所示:
(1)
式中:LD、[FFAs]、[TAGs]、[DAGs]和[MAGs]分别代表脂解度、游离脂肪酸(free fatty acids, FFAs)、甘油三酯(triacylglycerols, TAGs)、甘油二酯(diacylglycerols, DAGs)、单甘酯(monoacylglycerols, MAGs)的浓度。
1.3.6 GC-MS靶向中长链脂肪酸的测定
各阶段消化产物分别取适量加入5 mL二氯甲烷-甲醇溶液(体积比2∶1),涡旋混匀,加入2 mL的金标水洗涤,取下层溶液,氮气吹干。加入2 mL正己烷,加入内标,甲酯化0.5 h,加入2 mL金标水,吸取上清液2 000 μL,氮气吹干,加入正己烷复溶,取上清加入进样瓶,进入GC-MS检测。样品采用毛细管柱(Agilent 19091S-433UI:HP-5 ms,30 m×250 μm×0.25 μm)气相色谱系统进行分离,初始温度80 ℃,以20 ℃/min,升温至180 ℃并维持8 min,再以5 ℃/min升温至280 ℃并维持3 min,载气为氦气载气流速1.0 mL/min。后采用5977B MSD质谱仪(Agilent)进行质谱分析,进样口温度280 ℃,离子源温度230 ℃,传输线温度250 ℃,电子轰击电离(electron impact,EI)源,电子能量70 eV,采用SCAN/SIM模式检测待测物。后采用MSD ChemStation软件提取色谱峰面积及保留时间,绘制标准曲线,计算样品中中长链脂肪酸的含量。
1.3.7 共聚焦激光扫描显微镜
脂肪用Nile Red(尼罗红)染色,蛋白质用荧光异硫氰酸物(fluorescein isothiocyanate,FITC)染色。样品上下倒置4~5次混匀,吸取1 mL于1.5 mL的离心管,加入20 μL 1%(质量分数)的Nile Red,上下倒置混匀,室温避光染色30 min,再加入20 μL 0.5%(质量分数)FITC,混匀,室温避光染色30 min,盖上盖玻片,然后在激光共聚焦显微镜上倒置拍照(600倍比例尺20 μm;Nile Red的Ex/Em为535/572 nm;FITC的Ex/Em为488/519)。
1.4 数据分析
每个试验平行3次,结果以“平均值±标准差”表示。采用SPSS statistics 26软件独立样本T检验和单因素ANOVA检验进行显著性分析(P<0.05为存在显著性差异)。采用Origin 2022绘制折线图和柱状图。采用https://www.chiplot.online/#Heatmap绘制圈型聚类热图。采用https://www.bioincloud.tech/task-list绘制百分比堆积柱状图。
2 结果与分析
2.1 不同消化时间的蛋白质分析
2.1.1 不同消化时间蛋白质含量的变化
本试验使用BCA蛋白测定试剂盒测定了驼初乳与常乳在各消化阶段中的总蛋白含量,结果如图1所示。消化前(G0),驼初乳与常乳的蛋白含量分别为48.28 mg/mL和37.55 mg/mL。在胃的消化阶段的G0~G30,驼初乳和常乳的蛋白浓度急剧下降,而在G30~G120阶段两者蛋白浓度保持稳定,这表明在模拟婴儿胃条件下驼乳中的可溶性蛋白质未被胃蛋白酶大量水解。进入肠消化30 min(I30),两者出现了急剧的下降,持续至肠消化结束,表明胰蛋白酶加入后胃消化液中的蛋白质被迅速水解,并持续将其水解为肽。在整个消化过程中,驼初乳的蛋白含量始终高于常乳,消化结束(I120)两者差异不显著(P>0.05)。
2.1.2 不同消化时间的SDS-PAGE图谱
驼初乳与常乳在不同消化时间下蛋白质的变化如图2所示。驼初乳的蛋白带的强度更高,尤其是在较高的分子质量范围内,这与SUN等[14]早前报告的山羊初乳中高分子质量蛋白质比例较大的观点一致。且驼常乳蛋白质的消化速率比驼初乳快,该结果与图1蛋白含量的变化一致。在驼初乳中,α-CN的含量相对较高,β-CN和κ-CN的含量相对较低,而在常乳中β-CN相对较高,κ-CN的含量相对较低,与ROY等[6]报道的驼乳酪蛋白质组成一致。随着消化时间的延长,驼乳蛋白质条带逐渐变浅,在胃消化阶段,酪蛋白首先经历水解,进入肠消化阶段后,在胰蛋白酶的作用下乳铁蛋白、血清白蛋白和α-乳清蛋白逐渐被消化。在驼初乳中,乳铁蛋白在肠道消化后30 min(I30)消失,而血清白蛋白仍未被消化。在常乳中,乳铁蛋白和血清白蛋白在肠道消化后30 min消失。据研究表明,乳铁蛋白和血清白蛋白在肠道阶段部分持续存在,以保护免疫活性蛋白免受降解,支持婴儿肠道对抗病原体的抵抗力[17]。由此可推论,驼初乳在促进婴儿免疫系统方面起到有益的作用。另外,驼乳中含有人乳与牛乳所没有的PGRP1蛋白,该蛋白在分子质量19 kDa条带,可以与细胞壁中的肽聚糖结构结合抑制病原体的生长,这对婴儿建立免疫系统方面有着重要的作用[18]。
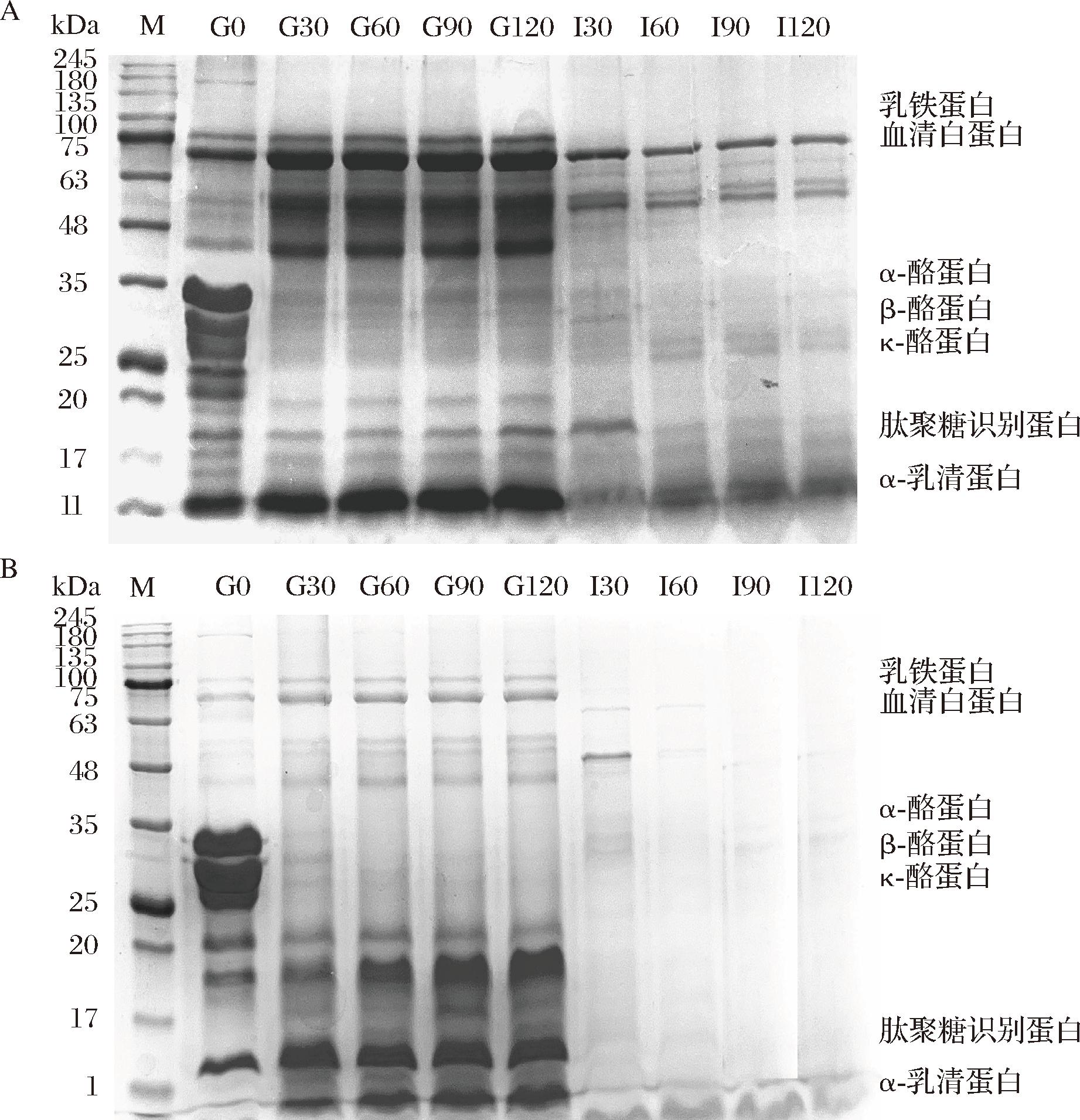
图2 驼初乳和常乳各阶段消化产物的SDS-PAGE电泳图
Fig.2 SDS-PAGE of proteolysis products of camel colostrum and mature milk during the in vitro gastrointestinal digestion process
2.1.3 不同消化时间的游离氨基酸的变化
氨基酸是蛋白质的基本组成单位,通过测定游离氨基酸的含量可以指示蛋白质的水解程度,使用氨基酸分析仪对初乳和常乳及胃肠消化产物进行了测定。结果如图3所示,共检测到16种氨基酸,随着消化时间的延长,驼乳蛋白进一步充分水解,驼初乳和常乳样品中各游离氨基酸的含量均增加。驼初乳中初始游离氨基酸含量为(3.79±0.07) mg/100 mL,常乳为(3.37±0.05) mg/100 mL;肠消化120 min(I120),游离氨基酸含量急剧增多,驼初乳的含量为(64.37±0.97) mg/100 mL,常乳为(58.59±1.26) mg/100 mL,表明进入肠道消化后,伴随着胰蛋白酶加入,胃阶段剩余的蛋白质被迅速水解,生成了大量的游离氨基酸,这与图1蛋白含量的变化一致,因此可以说明驼初乳和常乳蛋白质都能在婴儿的体内得到充分的消化。另外,在胃肠消化过程中,驼初乳和常乳都产生了大量的必需氨基酸,初乳中必需氨基酸的含量在各阶段均大于常乳。供应充足的必需氨基酸对婴儿的生长发育至关重要,其中赖氨酸(lysine,Lys)、缬氨酸(valine,Val)、亮氨酸(leucine,Leu)和异亮氨酸(isoleucine,Ile)均可以促进婴儿肌肉和骨骼的生长发育,苏氨酸(threonine,Thr)能够参与维生素、能量和核酸的代谢,苯丙氨酸(phenylalanine,Phe)对婴儿的神经系统发育和认知能力起着重要作用[19]。由此说明,相较于驼常乳,初乳蛋白水解可产生了更多的游离氨基酸,这将有利于婴儿的生长发育,具有更高的营养价值。
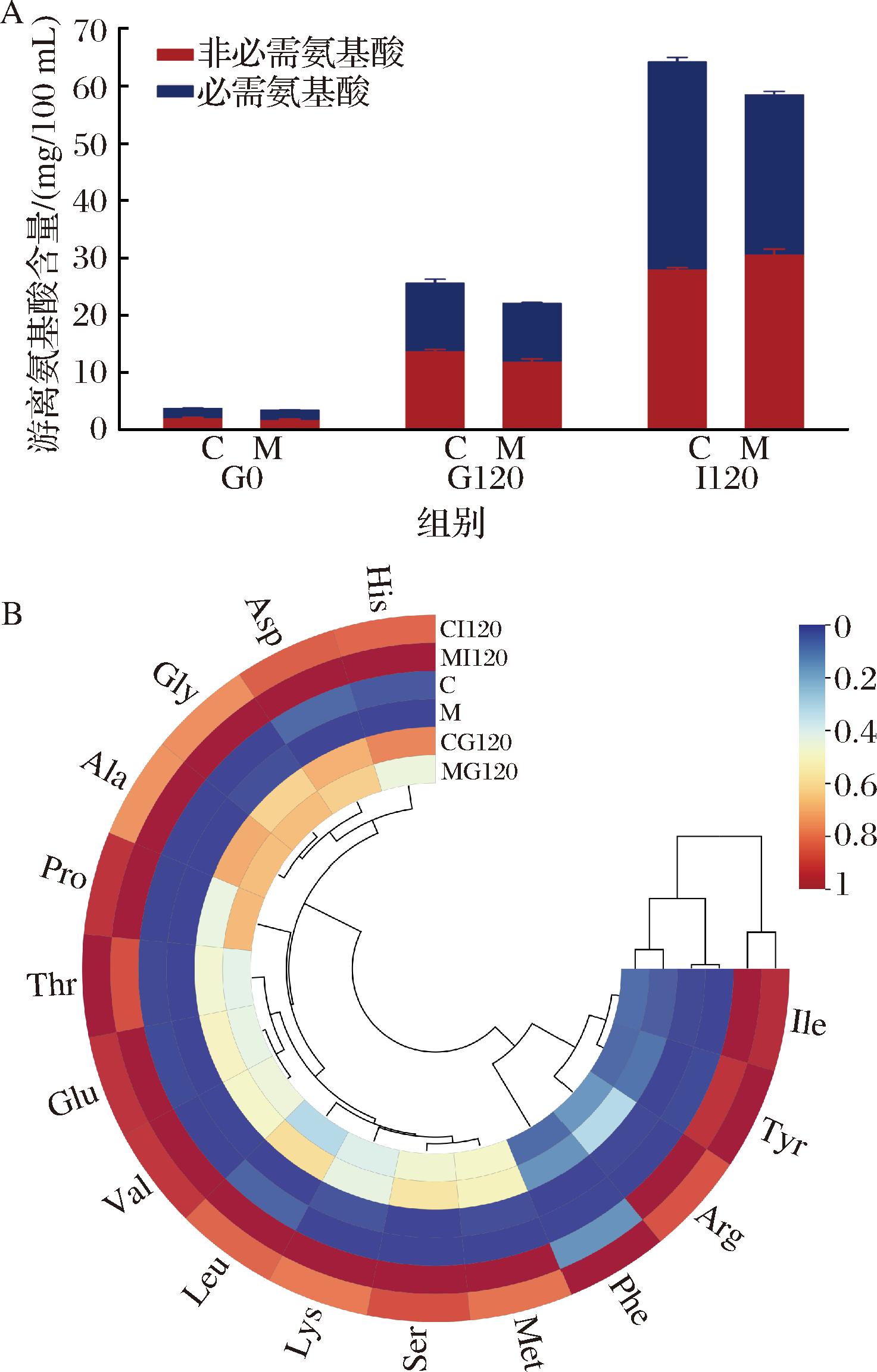
A-堆积柱状图;B-圈型聚类热图
图3 驼初乳和常乳胃肠消化终产物的游离氨基酸含量
Fig.3 Contents of free amino acids in gastrointestinal digestion end products of camel colostrum and mature milk
注:C表示初乳;M表示常乳(下同)。
2.2 不同消化时间的脂肪分析
2.2.1 不同消化时间脂肪的水解程度
为了探究驼初乳和常乳在消化过程中脂类水解的变化,本试验对胃肠终产物的脂肪水解速率(degree of lipolysis,LD)进行了测定,如图4所示。从消化开始到胃消化120 min(G0~G120),驼初乳和常乳脂肪水解速率略有增加,到肠消化120 min(I120),脂解活性迅速升高,引起肠道消化的脂解水平升高,这一趋势与先前关于母乳、牛乳和羊乳的研究结果一致[17],即脂肪在胃消化中不明显,而在肠消化阶段迅速脂解。胃消化120 min(G120),驼初乳和常乳的脂肪水解度分别为(7.66±1.47)%和(12.57±1.42)%,存在显著差异(P<0.05)。肠消化结束后,驼初乳中的脂肪水解程度比常乳高,分别为(47.32±3.40)%和(40.26±2.33)%,存在显著差异(P<0.05)。这种现象可能归因于乳脂球膜(milk fat globule membrane,MFGM)的表面积、界面厚度和成分之间会影响脂肪水解程度[20-23]。在肠道阶段,胆盐取代了部分原始乳化剂,改变了乳脂球的初始结构,随后引起了初乳脂肪水解速率的增加[24]。另外,脂肪水解程度与乳脂球(milk fat globule, MFG)的大小成反比,颗粒越小,相对表面积越大,脂肪消化速度越快[25]。据研究表明,驼乳脂肪颗粒(2.99 mm)明显小于水牛乳(8.7 mm)、牛乳(3.95 mm)和山羊乳(3.19 mm)[10]。LIU等[26]研究中驼乳的脂解速率最低,MEENA等[12]研究中驼乳最高,本试验的结果与LIU等[26]的趋势比较相近,与MEENA等[12]的研究结果不同。这种差异可能是与骆驼的品种、饮食、生活环境有关,这也可能是由于在脂肪消化过程中,蛋白质被消化和分解成氨基酸,在消化过程中对pH的变化有一定的缓冲作用,此外,驼乳蛋白质的颗粒大小较小,也可能导致其消化速度较慢[27]。
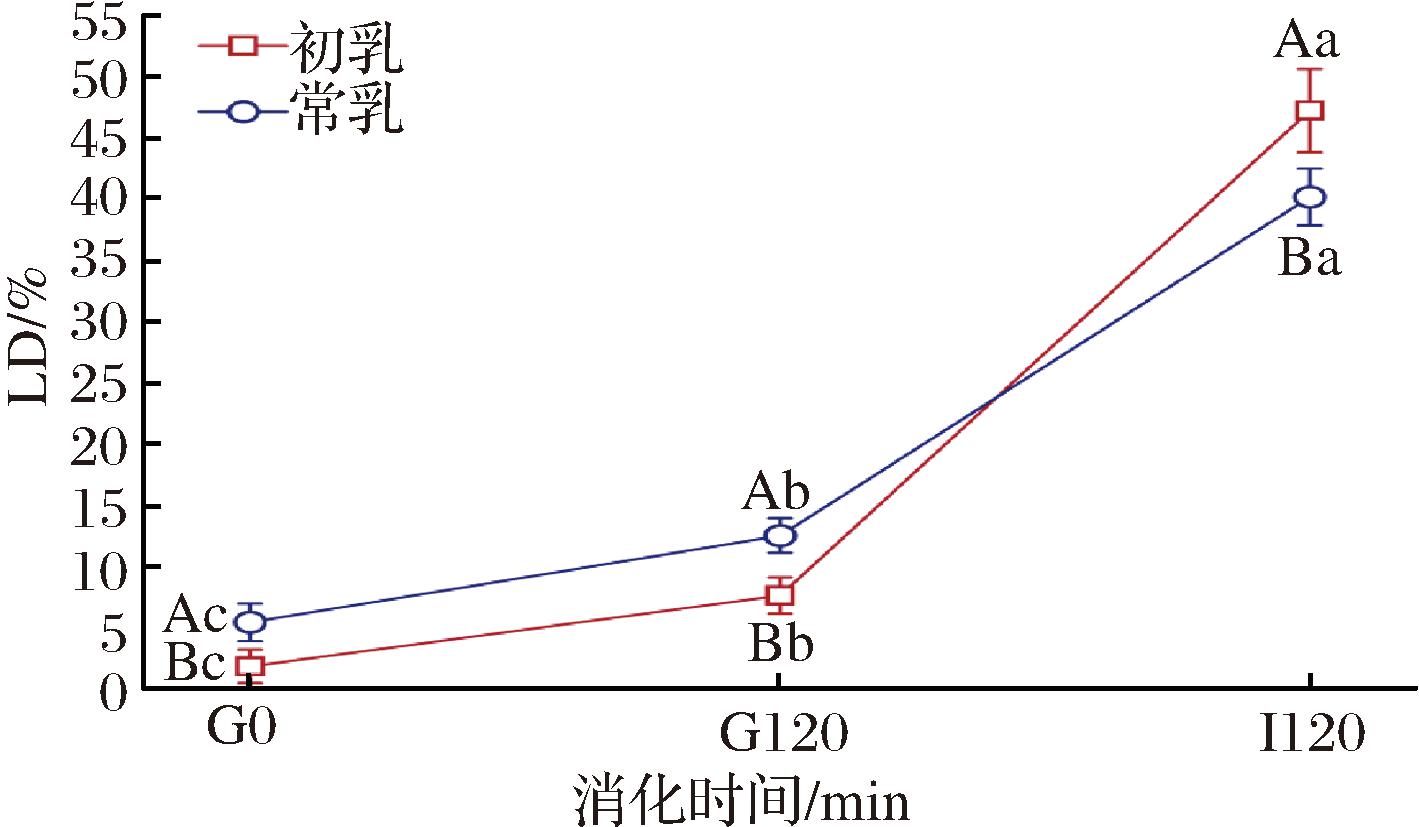
图4 驼初乳和常乳胃肠消化终产物的脂肪水解程度
Fig.4 Lipolysis degree of gastrointestinal digestion end products of camel colostrum and mature milk
2.2.2 不同消化时间脂肪的含量比较
为了更深入地了解脂质消化的过程,本研究对驼初乳和常乳在胃肠消化过程中脂肪含量进行了测定,结果如图5所示。消化前(G0),TAGs的含量超过90%,驼初乳极显著高于常乳(P<0.001),而DAGs常乳极显著高于初乳(P<0.001)。在胃消化120 min(G120),驼初乳TAGs的含量显著低于常乳(P<0.01),而DAGs和MAGs显著高于常乳(P<0.01),说明初乳快速消化,TAGs转变为DAGs和MAGs。肠消化120 min(I120),驼初乳和常乳中的TAGs和DAGs没有显著性差异(P>0.05),说明初乳和常乳在经过肠道消化后,TAGs得到了充分的水解。驼初乳和常乳各消化阶段共检测出34种脂肪酸,其中单不饱和脂肪酸(monounsaturated fatty acids, MUFA)最多,其次是饱和脂肪酸(saturated fatty acids, SFA),多不饱和脂肪酸(polyunsaturated fatty acids, PUFA)含量最少。
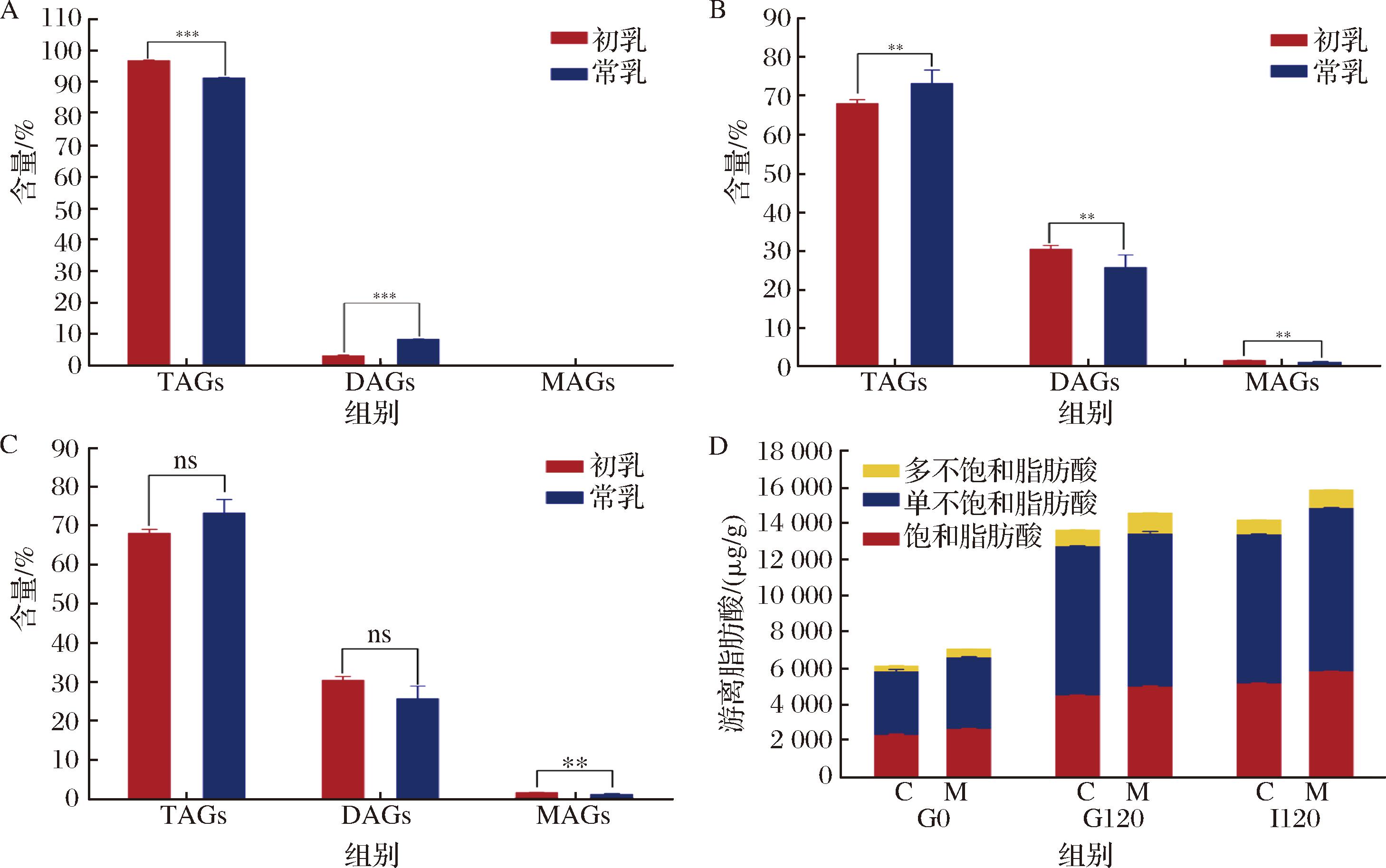
A-TAGs、DAGs和MAGs在G0时含量;B-TAGs、DAGs和MAGs在G120时含量;C-TAGs、DAGs和MAGs在I120时含量;D-FFAs含量变化
图5 驼初乳和常乳胃肠消化过程中脂肪含量的变化
Fig.5 Changes in fat content during gastrointestinal digestion of camel colostrum and mature milk
注:ns:无显著性差异;**:P<0.01;***:P<0.001。
随着消化时间的延长,驼初乳和常乳游离脂肪酸含量均逐渐增加,在消化结束时总释放量分别为14 176.21 μg/g和15 850.93 μg/g。此外,从消化开始到结束(G0~I120),都是驼常乳释放的FFAs含量大于初乳,这个结果与ZHANG等[28]对不同泌乳期山羊乳的研究结果一致。
2.2.3 不同消化时间脂肪的组成比较
对驼初乳和常乳胃肠消化过程中脂肪的组成进行了测定,如图6所示。在消化开始前(G0),驼初乳和常乳TAGs的碳原子数集中在40~50,其中50:2、52:2、52:1、48:2和46:1含量最丰富,主要以偶数碳原子为主,与对人乳和牛乳的先前研究结果一致[2];DAGs集中在30~36个碳原子,常乳前15种占比高于初乳;MAGs中含量最丰富的是32:1、32:0和18:3e。在胃消化120 min(G120),TAGs中46:2和48:2的占比明显减少,表明它们的消化更快,这可能与脂肪酶的选择性有关;DAGs中前15种各占比都有增加;MAGs中32:0和18:3e明显增加,32:1明显减少,初乳中的变化更加显著,这个结果与图5中含量变化一致。在肠消化120 min(I120),驼初乳的TAGs中46:0和44:0的含量比例减少,而常乳则呈增加趋势;DAGs和MAGs的前15种含量比例显著增加,其中DAGs的各组分占比没有明显变化,而MAGs中32:0持续明显增加,18:3e减少,这表明肠消化过程中,MAGs的变化更加强烈,其次是DAGs。而整个消化过程中,FFAs的成分比例没有明显变化。饱和脂肪酸中,肉豆蔻酸(C14:0)、硬脂酸(C16:0)和亚麻酸(C18:0)含量较为丰富。单不饱和脂肪酸中,棕榈油酸(C16:1)和油酸(C18:1)含量最高,而在多不饱和脂肪酸中,亚麻油酸(C18:2)最为丰富。这与之前BOURLIEU等[29]的研究一致,这种情况主要是由于脂肪酶对甘油三酯的Sn-3位点具有较强的选择性,导致该位置的酰基首先被释放。C18:1的生成对于婴儿的健康具有多种好处,它有助于大脑和视觉系统的发育,并在免疫调节中发挥着重要作用[30]。此外,相对较高含量的C16:0、C16:1和C14:0脂肪酸有助于婴儿的细胞结构和生长发育,同时在神经系统和脑部发育中扮演关键角色[31]。其中,C16:0是细胞膜的重要组成部分,促进细胞结构和功能,从而有助于细胞健康。而C16:1则有助于维持正常的血脂水平和心血管健康,并具有一定的抗炎和抗氧化作用[32]。

A-TAGs;B-DAGs;C-MAGs;D-FFAs
图6 驼初乳和常乳胃肠消化终产物的柱状百分比堆积图
Fig.6 Columnar percentage plot of gastrointestinal digestion end products of camel colostrum and mature milk
2.3 不同消化时间的微观结构分析
使用共聚焦显微镜观察了驼初乳和常乳初始及胃肠消化终产物。如图7所示,绿色为蛋白质,红色为脂肪。在消化开始前(G0),初乳和常乳中的蛋白质均匀稳定地分散在体系中,脂肪呈球状分布。胃消化120 min(G120),驼初乳和常乳中蛋白质聚集在一起形成块状,主要是由于婴儿胃pH环境下,胃蛋白酶的活性较弱,另外脂肪球明显破碎,形成聚集现象,常乳中脂肪的聚集尤其明显,这是由于蛋白质存在为水相,其水解主要通过与脂肪的结合影响脂肪酶解。肠消化120 min(I120),在两者中都观察到较少的脂肪球,蛋白质和脂肪都得到了更好的消化,大块状的蛋白质由于胰蛋白酶的作用一部分分解为破碎的小块,一部分分解为肽段和游离氨基酸,聚集的脂肪球也在脂肪酶的作用下分解。电镜的结果与图1蛋白含量变化和图4脂肪水解程度的结果一致,都表现出胃中消化缓慢、肠中迅速水解的现象。
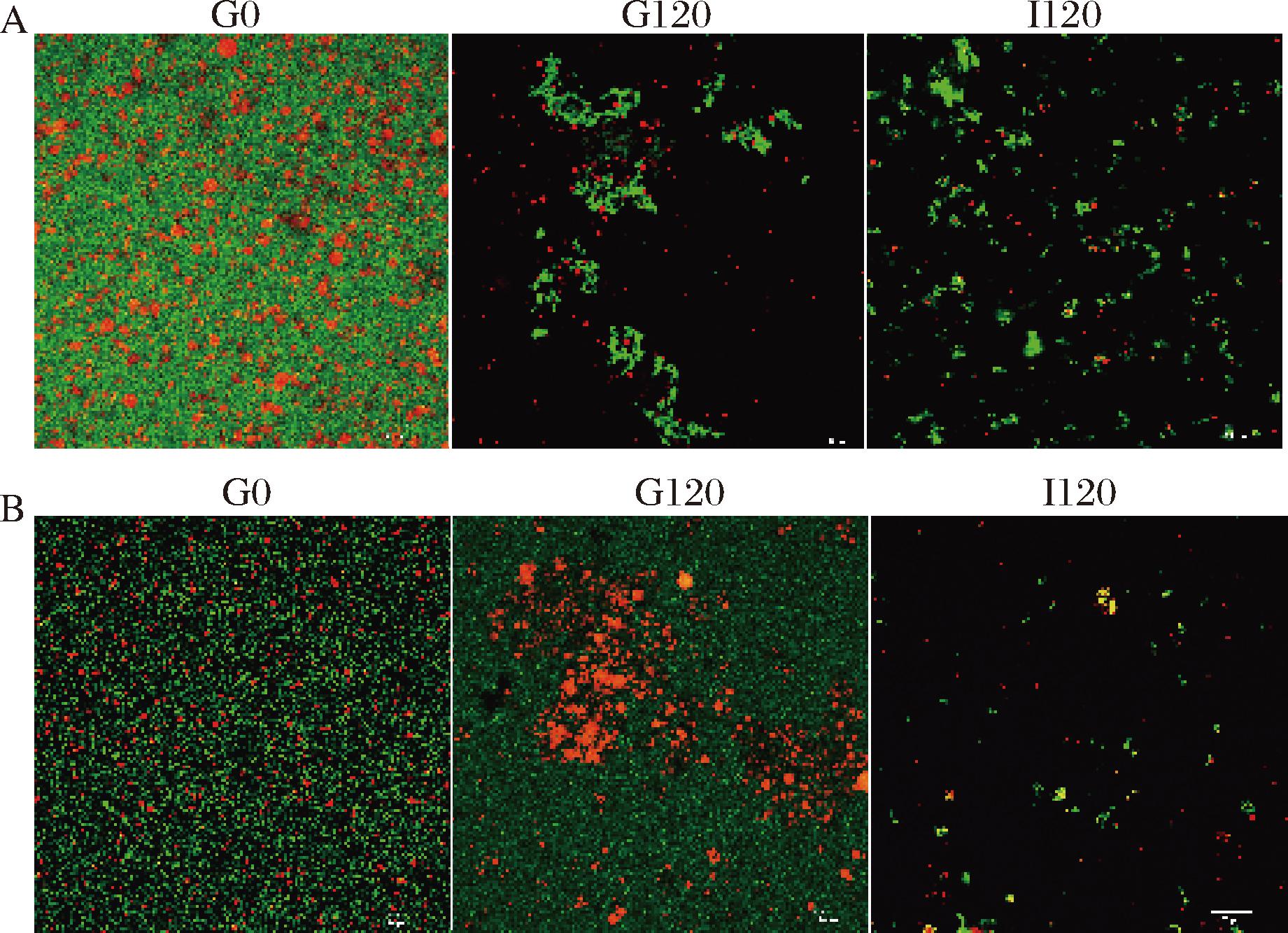
A-初乳;B-常乳
图7 驼初乳和常乳胃肠消化终产物的微观结构
Fig.7 Microstructure of gastrointestinal digestion end products of camel colostrum and mature milk
3 结论
本研究通过体外模拟婴儿胃肠消化模型,探究了驼初乳和常乳中蛋白质和脂质的消化行为,结果发现驼初乳和常乳中的蛋白质和脂肪在胃中的消化速度缓慢,进入肠道后都能够充分水解。在蛋白水解测定中发现,驼初乳中蛋白质对婴儿肠道免疫系统的建立有重要的作用,并且产生了更多的游离氨基酸供婴儿生长发育。在脂肪水解测定中发现,驼初乳和常乳都能被婴儿充分地消化,初乳TAGs水解更多,产生的DAGs和MAGs也更多,但是常乳产生了更多的FFAs。由此可知,驼初乳和常乳在婴儿的消化模型下都能得到很好的消化,产生的游离氨基酸和游离脂肪酸有利于婴儿的生长发育,并且驼初乳对婴儿的免疫系统有一定的益处,为驼乳在婴儿配方奶粉方面的应用提供了理论和依据。
[1] MICHAELSEN K F, GREER F R.Protein needs early in life and long-term health[J].The American Journal of Clinical Nutrition, 2014, 99(3):718S-722S.
[2] ZHAO P, YANG X, LI D, et al.Development of in vitro digestion simulation of gastrointestinal tract to evaluate lipolysis and proteolysis:Comparison of infant model digestion of breast milk and adult model digestion of cow milk[J].Food Hydrocolloids, 2023, 142:108859.
[3] JIANG H, XU Y X, CHEN G L, et al.Digestive properties and peptide profiles exhibited significant differences between skim camel milk and bovine milk powder after static in vitro simulated infant gastrointestinal digestion[J].Food Research International, 2024, 178:113860.
[4] JIANG H Y, GALLIER S, FENG L F, et al.Development of the digestive system in early infancy and nutritional management of digestive problems in breastfed and formula-fed infants[J].Food &Function, 2022, 13(3):1062-1077.
[5] BENMEZIANE-DERRADJI F.Evaluation of camel milk:Gross composition-a scientific overview[J].Tropical Animal Health and Production, 2021, 53(2):308.
[6] ROY D, YE A Q, MOUGHAN P J, et al.Composition, structure, and digestive dynamics of milk from different species-a review[J].Frontiers in Nutrition, 2020, 7:577759.
[7] ZOU Z Z, DULEY J A, COWLEY D M, et al.Digestibility of proteins in camel milk in comparison to bovine and human milk using an in vitro infant gastrointestinal digestion system[J].Food Chemistry, 2022, 374:131704.
[8] IZADI A, KHEDMAT L, MOJTAHEDI S Y.Nutritional and therapeutic perspectives of camel milk and its protein hydrolysates:A review on versatile biofunctional properties[J].Journal of Functional Foods, 2019, 60:103441.
[9] GOULDING D A, FOX P F, O'MAHONY J A. Milk Proteins[M]. Amsterdam: Elsevier, 2020:21-98.
[10] EL-ZEINI H M.Microstructure, rheological and geometrical properties of fat globules of milk from different animal species[J].Polish Journal of Food and Nutrition Sciences, 2006, 15(2):147-153.
[11] MAQSOOD S, AL-DOWAILA A, MUDGIL P, et al.Comparative characterization of protein and lipid fractions from camel and cow milk, their functionality, antioxidant and antihypertensive properties upon simulated gastro-intestinal digestion[J].Food Chemistry, 2019, 279:328-338.
[12] MEENA S, RAJPUT Y S, SHARMA R.Comparative fat digestibility of goat, camel, cow and buffalo milk[J].International Dairy Journal, 2014, 35(2):153-156.
[13] QURESHI T M, YASEEN M, NADEEM M, et al.Physico-chemical composition and antioxidant potential of buffalo colostrum, transition milk, and mature milk[J].Journal of Food Processing and Preservation, 2020, 44(10):e14763.
[14] SUN Y X, WANG C N, SUN X M, et al.Protein digestion properties of Xinong Saanen goat colostrum and mature milk using in vitro digestion model[J].Journal of the Science of Food and Agriculture, 2019, 99(13):5819-5825.
[15] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food-an international consensus[J].Food &Function, 2014, 5(6):1113-1124.
[16] MÉNARD O, BOURLIEU C, DE OLIVEIRA S C, et al.A first step towards a consensus static in vitro model for simulating full-term infant digestion[J].Food Chemistry, 2018, 240:338-345.
[17] PAN Y, XIA Y, YU X X, et al.Comparative analysis of lipid digestion characteristics in human, bovine, and caprine milk based on simulated in vitro infant gastrointestinal digestion[J].Journal of Agricultural and Food Chemistry, 2021, 69(35):10104-10113.
[18] KAPPELER S R, HEUBERGER C, FARAH Z, et al.Expression of the peptidoglycan recognition protein, PGRP, in the lactating mammary gland[J].Journal of Dairy Science, 2004, 87(8):2660-2668.
[19] WU G Y.Functional amino acids in nutrition and health[J].Amino Acids, 2013, 45(3):407-411.
[20] MICHALSKI M C, BRIARD V, MICHEL F, et al.Size distribution of fat globules in human colostrum, breast milk, and infant formula[J].Journal of Dairy Science, 2005, 88(6):1927-1940.
[21] GALLIER S, VOCKING K, POST J A, et al.A novel infant milk formula concept:Mimicking the human milk fat globule structure[J].Colloids and Surfaces B:Biointerfaces, 2015, 136:329-339.
[22] FONDACO D, ALHASAWI F, LAN Y, et al.Biophysical aspects of lipid digestion in human breast milk and SimilacTM infant formulas[J].Food Biophysics, 2015, 10(3):282-291.
[23] SALVIA-TRUJILLO L, VERKEMPINCK S H E, SUN L, et al.Lipid digestion, micelle formation and carotenoid bioaccessibility kinetics:Influence of emulsion droplet size[J].Food Chemistry, 2017, 229:653-662.
[24] LUO J, WANG Z W, LI Y R, et al.The simulated in vitro infant gastrointestinal digestion of droplets covered with milk fat globule membrane polar lipids concentrate[J].Journal of Dairy Science, 2019, 102(4):2879-2889.
[25] ABRAHAMSE E, MINEKUS M, VAN AKEN G A, et al.Development of the digestive system-experimental challenges and approaches of infant lipid digestion[J].Food Digestion, 2012, 3(1-3):63-77.
[26] LIU B, LIANG Y H, HE Y Z, et al.Differences in fat digestion from milk of different species:In vitro gastrointestinal digestion model for infants[J].Food Research International, 2023, 174:113571.
[27] SWELUM A A, EL-SAADONY M T, ABDO M, et al.Nutritional, antimicrobial and medicinal properties of camel’s milk:A review[J].Saudi Journal of Biological Sciences, 2021, 28(5):3126-3136.
[28] ZHANG Y, ZHENG Z J, TAN C P, et al.Digestion and absorption behaviors of goat milk fat from different lactation stages:An in-vitro comparative study[J].Food Bioscience, 2024, 58:103674.
[29] BOURLIEU C, MÉNARD O, BOUZERZOUR K, et al.Specificity of infant digestive conditions:Some clues for developing relevant in vitro models[J].Critical Reviews in Food Science and Nutrition, 2014, 54(11):1427-1457.
[30] GEORGE A D, GAY M C L, WLODEK M E, et al.The fatty acid species and quantity consumed by the breastfed infant are important for growth and development[J].Nutrients, 2021, 13(11):4183.
[31] JIANG T M, LIU B, LI J F, et al.Association between Sn-2 fatty acid profiles of breast milk and development of the infant intestinal microbiome[J].Food &Function, 2018, 9(2):1028-1037.
[32] SHRAMKO V S, POLONSKAYA Y V, KASHTANOVA E V, et al.The short overview on the relevance of fatty acids for human cardiovascular disorders[J].Biomolecules, 2020, 10(8):1127.