氨基甲酸乙酯(ethyl carbamate,EC),也称尿烷、乌拉坦,曾被用于纺织工业、化学品生产中的助溶剂、药物助溶剂等。2007年,基于实验和流行病学数据,EC被国际癌症研究机构(International Agency for Research on Cancer,IARC)列为2A级致癌物,即“可能的人类致癌物”[1]。人类接触EC的主要来源是发酵食品和饮料,如奶酪、面包、酸奶、腐乳、酱油、威士忌、白兰地、葡萄酒、泡菜等[2]。国际食品法典委员会(Codex Alimentarius Commission,CAC)指出,人类平均每天从酒精饮料中摄入的EC的量达到65 ng/kg体重[3],比通过发酵食品摄入的多4倍。因此,酒精饮料是人类摄入EC的主要来源。为了限制酒精饮料中的EC含量,保障食品安全,许多国家对流入市场的酒精饮料制定了EC的限制标准,特别是针对EC含量较高的谷物蒸馏酒类。加拿大、巴西、法国、日本等国家规定市场流通的蒸馏酒中的EC含量应低于150 μg/L。然而,中国白酒中曾检出高于上述国家限制标准的EC[4-5],带来了许多食品安全问题,也为中国酒类饮料的出口贸易带来了局限。
目前,酒精饮料中的EC生成机制受到了广泛关注,国内外已有一些针对酒精饮料中EC形成机制及消除方法的研究。但与葡萄酒、黄酒、以及白兰地、威士忌、朗姆酒、伏特加等其他蒸馏酒相比,中国白酒的工艺特点主要体现在以下方面:发酵过程在固态体系中进行、发酵所用微生物通过大曲自然接种、出酒方式为酒醅高温蒸馏、长时间的贮存。白酒的原辅料复杂、EC前体种类较多、不同香型白酒的酿造工艺、所用发酵剂的性质、参与发酵的微生物都存在较大差异。酱香型白酒作为白酒的代表,是通过投料、发酵、蒸馏等不同工艺多批次循环酿造而成。其酿造时间长,酿造工艺尤为复杂,影响EC代谢的因素较多,且彼此之间具有互相影响的机制[6]。根据以往的研究,EC主要是由多种EC前体在发酵、蒸馏、贮存过程中与乙醇反应形成的。前体包括尿素、氰化物、瓜氨酸等[7]。然而,由于酱香型白酒独特的工艺和所涉及的微生物复杂的代谢活动,其中EC的形成机制尚不清楚,这给消除EC带来了挑战。因此需要对酱香型白酒原辅料中EC前体的来源和不同工艺阶段EC的形成机理进行深入的研究。
本研究对酱香型白酒中不同原辅料、不同工艺节点的EC及其前体进行了检测,明确了酱香型白酒酿造过程中EC前体的来源,分析了不同工艺阶段中EC代谢的特点,为进一步研究酱香型白酒中的EC代谢机制提供了参考。
1 材料与方法
1.1 实验材料
1.1.1 实验材料
谷壳、大曲、高粱、酒醅,我国某酒厂;胰蛋白胨、酵母粉,英国oxoid公司;氯化钠、柠檬酸高铁铵,上海国药集团化学试剂有限公司;七叶苷,上海麦克林生化科技股份有限公司。
1.1.2 培养基
富集培养基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 10.0,百脉根苷0.015,苦杏仁苷0.015,蜀黍糖苷0.015;七叶苷培养基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 10.0,七叶苷3.0,柠檬酸高铁铵2.5;平板培养基再加入琼脂粉15.0 g/L。
1.2 仪器与设备
1200高效液相色谱,安捷伦科技(中国)有限公司;高分辨气质联用仪(质谱型号ExativeGC,气相型号Trace1310)、单四级杆气质联用仪(质谱型号ISQ LT,气相型号Trace1310),美国Thermo Scientific公司;GR60DA高压蒸汽灭菌锅,美国Zealway公司;Synergy H1多功能酶标仪,美国伯腾仪器有限公司;ZQZY-78AE振荡培养箱,上海知楚仪器有限公司;HCCI-116恒温培养箱,上海跃进医疗器械;A35厌氧工作站,英国Don Whitley Scientific公司。
1.3 实验方法
1.3.1 尿素、瓜氨酸、氰化物、EC、生氰糖苷的检测
对于固态样品,称取10.0 g与10.0 mL超纯水混合,超声处理15 min后离心,取上清液检测。尿素的检测方法参考报道过的文献[8],将尿素与占吨氰醇进行衍生化反应后,经高效液相色谱-荧光检测器检测尿素含量。瓜氨酸的检测方法参考报道过的文献[9],柱前衍生后采用高效液相色谱法-紫外检测器检测氰化物的检测参考国标GB 5009.36—2016 《食品中氰化物的测定》,在酸性条件下加入氯胺T后,采用高分辨气相色谱仪检测氰化物含量[10]。EC的检测方法参考报道过的文献[8,11],将10.0 mL样品经EC专用的固相萃取柱萃取后,再加入15.0 mL二氯甲烷冲洗柱子,在旋转蒸发仪中蒸发至0.5 mL,再用色谱级甲醇定容至1.0 mL,采用气相色谱-质谱联用法以内标法检测EC的浓度[12]。生氰糖苷的检测方法参考国标GB NY/T 3607—2020《农产品中生氰糖苷的测定 液相色谱-串联质谱法》。
1.3.2 模拟原辅料蒸煮过程中生氰糖苷的反应
将质量浓度为15.0 mg/L的百脉根苷、苦杏仁苷、蜀黍糖苷在100 ℃下加热100 min来模拟白酒生产时对原辅料的蒸煮过程[13],反应结束后测量氰化物浓度。
1.3.3 代谢生氰糖苷生成氰化物的菌株筛选
七叶苷可被β-糖苷酶分解生成七叶素,而七叶素与柠檬酸高铁铵反应形成黑色化合物[14]。经测定,在400 nm处有最大吸收峰。故可在培养基中添加七叶苷,根据产生的黑色圈的出现来筛选高产β-葡萄糖苷酶的微生物,具体操作如下:称取3.0 g酒醅于50 mL无菌离心管中,加入10.0 mL无菌生理盐水,于漩涡振荡器上充分振荡混匀1 min,取1.0 mL接种至含有50 mL富集培养基的摇瓶中,一份样品在30 ℃的厌氧工作站中培养72 h,一份样品30 ℃振荡培养48 h。以2%的接种量再次接种,循环3次。取三轮富集后的培养液稀释至合适倍数,涂布在七叶苷平板培养基上,30 ℃恒温培养箱中培养至单菌落长出,挑取平板上有黑色圈的菌株进入装有七叶苷液体培养基的96孔板中,30 ℃分别厌氧或振荡培养24 h,检测OD400值,挑选OD400值较高的菌株。
2 结果与分析
2.1 原辅料中EC前体含量变化分析
为了探究酱香型白酒酒醅中EC前体的来源,对酿造原辅料中EC的3种主要前体(尿素、氰化物、瓜氨酸)的含量进行了检测。根据酱香型白酒两次投料、八轮发酵的特殊工艺,对每个工艺节点加入的原辅料(清蒸后谷壳、大曲、高粱)分别进行了检测,结果如图1所示。结果显示,两次投料时加入的高粱原料中仅含有微量的尿素,几乎低于检测限;辅料谷壳中的尿素含量也相对较低,平均含量为2.47 mg/kg;而发酵剂大曲中的尿素含量较高,远高于高粱和谷壳的尿素含量,平均含量高达96.92 mg/kg。因此可以得出结论:酱香型白酒酿造酒醅中的尿素主要来自发酵剂大曲。这可能与大曲的制作工艺有关。酱香型大曲生产工艺复杂,制作过程中物质代谢复杂,会生成多种风味物质,且有多种微生物参与。微生物的氮代谢可能造成大曲中较高的尿素含量。
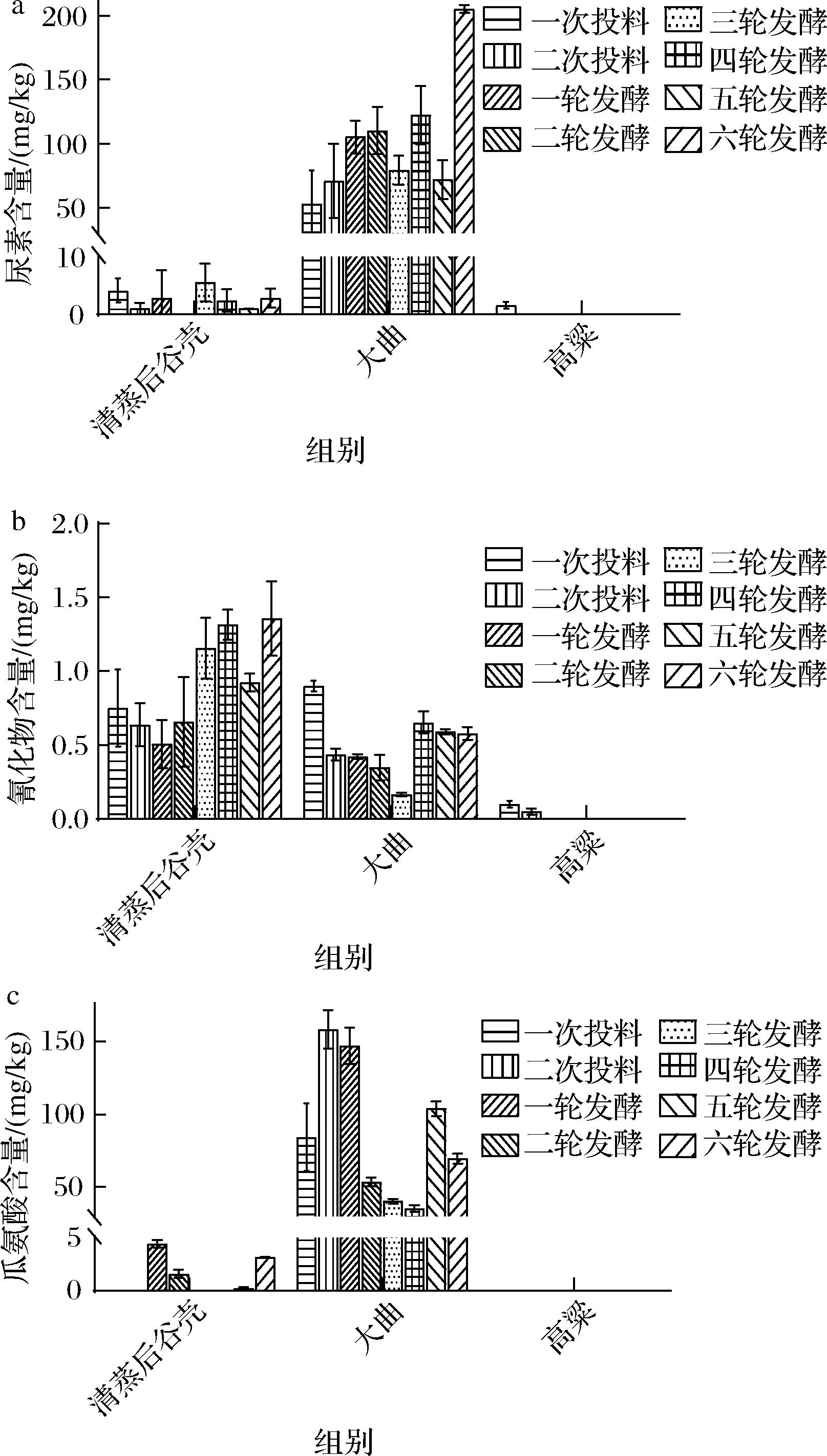
a-原辅料中的尿素含量;b-原辅料中的氰化物含量; c-原辅料中的瓜氨酸含量
图1 原辅料中的EC前体含量变化
Fig.1 Content of EC precursors in raw materials
不同原辅料的瓜氨酸含量的检测结果显示,两次投料时加入的高粱原料中,瓜氨酸含量均低于检测限。辅料谷壳中瓜氨酸含量较低,平均含量为1.17 mg/kg;发酵剂大曲中的瓜氨酸含量较高,不同批次大曲中均检测出远高于高粱和谷壳的瓜氨酸,平均含量达到86.45 mg/kg。因此得出结论:酱香型白酒酿造酒醅中的尿素主要来自于原料中的大曲。瓜氨酸是由精氨酸代谢生成,此过程称为ADI途径(arginine deiminase pathway,ADI),而酱香型白酒酿造最重要的菌株酿酒酵母能将精氨酸代谢为尿素[15]。因此得出结论:尿素和瓜氨酸都与精氨酸的代谢有关,大曲制作过程中的微生物氮代谢会同时造成大曲中较高的尿素和瓜氨酸含量。
在不同原辅料中,和尿素和瓜氨酸不同,在高粱、谷壳、和大曲中均检测到了氰化物,但整体含量低于1.50 mg/kg。原辅料中较低的氰化物含量是由氰化物的性质决定的。在中性及酸性的环境中,氰化物会与氢离子生成氰化氢气体,从而挥发到外界[16]。氰化物在谷壳和大曲的含量均高于高粱,所以得出结论:酱香型白酒由原辅料带入的氰化物可能主要来自谷壳和大曲。综上所述,在原辅料带入白酒酿造的EC前体中,大曲的贡献较高。
2.2 发酵过程中EC及其前体含量变化分析
为了探究酿造过程中EC及其前体含量的变化规律,分析酱香型白酒发酵过程中EC的主要来源,根据酱香型白酒2次投料、8轮发酵的特殊工艺,分别在每轮的拌曲结束、堆积结束、窖内中期、出窖的工艺节点进行取样和检测,并对基酒中EC的含量进行了检测,结果如图2所示。由图2-a可知,酒醅中的尿素含量在整个生产过程中呈上升趋势,经过不断积累,在6轮发酵后达到最高,为28.16 mg/kg。在每次拌曲之后,尿素的含量都有所上升。且6轮发酵所用大曲的尿素含量较高(图1-a),6轮拌曲结束后酒醅中的尿素含量也明显偏高,也说明了尿素主要是由原料中的大曲带入的,与2.1节的结论相符。在大曲带入大量尿素后,微生物可以利用尿素作为氮源,同时也会有酵母菌等微生物代谢精氨酸生成尿素。因此带入和生成的尿素的含量高于微生物利用尿素的含量,导致酒醅中的尿素含量在整个生产过程中不断积累,含量整体呈上升趋势。而在整个生产过程中,酒醅中瓜氨酸的含量没有规律性变化,在一定范围内波动(图2-b)。在整个生产过程中,酒醅中氰化物的含量呈前期较高,后期不断降低,逐渐趋于稳定的变化趋势(图2-c)。根据2.1节的结论,氰化物应主要来自于谷壳和大曲,但生产过程中的含量变化与此结论没有明显的对应,其原因需要进一步分析。整个生产过程中,酒醅中的EC含量逐渐增加,主要是由于发酵过程中EC前体不断形成EC,而EC较难挥发(沸点182 ℃),因此发酵过程形成的EC会在酒醅中不断累积,导致酒醅中EC含量上升,最高达到203.65 μg/kg(图2-d)。

a-发酵过程中的尿素含量;b-发酵过程中的瓜氨酸含量;c-发酵过程中的氰化物含量d-发酵过程中的EC含量
图2 发酵过程中的EC及其前体含量变化
Fig.2 Content of EC and its precursors during fermentation process
综合比较EC在堆积、窖内发酵、蒸馏工艺前后的变化,可以看出在每轮蒸馏后,基酒中的EC含量都出现大幅提升(图2-d)。将贡献度定义为所有轮次此阶段的EC增长量与EC总增长量的比值,将堆积阶段、窖内发酵阶段、蒸馏阶段的贡献度进行了可视化(图3)。可以看出,酱香型白酒中EC的主要形成阶段是蒸馏阶段,贡献度达到88.22%,而堆积阶段(10.24%)和窖内发酵阶段(1.54%)形成的EC有限。
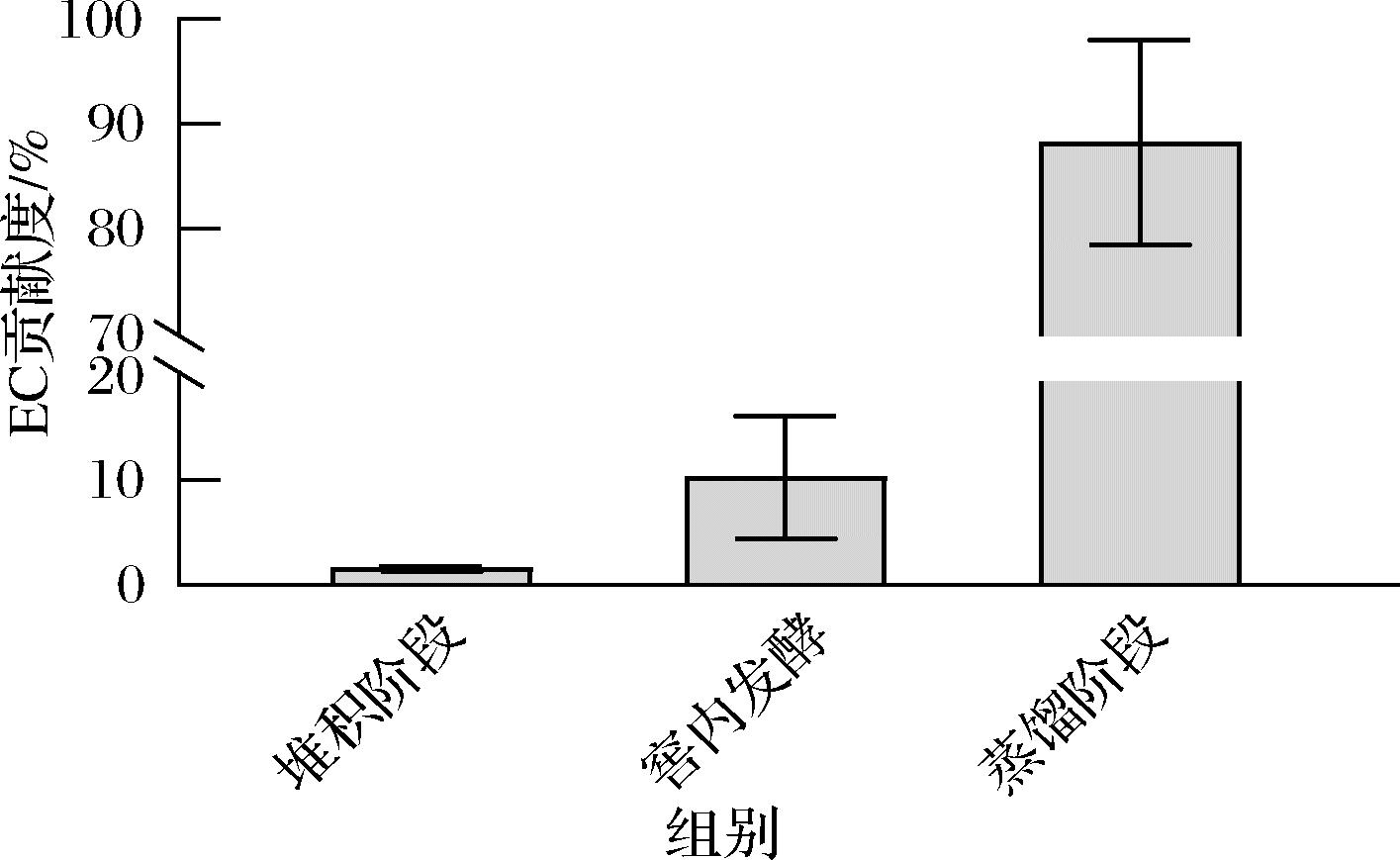
图3 不同工艺对EC的贡献度
Fig.3 Contribution of different processes to EC
根据发酵过程中的EC及其前体含量(图2)和已报道的EC形成化学原理[6],计算了发酵过程EC的理论转化值。与各工艺节点的实际EC含量相比,EC前体生成EC的实际转化率很低,在8个批次中都低于0.60%。这说明在发酵过程中,3种前体并没有在酒醅中大量转化形成EC。另外,由于EC的沸点是182.0 ℃,且自身很难挥发,其理化性质也决定了酒醅中已经生成的EC不容易带入基酒。如表1所示,发酵过程中EC前体的低转化率限制了酒醅中EC的生成量,而EC本身的理化性质限制了蒸馏带入基酒中的EC量。可以分析得出,基酒中大幅增长的EC不是来自酒醅中的EC,而是在蒸馏阶段由EC前体与乙醇蒸汽生成的。而在3种EC主要前体中,瓜氨酸构象稳定,且沸点较高(386.7 ℃),不具备在蒸馏阶段气态条件下形成EC的条件。而尿素在高温条件下不稳定,氰化物的沸点较低(<30.0 ℃)且易挥发。因此,尿素和氰化物是蒸馏阶段形成EC的主要前体。根据已有的文献报道,在蒸馏阶段,尿素会被热分解,挥发后以正氰酸的形式进入蒸汽,作为一种氰化物源与乙醇蒸汽反应,生成EC。而氰化物在蒸馏阶段会生成异氰酸,进入蒸汽,与乙醇蒸汽反应生成EC[2,7]。但由于正氰酸形成EC的吉布斯自由能较高,异氰酸生成EC的吉布斯自由能较低[17],因此氰化物是蒸馏阶段生成EC的主要前体。
表1 发酵过程EC前体理论转化值和实际转化率
Table 1 Theoretical conversion and actual conversion rate of EC precursors during fermentation
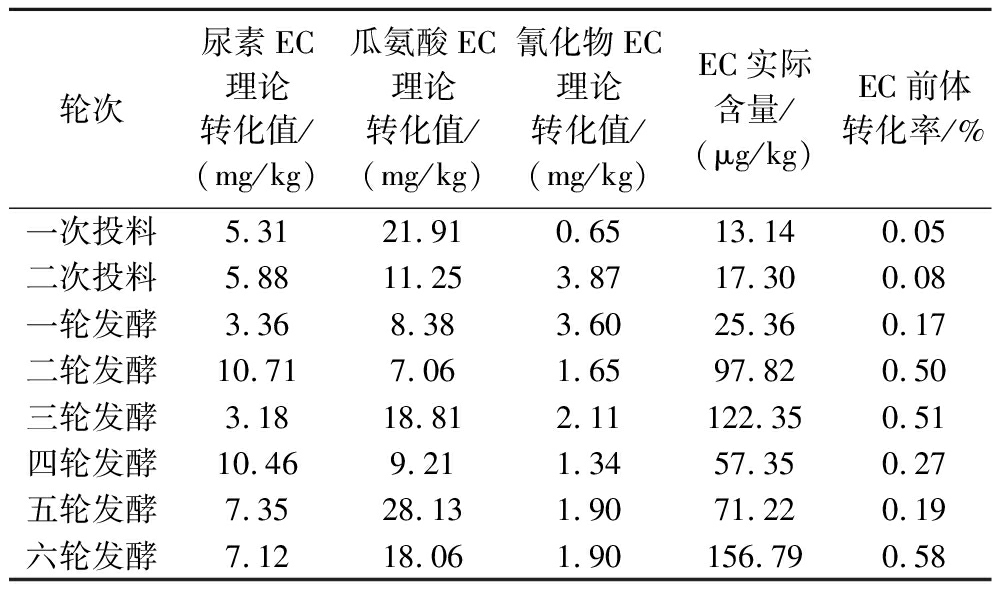
轮次尿素EC理论转化值/(mg/kg)瓜氨酸EC理论转化值/(mg/kg)氰化物EC理论转化值/(mg/kg)EC实际含量/(μg/kg)EC前体转化率/%一次投料5.3121.910.6513.140.05二次投料5.8811.253.8717.300.08一轮发酵3.368.383.6025.360.17二轮发酵10.717.061.6597.820.50三轮发酵3.1818.812.11122.350.51四轮发酵10.469.211.3457.350.27五轮发酵7.3528.131.9071.220.19六轮发酵7.1218.061.90156.790.58
2.3 氰化物及生氰糖苷的来源
由于蒸馏阶段是酱香型白酒中EC形成的主要阶段,而尿素和氰化物都会在蒸馏阶段以氰化物的形式进入蒸汽,与乙醇蒸汽反应生成EC。目前,酱香型白酒酒醅中尿素的来源较为明确,但氰化物来源和含量变化规律尚不清晰。因此,有必要明确氰化物的来源,分析其形成EC的机制。根据已有的文献报道,白酒酒醅中的氰化物除了从原辅料中直接带入之外,还来自生氰糖苷的酶解。生氰糖苷先在β-糖苷酶的作用下生成α-羟基腈,α-羟基腈很不稳定,会被分解为醛(酮)和氰化物[16]。因此,生氰糖苷是氰化物的一种重要前体,故检测了原辅料中生氰糖苷的含量,结果如图4所示。结果表明,生氰糖苷普遍存在于谷壳、大曲和高粱中,在谷壳中的平均含量为10.80 mg/kg,在大曲中的平均含量为16.82 mg/kg,在高粱中的平均含量为13.97 mg/kg。

图4 原辅料中的生氰糖苷含量
Fig.4 Content of cyanogenic glycosides in raw materials
综合比较不同原辅料中生氰糖苷的含量,结合3种原辅料的投料量,计算出各原辅料对生氰糖苷的贡献度:此辅料带入生氰糖苷的含量与原辅料带入生氰糖苷的总量的比值(图5)。结果显示,由于大曲和高粱的投料量相对较大,大曲对生氰糖苷的贡献度为47.55%,高粱对生氰糖苷的贡献度为46.46%,谷壳对生氰糖苷的贡献度相对较低(5.98%)。
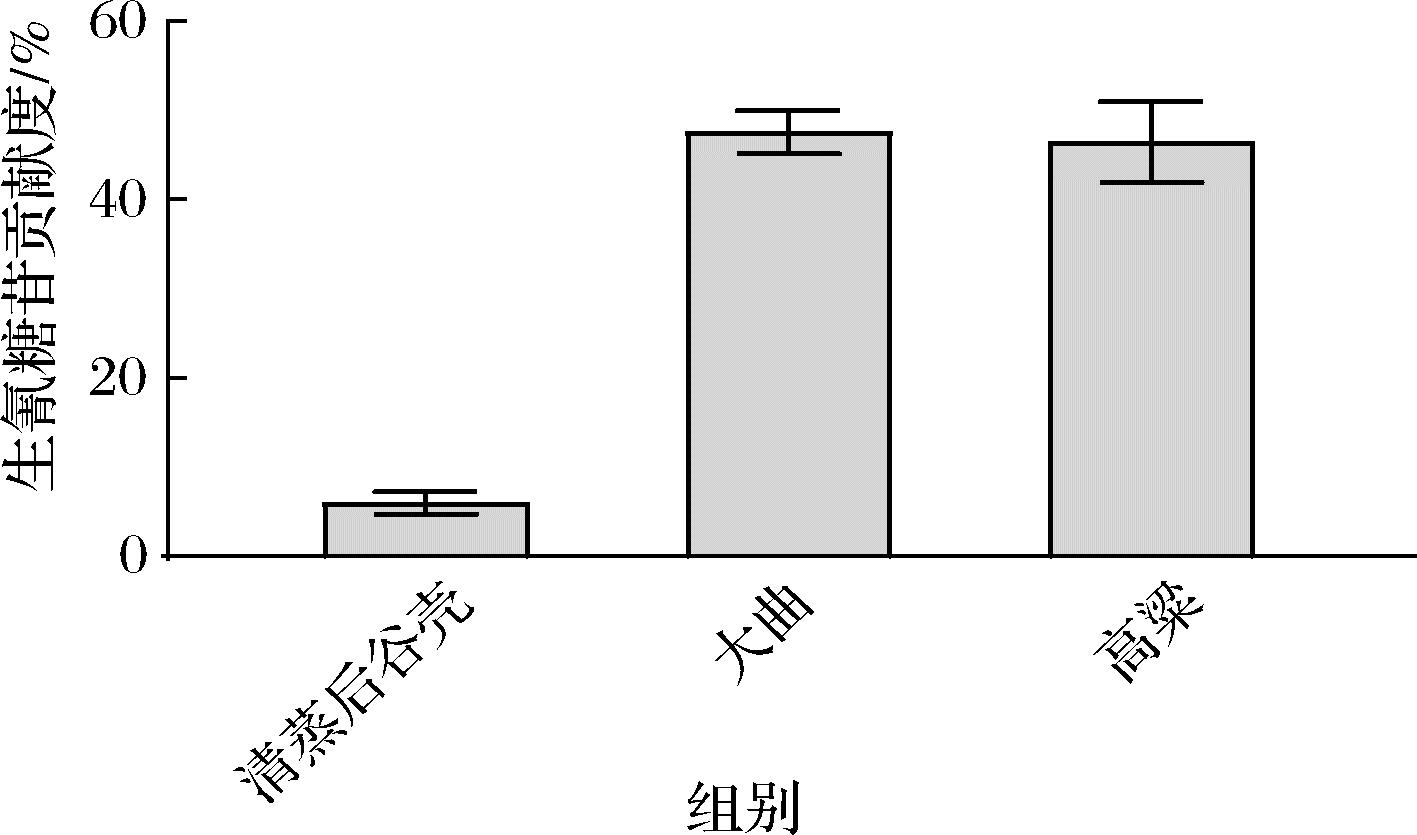
图5 不同原辅料对生氰糖苷的贡献度
Fig.5 Contribution of different materials to cyanogenic glycosides
常见的生氰糖苷包括苦杏仁苷、野黑樱苷、亚麻苦苷、蜀黍糖苷、百脉根苷等,蜀黍糖苷广泛存在于高粱中[18];苦杏仁苷广泛存在于桃、李、苹果等植物种子中[19];百脉根苷存在于豆科植物中[20],在酱香型白酒原辅料中主要存在这3种氰苷。为了进一步明确生氰糖苷的来源及生成氰化物的机制,测量了蜀黍糖苷、苦杏仁苷、百脉根苷在蒸粮工艺条件下生成氰化物的量。以原辅料中的平均浓度为底物浓度,模拟原辅料蒸煮后生成氰化物的量如图6所示。结果表明,高粱中蜀黍糖苷生成的氰化物要高于其他两种氰苷,并且高粱对生氰糖苷的贡献度相对较高(46.46%),所以高粱是原辅料带入的生氰糖苷的主要来源。2.2节的结果显示,酒醅中氰化物的含量呈现前期较高,后期不断降低的变化趋势(图2-c)。主要原因是,在前2次投料中投入了大量高粱,从而带入了大量的蜀黍糖苷作为氰化物的前体,导致氰化物的含量前期较高。而后续6轮发酵中,不再加入高粱,因此在酿造后期,酒醅中氰化物缺少前体,且同时部分在蒸馏阶段挥发、消耗,导致总体含量减少。所以高粱是生氰糖苷的主要来源这一结论与实际含量变化规律相符。
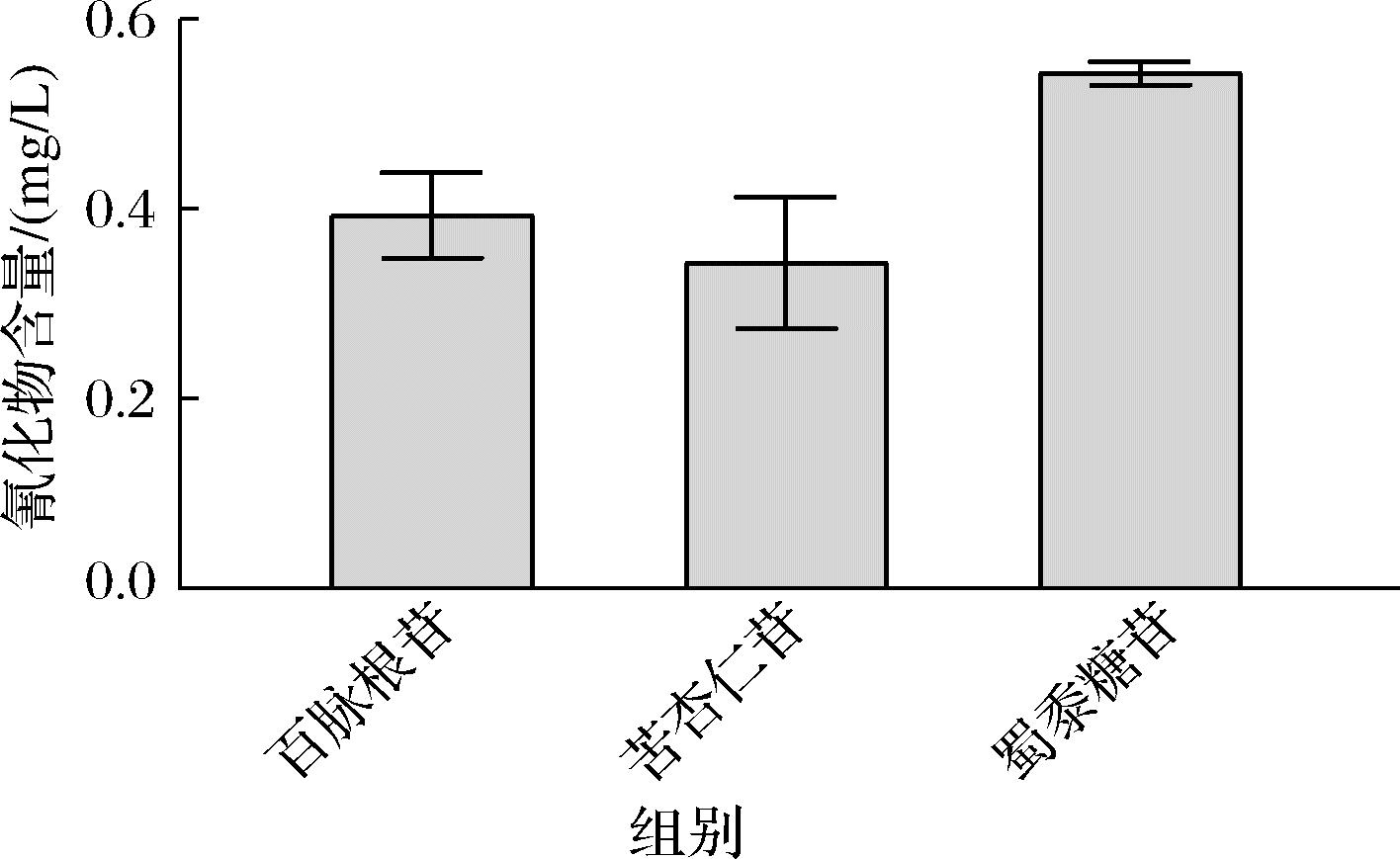
图6 不同种类生氰糖苷生成氰化物的浓度
Fig.6 Concentration of cyanide produced by different kinds of cyanogenic glycosides
2.4 代谢生氰糖苷为氰化物的菌株筛选
蒸馏阶段是基酒中EC的主要生成阶段,而氰化物是蒸馏阶段生成EC的主要前体。氰化物的主要前体为生氰糖苷[21-22]。白酒发酵过程中生氰糖苷的代谢途径如图7-a所示。百脉根苷、蜀黍糖苷、苦杏仁苷等生氰糖苷经原辅料带入后,会被β-糖苷酶水解为不稳定的α-羟基腈[16,23],进一步形成氰化物,氰化物会与乙醇生成EC。β-糖苷酶与生氰糖苷的代谢直接相关,与EC的代谢也具有一定的相关性。由于酱香型白酒的发酵过程有多种微生物参与,其中高产β-糖苷酶的微生物会对生氰糖苷和氰化物的代谢产生直接影响,也会对EC的代谢产生一定影响,已有研究人员通过β-糖苷酶控制生氰糖苷的含量。WU等[24]通过加入一种包含β-糖苷酶的酶制剂,降解了亚麻籽中99.3%的生氰糖苷。为从木薯、杏仁、高粱等其他可食用植物中去除生氰糖苷提供了一种方法。黑曲霉已被证明能有效地产生β-葡萄糖苷酶,ZHAI等[25]在高粱青贮饲料的发酵中添加黑曲霉,通过产生β-糖苷酶成功去除了高粱青贮中的生氰糖苷,进而去除了氰化物。因此,有必要明确白酒发酵过程中高产β-糖苷酶的微生物。
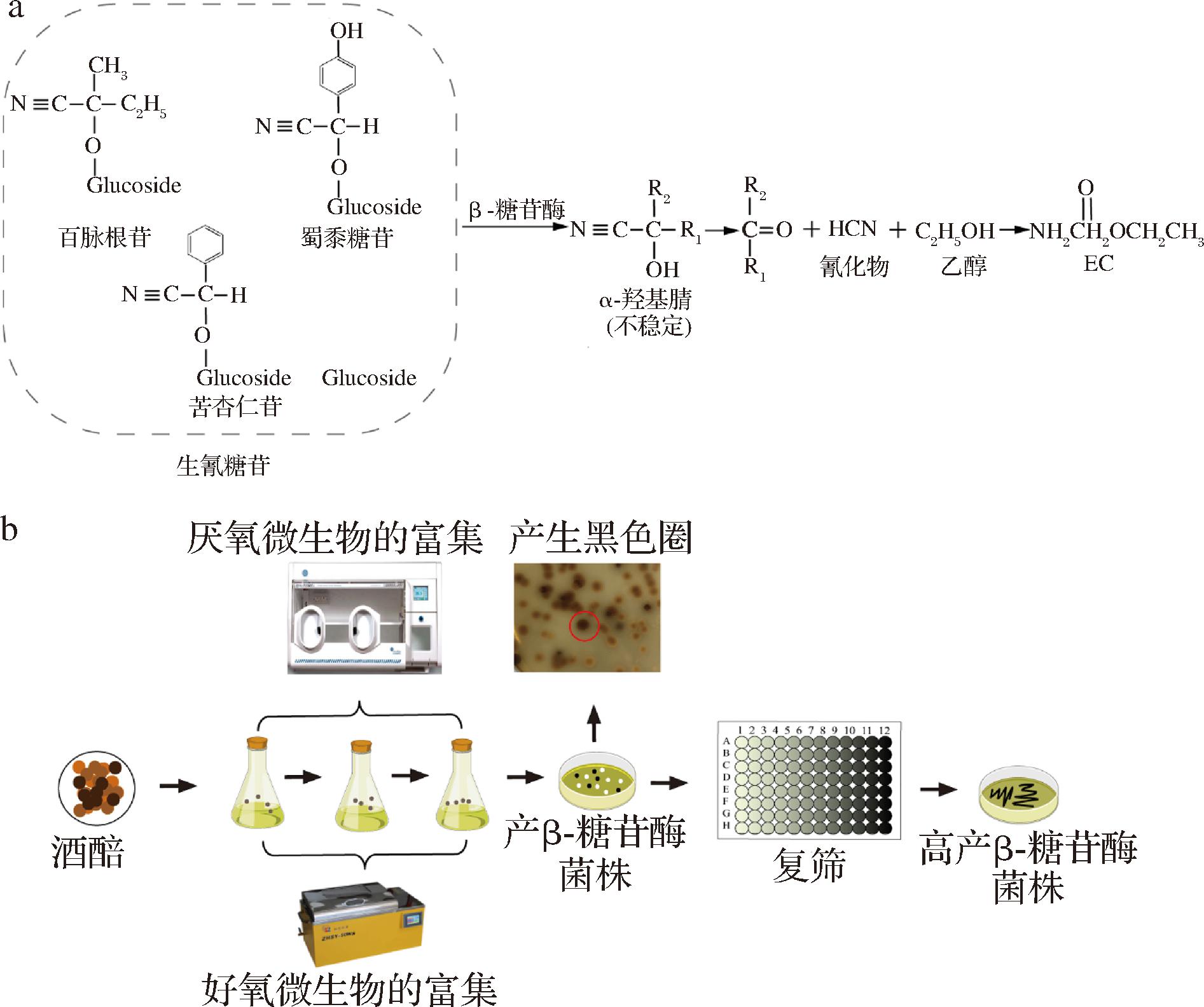
a-生氰糖苷的代谢途径;b-高产β-糖苷酶的菌株筛选流程
图7 代谢生氰糖苷为氰化物的菌株筛选
Fig.7 Screening of strains which can metabolize cyanogenic glycosides to cyanide
利用七叶苷显色法从酱香型白酒酒醅中高通量筛选了高产β-糖苷酶的微生物。在七叶苷培养基中初筛后有144株菌产生黑色圈,都能够分泌表达β-糖苷酶。在七叶苷液体培养基中复筛后挑选了一株高产β-糖苷酶的菌株,鉴定为一株热带假丝酵母(Candida tropicalis)。此菌株与生氰糖苷和氰化物的代谢直接相关,根据EC的代谢途径,也与EC的形成具有一定的相关性。
3 结论与讨论
本研究检测了酱香型白酒中不同原辅料以及不同工艺节点的酒醅中的EC及其EC前体含量。结果表明,不同原辅料之间,EC前体的主要来源是大曲。结合制曲工艺的原理,这可能与制曲过程中多种微生物的氮代谢有关。在发酵过程中,EC前体不断形成EC,而EC较难挥发(沸点182.0 ℃),因此发酵过程形成的EC会在酒醅中不断累积,导致酒醅中EC含量不断上升。在不同工艺阶段中,发酵阶段EC前体形成EC的转化率和贡献度都较低,而蒸馏阶段的贡献度达到88.22%,故酱香型白酒中EC的主要形成阶段是蒸馏阶段。根据尿素、瓜氨酸、氰化物的理化性质,不稳定的尿素和易挥发的氰化物是蒸馏阶段形成EC的主要前体。尿素需要经过热分解挥发,导致尿素在蒸馏阶段与乙醇生成EC的效率低于氰化物,故氰化物是蒸馏阶段的主要前体。生氰糖苷是氰化物的一种重要前体,普遍存在于谷壳、大曲和高粱中,被原辅料直接带入到白酒的发酵过程中。实验证明,高粱中的蜀黍糖苷是生氰糖苷的主要来源,这一结论也与氰化物在发酵过程中的含量变化规律相符。最后,从白酒酒醅中筛选得到了一株与生氰糖苷的代谢有关的热带假丝酵母(Candida tropicalis)。本研究明确了酱香型白酒酿造过程中EC前体的来源和EC生成的主要工艺阶段和主要前体,为后续研究酱香型白酒中EC及其前体的代谢机制提供了参考。
[1] JIAO Z H, DONG Y C, CHEN Q H.Ethyl carbamate in fermented beverages:Presence, analytical chemistry, formation mechanism, and mitigation proposals[J].Comprehensive Reviews in Food Science and Food Safety, 2014, 13(4):611-626.
[2] WEBER J V, SHARYPOV V I.Ethyl carbamate in foods and beverages:A review[J].Environmental Chemistry Letters, 2009, 7(3):233-247.
[3] Codex Committee on Methods of Analysis and Sampling[C].Joint FAO/WHO food standards programme codex committee on methods of analysis and sampling.Rome:Agricultural and Food Sciences, 2020.
[4] 张顺荣, 范文来, 徐岩.不同香型白酒中氨基甲酸乙酯的研究与风险评估[J].食品与发酵工业, 2016, 42(5):198-202.ZHANG S R, FAN W L, XU Y.Research and risk assessment of ethyl carbamate in different aroma types of Chinese liquors[J].Food and Fermentation Industries, 2016, 42(5):198-202.
[5] 王健, 艾涛波, 岳清洪.固相萃取和同位素内标法检测白酒中氨基甲酸乙酯[J].中国酿造, 2015, 34(1):115-117.WANG J, AI T B, YUE Q H.Detection of ethyl carbamate in Chinese liquor by SPE and isotope internal standard method[J].China Brewing, 2015, 34(1):115-117.
[6] WANG C, WANG M, ZHANG M P.Ethyl carbamate in Chinese liquor (Baijiu):Presence, analysis, formation, and control[J].Applied Microbiology and Biotechnology, 2021, 105(11):4383-4395.
[7] GOWD V, SU H M, KARLOVSKY P, et al.Ethyl carbamate:An emerging food and environmental toxicant[J].Food Chemistry, 2018, 248:312-321.
[8] DI Y H, LI J H, CHEN J, et al.Simulation and control of the formation of ethyl carbamate during the fermentation and distillation processes of Chinese Baijiu[J].Foods, 2023, 12(4):821.
[9] 白卫东, 沈棚, 钱敏, 等.高效液相色谱法测定黄酒中瓜氨酸的含量[J].中国食品学报, 2014, 14(3):229-233.BAI W D, SHEN P, QIAN M, et al.Measurement of the citrulline in rice wine liquor with high performance liquid chromatography[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(3):229-233.
[10] 李南, 何海茵, 郑悦珊, 等.顶空气相色谱法测定白酒中氰化物含量[J].食品安全质量检测学报, 2019, 10(1):240-244.LI N, HE H Y, ZHENG Y S, et al.Determination of cyanide in liquor by headspace gas chromatography[J].Journal of Food Safety &Quality, 2019, 10(1):240-244.
[11] ZHOU K, PATRIGNANI F, SUN Y M, et al.Inhibition of ethyl carbamate accumulation in soy sauce by adding quercetin and ornithine during thermal process[J].Food Chemistry, 2021, 343:128528.
[12] 王浩, 刘丽斌, 黄秋婷, 等.气相色谱-质谱联用内标法检测广州市场饮料酒中氨基甲酸乙酯含量的研究[J].酿酒科技, 2015, (2):110-113.WANG H, LIU L B, HUANG Q T, et al.The measurement of ethyl carbamate content in alcoholic beverage in Guangzhou by GC-MS with internal standard method[J].Liquor-Making Science and Technology, 2015, (2):110-113.
[13] 卢君, 唐平, 山其木格, 等.一种评价酱香型白酒酿造过程高粱蒸煮程度的技术研究[J].中国酿造, 2021, 40(3):73-78.LU J, TANG P, SHAN Q, et al.Evaluation technology of the cooking degree of sorghum in the brewing process of sauce-flavor Baijiu[J].China Brewing, 2021, 40(3):73-78.
[14] 姚红红, 任学梅, 严幻汝, 等.甘肃河西走廊葡萄酒产区高产糖苷酶非酿酒酵母菌株筛选及其酿酒适应性分析[J].食品与发酵工业, 2023, 49(16):49-58.YAO H H, REN X M, YAN H R, et al.Screening of non-Saccharomyces yeasts endowed with high glucosidase activity and their adaptability to wine biotope in Hexi corridor of Gansu province[J].Food and Fermentation Industries, 2023, 49(16):49-58.
[15] WU Q, LIN J C, CUI K X, et al.Effect of microbial interaction on urea metabolism in Chinese liquor fermentation[J].Journal of Agricultural and Food Chemistry, 2017, 65(50):11133-11139.
[16] 张顺荣. 白酒中氨基甲酸乙酯形成的氰化物途径研究[D].无锡:江南大学, 2016.ZHANG S R.Research of ethyl carbamate formation in Chinese liquor from the cyanide way[D].Wuxi:Jiangnan University, 2016.
[17] GALINARO C A, OHE T H K, DA SILVA A C H, et al.Cyanate as an active precursor of ethyl carbamate formation in sugar cane spirit[J].Journal of Agricultural and Food Chemistry, 2015, 63(33):7415-7420.
[18] 邓平. 杏仁氰苷及油脂组分积累模式研究[D].杨凌:西北农林科技大学, 2021.DENG P.Study on the accumulation pattern of cyanogenetic glycosides and lipid components in apricot kernel[D].Yangling:Northwest A&F University, 2021.
[19] JASWAL V, PALANIVELU J, RAMALINGAM C.Effects of the Gut microbiota on Amygdalin and its use as an anti-cancer therapy:substantial review on the key components involved in altering dose efficacy and toxicity[J].Biochemistry and Biophysics Reports, 2018, 14:125-132.
[20] BALLHORN D J, KAUTZ S, HEIL M, et al.Cyanogenesis of wild Lima bean (Phaseolus lunatus L.) is an efficient direct defence in nature[J].PLoS One, 2009, 4(5):e5450.
[21] 周韩玲, 安明哲, 赵东, 等.高粱中蜀黍氰苷与浓香型白酒中氰化物及氨基甲酸乙酯关系的研究[J].中国酿造, 2022, 41(10):25-29.ZHOU H L, AN M Z, ZHAO D, et al.Relationship between dhurrin in sorghum and cyanides and ethyl carbamate in strong-flavor Baijiu[J].China Brewing, 2022, 41(10):25-29.
[22] 余璐璐, 刘杨, 徐飞.氰化物的来源及其在植物中的功能研究进展[J].生命科学, 2019, 31(2):128-134.YU L L, LIU Y, XU F.The source of cyanide and its function in plants[J].Chinese Bulletin of Life Sciences, 2019, 31(2):128-134.
[23] CRESSEY P, REEVE J.Metabolism of cyanogenic glycosides:A review[J].Food and Chemical Toxicology, 2019, 125:225-232.
[24] WU C F, XU X M, HUANG S H, et al.An efficient fermentation method for the degradation of cyanogenic glycosides in flaxseed[J].Food Additives &Contaminants.Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2012, 29(7):1085-1091.
[25] ZHAI J R, WANG B, SUN Y P, et al.Effects of Aspergillus niger on cyanogenic glycosides removal and fermentation qualities of ratooning Sorghum[J].Frontiers in Microbiology, 2023, 14:1128057.