聚乙醇酸(polyglycolic acid,PGA)是最简单的脂肪族聚酯,由主链上含有α羟基酸的乙醇酸(glycolic acid,GA)聚合而成[1],具有优良的生物相容性、生物可降解性、无毒降解产物和机械稳定性[2]。美国食品和药物管理局(Food and Drug Administration,FDA)已经批准并推动了PGA在医疗领域的应用[3],如医学工程组织支架、手术缝合线、药物缓释载体和一次性医疗设备[4]。因此,聚乙醇酸的合成逐渐成为研究热点。乙醇酸作为聚乙醇酸的单体,由于其具备酸和醇的特性,广泛应用于食品、化妆品和化学清洗等领域。现阶段高纯度乙醇酸生产受到限制,国内虽有一定的生产规模,但生产工艺却相对落后,产品质量不高,70%(质量分数)液体乙醇酸为中国市场上的主流产品,而纯度99%的固体乙醇酸等高端产品生产能力不足,对进口产品依赖度较高[5]。
目前,工业上主要采用化学法合成乙醇酸,如氯乙酸水解法、羟基乙腈水解法[6]等。这些方法存在一些弊端,如羟基乙腈为剧毒物,难以实现连续化生产;氯乙酸腐蚀性较强,对生产设备要求较高。因此,生物法合成乙醇酸成为了研究热点。天津工业技术研究所以乙酸为原料合成乙醇酸,通过优化磷酸戊糖途径中NADPH辅助因子的供应,乙醇酸产量达到73.30 g/L[7]。然而,由于使用了诱导剂异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG),显著增加了生产成本。本实验室在前期研究中采用组成型启动子5′-UTR序列取代IPTG诱导系统,避免了诱导剂的使用[8]。然而截至目前,尚未有生物基聚乙醇酸的相关报道,尤其缺乏系统的分离纯化下游研究[9]。
本研究旨在打通全套生物基乙醇酸及聚乙醇酸的生产工艺,利用生物质糖-玉米芯水解液进行发酵,开展钙盐法系统分离纯化研究,并进行单体聚合应用,最终为生物基乙醇酸及其聚合物的规模化生产奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
大肠杆菌Mgly71(MG1655 DE3,ΔldhAΔglcBΔaceB ΔaldAΔglcDEFΔicdΔglcC,含有PJUN-5和PJUN-YA),本实验室保存。
1.1.2 试剂
磷酸氢二钠、磷酸二氢钾、氯化钠、氯化铵、氨水、氢氧化钠、氢氧化钙、氯化钙、硫酸、硫脲、氯化胆碱、硫酸镁、葡萄糖、苯甲醚、三氟乙酸、异丙醇,上海国药试剂集团;酵母粉、蛋白胨,Oxiod公司;氨苄青霉素、链霉素,上海生工;纤维素酶(羧甲基纤维素钠酶活性50 U/mg,50 ℃), Sigma-Aldrich。
1.1.3 培养基
种子培养基(LB)(g/L):胰蛋白胨 10.00,酵母粉 5.00,NaCl 10.00。pH自然,无需调节。灭菌条件为121 ℃,20 min。
发酵培养基(M9)(g/L):Na2HPO4 6.78,KH2PO4 3.00,NH4Cl 1.00,NaCl 0.50,MgSO4 0.24,CaCl2 0.01,蛋白胨 8.00,酵母粉 2.00,葡萄糖 8.00。pH自然,无需调节。灭菌条件为121 ℃,20 min。其中MgSO4、CaCl2和葡萄糖单独灭菌,于接种前加入培养基。葡萄糖灭菌条件为115 ℃,30 min。
1.2 仪器与设备
UV-2450紫外可见分光光度计,日本Shimadzu公司;1260 Infinity Ⅱ高效液相色谱,美国安捷伦有限公司;Y15全自动分析仪,上海佰三思生物科技有限公司;ST-16R高速冷冻离心机,赛默飞世尔科技(中国)有限公司;LS-B50L型立式圆形压力蒸气灭菌器,上海医用核子仪器厂;SHB-IIIS循环水式多用真空泵,郑州长城科工贸有限公司;RE-52A旋转蒸发仪,上海比朗仪器有限公司;DF-101Z集热式恒温加热磁力搅拌器,上海仪昕科学仪器有限公司。
1.3 实验方法
1.3.1 检测方法
1.3.1.1 玉米芯水解液的检测
取1 mL玉米芯水解液于离心管中,随后立即将离心管置于100 ℃沸水中5 min,使酶失活,然后以12 000 r/min离心5 min,通过Y15全自动分析仪检测葡萄糖浓度。
1.3.1.2 发酵液的检测
取1 mL发酵液,12 000 r/min离心2 min后取上清液过0.22 μm滤膜。利用高效液相色谱定量检测葡萄糖、乙醇酸、乳酸和乙酸。使用的色谱柱为Aminex HPX-87H(BIO-RAD,美国)。检测器为示差检测器,检测参数为:柱温35 ℃,流动相为5 mmol/L稀硫酸,流速0.60 mL/min,进样量10 μL。
1.3.2 培养方法
1.3.2.1 种子培养
将保存于-80 ℃冰箱的菌种在固体LB培养基进行划线,在37 ℃恒温培养箱培养14~16 h;挑取单菌落于装有10 mL LB培养基的50 mL锥形瓶中,37 ℃培养12~13 h作为一级种子液;按2%(体积分数,下同)接种量接种于装有50 mL LB培养基的250 mL锥形瓶中,培养9 h作为2级种子液。
1.3.2.2 发酵培养
摇瓶发酵:使用LB培养基进行种子培养,将培养好的二级种子液以2%的接种量接种于装有50 mL M9发酵培养基的250 mL锥形瓶中,添加一定量氨苄青霉素(ampicillin, Amp)和链霉素(streptomycin, Str)使其终质量浓度分别为100、50 mg/L,37 ℃,250 r/min条件下培养72 h。
5 L罐发酵:选择初始装液量2.80 L,葡萄糖质量浓度8 g/L,接种量为5%,转速为250 r/min,加入一定量Amp和Str使其终质量浓度分别为100、50 mg/L。发酵期间以氨水调控pH值为7.00,流加补糖保证葡萄糖供应,通气量为1 vvm,调节转速控制溶氧为30%。
1.3.3 玉米芯水解液的制备及发酵
1.3.3.1 离子液体的制备
氯化胆碱(ChCl)和尿素(Urea)以1∶2的摩尔比混合,150 r/min在80 ℃的集热式磁力搅拌器中加热,直至形成均一透明的液体,置于4 ℃冰箱备用。
1.3.3.2 玉米芯预处理
称取100 g干燥玉米芯(60目,过筛)以1∶20(质量比)的固液比加入到含有NaOH/ChCl∶Urea(3%,6%,质量分数)溶液的称量杯中,使用搅拌器室温下充分搅拌1 min。每次预处理后,向反应体系中加入同等质量的去离子水,然后搅拌冲洗调节直至pH为中性。处理完的玉米芯固体放置于60 ℃烘箱中干燥备用。
1.3.3.3 玉米芯的酶解糖化
在250 mL锥形烧瓶中,将10.00 g玉米芯与45 mL 50 mmol/L醋酸盐缓冲液(pH 4.8)混合,加入0.50 mL纤维素酶液,然后将烧瓶密封并置于50 ℃摇床中搅拌72 h,摇床转速180 r/min。酶解完全后离心取上清液,浓缩至500 g/L置于4 ℃冰箱待用。
1.3.3.4 玉米芯水解液摇瓶水平发酵乙醇酸研究
将二级种子液转接到50 mL的M9发酵培养基,添加玉米芯水解液代替葡萄糖,控制葡萄糖初始质量浓度为8.00 g/L,37 ℃、250 r/min培养72 h,分别在24、48、72 h取样,按照1.3.1.2节的方法检测乙醇酸含量。
1.3.3.5 玉米芯水解液5 L罐发酵乙醇酸研究
在摇瓶水平发酵的基础上,选择初始装液量2.80 L,接种量为5%,转速为250 r/min,发酵温度37 ℃,底物为玉米芯水解液,加入一定量Amp和Str使其终质量浓度分别为100、50 mg/L。发酵期间以氨水调控pH值为7.00,通气量为2.8 L/min,调节转速控制溶氧为30%。
1.3.4 乙醇酸分离纯化
1.3.4.1 乙醇酸发酵液预处理
发酵结束后,将发酵液以12 000 r/min离心10 min,收集上清液,加入30 g/L的活性炭,在40 ℃条件下使用集热式磁力搅拌器充分搅拌30 min,按照1.3.1.2节方法检测乙醇酸浓度。
1.3.4.2 初始pH对乙醇酸回收量的影响
取80 mL 50 g/L乙醇酸发酵液。使用氨水调节pH值为5.00、6.00、7.00、8.00、9.00、10.00。加入1.97 g氢氧化钙(30%,质量分数),50 ℃反应6 h,离心取上清液调节pH至中性后按照1.3.1.2节方法检测乙醇酸浓度,根据体积计算乙醇酸质量。取沉淀加入1.84 mol/L的稀硫酸15 mL进行酸化反应,55 ℃ 搅拌2 h,离心,取上清液按照1.3.1.2节方法检测乙醇酸浓度,根据体积计算乙醇酸质量。
1.3.4.3 钙化过程对乙醇酸回收量的影响
在钙化过程中,参照1.3.4.2节的方法,依次探究氢氧化钙添加量(1.97、2.10、2.20、2.30 g)、搅拌温度(45、50、55、60 ℃)及搅拌时间(4、5、6、7 h)对乙醇酸回收率的影响。
1.3.4.4 酸化过程对乙醇酸回收量的影响
在酸化过程中,参照1.3.4.2节的方法,依次探究1.84 mol/L稀硫酸添加量(10、15、20、25 mL)、搅拌温度(40、50、60、70 ℃)及搅拌时间(0.5、1、1.5、2 h)对乙醇酸回收率的影响。
1.3.4.5 乙醇酸水溶液除盐浓缩过程优化
取50 mL离心上清液,加入乙醇酸理论质量2~5倍的无水异丙醇,室温搅拌0.5 h后进行真空抽滤,取滤液,使用旋转蒸发仪在40~70 ℃,0.09 MPa的条件下除去异丙醇。异丙醇完全除去后取出余液,再次重复上述过程。
1.3.4.6 乙醇酸结晶及检测
将浓缩液置于结晶器中匀速降温至4 ℃左右,加入1%(质量分数)的晶种(纯度为99%)。再匀速降温至-20 ℃,等待结晶。结晶完成后使用布氏漏斗进行抽滤,抽滤结束后,母液可后续继续结晶,将带有部分水的乙醇酸结晶使用冷冻干燥机冻干,得到高纯度的固体乙醇酸。
1.3.5 聚乙醇酸的合成及表征
1.3.5.1 共沸蒸馏法合成聚乙醇酸
将5.00 g乙醇酸称重到烧瓶中,安装至铁架台上,使用氩气球排尽空气,并在氩气气氛下保持。加入75 mL的苯甲醚,并添加50 μL的三氟乙酸做催化剂。在反应过程中,混合物被加热到苯甲醚的沸点154 ℃,打开水循环,并进行磁力搅拌。30 h后反应结束,倒出所用溶剂,再加入75 mL乙酸乙酯在80 ℃下回流30 min。使用布氏漏斗进行抽滤,并用冰水进行水洗尽量去除有机溶剂的气味,再使用真空冷冻干燥机进行冻干,得到聚乙醇酸固体。
1.3.5.2 PGA红外表征
采用傅里叶红外光谱仪表征聚合物样品的分子结构,通过KBr压片法测定PGA的红外光谱。
1.3.5.3 PGA核磁表征
核磁共振氢谱(1H-nuclear magnetic resonance,1H-NMR):采用核磁共振谱仪表征聚合物样品的共聚组成。内标为四甲基硅烷,溶剂为氘代三氟乙酸。
1.3.5.4 PGA结晶性能
结晶度采用X射线粉末衍射仪测定。波长:0.154 nm,电压:40 kV,电流:30 mA,2θ角扫描范围:5°~80°,样品粉末压片。X射线图中结晶区域面积与总面积之比定义为结晶度,按照公式(1)计算:
结晶度![]()
(1)
式中:Ac为晶峰面积,Aa为非晶峰面积。
2 结果与分析
2.1 生物质糖的制备及发酵
2.1.1 低共熔溶剂法制备生物质糖
木质纤维素类生物质如玉米芯、小麦秸秆和甘蔗渣等[10],含有丰富的纤维素、半纤维素和木质素等成分[11-12]。本研究通过低共熔溶剂(deep eutectic solvents, DESs)预处理玉米芯,再结合纤维素酶酶解,进而获得生物质糖。如图1-a所示,与预处理前相比,酶解后的玉米芯总质量降低了95.40%,纤维素和半纤维素含量分别降低了92.80%和98.30%,这表明预处理去除了大部分的半纤维素,同时纤维素酶与大部分纤维素进行了反应。由图1-b可知,酶解反应在前24 h内迅速进行,在24 h时葡萄糖产量达到120.80 g/L,随后的48 h内,反应速率逐渐降低。在72 h时,葡萄糖产量增加至148.05 g/L,转化率为93.10%。从工业化的角度来看,将反应时间控制在24 h内可以显著节约时间并降低设备成本。玉米芯水解液作为农业废弃物玉米芯的提取物,具有价格低廉的优势[13]。此外,除了含有主要的碳源外,玉米芯水解液还富含多种营养物质[14],为后续乙醇酸的发酵应用奠定了基础。
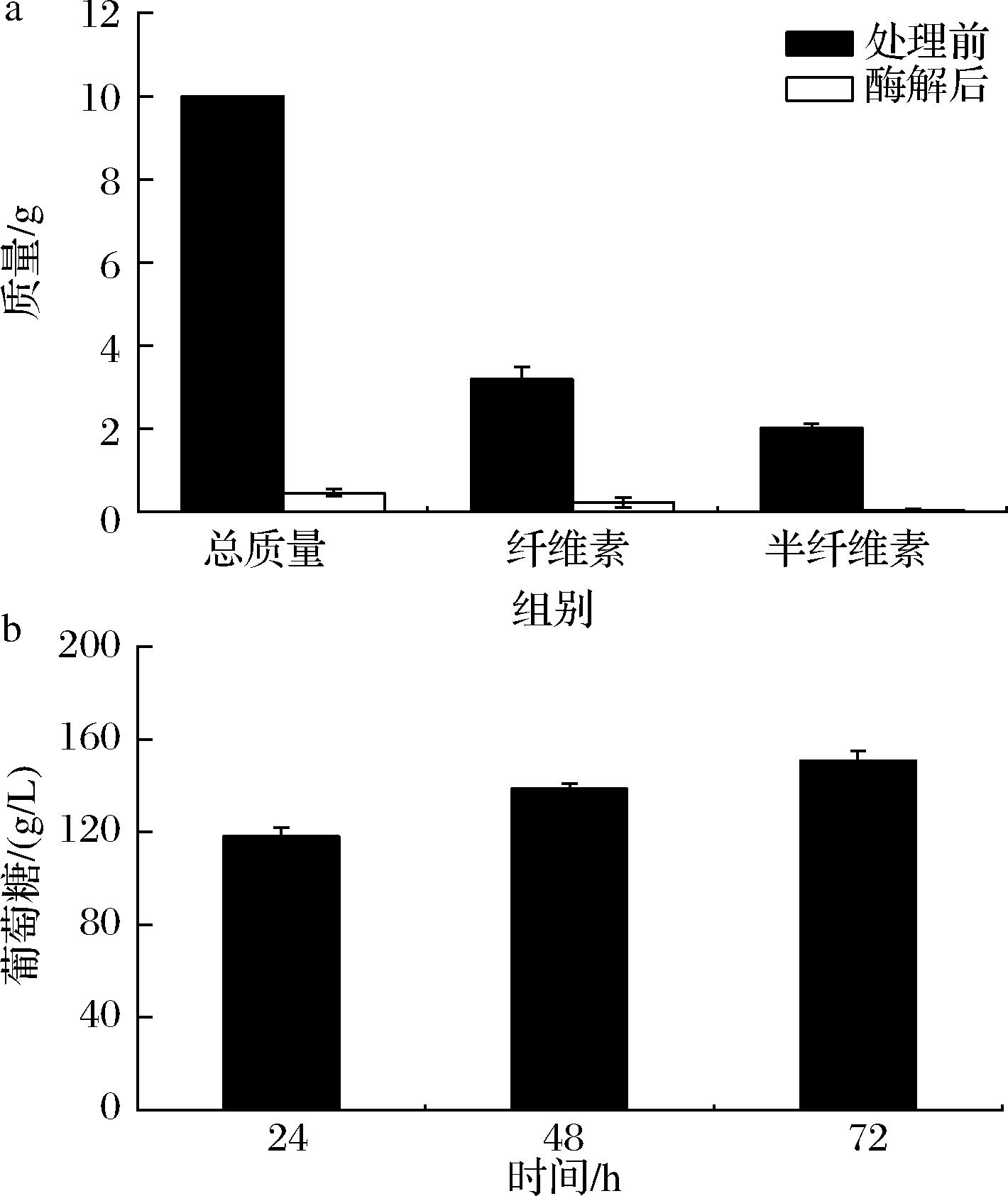
a-组分测定;b-酶解葡萄糖产量
图1 玉米芯组分测定与酶解分析
Fig.1 Determination of corn cob components and enzymatic hydrolysis analysis
2.1.2 玉米芯水解液摇瓶水平发酵乙醇酸研究
与葡萄糖为底物相比,同一时间下,使用玉米芯水解液作为底物发酵具有更高的菌体浓度(图2-a),72 h OD600值为7.25。同时,如图2-b所示,使用玉米芯水解液发酵乙醇酸产量也更高,24 h达到(3.84±0.15) g/L,后续48 h乙醇酸产量几乎不再增加,这可能是因为培养基中的初始糖已被消耗殆尽。传统的木质纤维素预处理方法通常会产生发酵抑制剂,如糠醛和5-羟甲基糠醛[15],后者可降低生物酶活性、抑制蛋白质和RNA合成。本研究使用的低共熔溶剂(NaOH/ChCl∶Urea)由2种廉价且安全、易生物降解的氢键受体和氢键供体组成,反应过程在室温条件下进行,避免了抑制物产生对后续发酵的影响[16]。上述结果表明玉米芯水解液可作为替代葡萄糖进行乙醇酸发酵的原料,从而降低发酵成本。
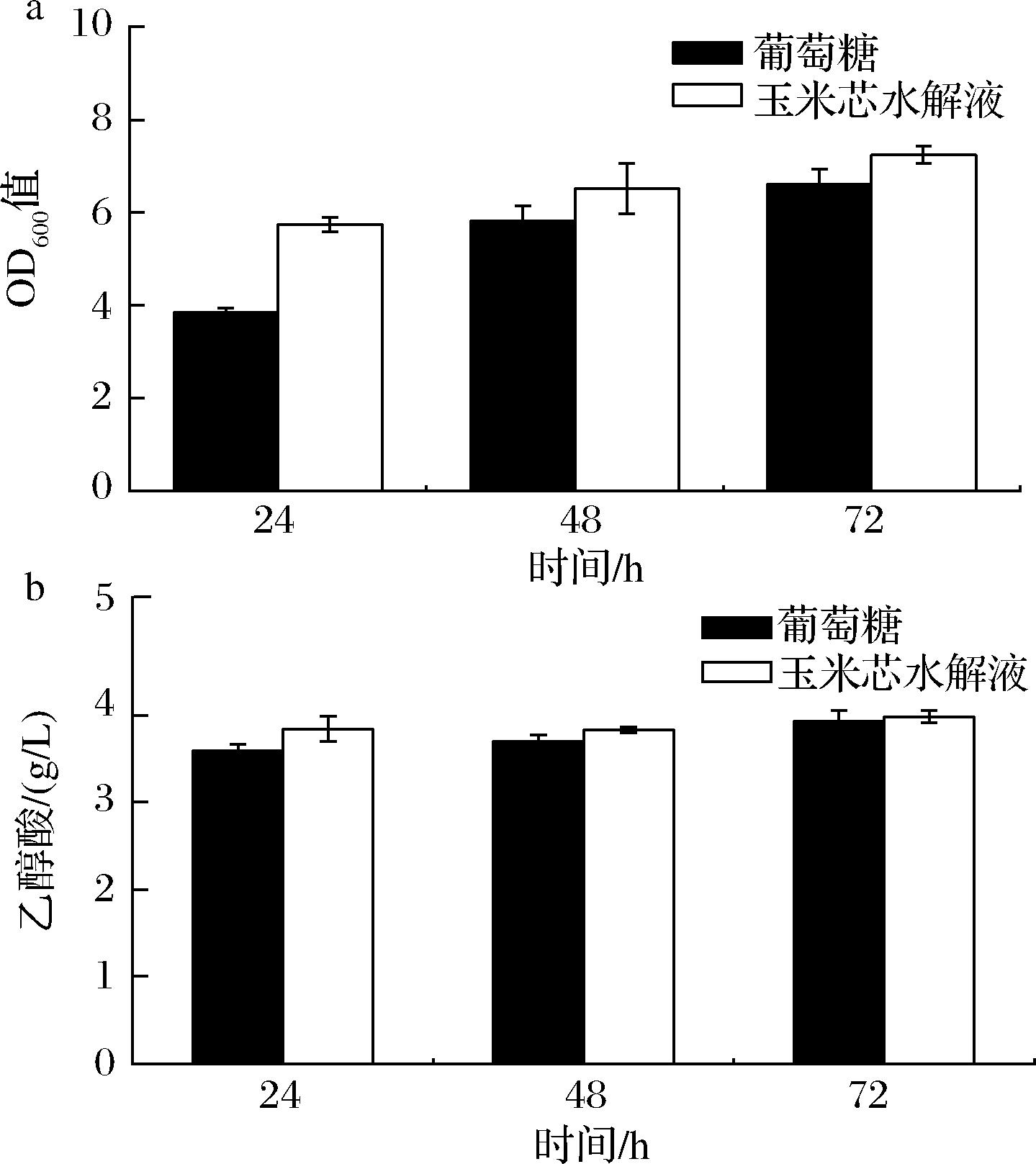
a-OD600;b-乙醇酸产量
图2 葡萄糖与玉米芯水解液摇瓶水平发酵乙醇酸结果比较
Fig.2 Comparison of horizontal fermentation results of glycolic acid using glucose and corn cob hydrolysate in shake flasks
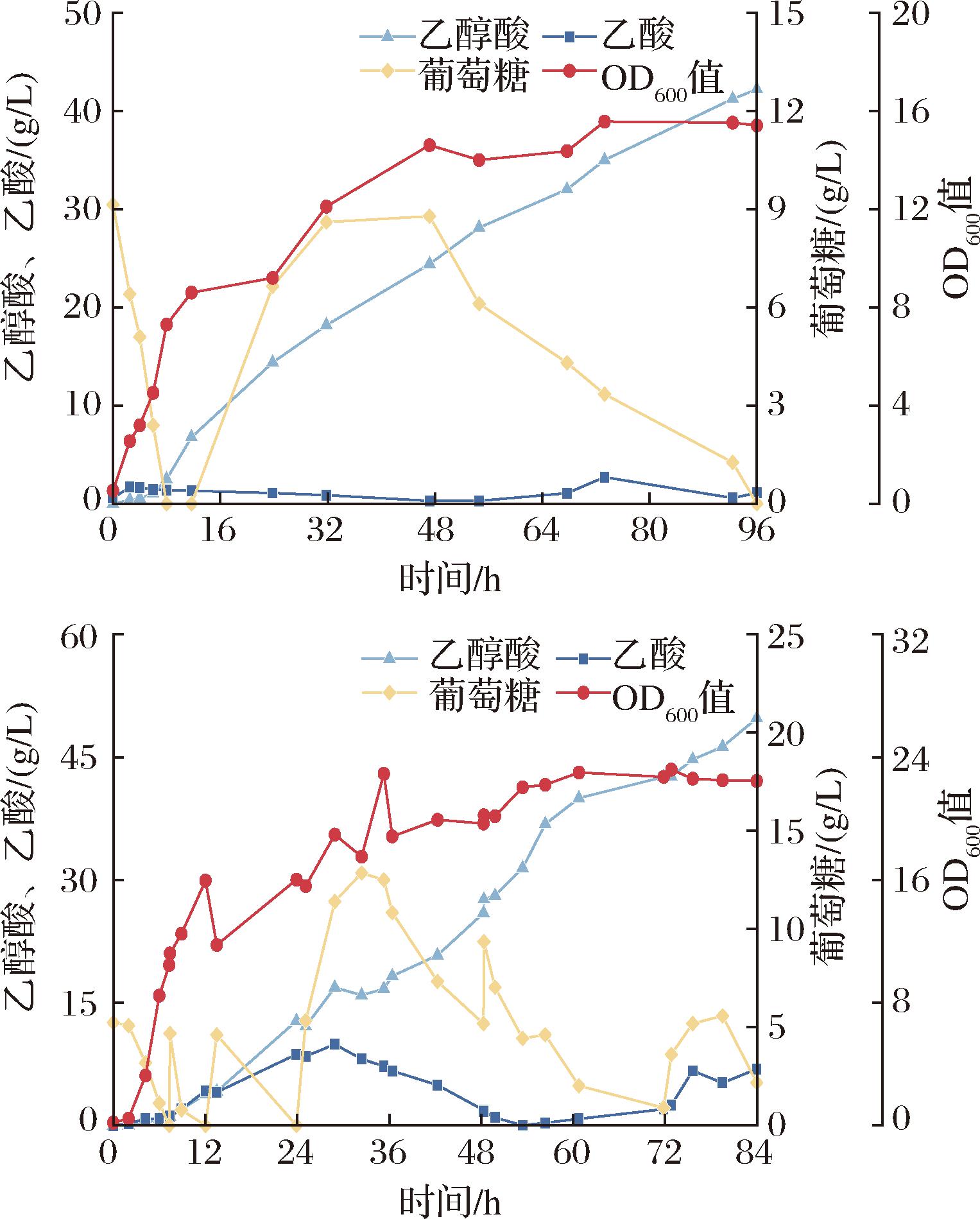
a-葡萄糖;b-玉米芯水解液
图3 葡萄糖和玉米芯水解液5 L罐发酵乙醇酸验证
Fig.3 Glycolic acid fermentation validation using glucose and corn cob hydrolysate in a 5 L bioreactor
2.1.3 玉米芯水解液5 L罐发酵乙醇酸研究
图3展示了工程菌株Mgly71分别使用葡萄糖和玉米芯水解液进行5 L罐发酵的结果。与葡萄糖作为底物相比,使用玉米芯水解液最高菌体浓度(OD600)达到了22.92,实现了显著的提升;随着菌体生长的增强,乙醇酸的产量也相应提高,84 h时乙醇酸的产量最高达到了49.80 g/L,相比葡萄糖组提高了16.00%,而且发酵时间也显著缩短。相关研究表明,除了作为碳源外,玉米芯水解液还可以为菌体细胞的生长和酶合成提供必要的元素,这些添加物在改善菌体细胞生长和代谢过程中发挥了重要的作用,最终实现乙醇酸产量的显著增加[17-18]。
2.2 乙醇酸的分离纯化
2.2.1 初始pH对乙醇酸回收量的影响
有机酸在溶液中的存在形式对分离提取有较大影响,其中解离常数(pKa)对其影响最大[19]。乙醇酸的pKa值为3.83,当pH>5.83时,溶液中99%的乙醇酸以离子形式存在,而当pH<2.83时,溶液中99%的乙醇酸以分子形式存在。本研究拟通过钙盐沉淀法分离乙醇酸,而只有以离子形式存在时,乙醇酸才可以参与后续反应,因此首先探究初始pH对乙醇酸回收率的影响。如图4所示,待提取溶液中含有4.00 g乙醇酸,随着氨水添加量的增加,乙醇酸的回收率逐步提高,当pH值为9.00时,酸化溶液中回收获得3.36 g乙醇酸,回收率达到83.75%。表明在乙醇酸的发酵过程中,确实产生了其他的杂酸,而随着氨水添加量的增加,酸性较强的杂酸和乙醇酸完全反应,此时回收率达到最高点。综上,pH 9.00为后续分离提取的最适pH值。
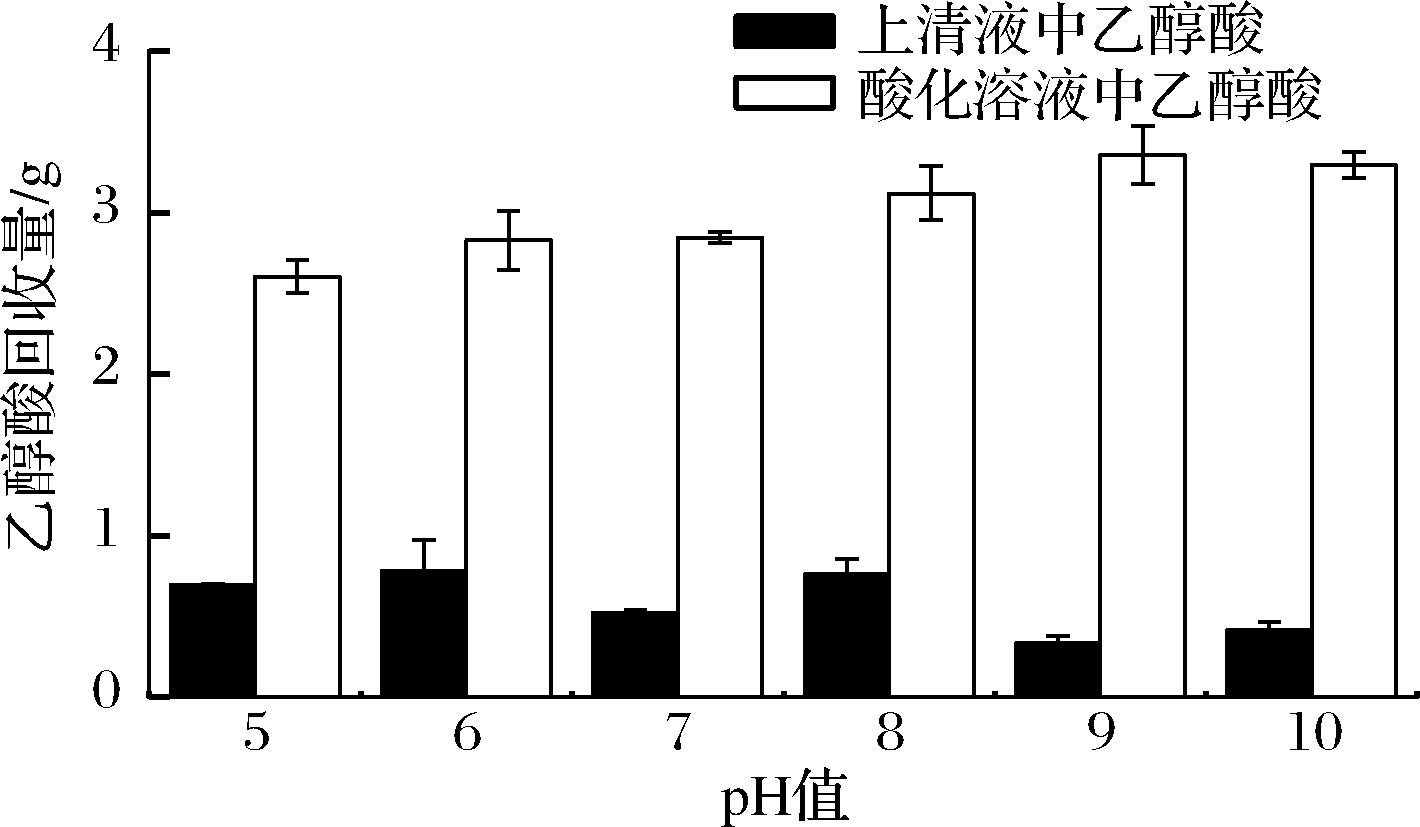
图4 初始pH对乙醇酸回收量的影响
Fig.4 Effect of initial pH on the recovery of glycolic acid
2.2.2 钙化过程对乙醇酸回收量的影响
本研究使用钙盐提取法[20]从发酵液中提取乙醇酸,该方法主要利用乙醇酸钙沉淀微溶于水,能溶于酸的特点来分离纯化发酵液中的乙醇酸。钙化过程通过添加氢氧化钙与乙醇酸反应,生成乙醇酸钙。为了探究钙化过程对乙醇酸回收率的影响,对氢氧化钙添加量、搅拌温度及搅拌时间进行了优化。根据图5-a的结果,随氢氧化钙添加量的增加,乙醇酸回收量先升高后降低,在氢氧化钙添加量为2.10 g时回收率达到最高值3.27 g,回收率为81.75%。分析其原因,4.00 g乙醇酸理论上与1.97 g氢氧化钙恰好反应,但发酵液中含有的部分杂酸可优先与氢氧化钙反应,同时过量的氢氧化钙不溶于水,可能会阻碍搅拌及反应进程,造成乙醇酸的损失,进而使回收量降低。如图5-b所示,在45~60 ℃时,乙醇酸回收量先升高后降低,在50 ℃达到最高值3.31 g,回收率为82.75%,这可能是因为低温过程中易生成絮状物,阻碍搅拌,进而影响反应进行;高温过程会导致乙醇酸部分缩聚,因此检测到的乙醇酸回收量减少。在搅拌时间的优化过程中(图5-c),乙醇酸回收量随时间延长逐步增高,在6 h达到3.35 g,回收率为83.75%。这是因为反应需要较长的时间,完全反应后乙醇酸的回收率趋于稳定。综上,确认钙化的最佳条件为氢氧化钙添加量2.10 g,搅拌温度50 ℃,搅拌时间6 h。
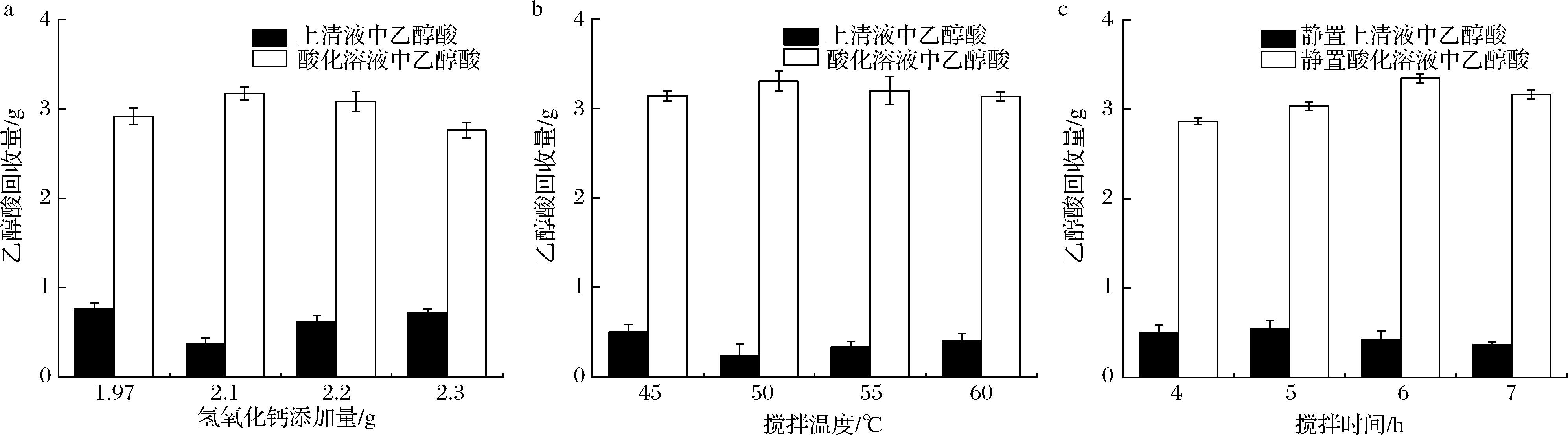
a-氢氧化钙添加量;b-搅拌温度;c-搅拌时间
图5 钙化过程对乙醇酸回收量的影响
Fig.5 Effect of calcification process on the recovery of glycolic acid
2.2.3 酸化过程对乙醇酸回收量的影响
在酸化过程中,通过添加1.84 mol/L的稀硫酸与乙醇酸钙沉淀发生反应,生成乙醇酸与不溶于水的硫酸钙沉淀。为了探究酸化过程对乙醇酸回收率的影响,对硫酸添加量、搅拌温度及搅拌时间进行了优化,初始乙醇酸含量均为4.00 g。如图6-a所示,随着硫酸添加量的增加,乙醇酸的回收率显著提高,在硫酸添加量为25 mL时,乙醇酸回收量为3.38 g,此时回收率最高为84.50%。当硫酸的添加量为20 mL和25 mL时,乙醇酸的回收率表现相似,这是因为当硫酸的添加量达到一定值时,过量的硫酸已经与乙醇酸钙和氢氧化钙完全反应,不再对乙醇酸的回收率产生进一步的影响。随着搅拌温度的升高,乙醇酸回收率先升高再降低(图6-b),在50 ℃时达到最高值3.39 g,回收率为84.80%。在较低温度下,搅拌温度的升高有利于提高反应速率和底物活性,从而促进乙醇酸的回收;而当温度升高到一定程度时,反应系统中可能发生一些不利的副反应,导致乙醇酸的缩聚或其他副产物的生成,从而降低乙醇酸的回收率。如图6-c所示,随着反应时间的延长,乙醇酸的回收率呈现上升趋势,1 h后趋于稳定,此时乙醇酸的回收率达到最高值87.50%。综上,确认酸化的最佳条件为硫酸添加量20 mL,搅拌温度50 ℃,搅拌时间1 h。
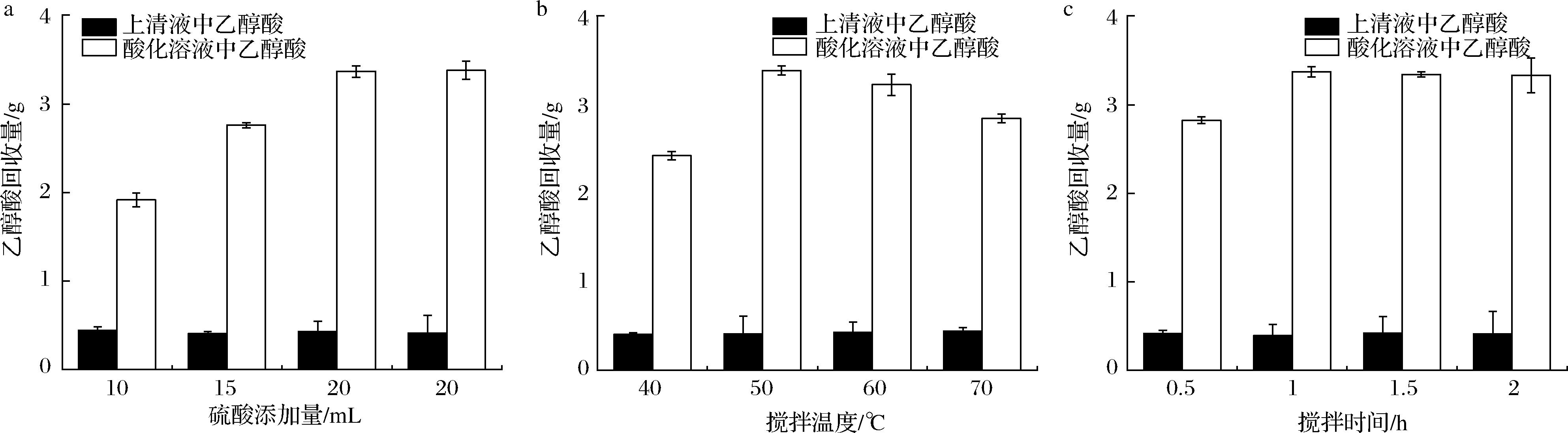
a-硫酸添加量;b-搅拌温度;c-搅拌时间
图6 酸化过程对乙醇酸回收量的影响
Fig.6 Effect of acidification process on the recovery of glycolic acid
2.2.4 乙醇酸水溶液除盐过程优化及结晶纯度检测
初步分离得到的乙醇酸溶液中含有部分盐离子且乙醇酸浓度较低,需要通过异丙醇除盐和蒸发浓缩使其达到降温结晶的要求。因此,对异丙醇添加倍数和旋蒸温度进行研究。如图7-a所示,随着异丙醇添加量的增加,乙醇酸回收率先增高后趋于稳定,当异丙醇添加量为乙醇酸理论质量3倍时,回收率最高为87.48%,这可能是因为3倍异丙醇已经完全除去了溶液中的盐离子,使得后续的降温结晶过程得以充分进行。图7-b的结果显示,在40 ℃和50 ℃浓缩时,乙醇酸的回收率没有明显变化,但是50 ℃相比40 ℃节约了大量时间。然而当温度升至60 ℃时,乙醇酸的回收率急剧下降。这是因为随着温度的升高,溶液出现剧烈沸腾,导致部分乙醇酸被异丙醇带走,从而造成了明显损失。综上,确认除盐和浓缩过程中,最佳异丙醇添加量为3倍,旋蒸温度50 ℃。随后开展结晶研究,如图8-a所示,冷冻干燥后的乙醇酸晶体颗粒透明,呈菱形,与标品形状相近,经过检测,其纯度达到了99.50%,符合市售优级品标准要求。
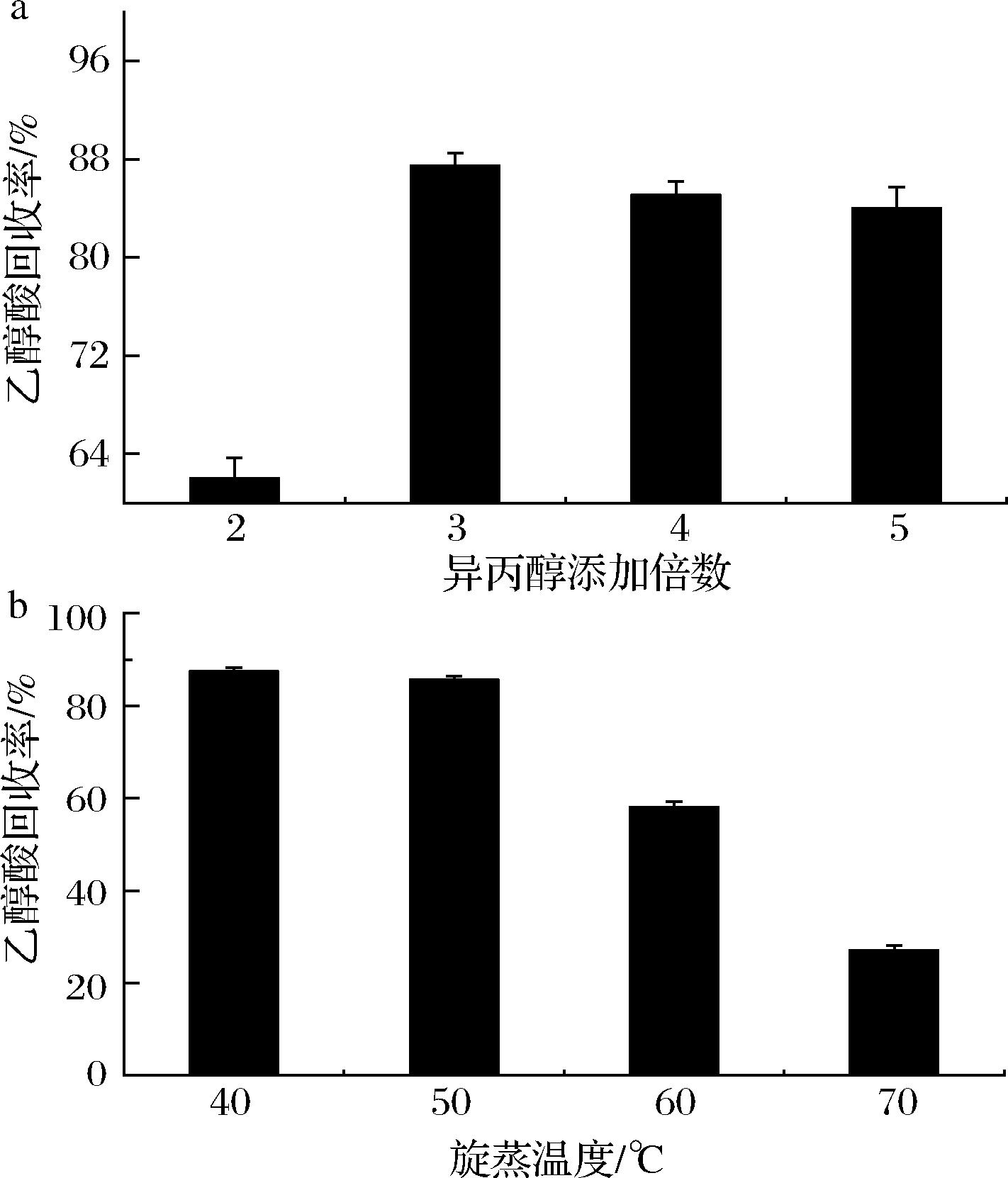
a-异丙醇添加倍数;b-旋蒸温度
图7 异丙醇添加量和旋蒸温度对乙醇酸回收率的影响
Fig.7 Effect of isopropanol addition and rotary evaporation temperature on the recovery of glycolic acid

a-乙醇酸;b-聚乙醇酸
图8 制备的乙醇酸及聚乙醇酸样品
Fig.8 Prepared glycolic acid and polyglycolic acid samples
2.3 PGA结构表征
2.3.1 PGA红外表征
采用共沸蒸馏法进行聚合,所得产物呈白色粉末状(图8-b),其红外光谱(图9)与文献报道聚乙醇酸红外谱图基本一致[21],具体峰值与官能团归属如下:1 744 cm-1处聚合物酯羰基(C![]() O)的伸缩振动吸收峰;1 095 cm-1处聚合物酯基中的C—O伸缩振动吸收峰;3 512 cm-1处为聚合物末端羟基O—H伸缩振动吸收峰;2 961 cm-1处为聚合物中亚甲基C—H伸缩振动峰;1 418 cm-1处为亚甲基C—H的弯曲振动吸收峰。因此,可以确定所得产物为聚乙醇酸。
O)的伸缩振动吸收峰;1 095 cm-1处聚合物酯基中的C—O伸缩振动吸收峰;3 512 cm-1处为聚合物末端羟基O—H伸缩振动吸收峰;2 961 cm-1处为聚合物中亚甲基C—H伸缩振动峰;1 418 cm-1处为亚甲基C—H的弯曲振动吸收峰。因此,可以确定所得产物为聚乙醇酸。
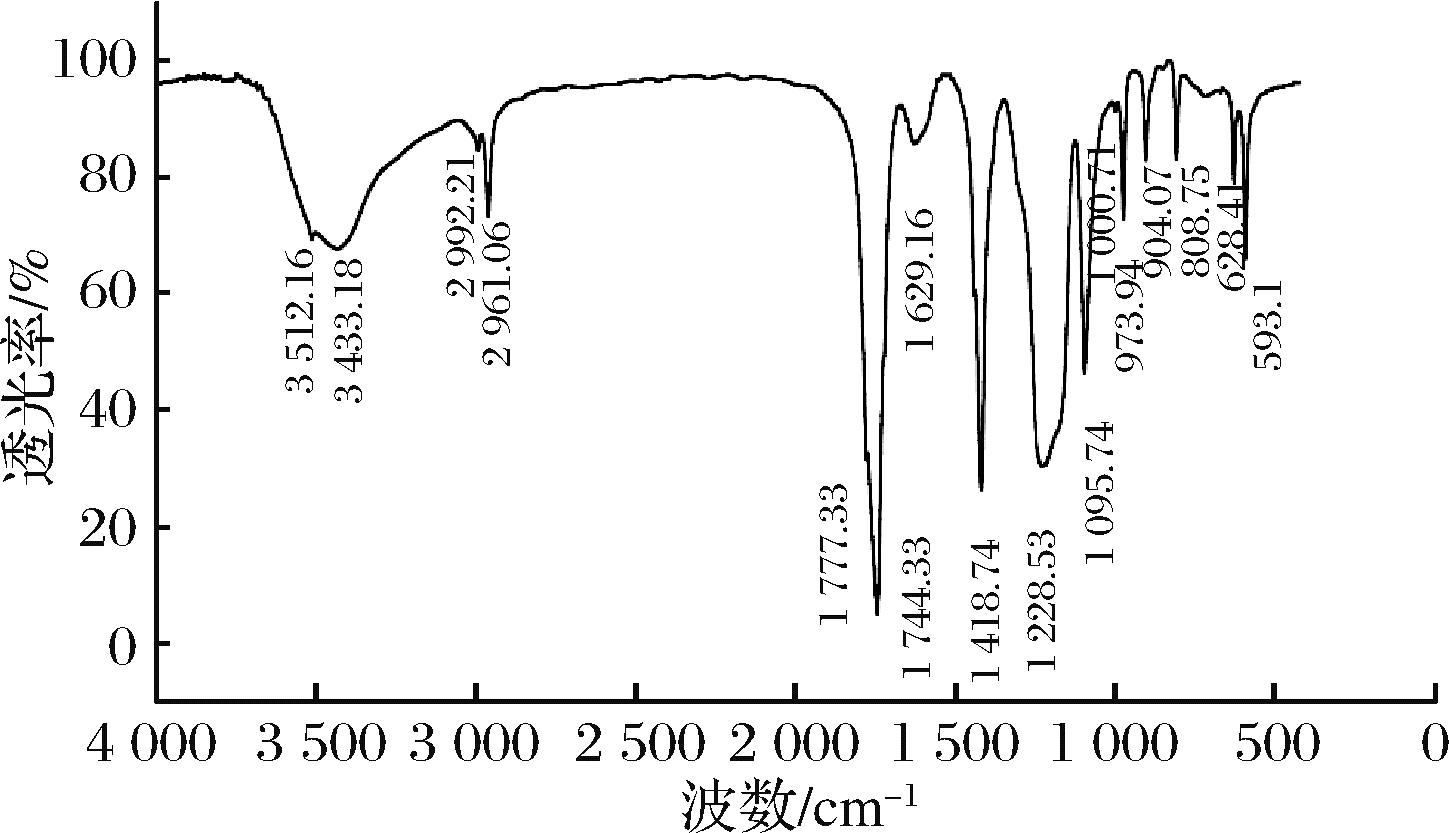
图9 聚乙醇酸红外表征
Fig.9 Infrared characterization of polyglycolic acid
2.3.2 PGA核磁表征
核磁共振谱图是通过研究原子核对射频辐射的吸收来进行定性分析,从而对各种有机和无机物的成分和结构进行表征。由图10可知,所制备样品核磁图谱共有2个峰,其中5.4 μL/L的峰为聚合物亚基的共振形成,而11.6 μL/L的峰为残留的三氟乙酸的非氘峰。上述结果与文献报道基本一致[21],这表明通过共沸蒸馏法成功聚合得到了聚乙醇酸。
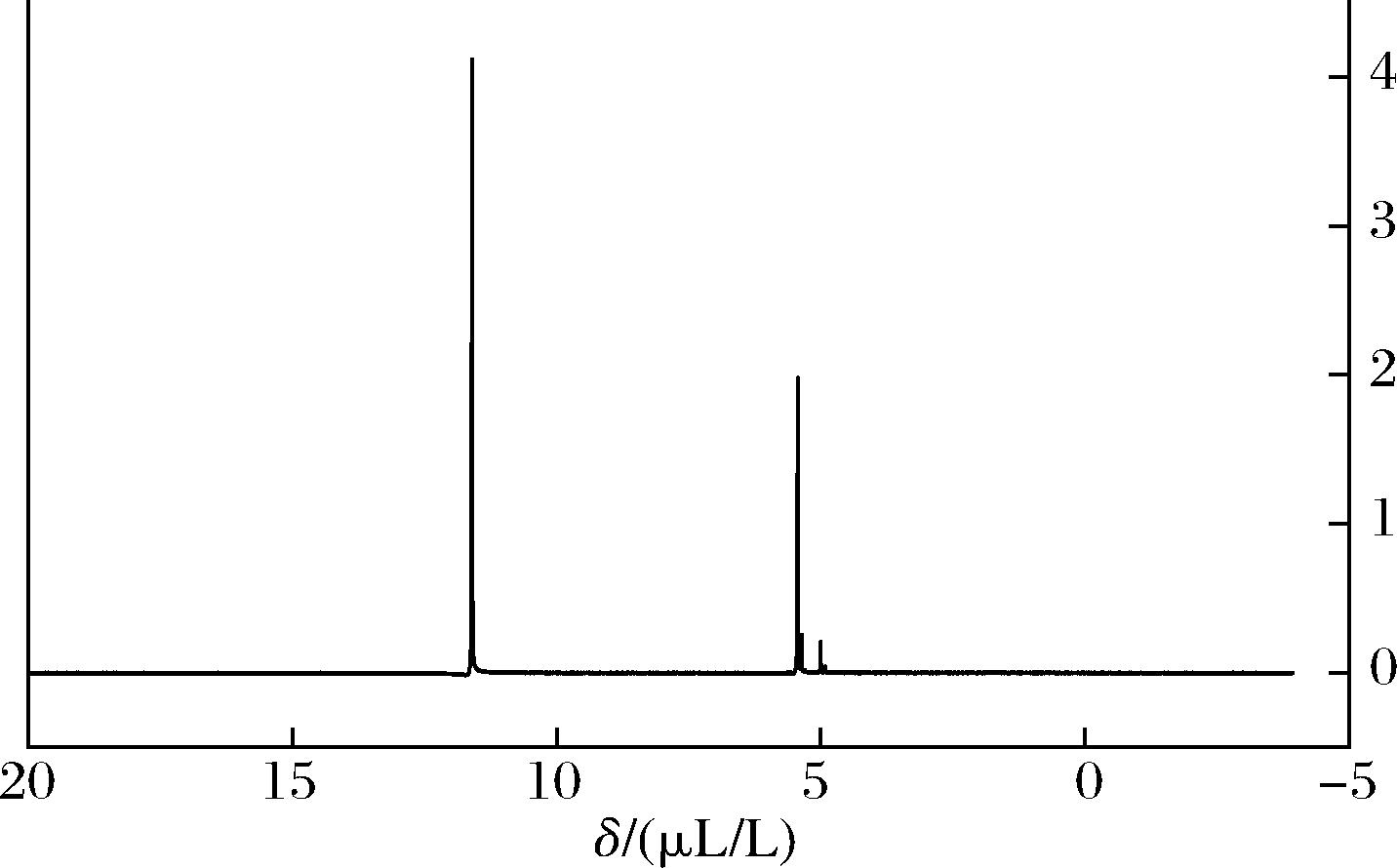
图10 聚乙醇酸核磁表征
Fig.10 NMR characterisation of polyglycolic acid
2.3.3 PGA结晶性能
聚合物根据其超分子结构可分为结晶型和非结晶型,结晶型聚合物的分子链呈有规则的排列,具有较高的耐热性能和机械性能[22],应用更为广泛。如图11所示,共沸蒸馏法合成的聚乙醇酸结晶度较高,约为89.60%,其(110)面和(020)面衍射峰位置分别在2θ为22.2°、28.9°附近,与文献报道一致[23]。从结晶程度上来看,共沸蒸馏法使乙醇酸分子极性增加,排列更规整。
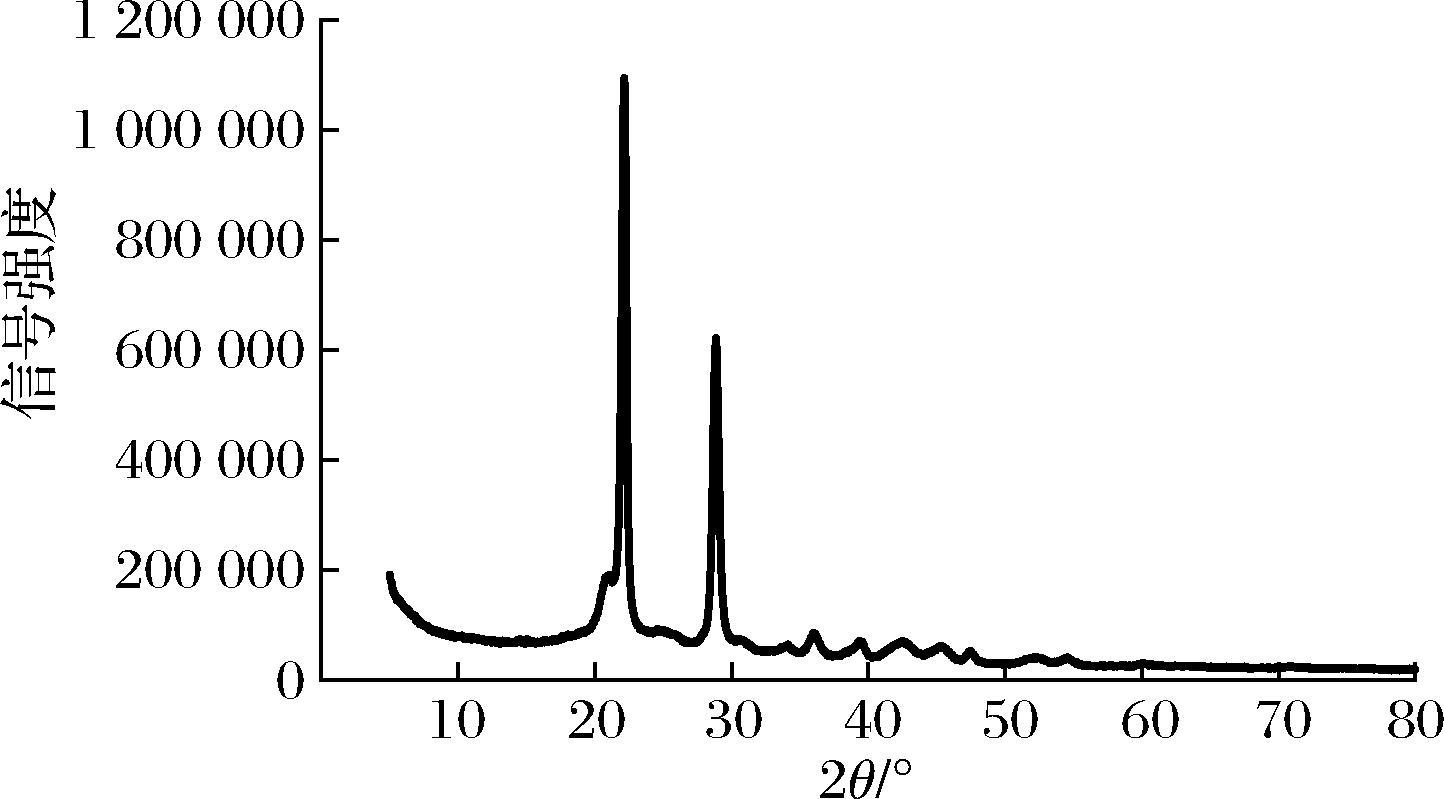
图11 聚乙醇酸X射线衍射图
Fig.11 X-ray diffractogram of polyglycolic acid
3 结论
本研究利用自制生物质糖进行发酵,通过系统的分离纯化研究,建立了低成本生物基乙醇酸和聚乙醇酸的生产工艺。其中玉米芯水解液葡萄糖质量浓度达到148.05 g/L,利用其发酵5 L罐乙醇酸产量达到49.80 g/L,实现了产量和效率的显著提升;分离纯化后生物基乙醇酸回收率达到87.50%,晶体纯度达到99.50%;利用其进行共沸蒸馏聚合,获得了高结晶度的聚乙醇酸样品。在后续的研究中,应优化分离纯化及聚合方法,提高乙醇酸的提取率,改善聚乙醇酸的性能,最终生产品质更优、含量更高的乙醇酸和聚乙醇酸,为推动其在包装、纤维、生物医药等领域的广泛应用奠定基础。
[1] SINGH V, TIWARI M.Structure-processing-property relationship of poly(glycolic acid) for drug delivery systems 1:Synthesis and catalysis[J].International Journal of Polymer Science, 2010, 2010:652719.
[2] MARIN E, BRICE O M I, CABALLERO-GEORGE C.Critical evaluation of biodegradable polymers used in nanodrugs[J].International Journal of Nanomedicine, 2013, 8:3071-3091.
O M I, CABALLERO-GEORGE C.Critical evaluation of biodegradable polymers used in nanodrugs[J].International Journal of Nanomedicine, 2013, 8:3071-3091.
[3] GAUDIN R, KNIPFER C, HENNINGSEN A, et al.Approaches to peripheral nerve repair:Generations of biomaterial conduits yielding to replacing autologous nerve grafts in craniomaxillofacial surgery[J].BioMed Research International, 2016, 2016:3856262.
[4] SCHMIDT C, BEHL M, LENDLEIN A, et al.Synthesis of high molecular weight polyglycolide in supercritical carbon dioxide[J].RSC Advances, 2014, 4(66):35099-35105.
[5] 王晓静, 魏琦峰, 任秀莲.乙醇酸和聚乙醇酸的制备与分离研究进展[J].化工进展, 2018, 37(9):3577-3584.WANG X J, WEI Q F, REN X L.Preparation and isolation of glycolic acid and polyglycolic acid[J].Chemical Industry and Engineering Progress, 2018, 37(9):3577-3584.
[6] 胡基埂. α-羟基乙酸合成与分析方法综述[J].化工进展, 2007, 26(4):496-500.HU J G.Advance in production and analysis of α-hydroxyacetic acid[J].Chemical Industry and Engineering Progress, 2007, 26(4):496-500.
[7] YU Y, SHAO M Y, LI D, et al.Construction of a carbon-conserving pathway for glycolate production by synergetic utilization of acetate and glucose in Escherichia coli[J].Metabolic Engineering, 2020, 61:152-159.
[8] XU S M, ZHANG L P, ZHOU S H, et al.Biosensor-based multigene pathway optimization for enhancing the production of glycolate[J].Applied and Environmental Microbiology, 2021, 87(12):e0011321.
[9] KAUR S, DHILLON G S, SARMA S J, et al.Waste Biomass:A Prospective Renewable Resource for Development of Bio-Based Economy/Processes[M].New York: Springer,2014:3-28.
[10] SUBHADRA B G.Sustainability of algal biofuel production using integrated renewable energy park (IREP) and algal biorefinery approach[J].Energy Policy, 2010, 38(10):5892-5901.
[11] JØRGENSEN H, KRISTENSEN J B, FELBY C.Enzymatic conversion of lignocellulose into fermentable sugars:Challenges and opportunities[J].Biofuels Bioproducts and Biorefining-Biofpr, 2007, 1(2):119-134.
[12] MOHR A, RAMAN S.Lessons from first generation biofuels and implications for the sustainability appraisal of second generation biofuels[J].Energy Policy, 2013, 63:114-122.
[13] XU Q Q, ZHAO M J, YU Z Z, et al.Enhancing enzymatic hydrolysis of corn cob, corn stover and sorghum stalk by dilute aqueous ammonia combined with ultrasonic pretreatment[J].Industrial Crops and Products, 2017, 109:220-226.
[14] LONG Y P, MA Y W, WAN J Q, et al.Hydrolysate from the enzymatic treatment of corn cob as a carbon source for heterotrophic denitrification process[J].Journal of Water Process Engineering 2023, 51:103473.
[15] HE O W, ZHANG Y F, WANG P, et al.Experimental and kinetic study on the production of furfural and HMF from glucose[J].Catalysts, 2020, 11(1):11.
[16] WU M J, GONG L, MA C L, et al.Enhanced enzymatic saccharification of sorghum straw by effective delignification via combined pretreatment with alkali extraction and deep eutectic solvent soaking[J].Bioresource Technology, 2021, 340:125695.
[17] POPOV S, SAPHIER O, POPOV M, et al.Factors enhancing the antibacterial effect of monovalent copper ions[J].Current Microbiology, 2020, 77(3):361-368.
[18] WANG X, YUAN W L, TAO J H, et al.Interactions between Escherichia coli survival and manganese and iron oxides in water under freeze-thaw[J].Environmental Pollution, 2021, 268:115237.
[19] LI Z G, TENG H, XIU Z L.Extraction of 1,3-propanediol from glycerol-based fermentation broths with methanol/phosphate aqueous two-phase system[J].Process Biochemistry, 2011, 46(2):586-591.
[20] 韩德新, 高年发, 周雅文.柠檬酸提取工艺研究进展[J].杭州化工, 2009, 39(3):3-6;19.HAN D X, GAO N F, ZHOU Y W.Research progress in citric acid extraction process[J].Hangzhou Chemical Industry, 2009, 39(3):3-6;19.
[21] 房鑫卿, 肖敏, 王拴紧, 等.高分子量聚乙交酯的合成及表征[J].高分子材料科学与工程, 2012, 28(1):1-4.FANG X Q, XIAO M, WANG S J, et al.Synthesis and characterization of high molecular weight polyglycolide[J].Polymer Material Science and Engineering, 2012, 28(1):1-4.
[22] ZHANG M C, GUO B H, XU J.A review on polymer crystallization theories[J].Crystals, 2016, 7(1):4.
[23] SANKO V, SAHIN I, AYDEMIR SEZER U, et al.A versatile method for the synthesis of poly(glycolic acid):High solubility and tunable molecular weights[J].Polymer Journal, 2019, 51(7):637-647.