墨红玫瑰(Rosa ‘Crimson Glory’),又名朱墨双辉,是蔷薇科蔷薇属落叶或半绿多年生木本植物,其花瓣大而厚,香气浓郁,可供食用,被称为“可食用花卉之王”[1]。由于云南的气候、海拔、光照等自然条件非常适合墨红玫瑰的生长,云南自从1989年引入墨红玫瑰后,已成为国内墨红玫瑰的主要种植生产地[2]。墨红玫瑰的可食用部位是其花瓣,已被广泛用于糕点、茶饮、果汁、果酒等食品加工中,不仅增加了食品的风味和观赏性,还赋予了产品独特的营养和功能,如云南鲜花饼已经成为国内外知名的特色美食。
研究表明,墨红玫瑰含有丰富的蛋白质、粗纤维、氨基酸、维生素、矿物质等营养成分,以及丰富的多酚、黄酮等活性物质,具备抗氧化、抗癌等功能活性,但其活性成分含量和功能活性受品种、产地影响较大[3-4]。董万鹏等[5]对不同食用玫瑰进行比较,发现墨红玫瑰品质最优,其花朵大而甜香,花期长,类黄酮类物质含量较高,达到79.3 mg/g。高嘉宁等[6]对不同产地、不同品种玫瑰花的多酚含量及抗氧化活性进行对比,发现墨红玫瑰的抗氧化活性仅次于紫花重瓣玫瑰。肖丽宏等[7]发现云南墨红玫瑰色素粗提物表现出较好的体外抗氧化活性,并具有一定抑制人结肠癌细胞Caco-2存活度的能力。张訸等[8]对云南不同产地的食用玫瑰花多酚含量及抗氧化活性进行分析,发现曲靖产墨红玫瑰中的多酚含量最高,达198.07 mg/g,抗氧化能力最强,对DPPH自由基的半清除质量浓度为27.52 μg/mL。总的说来,目前关于墨红玫瑰的研究主要集中在对不同品种、产地之间营养成分和抗氧化活性的简单比较,对于其在食品加工、美容护肤、保健功效、医药工业等领域的多样化研究较为缺乏。
在植物中活性成分提取过程中,溶剂种类和溶剂比例是重要的影响因素,选择合适的提取溶剂可以影响提取效率、活性成分的纯度和稳定性,而合适的溶剂比例有利于调节极性、提高溶解度和提取效率。乙醇作为一种最常用的提取溶剂,具有无毒且稳定、溶解范围广、提取效率高、对活性成分保护较好、提取产物纯度高、便于溶剂回收的特点。虽然已有文献报道了玫瑰乙醇提取物的降糖降脂、抑菌杀菌、美容护肤等功能活性[9-10],但目前对墨红玫瑰乙醇提取条件、护肤等方面的研究还罕见报道。基于此,本研究以云南产墨红玫瑰为研究对象,分析其主要营养成分,利用不同体积分数的乙醇提取其活性成分,探讨乙醇的溶剂比例对其化学成分、体外抗氧化活性和护肤活性的影响,为云南墨红玫瑰进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
墨红玫瑰,2023年4月购于云南省红河州大庄乡柴门庄园玫瑰种植基地。
2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT)、DPPH、ABTS、三(2-吡啶甲基)胺(tris-2-pyridylmethyl-amine,TPTZ)、曲酸、维生素C、芦丁、没食子酸,国药集团化学试剂有限公司;木犀草、山奈酚、芍药苷(生化色谱级),上海源叶生物科技有限公司;酪氨酸酶和左旋多巴(levodopa,L-DOPA),西格玛奥德里奇(上海)贸易有限公司。
1.2 仪器与设备
SUPERR-SS电子天平,烟台钧杰衡器有限公司;1260型高效液相色谱仪,美国Agilent公司;YB-250A高速多功能打粉机,永康市速峰工贸有限公司;H-2959R高速(冷冻)离心机,湘仪离心机仪器有限公司;SpectraMax PIus384型酶标仪,美国Molecular Devices公司;SB25-12DTDS超声波清洗机,宁波新艺超声设备有限公司。
1.3 实验方法
1.3.1 营养成分及矿物质元素含量测定
根据 GB 5009.3—2016《食品安全国家标准 食品中水分的测定》测定水分含量;根据 GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》测定蛋白质含量;GB 5009.4—2016《食品安全国家标准食品中灰分的测定》测定灰分含量;根据GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》测定脂肪含量;根据GB 12456—2021《食品安全国家标准 食品中总酸的测定》测定总酸含量。根据 GB 5009.86—2016《食品安全国家标准 食品中抗坏血酸的测定》测定维生素含量;根据GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》测定还原糖含量;根据 GB 5009.268—2016《食品安全国家标准 食品中多元素的测定》测定多元素含量(包括钙、铁、锌、镁、钠、钾等)。
1.3.2 氨基酸含量的测定
1.3.2.1 代谢物提取
取100 mg样品,加入300 μL预冷的甲醇-乙腈-水溶液(体积比2∶2∶1),并添加3颗钢珠,置于组织破碎仪中匀浆破碎。随后加入700 μL预冷的甲醇-乙腈-水溶液(体积比2∶2∶1),进行涡旋混匀,并在冰浴中超声处理30 min。样品在4 ℃下经过16 000×g离心30 min,取上清液后在高速真空浓缩离心机中挥干。将样品复溶于100 μL的50%乙腈溶液中,在4 ℃下20 000×g离心20 min,取上清液进行质谱进样分析。
1.3.2.2 超高效液相色谱条件
利用Shimadzu Nexera X2 LC-30AD高效液相色谱仪进行样品分析,使用Waters UPLC BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm)。设置流动相A为含20 mmol/L乙酸铵的5%乙腈水溶液(pH 9.45),流动相B为100%乙腈。样品在50%乙腈水溶液中复溶至100 μL,通过自动进样器注入2 μL样品。色谱条件设置为:柱温40 ℃,流速300 μL/min。液相梯度如下:起始0~0.1 min,90% B;0.1~2 min,B渐减至70%;2~5 min,B渐减至50%;5~7.5 min,B渐减至40%;7.5~9.4 min,保持40% B;9.4~9.5 min,快速恢复至90% B;最后9.5~12 min,维持90% B。
1.3.2.3 质谱条件
采用5500QTRAP质谱仪在正离子模式下进行质谱分析。质谱仪的ESI源参数设置如下:离子源温度为550 ℃,Ion Source Gas1(GAS1)设定为40,Ion Source Gas2(GAS2)设定为50,Curtain Gas(CUR)设定为35,离子喷雾电压浮动设定为5 500 V。采用MRM模式对待测离子对进行检测。
1.3.2.3 墨红玫瑰提取物的制备
新鲜墨红玫瑰花瓣去除花蕊及杂质后,冻干后,粉碎过40目筛。称取10 g样品,按料液比1∶36(g∶mL)分别加入体积分数为0%、50%、80%和100%的乙醇水溶液,在50 ℃条件下超声波辅助提取40 min,重复提取3次,提取液过滤合并,并在50 ℃下真空浓缩至浸膏,冻干即得到墨红玫瑰花提取物(dry extract,DE),4 ℃保存备用。
1.3.4 总酚含量的测定
参考THAVAMONEY等[11]方法测定总酚含量有所改动,将样品溶液置于酶标板中,随后加入福林酚试剂和Na2CO3溶液。接着,在避光条件下反应30 min,最后在765 nm波长下测定反应混合物的吸光值。同时,为了建立标准曲线,使用不同质量浓度的没食子酸标准溶液(20、40、60、80、100 μg/mL)进行相同过程的操作,随后根据标准曲线的吸光值对没食子酸质量浓度建立关系,计算样品中总酚含量。
1.3.5 总黄酮含量的测定
参考HUANG等[12]方法测定总黄酮含量,在室温条件下取40 μL样品溶液,依次加入NaNO2、Al(NO3)3和NaOH溶液,并允许反应。之后,在510 nm波长下测定反应混合物的吸光值。为建立标准曲线,相同条件下使用质量浓度分别为20、40、80、120、160、200 μg/mL的芦丁标准溶液测定其吸光度。根据标准曲线,计算样品中的总黄酮含量,结果以毫克芦丁当量每克干提取物(mg RE/g DE)的形式表示。
1.3.6 抗氧化活性的测定
1.3.6.1 DPPH自由基清除能力
参考GHANE等[13]方法测定样品中的DPPH自由基清除能力。在室温下,将100 μL样品溶液和100 μL 0.15 mmol/L DPPH溶液混合,避光反应30 min后,测定517 nm处的吸光度值(As)。利用溶液代替样品的反应作为空白(Ac),以及溶液代替DPPH溶液的反应作为样品空白(Ab)。采用维生素C和BHT作为阳性对照,每个实验重复3次。利用公式(1)计算样品中DPPH自由基的清除率,并计算样品清除DPPH自由基的半抑制质量浓度(half maximal inhibitory concentration,IC50),以评估其抗氧化性能,单位为mg/mL。
清除率![]()
(1)
1.3.6.2 ABTS阳离子自由基清除能力的测定
参考SAREGA等[14]方法测定样品中的ABTS阳离子自由基清除能力。进行了以下简化实验:先制备ABTS工作液,混合7 mmol/L的ABTS和140 mmol/L的过硫酸钾(体积比625∶11)在室温下避光反应12 h。然后,通过适当稀释,使ABTS工作液在734 nm处的吸光值约为0.70。实验在96孔酶标板中进行,每孔加入50 μL样品溶液和200 μL ABTS工作液,混合后避光反应6 min。使用维生素C和BHT作为阳性对照,每个实验进行3次重复。通过测定734 nm处的吸光度,计算样品的ABTS阳离子自由基清除率,并用IC50值表示其抗氧化活性。
1.3.6.3 铁离子还原能力
参考DAI等[15]方法测定样品的铁离子还原能力(ferric reducing ability of plasma,FRAP)。为了测定样品的铁离子还原能力,在常温下,将50 μL待测样品添加至酶标板内,并加入250 μL的FRAP工作液,在37 ℃下孵育10 min,然后测定反应体系在593 nm波长处的吸光度值。以不同质量浓度(10、20、40、60、80、100 mg/mL)的FeSO4标准溶液代替样品进行反应,以FeSO4质量浓度作为横坐标,吸光度为纵坐标,绘制标准曲线,用于计算样品的铁离子还原能力。
1.3.7 酪氨酸酶抑制活性
参照YU等[16]的方法并有所改动,在酶标板中加入50 μL的样品溶液,接着添加20 μL的100 U/mL酪氨酸酶溶液,然后加入140 μL的0.5 mmol/L L-DOPA底物溶液,混合均匀,并在37 ℃下的恒温反应15 min,然后测定反应体系在475 nm波长下的吸光度值,同时使用提取溶液代替样品作为空白对照,曲酸作为阳性对照。
1.3.8 高效液相色谱分析
将样品用色谱纯甲醇配制成5 mg/mL的溶液,并利用0.22 μm尼龙过滤器进行过滤,用于HPLC分析。色谱柱为Silgreen C18(4.6 mm×250 mm,5 μm),设置流动相为乙腈(A组分)与0.1%甲酸水溶液(B组分)。280 nm用于检测黄酮类物质,而520 nm用于检测花青素成分。色谱柱维持在30 ℃,样品的注入量为10 μL,流动相的流速设置为0.8 mL/min。液相洗脱程序定制如下:起始5%A,5 min后保持5%A,20 min递增至10%A,30 min至15%A,40 min至20%A,50 min至25%A,60 min至30%A,85 min直达100%A,之后调回至5%A直至95 min,并维持至100 min。
在HPLC分析中,使用没食子酸、芦丁、香草酸、丁香酸、槲皮素、杨梅素、矢车菊素-3,5-二葡萄糖苷(Cy3G5G)、矢车菊素-3-O-葡萄糖苷(Cy3G)、芍药素-3,5-二葡萄糖苷(Pn3G5G)、芍药素-3-O-葡萄糖苷(Pn3G)花卉中常见化合物作为标准物质。这些标准品分别精确称取1 mg,用色谱纯甲醇制备成质量浓度为50~500 μg/mL的混合标准溶液,在HPLC上进行检测。测定的峰面积与已知的进样量对其进行线性回归分析,得到标准曲线方程。利用所得到的标准曲线,对化合物进行定量。
1.4 数据处理
各项实验均进行3轮重复,结果表述为“均值±标准差”形式。相关数据的统计处理采用SPSS 24.0版本软件内嵌的单变量方差分析(ANOVA)工具,以检验样本间的差异性(P≤0.05)。图形绘制及呈现依靠Origin 2021软件与联川生物云平台(访问链接:https://www.omicstudio.cn/tool)的功能。
2 结果与分析
2.1 营养成分及矿物质成分分析
墨红玫瑰的花瓣不仅具有很高的观赏价值,也具有丰富的营养成分。如表1所示,墨红玫瑰水分含量较高(76.2%),总酸度较低(0.47 mg/100 g),有助于保持其新鲜度、平衡甜味和提升食用品质。同时含有丰富的蛋白质(4.68%)、脂肪(2.56%)、总糖(9.59%)和还原糖(6.26%),可为人体提供一定的氨基酸、脂肪酸、能量和营养,对于维持正常的生理功能和代谢活动具有重要作用。相比郑淑彦等[17]研究结果,墨红玫瑰维生素C的含量(113.84 mg/100 g)较高,有助于增强免疫力和抗氧化能力。灰分主要由无机盐及氧化物组成,墨红玫瑰的灰分含量达到5.33%,高于平阴玫瑰等其他玫瑰[18],可为人体提供更充足的无机元素。对墨红玫瑰中的20种氨基酸进行了定量分析,发现其氨基酸种类丰富,含量各异且组成合理。特别是天冬酰胺(49.75 μg/g)和天冬氨酸盐(35.79 μg/g)的含量显著高于其他氨基酸。天冬氨酸作为一种非必需氨基酸,对蛋白质合成和神经系统功能至关重要。色氨酸(22.84 μg/g)和酪氨酸(21.04 μg/g)作为必需氨基酸,分别参与血清素和多种神经递质的合成,对情绪调节、睡眠模式、应激反应和认知功能具有显著影响。此外亮氨酸(11.47 μg/g)、异亮氨酸(4.15 μg/g)和缬氨酸(12.45 μg/g)等支链氨基酸的含量也相对较高,它们对于能量代谢和肌肉生长具有重要作用。在各种矿物质元素中,墨红玫瑰的钾含量最高(10.67 g/kg),有助于维持细胞内外电解质平衡和心脏健康。同时富含镁、铁、铜、锌、钙、钠和锰元素,它们在骨骼健康、血红蛋白形成、酶活性和抗氧化防御等方面发挥着重要作用。特别是锌(16.21 mg/kg)和铁(34.44 mg/kg)的含量较高,对于增强免疫力和促进新陈代谢具有显著意义。上述结果充分表明了墨红玫瑰是一种营养丰富的食用花卉资源。
表1 墨红玫瑰中主要营养成分及矿物质元素含量
Table 1 The main nutrients and mineral contents in Rosa ‘Crimson Glory’.

类别指标含量(鲜重)营养成分 水分含量(76.20±2.65)%蛋白质(4.68±0.15)%脂肪(2.56±0.46)%灰分(5.33±0.10)%总糖(9.59±0.04)%还原糖(6.26±0.00)%维生素C(113.84±0.50)mg/100 g总酸(0.47±0.01)mg/100 g氨基酸 丙氨酸 (2.97±1.71)μg/mL精氨酸N/A天冬酰胺(49.75±4.94)μg/g天冬氨酸盐(35.79±3.16)μg/g半胱氨酸(0.60±0.31)μg/g谷氨酰胺(3.81±0.52)μg/g甘氨酸(0.79±0.18)μg/g组氨酸(1.69±0.37)μg/g异亮氨酸(4.15±1.04)μg/g亮氨酸(11.47±2.37)μg/gL-谷氨酸(3.80±0.71)μg/g赖氨酸(7.48±1.79)μg/g蛋氨酸(0.09±0.01)μg/g苯丙氨酸(6.48±0.50)μg/g脯氨酸(4.16±0.51)μg/g丝氨酸(6.23±0.62)μg/g苏氨酸(0.78±0.28)μg/g色氨酸(22.84±0.50)μg/g酪氨酸(21.04±6.40)μg/g缬氨酸(12.45±3.63)μg/g矿物质元素镁 (1.45±0.05)g/kg铁(34.45±1.36)mg/kg铜(4.83±0.20)mg/kg锌(16.22±0.83)mg/kg钙(0.70±0.03)g/kg钾(10.68±0.35)g/kg钠(0.10±0.00)g/kg锰(30.54±0.34)mg/kg
注:N/A表示未检测出。
2.2 总酚和总黄酮含量
多酚和黄酮类物质对于花卉的颜色形成、氧化应激、植物防御、信号传导、香味形成等有重要作用,同时也是花卉促进人体健康、提供营养和药用价值的关键活性成分[19]。结果表明,乙醇体积分数对墨红玫瑰的总酚含量(total polyphenol content,TPC)和总黄酮含量(total flavonoid content,TFC)提取效率有显著影响。如图1-a所示,使用50%乙醇进行提取时,总酚含量最高,达到54.21 mg/g,其次是100%乙醇(51.97 mg/g)、80%乙醇(51.15 mg/g)和纯水(0%乙醇,29.94 mg/g)。总黄酮含量的趋势相似,如图1-b所示,50%乙醇提取的总黄酮含量最高(14.20 mg/g),其次是100%乙醇(14.16 mg/g)、80%乙醇(13.83 mg/g)和纯水(11.73 mg/g)。这些结果表明,乙醇的存在有助于多酚和黄酮类物质的提取,且50%乙醇是最佳的提取溶剂,这与王双旦[20]的研究结果相似。
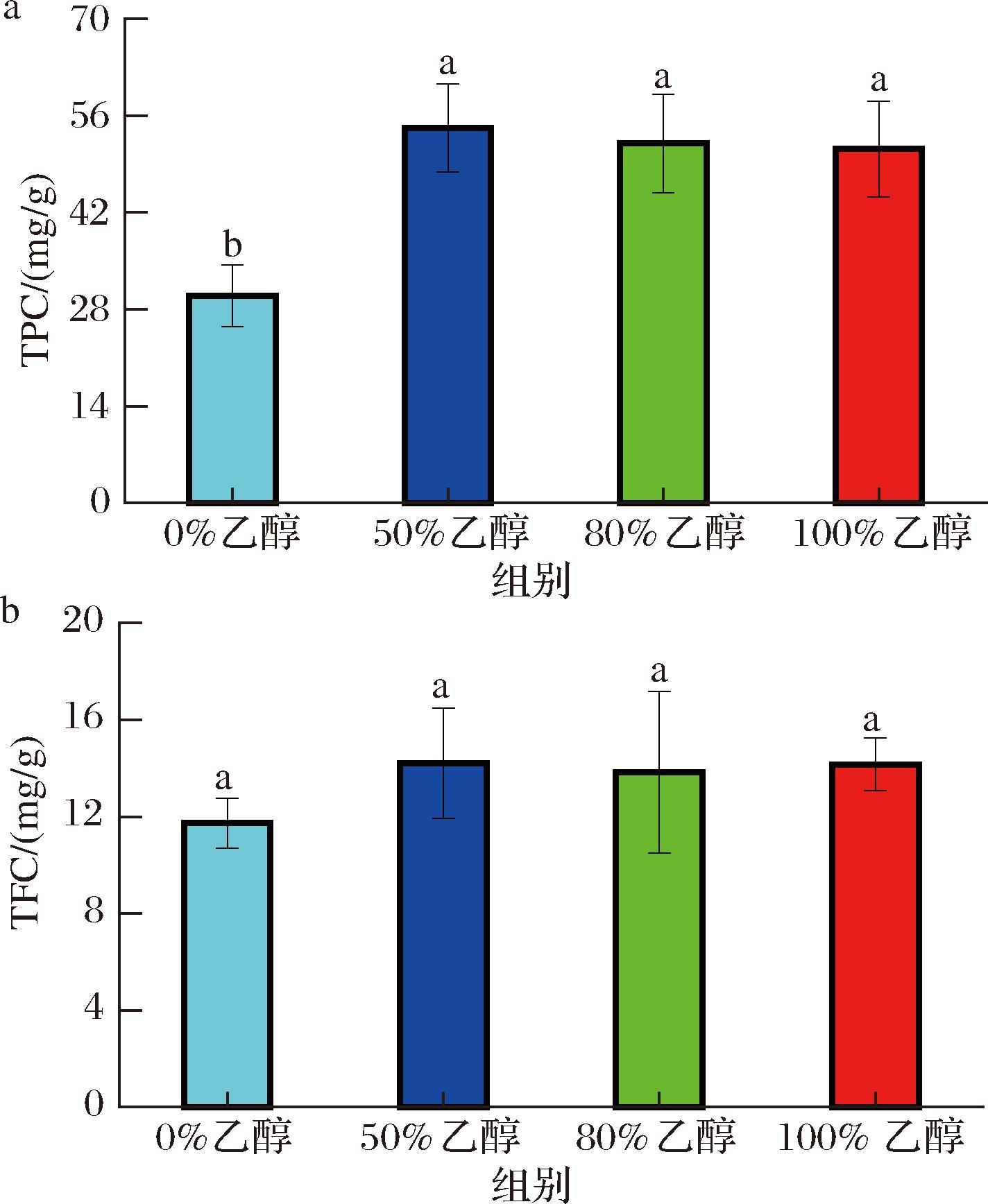
a-总酚含量;b-总黄酮含量
图1 乙醇体积分数对墨红玫瑰提取物总酚和总黄酮含量的影响
Fig.1 Effect of ethanol concentrations on the total phenolic and flavonoid content of Rosa ‘Crimson Glory’ extract
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 抗氧化活性的测定
2.3.1 DPPH自由基清除能力
DPPH自由基是一种广泛用于评估抗氧化特性的稳定自由基,样品提供氢原子与DPPH自由基发生反应,将其还原为无色的2,2-二苯基-1-吡啶。本文通过测定墨红玫瑰不同体积分数乙醇提取物对DPPH自由基的清除能力(图2),来评价其潜在的抗氧化效果。虽然一般认为DPPH自由基清除能力的强弱与总黄酮含量呈正相关关系[21],但本论文发现100%乙醇提取物清除DPPH自由基的IC50值最低(0.040 mg/mL),接近于阳性对照维生素C,显著优于其他体积分数乙醇提取物。其次是80%乙醇提取物(0.046 mg/mL)、50%乙醇提取物(0.050 mg/mL)和0%乙醇提取物(0.059 mg/mL),所有实验组均优于阳性对照BHT。这可能是较高体积分数的乙醇对植物细胞壁的渗透能力更强,有助于释放更多的细胞内抗氧化成分,同时也可能更有利于提取疏水性的抗氧化物质,这些物质通常具有较强的DPPH自由基清除能力。
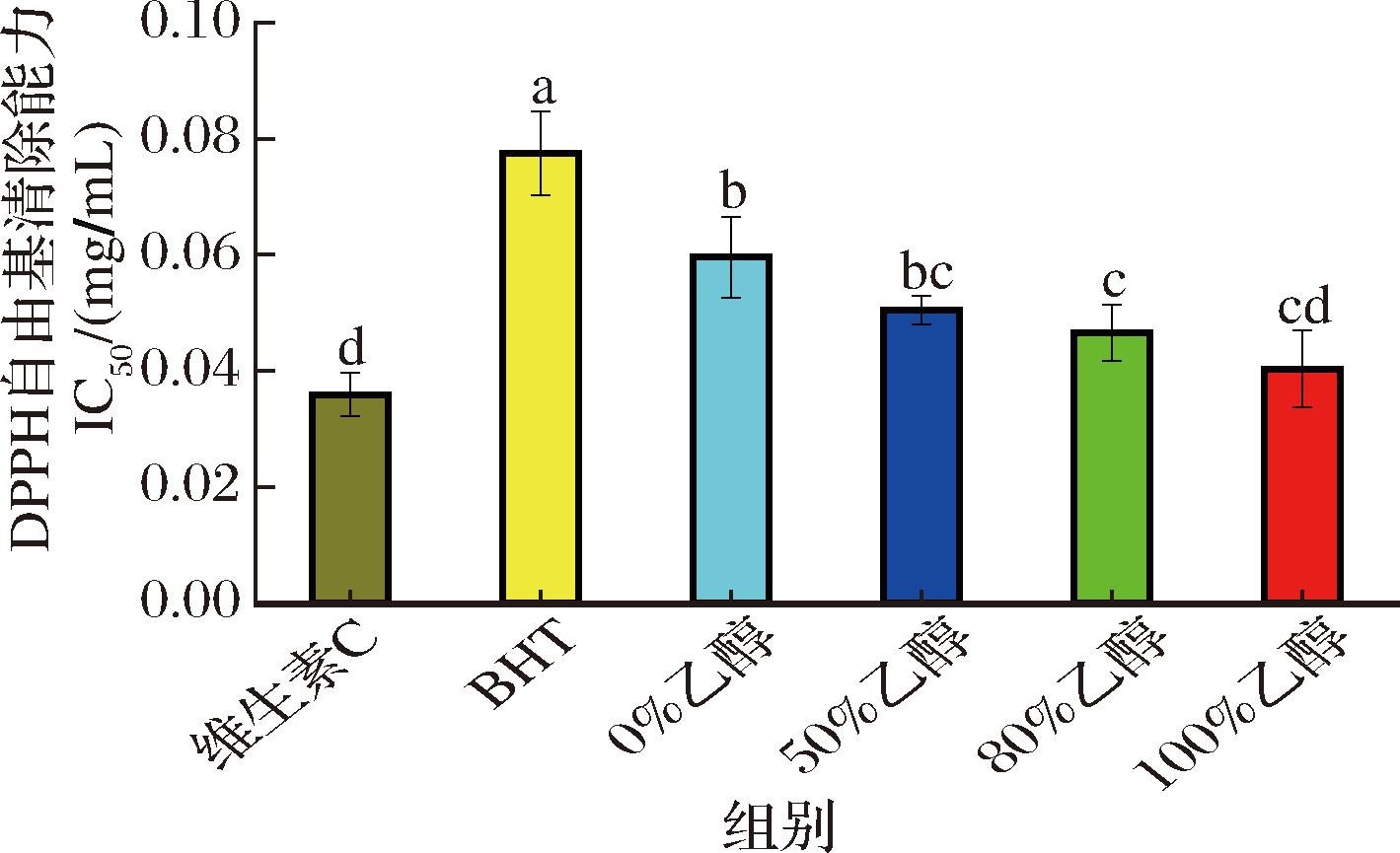
图2 墨红玫瑰提取物DPPH自由基的半抑制浓度
Fig.2 Half maximal inhibitory concentration of DPPH radicals of Rosa ‘Crimson Glory’ extract
2.3.2 ABTS阳离子自由基清除能力
ABTS可在过氧化氢和过渡金属离子的作用下生成ABTS阳离子自由基,进一步被抗氧化物质还原,使其恢复到无色的ABTS形态,因此被广泛用于评估抗氧化物质清除自由基能力[22]。由图3可知,墨红玫瑰的100%乙醇提取物同样展现出最强的清除ABTS阳离子自由基能力,其IC50值最低,为0.014 mg/mL,强于维生素C。其次是0%乙醇提取物(0.021 mg/mL)、50%乙醇提取物(0.029 mg/mL)和80%提取物(0.030 mg/mL),虽然均弱于维生素C,但均强于阳性对照BHT。
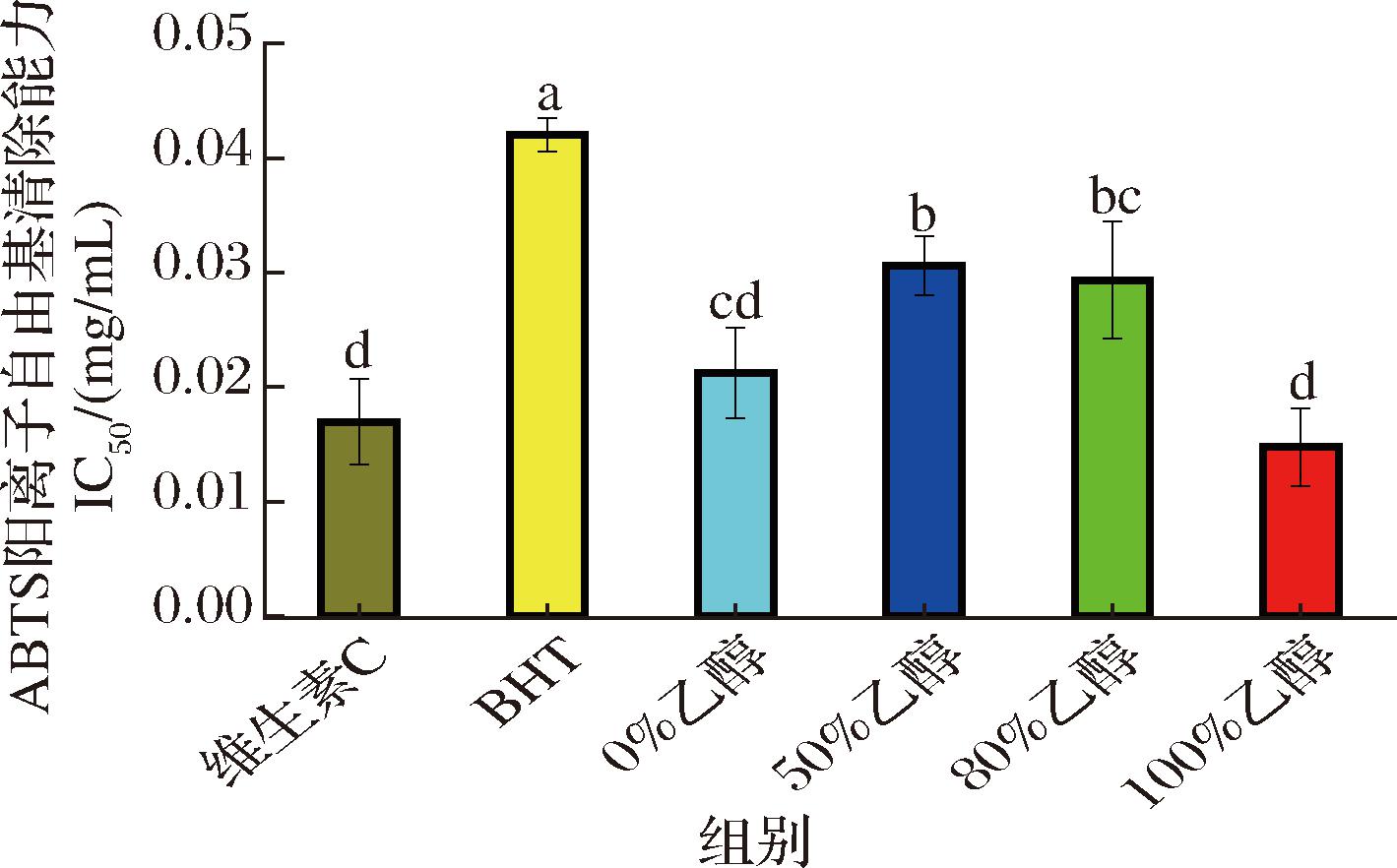
图3 墨红玫瑰提取物ABTS阳离子自由基的半抑制浓度
Fig.3 Half maximal inhibitory concentration of ABTS cationic radicals of Rosa ‘Crimson Glory’ extract
2.3.3 铁还原能力
在酸性环境下,Fe3+与TPTZ在FRAP试剂中形成蓝色的络合物。抗氧化物质通过将Fe3+还原为Fe2+,从而减少这种蓝色络合物的生成。与DPPH和ABTS实验侧重于评估氢供体的抗氧化能力不同,FRAP法主要衡量的是还原剂的抗氧化效果,即直接还原金属离子的能力[22]。如图4所示,乙醇体积分数为50%的墨红玫瑰提取物展现了最高的铁还原能力(64.75 mg FeSO4/g),甚至高于维生素C,而0%乙醇提取物(34.50 mg FeSO4/g)的铁还原能力相对较低。这一结果与总酚和总黄酮含量的趋势相一致,也与BURLANDO等[23]研究结果相似。综合3个抗氧化实验的结果来看,100%乙醇提取物还原自由基的能力较强,50%乙醇提取物的还原金属离子能力较强,纯水(0%乙醇提取物)的抗氧化活性相对较弱,但不同体积分数乙醇提取物的抗氧化能力几乎都强于商业抗氧化剂BHT。因此,不同乙醇体积分数对总酚、总黄酮以及抗氧化物质的提取具有选择性作用,需要根据实际需要进行合理选择以优化提取工艺,以获得具有更高生物活性的墨红玫瑰提取物。
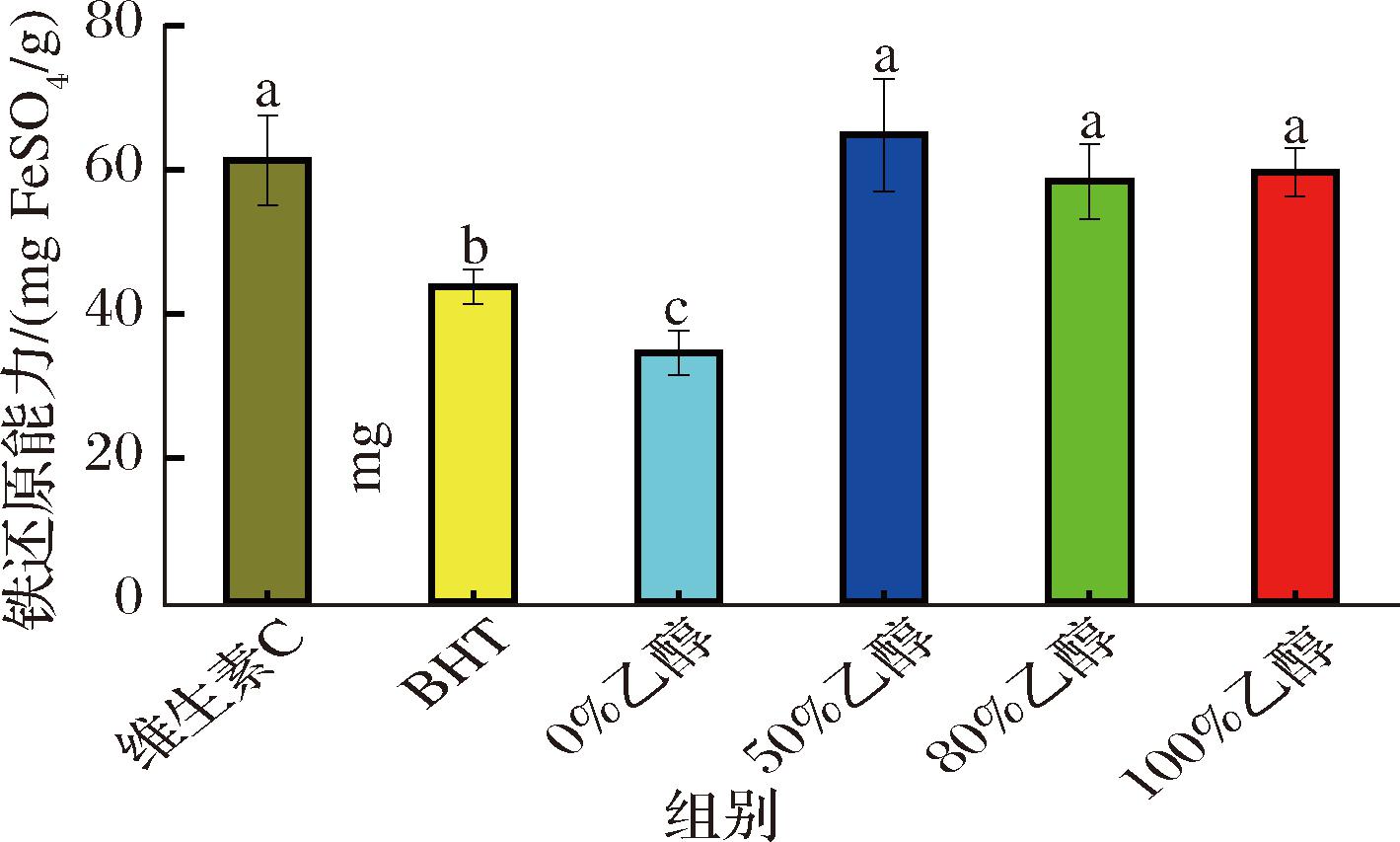
图4 墨红玫瑰提取物铁还原能力
Fig.4 Ferric reducing antioxidant ability of Rosa ‘Crimson Glory’ extract
2.4 酪氨酸酶抑制能力
酪氨酸酶是一种调节黑色素生物合成过程中的关键限速酶,酪氨酸酶抑制剂能够减轻皮肤色素沉着,对于治疗色素相关疾病和开发美白产品具有潜在价值,在食品、医药和美容行业中的应用前景广阔[23]。由图5可知,100%乙醇提取物具有最强的酪氨酸酶抑制能力(tyrosinase inhibition capacity,TYR),其IC50值最低,为0.042 mg/mL,显示出了开发为酪氨酸酶抑制剂的优良潜力。其次是80%乙醇提取物(0.047 mg/mL)、50%乙醇提取物(0.056 mg/mL)和0%乙醇提取物(0.064 mg/mL)。可能是具有酪氨酸酶抑制作用的关键化合物倾向于溶解在极性较低的乙醇溶剂中,从而在提取过程中被更有效地富集。
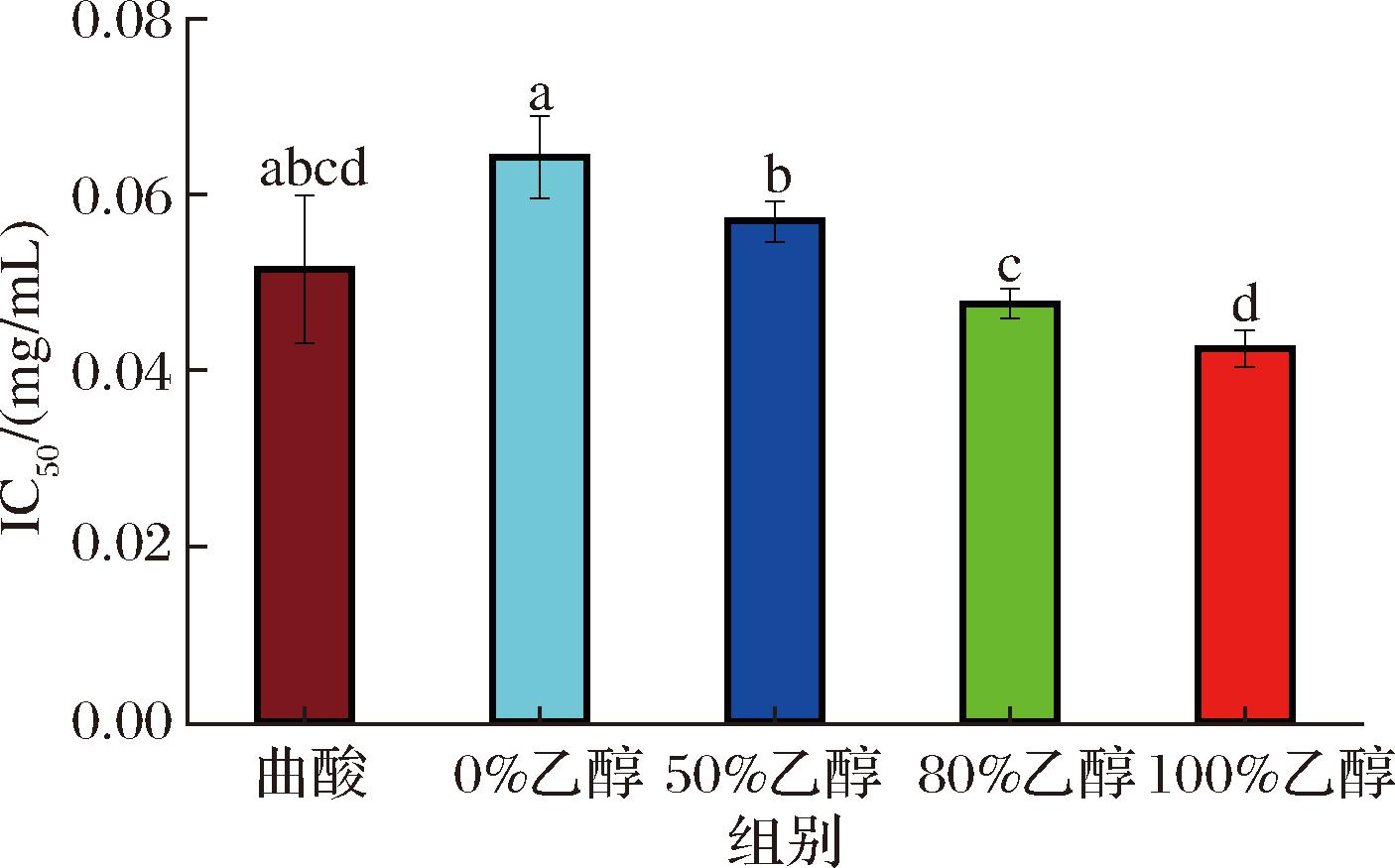
图5 墨红玫瑰提取物酪氨酸酶抑制能力
Fig.5 Tyrosinase inhibition activity of Rosa ‘Crimson Glory’ extract
2.5 HPLC分析结果
玫瑰中含有丰富的生物活性化合物,具有抗氧化、抗炎等多种活性,因此在药用、保健和美容领域具有重要的应用潜力[24]。根据图6-a和表2可知,所有12种目标化合物在不同乙醇体积分数的提取物中均被检出,且含量分布呈现出显著差异,其中100%乙醇的主要化合物具有最高的色谱峰,其次是50%乙醇、80%乙醇和0%乙醇,这也验证了前面抗氧化实验的结果。所测定化合物中,含量的高低顺序依次为儿茶素、山奈酚、矢车菊素-3,5-二葡萄糖苷、槲皮素、木樨草素、杨梅素、鞣花酸、芹菜素、香草酸、芍药素-3,5-二葡萄糖苷、芍药素-3-O-葡萄糖苷和矢车菊素-3-O-葡萄糖苷。值得注意的是,在50%乙醇体积分数下,儿茶素的含量最高,达到6.56 mg/g,而在100%乙醇体积分数下,儿茶素含量为4.77 mg/g。这表明50%和100%的乙醇体积分数对于提取和富集墨红玫瑰花中的黄酮类化合物尤为有效。进一步将这12种化合物与所测指标进行关联性分析(图6-b),发现其中芍药素-3,5-二葡萄糖苷、木樨草、香草酸与TPC高度相关,杨梅素、山奈酚、儿茶素与TFC高度相关,矢车菊素-3-O-葡萄糖苷、香草酸与ABTS阳离子自由基清除能力高度相关,杨梅素、山奈酚、儿茶素与FRAP高度相关,芹菜素与DPPH自由基清除能力和FYR高度相关。这也进一步验证了论文前面的抗氧化和酪氨酸酶抑制能力的实验结果。
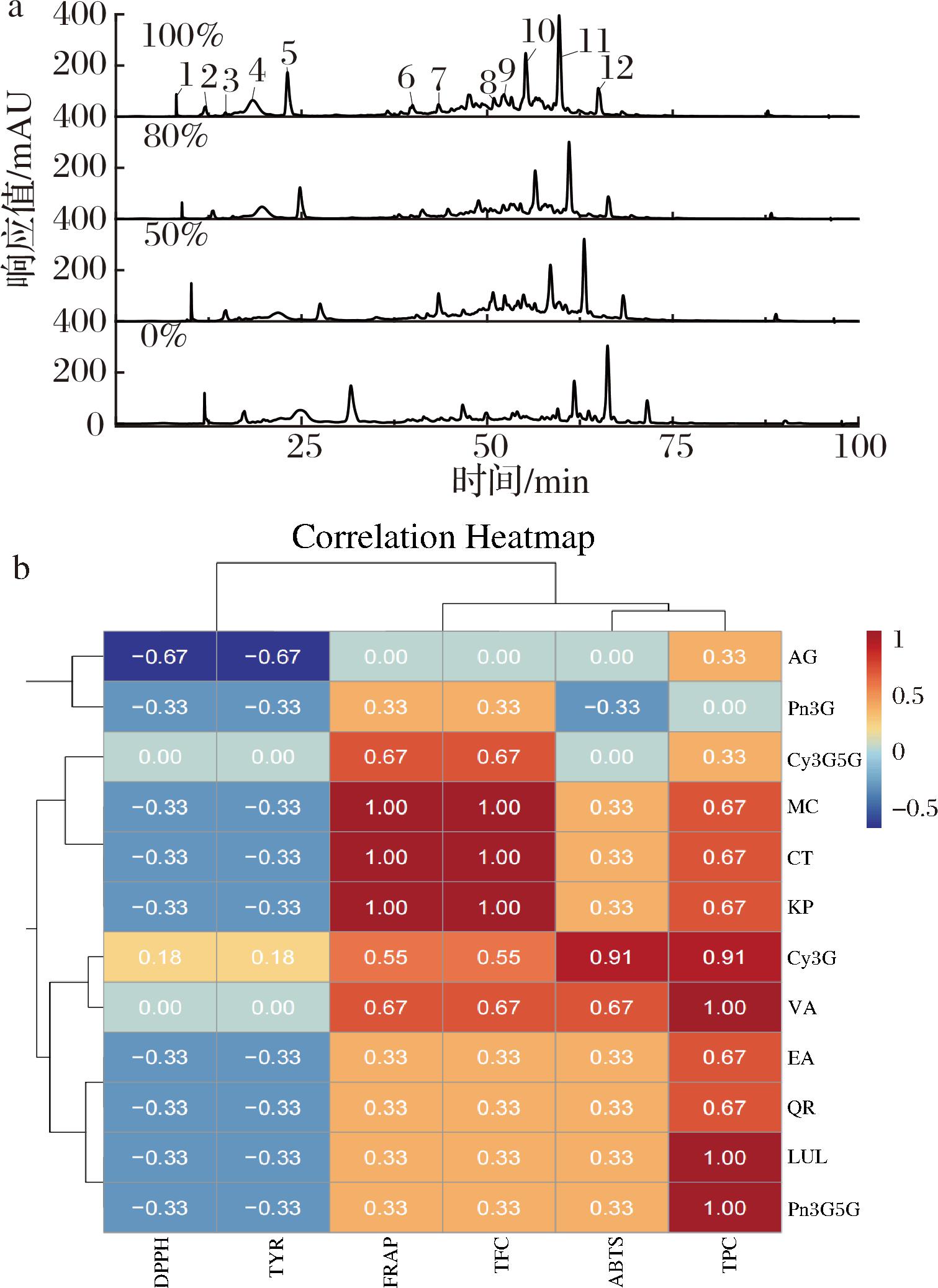
a-HPLC色谱图;b-各化学成分和功能活性的Spearman分析
图6 墨红玫瑰提取物化学成分和功能活性关联分析
Fig.6 Correlation analysis of Rosa ‘Crimson Glory’ extract chemical composition and functional activity
注:1-Cy3G;2-Pn3G;3-Cy3G5G;4-CT;5-Pn3G5G;6-AG;7-VA; 8-MC;9-EA;10-LUL;11-QR;12-KP。
表2 墨红玫瑰提取物的化合物含量
Table 2 Chemical compound contents of Rosa ‘Crimson Glory’ extracts

编号化合物化合物含量/(mg/g)0%乙醇50%乙醇80%乙醇100%乙醇1矢车菊素-3-O-葡萄糖苷0.03±0.00c0.06±0.00a0.01±0.00b0.01±0.00c2芍药素-3-O-葡糖糖苷0.15±0.00b0.16±0.00a0.11±0.00c0.19±0.00a3矢车菊素-3,5-二葡萄糖苷0.58±0.00b0.74±0.00a0.10±0.00c0.68±0.00ab4儿茶素1.04±0.00d6.56±0.01a2.67±0.01c4.77±0.01b5芍药素-3,5-二葡萄糖苷0.06±0.00c0.28±0.03a0.17±0.01b0.10±0.01c6芹菜素0.02±0.00d0.09±0.01c0.23±0.00a0.15±0.01b7香草酸0.02±0.00d0.22±0.00a0.11±0.01b0.09±0.00c8杨梅素0.19±0.01d0.54±0.00a0.27±0.00c0.35±0.01b9鞣花酸0.02±0.00d0.17±0.00b0.28±0.01a0.15±0.00b10木樨草0.02±0.00d0.17±0.00b0.37±0.01a0.26±0.00b11槲皮素0.02±0.00d0.19±0.00b0.48±0.00a0.18±0.00b12山奈酚0.13±0.01d1.25±0.00a0.34±0.01c0.92±0.00b
注:不同小写字母分别表示差异显著(P<0.05)。
2.6 相关性分析
相关性分析是一种统计方法,用于探索不同变量之间的线性关系,揭示它们之间的潜在联系,从而为形成新的科学假设和确定研究方向提供依据[25]。本研究对墨红玫瑰花提取物的总酚、总黄酮含量以及ABTS阳离子自由基和DPPH自由基清除能力、FRAP和酪氨酸酶抑制能力进行了综合的相关性分析。
由图7-a所示,资源描述与访问图(resource description and access diagrams,RDA),图中不同颜色的点表示不同组别的样品,箭头分别代表不同的活性指标。墨红玫瑰花的抗氧化性质(ABTS阳离子自由基清除能力、DPPH自由基清除能力和FRAP)与其酪氨酸酶抑制能力高度相关,多酚和黄酮含量与抗氧化性质和酪氨酸酶抑制能力高度相关。此外,图7-b热图分析进一步揭示了总酚和总黄酮含量与抗氧化能力之间存在显著的正相关,而与酪氨酸酶抑制能力之间则呈现显著的负相关。这些发现表明,墨红玫瑰花的功能活性并非只是由酚类和黄酮类化合物决定,可能是由多种化合物共同作用的结果。这些结果不仅验证了墨红玫瑰花提取物中总酚和总黄酮含量与抗氧化活性及酪氨酸酶抑制能力之间的关联,对于开发具有抗氧化和美白效果的天然产品具有一定的参考价值。
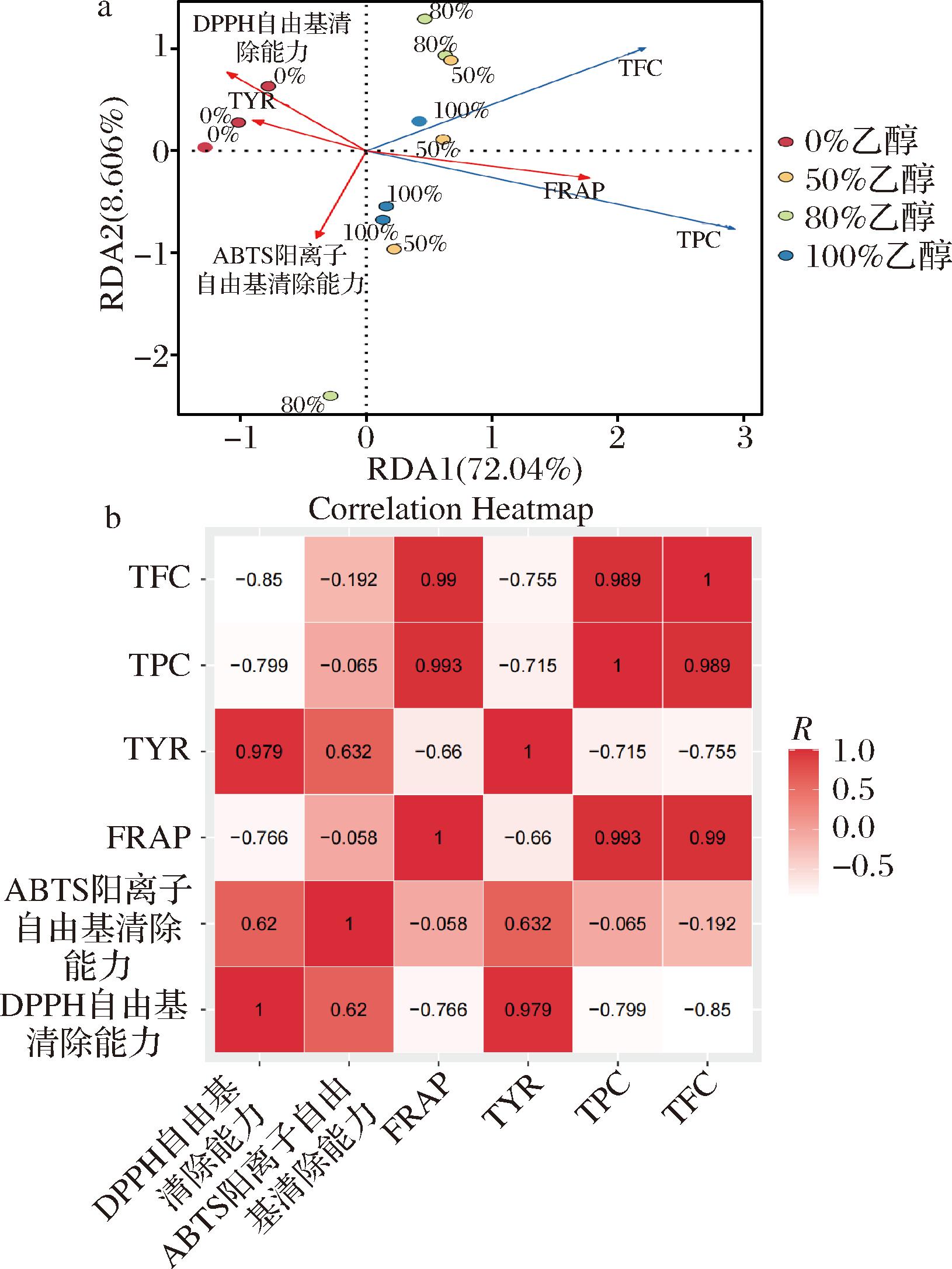
a-各样品组间关系分析图;b-各指标相关性热图
图7 各样品组间关系分析和各指标间相关性热图
Fig.7 The relationship analysis between each sample group and the correlation heatmap between each measurement index
注:EA为不同样品的乙醇浓度。
3 结论
墨红玫瑰作为一种具有高营养价值和显著抗氧化特性的可食用花卉,已在云南地区广泛种植并应用于食品加工中。本研究旨在探讨不同乙醇体积分数对墨红玫瑰花瓣中活性成分提取效率以及这些提取物的抗氧化活性和酪氨酸酶抑制能力的影响。
研究结果显示,墨红玫瑰花瓣含有丰富的营养成分,包括蛋白质、氨基酸、维生素和矿物质,以及具有生物活性的多酚和黄酮类化合物。在不同乙醇体积分数的提取条件下,总酚和总黄酮含量呈现出显著差异,其中50%乙醇提取物的总酚含量最高,而100%乙醇提取物的总黄酮含量最高。HPLC分析进一步确认了不同乙醇浓度提取物中12种活性化合物的含量,其中50%和100%乙醇提取物中这些活性成分含量最高。这表明乙醇体积分数对活性成分的提取效率具有显著影响,且不同体积分数的乙醇对特定化合物具有选择性提取作用。
在抗氧化能力方面,100%乙醇提取物在DPPH自由基和ABTS阳离子自由基清除实验中表现出最强的活性,而50%乙醇提取物在FRAP实验中表现最佳,甚至优于阳性对照维生素C,且不同浓度提取物几乎均高于阳性对照BHT。此外,100%乙醇提取物在抑制酪氨酸酶的实验中也展现出最强的活性,而0%乙醇(纯水)提取组虽然也具备了一定的抗氧化和酪氨酸酶抑制能力,但相对较弱。原因可能是醇溶剂在提取活性成分方面具备一定的优势,包括更高的提取效率、更好的溶解度以及对活性成分稳定性的保护等。水提取物中的活性成分虽然浓度较低,但若提取的总量较多,仍然可以表现出一定的功能活性,此外墨红玫瑰中可能也存在一些水溶性的活性物质,从而其纯水提取物也体现出一定的抗氧化和酪氨酸酶抑制活性。这些结果揭示了墨红玫瑰提取物在抗氧化和护肤方面的潜力,并为进一步将其开发为天然抗氧化剂和应用于美容护肤领域提供了科学依据。
综上所述,本研究揭示了不同乙醇体积分数对墨红玫瑰花瓣中活性成分提取效率和提取物功能活性的影响,为其在食品、美容和医药等领域的应用提供了重要的科学信息。未来的研究可以深入探索墨红玫瑰发挥其功能活性的具体作用机制和进一步的健康益处。
[1] QIU L Q, ZHANG M, MUJUMDAR A S, et al.Convenient use of near-infrared spectroscopy to indirectly predict the antioxidant activitiy of edible rose (Rose chinensis Jacq “Crimsin Glory” H.T.) petals during infrared drying[J].Food Chemistry, 2022, 369:130951.
[2] 王珍珍, 王其刚, 唐开学, 等.云南主栽食用玫瑰花香成分及关键花香基因表达分析[J].植物生理学报, 2019, 55(7):1038-1046.WANG Z Z, WANG Q G, TANG K X, et al.Analysis of volatile components and scent-related gene expressions of edible roses in Yunnan[J].Plant Physiology Journal, 2019, 55(7):1038-1046.
[3] 宁忻, 方伟, 董海燕, 等.云南墨红玫瑰主要营养成分分析[J].现代食品, 2021, 27(18):225-228.NING X, FANG W, DONG H Y, et al.Analysis and evaluation of the nutritional components in Rosa crimson glory[J].Modern Food, 2021, 27(18):225-228.
[4] 谢丽美, 晏慧君, 唐开学, 等.云南4个主栽食用玫瑰品种产量评价及营养成分分析[J].西南农业学报, 2022, 35(11):2627-2632.XIE L M, YAN H J, TANG K X, et al.Evaluation of yield and analysis on nutrient compositions of four edible rose varieties in Yunnan province[J].Southwest China Journal of Agricultural Sciences, 2022, 35(11):2627-2632.
[5] 董万鹏, 吴楠, 吴洪娥, 等.不同食用玫瑰生长特性、花品质及生理变化特征[J].热带农业科学, 2020, 40(8):6-11.DONG W P, WU N, WU H E, et al.Growth characteristics, flower quality and psychological changes of different varieties of edible roses[J].Chinese Journal of Tropical Agriculture, 2020, 40(8):6-11.
[6] 高嘉宁, 张丹, 何海燕, 等.不同产地、不同品种玫瑰花多酚含量及抗氧化活性研究[J].贵州科学, 2021, 39(1):1-9.GAO J N, ZHANG D, HE H Y, et al.Polyphenol content and antioxidant activity of Rosa rugosa of different varieties from different producing areas[J].Guizhou Science, 2021, 39(1):1-9.
[7] 肖丽宏, 李子兰, 李建宾, 等.云南墨红玫瑰花色素粗提物的体外抗氧化活性研究[J].食品科技, 2019, 44(7):291-296.XIAO L H, LI Z L, LI J B, et al.Antioxidant activity of the crude extracts of rose crimson glory pigment of Yunnan in vitro[J].Food Science and Technology, 2019, 44(7):291-296.
[8] 张訸, 刘云, 罗旭璐, 等.云南不同产地食用玫瑰花多酚含量及抗氧化活性[J].贵州农业科学, 2017, 45(2):150-153.ZHANG H, LIU Y, LUO X L, et al.Polyphenol content and antioxidant activity of edible roses from different producing areas in Yunnan[J].Guizhou Agricultural Sciences, 2017, 45(2):150-153.
[9] 兰卫. 小枝玫瑰醇提物降血糖降血脂舒张血管作用研究[J].中国食品添加剂, 2022, 33(7):59-66.LAN W.Study on Branchlets Rosa alcohol extract on lower glycemic and lipidemic index and vasodilation[J].China Food Additives, 2022, 33(7):59-66.
[10] 万晴晴. 平阴玫瑰花蕾醇提物对Staphylococcus aureus的抑菌活性、机理及其在猪肉中的抑菌应用[D].雅安:四川农业大学, 2022.WAN Q Q.Antibacterial activity and action mechanism of ethanol extract of Pinyin Rose bud against Staphylococcus aureus and its antibacterial application in pork[D].Ya’an:Sichuan Agricultural University, 2022.
[11] THAVAMONEY N, SIVANADIAN L, TEE L, et al.Extraction and recovery of phytochemical components and antioxidative properties in fruit parts of Dacryodes rostrata influenced by different solvents[J].Journal of Food Science and Technology, 2018, 55(7):2523-2532.
[12] HUANG R, WU W Y, SHEN S Y, et al.Evaluation of colorimetric methods for quantification of citrus flavonoids to avoid misuse[J].Analytical Methods, 2018, 10(22):2575-2587.
[13] GHANE S G, ATTAR U A, YADAV P B, et al.Antioxidant, anti-diabetic, acetylcholinesterase inhibitory potential and estimation of alkaloids (lycorine and galanthamine) from Crinum species:An important source of anticancer and anti-Alzheimer drug[J].Industrial Crops and Products, 2018, 125:168-177.
[14] SAREGA N, IMAM M U, OOI D J, et al.Phenolic rich extract from Clinacanthus nutans attenuates hyperlipidemia-associated oxidative stress in rats[J].Oxidative Medicine and Cellular Longevity, 2016, 2016:4137908.
[15] DAI J, MUMPER R J.Plant phenolics:Extraction, analysis and their antioxidant and anticancer properties[J].Molecules, 2010, 15(10):7313-7352.
[16] YU Q, FAN L P.Antityrosinase and antioxidant activity of Asparagus and its inhibition on B16F10 melanoma cells before and after hydrothermal treatment[J].Food Bioscience, 2021, 41:101026.
[17] 郑淑彦, 王伟, 董金金, 等.食用玫瑰营养保健功能及产品开发研究进展[J].食品研究与开发, 2016, 37(23):206-211.ZHENG S Y, WANG W, DONG J J, et al.Research progress on nutrition health function and product development of edible rose[J].Food Research and Development, 2016, 37(23):206-211.
[18] 李佳琦. 玫瑰花的营养、功能特性研究及其在再制奶豆腐中的应用[D].呼和浩特:内蒙古农业大学, 2021.LI J Q.Study on the nutritional and functional characteristics of rose and its application for reprocessing hurood[D].Hohhot:Inner Mongolia Agricultural University, 2021.
[19] 蔡霄英, 龚茵茵.食用花卉中的多酚类成分及生物活性研究进展[J].食品与机械, 2018, 34(11):178-182;189.CAI X Y, GONG Y Y.Polyphenols composition and biological activity in the edible flowers[J].Food &Machinery, 2018, 34(11):178-182;189.
[20] 王双旦. 几种天然产物及其复配物的美白、抑菌等活性研究和应用[D].上海:上海应用技术大学, 2023.WANG S D.Study and application on whitening and antibacterial activities of several natural plants and complexes[D].Shanghai:Shanghai Institute of Technology, 2023.
[21] 吴娜, 朱孛琛, 章旭, 等.体外模拟消化过程中余甘子果实及醇提物的活性成分和抗氧化能力的变化[J].食品工业科技, 2023, 44(24):349-358.WU N, ZHU B C, ZHANG X, et al.Changes in active ingredients and antioxidant capacity of Phyllanthus emblica linn and its ethanol extract in vitro simulated digestion[J].Science and Technology of Food Industry, 2023, 44(24):349-358.
[22] 张唯. 玫瑰花色苷的分离纯化及抗氧化活性研究[D].绵阳:西南科技大学, 2019.ZHANG W.Study on separation, purification and antioxidant activity of rose anthocyanins[D].Mianyang:Southwest University of Science and Technology, 2019.
[23] BURLANDO B, CLERICUZIO M, CORNARA L.Moraceae plants with tyrosinase inhibitory activity:A review[J].Mini Reviews in Medicinal Chemistry, 2017, 17(2):108-121.
[24] YANG H, SHIN Y.Antioxidant compounds and activities of edible roses (Rosa hybrida spp.) from different cultivars grown in Korea[J].Applied Biological Chemistry, 2017, 60(2):129-136.
[25] WANG W W, LE T, WANG W, et al.Effects of key components on the antioxidant activity of black tea[J].Foods, 2023, 12(16):3134.