青稞,主要产于中国西藏、青海等地,是禾本科、大麦属的一年生草本植物,其外表形态籽粒裸露,因此又被称为裸大麦。青稞具有较高的营养价值,富含蛋白质、膳食纤维、维生素,同时如β-葡聚糖、γ-氨基丁酸、多酚等功能成分的含量也较高[1]。相对于水稻、小麦、玉米等谷物,青稞的蛋白含量较高,可达6.35%~23.40%,并且青稞中含有的氨基酸种类可达18种,人体必需氨基酸也较为齐全[2]。但是由于青稞中形成面团所需的面筋蛋白含量较低[3],因此在很大程度上限制了青稞资源的开发和利用,如何对青稞蛋白进行改性来提高其应用价值,需要进一步的研究。
谷物醇溶蛋白由于其独特的自组装能力和良好的生物相容性而被用于活性因子的包埋和输送。然而它们的氨基酸组成中超过50%是疏水氨基酸[4],不利于长期贮存,且较差的水溶性很大程度上限制了醇溶蛋白的利用。壳聚糖(chitosan, Cs),又名脱乙酰甲壳素,是甲壳素脱乙酰度达到50%或以上时的产物。由于其良好的安全性、生物相容性、可降解性而用于包埋活性物质,其带电特性也被广泛用于各种蛋白的改性[5]。
近年来,蛋白质与多糖之间的相互作用已经成为了研究热点,利用食品生物大分子之间的相互作用来设计一种安全无害、人体亲和的递送系统引起了众多学者的广泛关注[6]。在这一复合体系中,非共价相互作用因其低能耗的特点往往研究得更多[7]。由于蛋白质本身也是一种聚电解质,因此在溶液体系中食品蛋白与带电多糖之间的相互作用往往是由静电相互作用占主导地位,有时也可能涉及疏水相互作用和氢键[8]。青稞醇溶蛋白(highland barley gliadin, HBG)是青稞蛋白主要存在形式之一,作为青稞籽粒胚乳的主要贮藏蛋白,它与青稞的营养品质和加工品质密切相关[9],然而其较强的疏水性很大程度上限制了HBG在食品工业中的应用,而且目前针对青稞的研究主要集中于青稞抗性淀粉及β-葡聚糖的开发利用,对于青稞蛋白的研究还较少。因此本课题尝试利用Cs与HBG之间的相互作用,使其作为一种简单快捷、成本低廉的方法对HBG的功能性质进行改善,并进一步探讨Cs与HBG相互作用程度及内在的相互作用力。
1 材料与方法
1.1 材料与试剂
昆仑14号黄青稞粉(60目),青海天佑德科技投资管理集团有限公司;金龙鱼玉米油,本地超市;BCA蛋白测定试剂盒、牛血清白蛋白(bovine albumin,BSA),上海碧云天生物科技有限公司;8-苯胺基-1-萘磺酸钠(8-anilino-1 naphthalene sulfonate, ANS),上海Sigma公司;壳聚糖、无水乙醇、冰醋酸、氢氧化钠、盐酸、氯化钠、尿素,国药集团化学试剂有限公司。
1.2 仪器与设备
150型高速多功能粉碎机,永康市蓝狐工贸有限公司;EL20 pH计,梅特勒-托利多国际贸易(上海)有限公司;SHB-IIIG型真空泵,郑州长城科工贸有限公司;HHS型数显恒温水浴锅,上海博讯实业有限公司医疗设备厂;RV10旋转蒸发仪、Ultra-Turrax T18均质器,德国IKA集团;LXJ-IIB型离心机,上海安亭科学仪器厂;christ冷冻干燥机,北京博劢行仪器有限公司;F-7000型荧光分光光度计、SU8100冷场发射扫描电子显微镜,日本日立公司;Thermo1510酶标仪,赛默飞世尔科技(中国)有限公司;IS10傅立叶红外光谱仪,美国Nicolet公司。
1.3 实验方法
1.3.1 HBG提取
参考已有方法[10]略有修改:称取300 g青稞粉末,加入3 000 mL去离子水混合均匀,并用1.0 mol/L NaOH将pH值调节至11。在40 ℃下搅拌30 min后,4 800×g离心10 min。弃去沉淀物,加入30% H2O2溶液(2%,体积分数)对上清液进行脱色,搅拌均匀。静置过夜后,使用1.0 mol/L HCl将上清液的pH值调节至等电点(pH 4.5)。然后使用Osborne法从青稞总蛋白中提取HBG。按照1∶10(g∶mL)的料液比,分别用去离子水、氯化钠(20 g/L)和乙醇(70%,体积分数)在40 ℃下搅拌提取2 h,4 800×g下离心10 min,所得上清液依次为青稞清蛋白、球蛋白和醇溶蛋白。接着在50 ℃下100×g旋转蒸发除去乙醇,得到的HBG用去离子水洗涤3次后冷冻干燥,在-20 ℃下贮存待用。
1.3.2 Cs-HBG复合物的制备
采用反溶剂法制备,参考已有方法[11]略作修改:用去离子水将无水乙醇和冰醋酸分别稀释成80%和1%(体积分数)。准确称取0.1 g HBG溶于2.5 mL 80%(体积分数)乙醇溶液中,0.017 5 g Cs溶解于17.5 mL 1%(体积分数)乙酸溶液中。在磁力搅拌下,将Cs溶液快速添加到乙醇溶液中并搅拌直至完全混合。在50 ℃下通过旋转蒸发去除乙醇溶液,并通过1 200×g离心10 min去除残留的不溶性物质。所得Cs-HBG复合物于4 ℃下静置过夜,水合充分后待用。
1.3.3 Cs-HBG复合体系相点的测定
采用浊度法[12]测定Cs-HBG复合物的可溶性和不溶性复合物的临界pH值。将新鲜制备的HBG及Cs-HBG复合物溶液(HBG质量浓度为5 g/L)分别调节到不同的pH(2.0~7.0),在540 nm处测量其吸光度值。
1.3.4 傅立叶红外光谱
采用傅立叶红外吸收光谱测定Cs与HBG之间的相互作用。HBG及Cs采用KBr压片法(样品与KBr质量比为1∶100)制备样品,Cs-HBG复合物则使用衰减全折射法(attenuated total reflection, ATR)进行测定。波数扫描范围为400~4 000 cm-1。
1.3.5 微观结构
采用冷场发射扫描电子显微镜观察Cs-HBG复合物的微观结构。将冷冻干燥后的Cs-HBG复合物黏附在铝制坩埚上,并在真空下喷金处理。分别在1、2、4 k放大倍率下进行观察。
1.3.6 表面疏水性
采用ANS荧光探针法[13]测定HBG及Cs-HBG复合物的表面疏水性。首先用去离子水配制8 mmol/L ANS溶液,接着将ANS溶液以1∶100(体积比)的比例添加到HBG及Cs-HBG复合物溶液(0.01~0.1 g/L)中,并在黑暗环境中放置8~15 min待反应充分。设置激发波长(λex)为390 nm,发射波长(λem)为470 nm,狭缝校正5 nm。使用荧光分光光度计测定不同质量浓度HBG及Cs-HBG复合物的荧光强度。荧光强度-质量浓度曲线初始阶段的斜率即为表面疏水性。
1.3.7 乳化性
参考已有方法[14]略作修改:取2 mL质量浓度为5 g/L的Cs-HBG复合物溶液,加入2 mL玉米油,在12 000×g下分散搅打1 min。分别在0 min和10 min时从底部吸取20 μL乳状液,加入1 g/L的SDS溶液稀释10倍后,用SDS溶液作为空白在500 nm下测定吸光度值,计算乳化活性(emulsification activity index, EAI)、乳化稳定性(emulsifying stability index, ESI)。其计算如公式(1)和公式(2)所示:
(1)
(2)
式中:T为2.302;N为稀释倍数,10;C为蛋白质的质量浓度,g/mL;ø为溶液中油的体积分数,0.5;A0为0 min时乳状液的吸光值;A10为10 min乳状液的吸光值;Δt,0~10 min。
1.3.8 起泡性
参考已有方法[15]略作修改:取10 mL质量浓度为5 g/L的Cs-HBG复合物溶液,用1.0 mol/L NaOH溶液调节pH值至7.0,在高速搅拌器中以12 000×g搅打3 min,分别测量0、10 min时的泡沫体积。0 min泡沫最高时的体积即为起泡性,而泡沫稳定性的计算如公式(3)所示:
泡沫稳定性![]()
(3)
式中:V0和V1分别表示0 min和10 min后的泡沫体积。
2 结果与分析
2.1 Cs与HBG相互作用分析
2.1.1 浊度
在不同的条件下,蛋白质和多糖之间可能形成多种不同的复合物。研究者往往使用浊度滴定法来确定可溶性复合物(pHc)和不溶性复合物(pHφ)的最佳pH(相点)。首先在浊度滴定曲线中确定2个浊度显著增加的点,然后在这2点绘制曲线的2条切线,并找到它们与曲线浊度最低处切线的2个交点,这2点的pH值即为复合体系的pHc和pHφ[16]。由图1-A可知,HBG的pHc和pHφ分别为2.6和2.8,而Cs-HBG复合物则为3.1和3.3,而两者在不同pH下的相图如图1-B所示。与大多数蛋白与Cs之间的反应类似,Cs与HBG之间的反应也会经历3个阶段。当pH较低时(pH<3.0),由于Cs和HBG都携带正电荷,此时两者之间的静电相互作用较弱,Cs与HBG之间只能形成初级复合物,溶液体系仍然只是两者的混合物。而随着pH值的逐渐增加,Cs和HBG在pHc时开始形成可溶性复合物,此时相互作用程度仍然较弱,复合体系的浊度较低。当pH达到pHφ时,Cs与HBG已经形成不溶性复合物,较强的相互作用使得复合体系较为稳定,此时溶液的浊度较高但并未发生相分离[17]。综上所述,最终选择pH 2.5、3.2和4.0分别代表Cs与HBG的初级、可溶性和不溶性复合物,进行后续研究。
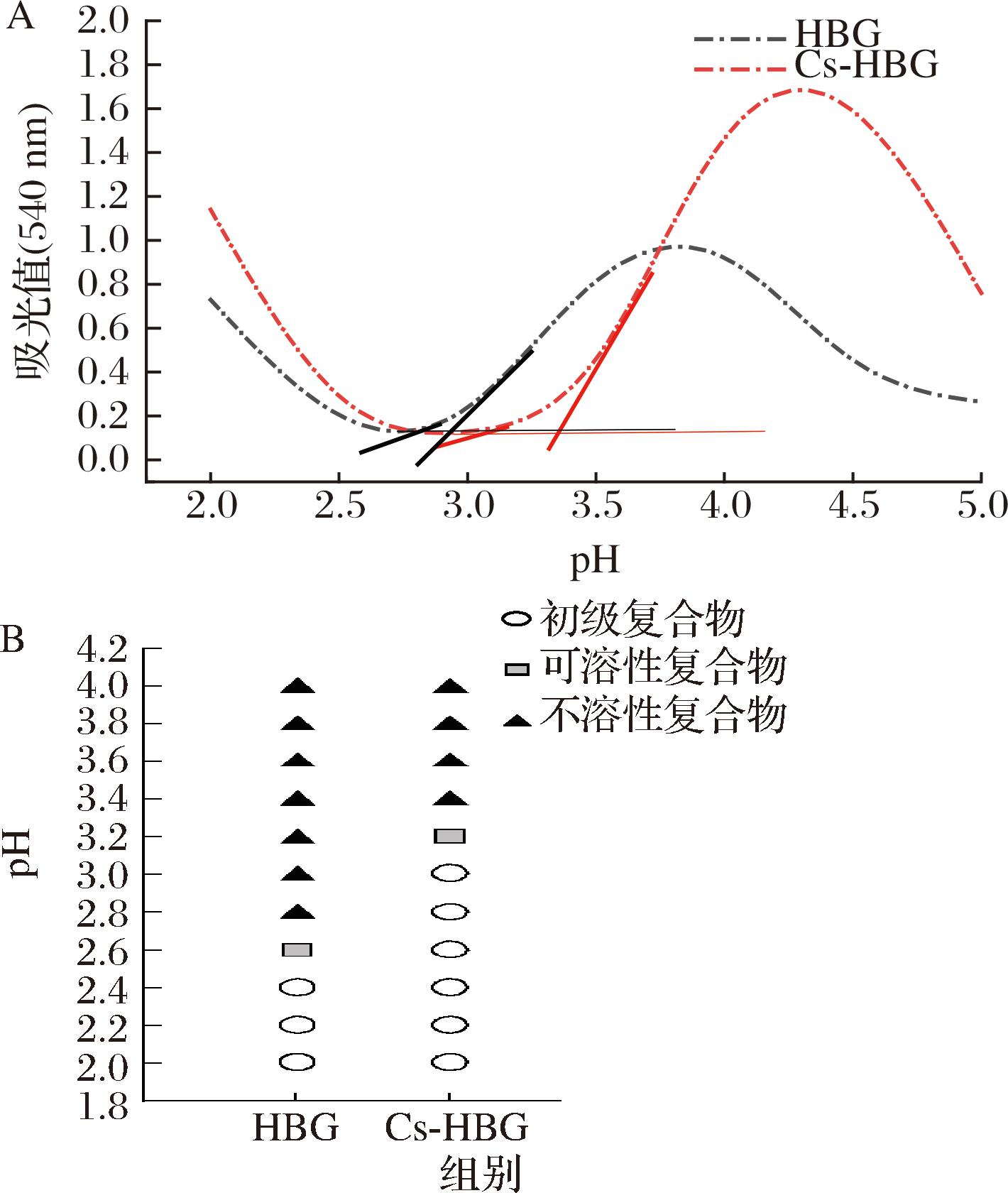
A-HBG和Cs-HBG复合物的浊度滴定曲线; B-不同pH下HBG与Cs-HBG复合物的相图
图1 HBG和Cs-HBG复合物的浊度滴定曲线和不同pH下 HBG与Cs-HBG复合物的相图
Fig.1 Turbidity titration curve of HBG and Cs-HBG complex and phase diagram of HBG and Cs-HBG complex at different pH
2.1.2 傅立叶红外光谱
红外光谱常被用于定性分析2种物质之间的相互作用。如图2所示,HBG的特征峰有3 303 cm-1(O—H伸缩)、2 927 cm-1(C—H伸缩)、1 660 cm-1(酰胺Ⅰ带,C![]() O伸缩)、1 535 cm-1(酰胺Ⅱ带,N—H弯曲)、1 446 cm-1(—CH2)。Cs的特征峰有3 428 cm-1(O—H伸缩)、2 875 cm-1(C—H伸缩)、1 596 cm-1(N—H弯曲)、1 380 cm-1(C—N伸缩)以及1 085 cm-1(O—C—O伸缩)。加入Cs后,HBG和Cs通过相互作用开始结合,特征峰出现明显变化:3 000~3 600 cm-1范围内的吸收峰变宽,这表明Cs和HBG之间可能存在氢键作用[17]。而随着pH的增加,酰胺Ⅰ带的特征峰出现蓝移,分别从1 660 cm-1移动到1 637、1 635、1 633 cm-1,峰宽也有所增加,酰胺Ⅱ带的吸收峰则有所变小,这可能是因为Cs与HBG之间存在静电相互作用。XIAO等[18]在高粱醇溶蛋白-Cs复合物中也观察到类似的现象,加入Cs后,高粱醇溶蛋白的酰胺带吸收峰出现明显变化。此外由于Cs与HBG分子都具有强烈的疏水性,因此两者之间还可能存在一定的疏水相互作用。
O伸缩)、1 535 cm-1(酰胺Ⅱ带,N—H弯曲)、1 446 cm-1(—CH2)。Cs的特征峰有3 428 cm-1(O—H伸缩)、2 875 cm-1(C—H伸缩)、1 596 cm-1(N—H弯曲)、1 380 cm-1(C—N伸缩)以及1 085 cm-1(O—C—O伸缩)。加入Cs后,HBG和Cs通过相互作用开始结合,特征峰出现明显变化:3 000~3 600 cm-1范围内的吸收峰变宽,这表明Cs和HBG之间可能存在氢键作用[17]。而随着pH的增加,酰胺Ⅰ带的特征峰出现蓝移,分别从1 660 cm-1移动到1 637、1 635、1 633 cm-1,峰宽也有所增加,酰胺Ⅱ带的吸收峰则有所变小,这可能是因为Cs与HBG之间存在静电相互作用。XIAO等[18]在高粱醇溶蛋白-Cs复合物中也观察到类似的现象,加入Cs后,高粱醇溶蛋白的酰胺带吸收峰出现明显变化。此外由于Cs与HBG分子都具有强烈的疏水性,因此两者之间还可能存在一定的疏水相互作用。
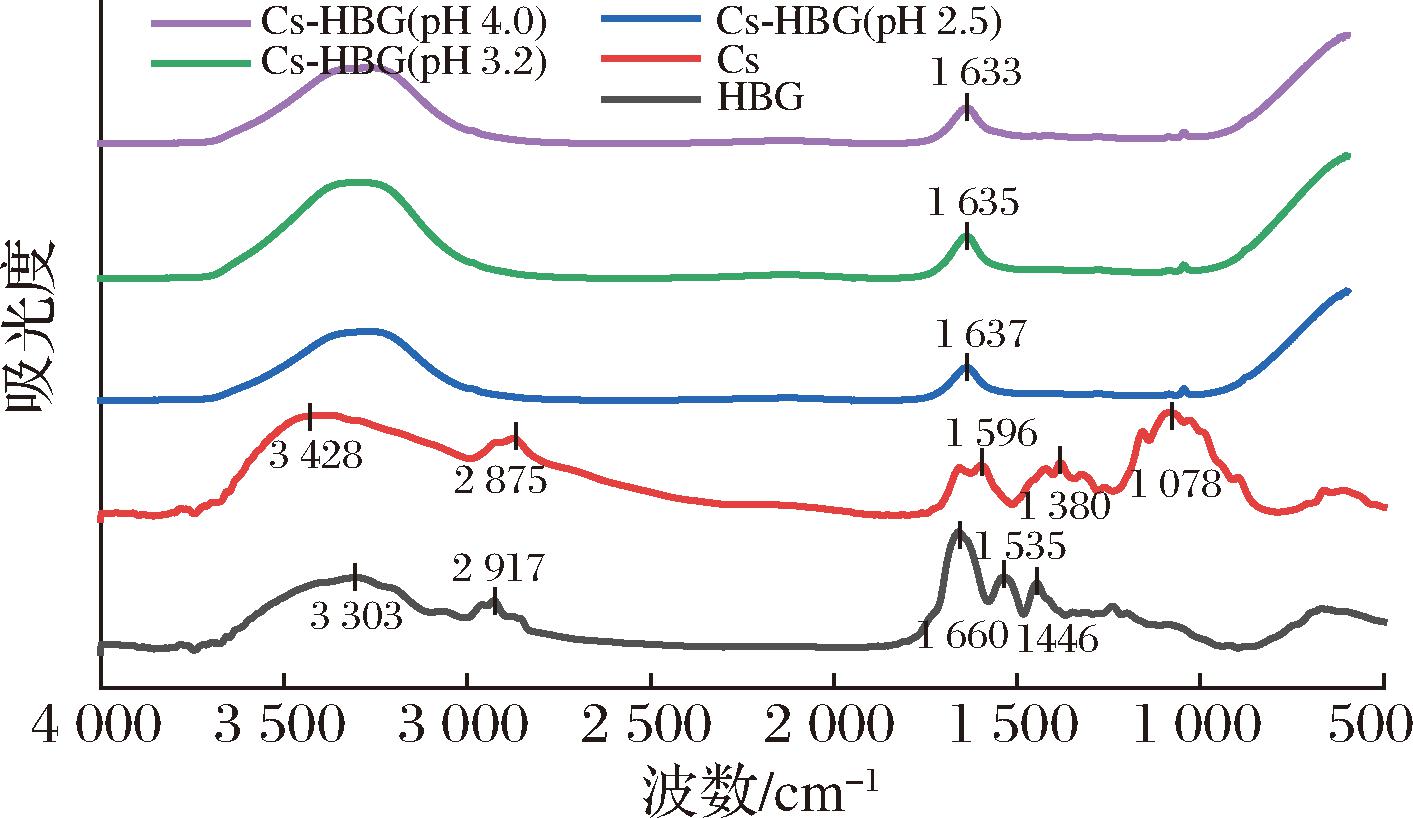
图2 Cs-HBG复合物在不同pH下的红外光谱图
Fig.2 The infrared spectra of Cs-HBG complex at different pH
2.1.3 相互作用力测定
为了验证红外光谱中Cs与HBG相互作用力的猜想,进一步通过荧光光谱进行了分析,NaCl、尿素、SDS分别用于抑制静电相互作用、氢键和疏水相互作用。如图3所示,随着不同阻断剂的加入,Cs-HBG复合物的荧光强度均出现了不同程度的减弱,这表明Cs-HBG复合物的形成是由静电相互作用、氢键和疏水相互作用共同驱动的,这验证了傅立叶红外光谱的实验结果。然而值得注意的是,疏水相互作用和氢键在Cs-HBG复合物的形成中起主导作用,而不是静电相互作用。这与之前Cs与其他谷物醇溶蛋白的复合过程不同[11],这可能是因为HBG独特的蛋白结构所导致的。在与Cs的反应过程中,一开始在较强的酸性环境影响下(pH<3),HBG内部的疏水基团逐渐暴露出来,与Cs分子链上的氨基基团和乙酰胺基团发生相互作用,形成了更为紧密的氢键网络和疏水结构,随着pH值逐渐增大至4.0,正电荷影响减弱,HBG分子结构又再次发生螺旋和折叠,有序性增强,蛋白的稳定性也有所改善。上述结果表明蛋白与带电多糖之间的相互作用,也许在更大程度上受蛋白本身结构的影响。
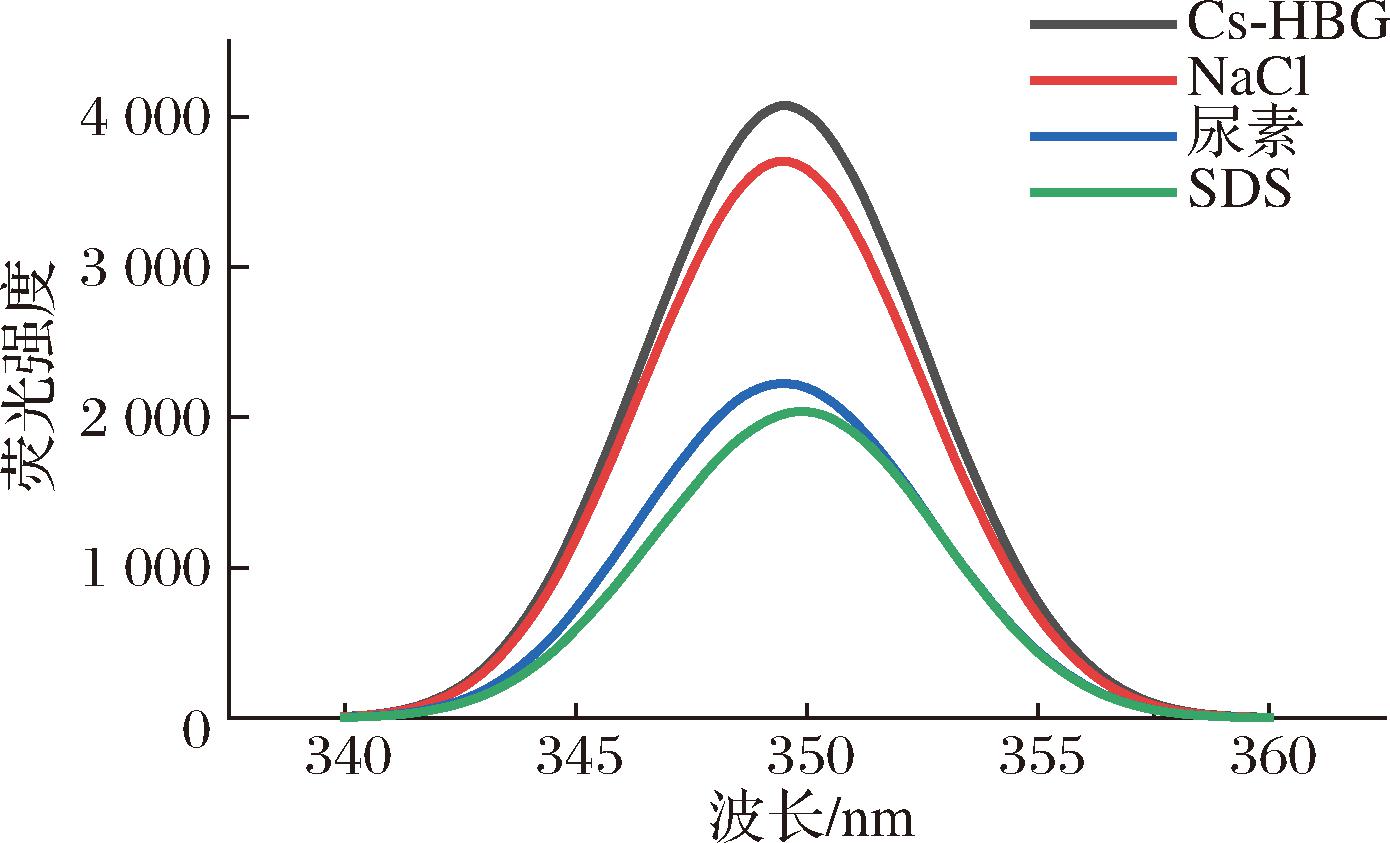
图3 加入不同阻断剂后Cs-HBG复合物的荧光光谱图
Fig.3 The fluorescence spectra of Cs-HBG complex after adding different blocking agents
2.1.4 微观结构
为了更加直观地表现不同pH下Cs与HBG之间的相互作用,采用扫描电子显微镜(scanning electron microscope, SEM)分别对Cs和HBG形成的初级复合物、可溶性复合物和不溶性复合物的微观结构进行了观察分析。如图4所示,当pH值为2.5时,由于HBG的质子化,与具有相同电荷的Cs的相互作用仍然不明显,Cs和HBG两者只能形成初级复合物。可以观察到此时Cs-HBG复合物的表面相对光滑平坦(图4-B),这表明此时Cs-HBG复合物仍然具有较强的疏水性,在水溶液中的稳定性较差。当pH值达到3.2时,Cs和HBG之间开始通过静电相互作用形成可溶性复合物。由于此时Cs与HBG仍然带有较高的相同电荷,HBG的内部结构也刚刚开始打开,因此相互作用仍然较弱。可以观察到Cs-HBG复合物的表面已经产生部分褶皱的结构(图4-E),这也证实了HBG的结构在Cs的影响下开始发生变化。随着pH值的继续增大,HBG表面的负电荷增多,更多的疏水基团也得以暴露出来,Cs与HBG之间逐渐形成不溶性复合物。最后当pH值达到4.0时,Cs与HBG的相互作用最强,HBG分子结构发生重组,蛋白重新发生螺旋和折叠,有序性增强。疏松多孔结构(图4-I)的产生也证实了Cs-HBG复合物内部强烈的相互作用,这表明HBG的溶解度大大提高,疏水性显著减弱。YUAN等[19]的研究中也发现了类似的现象,Cs-SPI复合物在较高pH(5.5~6.0)下也发生了聚集现象,并形成类似凝胶的网络结构。蛋白中添加Cs,成功减弱了蛋白的表面疏水性,水溶性得到改善。

A、B、C-放大倍率1、2、4 k下pH 2.5时的Cs-HBG复合物;D、E、F-放大倍率1、2、4 k下pH 3.2时的Cs-HBG复合物; G、H、I-放大倍率1、2、4 k下pH 4.0时的Cs-HBG复合物
图4 Cs-HBG复合物在不同pH下的微观结构
Fig.4 The microscopic structure of Cs-HBG complex at different pH
2.2 Cs对HBG功能性质的影响
2.2.1 表面疏水性
表面疏水性常被用于直观地表征蛋白质的水溶性。如图5-A所示,相比于单独的HBG,加入Cs后HBG的表面疏水性得到明显减弱,证实了Cs与HBG相互作用的存在。随着Cs质量浓度的减小,Cs-HBG复合物的表面疏水性先减小后增大,当质量浓度比(Cs∶HBG)为1∶50时,Cs-HBG复合物的表面疏水性最弱,在水溶液中的稳定性最好。这可能是此质量浓度比下,绝大多数的HBG分子均已与Cs反应,HBG内部的疏水基团与Cs分子通过疏水相互作用和氢键网络结合,最后在pH 4.0的条件下重新螺旋和折叠,从而形成了最为稳定的结构[20]。当Cs质量浓度较低(1∶10)时反应不够充分,仍然存在部分HBG分子未能与Cs结合,而Cs质量浓度过高时,过量的Cs存在于复合体系中又会导致Cs-HBG复合物的疏水性增强。此外,如图5-B所示,在pH 4.0条件下,Cs-HBG复合物的表面疏水性最弱,稳定性最好,这也再次证实了SEM的观察结果。正如前面提到的,这是由于pH 4.0条件下Cs与HBG之间形成的不溶性复合物具有最强的相互作用。HU等[21]的研究也发现了类似的现象,通过向高压微射流处理过的马铃薯蛋白中添加Cs,成功减弱了蛋白的表面疏水性,水溶性得到改善。
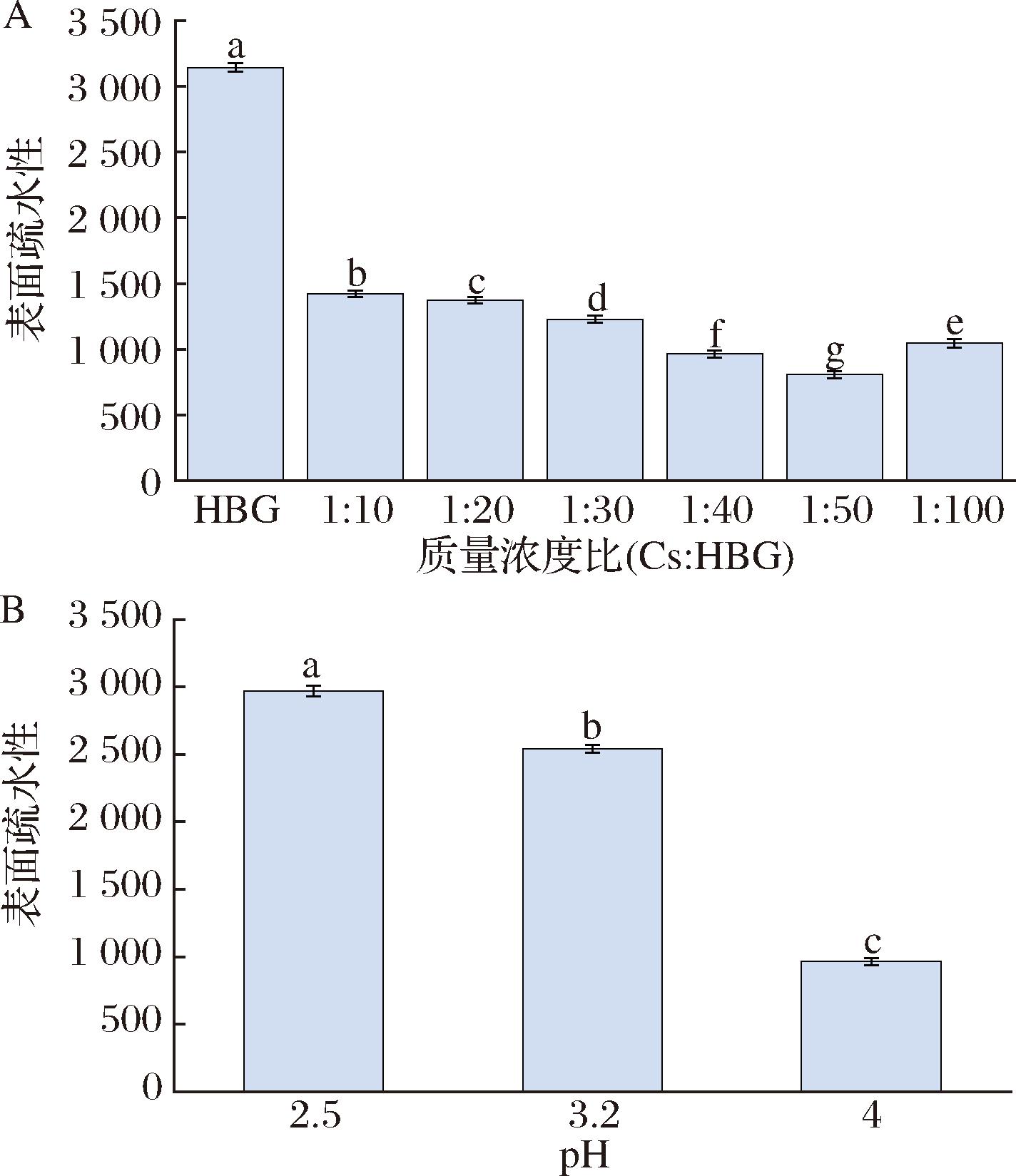
A-不同质量浓度比下Cs-HBG复合物的表面疏水性; B-不同pH下Cs-HBG复合物的表面疏水性
图5 不同质量浓度比和pH下Cs-HBG复合物的表面疏水性
Fig.5 The surface hydrophobicity of Cs-HBG complex at different concentration ratios and pH
注:图中每组不同小写字母表示存在显著性差异(P<0.05)(下同)。
2.2.2 乳化性
乳化性作为蛋白质的一项重要功能指标,可以反映蛋白质稳定油水界面并形成乳液的能力。如图6-A所示,Cs的加入使得HBG的EAI和ESI均出现不同程度的增强,这是Cs与HBG之间的相互作用导致的,HBG分子可能出现了结构重排,内部的基团展开,结构也更加灵活,颗粒表面积增大从而导致在油水界面处的吸附增强[22]。随着Cs质量浓度的减小,Cs-HBG复合物的乳化性差异不明显(P>0.05),但当质量浓度比(Cs∶HBG)为1∶40时,Cs-HBG复合物的乳化稳定性最好,这可能是因为该质量浓度比下的相互作用最强,Cs-HBG的疏水性最弱,水溶性最好,表面张力最弱,而蛋白质本身的乳化性与其水溶性通常呈正相关性[23],因此乳化稳定性最好,这也证实了表面疏水性的测定结果。ZHENG等[14]研究也发现用右旋糖酐修饰后,卵清蛋白的ESI和EAI显著增加,这也说明多糖与蛋白质之间的相互作用往往会有利于提高蛋白质本身的乳化能力。
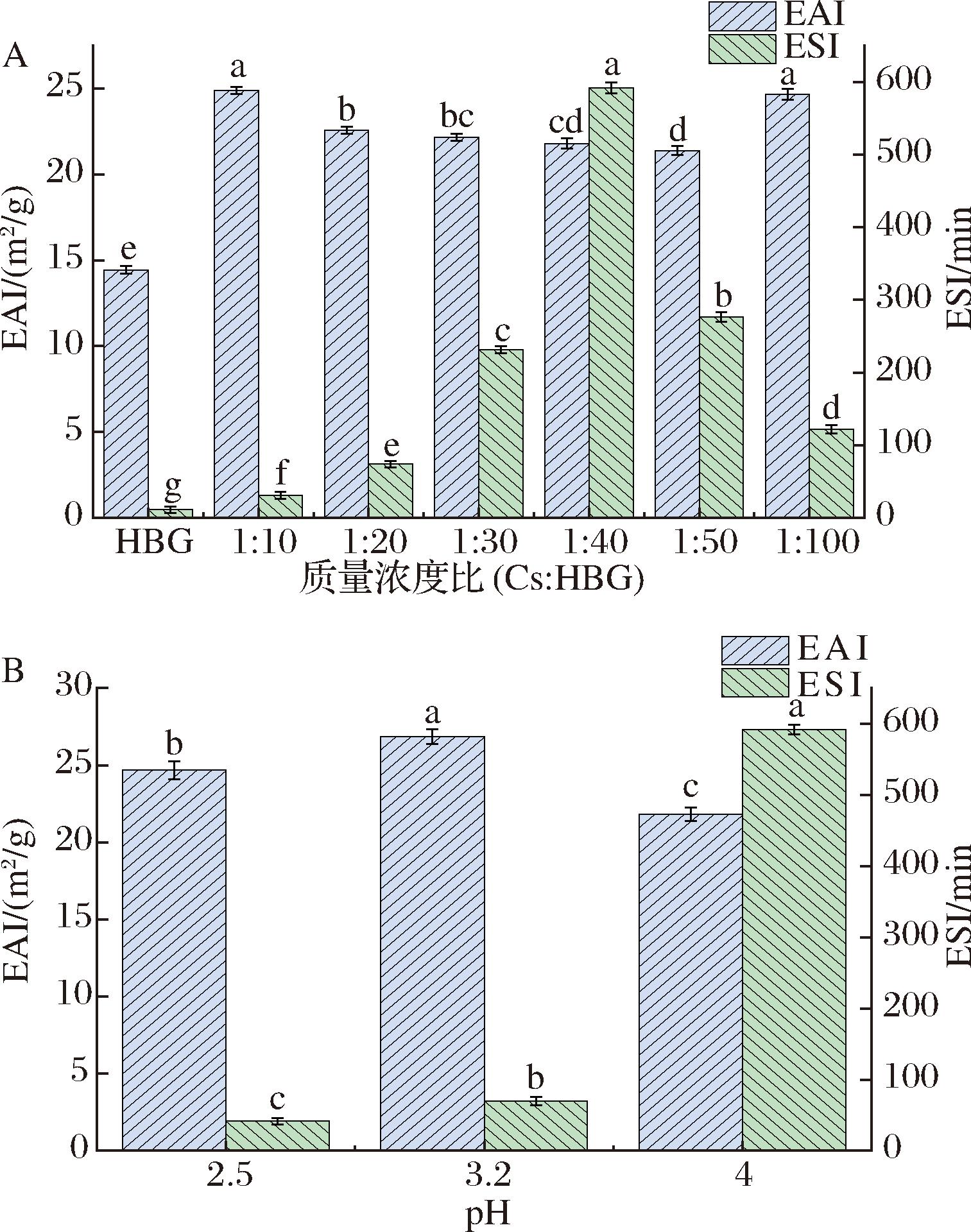
A-不同质量浓度比下Cs-HBG复合物的乳化活性和乳化稳定性; B-不同pH下Cs-HBG复合物的乳化活性和乳化稳定性
图6 不同质量浓度比和pH下Cs-HBG复合物的乳化 活性和乳化稳定性
Fig.6 The EAI and ESI of Cs-HBG complex at different concentration ratios and pH
2.2.3 起泡性
蛋白质作为一种天然发泡剂,其起泡性能可以用起泡性和泡沫稳定性来表征。如图7所示,加入Cs后,Cs-HBG复合物的起泡性和泡沫稳定性均出现显著提高(P<0.05),这可能是因为Cs的加入使得溶液的黏度增加,复合体系中的分子含量增多,分子间距减小,从而改善了起泡性能。而且Cs与HBG之间的相互作用还增强了HBG的水溶性,更高的溶解度更有利于蛋白在空气-水界面形成多层膜状结构[24]。此外,Cs的加入还有可能增强了HBG蛋白结构的有序性,从而增强了HBG的机械强度和弹性,最终导致其泡沫稳定性得到改善[25]。不同的Cs质量浓度对HBG起泡性的影响较小,但总体上Cs质量浓度越高,Cs-HBG复合物的泡沫稳定性也更强。一方面这是由于Cs本身较强的成膜性引起的,过量的Cs存在与复合体系中对泡沫气液层起到了一定的保护作用。另一方面过量的Cs还会影响HBG的表面疏水性和表面张力,从而促进蛋白质向气液表面的迁移[26]。冷雪冬[27]分别向米糠蛋白中加入了戊聚糖、葡聚糖、壳聚糖及麦芽糊精4种多糖,结果发现米糠蛋白的起泡性和泡沫稳定性均出现了不同程度的提高。
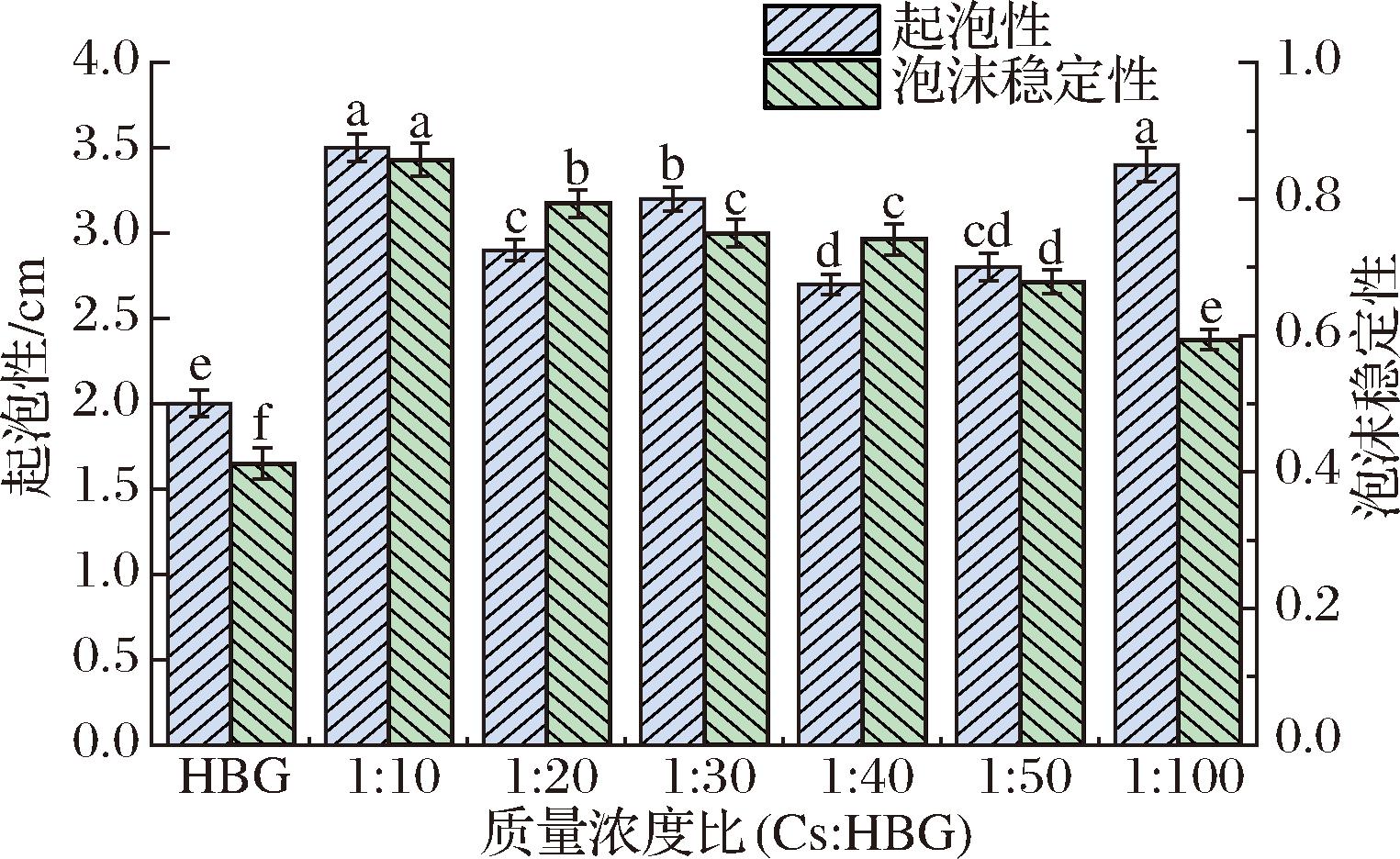
图7 不同质量浓度比下Cs-HBG复合物的起泡性和泡沫稳定性
Fig.7 The foaming and foam stability of Cs-HBG complex at different concentration ratios
3 结论
本文研究了Cs与HBG之间的相互作用,并测定了Cs对HBG功能特性的影响。结果表明,驱动Cs-HBG复合形成的主要驱动力是疏水相互作用和氢键,同时还存在静电相互作用。Cs的加入使得HBG的表面疏水性、乳化性、起泡性均得到不同程度的改善,此外在pH 4.0,Cs与HBG质量浓度比接近1∶40时两者的相互作用最强,改性效果也最好。
综上所述,添加Cs作为一种成本低廉、简单快捷、安全可靠的方法,可以用于改善以HBG为代表的各种疏水性蛋白的性质。以Cs-HBG复合物为基础,在用于稳定Pickering乳液或静电凝胶以用于生物活性物质的包埋和运载,或制造高生物相容性食品包装膜,或开发可用于乳品或烘焙行业的新型脂肪替代物等领域具有一定的研究潜力。
[1] RICO D, PE AS E, GARC
AS E, GARC A M D C, et al.Sprouted barley flour as a nutritious and functional ingredient[J].Foods, 2020, 9(3):296.
A M D C, et al.Sprouted barley flour as a nutritious and functional ingredient[J].Foods, 2020, 9(3):296.
[2] WANG C P, PAN Z F, NIMA Z X, et al.Starch granule-associated proteins of hull-less barley (Hordeum vulgare L.) from the Qinghai-Tibet Plateau in China[J].Journal of the Science of Food and Agriculture, 2011, 91(4):616-624.
[3] ZHANG H X, CHEN G J, LIU M, et al.Effects of multi-frequency ultrasound on physicochemical properties, structural characteristics of gluten protein and the quality of noodle[J].Ultrasonics Sonochemistry, 2020, 67:105135.
[4] WOUTERS A G, DELCOUR J A.Cereal protein-based nanoparticles as agents stabilizing air-water and oil-water interfaces in food systems[J].Current Opinion in Food Science, 2019, 25:19-27.
[5] KURUKJI D, NORTON I, SPYROPOULOS F.Fabrication of sub-micron protein-chitosan electrostatic complexes for encapsulation and pH-Modulated delivery of model hydrophilic active compounds[J].Food Hydrocolloids, 2016, 53:249-260.
[6] LI H, WANG T, HU Y L, et al.Designing delivery systems for functional ingredients by protein/polysaccharide interactions[J].Trends in Food Science &Technology, 2022, 119:272-287.
[7] GENTILE L.Protein-polysaccharide interactions and aggregates in food formulations[J].Current Opinion in Colloid &Interface Science, 2020, 48:18-27.
[8] ZHANG Q, ZHOU Y Y, YUE W T, et al.Nanostructures of protein-polysaccharide complexes or conjugates for encapsulation of bioactive compounds[J].Trends in Food Science &Technology, 2021, 109:169-196.
[9] 张鑫. 青稞β-葡聚糖基新鲜度指示膜的制备及应用[D].无锡:江南大学, 2023.ZHANG X.Development and application of indicator film base on highland barley β-glucan[D].Wuxi:Jiangnan University, 2023.
[10] DU Y, CHEN Z X, LIANG F, et al.Effects of salidroside on functional and structural changes in highland barley proteins[J].LWT, 2022, 160:113310.
[11] 李梦帆. 醇溶蛋白-多糖复合颗粒的构建及其在Pickering乳液的应用研究[D].广州:广州大学, 2019.LI M F.Construction of gliadin-polysaccharide composite particles and its application in Pickering emulsion[D].Guangzhou:Guangzhou University, 2019.
[12] ELMER C, KARACA A C, LOW N H, et al.Complex coacervation in pea protein isolate-chitosan mixtures[J].Food Research International, 2011, 44(5):1441-1446.
[13] TANG S, LI J S, HUANG G X, et al.Predicting protein surface property with its surface hydrophobicity[J].Protein and Peptide Letters, 2021, 28(8):938-944.
[14] ZHENG Y M, CHANG Y, LUO B Y, et al.Molecular structure modification of ovalbumin through controlled glycosylation with dextran for its emulsibility improvement[J].International Journal of Biological Macromolecules, 2022, 194:1-8.
[15] WANG J G, YAN R, LIU T X, et al.The formation, interfacial, and foaming properties of complex constructed by caseinate and soy protein nanoparticle[J].Food Hydrocolloids, 2024, 151:109802.
[16] YUAN Y, KONG Z Y, SUN Y G, et al.Complex coacervation of soy protein with chitosan:Constructing antioxidant microcapsule for algal oil delivery[J].LWT, 2017, 75:171-179.
[17] LI M F, CHEN L, XU M Z, et al.The formation of zein-chitosan complex coacervated particles:Relationship to encapsulation and controlled release properties[J].International Journal of Biological Macromolecules, 2018, 116:1232-1239.
[18] XIAO J, NIAN S, HUANG Q R.Assembly of kafirin/carboxymethyl chitosan nanoparticles to enhance the cellular uptake of curcumin[J].Food Hydrocolloids, 2015, 51:166-175.
[19] YUAN Y, WAN Z L, YANG X Q, et al.Associative interactions between chitosan and soy protein fractions:Effects of pH, mixing ratio, heat treatment and ionic strength[J].Food Research International, 2014, 55:207-214.
[20] LI M F, HE Z Y, LI G Y, et al.The formation and characterization of antioxidant Pickering emulsions:Effect of the interactions between gliadin and chitosan[J].Food Hydrocolloids, 2019, 90:482-489.
[21] HU C, XIONG Z Y, XIONG H G, et al.The formation mechanism and thermodynamic properties of potato protein isolate-chitosan complex under dynamic high-pressure microfluidization (DHPM) treatment[J].International Journal of Biological Macromolecules, 2020, 154:486-492.
[22] YU C P, LI S H, SUN S, et al.Modification of emulsifying properties of mussel myofibrillar proteins by high-intensity ultrasonication treatment and the stability of O/W emulsion[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2022, 641:128511.
[23] CHENG M M, LI Y N, LUO X H, et al.Effect of dynamic high-pressure microfluidization on physicochemical, structural, and functional properties of oat protein isolate[J].Innovative Food Science &Emerging Technologies, 2022, 82:103204.
[24] AJIBOLA C F, MALOMO S A, FAGBEMI T N, et al.Polypeptide composition and functional properties of African yam bean seed (Sphenostylis stenocarpa) albumin, globulin and protein concentrate[J].Food Hydrocolloids, 2016, 56:189-200.
[25] SHA X M, HU Z Z, TU Z C, et al.Influence of dynamic high pressure microfluidization on functional properties and structure of gelatin from bighead carp (Hypophthalmichthys nobilis) scale[J].Journal of Food Processing and Preservation, 2018, 42(5):e13607.
[26] TAO X, CAI Y J, LIU T X, et al.Effects of pretreatments on the structure and functional properties of okara protein[J].Food Hydrocolloids, 2019, 90:394-402.
[27] 冷雪冬. 稻米米糠蛋白复合多糖脂肪替代物制备及应用研究[D].大庆:黑龙江八一农业大学, 2023.LENG X D.Preparation and application of rice bran protein composite polysaccharide fat substitutes[D].Daqing:Heilongjiang Bayi Agricultural Reclamation University, 2023.