核桃(Juglans regia L.)是胡桃科胡桃属植物,广泛分布于世界各地。中国是核桃种植大国,核桃产量约占全球的46.30%[1]。核桃是重要的木本油料作物,核桃仁中含油率高达52%~70%[1]。近年来,核桃油因富含多不饱和脂肪酸等营养成分,其市场需求持续增长,这导致核桃榨油副产品核桃粕的大量产生。核桃粕通常被直接丢弃或用作低价值的饲料和土地肥料,这造成了资源的极大浪费。为实现核桃粕资源的高效利用,成静等[2]以核桃粕为原料,采用酶解法高效制备出核桃肽(walnut peptide,WP)。研究表明,WP具有健脑、抗疲劳、降血糖、改善记忆力及抗氧化等多种生理活性[3]。因此,核桃粕是一种具有巨大开发潜力的生物活性肽来源。
铁是人体必需的微量元素,铁元素缺乏会干扰血液中血红素和氧气形成氧合血红蛋白,最终导致缺铁性贫血的发生[4]。一般来说,人体所需铁元素无法通过自身代谢产生,必须通过外界摄取。此外,个体吸收差异及膳食铁吸收抑制剂(植酸、单宁等)的影响[5],进一步导致了铁缺乏现象的普遍性,这一现象在婴儿和孕妇等特殊人群中尤为突出。报告显示,中国成年人贫血率高达8.7%[6],成人每日铁摄取量需达到10~15 mg才能满足正常生理需要。膳食铁补充剂摄入是解决以上的问题的最主要手段。目前,最具代表性的膳食补铁剂主要有两类:无机铁(如硫酸亚铁)和有机铁(如富马酸亚铁)。但较低的生物利用度及胃肠副作用,严重制约了其广泛适用性[7]。因此,高效低毒的新型补铁剂亟待开发。
不同于传统补铁剂,肽铁螯合物可通过胞吞作用或专有通道被肠细胞完整吸收,因而可大幅提高铁离子的吸收效率[8-10]。此外,肽铁螯合物显现出比传统补铁剂更高的安全性[11]。目前羊骨肽[12]、小麦低聚肽[13]、花椒籽肽[14]等原料制备的肽铁螯合物,已被用以设计新型铁补充剂。然而,关于核桃肽-铁螯合物(walnut peptide - ferrous chelate,WP-Fe)的研究鲜见报道。本研究以核桃肽与FeCl2为原料制备WP-Fe,并对其结构进行表征,以期为新型铁补充剂的开发及核桃粕资源的可持续开发利用提供重要参考。
1 材料与方法
1.1 材料与试剂
WP(相对分子质量<1 000 Da的蛋白质水解物≥80%,水分≤7%,灰分≤8%),山东中食都庆生物技术有限公司;菲洛嗪,上海源叶生物科技有限公司;四水氯化亚铁、氢氧化钠,成都金山化学试剂有限公司;无水乙醇,天津富宇精细化工有限公司;L-抗坏血酸、浓盐酸,上海国药集团化学试剂有限公司。
1.2 仪器和设备
FA3004电子分析天平,上海衡际科学仪器有限公司;TDZ5-WS离心机,湖南平凡科技有限公司;F-280荧光分光光度计,天津港东有限公司;UV-2600紫外光谱仪,日本岛津公司;JSM-6390扫描电镜,日本电子株式会社;5430R台式高速离心机,德国艾本德公司;L-8900全自动氨基酸分析仪,日本日立集团;VERTEX 70红外光谱仪,德国布鲁克分析仪器公司;WHL-25AB台式电热恒温干燥箱,天津市泰斯特仪器有限公司;PHS-25 pH计,上海仪电科学仪器股份有限公司;DF-101D恒温水浴锅,巩义市予华仪器有限责任公司;VORTEX-5旋涡混合器,海门市其林贝尔仪器制造有限公司。
1.3 实验方法
1.3.1 单因素及正交试验
1.3.1.1 多肽质量浓度对Fe2+螯合率的影响
在pH值7、肽铁(WP/FeCl2)质量比为3∶1条件下,反应体系中分别加入多肽质量浓度为10、20、30、40、50 g/L的WP,在40 ℃下反应40 min后离心,取上清液测定其Fe2+螯合率。
1.3.1.2 pH值对Fe2+螯合率的影响
在多肽质量浓度为30 g/L、肽铁质量比为3∶1的条件下,分别调节反应体系pH为3、4、5、6、7,在40 ℃ 下反应40 min后,离心取上清液测定其Fe2+螯合率。
1.3.1.3 肽铁质量比对Fe2+螯合率的影响
在多肽质量浓度为30 g/L、pH值7的条件下,分别调节肽铁质量比为1∶2、1∶1、2∶1、3∶1、4∶1,在40 ℃下反应40 min后,离心取上清液测定其Fe2+螯合率。
1.3.1.4 反应温度对Fe2+螯合率的影响
在多肽质量浓度为30 g/L、pH值7、肽铁质量比3∶1的条件下,分别调节反应温度为30、40、50、60、70 ℃,反应40 min后,离心取上清液测定其Fe2+螯合率。
1.3.1.5 反应时间对Fe2+螯合率的影响
在多肽质量浓度为30 g/L、pH 7、肽铁质量比3∶1、反应温度40 ℃条件下,分别反应20、30、40、50、60 min后,离心取上清液测定其Fe2+螯合率。
1.3.1.6 正交试验设计
在单因素试验结果的基础上,以Fe2+螯合率为响应变量,分别选取多肽质量浓度、pH值、肽铁质量比、反应温度进行4因素3水平正交试验。结合极差分析,获得WP-Fe的最佳制备工艺,并加以验证。
1.3.2 WP-Fe制备及Fe2+螯合率测定
40 g/L WP和FeCl2以质量比3∶1置于烧杯中,使用蒸馏水溶解后,加入2 mL抗氧化剂L-抗坏血酸(10 g/L),用1 mol/L氢氧化钠调节pH到7,然后在40 ℃水浴锅中恒温螯合40 min。反应完成后,反应液5 000 r/min离心20 min。取上清液,并加入10倍体积无水乙醇。醇沉30 min后,再次5 000 r/min离心20 min。沉淀于40 ℃烘箱中干燥后,即得产品WP-Fe。
采用菲洛嗪比色法测定螯合物的Fe2+螯合率[15],使用紫外分光光度计在562 nm处记录吸光度。Fe2+螯合率的具体计算公式(1)如下:
Fe2+螯合率![]()
(1)
式中:A0为螯合前总铁的吸光度;AS为反应后WP-Fe中螯合铁的吸光度。
1.3.3 紫外光谱分析
将WP配制成质量浓度为1 mg/mL的多肽溶液备用。依次加入FeCl2,使Fe2+的浓度分别达到1、5、10、20和30 μmol/L。室温条件下,混匀静置反应15 min后,在190~400 nm波长范围内,使用紫外分光光度计扫描[16],以观测WP-Fe形成的动态过程。
1.3.4 荧光光谱分析
为观测Fe2 +对WP 间构象的动态调控,在1 mg/mL WP溶液中依次加入FeCl2,使Fe2+的浓度分别达到5、10、20、30和50 μmol/L。室温条件下,混匀静置反应15 min。随后使用荧光分光光度计,记录300~500 nm波长的发射光谱。激发波长设置为280 nm,激发和发射狭缝宽度设置为10 nm[17]。
1.3.5 扫描电镜
利用扫描电镜分析WP和WP-Fe的微观结构。样品粉末经喷金处理后,在20 kV的加速电压下观察并记录样品形态[18]。
1.3.6 氨基酸组成测定
在10 mL 6 mol/L HCl溶液(含0.1%体积分数苯酚)中加入80 mg样品粉末,110 ℃水解22 h。使用0.45 μm滤膜过滤并稀释水解产物至50 mL,测定其氨基酸组成[19]。
1.3.7 红外光谱分析
在玛瑙研钵中,1 mg样品粉末与100 mg干燥KBr混合。仔细研磨混匀后,压成透明薄片,装载后扫描测定。具体测定参数设置如下:分辨率4 cm-1,扫描范围4 000~400 cm-1,扫描次数32[17]。
1.3.8 体外模拟胃肠消化稳定性
为探究WP-Fe的生物可及性,测定了其体外模拟胃肠消化稳定性,具体评价方法参照WU等[20]的实验方案。消化结束后,采用菲洛嗪比色法测定Fe2+释放率[15],具体计算公式(2)如下:
Fe2+释放率![]()
(2)
式中:Nt为上清液中铁离子质量,μg;N为消化溶液中总铁质量,μg。
1.3.9 Caco-2细胞活力测定
Caco-2细胞活力测定参照WANG等[11]的方法操作。WP-Fe和阳性对照FeSO4的质量浓度梯度均设置为0、0.25、0.5、0.75、1和2 mg/mL。按照公式(3)计算Caco-2细胞活力:
细胞活力![]()
(3)
式中:B0为空白吸光度;B1为处理后Caco-2细胞吸光度;B2为未处理Caco-2细胞吸光度。
1.4 统计分析
所有实验均重复测定3次,结果以平均值±标准偏差表示。使用Origin 2018软件绘制图片,使用SPSS 18.0软件进行统计分析。单因素方差分析和Duncan多重范围检验用于均值多重比较。P<0.05时,认为平均值有显著差异。
2 结果分析
2.1 单因素及正交试验
2.1.1 多肽质量浓度对Fe2+螯合率的影响
Fe2+螯合率是评估WP-Fe生产质量的重要指标,而制备条件对Fe2+螯合率提高有显著的影响。因此,本研究评估了多肽质量浓度、pH值、肽铁质量比、温度和时间等单因素条件对Fe2+螯合率的影响。如图1所示,随多肽质量浓度的增加,Fe2+螯合率呈现先增加后减少的趋势,在WP质量浓度为40 g/L时,达到峰值56.65%。这可能是由于当多肽质量浓度增加时,WP的活性基团和Fe2+之间碰撞几率相应增加[21],从而有助于WP-Fe的形成。然而,过高的WP质量浓度会显著降低反应体系中水分的质量分数,严重阻碍WP的扩散和运动,从而抑制了WP-Fe的形成。
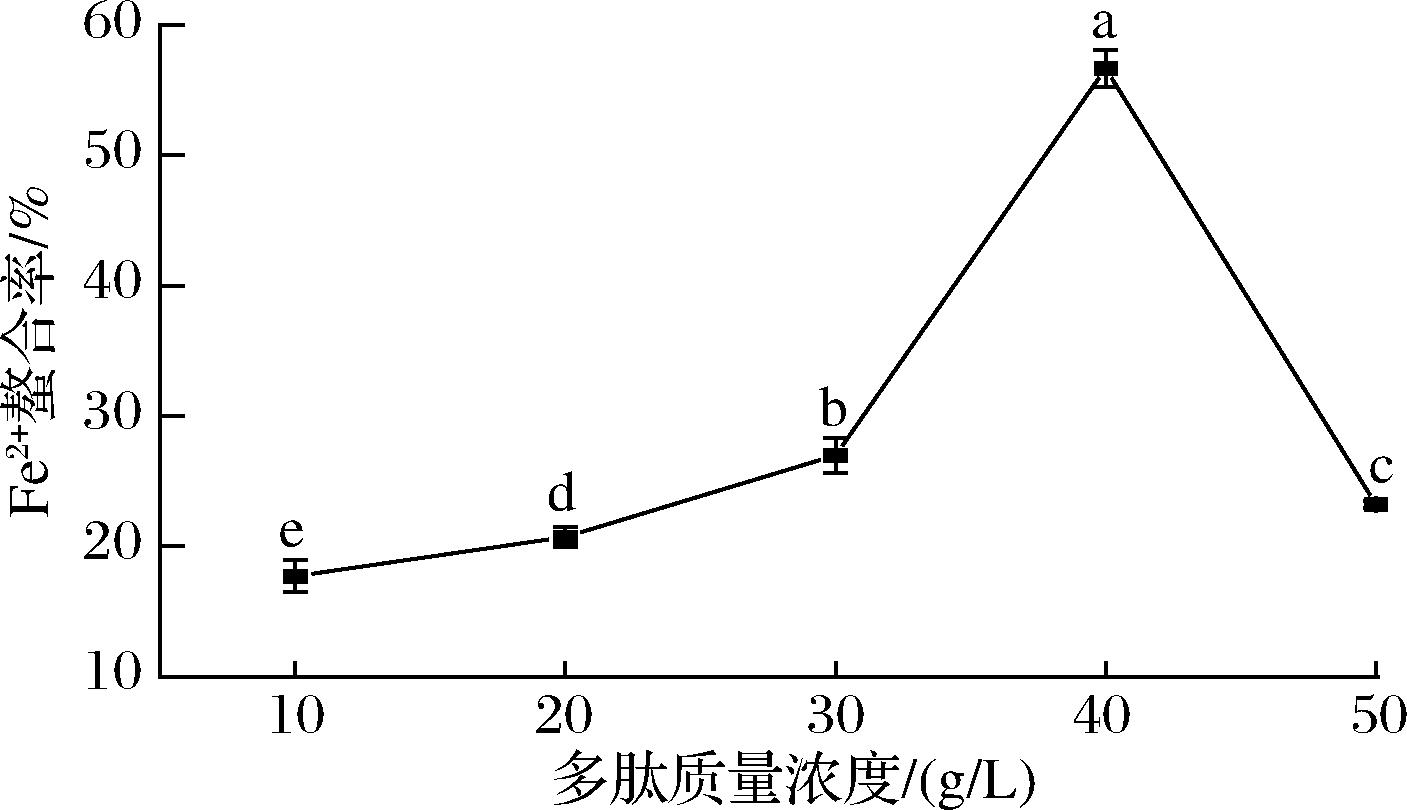
图1 WP浓度对Fe2+螯合率的影响
Fig.1 Effect of WP concentration on Fe2+ chelating rate
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.1.2 pH值对Fe2+螯合率的影响
图2显示了pH值对Fe2+螯合率的影响。随pH值从3增加到7,Fe2+螯合率逐渐上升,在pH值为7时,达到极大值84.62%。当pH<7时,反应混合液呈酸性。较高的H+浓度条件下,H+与Fe2+竞争性结合WP中的供电子基团,从而降低了WP与Fe2+的螯合能力[18]。而当pH>7时,反应混合液呈碱性。较高的OH-浓度条件下,OH-极易与Fe2+反应形成大量Fe(OH)2沉淀,最终导致WP中的供电子基团无法与Fe2+结合。因此,选择pH值7作为螯合物生成的最佳pH值。
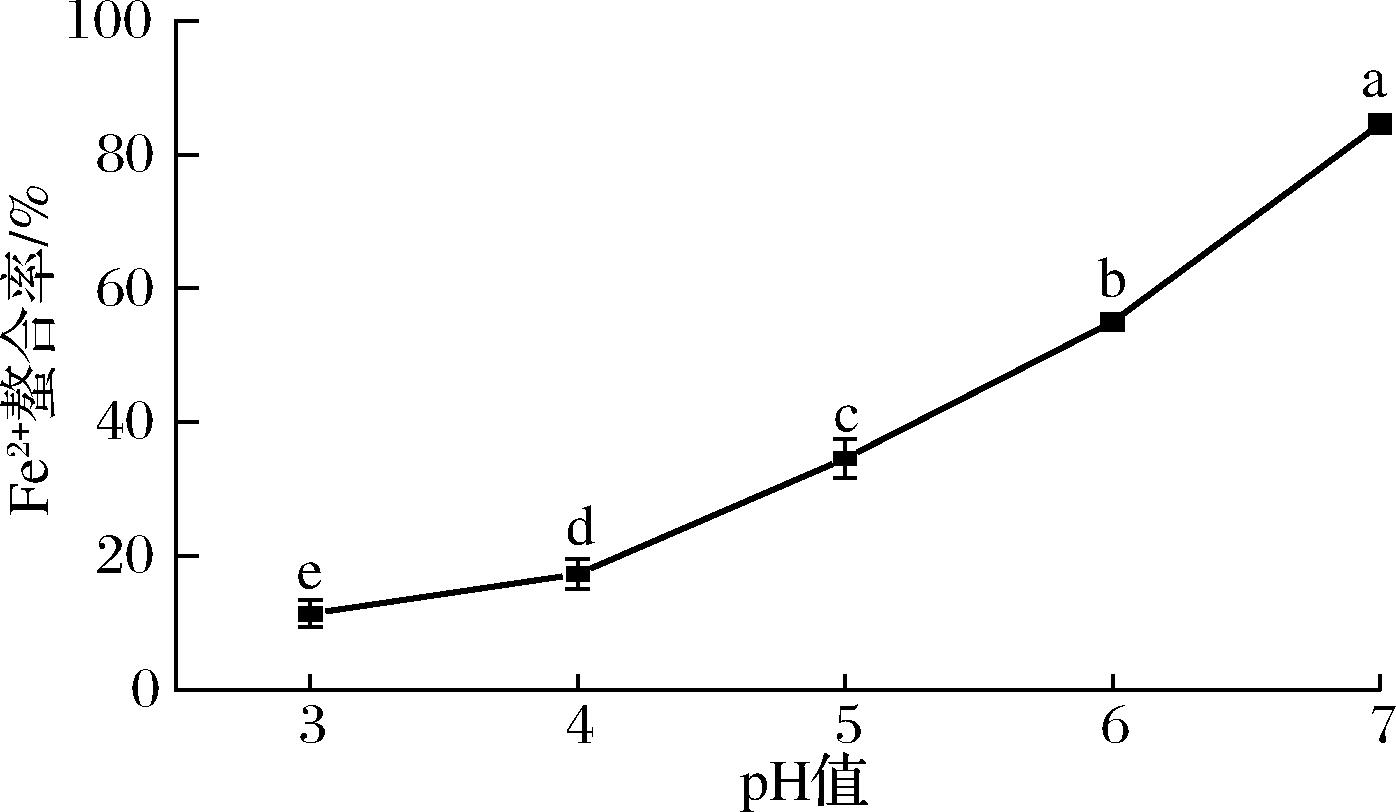
图2 pH对Fe2+螯合率的影响
Fig.2 Effect of different pH on Fe2+ chelating rate
2.1.3 肽铁质量比对Fe2+螯合率的影响
WP与FeCl2质量比对Fe2+螯合率的影响如图3所示。随肽铁比增大,Fe2+螯合率逐渐增大,当两者质量比为4∶1时,达到最大值87.81%。肽铁质量比较低时,WP的质量相对不足,不能为Fe2+提供足够的反应基团,螯合率较低;肽铁质量比较高时,WP的质量相对过量,Fe2+能够与WP充分结合,螯合率较高。然而,另一方面,过高的WP含量将导致效价降低,造成螯合物生产成本的升高。因此,选择质量比4∶1作为WP-Fe制备的最佳肽铁比。在小麦低聚肽肽铁螯合物的制备过程中,肽铁质量比对Fe2+螯合率的影响规律与本研究类似[13]。

图3 肽铁质量比对Fe2+螯合率的影响
Fig.3 Effect of mass ratio of WP/FeCl2 on Fe2+ chelating rate
2.1.4 反应温度对Fe2+螯合率的影响
温度对Fe2+螯合率的影响见图4。当温度从30 ℃升高到50 ℃时,WP-Fe的Fe2+螯合率从21.53%显著提高到峰值56.19%。这是因为,多肽与金属离子的结合是一种吸热反应,温度的适度升高有助于加速分子的运动,增加分子间碰撞的几率,从而提高反应效率[17]。然而,当温度继续升高到60 ℃时,Fe2+螯合率大幅降低至37.28%,这可能与过高温度导致的核桃肽部分或完全变性有关。因此,50 ℃是较为理想的螯合反应温度。
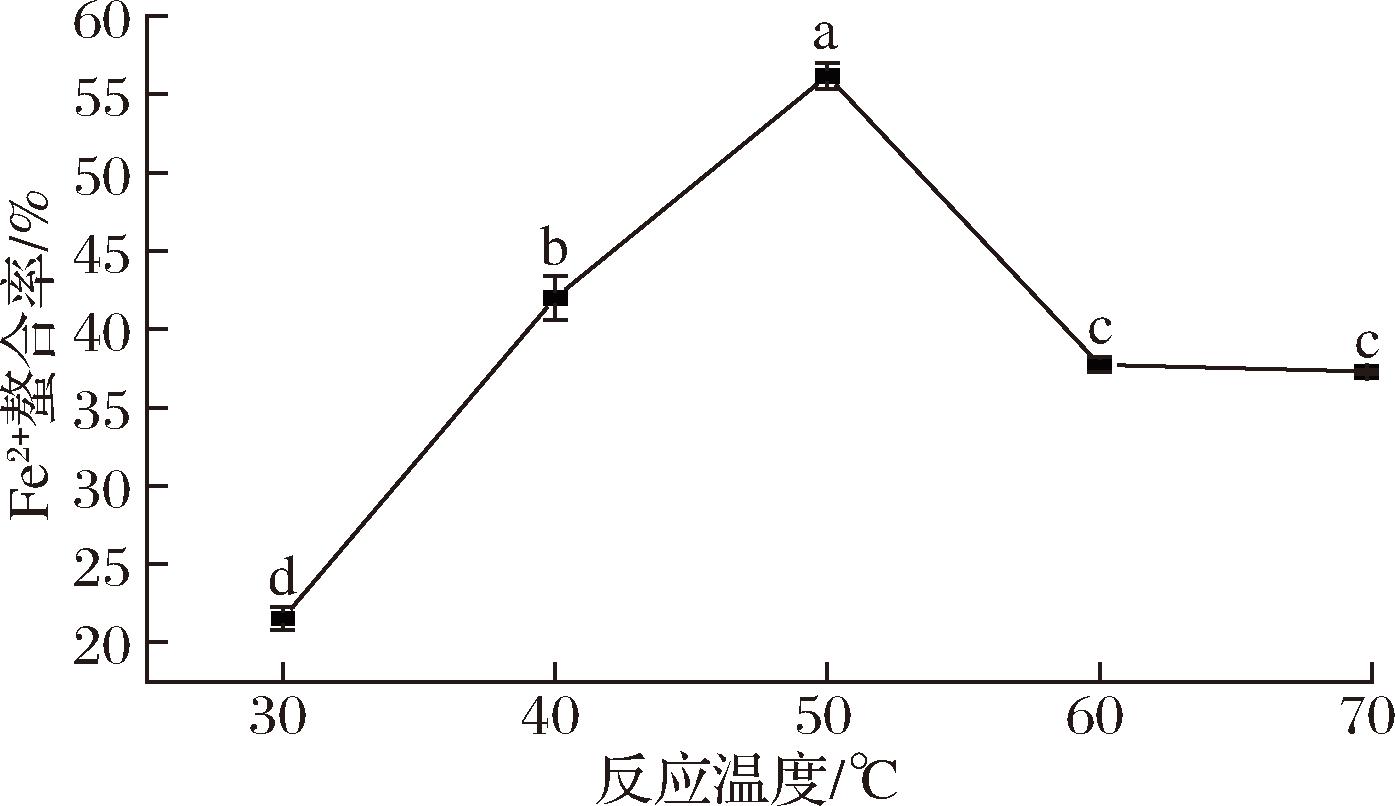
图4 反应温度对Fe2+螯合率的影响
Fig.4 Effect of reaction temperature on Fe2+ chelating rate
2.1.5 反应时间对Fe2+螯合率的影响
如图5所示,当螯合反应时间从20 min延长到40 min,Fe2+螯合率相应地从46.83%迅速提升至84.24%。进一步延长反应时间,反而导致Fe2+螯合率降低。这可能是因为过长的反应时间,促进了螯合物的逆向解离并伴随大量副产物的生成,降低了螯合率[22]。结果表明,WP与Fe2+的结合属于快速反应,在较短的时间内,即可完成。因此,为简化后续的正交试验设计,节约时间与经济成本,将螯合反应时间固定在40 min。
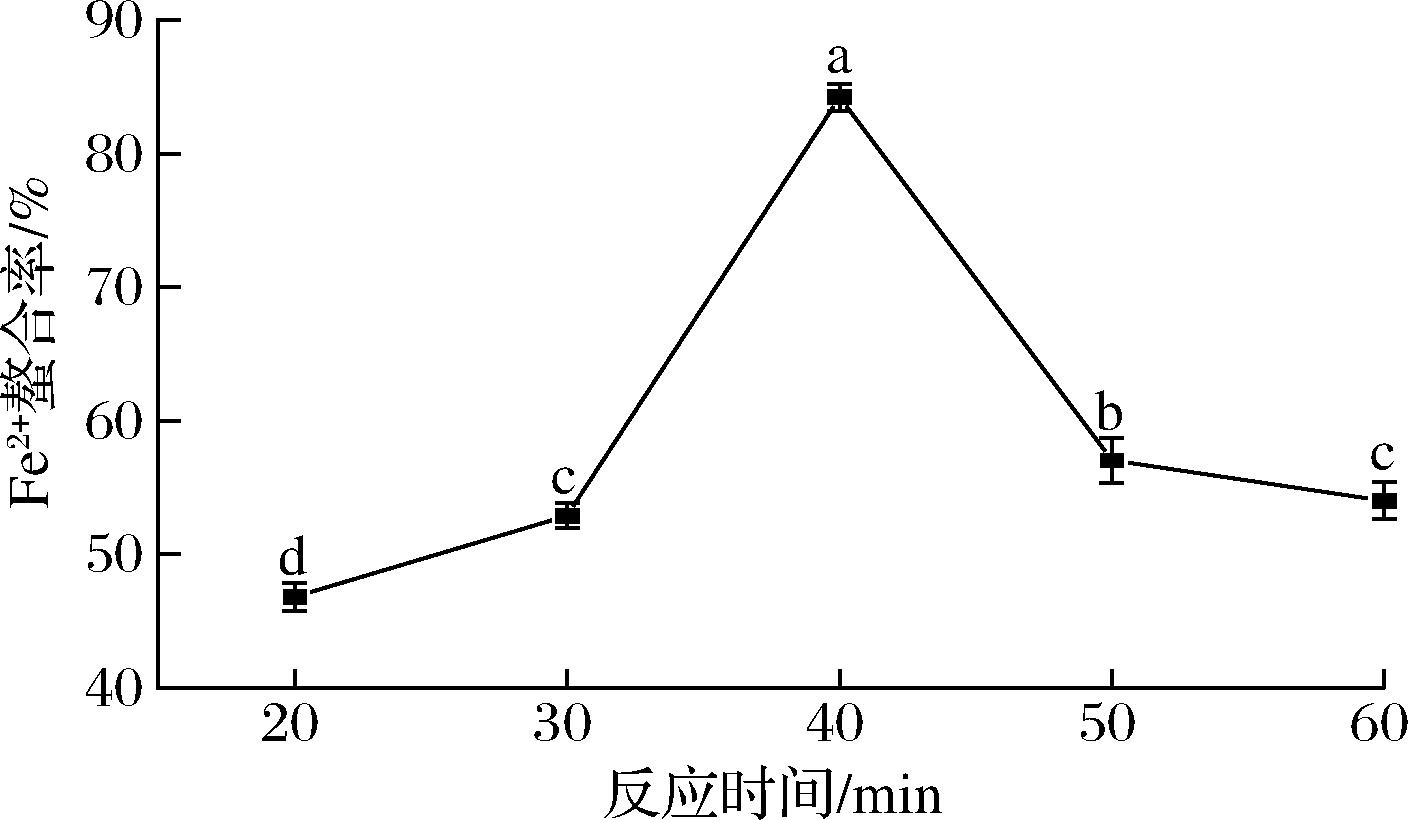
图5 反应时间对Fe2+螯合率的影响
Fig.5 Effect of reaction time on Fe2+ chelating rate
2.2 正交试验结果
参照单因素试验结果,以Fe2+螯合率为响应值,设计L9(34)正交表,对WP-Fe的制备工艺进行优化,实验设计及结果如表1所示。直观分析结果显示,影响Fe2+螯合率的因素顺序依次为:肽铁质量比>温度>多肽质量浓度>pH值。WP-Fe的最佳制备条件为A2B3C2D1,即多肽质量浓度40 g/L、pH值7、肽铁质量比3∶1、温度40 ℃、时间40 min。根据以上条件开展3次验证试验,结果显示,此时Fe2+螯合率高达91.99%,高于任一单因素组合,WP-Fe制备工艺优化成功。
表1 正交试验结果
Table 1 Orthogonal array experimental results

序号A(多肽质量浓度)/(g/L)B(pH值)C(肽铁质量比)D(反应温度)/℃Fe2+螯合率/%13052∶14067.7923063∶15072.9333074∶16084.7344053∶16071.9454064∶14088.4864072∶15069.8075054∶15079.2585062∶16054.9795073∶14078.04k175.1572.9964.1978.10k276.7472.1384.1573.99k370.7577.5274.3070.55R5.985.4019.977.55最优组合A2B3C2D191.99排列顺序C>D>A>B
2.3 紫外吸收光谱分析
金属离子与有机配体发生反应时,常导致紫外吸收光谱中新吸收峰的出现或原吸收峰的移动或消失。因此紫外光谱的变动常用以确证有机配体与金属离子之间螯合反应的发生[16]。如图6所示,WP在276 nm处有最大吸收峰。这可能是由WP中芳香族氨基酸残基上的苯环π-π跃迁引起。仅添加1 μmol/L Fe2+,就可导致WP的紫外吸收波谱从276 nm 红移至279 nm,紫外吸收强度由0.80增加至1.24。继续增加Fe2+浓度到5、10、20和30 μmol/L,紫外吸收发生红移,逐步从279 nm移动至281 nm,吸收强度也缓慢由1.24上升至1.58。这可能是WP上的活性反应基团与Fe2+发生复杂的配位反应所致。WP与Fe2+之间发生电子转移,改变了价电子跃迁能级以及具有手性的生色基(—C![]() O和—COOH)和助色基(—OH和—NH2)的空间结构,使得WP的特征紫外吸收峰的位置与强度都发生了变化[16]。此外,MENG等[19]证实,金属离子络合引起的多肽折叠,将原本位于多肽内部的芳香族氨基酸暴露出来,引起了紫外吸收波谱的改变。紫外波谱结果表明,WP可能通过与Fe2+结合,形成了新的化合物WP-Fe。
O和—COOH)和助色基(—OH和—NH2)的空间结构,使得WP的特征紫外吸收峰的位置与强度都发生了变化[16]。此外,MENG等[19]证实,金属离子络合引起的多肽折叠,将原本位于多肽内部的芳香族氨基酸暴露出来,引起了紫外吸收波谱的改变。紫外波谱结果表明,WP可能通过与Fe2+结合,形成了新的化合物WP-Fe。
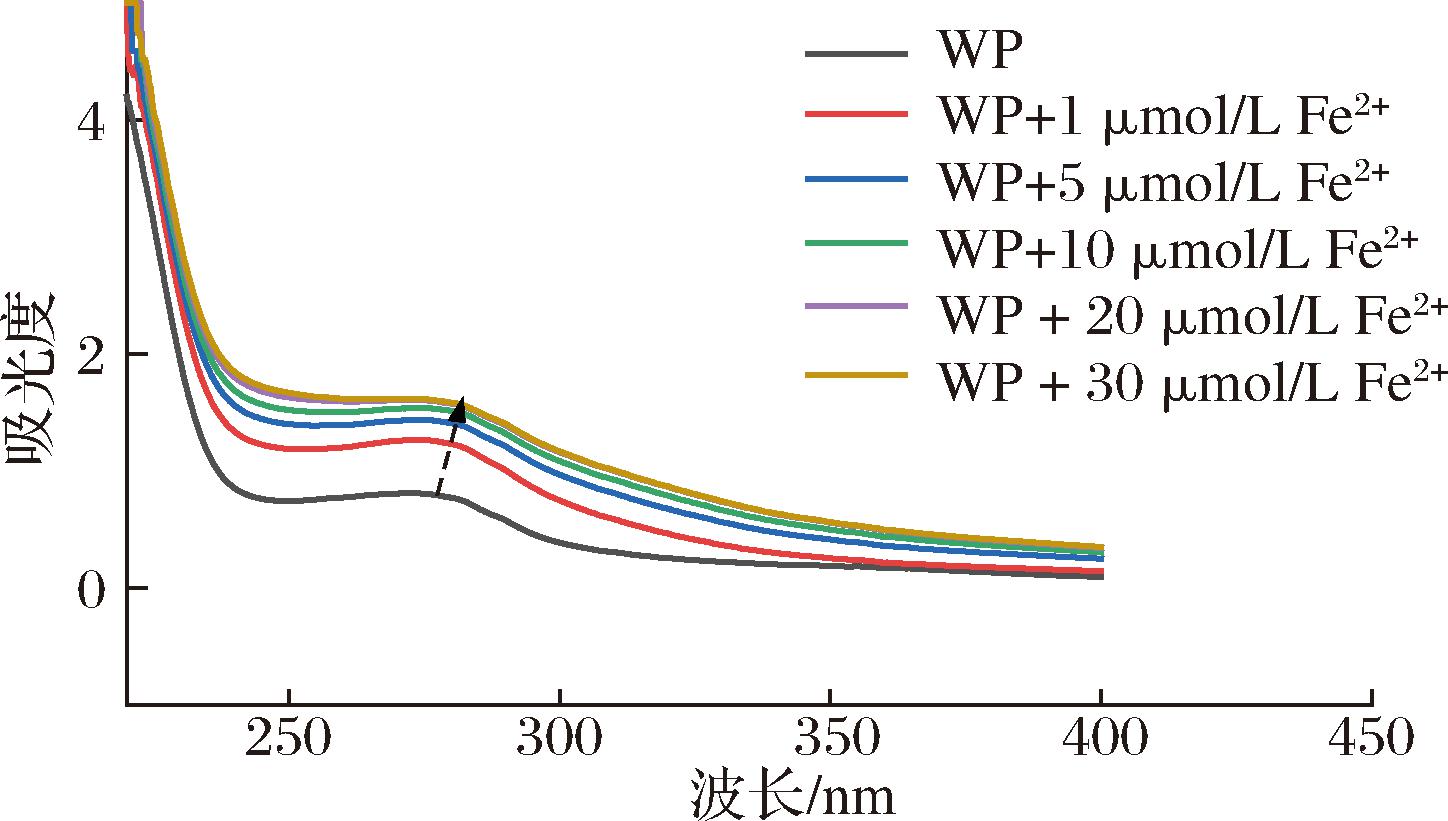
图6 不同浓度Fe2+作用下WP的紫外光谱
Fig.6 UV-Visible spectra of WP with different concentrations of Fe2+
2.4 荧光光谱分析
蛋白质或多肽中常含有大量的芳香族氨基酸残基。其具有共轭结构,受到特定激发,易发生π-π*跃迁,从而产生荧光光谱[18]。外源物质的结合会显著改变其空间结构,影响其跃迁能级,最终改变其荧光光谱。因此,荧光光谱常用于分析蛋白或多肽空间结构的改变情况。如图7所示,WP的荧光光谱变化分为2个阶段:a)仅添加5 μmol/L Fe2+时,WP发射光谱从354 nm处蓝移至350 nm处,荧光强度从88.07 上升至131.59。b)Fe2+添加量增加到10、20、30、50 μmol/L时,350 nm处的发射峰强度逐渐降低(从131.59下降至89.95),峰位置逐渐红移至352 nm。以上实验结果反映了Fe2+对WP空间结构调整的剂量依赖效应。少量Fe2+的结合,导致原本位于内部的芳香氨基酸残基暴露至肽分子表面,引起增色效应。而较高浓度Fe2+的结合,又引导外部的芳香氨基酸残基逐步转入分子内部,引起减色效应。侯健等[18]在辣木籽粕多肽亚铁螯合物的荧光光谱中也发现了类似的变化规律。
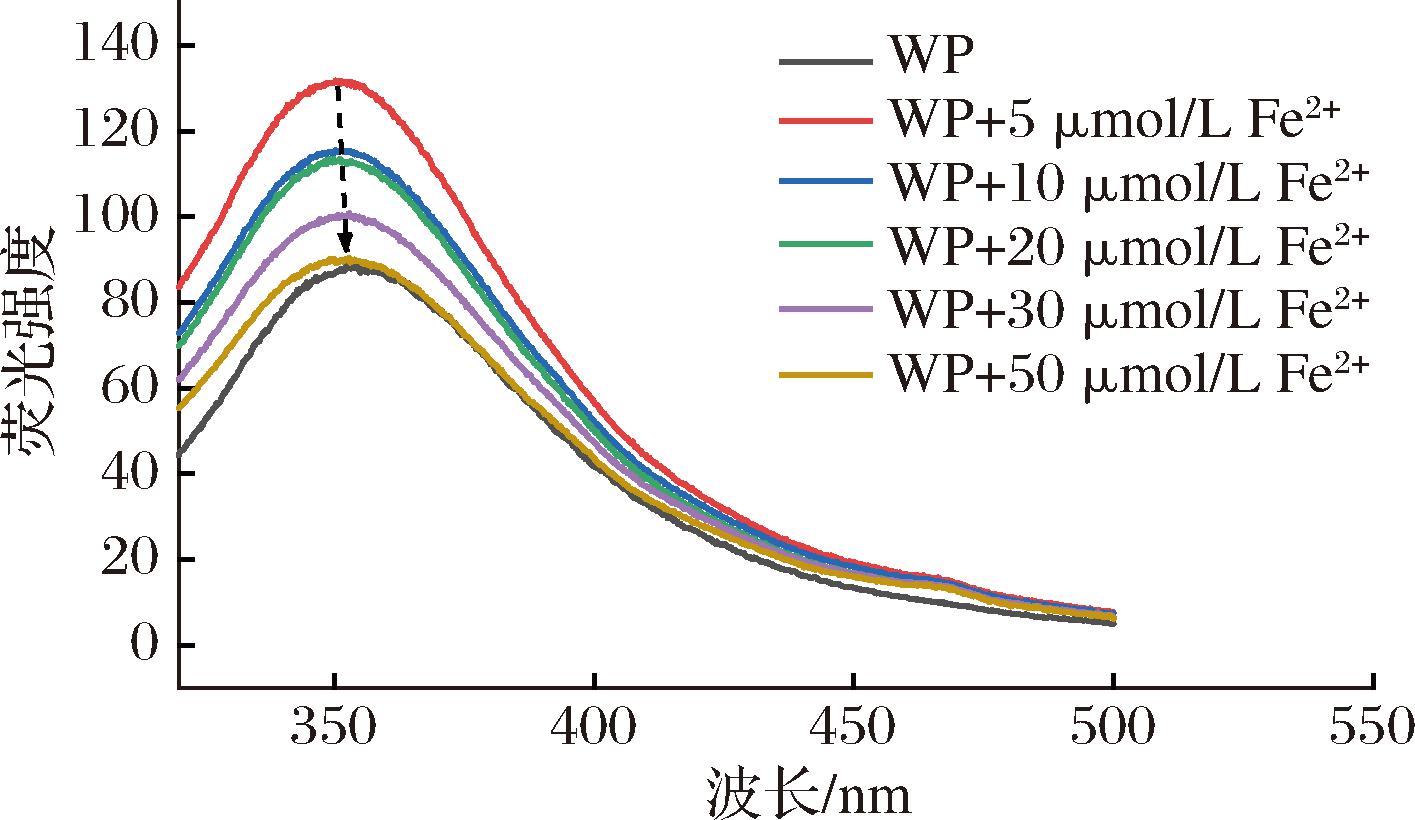
图7 不同浓度Fe2+作用下WP的荧光光谱
Fig.7 Fluorescence spectra of WP with different concentrations of Fe2+
2.5 扫描电镜分析
扫描电镜可反映WP-Fe及WP在微观结构方面的差异[17]。如图8所示,WP表面光滑且完整,而一旦与铁离子螯合后,表面完整性被打破,呈现出疏松多孔的颗粒状结构。同时,颗粒紧密堆积在一起,进一步形成了聚集体。形貌上的巨大改变可能是由于WP与Fe2+之间形成配位键,分子内部结构发生折叠和聚集所致。与此结果类似,LIU等[23]发现,黄皮抗氧化肽与铁螯合后,也可形成清晰的颗粒状聚集体。

a-WP;b-WP-Fe
图8 扫描电子显微镜图片(4 000×)
Fig.8 Scanning electron microscopic images
2.6 氨基酸组成分析
肽的金属离子结合能力与氨基酸类型及含量密切相关[24]。如表2所示,WP-Fe的氨基酸组成与WP有明显差异,酸性氨基酸(天冬氨酸和谷氨酸)含量由35.83%增加到42.82%,碱性氨基酸(赖氨酸、组氨酸和精氨酸)由16.68%增加到17.39%。酸性与碱性氨基酸是最常被报道的具有金属离子螯合活性的多肽氨基酸残基。由此推断,WP中的酸性或碱性氨基酸残基可能参与了Fe2+的螯合反应[24]。
表2 WP和WP-Fe的氨基酸组成
Table 2 Amino acid compositions of WP and WP-Fe
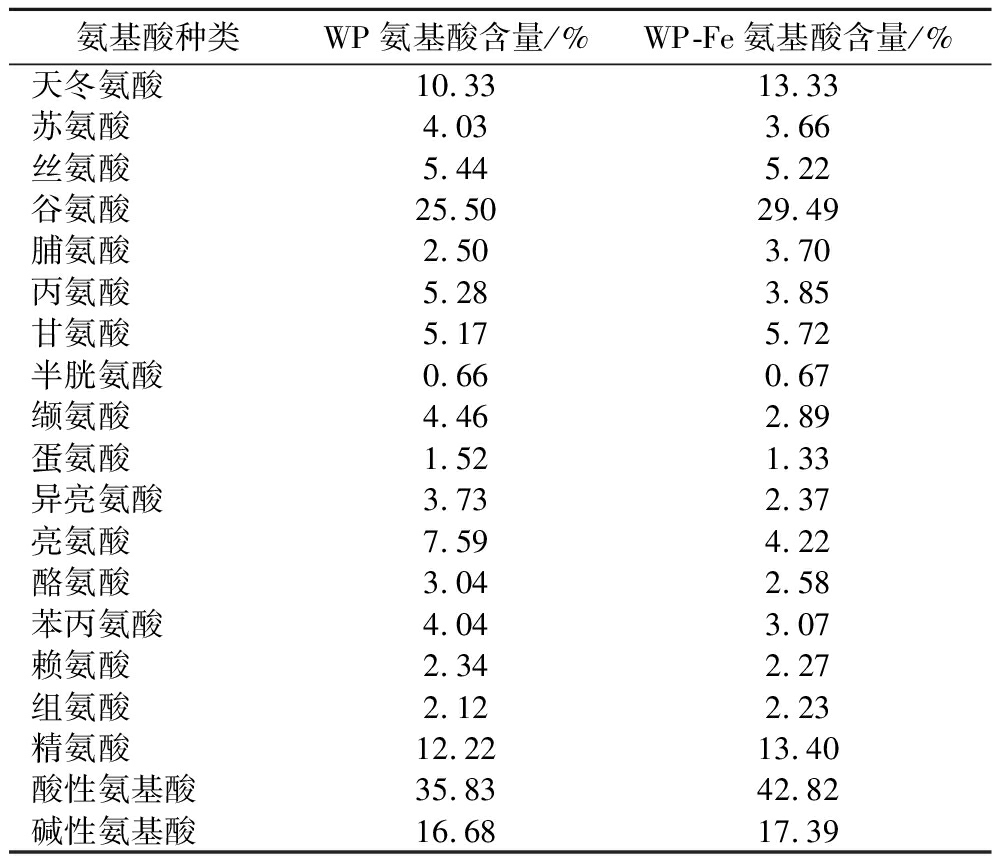
氨基酸种类WP氨基酸含量/%WP-Fe氨基酸含量/%天冬氨酸10.3313.33苏氨酸4.033.66丝氨酸5.445.22谷氨酸25.5029.49脯氨酸2.503.70丙氨酸5.283.85甘氨酸5.175.72半胱氨酸0.660.67缬氨酸4.462.89蛋氨酸1.521.33异亮氨酸3.732.37亮氨酸7.594.22酪氨酸3.042.58苯丙氨酸4.043.07赖氨酸2.342.27组氨酸2.122.23精氨酸12.2213.40酸性氨基酸35.8342.82碱性氨基酸16.6817.39
注:酸性氨基酸(天冬氨酸、谷氨酸);碱性氨基酸(赖氨酸、组氨酸、精氨酸)。
2.7 红外光谱分析
傅里叶变换红外光谱主要用于物质特征官能团的表征,现已广泛用于多肽与金属离子螯合位点的确认[15]。如图9所示,N—H 键伸缩振动引起的红外吸收,从3 486 cm-1移动到了3 484 cm-1。这可能是由于Fe2+与N原子的配位,降低了N—H键间电子云的密度,N—H键键长变长所致。此外,WP与Fe2+结合后,C![]() O键伸缩振动引起的红外吸收,从1 673 cm-1移至1 686 cm-1;—COO-的对称伸缩振动从1 426 cm-1移至1 454 cm-1;C—N面内弯曲振动从618 cm-1移动至616 cm-1。以上结果表明,羰基/羧基氧原子、氨基/酰胺氮原子可能是Fe2+发生螯合反应的具体结合位点[17]。这与2.6节部分氨基酸组成分析结果吻合,也与曹丛丛等[25]对阿胶肽铁螯合物螯合位点的分析结果类似。
O键伸缩振动引起的红外吸收,从1 673 cm-1移至1 686 cm-1;—COO-的对称伸缩振动从1 426 cm-1移至1 454 cm-1;C—N面内弯曲振动从618 cm-1移动至616 cm-1。以上结果表明,羰基/羧基氧原子、氨基/酰胺氮原子可能是Fe2+发生螯合反应的具体结合位点[17]。这与2.6节部分氨基酸组成分析结果吻合,也与曹丛丛等[25]对阿胶肽铁螯合物螯合位点的分析结果类似。
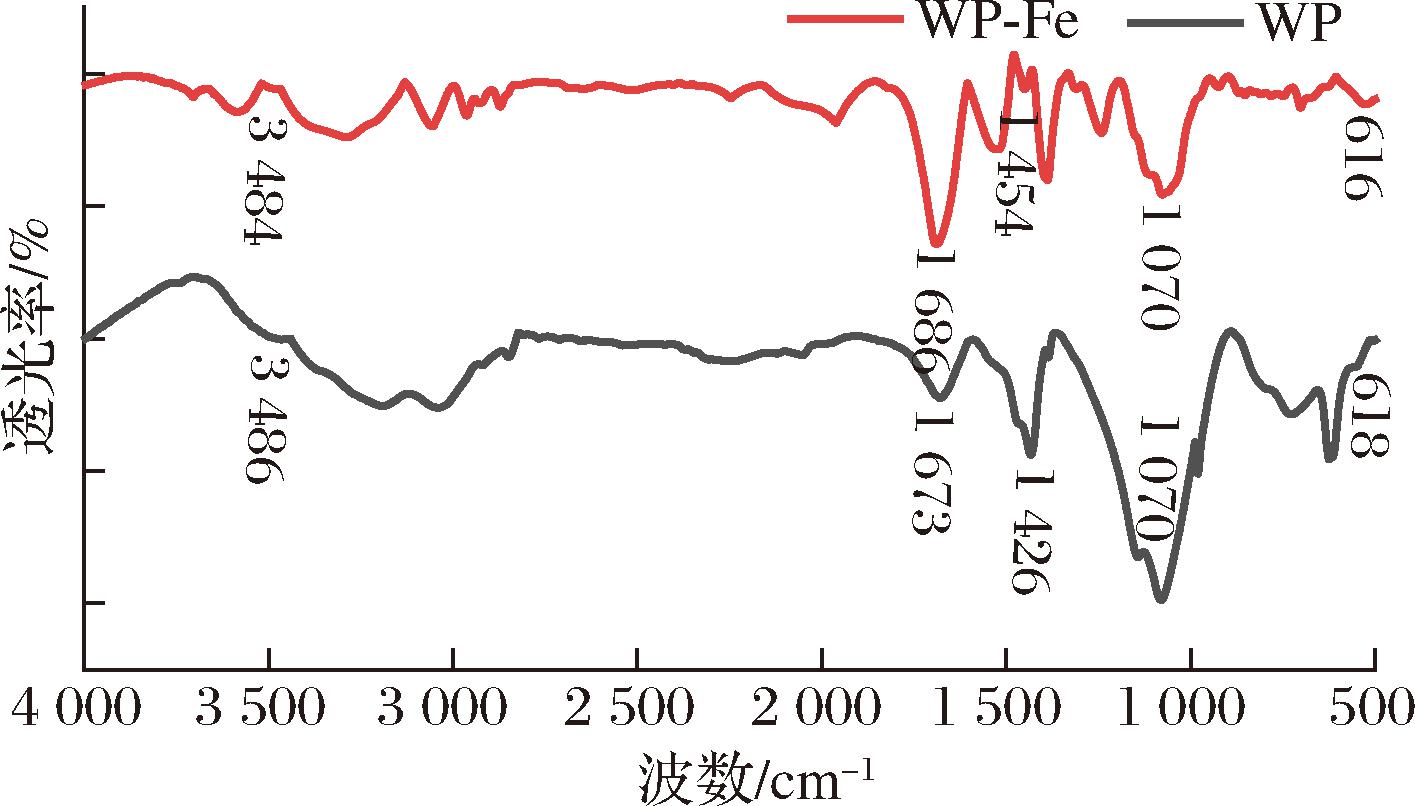
图9 WP和WP-Fe的红外光谱
Fig.9 Fourier transform infrared spectrometer of WP and WP-Fe
2.8 体外模拟胃肠消化过程中铁的释放率
考虑到良好的人体胃肠道溶解度是铁补充剂有效性的先决条件,本研究以FeSO4作为阳性对照,在模拟消化条件下测量铁的释放率。如图10所示,在胃消化阶段(0~120 min),WP-Fe孵育60 min后,Fe2+的释放率开始显著优于FeSO4,且释放率维持在75%以上。一旦进入肠消化期(120~240 min),两者的铁释放率均急剧下降。值得注意的是,在整个肠道消化阶段,FeSO4的铁释放率极低,仅保持在10%左右。而WP-Fe的铁离子释放率始终维持在35%以上,显著高于相应时间点的FeSO4。这可能是由于肠道消化液呈弱碱性,FeSO4中的Fe2+容易与OH-形成Fe(OH)2沉淀,阻碍了其在上清液中的释放。而WP-Fe中的Fe2+由于多肽的包裹,避免了与OH-的直接接触,从而保护了Fe2+[20]。综上所述,WP-Fe在整个消化过程中始终保持较高的铁释放率,具有良好的溶解度/生物可及性,有利于铁在人体肠道中的进一步吸收和运输。
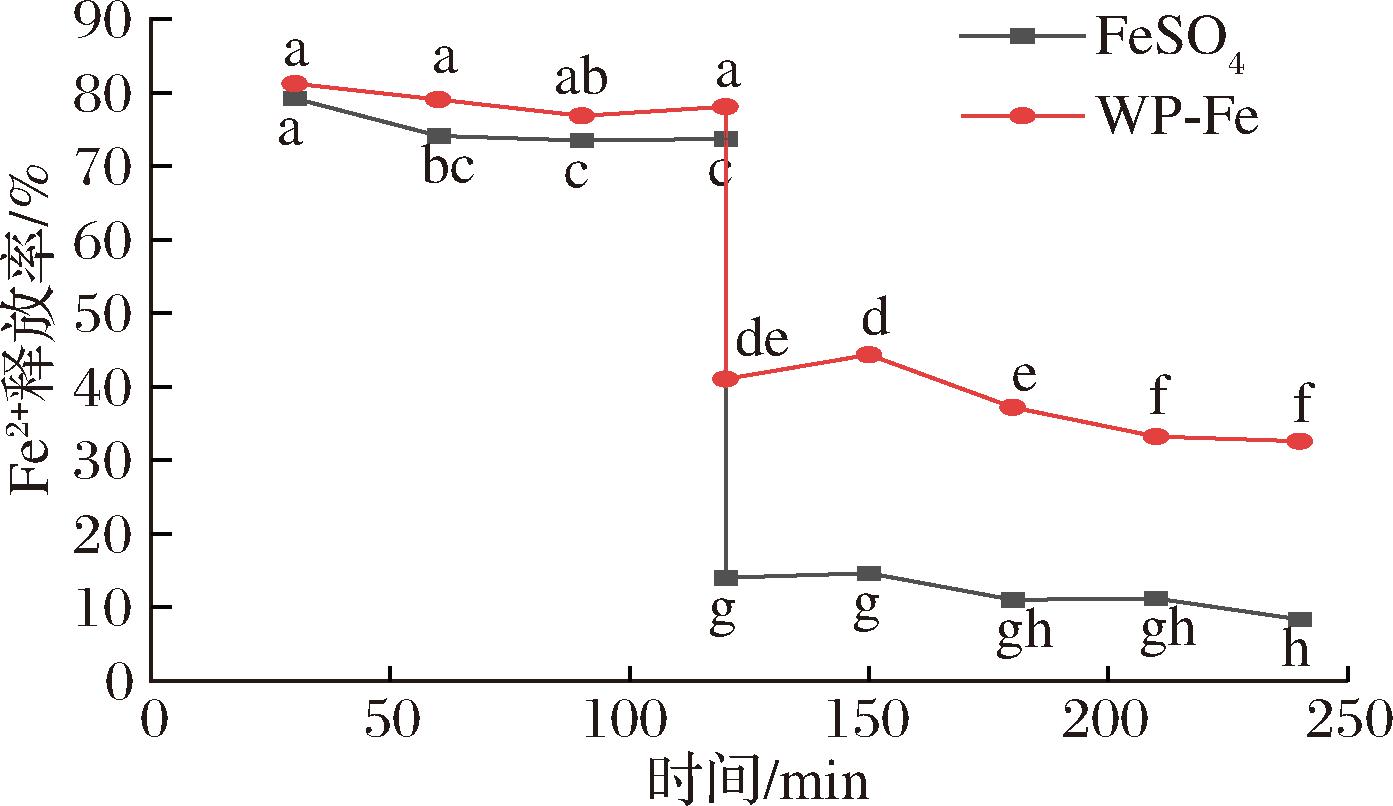
图10 体外模拟胃肠消化条件下WP-Fe和FeSO4的 Fe2+释放率
Fig.10 Fe2+ release rates of WP-Fe and FeSO4 under simulated gastrointestinal digestion in vitro
2.9 Caco-2细胞活力
为初步测定WP-Fe的安全性,其对Caco-2细胞活力的影响被测定。如图11所示,在所有测试的质量浓度条件下,WP-Fe均未显现出明显的细胞毒性,细胞存活率均保持在80%以上。在同等质量浓度下,WP-Fe对Caco-2细胞活力的影响均弱于FeSO4。以上结果表明,作为潜在的新型补铁剂,WP-Fe比传统补铁剂FeSO4具有更高的安全性。WANG等[11]利用Caco-2细胞,针对酪蛋白肽铁螯合物开展的细胞毒性测试结果与本研究一致。
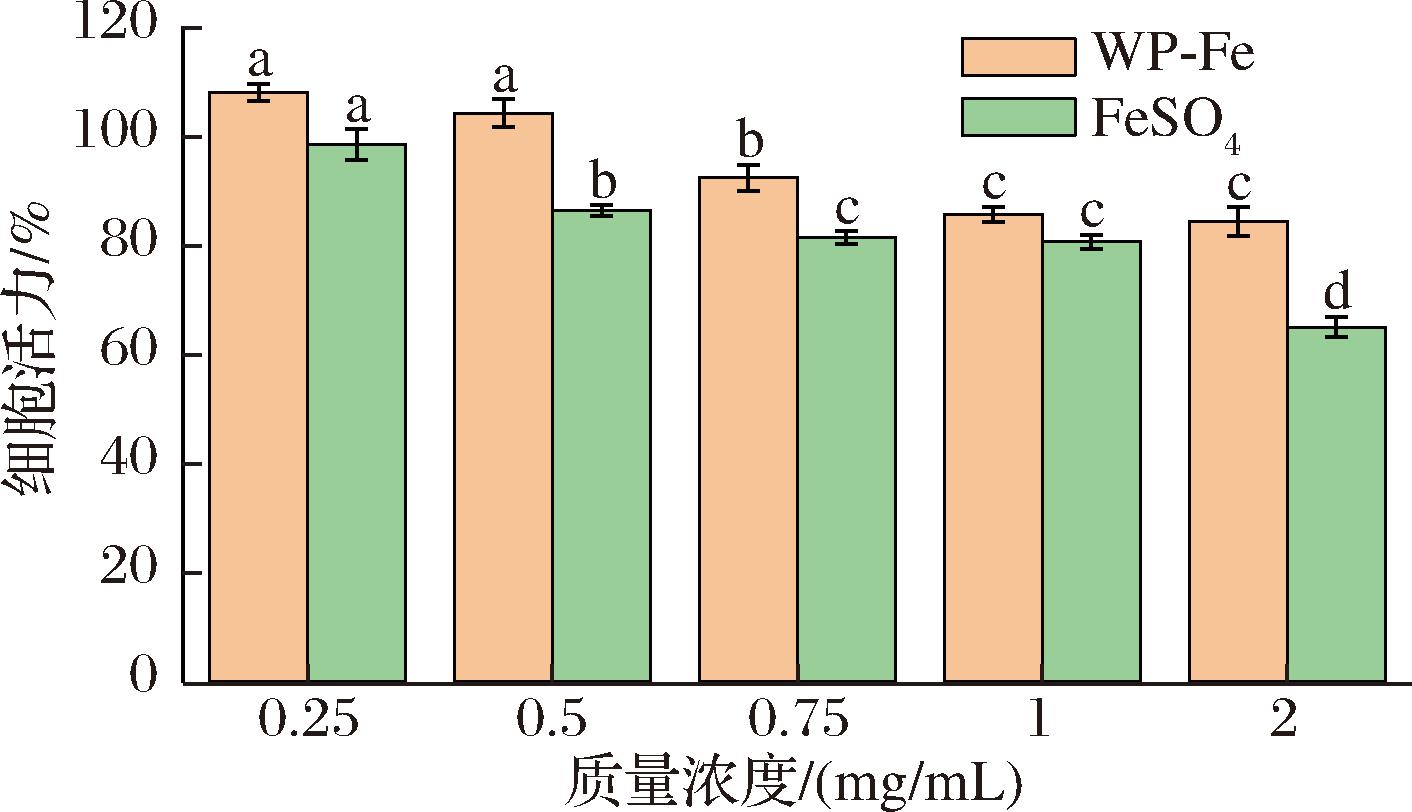
图11 WP-Fe和FeSO4的细胞活力
Fig.11 Cell viability of WP-Fe and FeSO4
3 结论
WP-Fe的最佳制备条件为多肽质量浓度40 g/L、pH值7、肽铁质量比3∶1、反应温度40 ℃、反应时间40 min。在此条件下,Fe2+螯合率可达91.99%。基于紫外、荧光光谱及扫描电镜观察结果,证实WP与Fe2+成功螯合,螯合物表面粗糙,呈颗粒状。氨基酸组成分析及红外光谱结果表明,酸/碱性氨基酸残基上的氨基氮原子和羧基氧原子是WP与Fe2+结合的主要位点。此外,体外胃肠模拟消化和Caco-2细胞毒性实验结果证实,WP-Fe具有比FeSO4更高的Fe2+释放率和安全性。本研究结果将为新型铁补充剂的开发及核桃加工废料的高值化利用提供新的思路。
[1] SONG H Y, CONG Z F, WANG C L, et al.Research progress on walnut oil:Bioactive compounds, health benefits, extraction methods, and medicinal uses[J].Journal of Food Biochemistry, 2022, 46(12):e14504.
[2] 成静, 陈大伟, 曲敏, 等.核桃肽制备工艺的优化及其改善记忆功能研究[J].食品工业科技, 2021, 42(11):135-141.CHENG J, CHEN D W, QU M, et al.Study on the optimization of the preparation process of walnut peptide and the improvement of memory function[J].Science and Technology of Food Industry, 2021, 42(11):135-141.
[3] WEN C T, ZHANG Z Y, CAO L Y, et al.Walnut protein:A rising source of high-quality protein and its updated comprehensive review[J].Journal of Agricultural and Food Chemistry, 2023, 71(28):10 525-10 542.
[4] BATHLA S, ARORA S.Prevalence and approaches to manage iron deficiency anemia (IDA)[J].Critical Reviews in Food Science and Nutrition, 2022, 62(32):8 815-8 828.
[5] SHUBHAM K, ANUKIRUTHIKA T, DUTTA S, et al.Iron deficiency anemia:A comprehensive review on iron absorption, bioavailability and emerging food fortification approaches[J].Trends in Food Science &Technology, 2020, 99:58-75.
[6] 刘月姣. 《中国居民营养与慢性病状况报告(2020年)》发布[J].中国食物与营养, 2020, 26(12):2.LIU Y J.The report on nutrition and chronic diseases of China residents (2020) was released[J].Food and Nutrition in China, 2020, 26(12):封2.
[7] CAO G Y, LI K X, JIN P F, et al.Comparative bioavailability of ferrous succinate tablet formulations without correction for baseline circadian changes in iron concentration in healthy Chinese male subjects:A single-dose, randomized,2-period crossover study[J].Clinical Therapeutics, 2011, 33(12):2054-2059.
[8] FRAZER D M, ANDERSON G J.The regulation of iron transport[J].BioFactors, 2014, 40(2):206-214.
[9] 王孟丽, 布冠好.肽与金属离子螯合物的研究进展[J].食品工业, 2021, 42(5):323-326.WANG M L, BU G H.Research progress of peptide and metal ion chelate[J].The Food Industry, 2021, 42(5):323-326.
[10] 刘凌云. 国内外多肽金属离子螯合物的研究进展[J].化工设计通讯, 2023, 49(8):32-34.LIU L Y.Research progress in peptide metal ion chelates at home and abroad[J].Chemical Engineering Design Communications, 2023, 49(8):32-34.
[11] WANG Y H, CAI M, ZENG H, et al.Preparation, characterization and iron absorption by Caco-2 cells of the casein peptides-iron chelate[J].International Journal of Peptide Research and Therapeutics, 2022, 28(4):116.
[12] 陈嘉琪, 张珍, 费莹莹, 等.羊骨多肽亚铁螯合物的制备工艺优化及结构表征[J].食品与发酵科技, 2021, 57(5):1-7;21.CHEN J Q, ZHANG Z, FEI Y Y, et al.Preparation process optimization and structure characterization of sheep bone polypeptide chelate with ferrous iron[J].Food and Fermentation Sciences &Technology, 2021, 57(5):1-7;21.
[13] 孙传强, 张新雪, 刘家生, 等.小麦低聚肽螯合铁的制备与结构表征[J].食品与发酵工业, 2023, 49(9):194-200.SUN C Q, ZHANG X X, LIU J S, et al.Preparation and structure characterization of iron-chelating wheat oligopeptides[J].Food and Fermentation Industries, 2023, 49(9):194-200.
[14] 原洪, 柴丽琴, 王立霞, 等.花椒籽肽-铁螯合物的制备及其理化性质[J].食品与发酵工业, 2018, 44(6):164-171.YUAN H, CHAI L Q, WANG L X, et al.Preparation of iron-chelating peptides of Zanthoxylum bungeanum seed and its physicochemical properties[J].Food and Fermentation Industries, 2018, 44(6):164-171.
[15] 郭安鹊, 张星星, 张予林, 等.葡萄酒中总铁和Fe2+的改良菲洛嗪法快速测定[J].农业机械学报, 2017, 48(10):338-344.GUO A Q, ZHANG X X, ZHANG Y L, et al.Rapid determination of total iron and ferrous ion in wine by modified ferrozine assay[J].Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(10):338-344.
[16] 温耀涵. 牛血红蛋白肽亚铁螯合物的制备及其稳定性研究[D].郑州:河南农业大学, 2023.WEN Y H.Preparation and stability of bovine hemoglobin peptide-ferrous chelata[D].Zhengzhou:Henan Agricultural University, 2023.
[17] 杨静, 石景, 邹烨, 等.鸡血多肽亚铁螯合物的制备工艺优化及结构表征[J].江苏农业学报, 2022, 38(6):1678-1685.YANG J, SHI J, ZOU Y, et al.Preparation process optimization and structural characterization of chicken blood peptides-iron chelate[J].Jiangsu Journal of Agricultural Sciences, 2022, 38(6):1678-1685.
[18] 侯健, 李美萍, 郭彩霞, 等.辣木籽粕多肽亚铁螯合物的制备及其结构分析[J].中国粮油学报, 2023, 38(11):75-82.HOU J, LI M P, GUO C X, et al.Preparation and structure analysis of polypeptide chelate with ferrous iron from Moringa oleiferia seed meal[J].Journal of the Chinese Cereals and Oils Association, 2023, 38(11):75-82.
[19] MENG K K, CHEN L, XIA G H, et al.Effects of zinc sulfate and zinc lactate on the properties of tilapia (Oreochromis niloticus) skin collagen peptide chelate zinc[J].Food Chemistry, 2021, 347:129043.
[20] WU W M, HE L C, LIANG Y H, et al.Preparation process optimization of pig bone collagen peptide-calcium chelate using response surface methodology and its structural characterization and stability analysis[J].Food Chemistry, 2019, 284:80-89.
[21] 熊喆, 秦子波, 赵钰, 等.鲢鱼鳞胶原肽-铁螯合物的制备及其特性表征[J].现代食品科技, 2023, 39(4):187-195.XIONG Z, QIN Z B, ZHAO Y, et al.Preparation and characterization of iron-chelating peptides from silver carp scale collagen[J].Modern Food Science and Technology, 2023, 39(4):187-195.
[22] 徐铭笙. 纤维/肽铁螯合物的制备、理化性质及生物利用率的研究[D].杭州:浙江工商大学, 2023.XU M S.Study on preparation, physicochemical properties and bioavailability of fiber/peptide iron chelate[D].Hangzhou:Zhejiang Gongshang University, 2023.
[23] LIU Y, MA X Y, SI X X, et al.Preparation, characterization, and properties of wampee seed antioxidant peptides-iron chelate[J].Journal of Food Processing and Preservation, 2022, 46(5):e16513.
[24] FAN C Z, GE X F, HAO J Y, et al.Identification of high iron-chelating peptides with unusual antioxidant effect from sea cucumbers and the possible binding mode[J].Food Chemistry, 2023, 399:133912.
[25] 曹丛丛, 管玲娟, 屠飘涵, 等.具有潜在补血活性的阿胶肽铁螯合物的结构表征[J].食品与发酵工业, 2021, 47(24):28-34.CAO C C, GUAN L J, TU P H, et al.Structural characterization of Ejiao peptide-iron chelates with potential hematopoietic effect[J].Food and Fermentation Industries, 2021, 47(24):28-34.