微胶囊技术可提升藻油二十二碳六烯酸(docosahexaenoic acid,DHA)的稳定性,目前制备藻油微胶囊常用的方法为喷雾干燥法,但在喷雾干燥的制备过程中,不可避免的高温会导致藻油发生氧化[1]。冷冻干燥法制备微胶囊可避免产生高温高热,防止藻油DHA在微胶囊制备过程过度氧化,但在冻干过程中,冰晶的升华和水分的析出等可能会影响微胶囊结构的稳定,进而影响芯材的包埋效果。因此使用冷冻干燥法制备藻油微胶囊时,微胶囊壁材还需具有良好的冷冻保护性[2]。本研究此前制备的糖基化明胶相比于原始明胶乳化稳定性显著提升,有利于藻油乳液在冻干的过程中保持稳定[3]。研究表明,还原糖具有良好的冷冻保护性,因此在冷冻干燥过程中,糖基化明胶中的还原糖可对微胶囊结构起到一定保护作用[4]。
冷冻干燥前乳液的性质对微胶囊产品的性能和质量有重要影响,乳液的粒径同微胶囊的包埋率直接相关,乳液中的固形物含量、芯壁比、乳液液滴大小和稳定性对微胶囊的稳定性具有重要作用[5]。良好的藻油微胶囊产品不仅要求产品包埋率高,同时还要求产品具有水分含量低、溶解性好和易分散等特性[6]。水分含量直接影响微胶囊的贮藏稳定性,而溶解度则会影响微胶囊的食用品质以及在人体内的释放和消化吸收性能[7]。加速氧化的方法是评定油脂产品贮藏稳定性的常用方法,通过烘箱法加热最为常用,60 ℃烘箱加热加速油脂氧化能够较为准确地反映出油脂在室温下的氧化情况[8]。
本研究采用冷冻干燥法并以糖基化明胶为壁材制备藻油微胶囊,利用粒径分析及微观结构观察等手段研究不同壁材体系对乳液冻融稳定性和微胶囊复水性的影响,考察微胶囊水分含量、水分活度、溶解性和分散性,使用加速氧化测定藻油微胶囊的过氧化值(peroxidation value,POV)和DHA保留率随贮藏时间的变化,并对氧化过程中的氧化动力学进行研究。以期为藻油微胶囊质量评价及氧化稳定性的研究提供参考。
1 材料与方法
1.1 材料与试剂
A型明胶(~220 g Bloom),河南博洋生物科技有限公司;低聚甘露糖(聚合度2~10),郑州宇控生物科技有限公司;尼罗红,上海麦克林生化科技有限公司;DHA标准品,上海毕得医药有限公司;十七烷酸,上海迈瑞尔化学技术有限公司。
1.2 仪器与设备
SY-10真空冷冻干燥机,北京松源华兴科技发展有限公司;5804R多功能台式冷冻离心机,德国艾本德公司;Nano ZS90纳米粒度仪,英国马尔文公司;BX43光学显微镜,日本奥林巴斯公司;A1+R10802光谱性激光共聚焦显微镜(confocal laser scanning microscope,CLSM),日本尼康公司;Phenom Pro扫描电镜(scanning electron microscope,SEM),荷兰分飞纳公司;GC-2010气相色谱仪,日本岛津公司。
1.3 实验方法
1.3.1 明胶糖基化产物制备
采用干法制备糖基化明胶[9],准确称取一定量明胶,室温下用去离子水溶胀2 h,40 ℃水浴搅拌溶解1 h,定容至0.1 g/mL。将麦芽糊精和低聚甘露糖分别用去离子水溶解,定容至0.1 g/mL,按照V(明胶)∶V(糖)=2∶1混合2种溶液。用0.1 mol/L NaOH溶液和0.1 mol/L HCl溶液调节混合溶液pH值至7,40 ℃搅拌1 h,冷冻干燥。然后置于底部装有饱和KCl溶液的干燥器中,65 ℃(相对湿度79%)干热反应。麦芽糊精-明胶混合物干热反应48 h,低聚甘露糖-明胶糖基化产物干热反应24 h,最后冷冻干燥。
1.3.2 糖基化明胶-藻油乳液和微胶囊制备
按芯壁比0.3、固形物含量17.5%的比例混合藻油和麦芽糊精-糖基化明胶溶液,用高速分散器于12 500 r/min下将混合溶液均质2 min,得糖基化麦芽糊精-明胶-藻油乳液,将该乳液冷冻干燥,破碎成粉,得藻油微胶囊,乳液和微胶囊记为MG。按固形物含量12.5%、分散转速12 500 r/min、芯壁比0.3的条件制备糖基化低聚甘露糖-明胶-藻油乳液和微胶囊,记为OG。等质量混合2种糖基化壁材,按MG微胶囊的条件制备藻油乳液微胶囊和乳液,记为MOG;同时按MG微胶囊的制备条件单独用明胶制备藻油乳液和微胶囊,记为GE。
1.3.3 微胶囊性质表征
1.3.3.1 包埋率
表面油含量测定参考SONG等[10]的方法并适当修改,准确称取2 g(精确到0.000 1 g)微胶囊样品至洁净干燥的锥形瓶中,加入30 mL沸程为30~60 ℃石油醚,振荡3 min,过滤至已知质量的圆底烧瓶(m0)中,继续用10 mL石油醚洗涤锥形瓶3次。将圆底烧瓶于50 ℃旋转蒸发除去石油醚,放入烘箱中烘至恒重,冷却后称量并记录质量(m1)。按照公式(1)计算表面油质量:
表面油含量/g=m1-m0
(1)
总油含量测定参考李成忠等[11]的方法并适当修改,准确称取2 g(精确到0.000 1 g)微胶囊样品置于洁净干燥烧杯中,加入去离子水20 mL,50 ℃加热搅拌至溶解,依次加入无水乙醇、石油醚、无水乙醇(体积比2∶1∶1),充分搅拌,将上层萃取液转移至已知质量(m0)的干燥圆底烧瓶,重复萃取2次,50 ℃旋转蒸发除去溶剂,转移至烘箱中烘干至恒重,冷却后称量记录质量(m1)。按照公式(2)计算总油含量:
总油含量/g=m1-m0
(2)
微胶囊包埋率按照公式(3)计算:
包埋率![]()
(3)
1.3.3.2 水分含量
水分含量采用质量法测定[12],准确称取1.0 g微胶囊粉末,105 ℃加热3~5 h后置于干燥器中冷却至室温,称重,重复以上操作至样品恒重,记录数据。按照公式(4)计算:
水分含量![]()
(4)
式中:m0为未处理的微胶囊质量,g;m1为处理之后的微胶囊质量,g。
1.3.3.3 水分活度测定
采用水分活度仪于室温下测定,准确称取1 g微胶囊样品置于样品台,平衡10 min后测定,仪器读数稳定后记录数据。
1.3.3.4 溶解度测定
参考CANO-CHAUCA等[13]的方法并适当修改,准确称取1 g微胶囊样品溶解于30 mL去离子水中,1 000 r/min搅拌5 min,3 000×g离心10 min,取10 mL上清液转移到已知质量的培养皿中,105 ℃干燥4 h,微胶囊不同温度水浴溶解度按公式(5)计算:
溶解度![]()
(5)
式中:m0为原始粉末质量,g;m1为培养皿中粉末质量,g。
1.3.3.5 分散性测定
参考CHEN等[14]的方法并适当修改,称取0.1 g微胶囊样品,室温下分散在100 mL去离子水表面,记录所有微胶囊粉末在去离子水表面完全自然浸没所需时间。
1.3.4 藻油乳液和微胶囊粒径测定
分别将1 mL新制乳液、解冻乳液和微胶囊复水乳液用去离子水稀释100倍,取2 mL稀释液置于马尔文比色皿中测定粒径,平衡时间90 s,每次测量连续12次连续读数。
1.3.5 藻油乳液和微胶囊微观结构观察
1.3.5.1 光学显微观察
吸取100 μL乳液置于载玻片上用盖玻片覆盖,观察时,先用低倍物镜找到物象再转高倍物镜,所有测量均在25 ℃下进行。
1.3.5.2 CLSM观察
将质量分数1.0%的尼罗红溶液加入25倍体积的藻油乳液中,取100 μL染色乳液于载玻片上并用盖玻片覆盖。观察时选择尼罗红(488 nm)的选择性激发,找到清晰物象后拍照,所有测量均在25 ℃下进行。
1.3.5.3 藻油微胶囊SEM观察
将藻油微胶囊粉末用导电双面胶固定在样品台,吹去固定未牢固粉末,喷金处理进行SEM观察,调节加速电压20 kV,放大倍数2 000×。
1.3.6 藻油乳液冻融稳定性和复水性测定
量取藻油乳液20 mL于旋盖玻璃瓶中,-40 ℃冰箱冷冻24 h,取出后45 ℃水浴2 h,测定冻融后的粒径并用光学显微观察。
称取一定量藻油微胶囊,溶于45 ℃去离子水中,用相同温度去离子水定容至新制乳液浓度,得藻油微胶囊复水乳液,测定复水乳液粒径,用光学显微和CLSM观察。
1.3.7 藻油微胶囊加速贮藏实验
将藻油及其微胶囊置于烘箱中,60 ℃贮存21 d,每3 d取样,测定样品的POV和DHA保留率,对藻油及其微胶囊的POV随贮藏时间的变化用零级反应方程式和一级反应方程式进行线性回归分析。过氧化值测定参照GB 5009.227—2023《食品安全国家标准 食品中过氧化值的测定》,藻油DHA含量测定参考GB/T 38095—2019《DHA、EPA含量测定 气相色谱法》,DHA保留率即为贮藏一定时间的藻油DHA含量占原始藻油DHA含量的比值。
1.4 数据处理
用SPSS 25.0和Microsoft Excel 2019软件进行数据分析,所有实验平行3次,数据以“平均值±标准偏”差表示,结果用Origin 9.5软件作图表示。
2 结果与分析
2.1 藻油微胶囊基本理化性质
2.1.1 藻油微胶囊包埋率分析
由表1可知,4种藻油微胶囊的包埋率分别为:MOG微胶囊93.45%、MG微胶囊91.15%、OG微胶囊89.75%、GE微胶囊85.14%。GE微胶囊的包埋率不高可能是GE的藻油乳液稳定性差。MOG微胶囊的包埋率高于MG和OG微胶囊,说明复配2种糖基化壁材对微胶囊包埋率可能有积极影响。
表1 藻油微胶囊的包埋率
Table 1 The embedding rate of algae oil microcapsules

藻油微胶囊包埋率/%MG91.15±1.93abMOG93.45±2.01aOG89.75±1.73bGE85.14±1.09c
注:同列中不同字母表示具备显著性差异(P<0.05)(下同)。
2.1.2 藻油微胶囊水分活度和水分含量分析
由表2可知,4种微胶囊的水分含量均低于4%,OG微胶囊水分含量和水分活度最高,可能因为低聚甘露糖具有较强的吸湿性,不利于微胶囊在自然贮藏过程中保持氧化稳定性。GE和MG微胶囊的水分含量比MOG微胶囊稍低,三者无显著性差异。MG和MOG微胶囊的水分含量和水分活度显著低于OG微胶囊。微胶囊属于干粉产品,水分含量一般须低于4%[10],因此MG微胶囊和MOG微胶囊效果更佳。
表2 藻油微胶囊的水分含量和水分活度
Table 2 Water content and water activity of algal oil microcapsules

壁材类型水分含量/%水分活度GE2.15±0.10b0.221±0.008bcMG2.10±0.07b0.211±0.004cOG3.09±0.08a0.288±0.010aMOG2.28±0.14b0.235±0.011b
2.1.3 藻油微胶囊的溶解性和分散性分析
良好的溶解性有利于提升微胶囊的生物利用度,扩大应用范围。由表3可知,室温下,GE微胶囊溶解性最差,其溶解性显著低于3种以糖基化明胶为壁材的微胶囊。糖基化改性可提高蛋白质的溶解性,可能与其所导致的明胶三螺旋结构破坏,亲水基团更易与水结合有关[15]。GHAEDI等[16]的研究表明,糖基化改性降低了蛋白质分子间聚集,保留出更多亲水基团。OG微胶囊具有最好的溶解性,可能由于其与水结合的能力较强。
表3 藻油微胶囊的溶解度和分散时间
Table 3 Solubility and dispersion time of algal oil microcapsules

壁材类型溶解度/%分散时间/sGE73.45±1.51c52.00±4.58aMG84.97±0.84b47.00±7.55aOG89.08±0.81a21.00±4.04bMOG86.59±1.90ab42.00±8.32a
分散性可以反映出微胶囊同水分子相互作用的能力,主要受到微胶囊中的乳液粒径和壁材的影响,与微胶囊的复水性相关[17-18]。由表3可知,4种微胶囊的分散时间为21~52 s,湿润时间都在60 s以内,可能与明胶本身较多的亲水基团有关。4种微胶囊中,GE微胶囊的分散时间最长,OG微胶囊的分散时间最短。
2.2 藻油乳液和微胶囊粒径分析
多数天然蛋白质稳定的乳液在冷冻贮存时,可发生冷冻浓缩、水相结冰等不良变化,乳液性能在解冻后会变差,甚至乳液完全分离为油相和水相[19]。4种壁材稳定的新制乳液、解冻乳液和微胶囊复水乳液的粒径分布如图1所示,4种壁材稳定的乳液的平均粒径大小为:微胶囊复水乳液>解冻乳液>新制乳液。不同壁材体系稳定的乳液中,GE新制乳液的平均粒径最大,OG新制乳液的平均粒径最小,且OG解冻乳液和微胶囊复水乳液的平均粒径较新制乳液的平均粒径变化最小,乳液粒径分布更为均一,说明OG微胶囊乳液体系的冻融稳定性和复水性最佳。糖基化改性可提升蛋白在油水界面的稳定能力,WANG等[20]的研究发现,利用辐照制备的麦芽糖-大豆分离蛋白糖基化产物稳定的乳液比单独使用大豆分离蛋白稳定的乳液具有更强的冻融稳定性。MOG新制乳液与MG新制乳液的平均粒径差异不大,相比于MG解冻乳液和微胶囊复水乳液,MOG解冻乳液和微胶囊复水乳液平均粒径更小,因此MOG乳液微胶囊体系的冻融稳定性和复水性比MG乳液微胶囊体系好。
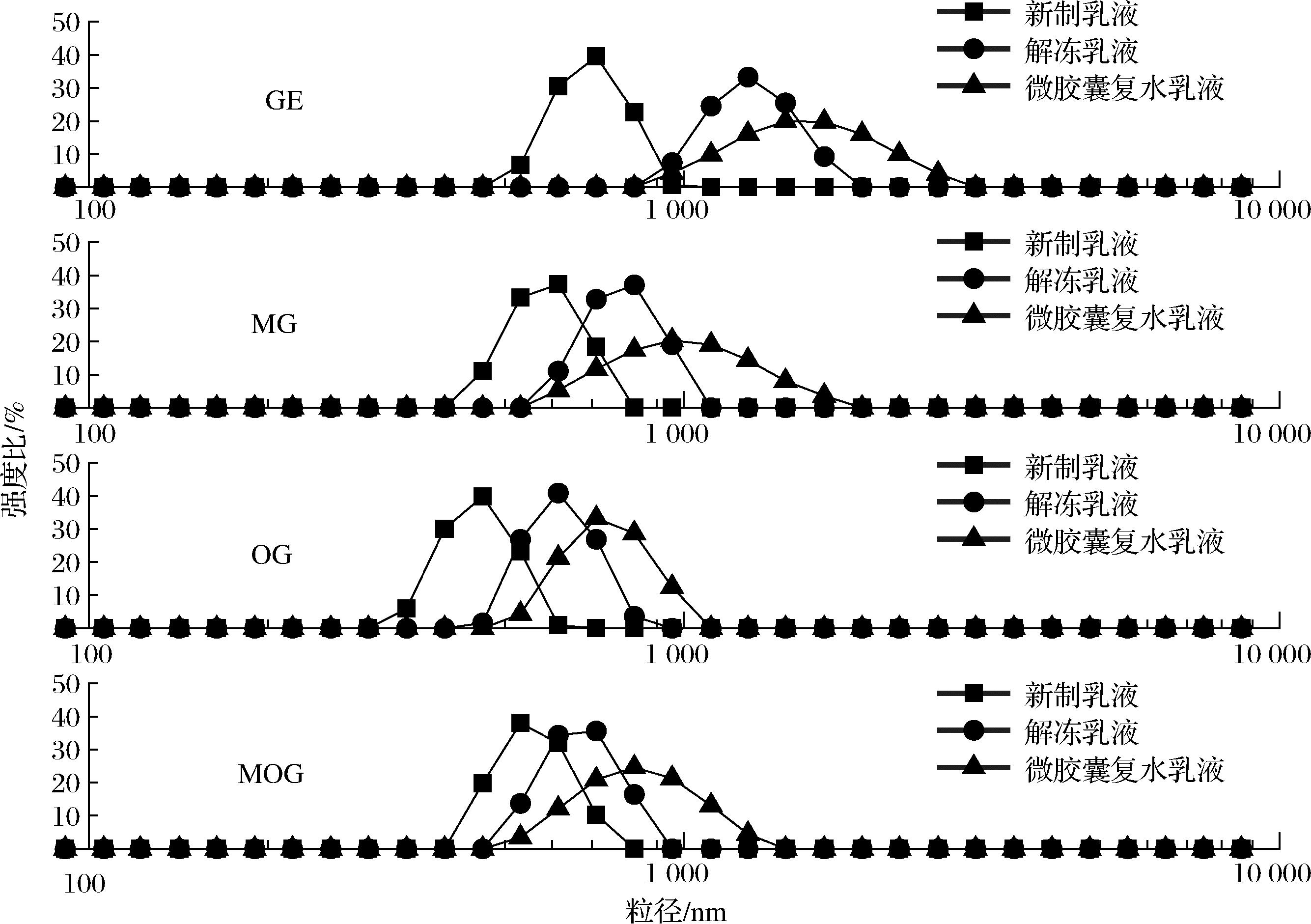
图1 藻油乳液、冻融乳液和微胶囊复水乳液的粒径分布图
Fig.1 Particle size distribution of algal oil emulsion, freeze-thaw emulsion, and microcapsule rehydration emulsion
2.3 藻油乳液和微胶囊微观结构分析
2.3.1 光学显微观察分析
糖可以降低水的冻结温度,增加乳液液滴的界面强度,在液滴之间形成空间位阻,阻止液滴聚集[21],由图2可知,3种糖基化明胶稳定的新制乳液和解冻乳液形态差别不大,GE解冻乳液比其新制乳液液滴聚集增多,液滴粒径明显增大。MG乳液液滴大小冻融前后变化不大,MAO等[22]的研究发现,麦芽糊精可减少冻融后乳液液滴聚集。OG乳液液滴冻融前后差异较小可能与乳液黏度较高有关,黏度较高的乳液在解冻时会减缓聚沉和絮凝等过程,一般具有更好的冻融稳定性。如图2所示,GE微胶囊复水乳液液滴聚集和粒径增大现象较其冻融乳液更严重,MG、OG和MOG微胶囊复水乳液与其新制乳液形态差异不大,说明3种以糖基化明胶为壁材的微胶囊具有优良的复水性。微胶囊复水后保持良好的乳液性能有利于芯材在人体消化过程中保持生理活性[23]。

a、b、c-GE乳液、解冻乳液和微胶囊复水乳液;d、e、f-MG乳液、解冻乳液和微胶囊复水乳液; g、h、i-OG乳液、解冻乳液和微胶囊复水乳液;j、k、l-MOG乳液、解冻乳液和微胶囊复水乳液
图2 藻油乳液、冻融乳液和微胶囊复水乳液的光学显微观察
Fig.2 Light microscope images of algal oil emulsion, freeze-thaw emulsion, and microcapsule rehydration emulsion
2.3.2 CLSM分析
乳液液滴的大小直观反映乳液稳定性,液滴更小的乳液稳定的时间更长,不同壁材体系稳定的藻油乳液及微胶囊复水乳液的CLSM观察如图3所示,藻油被尼罗红染料染成红色,4种新制乳液液滴都呈现出较为规整的圆形且液滴分布较为分散。相比于GE新制乳液,GE微胶囊复水乳液的液滴聚集现象明显,小液滴聚集形成大液滴,乳液液滴整体大于GE新制乳液液滴。MG微胶囊复水乳液有轻微液滴聚集现象,大液滴形成不多。OG微胶囊乳液复水前后差别不大,说明其复水性好。MOG微胶囊液滴聚集现象较少,部分液滴大小不均一。OG微胶囊的复水性最佳,4种微胶囊CLSM观察结果与光学显微镜观察结果相差不大。以糖基化明胶为壁材的藻油微胶囊相比于GE微胶囊复水性能的提升,可能是因为糖基化改性为明胶分子中引入疏水性基团,改善了明胶稳定油水界面的能力,提升了稳定乳液的能力[24]。

a、b-GE乳液和微胶囊复水乳液;c、d-MG乳液和微胶囊复水乳液;e、f-OG乳液和微胶囊复水乳液; g、h-MOG乳液和微胶囊复水乳液
图3 藻油乳液和微胶囊复水乳液的激光共聚焦显微观察
Fig.3 CLSM images of algal oil emulsion and microcapsule rehydration emulsion
2.3.3 SEM观察
4种藻油微胶囊SEM显微如图4所示,4种微胶囊均呈片状多孔结构,符合冷冻干燥法制备微胶囊的结构特征,多孔结构中的部分孔洞为乳液液滴在冷冻干燥后形成,冰晶的升华可能导致微胶囊孔洞直径稍大于其乳液液滴粒径[2]。GE微胶囊相比于3种糖基化明胶微胶囊的孔洞较为聚集,可能由于冷冻和升华过程中乳液液滴聚集。MG、OG和MOG微胶囊的乳液体系稳定性较好且壁材体系中引入了糖类作为冷冻保护剂,冷冻干燥过程中乳液液滴更能保持结构的稳定性,孔洞分布较分散,聚集现象较少。3种以糖基化明胶为壁材的微胶囊孔洞的结构差别不明显,OG微胶囊的孔径较另2种糖基化微胶囊稍小,可能也与OG乳液性能比另外2种糖基化壁材微胶囊更强有关。

a-GE微胶囊;b-MG微胶囊;c-OG微胶囊;d-MOG微胶囊
图4 藻油微胶囊扫描电镜观察
Fig.4 SEM images of algae oil microcapsules
2.4 微胶囊的贮藏稳定性
2.4.1 藻油微胶囊过氧化值随贮藏时间的变化
POV是判断油脂微胶囊氧化程度的常用指标,直观反映脂质初级氧化产物的生成情况,POV越低,油脂氧化程度越低。如图5所示,藻油初始POV为0.77 mmol/kg,4种微胶囊中藻油的初始POV为1.18~1.85 mmol/kg,由于藻油微胶囊在制备过程中受光照、加热、加压和机械剪切等因素影响,导致藻油发生了轻微氧化,POV轻微上升。
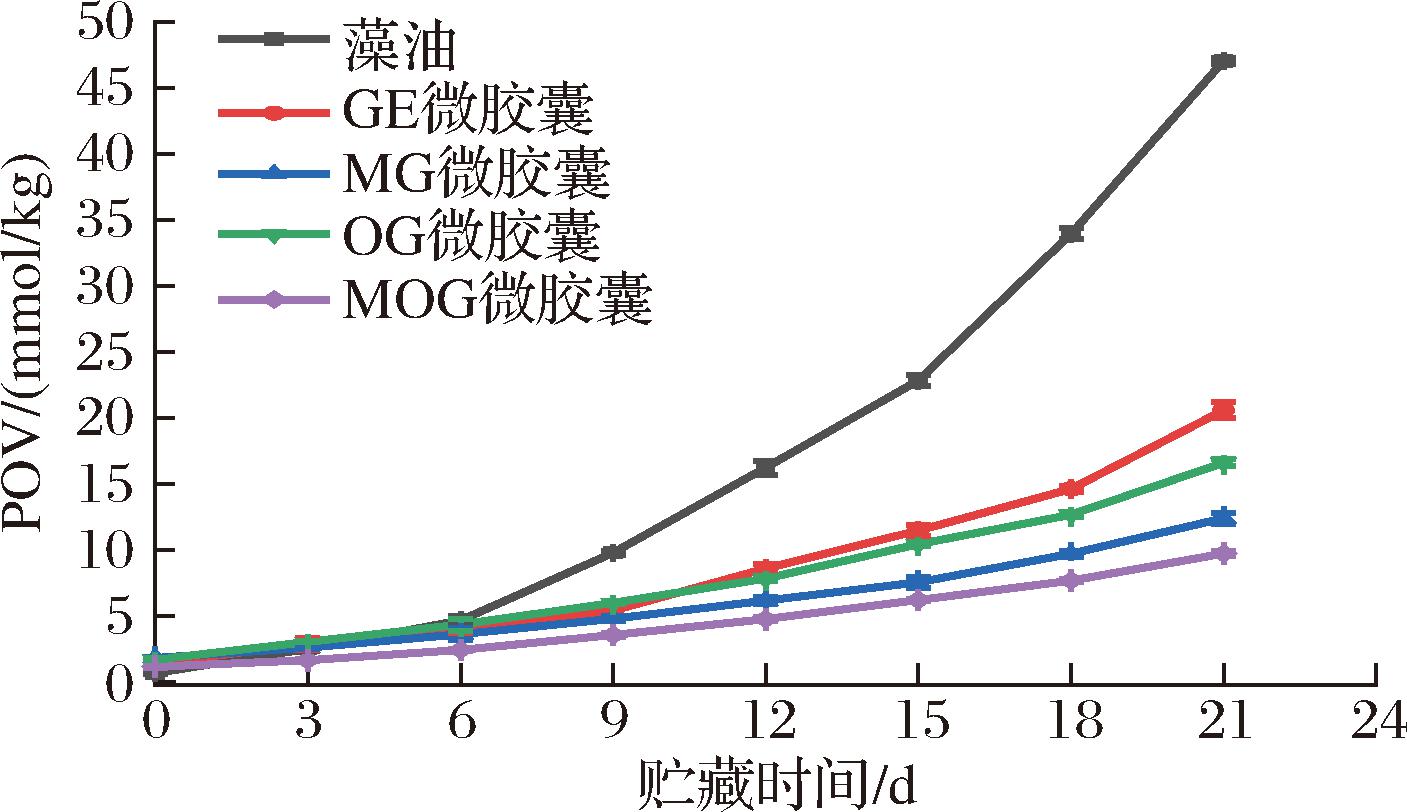
图5 藻油及其微胶囊的POV随贮藏时间的变化
Fig.5 POV variation of algal oil and its microcapsules with storage time
在贮藏时间0~6 d内,藻油及其微胶囊的POV变化相差不大。贮藏时间超过6 d后,藻油中初级氧化产物逐渐累积,藻油的POV升高速度加快,4种微胶囊的POV上升速度明显弱于藻油。微胶囊的包埋可减少藻油同光和氧气接触,随着贮藏时间延长,明显减缓藻油氧化,没有被微胶囊包埋的藻油的氧化速度则变快。GE微胶囊的氧化速度快于另外3种微胶囊,说明糖基化明胶比原始明胶更适合作微胶囊壁材,能为藻油提供良好保护,延缓藻油氧化,可能与糖基化明胶本身具有一定抗氧化性且将其作为微胶囊壁材稳定性更强有关。相比于其他GE、MG和OG微胶囊,MOG微胶囊在加热贮藏过程中始终保持最低的POV,氧化稳定性最佳。
2.4.2 藻油及其微胶囊POV氧化动力学分析和货架期预测
使用零级方程C=C0-kt和一级反应方程lnC0=lnC-kt对藻油及其微胶囊的POV变化进行线性回归分析,结果如图6、图7和表4所示。表4显示藻油及其4种微胶囊的零级反应方程系数均小于其一级反应方程系数,说明一级反应氧化动力学更适合表示藻油及其微胶囊的氧化动力学。
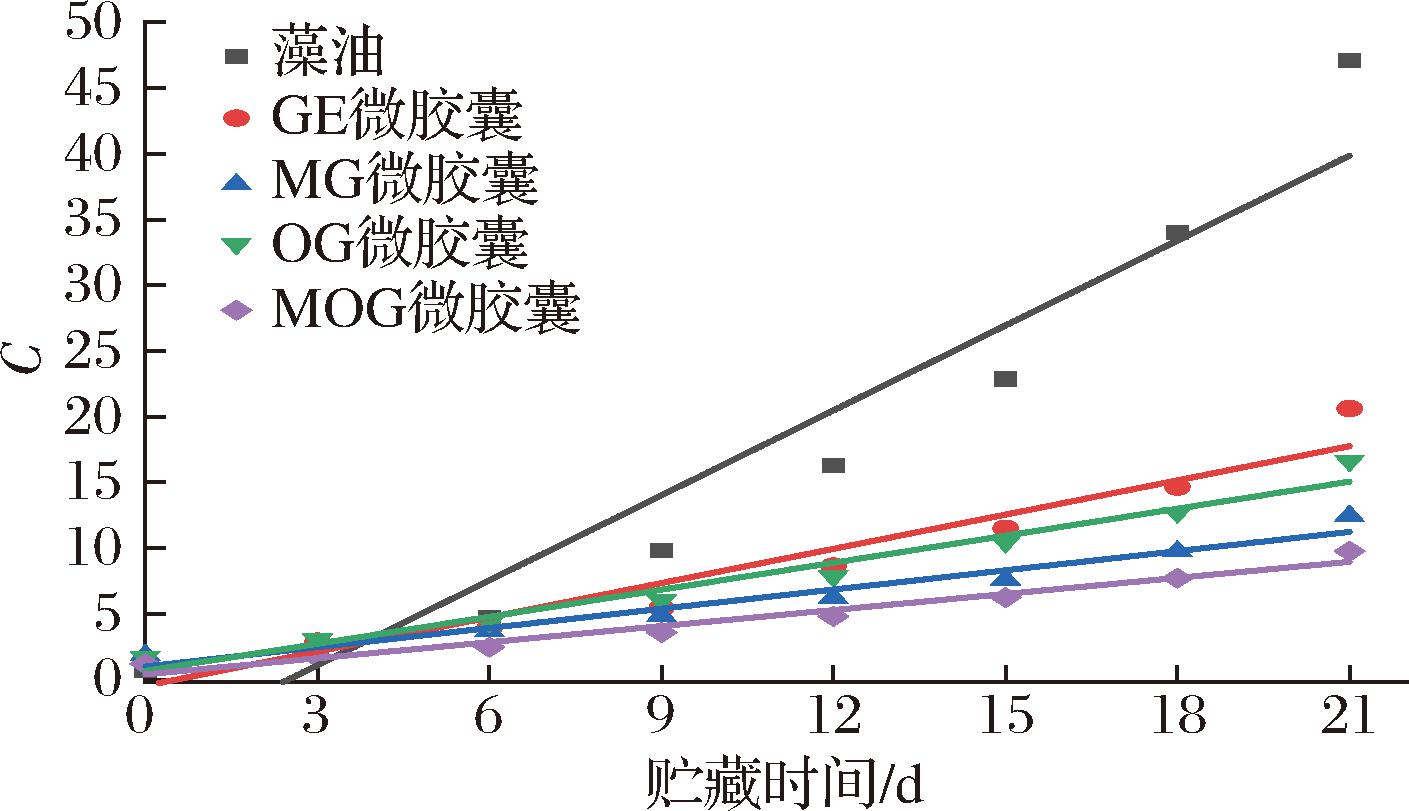
图6 POV随贮藏时间变化的零级回归分析
Fig.6 Zero order regression analysis of POV variation with storage time
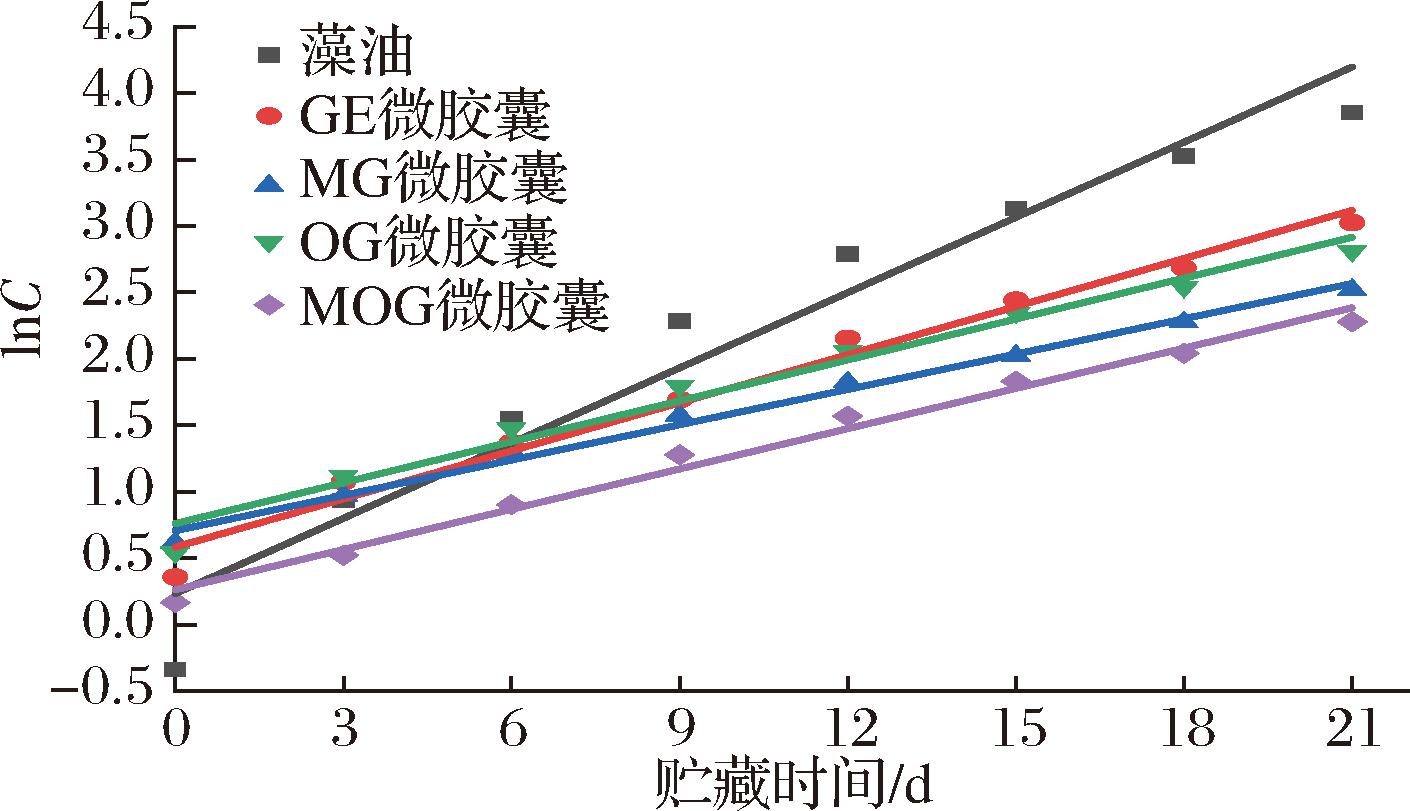
图7 POV随贮藏时间变化的一级回归
Fig.7 First order regression analysis of POV variation with storage time
表4 POV线性回归分析
Table 4 Linear regression analysis of POV variation with storage time
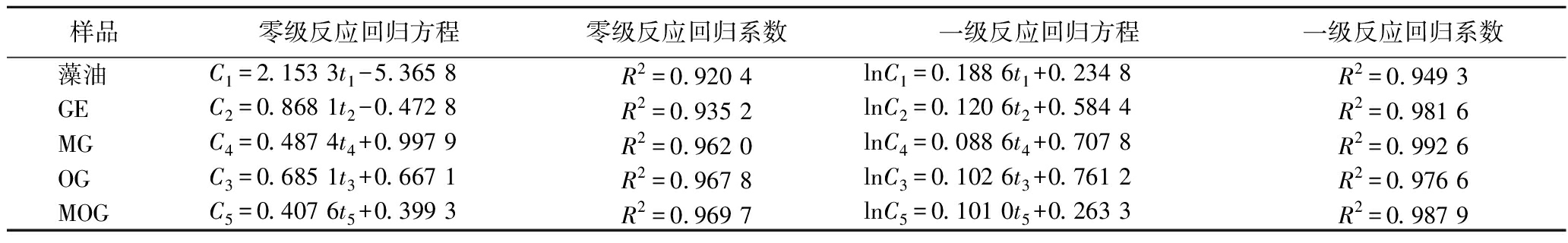
样品零级反应回归方程零级反应回归系数一级反应回归方程一级反应回归系数藻油C1=2.153 3t1-5.365 8R2=0.920 4lnC1=0.188 6t1+0.234 8R2=0.949 3GEC2=0.868 1t2-0.472 8R2=0.935 2lnC2=0.120 6t2+0.584 4R2=0.981 6MGC4=0.487 4t4+0.997 9R2=0.962 0lnC4=0.088 6t4+0.707 8R2=0.992 6OGC3=0.685 1t3+0.667 1R2=0.967 8lnC3=0.102 6t3+0.761 2R2=0.976 6MOGC5=0.407 6t5+0.399 3R2=0.969 7lnC5=0.101 0t5+0.263 3R2=0.987 9
根据国际食品法典委员会对食用植物油的过氧化值限定规定(POV≤10 mmol/kg),将10 mmol/kg代入表4中藻油及其微胶囊的一级反应动力学方程,可预测藻油及其微胶囊的货架期。60 ℃下,藻油、GE微胶囊、MG微胶囊、OG微胶囊及MOG微胶囊的贮存时间分别为11、14、18、15、20 d。根据Vant’Hoff经验公式[25],反应温度每升高10 ℃,产品贮存时间缩短1/2,因此样品在60 ℃下贮存1 d相当于在20 ℃下贮存16 d。藻油、GE微胶囊、MG微胶囊、OG微胶囊及MOG微胶囊在20 ℃下的货架期预测为175、228、287、240、323 d。因此理论上使用MOG微胶囊包埋藻油能将货架期延长近一倍。
2.4.3 藻油微胶囊DHA保留率随储存时间的变化
图8为藻油及其微胶囊的DHA保留率随贮藏时间的变化趋势,原始藻油的DHA保留率为100%,GE微胶囊、MG微胶囊、OG微胶囊和MOG微胶囊的DHA保留率分别为93.36%、95.35%、95.23%和96.44%,乳液制备过程及冻干过程导致DHA发生轻微氧化。藻油及其微胶囊的DHA保留率都随贮藏时间延长而下降,经过21 d加速贮藏,原始藻油、GE微胶囊、MG微胶囊、OG微胶囊和MOG微胶囊的DHA保留率分别为22.34%、41.83%、55.21%、50.98%和57.79%。4种微胶囊中,GE微胶囊包埋率最低,微胶囊结构中更多藻油DHA暴露在外导致GE微胶囊中藻油DHA较易氧化。MG、OG和MOG微胶囊的DHA保留率在贮藏过程中始终高于GE微胶囊和原始藻油,表明3种以糖基化明胶为壁材的微胶囊对DHA保护性优于GE微胶囊和原始藻油,3种以糖基化明胶为壁材的微胶囊中,MOG微胶囊DHA保护性最好,整个贮藏过程中DHA保留率始终最高。
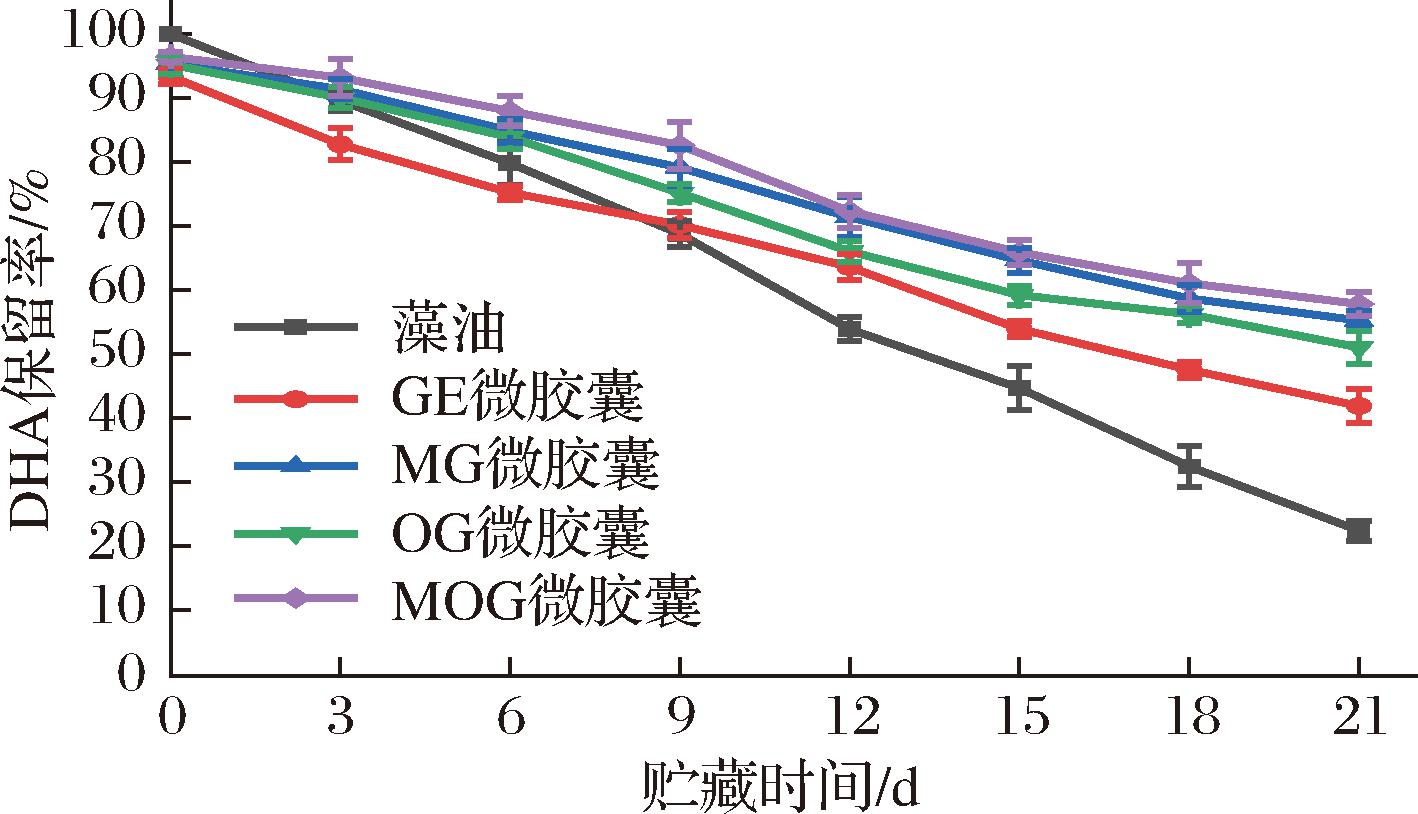
图8 藻油及其微胶囊DHA保留率随贮藏时间的变化
Fig.8 Variation of DHA retention rate of algae oil and its microcapsules with storage time
3 结论与讨论
本研究发现以糖基化明胶作壁材的微胶囊较对照组而言,其乳液体系冻融稳定性和复水性明显改善。其中MOG微胶囊对藻油的包埋率最高,复水性、乳液冻融稳定性、溶解性和分散性稍弱于最优的OG微胶囊,水分含量和水分活度显著低于OG微胶囊,POV和DHA保留率随贮藏时间变化最小,预测货架期最长。氧化动力学符合一级氧化动力学方程,芯材释放过程较为复杂,属于非恒速、非稳态过程。综上,MOG微胶囊-混合2种糖基化明胶对藻油有很好的保护作用,有潜能进一步应用到藻油微胶囊壁材中。
[1] ANWAR S H, KUNZ B.The influence of drying methods on the stabilization of fish oil microcapsules:Comparison of spray granulation, spray drying, and freeze drying[J].Journal of Food Engineering, 2011, 105(2):367-378.
[2] AKSOYLU ÖZBEK Z, GÜNÇ ERGÖNÜL P.Optimisation of wall material composition of freeze-dried pumpkin seed oil microcapsules:Interaction effects of whey protein, maltodextrin, and gum Arabic by D-optimal mixture design approach[J].Food Hydrocolloids, 2020, 107:105909.
[3] 刘杰, 邓利玲, 曾云军, 等.糖基化改性对明胶乳化性和抗氧化活性的影响[J].食品与发酵工业, 2023, 49(19):175-182.LIU J,DENG L L, ZENG Y J, et al.Effects of glycosylation modification on emulsifying property and antioxidant activity of gelatin[J].Food and Fermentation Industries, 2023, 49(19):175-182.
[4] ZHANG B, ZHANG X L, SHEN C L, et al.Understanding the influence of carrageenan oligosaccharides and xylooligosaccharides on ice-crystal growth in peeled shrimp (Litopenaeus vannamei) during frozen storage[J].Food &Function, 2018, 9(8):4394-4403.
[5] DI GIORGIO L, SALGADO P R, MAURI A N.Encapsulation of fish oil in soybean protein particles by emulsification and spray drying[J].Food Hydrocolloids, 2019, 87:891-901.
[6] ENCINA C, VERGARA C, GIMÉNEZ B, et al.Conventional spray-drying and future trends for the microencapsulation of fish oil[J].Trends in Food Science &Technology, 2016, 56:46-60.
[7] ![]() N,
N, ![]() A, ARTICHOWICZ W, et al.Microencapsulation of fish oil-determination of optimal wall material and encapsulation methodology[J].Journal of Food Engineering, 2020, 268:109730.
A, ARTICHOWICZ W, et al.Microencapsulation of fish oil-determination of optimal wall material and encapsulation methodology[J].Journal of Food Engineering, 2020, 268:109730.
[8] 牛付欢, 梁俊梅, 张余权, 等.油脂OSI加速氧化条件下氧化机制初探[J].中国粮油学报, 2014, 29(10):67-71.NIU F H, LIANG J M, ZHANG Y Q, et al.Preliminary study on the oxidation mechanism of lipid under the accelerated conditions of the OSI method[J].Journal of the Chinese Cereals and Oils Association, 2014, 29(10):67-71.
[9] IFEDUBA E A, AKOH C C.Microencapsulation of stearidonic acid soybean oil in Maillard reaction-modified complex coacervates[J].Food Chemistry, 2016, 199:524-532.
[10] SONG F, LI Y N, WANG B, et al.Effect of drying method and wall material composition on the characteristics of camellia seed oil microcapsule powder[J].Journal of the American Oil Chemists, Society, 2022, 99(4):353-364.
[11] 李成忠, 孙燕, 周霞, 等.响应面法优化牡丹籽油微胶囊的制备工艺[J].中国粮油学报, 2017, 32(12):81-86.LI C Z, SUN Y, ZHOU X, et al.The preparation optimization of peony seed oil microcapsule using response surface methodology[J].Journal of the Chinese Cereals and Oils Association, 2017, 32(12):81-86.
[12] MEHYAR G F, AL-ISMAIL K M, AL-GHIZZAWI H M, et al.Stability of cardamom (Elettaria cardamomum) essential oil in microcapsules made of whey protein isolate, guar gum, and carrageenan[J].Journal of Food Science, 2014, 79(10):C1939-C1949.
[13] CANO-CHAUCA M, STRINGHETA P C, RAMOS A M, et al.Effect of the carriers on the microstructure of mango powder obtained by spray drying and its functional characterization[J].Innovative Food Science &Emerging Technologies, 2005, 6(4):420-428.
[14] CHEN Q, ZHONG F, WEN J Y, et al.Properties and stability of spray-dried and freeze-dried microcapsules co-encapsulated with fish oil, phytosterol esters, and limonene[J].Drying Technology, 2013, 31(6):707-716.
[15] ZHANG T, DING M Z, ZHANG H, et al.Fish oil-loaded emulsions stabilized by synergetic or competitive adsorption of gelatin and surfactants on oil/water interfaces[J].Food Chemistry, 2020, 308:125597.
[16] GHAEDI N, HOSSEINI E.Physical and oxidative stability of emulsions treated with bitter almond gum-soy protein isolate Maillard conjugates[J].LWT, 2021, 152:112352.
[17] DIMA C, P TRA
TRA CU L, CANTARAGIU A, et al.The kinetics of the swelling process and the release mechanisms of Coriandrum sativum L.essential oil from chitosan/alginate/inulin microcapsules[J].Food Chemistry, 2016, 195:39-48.
CU L, CANTARAGIU A, et al.The kinetics of the swelling process and the release mechanisms of Coriandrum sativum L.essential oil from chitosan/alginate/inulin microcapsules[J].Food Chemistry, 2016, 195:39-48.
[18] CHANG C, VARANKOVICH N, NICKERSON M T.Microencapsulation of canola oil by lentil protein isolate-based wall materials[J].Food Chemistry, 2016, 212:264-273.
[19] ZHANG Z Y, WANG X B, YU J, et al.Freeze-thaw stability of oil-in-water emulsions stabilized by soy protein isolate-dextran conjugates[J].LWT, 2017, 78:241-249.
[20] WANG Y Y, ZHANG A Q, WANG X B, et al.The radiation assisted-Maillard reaction comprehensively improves the freeze-thaw stability of soy protein-stabilized oil-in-water emulsions[J].Food Hydrocolloids, 2020, 103:105684.
[21] GU Y S, DECKER E A, JULIAN MCCLEMENTS D.Application of multi-component biopolymer layers to improve the freeze-thaw stability of oil-in-water emulsions:β-Lactoglobulin-ι-carrageenan-gelatin[J].Journal of Food Engineering, 2007, 80(4):1246-1254.
[22] MAO L K, ROOS Y H, MIAO S.Effect of maltodextrins on the stability and release of volatile compounds of oil-in-water emulsions subjected to freeze-thaw treatment[J].Food Hydrocolloids, 2015, 50:219-227.
[23] CHEN W J, WANG W J, GUO M M, et al.Whey protein isolate-gum Acacia Maillard conjugates as emulsifiers for nutraceutical emulsions:Impact of glycation methods on physicochemical stability and in vitro bioaccessibility of β-carotene emulsions[J].Food Chemistry, 2022, 375:131706.
[24] ZHANG Y Y, XU J M, ZHANG T, et al.Effect of carbon numbers and structures of monosaccharides on the glycosylation and emulsion stabilization ability of gelatin[J].Food Chemistry, 2022, 389:133128.
[25] 刘成祥. 牡丹籽油微胶囊的制备及其性质研究[D].无锡:江南大学, 2016.LIU C X.Study on preparation of peony seed oil microcapsule and its properties[D].Wuxi:Jiangnan University, 2016.