多糖是由单糖聚合形成的一类天然大分子化合物,广泛分布于动物、植物以及微生物中。植物多糖类化合物因毒副作用小、安全性高、疗效好等优点,在食品和保健行业广泛应用[1]。现代研究表明,多糖具有降血糖、抗肿瘤、抗艾滋、抗衰老、降血脂、抗病毒、保肝、调节肠道菌群等功能[2-3]。多糖的结构修饰是通过化学或生物学的方法,对多糖的结构(取代基种类、取代基位置等)进行修饰改造,以获得更加丰富的多糖衍生物,便于生物学活性和结构的相关性研究,但多糖结构修饰不如小分子结构修饰灵活多样,目前主要有羧甲基化、乙酰化、硫酸化和磷酸化修饰等[4]。多糖的羧甲基化改性可以显著增强多糖的结构特征,提高多糖的生物活性,甚至使多糖赋予新的生物活性。陈栅等[5]研究发现酸枣多糖经羧甲基修饰后,黏度降低、水溶性增高,对羟自由基清除能力提高至95.8%,并且对嗜酸乳杆菌和鼠李糖乳杆菌有更好的促生长效果。黄馨阅等[6]研究发现红须腹菌羧甲基修饰多糖对环磷酰胺造成的小鼠脏器中血清细胞因子含量减小,造血功能及巨噬细胞吞噬能力减弱,并且对脾脏和胸腺的组织损伤有显著缓解作用,经羧甲基化修饰的红须腹菌多糖与未修饰前多糖相比免疫调节活性更为优异。HORI等[7]研究发现,茯苓多糖经羧甲基化修饰后对葡聚糖硫酸钠盐(dextran sulfate sodium salt,DSS)诱导的小鼠结肠炎修复作用更加显著,经羧甲基化修饰后的茯苓多糖减轻了DSS诱导的小鼠体重下降、结肠缩短和结肠组织中的炎症因子侵袭。
桦树茸[Inonotuso bliquus(Fr.)Pilat]又称桦褐孔菌、白桦茸,是一种寄生于白桦树树皮下的褐色多孔药食两用型真菌,主要分布于俄罗斯、日本北海道、朝鲜、我国东北等寒冷地区[8]。桦树茸具有“免疫之王”之称,常被认为是“万能药”,《金匮要略》记载桦树茸具有调节血糖、维持肠道菌群平衡、抗癌等功效,市场上以桦树茸为主原料的桦褐孔菌精菌粉在临床上对平衡血糖,防治糖尿病并发症发挥显著效果,对Ⅱ型糖尿病的治愈率已高达93%[9]。现有的报道主要集中在桦树茸品质鉴定、风味饮品加工、多糖提取及抗氧化、降糖等功能活性研究[10-11],针对桦树茸多糖修饰研究中,仅有少量文章报道桦褐孔菌多糖磷酸化、乙酰化修饰的工艺研究[12-13],但均未对其修饰前后的理化性质、降糖活性展开研究。因此,有必要在保证低成本、保结构、保活性的前提下,开发新的方法以促进桦树茸多糖的进一步开发利用,提高经济效益。
本研究采用经分离纯化制备含量高的均一桦树茸多糖,通过羧甲基化方法修饰纯化多糖,在这一基础上优化修饰工艺,并研究其理化特征,包括黏度、溶解度、单糖组成、形貌特征、热稳定性等;通过抑制α-葡萄糖甘酶、α-淀粉酶能力测定其体外降糖活性。本研究可为丰富桦树茸多糖基础研究提供实验数据支持,也为筛选高功能成分的桦树茸多糖改性修饰提供科学依据。
1 材料与方法
1.1 材料与试剂
桦树茸,采自新疆维吾尔自治区新源县那拉提镇,鉴定人:伊犁师范大学生物质资源清洁转化与高值化利用重点实验室主任钱大益教授。α-葡萄糖甘酶、α-淀粉酶、阿卡波糖,上海阿拉丁生化科技股份有限公司;透析袋,美国BioSharp公司;三氟乙酸、石油醚、无水乙醇、氢氧化钠、氯化钠、溴化钾等均为国产分析纯。
1.2 仪器与设备
PRI24ZH/E电子天平,常州奥豪斯仪器有限公司;UV-2550紫外可见分光光度计,日本Shimadzu有限公司;7500F扫描电子显微镜,日本Jeol有限公司;LGJ-10C冷冻干燥机,北京福瑞科仪科技有限公司;HH-S6数显恒温水浴锅,江苏金怡仪器科技有限公司;I-300旋转蒸发仪,瑞士BUCHI有限公司;5430R高速台式离心机,德国Eppendof公司;Cary 630傅里叶变换红外光谱仪、6300A气相色谱仪,Agilent科技(中国)有限公司;Spectra Max M5酶标仪,美国Thermo科技有限公司;HS-TGA-102热重分析仪,上海和晟仪器有限公司。
1.3 实验方法
1.3.1 桦树茸多糖的制备
自然风干至恒重的桦树茸,粉碎后过20目筛。分别用石油醚、无水乙醇于索氏提取器脱脂、脱色素24 h后,过滤,将滤渣阴干后得脱脂、脱色素的桦树茸。称取100 g前处理样品粉末,在功率400 W、液料比1∶30(mL∶g)、提取温度70 ℃下超声提取150 min,将提取液离心(4 000 r/min)8 min、浓缩至四分之一体积后,采用三氯乙酸法除蛋白,重复多次,直至280 nm处无明显吸收峰。3倍体积无水乙醇醇沉24 h,透析72 h,冷冻干燥得桦树茸粗多糖。
1.3.2 桦树茸多糖分离纯化
以水为溶剂配制4 g/mL桦树茸多糖溶液,过滤,上样至DEAE-Cellulose 100纤维素柱(37 cm×260 mm),以1 mL/min的流速分别用3倍柱体积的超纯水、0.2、0.4、0.6 mol/L的氯化钠洗脱,自动收集器收集洗脱液,每管20 mL,采用苯酚-硫酸比色法进行鉴定,并根据洗脱曲线合并同一洗脱液的多糖溶液,透析48 h后,浓缩、冷冻干燥。其中0.2 mol/L盐洗组分得率最高。将0.2 mol/L盐洗组分通过Sephadex G-100凝胶柱(16 mm×800 mm)进一步纯化,以超纯水为洗脱剂,0.4 mL/min流速洗脱3倍柱体积,自动收集器收集洗脱液,每管10 mL,用苯酚-硫酸比色法进行检测,收集并合并同一多糖组分,冷冻干燥后得到纯化后的桦树茸多糖(Inonotuso bliquus polysaccharides,IBP),用于后续羧甲基化实验。
1.3.3 羧甲基化修饰桦树茸多糖工艺研究
1.3.3.1 羧甲基化桦树茸多糖的制备
参照陈栅等[5]的方法稍作修改。称取250 mg IBP多糖,加入25 mL 15%(质量分数)NaOH溶液,在一定碱化温度下搅拌60 min,加入一定质量分数的氯乙酸,在80 ℃下反应一定时间后,冷却至室温,冰乙酸调节pH值至7.0,透析72 h后,冷冻干燥即得羧甲基化桦树茸多糖(carboxymethylation Inonotuso bliquus polysaccharides,CM-IBP)。
1.3.3.2 单因素试验
以IBP羧甲基化的取代度为指标,分别考查碱化温度(40、50、60、70、80 ℃)、氯乙酸添加质量分数(1%、2%、3%、4%、5%)、反应时间(3.0、3.5、4.0、4.5、5 h)对IBP羧甲基化多糖取代度的影响。
1.3.3.3 响应面试验
在1.3.3.2节试验结果基础上,通过Design Expert 13软件,设计以CM-IBP取代度为响应值的3因素3水平的Box-Benhnken试验,来确定桦树茸羧甲基化修饰的最佳工艺条件。结果如表1所示。
表1 三因素三水平的响应面分析表
Table 1 The there-factor three-level response surface analysis

水平因素A(碱化温度)/hB(氯乙酸添加质量分数)/%C(反应时间)/h-14013.50502416034.5
1.3.3.4 取代度测定
取代度测定参考文献[14]的方法稍作修改,称取10 mg CM-IBP于100 mL容量瓶中,加入10 mL浓度为0.01 mol/L NaOH溶液,搅拌至完全溶解,40 ℃水浴反应30 min,冷却至室温后,以酚酞为指示剂,用质量浓度为0.01 mol/L的HCl滴定,至红色褪去。取代度如公式(1)和公式(2)计算:
(1)
(2)
式中:DS,取代度;A,羧甲基含量,mmol/mg;V0,氢氧化钠体积,mL;C0,氢氧化钠溶液浓度,mol/L;V1,所消耗盐酸溶液体积,mL;C1,盐酸溶液浓度,mol/L;m,CM-IBP样品质量,g。
1.3.4 CM-IBP理化性质研究
1.3.4.1 黏度、溶解度、总糖含量、蛋白质含量、糖醛酸含量测定
黏度测定:取100 mg样品溶解于60 mL蒸馏水中,待黏度测定计数字稳定后记录读数,每个样品平衡3次;溶解度测定:配制10 mg/mL样品溶液,采用平衡法测定其溶解度[15];采用苯酚-硫酸法测定总糖含量;采用牛血清试剂法进行蛋白质含量测定[16];采用四硼酸钠硫酸法测定糖醛酸含量[16]。
1.3.4.2 单糖组成分析
单糖衍生物制备:向5 mg 样品中加入5 mL 2 mmol/L的三氟乙酸,混匀,115 ℃下水解6 h后,冷却至室温,加入4 mL甲醇,混匀后减压浓缩除去三氟乙酸和甲醇(重复5~6次)。加入2 mL超纯水溶解,移取100 μL依次加入100 μL的0.6 mol/L NaOH、200 μL 0.5 mol/L丙二醇甲醚丙酸酯-甲醇溶液,摇匀,在70 ℃下反应100 min。冷却至室温,加入400 μL二氯甲烷萃取5~6次,离心,取水层过滤膜(0.24 μm)备用。单糖标准品无需酸解,其余步骤同样品处理。依据各单糖标准品保留时间和峰面积对比出IBP、CM-IBP单糖组成及各单糖含量百分比。
色谱条件:色谱柱:型号为Vondacap df(30 m×0.25 mm,0.25 μm);升温程序:150 ℃保持2 min,以5 ℃/min升至250 ℃,保持5 min;载气(He)流速4 mL/min,压力8.7 kPa,进样量2 μL;分流比:40∶1。
1.3.4.3 紫外光谱分析
将IBP、CM-IBP配制成质量浓度为0.2 mg/mL水溶液,用紫外分光光度计于200~400 nm波长处扫描,得紫外光谱图。
1.3.4.4 红外光谱分析
分别称取IBP、CM-IBP样品各5 mg,分别与250 mg溴化钾在玛瑙研钵中混匀,压片后采用傅里叶红外光谱仪在400~4 000 nm波长进行光谱扫描。
1.3.4.5 刚果红实验
IBP、CM-IBP的三维螺旋构象采用刚果红实验检测[17]。分别移取1 mL 3 mg/mL的IBP、CM-IBP水溶液、依次加入1 mL 0.2 mmol/L的刚果红溶液、不同质量浓度的NaOH溶液。混匀后,在暗室反应10 min,用紫外-可见分光光度计在400~600 nm波长范围内扫描,记录最大吸收波长,同时,以刚果红为对照。氢氧化钠浓度为横坐标,吸光值为纵坐标,绘制刚果红实验结果曲线。每次实验重复3次取平均值。
1.3.4.6 X射线衍射分析(X-ray diffraction,XRD)
采用X射线衍射技术分析样品中分子结构特性。分别移取适量IBP、CM-IBP用X射线衍射仪扫描(范围:5°~100°,步长0.01°;速度:0.1秒/步)。
1.3.4.7 扫描电镜(scanning electron microscope,SEM)和能谱仪(energy dispersive X-ray spectroscopy,EDX)分析
使用导电胶带分别将少量IBP、CM-IBP样品固定在样品台后,用离子溅射仪喷金后,在加速电压为10.0 kV放大5 000倍下观察样品显微结构。同时,采用EDX模式进行IBP、CM-IBP样品元素分析。
1.3.4.8 CM-IBP的热重分析
分别取10 mg IBP、CM-IBP样品置于铂坩埚,以N2做保护气,升温速率为10 ℃/min,从35 ℃加热到550 ℃,用热重分析仪采集IBP、CM-IBP的热重分析(thermogravimetric analysis,TG)、示差热重量(differential thermogravimetric analysis,DTG)、差示扫描量热(differential scanning calorimeter,DSC)数据。
1.3.5 CM-IBP体外降糖活性研究
分别将 IBP、CM-IBP配制成质量浓度为1.0、2.0、3.0、4.0、5.0 mg/mL的样品溶液,用于后续体外降糖活性测试。
1.3.5.1 抑制α-葡萄糖苷酶活性测定
分别移取500 μL 1.3.5节的不同浓度IBP、CM-IBP溶液,加入等体积α-葡萄糖苷酶溶液,37 ℃水浴反应20 min,加入等体积的对硝基苯酚-β-D-半乳糖苷溶液并在37 ℃避光反应20 min后,加入4 mL碳酸钠溶液和1.5 mL磷酸缓冲液(pH=6.8)后,沸水浴反应5 min,冷却至室温,用酶标仪在400 nm处测定吸光值,同时以阿卡波糖为阳性对照,每次实验平行3次。按公式(3)计算IBP、CM-IBP的α-葡萄糖苷酶抑制率:
α-葡萄糖苷酶抑制率![]()
(3)
式中:A1,IBP、CM-IBP溶液+α-葡萄糖苷酶溶液的吸光值;A2,磷酸盐缓冲溶液+IBP、CM-IBP溶液的吸光值;A0,α-葡萄糖苷酶溶液+磷酸盐缓冲溶液的吸光值。
1.3.5.2 抑制α-淀粉酶活性测试
分别移取300 μL 1.3.5节的不同浓度IBP、CM-IBP溶液,与等体积的α-淀粉酶溶液混匀后,37 ℃水浴反应5 min,加入与样品等体积的质量分数1%的淀粉溶液(PBS),37 ℃水浴反应20 min,最后加入0.5 mL 质量分数为0.63%的3,5-二硝基水杨酸溶液(3,5-dinitrosalicylic acid,DNS),沸水浴10 min,冷却至室温后,以水为空白,阿卡波糖为对照,用酶标仪在415 nm处测定吸光值。每次实验平行3次。按公式(4)计算IBP、CM-IBP对α-淀粉酶抑制率:
α-淀粉酶抑制率![]()
(4)
式中:A1,蒸馏水+α-淀粉酶溶液+DNS溶液测定的吸光值;A2,蒸馏水+PBS溶液+DNS溶液测定的吸光值;A3,IBP、CM-IBP溶液+α-淀粉酶溶液+DNS溶液测定的吸光值;A4,IBP、CM-IBP溶液+PBS溶液+DNS溶液测定的吸光值。
1.4 数据分析
采用Origin 2022 进行单因素、理化性质结果进行绘图及统计计算,采用Design-Expert 13 中的Box-Benhnken对响应面结果进行优化。
2 结果与分析
2.1 桦树茸多糖分离纯化结果
采用DEAE-Cellulose 100对桦树茸多糖进行分离纯化,采用苯酚硫酸法测定多糖含量。依次得到3个组分,得率分别为2.42%、16.5%、1.08%,洗脱曲线见图1-a。其中0.2 mol/L NaCl洗脱得率最高,将该馏分合并、浓缩、透析后冷冻干燥,使用Sephadex G-100凝胶柱进一步分离纯化,洗脱曲线见图1-b。收集含量较多的组分经浓缩、冷冻干燥后,得纯化后的IBP,得率为74.6%。
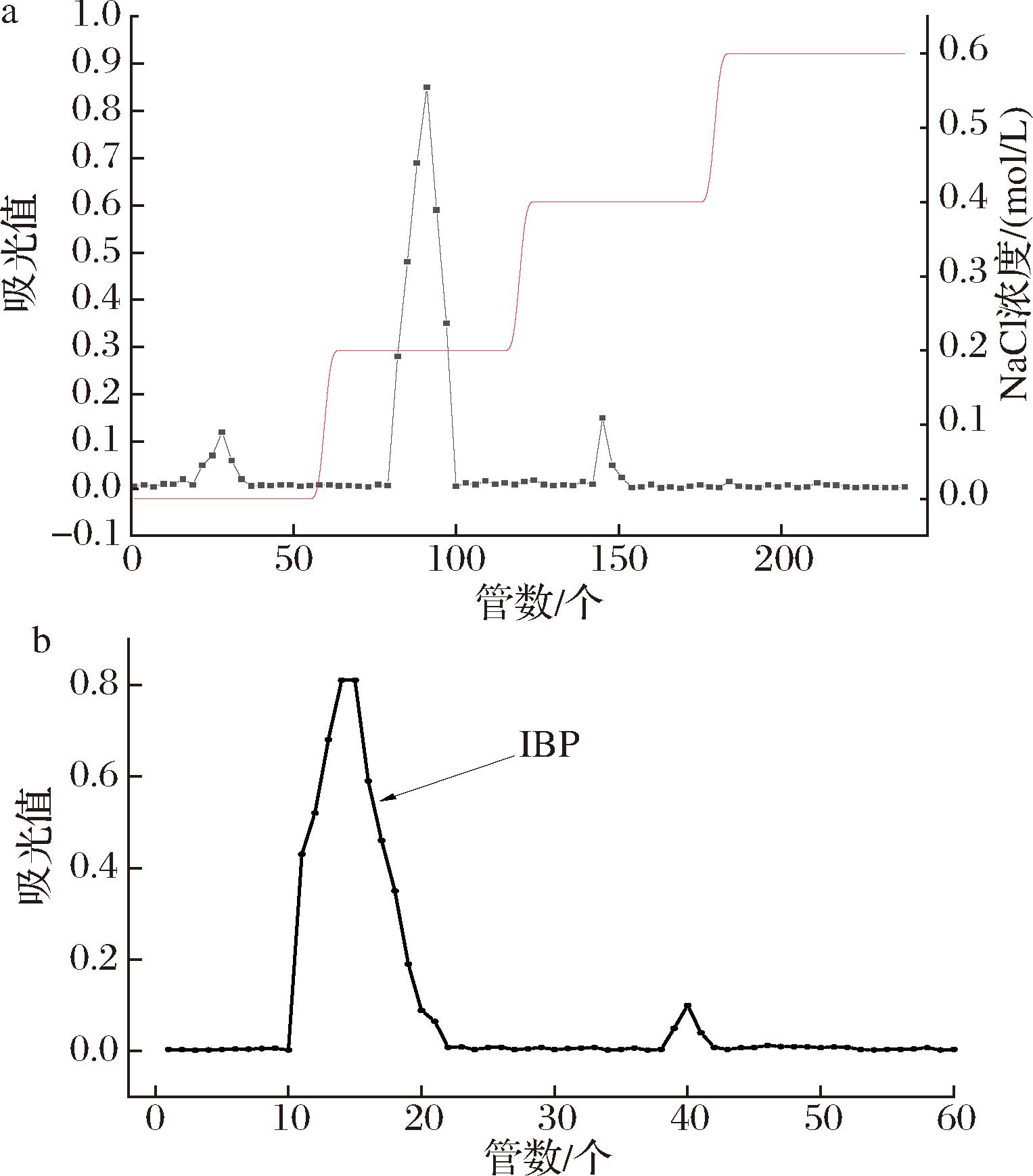
a-DEAE-Cellulose 100;b-Sephadex G-100
图1 DEAE-Cellulose 100、Sephadex G-100分离纯化
Fig.1 Separation and purification curves of DEAE-Cellulose 100 and Sephadex G-100
注:a图每管收集20 mL,b图每管收集10 mL。
2.2 单因素试验
不同碱化温度、氯乙酸质量分数、反应时间对IBP羧甲基化多糖修饰的影响见图2。由图2-a可知,IBP羧甲基化的取代度随碱化温度升高呈现先升高后下降趋势,碱化温度为50 ℃时,取代度达到最大值为0.292,继续升高碱化温度,取代度迅速下降。这可能是适当的碱化温度会促使体系分子热运动速率加快,有利于醚化反应发生,但当温度过高时,可能导致已经被取代的羧甲基发生裂解,羟基基团显露,反应空间缩小不利于取代反应的发生[18]。由图2-b可知,IBP羧甲基化的取代度随氯乙酸添加量增大呈现先升高后下降趋势,当氯乙酸添加质量分数为2%时,取代度达到最大为0.279,继续增大氯乙酸添加量,取代度下降。这可能是氯乙酸添加量越大,可提供更多的CH2COO—,从而增大羧甲基化反应机率,但氯乙酸添加量过大时,体系中氢氧化钠消耗殆尽,整个体系的pH值降低,不利于取代反应的顺利进行[19]。由图2-c可知,IBP羧甲基化的取代度随反应时间延长呈现先升高后下降趋势,当反应时间达到4.0 h时,取代度达到最大值为0.287。这可能是随反应时间的延长,反应活性中心增多,IBP与氯乙酸反应速率增加,取代度升高,但反应时间过长会使反应中不稳定的中间产物分解,使取代度下降[20]。
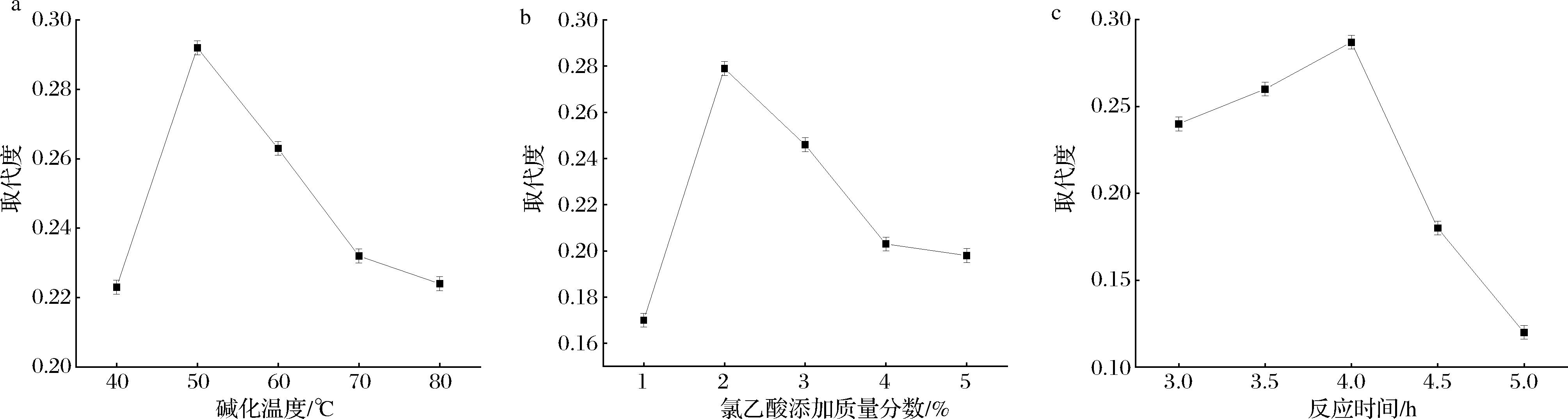
a-碱化温度;b-氯乙酸添加质量分数;c-反应时间
图2 碱化温度、氯乙酸添加质量分数、反应时间对取代度影响
Fig.2 Effect of alkalinization temperature, chloroacetic acid addition, and reaction time on degree of substitution
2.3 响应面试验
羧甲基化桦树茸多糖(CM-IBP)工艺优化选取碱化温度(A)、氯乙酸添加质量分数(B)、反应时间(C)为响应因素,羧甲基化取代度为指标,使用Design-Expert软件13.0设计并分析试验,试验设计方案及数据见表2,并进行回归拟合,二次多元回归方程如公式(5)所示:
Y=0.294+0.003 0A+0.020 4B-0.016 6C-0.010 5AB+0.006 0AC-0.018 2BC-0.026 3A2-0.040 1B2-0.028 6C2
(5)
表2 响应面试验方案及响应数据
Table 2 Experimental design scheme and response value of response surface
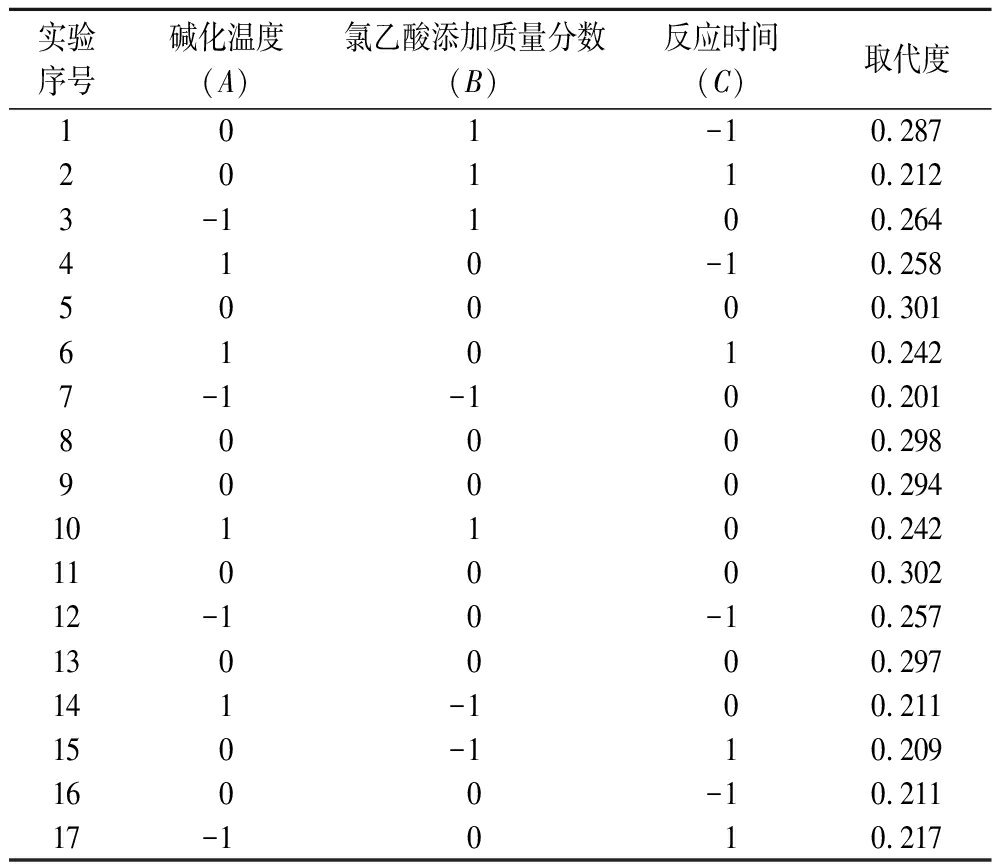
实验序号碱化温度(A)氯乙酸添加质量分数(B)反应时间(C)取代度101-10.28720110.2123-1100.264410-10.25850000.30161010.2427-1-100.20180000.29890000.294101100.242110000.30212-10-10.257130000.297141-100.211150-110.2091600-10.21117-1010.217
2.3.1 方差分析
如表3所示,该模型中F值为87.07、P值<0.000 1,模型极显著,失拟误差P为0.075 7,代表相对于纯误差失拟不显著;模型绝对系数R2为0.991 1,说明该模型99.11%的数据可以用回归方程解释;调整后的![]() 为0.979 8,表明模型的拟合度高,预测值与实测值具有97.98%的相关性;模型变异系数CV为2.09,表明该模型精密度和可靠性高;模型信噪比为24.62,表明该模型具有充分的信号来响应。综上,所建立的模型可用于预测分析CM-IBP羧甲基化取代度[21]。
为0.979 8,表明模型的拟合度高,预测值与实测值具有97.98%的相关性;模型变异系数CV为2.09,表明该模型精密度和可靠性高;模型信噪比为24.62,表明该模型具有充分的信号来响应。综上,所建立的模型可用于预测分析CM-IBP羧甲基化取代度[21]。
表3 回归模型方差分析
Table 3 Regression model analysis of variance
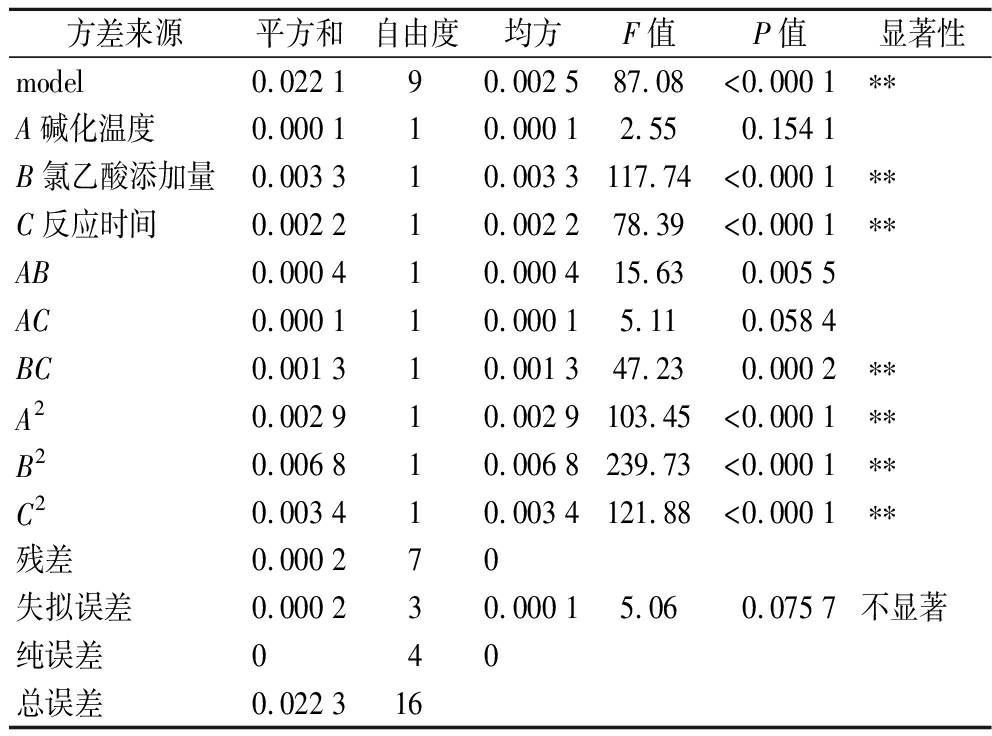
方差来源平方和自由度均方F值P值显著性model0.022 190.002 587.08<0.000 1∗∗A碱化温度0.000 110.000 12.550.154 1B氯乙酸添加量0.003 310.003 3117.74<0.000 1∗∗C反应时间0.002 210.002 278.39<0.000 1∗∗AB0.000 410.000 415.630.005 5AC0.000 110.000 15.110.058 4BC0.001 310.001 347.230.000 2∗∗A20.002 910.002 9103.45<0.000 1∗∗B20.006 810.006 8239.73<0.000 1∗∗C20.003 410.003 4121.88<0.000 1∗∗残差0.000 270失拟误差0.000 230.000 15.060.075 7不显著纯误差040总误差0.022 316
注:*代表显著(P<0.05),**代表极显著(P<0.01)。
2.3.2 响应面分析与验证试验
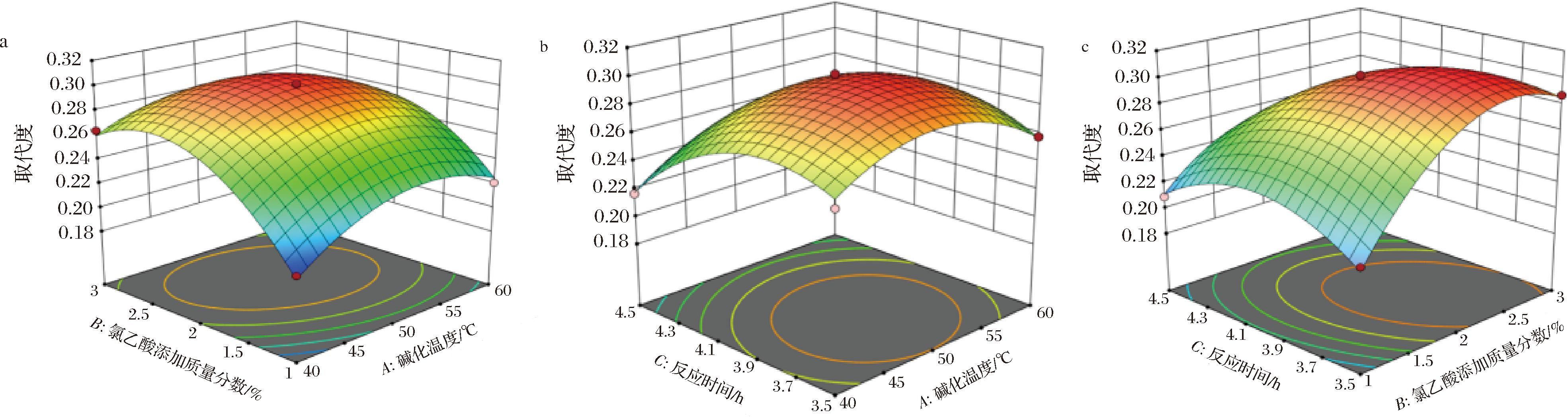
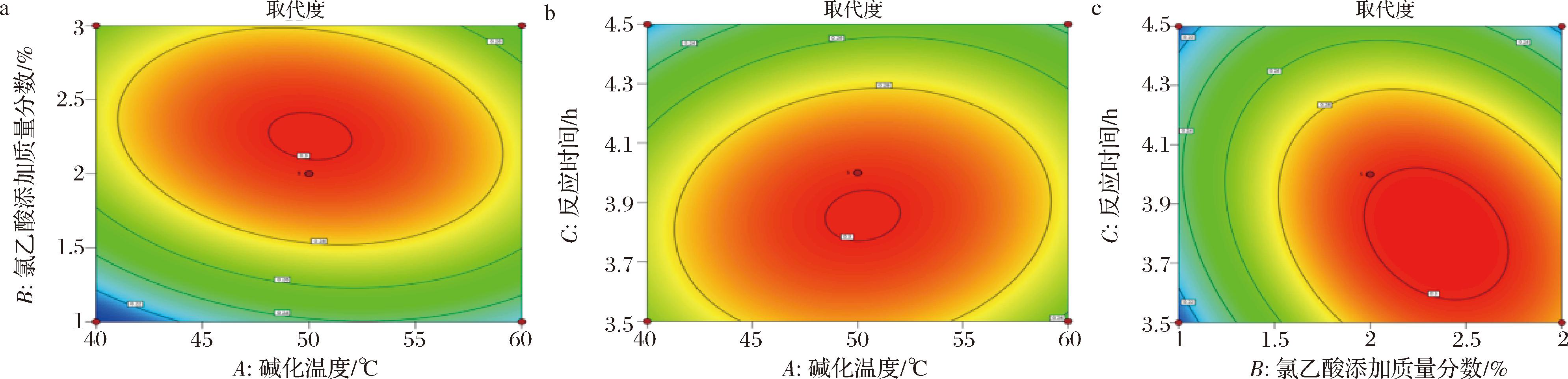
通过Design Expert 13软件,以IBP羧甲基化取代度为响应值,得响应值与各因素的响应面曲线图(图3)和等高线图(图4),由图3可知,各因素之间的相互作用图开口均朝下,表明该模型取代度存在最大值[22]。结合响应面图形弯曲程度和图4等高线图椭圆程度可知,各因素对IBP羧甲基化取代度影响为:氯乙酸添加质量分数(B)>反应时间(C)>碱化温度(A),其中,氯乙酸添加质量分数(B)和碱化温度(A)的交互作用最显著。根据响应面软件分析得出该模型优化最佳工艺为:碱化温度50.539 ℃、氯乙酸添加质量分数2.225%、反应时间为3.964 h,模型预测最佳取代度为0.311。为方便操作,对优化后条件进行调整,即碱化温度51 ℃、氯乙酸添加质量分数2.3%、反应时间为4 h,在该条件下进行3次重复实验,其取代度结果为0.313、0.312、0.310,平均取代度为0.312,均优于其他实验结果,表明最优方法合理,结果与预测值误差较小。
a-氯乙酸添加质量分数和碱化温度的交互作用;b-反应时间和碱化温度的交互作用;c-反应时间和氯乙酸添加质量分数的交互作用
图3 各因素对CM-ICP取代度影响的响应面图
Fig.3 Response surface plots of the effect of each factor on CM-ICP substitution degree
a-氯乙酸添加质量分数和碱化温度的交互作用;b-反应时间和碱化温度的交互作用;c-反应时间和氯乙酸添加质量分数的交互作用
图4 各因素对CM-ICP取代度影响的等高线图
Fig.4 Contour plot of the effect of each factor on CM-ICP substitution degree
2.4 CM-IBP理化性质研究
2.4.1 黏度、溶解度、总糖含量、蛋白质含量、糖醛酸含量测定
多糖经羧甲基修饰后,可解决其黏度高、水溶性差等不利于生物活性发挥的问题。桦树茸多糖的羧甲基化修饰后的黏度、溶解度、总糖、蛋白质和糖醛酸含量见表4,羧甲基修饰后的黏度由修饰前的3 298 mPa·s下降至2 984 mPa·s,溶解度从59.54 mg/mL上升至86.32 mg/mL,在一定程度解决了桦树茸多糖黏度高、溶解性低的问题。总糖、蛋白质、糖醛酸含量均下降,这可能是羧甲基化反应中部分糖、蛋白质及糖醛酸中的羟基参与羧甲基化反应,从而引起含量下降[11]。
表4 IBP、CM-IBP黏度、溶解度、总糖、蛋白质、糖醛酸含量
Table 4 Viscosity, solubility, total sugar, protein, and glucuronide content of IBP and CM-IBP

样品黏度/(mPa·s)溶解度/(mg/mL)总糖含量/%蛋白质含量/%糖醛酸含量/%IMP329 8±99.659.54±0.9697.540.62±0.091.24±0.08CM-IBP298 4±96.786.32±0.7988.370.38±0.020.78±0.04
2.4.2 单糖组成
图5为IBP、CM-IBP和单糖标准品的气相色谱图,IBP是一种杂多糖,主要由Glc、Gal两种单糖组成,并含有少量的Fuc、Ara、Xyl、Man,2种主要单糖Glc和Gal摩尔比为53.37∶18.66,经羧甲基化修饰的CM-IBP单糖组成未发生变化,但2种主要单糖Glc、Gal摩尔比为33.37∶48.66,羧甲基化修饰后,对单糖的种类无影响,但单糖的组成比例发生明显变化。
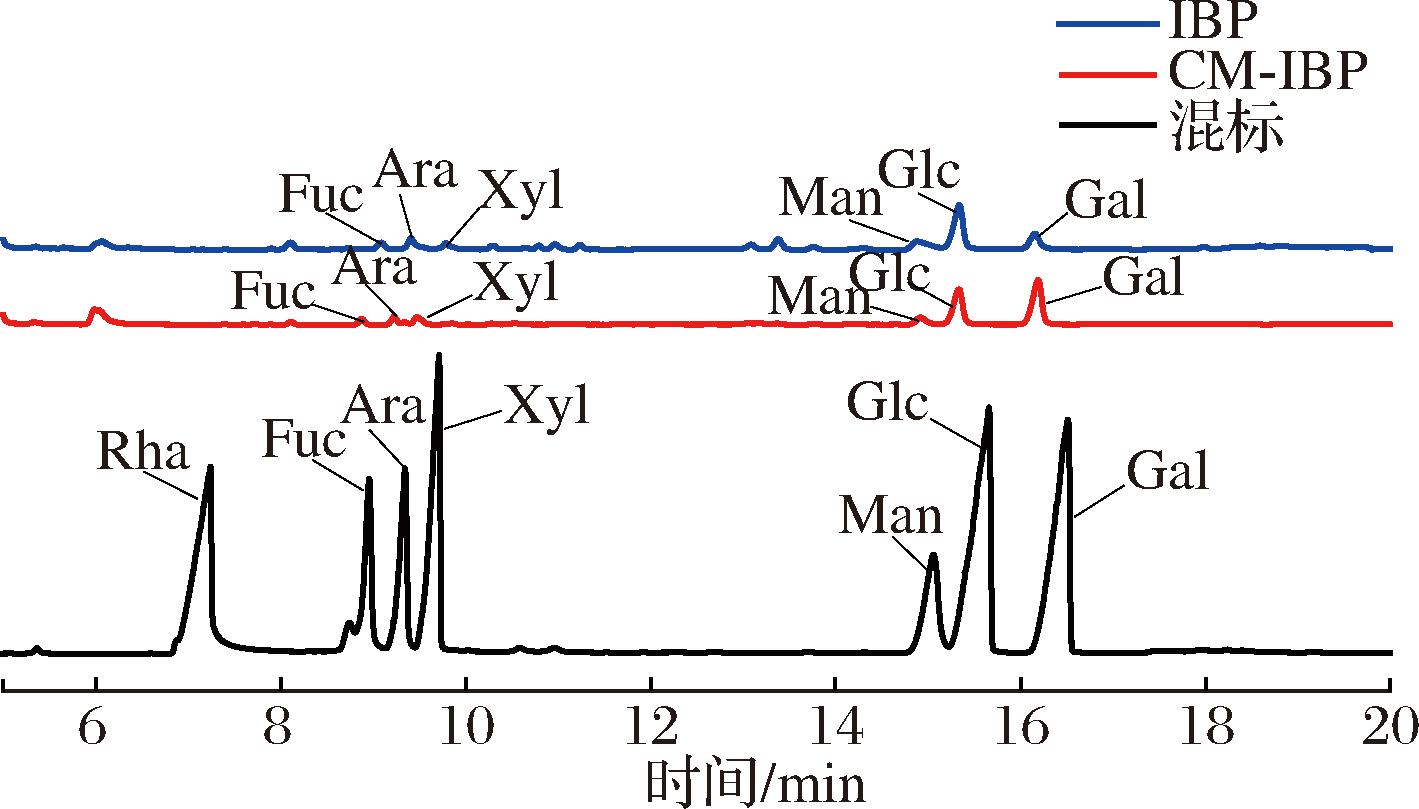
图5 IBP、CM-IBP和单糖混标的气相色谱图
Fig.5 Gas chromatograms of IBP, CM-IBP, and monosaccharides mixed labels
2.4.3 紫外光谱
图6为IBP、CM-IBP多糖水溶液的紫外全波长扫描图,IBP、CM-IBP在200~400 nm处无强吸收峰存在,但均在260~280 nm处有一定弱吸收峰,表明IBP、CM-IBP存在微量蛋白质与糖醛酸,这与表4理化分析结果一致。
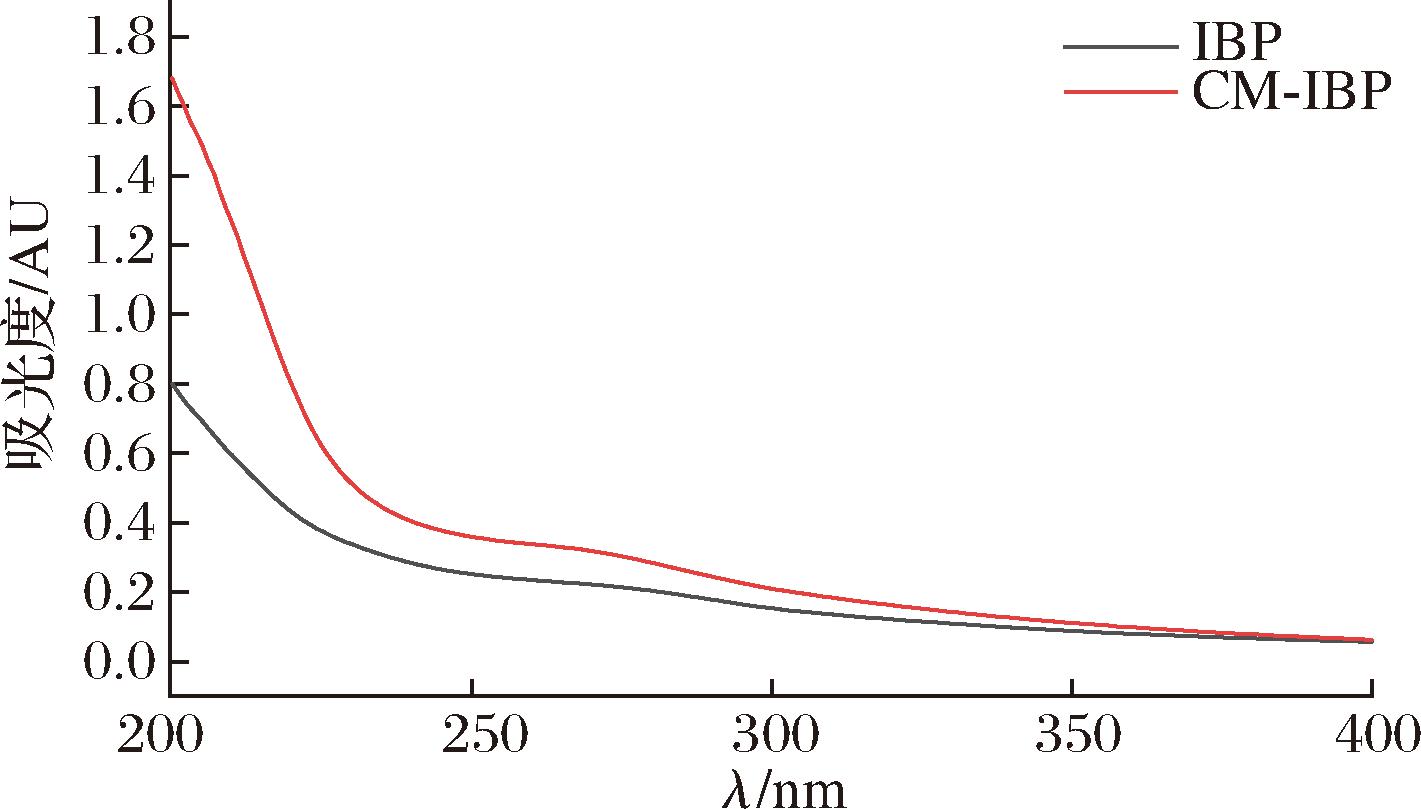
图6 IBP、CM-IBP紫外光谱图
Fig.6 UV spectra of IBP and CM-IBP
2.4.4 红外光谱
IBP和CM-IBP的红外光谱图见图7。IBP和CM-IBP的红外吸收光谱虽有一定移动,但大致相似,这可能是由于多糖分子中引入羧甲基基团。其中CM-IBP中3 427 cm-1和2 918 cm-1区域分别为多糖特征吸收峰—OH和—CH引起的,1 023 cm-1处的吸收峰表明存在C—O—C和C—O—H的吸收峰,与IBP的红外光谱图相比,CM-IBP在3 400 cm-1左右的吸收峰宽变窄,这可能是由于羟基的缔合作用引起的。在1 683、1 431、1 382 cm-1处出现了新的强吸收峰,其中,1 683 cm-1处为—C![]() O的非对称伸缩振动峰,1 431 cm-1处为—C
O的非对称伸缩振动峰,1 431 cm-1处为—C![]() O的对称伸缩振动峰,1 382 cm-1处为—CH2COOH中的CH的伸缩振动,3个峰均为羧甲基的特征吸收峰。CM-IBP其余吸收峰与IBP相似,表明桦树茸多糖在分子结构不变的同时成功引入羧甲基基团[23]。
O的对称伸缩振动峰,1 382 cm-1处为—CH2COOH中的CH的伸缩振动,3个峰均为羧甲基的特征吸收峰。CM-IBP其余吸收峰与IBP相似,表明桦树茸多糖在分子结构不变的同时成功引入羧甲基基团[23]。
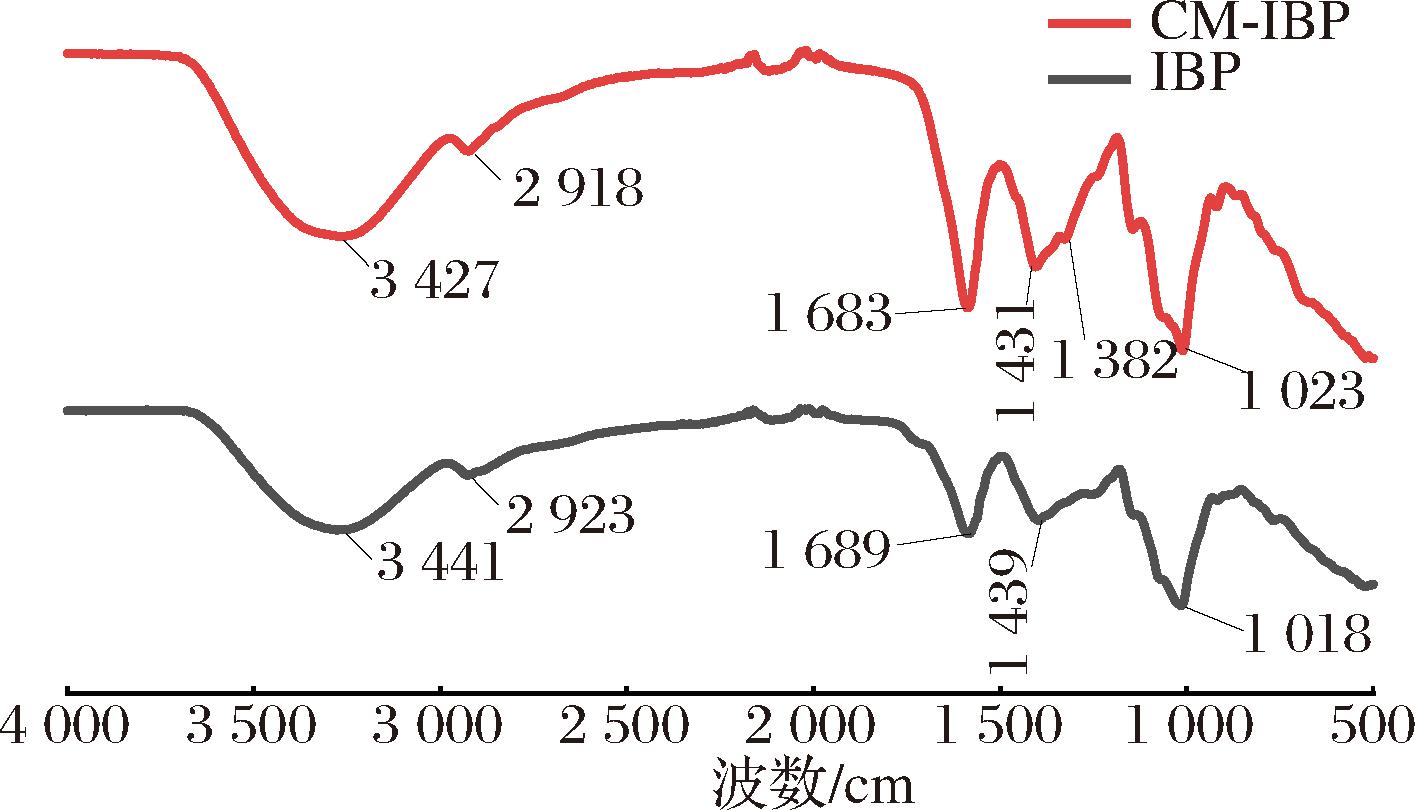
图7 IBP、CM-IBP红外光谱图
Fig.7 Infrared spectra of IBP and CM-IBP
2.4.5 刚果红实验
刚果红染料具有的螺旋构象可与多糖形成络合物,一般可通过紫外-可见分光光度计测定最大吸收波长是否红移为依据判断多糖是否具有三螺旋结构[24]。具有三股螺旋结构的多糖中存在β-1,3-糖残基,可显著提高多糖的降糖、抗氧化及抗肿瘤活性[25]。如图8所示,IBP、CM-IBP在低NaOH浓度下最大吸收波长急剧增加,在高浓度NaOH浓度下最大吸收波长开始降低,说明IBP、CM-IBP均在发生了分子间作用力变化,都具有三股螺旋结构。
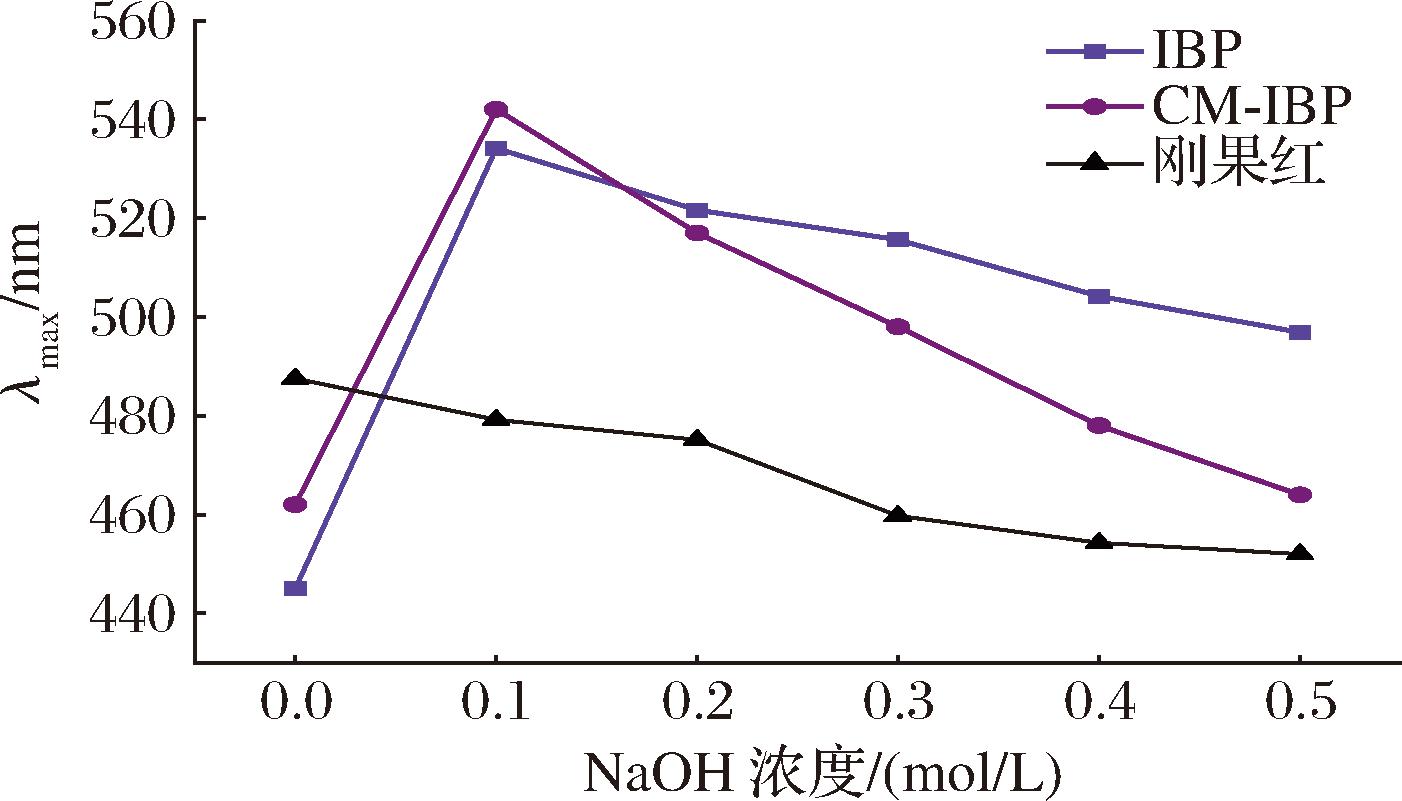
图8 IBP、CM-IBP在不同NaOH浓度下λmax变化的影响
Fig.8 Effect of λmax change in IBP and CM-IBP at different NaOH concentrations
2.4.6 XRD分析
IBP、CM-IBP的XRD谱图如图9所示,当2θ为15°左右时,IBP、CM-IBP均显示出一个较宽的弥散型衍射峰,为多糖特征衍射峰。此外,XRD图中2θ在27°、32°、46°、58°能观察到IBP、CM-IBP 均呈现尖峰。发现IBP、CM-IBP主要存在于结晶、非晶和多晶体系中,并且晶体和非晶共存,表明羧甲基修饰对修饰前的多糖晶体结构无显著影响,该研究结果与郝辉等[26]对甜茶多糖羧甲基化修饰结果一致。
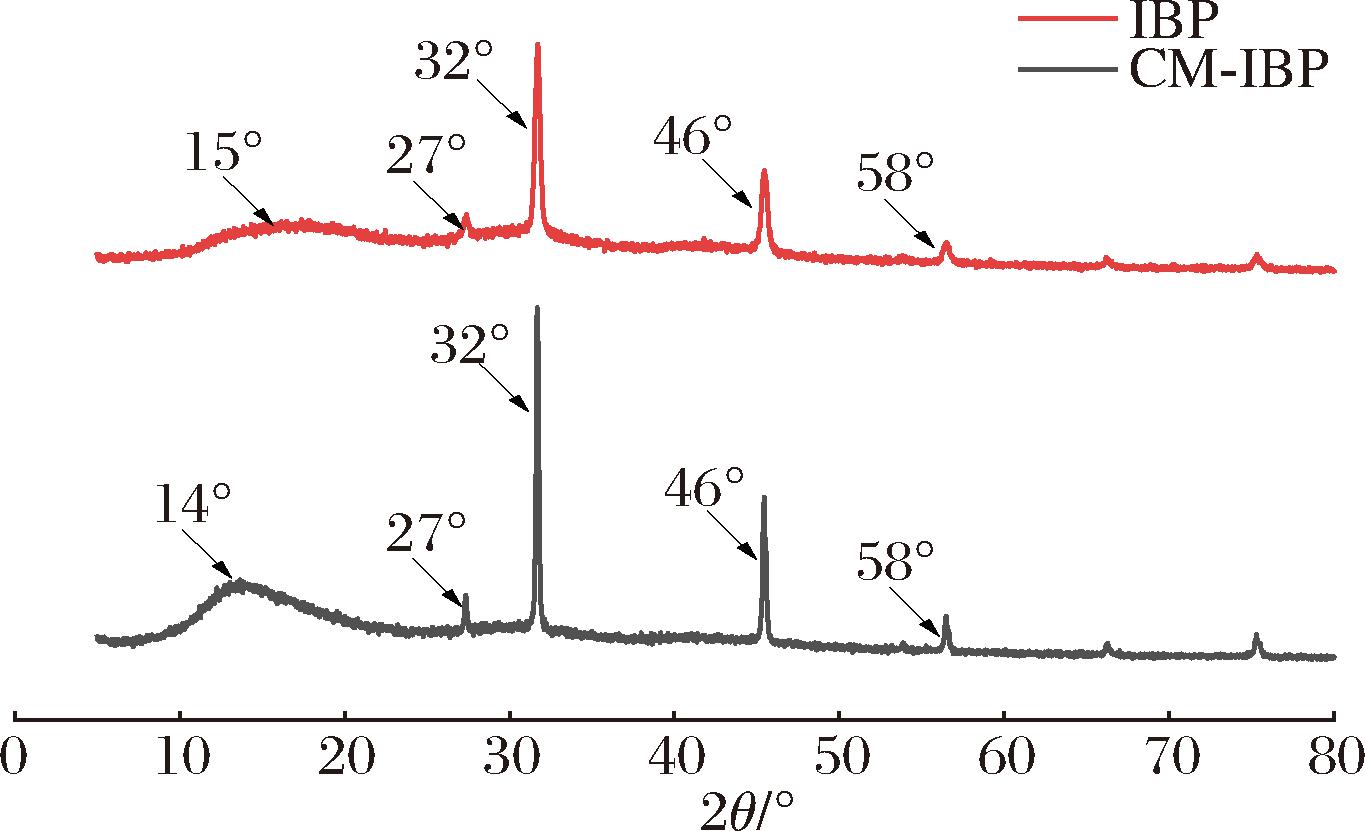
图9 IBP、CM-IBP的XRD图谱
Fig.9 XRD patterns of IBP and CM-IBP
2.4.7 SEM和EDX分析
多糖的立体结构通常比核苷酸和蛋白质的更为复杂。IBP、CM-IBP的SEM图像如图10-a、图10-b所示,由图10-a可以发现,IBP形态主要为表面均匀的层状结构,无卷曲,大部分呈现堆积现象,存在大小不一的孔隙,其中较大的孔径可能是由于在冷冻干燥过程中,游离水快速蒸发导致的,较小的孔径可能是大分子间官能团相互排斥引起的,同时这些孔隙也是多糖具有持水性和持油性的结构基础[21]。图10-b中可以发现,随温度升高,CM-IBP无层状结构,表面呈现球形平整结构,并且分散性较好,这可能是由于新基团的加入,导致分子间距增大,孔径增大以及改变分子间作用力导致的。羧甲基化修饰改变了多糖的空间形态,这也与其生物活性密切相关[27]。EDX结果发现,IBP主要以C和O元素为主,其中C元素占48.12%,O元素占48.75 %,CM-IBP中C元素占34.78%,O元素占40.28%,Na元素占10.17%,Cl元素占3.27%。这可能是CM-IBP引入—CH2COO基团导致CM-IBP中O元素所占比例较大,Na和Cl元素的出现可能是由于羧甲基化修饰时采用的氢氧化钠-氯乙酸体系[5],除此之外,IBP和CM-IBP均有少量对人体有益的微量元素。

a-IBP;b-CM-IBP
图10 IBP、CM-IBP的SEM图
Fig.10 SEM images of IBP and CM-IBP
2.4.8 热重分析
热稳定性是多糖工业应用的一个重要检测指标。热稳定性可监测样品脱水、分解、氧化有关的物料质量随时间和温度的变化[28]。IBP、CM-IBP的TG、DTG、DSC曲线如图11-a、图11-b所示,IBP、CM-IBP的TG、DTG均呈现两步降解模式,第1个吸收热峰分别出现在58.96和67.18 ℃,此阶段质量损失分别为9.23%和8.92%,这可能是多糖中的游离水、结合水损失造成的,第2个吸收热峰分别在200~350 ℃和258~380 ℃出现,第2阶段质量损失分别为56.44%和50.67%,这表明多糖发生剧烈分解,可能是由于碳链和氢链断裂导致,最终残碳率分别为34.33%、40.41%,表明CM-IBP的热稳定性优于IBP,并且修饰前后的桦树茸多糖在230 ℃以下趋于稳定。这可能是由于多糖中的氢被羟甲基取代后,基团结构更加稳定,而未修饰前多糖的羟基相比更容易暴露[29]。因此,经羧甲基化修饰后多糖热稳定性更为优异。
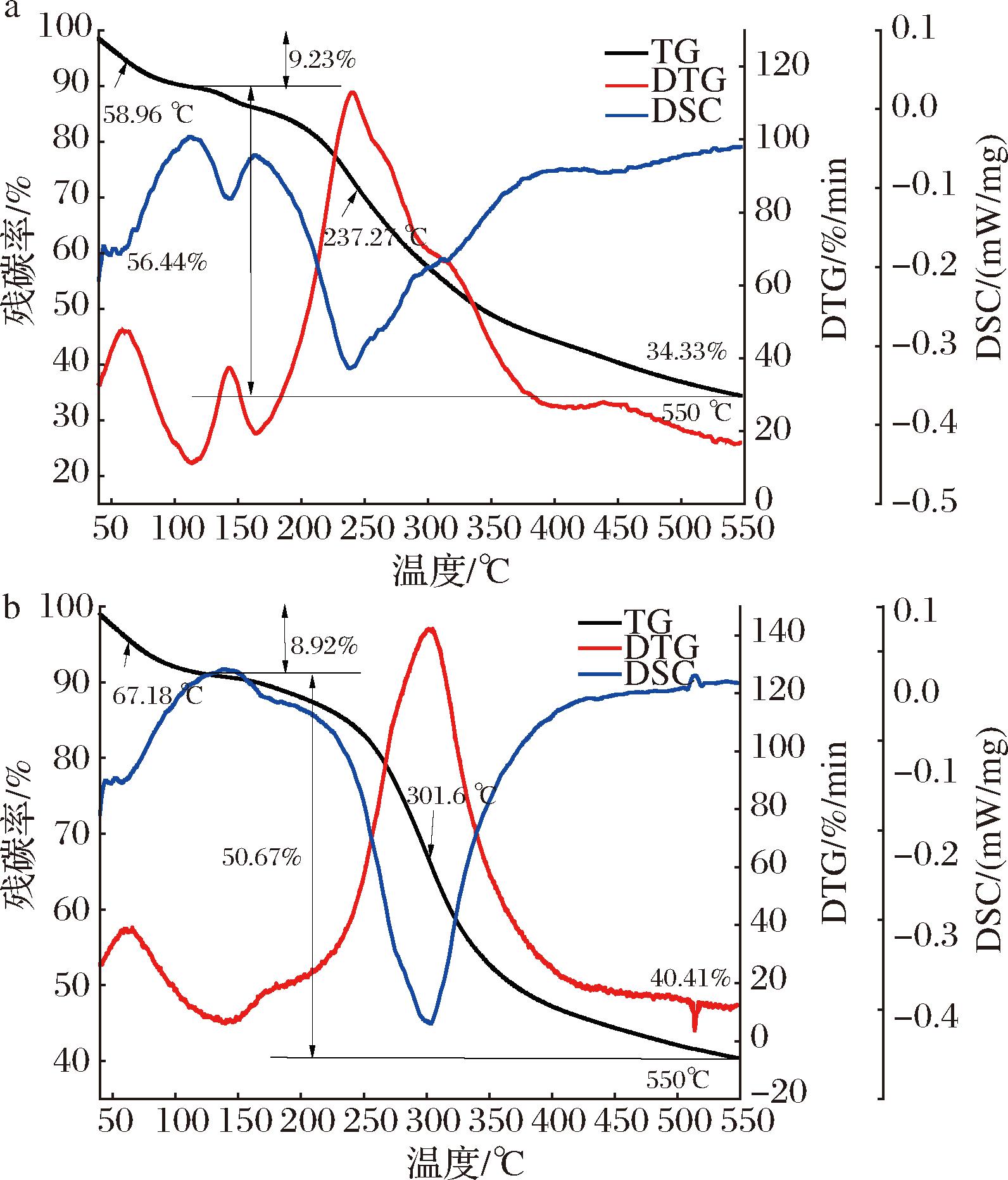
a-IBP;b-CM-IBP
图11 IBP、CM-IBP的热分析图
Fig.11 Thermal analysis of IBP and CM-IBP
2.5 IBP、CM-IBP体外降糖分析
糖尿病患者一般因代谢障碍而导致血糖浓度发生异常,预防和治疗这类疾病的有效方法之一就是延缓多糖在消化道分解速率[30]。α-葡萄糖甘酶和α-淀粉酶抑制剂作为糖尿病口服降血糖药目前已引起广泛关注,其能够抑制碳水化合物分解为葡萄糖,延缓吸收速率,从而改善餐后血糖水平[31]。图12-a、图12-b分别为IBP、CM-IBP和阳性对照阿卡波糖、α-葡萄糖甘酶和α-淀粉酶抑制活性结果。由图12-a可知,IBP、CM-IBP对α-葡萄糖甘酶抑制率均随质量浓度的增大而增加,在质量浓度为5 mg/mL下,IBP、CM-IBP对α-葡萄糖甘酶抑制率分别达到71.53%和98.54%,其IC50分别为2.64、1.0 mg/mL。由图12-b可知,IBP、CM-IBP对α-淀粉酶抑制率均随质量浓度的增大而增加,当质量浓度为5 mg/mL下,IBP、CM-IBP对α-淀粉酶抑制率分别达到63.55%和84.78%,IC50分别为3.68、2.29 mg/mL。结果表明,桦树茸多糖修饰前具有较弱的降糖活性,当质量浓度为5 mg/mL时,修饰后的CM-IBP对α-葡萄糖甘酶和α-淀粉酶的抑制率比IBP提高约20%,这可能是引入羟甲基基团后,多糖支链得到伸展,链构象结构改变,提高了桦树茸多糖抑制α-葡萄糖甘酶和α-淀粉酶活性[32]。
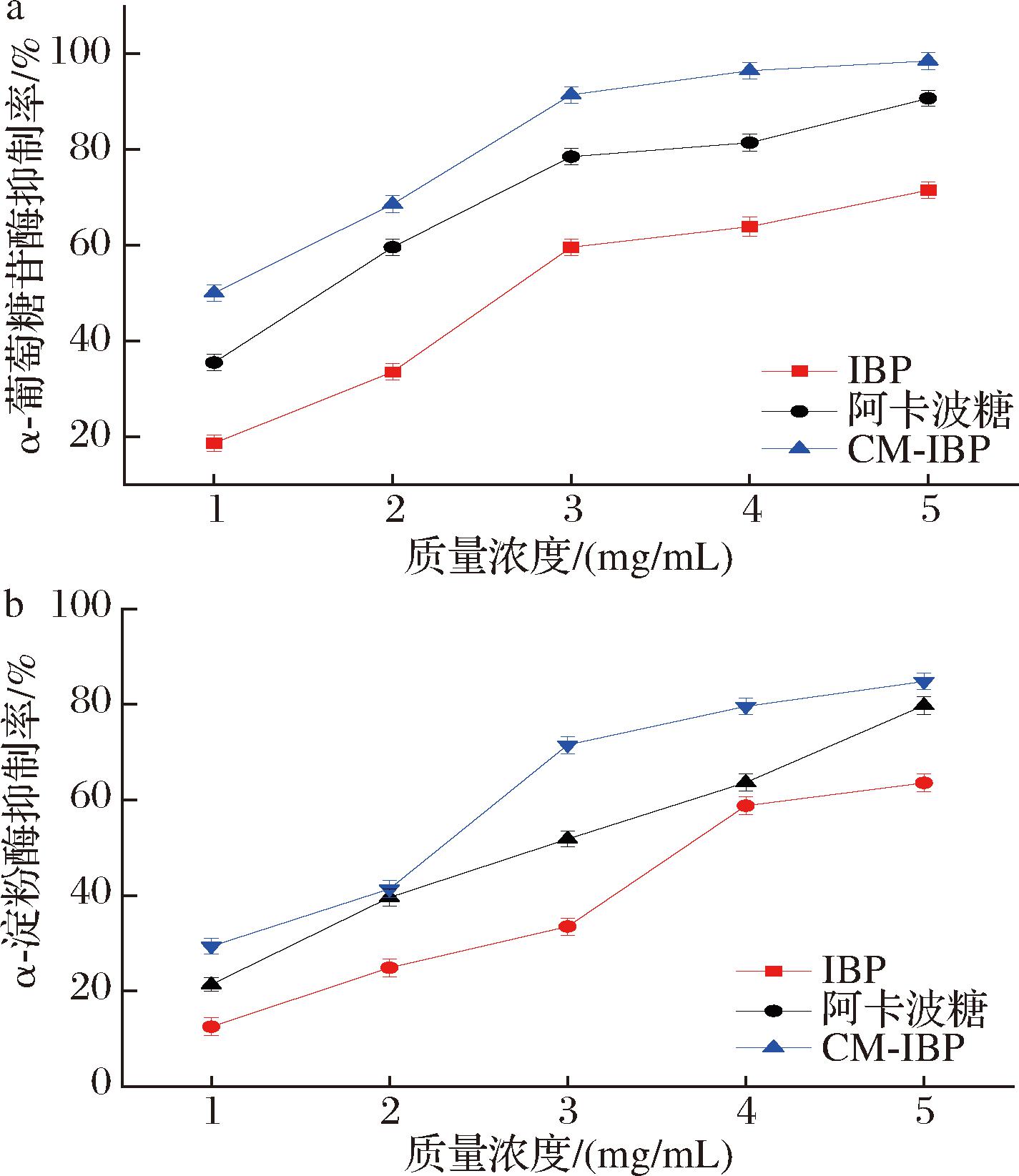
a-α-葡萄糖甘酶;b-α-淀粉酶
图12 阿卡波糖、IBP和CM-IBP对α-葡萄糖甘酶、 α-淀粉酶的抑制作用
Fig.12 Inhibitory effects of acarbose, IBP, and CM-IBP on α-glucosidase and α-amylase
3 结论与讨论
本研究采用DEAE-celucose 100和Sephdex G-100对桦树茸多糖进行分离纯化,得均一的IBP多糖,以羧甲基衍生法对IBP进行修饰,得修饰后的CM-IBP,其最佳修饰工艺为:碱化温度51 ℃、氯乙酸添加质量分数2.3%、反应时间为4 h,此条件下羧甲基取代度为0.312。CM-IBP与IBP相比,黏度降低,水溶性增大,蛋白质、糖醛酸含量降低,2种糖均由Fuc、Ara、Xyl、Man、Glc、Gal共6种单糖组成,羧甲基修饰对单糖的种类无影响,但单糖的组成比例发生明显变化。CM-IBP红外吸收光谱在1 683、1 431、1 382 cm-1处出现了新的强吸收峰,3个峰均为羧甲基的特征吸收峰,表明羧甲基化修饰成功。XRD及刚果红实验发现IBP、CM-IBP是晶体与非晶体共存,具有特殊螺旋结构的多糖。SEM、EDX对IBP、CM-IBP的微观形貌进行结构分析,发现CM-IBP表面更加平滑,并且由于CM-IBP引入—CH2COO基团导致CM-IBP中O元素所占比例较大,Na和Cl元素的出现可能是由于羧甲基化修饰时采用的氢氧化钠-氯乙酸体系。热稳定实验发现IBP、CM-IBP残碳率分别为34.33%、40.41%,表明两者都具有优异的热稳定性,但CM-IBP的热稳定性优于IBP。在质量浓度为5 mg/mL下,IBP、CM-IBP对α-葡萄糖甘酶IC50分别为2.64、1.0 mg/mL,对α-淀粉酶IC50分别为3.68、2.29 mg/mL。桦树茸多糖修饰前具有较弱的降糖活性,修饰后的CM-IBP对α-葡萄糖甘酶和α-淀粉酶体外抑制活性明显增强,并且高于阳性对照阿卡波糖,本研究为桦树茸多糖的构型关系研究提供方向,也为其他药用菌类多糖降血糖活性修饰研究提供重要参考。
[1] THI THUY VAN N, GASPILLO P A, THANH H G T, et al. Cellulose from the banana stem: Optimization of extraction by response surface methodology (RSM) and charaterization[J]. Heliyon, 2022, 8(12): e11845.
[2] 肖芳, 陈涛, 伍振煌, 等. 植物多糖的提取工艺、生物学功能及其在动物生产中的研究进展[J]. 饲料研究, 2022, 45(14):125-128.XIAO F, CHEN T, WU Z H, et al. Research progress on extraction technology, biological function and animal production of plant polysaccharides[J]. Feed Research, 2022, 45(14):125-128.
[3] 孔志强, 赵玉红. 沙棘降解多糖结构表征和功能特性研究[J]. 食品科学技术学报, 2023, 41(6):65-74; 138.KONG Z Q, ZHAO Y H. Structural characterization and functional properties of sea buckthorn degraded polysaccharides[J]. Journal of Food Science and Technology, 2023, 41(6):65-74; 138.
[4] 杨艺, 赵媛, 孙纪录, 等. 化学修饰多糖的方法及生物活性研究进展[J]. 食品工业科技, 2023, 44(11):468-479.YANG Y, ZHAO Y, SUN J L, et al. Research progress on chemical modification methods of polysaccharides and their biological activity[J]. Science and Technology of Food Industry, 2023, 44(11):468-479.
[5] 陈栅, 冯润芳, 袁野, 等. 酸枣多糖羧甲基化修饰及活性研究[J]. 中国食品学报, 2022, 22(4):55-66.CHEN S, FENG R F, YUAN Y, et al. Studies on carboxy methylation modification and activity of wild jujube polysaccharide[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(4):55-66.
[6] 黄馨阅, 丁慧敏, 马士玄, 等. 红须腹菌多糖的提取、羧甲基化修饰及免疫活性研究[J]. 南京师大学报(自然科学版), 2023, 46(3):60-68.HUANG X Y, DING H M, MA S X, et al. Extraction, carboxymethylation modification and in vivo immunomodulatory effects of polysaccharides from Rhizopogon rubescens(tul.)tul[J]. Journal of Nanjing Normal University (Natural Science Edition), 2023, 46(3):60-68.
[7] HORI I, HARASHIMA H, YAMADA Y. Development of a mitochondrial targeting lipid nanoparticle encapsulating berberine[J]. International Journal of Molecular Sciences, 2023, 24(2):903.
[8] 韩增华, 王玉霞, 戴肖东, 等. 高三萜含量桦褐孔菌菌核栽培[J]. 食用菌学报, 2022, 29(5):65-72.HAN Z H, WANG Y X, DAI X D, et al. Cultivation of Inonotus obliquus Sclerotium with high triterpene content by methyl jasmonate elicitation[J]. Acta Edulis Fungi, 2022, 29(5):65-72.
[9] HU Y, SHENG Y, YU M, et al. Antioxidant activity of Inonotus obliquus polysaccharide and its amelioration for chronic pancreatitis in mice[J]. International Journal of Biological Macromolecules, 2016, 87:348-356.
[10] HAN Y Q, NAN S J, FAN J, et al. Inonotus obliquus polysaccharides protect against Alzheimer’s disease by regulating Nrf2 signaling and exerting antioxidative and antiapoptotic effects[J]. International Journal of Biological Macromolecules, 2019, 131:769-778.
[11] CHEN Y F, ZHENG J J, QU C, et al. Inonotus obliquus polysaccharide ameliorates dextran sulphate sodium induced colitis involving modulation of Th1/Th2 and Th17/Treg balance[J]. Artificial Cells, Nanomedicine, and Biotechnology, 2019, 47(1):757-766.
[12] 于方园, 胡淼, 门雨薇, 等. 桦褐孔菌多糖磷酸化修饰工艺研究[J]. 食品研究与开发, 2022, 43(12):133-138.YU F Y, HU M, MEN Y W, et al. Phosphorylation modification process of Inonotus obliquus polysaccharides[J]. Food Research and Development, 2022, 43(12):133-138.
[13] 邵珠领, 吴艳丽, 张宇, 等. 桦褐孔菌多糖的乙酰化修饰及其抗氧化活性[J]. 食品工业科技, 2019, 40(9):73-77.SHAO Z L, WU Y L, ZHANG Y, et al. Acetylated modification and antioxidant activity of polysaccharides from Inonotus obliquus[J]. Science and Technology of Food Industry, 2019, 40(9):73-77.
[14] 杨嘉欣, 李瑶, 黄显健, 等. 海带多糖羧甲基化修饰工艺优化及其生物活性研究[J]. 食品与发酵工业, 2024, 50(18):115-122.YANG J X, LI Y, HUANG X J, et al. Optimization of carboxymethylation modification process and study on biological activity of Laminaria japonica polysaccharide[J]. Food and Fermentation Industries, 2024, 50(18):115-122.
[15] 任冰, 唐洪彬, 蒋德祥, 等. 静态平衡法测定甲基膦酸二甲庚酯在酸性溶液中的溶解度[J]. 核化学与放射化学, 2019, 41(3):272-277.REN B, TANG H B, JIANG D X, et al. Determination of solubility of di(1-methyl-heptyl) methyl phosphonate in acidic solution by static equilibrium method[J]. Journal of Nuclear and Radiochemistry, 2019, 41(3):272-277.
[16] YANG M Y, BELWAL T, DEVKOTA H P, et al. Trends of utilizing mushroom polysaccharides (MPs) as potent nutraceutical components in food and medicine: A comprehensive review[J]. Trends in Food Science &Technology, 2019, 92:94-110.
[17] NUERXIATI R, ABUDUWAILI A, MUTAILIFU P, et al. Optimization of ultrasonic-assisted extraction, characterization and biological activities of polysaccharides from Orchis chusua D. Don (Salep)[J]. International Journal of Biological Macromolecules, 2019, 141:431-443.
[18] 马永强, 张一鹏, 王鑫, 等. 黄精多糖羧甲基化修饰及其抗氧化活性研究[J]. 中国食品添加剂, 2023, 34(6):38-47.MA Y Q, ZHANG Y P, WANG X, et al. Carboxymethylation modification of Polygonatum polysaccharide and its antioxidant activity[J]. China Food Additives, 2023, 34(6):38-47.
[19] 慈璐雨, 倪天颖, 蓝蔚冰. 羧甲基化和磷酸化凝胶多糖的制备及结构与抗氧化活性对比分析研究[J]. 食品与发酵工业, 2024, 50(16):249-255.CI L Y, NI T Y, LAN W B. Comparative analysis of preparation, structure, and antioxidant activity of carboxymethylated and phosphorylated curdlan[J]. Food and Fermentation Industries, 2024, 50(16):249-255.
[20] GAO Y L, ABUDUAINI G, YANG C H, et al. Isolation, purification, and structural elucidation of Stropharia rugosoannulata polysaccharides with hypolipidemic effect[J]. Frontiers in Nutrition, 2022, 9:1092582.
[21] PAULO F, TAVARES L, SANTOS L. Response surface modeling and optimization of the extraction of phenolic antioxidants from olive mill pomace[J]. Molecules, 2022, 27(23):8620.
[22] ZHAO X Y, LI J Y, LIU Y Q, et al. Structural characterization and immunomodulatory activity of a water soluble polysaccharide isolated from Botrychium ternatum[J]. Carbohydrate Polymers, 2017, 171:136-142.
[23] 苗兰宁, 贺奕森, 唐涛, 等. 羧甲基化沙棘多糖钙螯合物稳定性的探究[J]. 中国食品工业, 2023(3): 95-97.MIAO L N, HE Y S, TANG T, et al. Investigation of the stability of calcium chalates of carboxymethylated sea buckthorn polysaccharides[J]. China Food Industry, 2023(3): 95-97.
[24] ZHENG P Z, CAI D X, ZHAO J H, et al. Thermodynamic properties of mixed surfactants of dodecyltrimethylammonium bromide and 1-dodecyl-3-methylimidazolium bromide[J]. The Journal of Chemical Thermodynamics, 2017, 113:394-398.
[25] PRICE N P, LABEDA D P, NAUMANN T A, et al. Quinovosamycins: New tunicamycin-type antibiotics in which the α, β-1″, 11′-linked N-acetylglucosamine residue is replaced by N-acetylquinovosamine[J]. Journal of Antibiotics, 2016, 69(8):637-646.
[26] 郝辉, 龚梅秋, 刘远上, 等. 甜茶多糖的提取、羧甲基化修饰及抗氧化活性研究[J]. 陕西农业科学, 2022, 68(11):37-42.HAO H, GONG M Q, LIU Y S, et al. Study on extraction, carboxymethylation and antioxidant activity of sweet tea polysaccharide[J]. Shaanxi Journal of Agricultural Sciences, 2022, 68(11):37-42.
[27] AN Y Z, LIU H T, LI X X, et al. Carboxymethylation modification, characterization, antioxidant activity and anti-UVC ability of Sargassum fusiforme polysaccharide[J]. Carbohydrate Research, 2022, 515:108555.
[28] ABUDUWAILI A, NUERXIATI R, MUTAILIFU P, et al. Isolation, structural modification, characterization, and bioactivity of polysaccharides from Folium Isatidis[J]. Industrial Crops and Products, 2022, 176:114319.
[29] 邢慧珍, 张玉梅, 刘会平, 等. 淡竹叶多糖的制备、热稳定性及其抗氧化活性[J]. 食品研究与开发, 2023, 44(19):86-96.XING H Z, ZHANG Y M, LIU H P, et al. Preparation, thermal stability and antioxidant activity of polysaccharide from Lophatherum gracile brongn[J]. Food Research and Development, 2023, 44(19):86-96.
[30] 李文文, 蔺永刚, 边鹏, 等. 新疆藁本多糖的提取、理化性质与生物活性[J]. 精细化工, 2024, 41(9):1966-1977; 2081.LI W W, LIN Y G, BIAN P, et al. Extraction, physicochemical properties and bioactivities of polysaccharides from Conioselinum vaginatium[J]. Fine Chemicals, 2024, 41(9):1966-1977; 2081.
[31] CHEN X Y, JI H Y, ZHANG C F, et al. Optimization of extraction process from Taraxacum officinale polysaccharide and its purification, structural characterization, antioxidant and anti-tumor activity[J]. Journal of Food Measurement and Characterization, 2020, 14(1):194-206.
[32] DONG R H, TIAN J L, HUANG Z Y, et al. Intermolecular binding of blueberry anthocyanins with water-soluble polysaccharides: Enhancing their thermostability and antioxidant abilities[J]. Food Chemistry, 2023, 410:135375.