由于海藻来源的多糖具有抗氧化[1]、降血糖[2]、抗炎[3]、抗肿瘤[4]、免疫调节[5]等多种功效,近年来海藻多糖在功能食品、医药和化妆品等方面的应用越来越多。多糖的生物活性、理化特性与其单糖组成、糖苷键类型以及分子大小等特征密切相关[6]。了解海藻多糖的理化性质和生物活性是多糖在食品、医药等行业中应用的基础,也是实现多糖高值化利用的关键。
水提醇沉因易于操作和中试放大,是工业上常用的多糖分级分离方法,也是实验室对多糖的生物活性和理化特性进行初步评估常用的分离方法。JIA等[7]采用分级醇沉分离玉米丝多糖,发现80%的多糖具有较强的抗氧化活性和α-葡萄糖苷酶抑制活性;HUI等[8]采用分级醇沉分离败酱草多糖并探索其理化特性和抗氧化活性,发现70%、80%醇沉的多糖抗氧化活性比50%、60%醇沉的多糖强。CHEN等[1]采用乙醇分级沉淀分离小球藻多糖,发现70%醇沉的多糖抗氧化活性最强。
微拟球藻(Nannochloropsis sp.)是一种单细胞海洋微藻,富含二十碳五烯酸(eicosapentaenoic acid, EPA)等不饱和脂肪酸,在水产养殖[9]、功能食品和医药等行业中有着广泛的应用前景[10]。然而,当前有关微拟球藻的研究主要集中在油脂方面[11],关于微拟球藻多糖理化性质、提取分离的相关研究较少[12-13]。
本研究采用乙醇分级沉淀的方法对微拟球藻水溶性多糖进行初步分离,分析各组分的理化特性和抗氧化活性,以期为微拟球藻多糖的开发和高值化利用提供理论参考。
1 材料与方法
1.1 材料与试剂
微拟球藻藻粉,上海光语生物有限公司;无水乙醇,西陇科学股份有限公司;抗坏血酸,如吉生物科技有限公司;考马斯亮蓝,上海蓝季科技发展有限公司;明胶,天津市光复精细化工研究所;单糖标准品,Sigma公司;牛血清白蛋白标准品,上海源叶生物科技有限公司;苯酚、铁氰化钾等(均为分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
RE-52AA旋转蒸发仪,上海亚荣生化仪器有限公司;Infinite M200 Pro酶标仪,瑞士帝肯公司;K9840自动凯氏定氮仪,山东海能科学仪器有限公司;Optilab T-rEx示差折光检测器、DAWN HELEOS Ⅱ多角度激光光散射仪,美国Wyatt Technology公司;U3000高压凝胶色谱、ICS 5000+高效液相色谱仪,Nicolet IS50红外光谱仪,美国Thermo Fisher公司;MCR302e流变仪,奥地利Anton Paar公司。
1.3 实验方法
1.3.1 营养成分测定
蛋白质的测定参考GB/T 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法。脂肪的测定参考GB/T 5009.6—2016《食品安全国家标准 食品中脂肪的测定》索氏提取法。碳水化合物的测定参考苯酚-硫酸法[14]。
1.3.2 藻多糖的制备
采用纤维素破壁、热水碱提、分步醇沉的方法制备藻多糖。具体步骤如图1所示,40%、60%、80%醇沉所得多糖分别命名为NSP40、NSP60、NSP80。
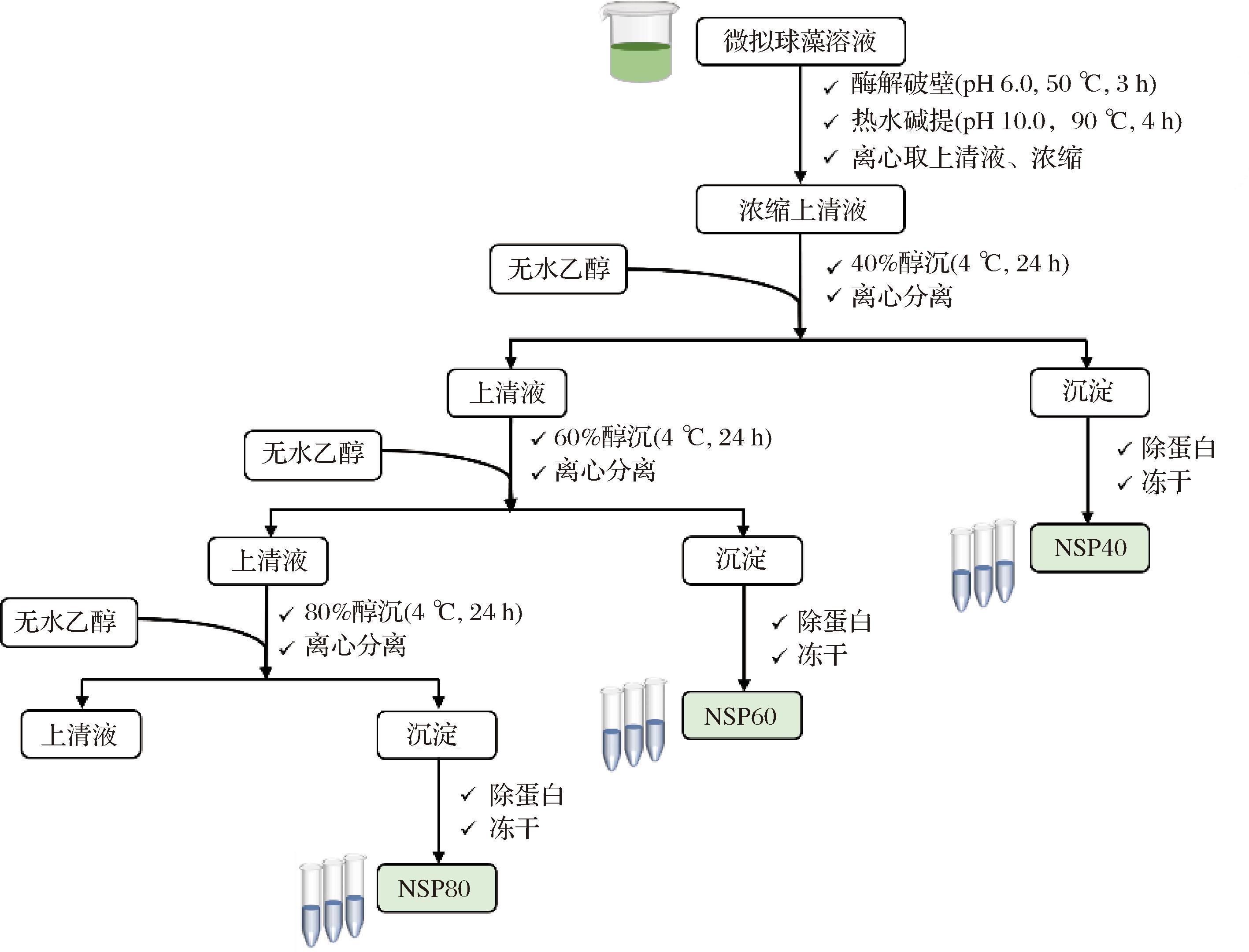
图1 微拟球藻多糖的制备流程
Fig.1 Preparation of polysaccharides from Nannochloropsis sp.
1.3.3 除蛋白
采用Sevag法[15]除去多糖中的蛋白。将粗多糖溶液与Sevag试剂以4∶1体积比混匀,振荡后离心,多次吸取上层糖液,直至中间层无变性蛋白层存在。
1.3.4 多糖理化特性
1.3.4.1 单糖组成分析
取适量多糖样品,加入1 mL 2 mol/L三氟乙酸溶液,121 ℃加热2 h,通氮气吹干。加入甲醇清洗后用无菌水溶解,转入色谱瓶。采用外标法定量。
采用HPLC对NSP的单糖组成进行分析。色谱条件为DionexTM CarboPacTM PA20(150 mm×3.0 mm,10 μm)液相色谱柱;进样量为5 μL。流动相A(H2O),流动相B(0.1 mol/L NaOH),流动相C(0.1 mol/L NaOH,0.2 mol/L CH3COONa),流速0.5 mL/min;柱温30 ℃,梯度洗脱,0 min:A相∶B相∶C相为95∶5∶0(体积比);26 min至42 min:A相∶B相∶C相为85∶5∶10(体积比);42.1 min:A相∶B相∶C相为60∶0∶40(体积比);52 min:A相∶B相∶C相为60∶40∶0(体积比);52.1 min至60 min:A相∶B相∶C相为95∶5∶0(体积比)。
1.3.4.2 分子质量分布
将样品溶于0.1 mol/L NaNO3水溶液[含0.02%(质量分数)NaN3]中,使质量浓度为1 mg/mL。
采用凝胶色谱-示差-多角度激光光散射系统(high pressure gel chromatography-muitiple angle light scattering detector-differential refractive index detector, HPSEC-MALS-RI)系统,样品过滤(孔径0.45 μm)后上机检测。
采用Ohpak SB-805 HQ、Ohpak SB-804 HQ和Ohpak SB-803 HQ凝胶排阻色谱柱串联,色谱柱均为(300 mm×8 mm);柱温为45 ℃;进样量100 μL;流动相:0.02% NaN3,0.1 mol/L NaNO3;流速0.4 mL/min;洗脱梯度:等度100 min。以检测保留时间为横坐标,相对尺度为纵坐标作分子质量分布图。
1.3.4.3 傅里叶红外光谱分析
参照文献[16],使用傅里叶红外光谱分析(Fourier transform infrared spectroscopy, FT-IR)仪在500~4 000 cm-1扫描(32次),检测器为MCT。
1.3.4.4 流变特性
参照文献[17]的方法并加以修正。配制2 mg/mL的多糖溶液,并在分析前静置12 h,用流变仪研究3种多糖。采用直径为50 mm的锥板测量系统,夹具为CP50-1锥板,模具与平台间隙为0.102 mm,在25 ℃,剪切速率范围为1~100 s-1扫描。采集数据点,测定表观黏度和剪切应力的变化规律。采用Power-law幂律模型拟合NSP的流动曲线。
1.3.4.5 总糖含量测定
采用苯酚-硫酸法[14]测定总糖含量。取1 mL待测样品,加入1 mL 5%(质量分数)的苯酚溶液和5 mL 浓硫酸,混匀,室温下静置30 min后,测定溶液在490 nm处吸光值。以葡萄糖为标准品,计算糖含量。
1.3.4.6 蛋白质含量测定
采用考马斯亮蓝法[14]测定蛋白质含量。取20 μL待测样品,加入200 μL Bradford工作液,混匀,静置5 min后,测定溶液在595 nm处吸光值,以BSA为标准溶液,绘制标准曲线,测定蛋白质含量。
1.3.4.7 硫酸根含量测定
采用氯化钡-明胶法[8]测定硫酸根含量。取0.2 mL 待测样品(1 mol/L HCl溶解,于100 ℃下水解6 h),加入3.8 mL 3%(质量分数)三氯乙酸溶液和2 mL 0.5%(质量分数)氯化钡-明胶溶液,混匀,于360 nm处测定吸光值A1,以0.5%(质量分数)明胶溶液代替氯化钡-明胶溶液,测得吸光值A2。以0.6 mg/mL K2SO4为标准溶液,绘制标准曲线,测定硫酸根含量。
1.3.4.8 糖醛酸含量测定
采用硫酸-咔唑比色法[8]测定糖醛酸含量。取0.5 mL待测样品,加入3 mL 9.54 mg/mL硼砂硫酸溶液,混匀后于100 ℃下水浴15 min,冷却,加入0.2 mL 0.15%(质量分数)咔唑溶液,混匀后测定溶液在530 nm处吸光值。以0.1 mg/mL半乳糖醛酸溶液为标准品,计算糖醛酸含量。
1.3.5 多糖的抗氧化活性研究
1.3.5.1 羟自由基清除能力
参考王宝贝等[18]的方法,通过水杨酸法测定微拟球藻多糖样品对羟自由基的清除能力。分别取NSP40、NSP60和NSP80和抗坏血酸溶于水,配制样品溶液。各取400 μL样液、FeSO4、水杨酸混匀,静置10 min后加入200 μL H2O2,混匀后静置冷却,于510 nm处测定吸光值Ai;以等体积蒸馏水代替H2O2,测得Ax;以蒸馏水为空白对照,测得A0。清除率的计算如公式(1)所示:
清除率![]()
(1)
1.3.5.2 ABTS阳离子自由基清除能力
参考李菀等[14]的方法,按1.3.5.1节方法制备样品溶液。在96孔板中加入200 μL ABTS工作液和10 μL样品溶液,混匀后,室温静置5 min,测定溶液在734 nm处的吸光值Ai,以蒸馏水为空白对照,测得吸光值A0,清除率的计算如公式(2)所示:
清除率![]()
(2)
1.3.5.3 总还原力
采用铁氰化钾法[14]进行测定。按1.3.5.1节方法制备样品溶液。取200 μL样品溶液、200 μL PBS(pH=6.6)和500 μL 1%(质量分数)铁氰化钾溶液,混匀,50 ℃反应20 min,冷却;加入200 μL 10%(质量分数)三氯乙酸溶液,离心,取500 μL上清液,依次加入500 μL蒸馏水、100 μL 0.1%(质量分数)FeCl3溶液混匀,室温下放置10 min后,于700 nm处测定吸光度。以蒸馏水为空白对照,抗坏血酸为阳性对照,测定总还原力。
1.4 数据处理
所有试验在相同条件下重复测定3次,结果都以均值±标准差的方式表示,采用SPSS 17.0软件进行显著性分析,采用Origin 2024软件进行做图。
2 结果与分析
2.1 多糖组分的得率及其化学组成
采用40%、60%和80%的乙醇依次从微拟球藻热水提取物中分级沉淀多糖,所得3个部位的多糖分别命名为NSP40、NSP60和NSP80。总多糖得率为(4.89±0.21)%,其中NSP40、NSP60和NSP80的得率分别为(0.21±0.01)%、(1.21±0.41)%和(3.48±0.04)%,占总多糖的4.09%、24.74%和71.17%(表1)。可见,多糖的析出量随着乙醇体积分数的增加而增加(P<0.05)。该结果与李顺峰等[19]采用乙醇分级沉淀香菇多糖得到的结论相似。这主要是与多糖的结构和极性有关,比如多糖母环上的羟基数量会影响多糖的极性,从而影响多糖在不同体积分数乙醇中的溶解性。
表1 微拟球藻多糖的得率及其化学组成
Table 1 Yield and chemical compositions of NSP
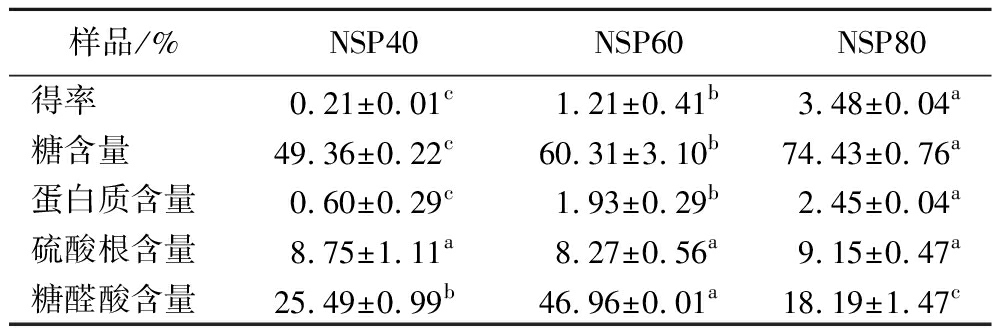
样品/%NSP40NSP60NSP80得率0.21±0.01c1.21±0.41b3.48±0.04a糖含量49.36±0.22c60.31±3.10b74.43±0.76a蛋白质含量0.60±0.29c1.93±0.29b2.45±0.04a硫酸根含量8.75±1.11a8.27±0.56a9.15±0.47a糖醛酸含量25.49±0.99b46.96±0.01a18.19±1.47c
注:不同字母表示样品间具有显著性差异(P<0.05)(下同)。
不同部位粗多糖的化学组成如表1所示。NSP40、NSP60、NSP80的总糖含量分别为(49.36±0.22)%、(60.31±3.10)%、(74.43±0.76)%,蛋白含量依次为(0.60±0.29)%、(1.93±0.29)%、(2.45±0.04)%。可见,随着乙醇体积分数的升高,析出的粗多糖总糖含量和蛋白质含量呈上升趋势。60%和80%乙醇沉淀所得组分的总糖含量均超过60%,分别为NSP40的1.22倍(P<0.05)和1.51倍(P<0.05)。本研究分离所得粗多糖纯度较高。同样采用60%乙醇沉淀分离,NSP60的多糖含量是小球藻多糖CCP60(34.35%)的1.76倍[1]。本研究醇沉所得3个多糖组分的蛋白含量均很低,其中含量最高的NSP80蛋白含量与ZHANG等[20]从竹笋中提取的粗多糖CPS70的蛋白含量(2.49±0.10)%相当,比JIA等[21]从玉米须中提取的粗多糖CSP40的蛋白含量低3%。这可能是由于本研究粗多糖的制备经过多次去除蛋白,游离蛋白质去除比较彻底[20],所检测到的蛋白主要是与糖紧密结合的糖蛋白。
由表1可知,所有醇沉组分均检测到糖醛酸、硫酸根和蛋白质,表明这些组分中很可能含有酸性蛋白[22]。不同体积分数乙醇沉淀所得粗多糖的硫酸根含量无明显差异,为8.27%~9.15%(P>0.05)。然而,糖醛酸含量差别却很大。其中,NSP60的糖醛酸含量最高(46.96±0.01)%,分别为NSP40和NSP80的1.84倍和2.58倍。可见,乙醇体积分数会影响所沉淀微拟球藻多糖的糖醛酸含量。WANG等[22]采用梯度醇沉法提取大豆壳水溶性多糖时也发现多糖的糖醛酸含量因乙醇体积分数的不同而不同。当乙醇体积分数从20%上升至60%时,粗多糖的糖醛酸含量从(42.58±0.01)%降至(9.15±0.06)%。JIA等[21]也发现当乙醇体积分数从20%提高至80%时,玉米须多糖的糖醛酸含量从(27.9±1.34)%降低至(7.50±1.92)%。有趣的是,本研究中微拟球藻多糖的糖醛酸含量与乙醇体积分数并无明显的负相关关系。含量最低的NSP80(18.19±1.47)%的糖醛酸含量仍比竹笋多糖和败酱草多糖的高,前者糖醛酸含量为2.13%~9.42%[20],而后者糖醛酸含量仅为1.1%~5.5%[8]。这可能是由于不同来源的多糖,其结构和组成不同,糖醛酸含量也各有差异。此外,本研究的蛋白去除比较彻底,所得糖纯度较高,也会使糖醛酸的含量提高。
2.2 单糖组成
由图2和表2可知,3个NSP组分均由葡萄糖(glucose, Glc)、甘露糖(mannose, Man)、半乳糖(galactose, Gal)、核糖(ribose, Rib)、鼠李糖(rhamnose, Rha)、岩藻糖(fucose, Fuc)、木糖(xylose, Xyl)、阿拉伯糖(arabinose, Ara)和葡萄糖醛酸(glucuronic acid, Glc-UA)等9种单糖为单元构建的杂多糖。其中Glc、Man、Gal、Rib为NSP的主要单糖组分,Glc-UA为主要的糖醛酸成分。在3个多糖组分中均未检测到果糖(fructose, Fru)、半乳糖醛酸(galacturonic Acid, Gal-UA)、甘露糖醛酸(mannuronic acid, Man-UA)和古罗糖醛酸(guluronic acid, Gul-UA)。
表2 分级醇沉各组分的单糖组成(摩尔比)
Table 2 Monosaccharide composition of fractions obtained by gradient ethanol precipitation (molar ratio)

单糖NSP40NSP60NSP80葡萄糖(Glc)43.0133.6832.59甘露糖(Man)17.5328.0115.09半乳糖(Gal)10.936.663.09核糖(Rib)7.2110.5330.24鼠李糖(Rha)6.558.308.90岩藻糖(Fuc)6.056.713.62木糖(Xyl)4.093.604.70阿拉伯糖(Ara)1.270.591.14果糖(Fru)0.000.000.00葡萄糖醛酸(Glc-UA)3.361.920.63半乳糖醛酸(Gal-UA)0.000.000.00甘露糖醛酸(Man-UA)0.000.000.00古罗糖醛酸(Gul-UA)0.000.000.00
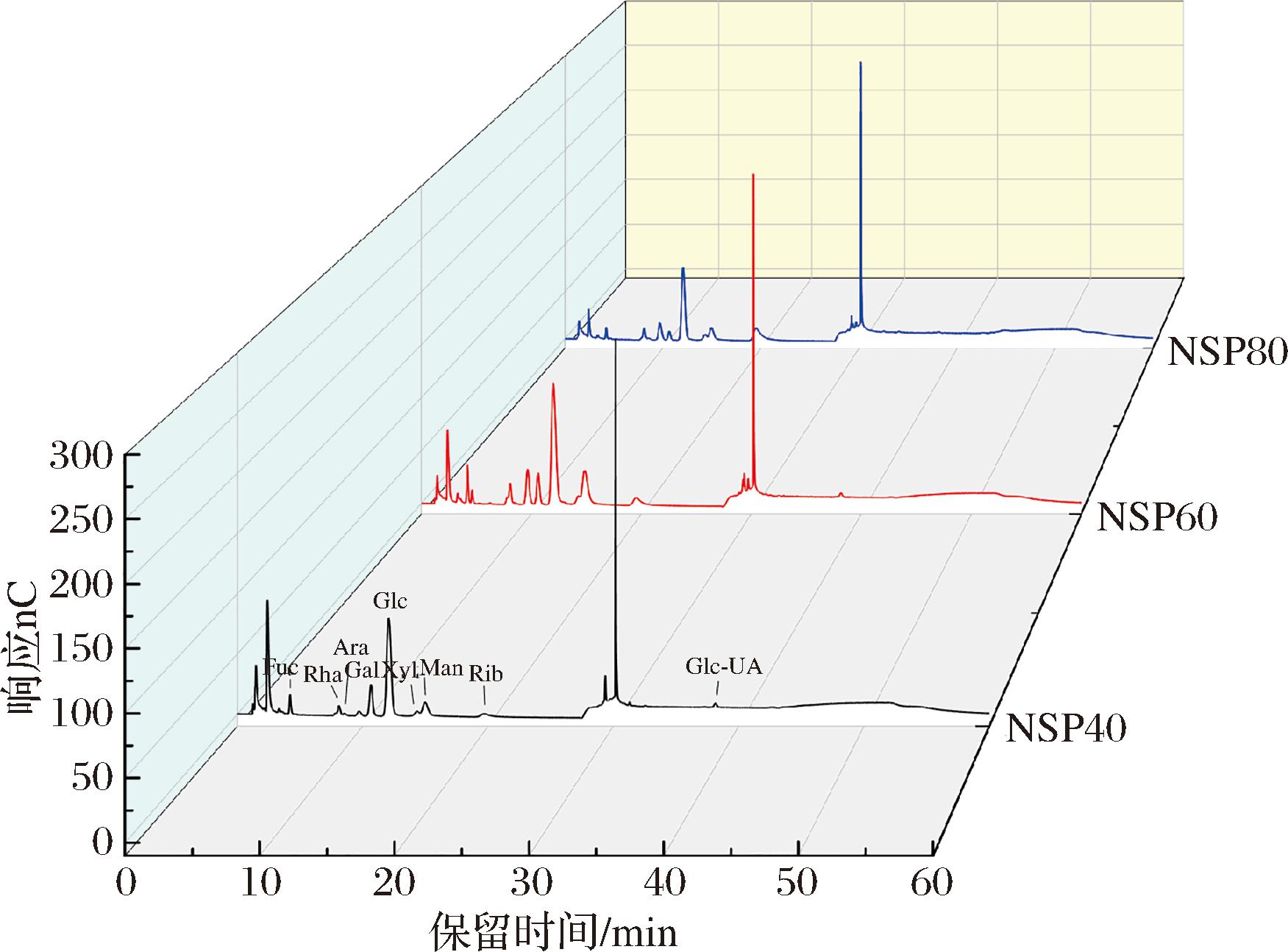
图2 NSP40、NSP60和NSP80的单糖HPLC图
Fig.2 HPLC chromatograms of monosaccharide composition of NSP40, NSP60, and NSP80
虽然3个NSP组分的单糖组成相同,但其摩尔比各不相同。NSP40中Glc∶Man∶Gal∶Rib∶Rha∶Fuc∶Xyl∶Ara∶Glc-UA的摩尔比为43.01∶17.53∶10.93∶7.21∶6.55∶6.05∶4.09∶1.27∶3.36。NSP40中葡萄糖含量最高(43.01%)、甘露糖次之(17.53%)、半乳糖第三(10.93%),而阿拉伯糖含量最低,仅为1.27%。此外,NSP40还含有7.21%的核糖、6.55%鼠李糖、6.05%岩藻糖、4.09%的木糖和3.36%的葡萄糖醛酸。NSP60中Glc、Man和Gal的含量分别为33.68%、28.01%、6.66%;NSP80中三者浓度依次为32.59%、15.09%、3.09%。可见,乙醇体积分数会影响沉淀多糖的单糖组成。这可能与单糖的极性和多糖的结构、极性有关。葡萄糖和半乳糖主要在乙醇体积分数较低时(NSP40)析出,而甘露糖则更多地富集于60%的乙醇中(NSP60)。此外,乙醇体积分数越高,所沉淀的多糖中核糖的比例也越高。当乙醇体积分数增至80%时,核糖的含量达到30.24%,为NSP40的4.19倍。当然,无论乙醇体积分数为多少,葡萄糖均为含量最高的单糖,这主要是由于微拟球藻中最主要的单糖就是葡萄糖[23]。类似的,PANDEIRADA等[23]采用乙醇沉淀微拟球藻多糖,得到的也是杂多糖,且其单糖组成以葡萄糖和甘露糖居多,半乳糖次之,并且也同样未发现果糖。其采用不同体积分数乙醇沉淀的单糖摩尔比也不一样,50%和85%乙醇沉淀所得多糖中Glc∶Man∶Gal的摩尔比分别为34∶5.4∶1.1和4∶26∶5.3。ZHANG等[24]采用乙醇梯度沉淀马尾藻多糖,得到SPP-30、SPP-60、SPP-90均为杂多糖,并且其单糖摩尔比也不同。SPP-30中Glc、Fuc占有较大比例,SPP-60则富含Fuc和Gal,而SPP-90中Glc的摩尔比高达70%以上。可见,乙醇体积分数会影响所沉淀的杂多糖的单糖组成。研究表明,不同提取方法会影响所提取多糖的组分,从而影响所得多糖的物理性质和生物活性[7]。
2.3 多糖分子质量分布
NSP60、NSP40、NSP80 3个粗多糖组分的分子质量分析结果如图3和表3所示。结果表明,所得多糖分子质量分布范围较广,且分布不均。其中,数均分子质量(Mn)最大为NSP60(26.26±0.23) kDa、NSP40次之(12.57±0.23) kDa、NSP80最小(3.15±0.16) kDa。重均分子质量、Z均分子质量和峰值分子质量呈现相同趋势,即NSP60>NSP40>NSP80。此外,多分散指数(Mw/Mn)为2.21~9.59,这说明本研究通过乙醇分级沉淀所提取的多糖为多分散聚集体[22]。其中,NSP60的指数最高,表明其多糖分子质量分布最宽。类似的,ZHANG等[24]采用30%、60%和90%的乙醇梯度沉淀马尾藻多糖,得到了分子质量分布范围较广的杂多糖SPP-30、SPP-60和SPP-90。其中,SPP-30分子质量为3.77~206.73 kDa,SPP-60的分子质量为5.55~189.44 kDa。当乙醇体积分数最高时(SPP-90),所得多糖的分子质量最小(4.92 kDa)。
表3 微拟球藻多糖分子质量的相关参数
Table 3 Related parameters of molecular weight of NSP

样品NSP40NSP60NSP80峰范围/min48.00~60.0034.00~61.0051.00~62.00数均分子质量Mn/kDa12.57±0.2326.26±0.233.15±0.16峰值分子质量Mp/kDa4.76±0.3030.34±0.171.63±0.15重均分子质量Mw/kDa27.79±0.16251.72±0.039.88±0.18Z均分子质量Mz/kDa46.42±0.332 846.71±0.0537.70±0.41多分散指数(Mw/Mn)2.219.593.14
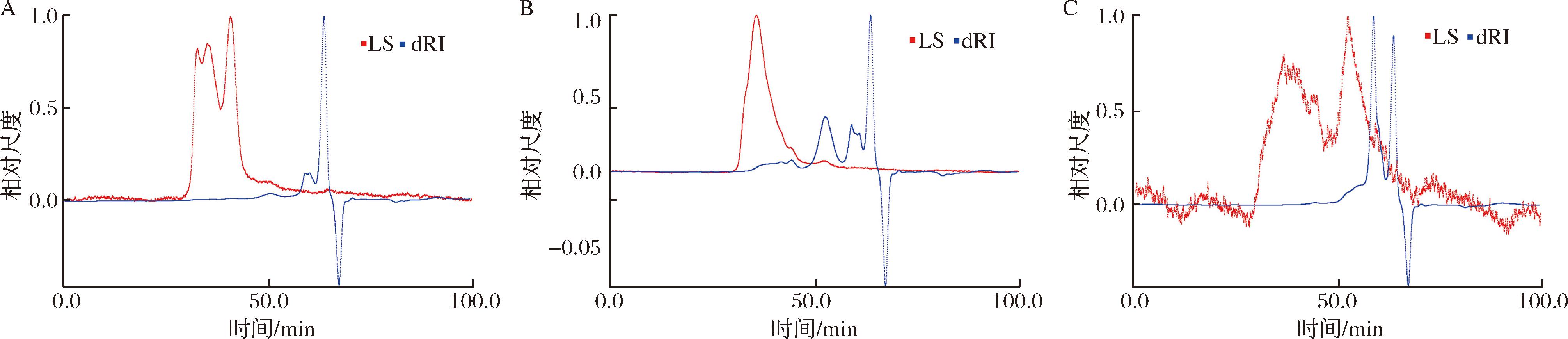
A-NSP40分子质量分布;B-NSP60分子质量分布;C-NSP80分子质量分布
图3 不同部位微拟球藻多糖的分子质量分布
Fig.3 Molecular weight distribution of different fractions of NSP
可见,乙醇体积分数会影响所沉淀多糖的分子质量分布。这可能与多糖的极性有关,多糖的羟基越少,极性越小,亲水性也越小。因此可以通过改变乙醇的体积分数,实现对微拟球藻多糖的初步分离。多糖分子质量大小不仅与多糖的极性有关,还会影响多糖的流变特性,从而影响其生物活性[17]。
2.4 FT-IR
NSP40、NSP60和NSP80在500~4 000 cm-1范围内的FT-IR分析结果如图4所示。可见,采用不同体积分数微拟球藻中沉淀的多糖,其FT-IR谱图的整体趋势相似。其中,3 300 cm-1附近的强宽吸收峰与—OH的伸缩振动有关[25]。1 630 cm-1附近的吸收峰为结合水非晶态区所产生的吸收峰,表明NSP中存在游离的羧酸基团[22]。1 410 cm-1附近的吸收峰由碳氧键的伸缩振动所产生[20]。此外,NSP40、NSP60在1 020 cm-1附近的吸收峰,以及NSP80在1 080 cm-1附近的吸收峰,都与C—O—C或C—O吡喃糖环的伸缩振动有关,表明这3种粗多糖均含有α-吡喃糖环。该结果与ZHANG等[24]的检验结果相似,也发现不同体积分数乙醇沉淀所得多糖的FT-IR谱图趋势一致,具有多糖的特征吸收峰[20,22,24]。
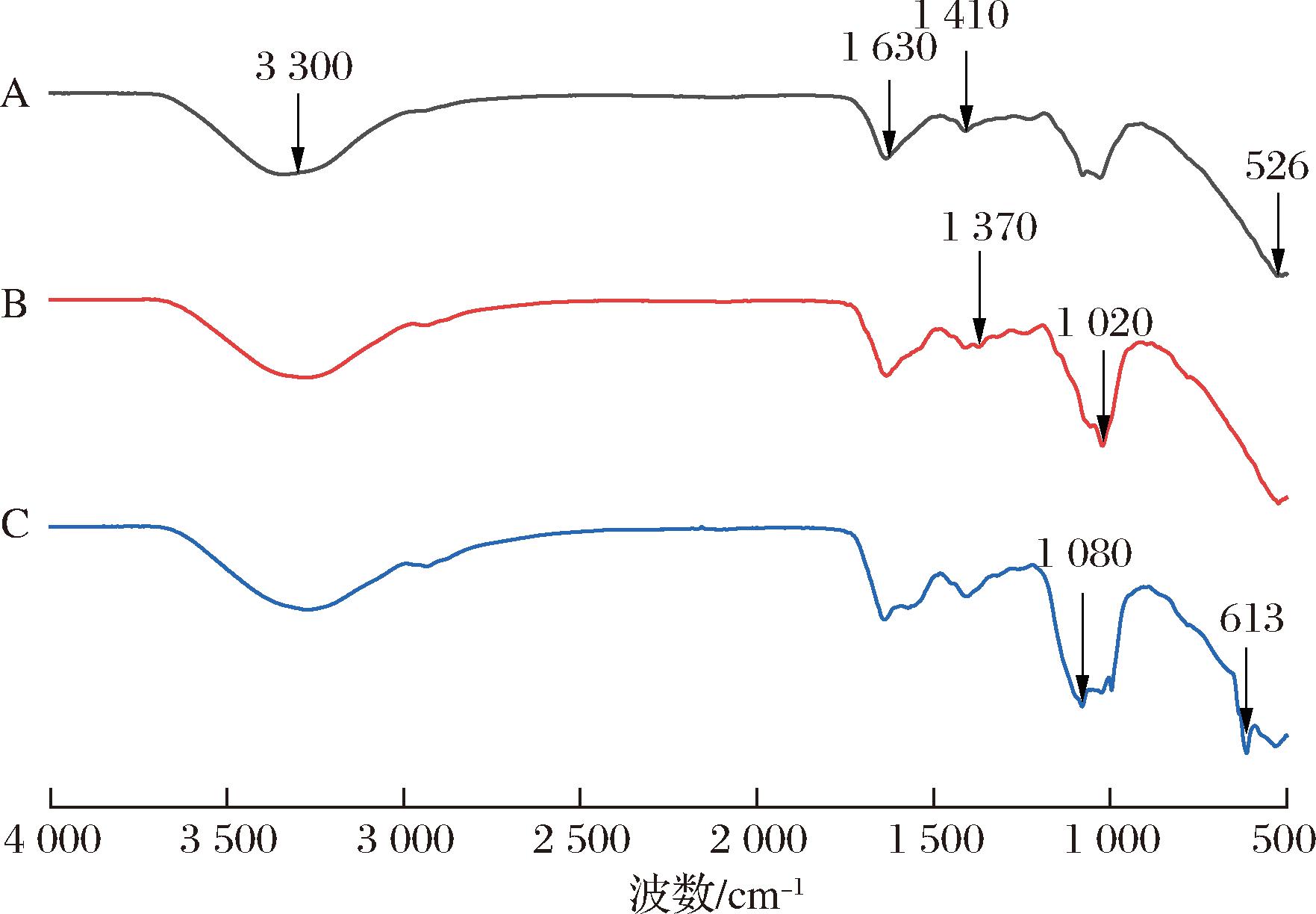
A-NSP40;B-NSP60;C-NSP80
图4 NSP在500~4 000 cm-1范围内的FT-IR光谱
Fig.4 FT-IR spectra of NSP fractions from 500 to 4 000 cm-1
2.5 流变特性
分别配制NSP40、NSP60和NSP80 3种多糖溶液,测其在2 mg/mL时的表观黏度。由图5可知,3种NSP水溶液的表观黏度随剪切速率的增加而逐渐减小。剪切应力随剪切速率的增加而逐渐增大,其流动特性表现为当施加外力使其流动,则具有剪切变稀的特点。3种NSP多糖溶液的表观黏度都很符合非牛顿流体的Power-law幂律模型[17],即黏度函数是剪切速率绝对值的一个指数函数,并且三者的n值都小于1,这表明在剪切速率(1~100 s-1)范围内,3种NSP水溶液均符合非牛顿流体的性质,属于假塑性流体。在相同剪切速率下,NSP60的黏度是3种NSP中最高的。这种差异可能是由于多糖含量较高,而大量的多糖能够紧密地形成交联结构,从而增加了黏度。分子质量对其活性非常重要,对黏度也有显著影响。如表3可知,NSP60的分子质量远高于NSP40和NSP80,其重均分子质量甚至是后两者的10倍以上。与其他2种多糖相比,高分子质量的NSP60黏度较高,表明多糖的黏度与其分子质量密切相关[17]。
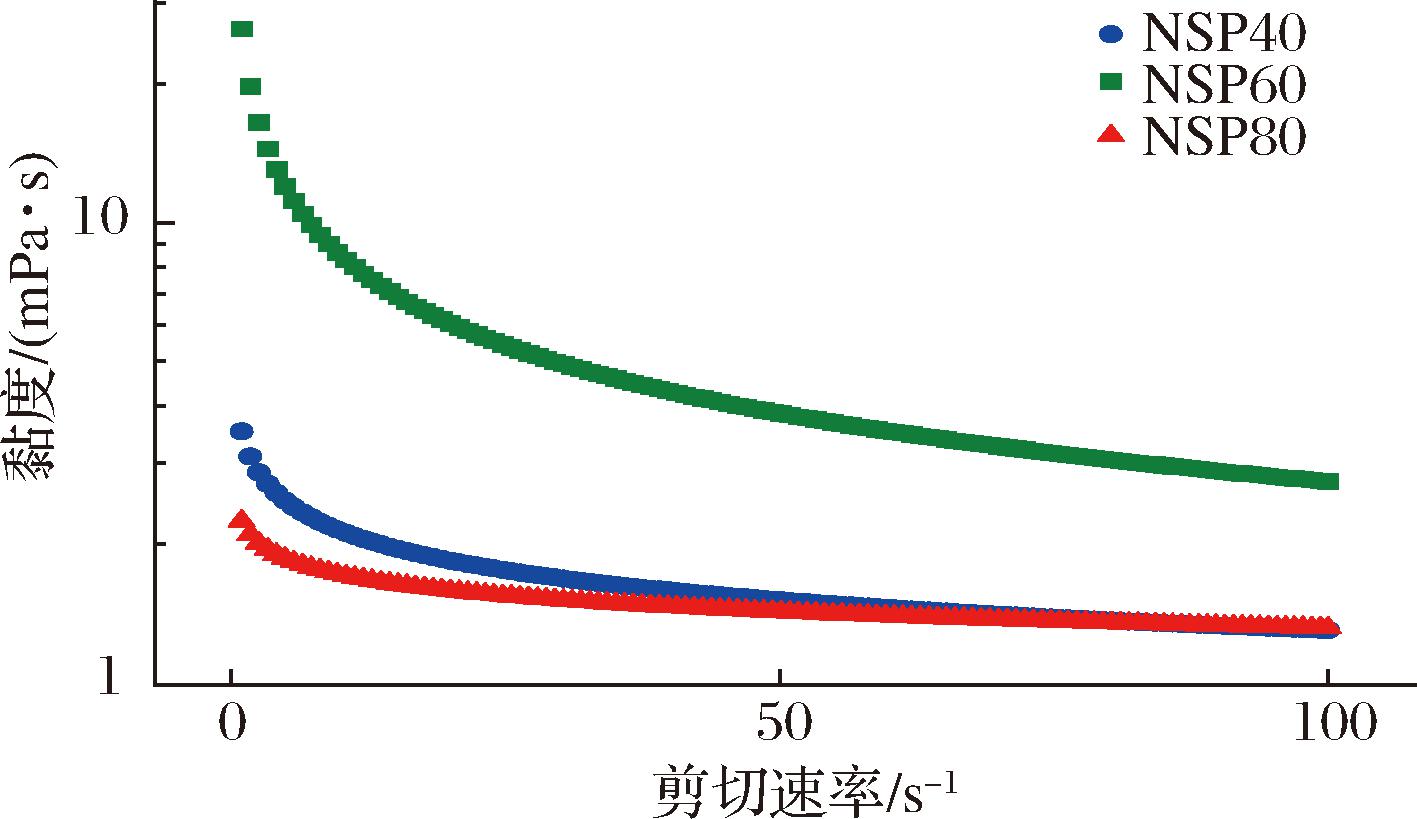
图5 三种NSP多糖水溶液的黏度-剪切速率曲线
Fig.5 Viscosity-shear rate curves of aqueous solutions of three NSP polysaccharides
类似的,WANG等[22]也发现不同体积分数的乙醇分离的大豆壳多糖(SHSP20、SHSP40和SHSP60)的表观黏度也与剪切速率呈负相关。并且,表观黏度最高的多糖也是由中等乙醇体积分数沉淀所得。不同的是,SHSP40和SHSP60具有相似的流动特性,而本研究中具有相似流动特性的则是NSP40和NSP80。这可能是由于不同来源的多糖其组成和分子质量不同,以及分子之间的链刚度有差异,使得最终所产生的多糖黏度不同。
2.6 抗氧化活性
2.6.1 羟自由基清除能力
分别对3种多糖清除羟自由基的能力进行评价,以抗坏血酸为阳性对照。由图6可知,NSP多糖对羟自由基的清除能力在0.008~10 mg/mL的质量浓度范围内呈现剂量依赖性,且当质量浓度达到10 mg/mL时,3种多糖组分清除羟自由基的能力均达到95%以上,与抗坏血酸相近。在较低质量浓度时(0.2 mg/mL),NSP40、NSP60和NSP80对羟自由基的抑制率分别为(24.10±1.50)%、(9.52±2.62)%和(9.51±2.45)%;NSP40清除羟自由基的能力最佳,是NSP60和NSP80的2.11倍以上。当质量浓度增加至1.0 mg/mL时,NSP40、NSP60和NSP80对羟自由基的清除能力分别增至(32.11±4.24)%、(31.62±0.64)%和(18.77±1.97)%,分别是同浓度下抗坏血酸清除能力的49.59%、48.83%和28.99%。其中,NSP80对羟自由基的清除能力略低于同浓度下的金瓜多糖CP-60、CP-70[26]和辣木籽粗多糖[27]。这说明多糖来源、提取分离多糖的方式均会对多糖的羟自由基清除能力产生影响。

图6 羟自由基的清除能力
Fig.6 Hydroxyl radical scavenging activity
2.6.2 ABTS阳离子自由基清除能力
进一步对3种多糖组分清除ABTS阳离子自由基的能力进行评价,结果如图7所示。当质量浓度达到10 mg/mL时,NSP40对ABTS阳离子自由基的清除能力最佳(38.18±3.67)%,NSP60次之(31.91±2.25)%,NSP80最弱(24.86±0.68)%,分别为相同浓度下抗坏血酸的48.52%、40.55%和31.60%。当质量浓度为5 mg/mL时,3种NSP多糖的ABTS阳离子自由基清除率均略低于滑菇多糖[28](最低约20%)和4 mg/mL的败酱草多糖[8][最低为(43.5±1.6)%]。NSP多糖的ABTS阳离子自由基清除率低于滑菇多糖和败酱草多糖可能与多糖来源和提取条件的差异等因素有关。
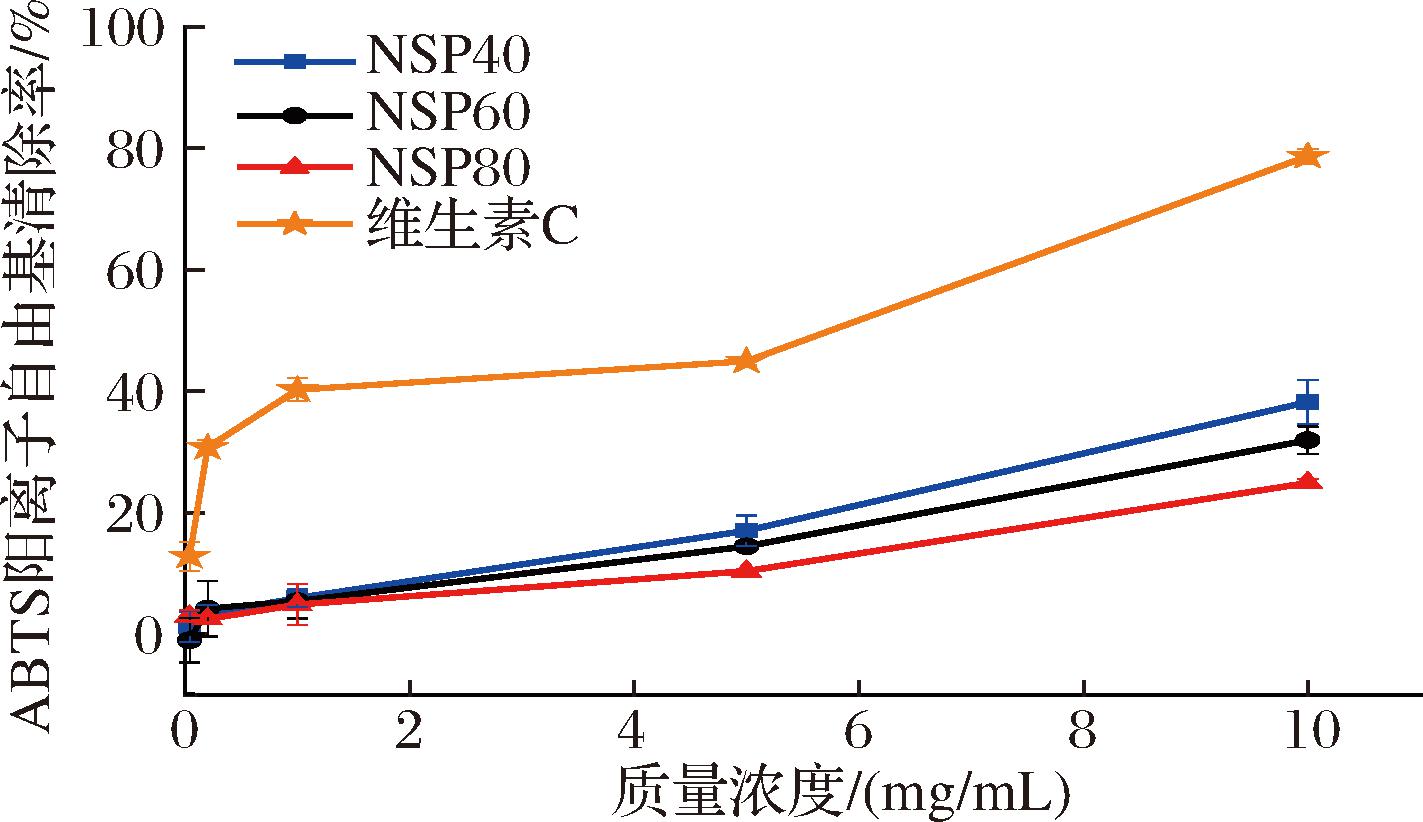
图7 ABTS阳离子自由基清除能力
Fig.7 ABTS cationic radical scavenging activity
2.6.3 总还原力
由图8可知,NSP40、NSP60、NSP80的还原能力随着质量浓度的增加而增加,并且在考察浓度范围内(0.04~10.0 mg/mL)存在线性关系(R2≥0.99)。当质量浓度达到10 mg/mL时,NSP40、NSP60、NSP80的吸光度分别为0.478±0.016、0.558±0.017、0.315±0.006。对比葛志超[29]研究的裸藻多糖的还原力,裸藻多糖在10 mg/mL时还原力为0.17,同一浓度下长松藻多糖的吸光度为0.07[30],可见,NSP多糖的总还原力高于裸藻多糖和长松藻多糖。在质量浓度<10.0 mg/mL时,裸藻多糖和长松藻多糖的还原力也存在线性关系,呈现剂量依赖性。而NSP多糖的还原力也呈现剂量依赖性,这与之前的研究结果一致[30],但本研究的线性关系较好(R2≥0.99)。

图8 总还原力
Fig.8 Total reducing power
3 结论
采用不同乙醇体积分数(40%、60%和80%)分级沉淀微拟球藻多糖,总多糖得率为(4.89±0.21)%,多糖析出量、总糖含量均随乙醇体积分数的增加而增加(P<0.05)。当乙醇体积分数达80%时,所得的NSP80得率和总糖含量最高,分别为(3.48±0.04)%和(74.43±0.76)%。乙醇体积分数对所沉淀粗多糖的硫酸根含量影响不大(8.27%~9.15%),却显著影响多糖的糖醛酸含量。其中,NSP60的含量最高,为(46.96±0.01)%,分别为NSP40和NSP80的1.84倍和2.58倍。3个NSP组分均为Glc、Man、Gal、Rib、Rha、Fuc、Xyl、Ara和Glc-UA等9种单糖为单元构建的杂多糖。各组分间的单糖摩尔比差异较大,说明乙醇体积分数会影响NSP的单糖组成。多糖的平均分子质量大小依次为:NSP60>NSP40>NSP80,即乙醇体积分数最高的多糖平均分子质量最低。可见,可以采用分级醇沉法对微拟球藻多糖进行初步分离纯化。在相同剪切速率下(1~100 s-1),NSP60的黏度是所有NSP中最高的,这可能是其多糖含量和分子质量较高所导致的。
抗氧化分析结果表明,分级醇沉的3种多糖均有一定的抗氧化能力,且羟自由基清除能力较强。当质量浓度达到10 mg/mL时,3种多糖组分对羟自由基的清除率甚至与抗坏血酸相当。此外,NSP40对ABTS阳离子自由基和羟自由基的清除能力强于NSP60和NSP80,但NSP60的总还原力强于NSP40和NSP80。这些结果表明,微拟球藻多糖具有较强的抗氧化活性,其残渣具有一定的回收价值,提取的多糖有望用于功能食品生产、保健品开发等领域。
[1] CHEN Y X, LIU X Y, XIAO Z, et al.Antioxidant activities of polysaccharides obtained from Chlorella pyrenoidosa via different ethanol concentrations[J].International Journal of Biological Macromolecules, 2016, 91:505-509.
[2] 严尚隆, 潘创, 杨贤庆, 等.长松藻多糖降解、结构表征及降血糖活性测定[J].食品与发酵工业, 2021, 47(18):119-126.YAN S L, PAN C, YANG X Q, et al.Degradation, structural characterization and hypoglycemic activity of polysaccharides from Codium cylindricum[J].Food and Fermentation Industries, 2021, 47(18):119-126.
[3] 宁利敏, 朱玉翠, 于光, 等.几种海藻功能寡糖的结构、制备、活性与应用研究进展[J].海洋科学, 2021, 45(2):144-151.NING L M, ZHU Y C, YU G, et al.Recent advances in the structure, preparation, activity, and application of several marine seaweed functional oligosaccharides[J].Marine Sciences, 2021, 45(2):144-151.
[4] TOUNSI L, HENTATI F, BEN HLIMA H, et al.Microalgae as feedstock for bioactive polysaccharides[J].International Journal of Biological Macromolecules, 2022, 221:1 238-1 250.
[5] GOUDA M, TADDA M A, ZHAO Y L, et al.Microalgae bioactive carbohydrates as a novel sustainable and eco-friendly source of prebiotics:Emerging health functionality and recent technologies for extraction and detection[J].Frontiers in Nutrition 2022, 9:806692.
[6] XU S Y, HUANG X S, CHEONG K L.Recent advances in marine algae polysaccharides:Isolation, structure, and activities[J].Marine Drugs, 2017, 15(12):388.
[7] JIA Y N, GAO X D, XUE Z H, et al.Characterization, antioxidant activities, and inhibition on α-glucosidase activity of corn silk polysaccharides obtained by different extraction methods[J].International Journal of Biological Macromolecules, 2020, 163:1640-1648.
[8] HUI H P, GAO W J.Physicochemical features and antioxidant activity of polysaccharides from Herba Patriniae by gradient ethanol precipitation[J].Arabian Journal of Chemistry, 2022, 15(5):103770.
[9] LIAO H P, LIU P Q, DENG Y Y, et al.Feeding effects of low-level fish meal replacement by algal meals of Schizochytrium limacinum and Nannochloropsis salina on largemouth bass (Micropterus salmoides)[J].Aquaculture, 2022, 557:738311.
[10] CAMACHO F, MACEDO A, MALCATA F.Potential industrial applications and commercialization of microalgae in the functional food and feed industries:A short review[J].Marine Drugs, 2019, 17(6):312.
[11] XU Y.Biochemistry and biotechnology of lipid accumulation in the microalga Nannochloropsis oceanica[J].Journal of Agricultural and Food Chemistry, 2022, 70(37):11500-11509.
[12] 李洁琼, 刘红全, 袁莎.微藻多糖的研究进展[J].现代化工, 2016, 36(6):60-62.LI J Q, LIU H Q, YUAN S.Research progress of microalgae polysaccharide[J].Modern Chemical Industry, 2016, 36(6):60-62.
[13] CAETANO P A, DO NASCIMENTO T C, FERNANDES A S, et al.Microalgae-based polysaccharides:Insights on production, applications, analysis, and future challenges[J].Biocatalysis and Agricultural Biotechnology, 2022, 45:102491.
[14] 李菀, 胡月, 李光霞, 等.纤维素酶和果胶酶提取对甘草渣多糖抗氧化和抗肿瘤性能的影响[J].食品工业科技, 2020, 41(9):309-313;319.LI W, HU Y, LI G X, et al.Effects of cellulase and pectinase extraction on the antioxidant and antitumor activities of licorice residue polysaccharide[J].Science and Technology of Food Industry, 2020, 41(9):309-313;319.
[15] 何美佳, 刘晓, 唐翠翠, 等.多糖脱蛋白方法的研究进展[J].中国海洋药物, 2019, 38(3):82-86.HE M J, LIU X, TANG C C, et al.Research progress on the methods for deproteinization of polysaccharide[J].Chinese Journal of Marine Drugs, 2019, 38(3):82-86.
[16] 李美凤, 袁明昊, 邹仕赟, 等.松露多糖的提取、分离纯化和结构鉴定[J].食品与发酵工业, 2020, 46(16):196-200.LI M F, YUAN M H, ZOU S Y, et al.Extraction, separation, purification and structure identification of polysaccharides from truffles[J].Food and Fermentation Industries, 2020, 46(16):196-200.
[17] ZHU H, XU L, WANG J, et al.Rheological behaviors of ethanol-fractional polysaccharides from Dendrobium officinale in aqueous solution:Effects of concentration, temperature, pH, and metal ions[J].Food Hydrocolloids, 2023, 137:108311.
[18] 王宝贝, 邱颖辉, 陈玟璇, 等.小球藻对青稞面包品质的影响及其抗氧化特性[J].食品与发酵工业, 2019, 45(23):157-162.WANG B B, QIU Y H, CHEN W X, et al.Effects of Chlorella on the quality of highland barley bread and its antioxidant properties[J].Food and Fermentation Industries, 2019, 45(23):157-162.
[19] 李顺峰, 刘丽娜, 王安建, 等.分级醇沉香菇柄多糖及其抗氧化活性研究[J].包装与食品机械, 2020, 38(4):10-15.LI S F, LIU L N, WANG A J, et al.Study on gradient ethanol precipitation of Lentinula edodes stipe polysaccharide and their antioxidant activities[J].Packaging and Food Machinery, 2020, 38(4):10-15.
[20] ZHANG F S, RAN C X, ZHENG J, et al.Polysaccharides obtained from bamboo shoots (Chimonobambusa quadrangularis) processing by-products:New insight into ethanol precipitation and characterization[J].International Journal of Biological Macromolecules, 2018, 112:951-960.
[21] JIA Y N, XUE Z H, WANG Y J, et al.Chemical structure and inhibition on α-glucosidase of polysaccharides from corn silk by fractional precipitation[J].Carbohydrate Polymers, 2021, 252:117185.
[22] WANG S N, ZHAO L L, LI Q H, et al.Rheological properties and chain conformation of soy hull water-soluble polysaccharide fractions obtained by gradient alcohol precipitation[J].Food Hydrocolloids, 2019, 91:34-39.
[23] PANDEIRADA C O, MARICATO É, FERREIRA S S, et al.Structural analysis and potential immunostimulatory activity of Nannochloropsis oculata polysaccharides[J].Carbohydrate Polymers, 2019, 222:114962.
[24] ZHANG K, YUAN D, LI C, et al.Physicochemical properties and bioactivity of polysaccharides from Sargassum pallidum by fractional ethanol precipitation[J].International Journal of Food Science and Technology, 2021, 56(7):3 536-3 545.
[25] 何婷婷, 柴军红, 钟读波, 等.蒲公英活性成分提取工艺的优化、多糖红外表征及其抗氧化性[J].江苏农业科学, 2018, 46(11):163-166.HE T T, CHAI J H, ZHONG D B, et al.Study on optimization of extraction process for active components from dandelion, IR characterization of polysaccharide and its antioxidant activity[J].Jiangsu Agricultural Sciences, 2018, 46(11):163-166.
[26] 陈冰洁, 乔勇进, 王晓, 等.金瓜多糖不同分级组分的抗氧化和降血糖活性[J].食品与机械, 2023, 39(7):165-171.CHEN B J, QIAO Y J, WANG X, et al.Antioxidant and hypoglycemic activities of different graded fractions of polysaccharide from goldenmelon[J].Food and Machinery, 2023, 39(7):165-171.
[27] 李玲玲, 徐妍然, 牛延菲, 等.辣木籽粗多糖的分级提取及抗氧化活性研究[J].中国油脂, 2024,49(7):124-129.LI L L, XU Y R, NIU Y F, et al.Graded extraction and antioxidant activity of crude polysaccharides from Moringa oleifera seeds[J].China Oils and Fats, 2024,49(7):124-129.
[28] CHOU C H, SUNG T J, HU Y N, et al.Chemical analysis, moisture-preserving, and antioxidant activities of polysaccharides from Pholiota nameko by fractional precipitation[J].International Journal of Biological Macromolecules, 2019, 131:1 021-1 031.
[29] 葛智超. 裸藻多糖的分离纯化及活性研究[D].上海:上海海洋大学, 2020.GE Z C.Study on the isolation, purification and activity of poilsaccharide from Euglena gracilis[D].Shanghai:Shanghai Ocean University, 2020.
[30] 严尚隆. 长松藻多糖降解、结构解析及生物活性研究[D].上海:上海海洋大学, 2021.YAN S L.Degradation, structure analysis and biological activity of polysaccharides from Codium cylindricum[D].Shanghai:Shanghai Ocean University, 2021.