苹果果肉褐变的速度过快会直接缩短苹果的贮藏期、增加产品加工成本[1-2]。作为果品加工贮藏中较为普遍的现象,褐变也会直接影响果实的外观、鲜食的口感等,明显降低其商品价值[3-4]。褐变问题已成为制约苹果加工和贮藏的主要障碍之一,因其造成的园艺产品损失占全年总损失的50%以上[5]。有酶参与的褐变为酶促褐变,没有酶参与的褐变称为非酶促褐变。苹果主要发生的褐变为酶促褐变,过程为以酚类物质作为底物,在多酚氧化酶(polyphenol oxidase, PPO)的催化下被氧化为初始产物邻苯醌,进一步聚合形成可见光吸收的色素,导致褐变[6-7]。PPO作为果实发生褐变的主要内源酶。同时,相关研究表明,果品的酶促褐变还与绿原酸和总酚的含量呈相关性[8]。酶促褐变需要活性氧(reactive oxygen species, ROS)参与,氧气不能直接参与反应。植物的生长过程中ROS的产生与消除都处在动态平衡的状态[9]。果品的破损、切分等外界环境具有胁迫作用,动态平衡会被打破导致ROS大量积累,加速褐变的发生[10]。
OPAL苹果于1999年在欧洲被发现,其是用金冠和黄玉配置亲本组合,通过杂交育种选育出的苹果品种,也是美国第一个通过非转基因的苹果品种。在果园生产和实验中发现,OPAL苹果具有黄玉品种的抗病性,果实果形正、果汁饱满等特点。其果皮大面积为黄色,成熟后果面少有泛浅红,果茎呈深褐色,口感清脆,带有浓郁香味,受到消费者的喜爱。在欧洲、新西兰和南非等地均有一定面积的种植,是值得推广种植的苹果品种。其主要优点是其褐变速度较为缓慢,可以有效地提高果实加工时的品质。
本研究以OPAL苹果为实验材料,通过比较OPAL与金冠苹果、富士苹果的表观特点、相关酶活力,以及利用超高效液相色谱-高分辨质谱(ultra-high-performance liquid chromatography coupled with linear ion trap-Orbitrap mass spectromet, UHPLC-LTQ-Orbitrap MS)技术进行非靶向代谢分析,筛选出有关于褐变的代谢产物,对比分析其褐变机理,探究OPAL苹果果肉褐变延迟的生理机制,有助于减少切面变色、失水、果肉软化等现象对果品加工产生负面影响、提高果品加工率。
1 材料与方法
1.1 材料与试剂
实验材料种植于宁夏回族自治区银川苹果试验站,在种植OPAL、金冠和富士苹果这3个品种的果树中选择生长情况、树势较为一致的,采收果形大小相似,成熟度相同,无机械损伤、无病虫害的健康果实。每个品种按照鲜切后0、3、6、9、12、24、36、72 h这个8个处理取样,其中12、24、36 h处理设置12个重复,其余每个处理设置6个重复。设定金冠为A组、OPAL为B组、金冠为C组。样品均经液氮冷冻处理后,在-80 ℃冰箱内保存待用。
Solarbio BC0190 多酚氧化酶试剂盒,北京索莱宝科技有限公司;甲醇、乙腈(均为色谱级),上海麦克林生化科技股份有限公司。
1.2 仪器与设备
分光光度计-UV2600,上海天美科学仪器有限公司;SCIENTZ-48高通量组织研磨器,上海鑫翁科学仪器有限公司;1100MSD 液质联用仪,美国加利福尼亚州 Agilent安捷伦科技公司。
1.3 实验方法
1.3.1 PPO酶活力的测定
PPO活力检测,利用试剂盒,将苹果样本称取约0.1 g,加入1 mL提取液进行冰浴匀浆。8 000 r/min 4 ℃离心10 min,取上清溶液,置于冰上待测。将分光光度计调至410 nm,蒸馏水调零。按照试剂盒说明配制测定管和对照管试剂,25 ℃水浴10 min,迅速放入沸水中加热10 min,冷却后,5 000 r/min常温离心10 min,收集上清溶液,在410 nm处检测对照管和测定管的吸光度,计算PPO酶活力。
1.3.2 代谢物的提取
3个苹果品种的3个时期(鲜切后12、24、36 h)处理分别取50 mg冷冻样本,加入1 000 μL含有内标的提取液[V(甲醇)∶V(乙腈)∶V(水)=2∶2∶1,内标质量浓度20 mg/L],涡旋混匀30 s,加入钢珠,45 Hz研磨仪处理10 min,超声10 min(冰水浴)。
利用代谢组学分析的液质联用系统进行上机检测,使用MassLynx V4.2采集的原始数据通过Progenesis QI软件做峰提取、峰对齐等数据处理操作,基于Progenesis QI软件在线METLIN数据库进行鉴定,同时进行理论碎片识别。
1.3.3 代谢物数据分析
对于所获得的数据进行主成分分析(principal component analysis, PCA)和样本的相关性分析来比较重复性和差异性,通过正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)方法筛选显著的代谢产物并进行代谢物分析,利用HMDB(human metabolome data base)和KEGG数据库对于差异代谢物进行功能性研究分析,获得相关生物学通路的数据。
1.4 数据分析
采用IBM SPSS17.0统计软件进行单因素方差分析(ANOVA)及显著性分析,使用Origin 64、TB tools软件进行数据的汇总和绘图。
2 结果与分析
2.1 果实褐变对果实品质影响
如图1所示,果实在鲜切后放置9、24、36 h的对比中,可以发现在不同时期富士苹果的褐变程度都要略大于OPAL品种,主要表现在苹果果肉颜色的褐化深于OPAL、在放置36 h后富士苹果果实果皮皱缩程度略大于OPAL。

图1 富士和OPAL苹果鲜切后不同时期褐变特征
Fig.1 Browning characteristics of Fuji apples and OPAL apples in different periods after fresh cutting
2.2 PPO活力
PPO是影响酶促褐变反应的关键酶,品种不同其酶活力的变化也不同。如图2所示,OPAL苹果在各时期酶活力要低于金冠和富士2个品种的变化趋势,在鲜切放置9 h后,OPAL的PPO酶活力要显著低于其他2个品种,酶活力为金冠PPO活力的64%、富士PPO活力的67%。
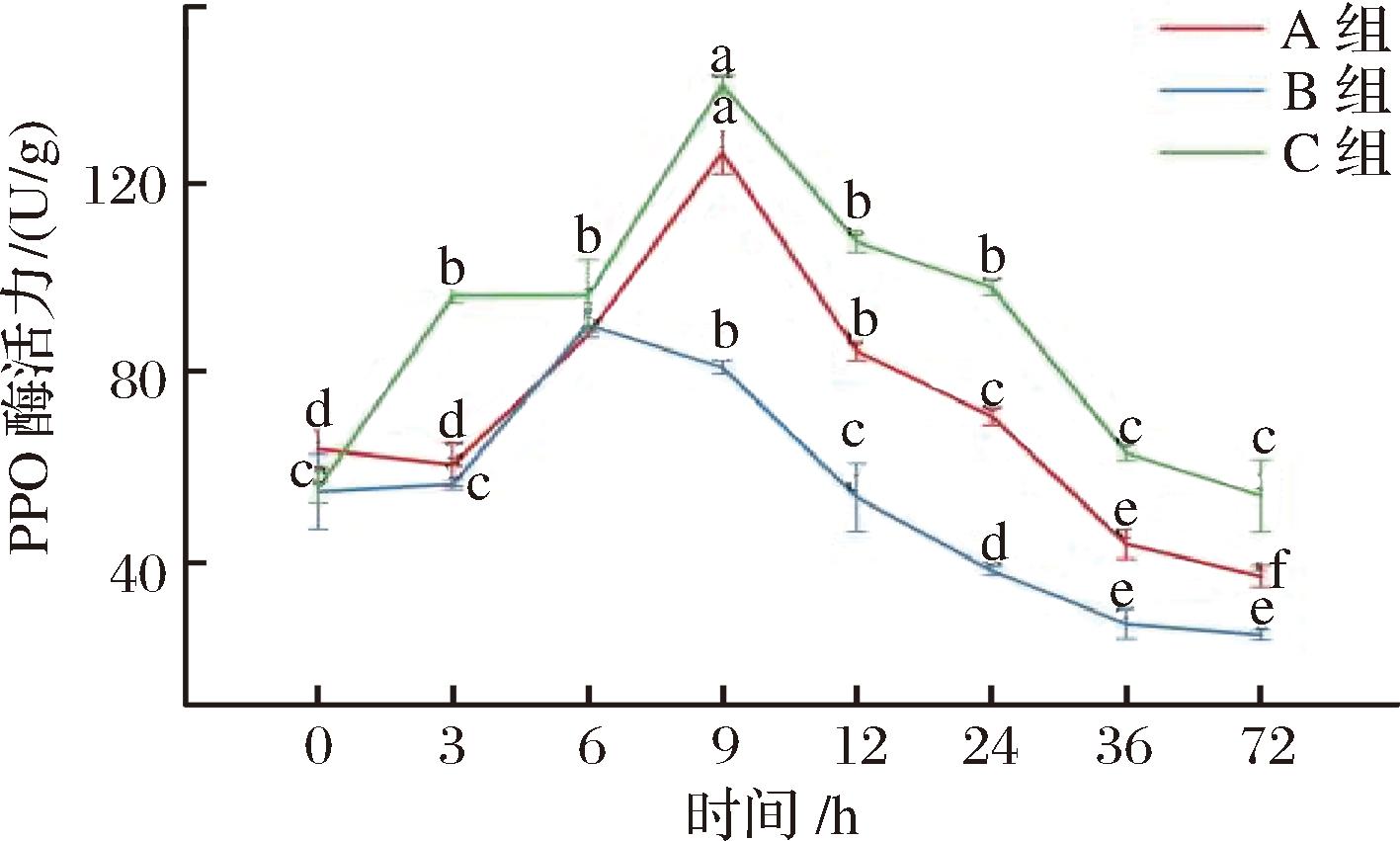
图2 金冠、OPAL、富士不同贮藏时期PPO酶活力变化
Fig.2 Changes of PPO enzyme activity in Golden Delicious, OPAL and ‘Fuji’ during different storage period
注:图中A组表示金冠,B组为OPAL,C组为富士苹果(下同), 以下简称A、B、C。不同小写字母表示差异显著(P<0.05)(下同)。
2.3 苹果品种非靶向代谢组学分析
如图3-a所示,对3个苹果品种鲜切后12、24、36 h的代谢产物进行差异性分析,主要参考VIP、FC、P-value等参数。PCA显示共存在2个主要成分,第一主成分的贡献率为44.55%(PC1),第二主成分的贡献率为26.78%(PC2)。可以明显看出3个品种间存在显著的区别,每个品种也有显著的聚类趋势。利用OPLS-DA模型过滤掉部分代谢物后,进一步探测OPAL苹果的生物标志物,得到更可靠的组间差异和相关性。如图3-b和图3-c所示,所有样本均落在置信区间内,无任何重叠、均位于图的两侧。样品彼此完全分离,空间上可以完全区分,呈现明显的聚类趋势,说明模型具有较高的稳定性和较好的分辨性。通过交叉验证对于偏最小二乘法判别分析 (partial least squares discriminant analysis,PLS-DA)模型进行验证,如图3-d和图3-e所示,金冠与OPAL、OPAL与富士2组数据的PLS-DA置换检验图对X变量数据的可解释度R2X,对Y变量数据的可解释度R2Y,模型可预测度Q2,分别为0.673、0.994、0.987和0.78、0.999、0.996。参数值均大于0.5,说明在代谢物种类及数量上存在明显差异,均属于出色可靠的模型。

a-三个品种PCA图; b、c-三个品种OPLS-DA对比图;d-金冠与OPAL的PLS-DA置换检验图;e-OPAL与富士的PLS-DA置换检验图
图3 苹果差异代谢物的表达分析
Fig.3 Expression analysis of differential metabolites
注:图a中的A-1为金冠苹果鲜切后12h,A-2为金冠苹果鲜切后24h,A-3为金冠苹果鲜切后36h;B、C同理。 A-1-1,2,3表示同组的生物学重复(下同)。
2.4 不同苹果品种差异代谢功能性分析
以重要性投影(variable importance in project, VIP)和差异性倍数(VIP>1、FC>2)作为标准,进行筛选。OPAL苹果共筛选出893个差异代谢物,其中上调表达的有378个、下调表达的差异代谢物有515个。
如图4-a所示,通过与HMDB数据库进行代谢物比对,获得差异代谢物分类信息。发现差异代谢物主要集中在脂质和类脂分子中,占比为(65.49%),其余代谢物分类占比较大的有苯基丙烷和聚酮(23.24%)和有机酸及其衍生物(4.23%)。由此表明,OPAL苹果褐变的反应是连续的,此过程发生变化的代谢物主要有脂质和类脂分子、苯基丙烷和聚酮、有机酸及其衍生物。
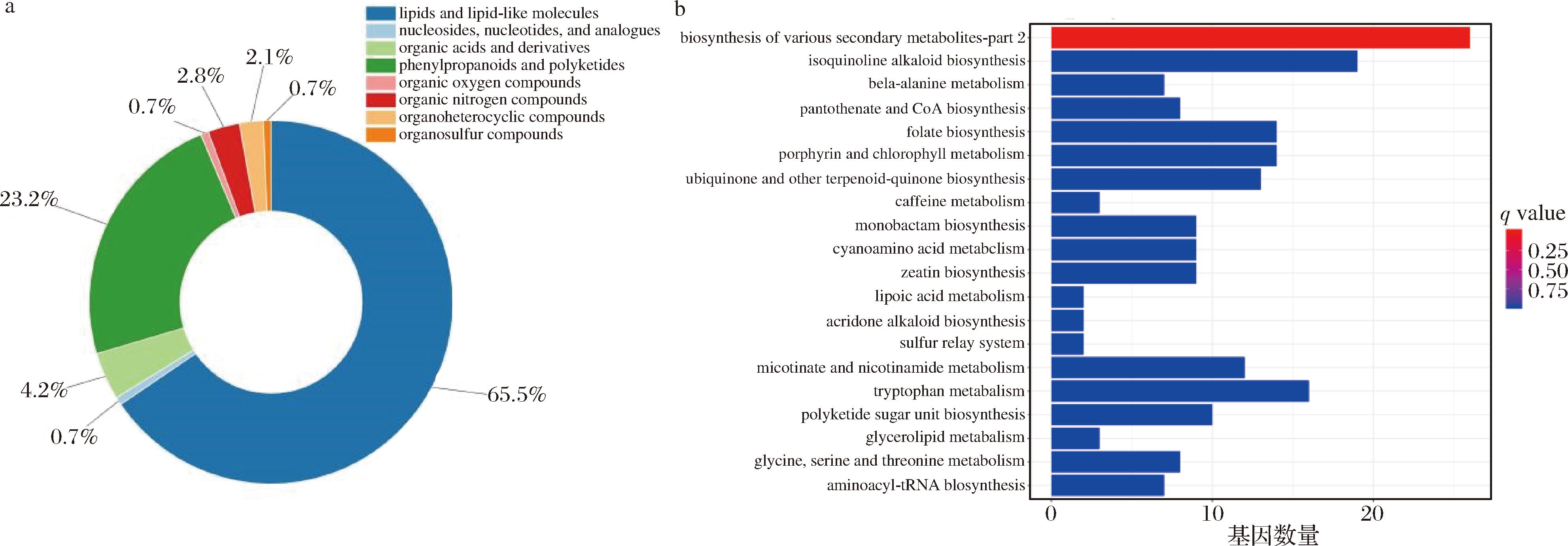
a-HMDB分类图;b-KEGG功能注释图
图4 OPAL苹果差异代谢物HMDB分类图和KEGG功能注释图
Fig.4 HMDB classification diagram of OPAL Apple differential metabolites, KEGG functional annotation diagram
注: a图中英文名称翻译为:lipids and lipid-like molecules(脂类和类脂分子);nucleosides, nucleotides, and analogues(核苷、核苷酸和类似物); organic acids and derivatives(有机酸及其衍生物);phenylpropanoids and polyketides(苯丙烷和聚酮);organic oxygen compounds(有机含氧化合物) organic nitrogen compounds(有机含氮化合物);organoheterocyclic compounds(有机杂环化合物);organosulfur compounds(有机硫化合物), b图中的英文名称翻译为:biosynthesis of various secondary metabolites·part 2(各种次生代谢产物合成 第2部分);isoquinoline alkaloid biosynthesis (异喹啉生物碱生物合成);beta-alanine metabolism(β-丙氨酸代谢);pantothenate and coa biosynthesis(泛酸和辅酶a生物合成);folate biosynthesis (叶酸合成);porphyrin and chlorophyll metabolism(卟啉和叶绿素代谢);ubiquinone and other terpenoid-quinone biosynthesis(泛醌和其他萜类醌生物 合成);cafleine metabolism(咖啡碱代谢);monobactam biosynthesis(单巴坦生物合成);cyanoamino acid metabolism(氰胺酸代谢);zeatin biosynthesis (玉米蛋白生物合成);lipoic acid metabolism(硫辛酸代谢);acridone alkaloid biosynthesis(吖啶酮生物碱生物合成);sultfur relay system(硫磺继 电器系统);nicotinate and nicotinamide metabolism(烟酸和烟酰胺代谢);tryptophan metabolism(色氨酸代谢);poyketide sugar unit biosynthesis (聚酮糖单元生物合成);glycerolipid metabolism(甘油脂代谢);glycine,serine and threonine metabolism(甘氨酸、丝氨酸和苏氨酸代谢); aminoacyl-tRNA biosynthesis(氨基酰基-tRNA生物合成)。
将已筛选出的代谢通过KEGG Pathway数据库进行比对,找到其参加的代谢通路,如图4-b所示,筛选到OPAL代谢物中主要以各种次生代谢产物的生物合成、甜菜碱生物合成、叶酸生物合成、异喹啉生物碱生物合成、色氨酸代谢等代谢通路为主。
2.5 褐变相关代谢物筛选
根据差异代谢物HMDB分类分析和KEGG功能通路分析,OPAL苹果的代谢模式与其他2个品种相比存在较大差异。对3个品种代谢物中有机氧化合物类别和苯丙类和聚酮类代谢物进行了聚类层次分析,聚类分析结果如图5所示,OPAL苹果中的有机氧化合物:熊果苷、葡萄糖香草醛和绿原酸的含量较其他2个品种,呈明显下调,大多数有机氧化合物也皆呈下调趋势。但在苯丙类和聚酮类代谢物中,OPAL苹果显示上调的代谢物有:氨基酸、表儿茶素等。通过对比发现金冠苹果中含量相对丰富的代谢物为绿原酸、熊果苷等;OPAL苹果中含量相对丰富的代谢物有表儿茶素、氨基酸等,这些代谢物会影响食用口感和果实的品质。

a-有机氧化合物聚类层次分析;b-苯丙类和聚酮类代谢物聚类层次分析
图5 OPAL苹果有机氧化合物聚类层次、苯丙类和聚酮类代谢物聚类层次分析
Fig.5 OPAL apple organic oxygen compounds cluster hierarchical, phenylene and polyketone metabolites cluster hierarchical analysis diagram
注: a图中的英文名称翻译为chlorogenate(氯原酸盐);furfural(糠醛);tobramycin(妥布霉素);CMP-N-frimethyl-2-aminoethylphosphonate (CMP-N-季甲基-2-氨基乙基膦酸酯);xylitol(木糖醇);myo-inositol(肌醇);glycerone(甘油酮);quinic acid(奎尼酸);5-hydroxy-N-formylkynurenine (5-羟基-N-甲酰基犬尿氨酸);chitobiose(千二糖);nicotinate D-ribonucleoside(烟酸 D-核糖核苷);glucoerucin(糖皮质激素);shikimic acid(莽草酸); xylobiose(木二糖);(R)-5-diphosphomevalonate[(R)-5-二磷甲羟戊酸];D-mannoheptulose(D-甘露庚酮糖);D-giucosamine(D-二十八烷胺); 2-deoxy-D-ribose 1-phosphate(2-脱氧-D-核糖·1-磷酸);(E)-2-methylpropanal oxime[(E)-2-甲基丙醛·肟];maltohexaose(麦芽六糖); trans-beta-D-glucosyl-2-hydroxycinnamate(反式β-D-葡萄糖基-2-羟基肉桂酸酯);mithramycin(密特拉霉素);3-hydroxykynurenamine(3-羟基犬尿胺); pantothenol(泛醇);5,6,7,8-tetrahydromethanopterin(5,6,7,8-四氢甲烷蝶呤);amygdalin(杏仁核);N-acetylglucosaminylasparagine(N-乙酰氨基葡萄 糖苷);L-fucose 1-phosphate(L-岩藻糖1-磷酸);4-hydroxykynurenamine(4-羟基犬尿胺);5-phosphoribosylamine(5-磷酸核糖胺);jasmone(茉莉酮), b图中英文名称翻译为3-hydroxycoumarin(3-羟基香豆素);dihydrokaempferol(二氢山奈酚);aflatoxin G2(黄曲霉毒素G2);liquiritigenin(甘草素); formononetin(芒柄花素);dGDP(国内生产总值);dihydrokavain(二氢卡韦);malvidin 3-glucoside-4-vinylcatechol(马尔维丁3-葡萄糖苷-4-乙烯 基儿茶酚);cyanidin(氰化物);5-hydroxyferulic acid methyl ester(5-羟基阿魏酸甲酯);sinapic acid(芥子酸);kaempferol 3-O-glucoside (樟脑酚3-O-葡萄糖);quercitrin(槲皮素);4-coumarate(4-香豆素);2′-hydroxydihydrodaidzein(2′-羟基二氢代苯胺);solanine(茄碱); tangeritin(桔皮素);epicatechin(表儿茶素);luteoforol(卢特福罗);(-)-naringenin[(-)-纳林根)];sterigmatocystin(杂色曲霉素)。
3 讨论
OPAL苹果与金冠和富士相比有更优的果实品质和更慢的褐变速率,已有其他品种苹果的综合果实品质评价及褐变机理相关的研究[11-12],但很少有涉及OPAL、金冠和富士苹果的褐变机理相关的报道和研究。本研究对3个苹果品种在代谢组学水平上的营养成分和抗氧化指标进行分析,探究OPAL苹果不易褐变的机理,为当地品种栽培引进提供相关数据支撑。
褐变分为酶促褐变和非酶促褐变,区别在于是否有酶参与。果蔬的褐变与酚类物质和PPO的分布有关,PPO位于植物细胞的质体中,在果蔬贮藏期间因外力因素造成的细胞膜系统破坏,打乱了原本的分布结构,进而导致褐变的发生。PPO能够直接催化邻苯二酚产生褐色产物醌,从而引起褐变[13-15]。TOMAS-BARBE RAN等[16]认为果蔬受到切割会导致PPO活力升高。在水果的贮藏期间,有机酸、维生素C等含量的降低,会减少对于PPO的抑制,进而增强PPO活力,单宁物质增加加速了褐变[17]。本研究通过对不同贮藏时间的OPAL、金冠和富士苹果的PPO含量进行比较,发现褐变慢的OPAL苹果PPO活力低于其他品种,与前期研究结果一致[18-19]。
代谢组学目前是研究各方向机理较为有效的途径,通过非靶向代谢可以检测更多的代谢物质变化[20]。FRANK等[21]研究发现在梨的褐变组织中,延胡索酸的含量升高,琥珀酸和苹果酸的含量均降低。通过代谢组学分析了苹果褐变组织中的延胡索酸、琥珀酸、苹果酸含量,均与对照无明显变化,但发现柠檬酸的含量有明显的降低[22]。本研究实验数据表明,相对易褐变的金冠和富士苹果组织中苹果酸、琥珀酸的含量降低的速度要快于OPAL苹果。同时对代谢物进行分类发现,脂质和类脂分子、苯基丙烷和聚酮、有机酸及其衍生物是OPAL苹果的主要代谢物。将筛选出的代谢物通过KEGG Pathway数据库进行比对,得到OPAL代谢物中主要以各种次生代谢产物的生物合成、甜菜碱生物合成、叶酸生物合成、异喹啉生物碱生物合成、色氨酸代谢等代谢通路为主。
酚类物质是果实酶促褐变的重要元素,引起褐变的酚类物质总共有100多种,包含了多聚体和单聚体[23]。酚类物质的多聚体包括水解单宁和缩合单宁;单聚体分为酚酸和类黄酮,柑橘皮中的主要酚酸就是肉桂酸型酚酸。不同的植物品种、同一果实的不同部位其褐变底物也不同。在多酚氧化酶催化下可将果实中的绿原酸、表儿茶素、咖啡酸、熊果苷等多酚物质氧化为醌类物质,这些醌类物质通过相互反应后被蛋白质包围形成黑色素,导致褐变的发生[24]。例如:甘薯的主要褐变底物是绿原酸,但儿茶素是PPO的最适作用底物[25]。荔枝的褐变酚类物质是类黄酮和花青苷[26]。苹果果实里的绿原酸、儿茶素是较好的PPO褐变底物[27-28],可加速褐变的发生。相关研究表明,易褐变果实中的绿原酸、熊果苷、咖啡酸的含量相较于不易褐变果实偏高,含量相对丰富[29-30]。本研究通过代谢物含量分析,发现OPAL苹果果肉中的绿原酸含量、熊果苷含量均低于金冠苹果和富士苹果果肉,表儿茶素、氨基酸的含量均高于金冠苹果,这与前人研究结果一致。可以推断以上代谢物质的含量是影响果实褐变快慢的关键因素,这为开展褐变相关调控的分子生物学研究奠定了理论基础。
4 结论
本研究主要探究了OPAL苹果褐变延迟的生理机制,通过比较金冠和富士苹果的相关指标,发现OPAL苹果有褐变慢、品质优等特点。OPAL苹果在实验涉及的各个时期PPO活力均低于其余2个品种,通过筛选代谢物,其上调表达的代谢物有378个,下调表达的代谢物有515个。通过对比HMDB数据库,获得其差异代谢中有65.49%来自脂质和类脂分子;23.24%来自苯基丙烷和聚酮;4.23%为有机酸及其衍生物。前期研究表明,绿原酸、熊果苷含量会加速果实褐变;表儿茶素、氨基酸会延缓褐变。这与OPAL苹果代谢物组学分析得到的结果一致。其绿原酸、熊果苷均低于其余2个品种,其表儿茶素、氨基酸含量与其余2个品种比较相对丰富。
基于LC-QTOF平台进行非靶向代谢组学的分析,在代谢组学水平上比较了OPAL苹果和金冠苹果的代谢物的差异等综合评价,进一步阐明了OPAL苹果褐变延迟的代谢基础和机理,为今后褐变调控技术的研究和开发提供理论支撑,为苹果种植优化及栽培品种的选择奠定了基础。
[1] BUSTOS M C, MAZZOBRE M F, BUERA M P. Stabilization of refrigerated avocado pulp: Effect of Allium and Brassica extracts on enzymatic browning[J]. LWT-Food Science and Technology, 2015, 61(1):89-97.
[2] CONSTABEL C P, BARBEHENN R. Defensive Roles of Polyphenol Oxidase in Plants[D]. New York: Springer Netherlands, 2008.
[3] 王曼玲, 胡中立, 周明全, 等. 植物多酚氧化酶的研究进展[J]. 植物学通报, 2005, 40(2):215-222.WANG M L, HU Z L, ZHOU M Q, et al. Advances in research of polyphenol oxidase in plants[J]. Chinese Bulletin of Botany, 2005, 40(2):215-222.
[4] SCHALLER, ANDREAS. Induced defensive roles of polyphenol oxidase in plants[J]. Springer Science, 2008, 8(12): 253-270.
[5] 苏艳丽, 杨健, 田永真, 等. 梨果实发育过程中褐变相关生理指标的变化[J]. 果树学报, 2018, 35(S1):118-124.SU Y L, YANG J, TIAN Y Z, et al. Changes of physiological indexes related to browning during pear fruit development[J]. Journal of Fruit Science, 2018, 35(S1):118-124.
[6] 汪东风, 孙丽平, 张莉. 非酶褐变反应的研究进展[J]. 农产品加工(学刊), 2006(10):9-19.WANG D F, SUN L P, ZHANG L. Reseach progress on nonenzymatic browning reaction[J]. Academic Periodical of Farm Products Processing, 2006(10):9-19.
[7] 李京赞, 刘玉德, 石文天, 等. 植物果蔬的褐变及抑制的研究[J]. 包装与食品机械, 2019, 37(1):63-68.LI J Z, LIU Y D, SHI W T, et al. Advances in research on browning and inhibition of plant fruits and vegetables[J]. Packaging and Food Machinery, 2019, 37(1):63-68.
[8] WANG H, WANG S, FAN M M, et al. Metabolomic insights into the browning of the peel of bagging ‘Rui Xue’ apple fruit[J]. BMC Plant Biology, 2021, 21(1):209.
[9] DING R R, CHE X K, SHEN Z, et al. Metabolome and transcriptome profiling provide insights into green apple peel reveals light- and UV-B-responsive pathway in anthocyanins accumulation[J]. BMC Plant Biology, 2021, 21(1):351.
[10] 闵婷, 谢君, 郑梦林, 等. 果蔬采后酶促褐变的机制及控制技术研究进展[J]. 江苏农业科学, 2016, 44(1):273-276.MIN T, XIE J, ZHENG M L, et al. Research progress on mechanism and control technology of enzymatic browning of fruits and vegetables after harvest[J]. Jiangsu Agricultural Sciences, 2016, 44(1):273-276.
[11] KASAI S, ARAKAWA O. Antioxidant levels in watercore tissue in ‘Fuji’ apples during storage[J]. Postharvest Biology and Technology, 2010, 55(2):103-107.
[12] 宋烨, 翟衡, 刘金豹, 等. 苹果加工品种果实中的酚类物质与褐变研究[J]. 中国农业科学, 2007, 40(11):2563-2568.SONG Y, ZHAI H, LIU J B, et al. Polyphenolic compound and degree of browning in processing apple varieties[J]. Scientia Agricultura Sinica, 2007, 40(11):2563-2568.
[13] MAYER A M, HAREL E. Polyphenol oxidases in plants[J]. Phytochemistry, 1979, 18(2):193-215.
[14] 程双, 胡文忠, 马跃, 等. 鲜切果蔬酶促褐变机理及控制研究进展[J]. 食品与机械, 2009, 25(4):173-176.CHENG S, HU W Z, MA Y, et al. Research progress on enzymatic browning mechanism of fresh-cut fruits and vegetables and its control[J]. Food &Machinery, 2009, 25(4):173-176.
[15] 马跃, 胡文忠, 程双, 等. 鲜切对果蔬生理生化的影响及其调控方法[J]. 食品工业科技, 2010, 31(2):338-341.MA Y, HU W Z, CHENG S, et al. Effects of fresh-cut on the physio-biochemical changes of fruits and vegetables and its controlling methods[J]. Science and Technology of Food Industry, 2010, 31(2):338-341.
[16] TOMAS-BARBERAN F A , ROBINS R J , KRIKORIAN A D .Phytochemistry of fruit and vegetables[J].Quarterly Review of Biology, 1998, 157:272-279.
[17] 彭世清, 李华. 葡萄贮藏过程中的褐变初探[J]. 食品科学, 1995, 16(7): 54-56. PENG S Q, LI H. Preliminary study on browning of grapes during storage [J]. Food Science, 1995, 16(7): 54-56.
[18] 王思新, 刘杰超, 焦中高, 等. 苹果中多酚物质及其在果实发育过程中的变化[J]. 果树学报, 2003, 20(6):427-431.WANG S X, LIU J C, JIAO Z G, et al. Changes of polyphenols during fruit development in apples[J]. Journal of Fruit Science, 2003, 20(6):427-431.
[19] OIKAWA A, OTSUKA T, NAKABAYASHI R, et al. Metabolic profiling of developing pear fruits reveals dynamic variation in primary and secondary metabolites, including plant hormones[J]. PLoS One, 2015, 10(7): e0131408.
[20] RAZA A. Metabolomics: A systems biology approach for enhancing heat stress tolerance in plants[J]. Plant Cell Reports, 2022, 41(3):741-763.
[21] FRANCK C, LAMMERTEYN J, NICOLAÏ B. Metabolic profiling using GC-MS to study biochemical changes during long-term storage of pears[J]. Acta Horticulturae, 2005(682):1991-1998.
[22] 王云香. 基于代谢组学的苹果保鲜机理及减损技术研究[D]. 北京: 中国农业大学, 2016.WANG Y X. Study on the mechanism of apple preservation and its impairment technology based on metabonomics[D]. Beijing: China Agricultural University, 2016.
[23] BALASUNDRAM N, SUNDRAM K, SAMMAN S. Phenolic compounds in plants and agri-industrial by-products: Antioxidant activity, occurrence, and potential uses[J]. Food Chemistry, 2006, 99(1):191-203.
[24] DEUTCH C E. Browning in apples: Exploring the biochemical basis of an easily-observable phenotype[J]. Biochemistry and Molecular Biology Education, 2018, 46(1):76-82.
[25] 郁志芳, 夏志华, 陆兆新. 鲜切甘薯酶促褐变机理的研究[J]. 食品科学, 2005, 26(5):54-59.YU Z F, XIA Z H, LU Z X. Enzymatic browning mechanism of freshcut sweet potatoes (Ipomoea batatas)[J]. Food Science, 2005, 26(5):54-59.
[26] 孙蕾, 王太明, 乔勇进, 等. 果实褐变机理及研究进展[J]. 经济林研究, 2002, 20(2):92-94.SUN L, WANG T M, QIAO Y J, et al. Review of the mechanism of fruit browning with reference to prevention[J]. Economic Forest Reseaches, 2002, 20(2):92-94.
[27] AWAD M A, DE JAGER A. Flavonoid and chlorogenic acid concentrations in skin of ‘Jonagold’ and ‘Elstar’ apples during and after regular and ultra low oxygen storage[J]. Postharvest Biology and Technology, 2000, 20(1):15-24.
[28] MURATA M, KUROKAMI C, HOMMA S. Purification and some properties of chlorogenic acid oxidase from apple (Malus pumila)[J]. Bioscience, Biotechnology, and Biochemistry, 1992, 56(11):1705-1710.
[29] 毕阳, 郭玉蓉, 李永才, 等. 冷藏期间三种梨果皮中酚类物质含量及多酚氧化酶活性变化与褐变度的关系[J]. 制冷学报, 2002, 23(4):52-54.BI Y, GUO Y R, LI Y C, et al. Changes in peel of three cultivars pears polyphenol concentrations and polyphenoloxidase in relation to degree of browning during cold storage[J]. Refrigeration Journal, 2002, 23(4):52-54.
[30] ZUO W F, LU L, SU M Y, et al. Analysis of differentially expressed genes and differentially abundant metabolites associated with the browning of Meihong red-fleshed apple fruit[J]. Postharvest Biology and Technology, 2021, 174:111437.