真菌毒素是由产毒真菌在一定环境条件下所产生的有毒次级代谢产物,在全球范围内的农产品和食品中广泛存在[1]。在目前已鉴别出的400余种真菌毒素中,以黄曲霉毒素(aflatoxins,AFs)、链格孢霉毒素(alternaria toxins,ATs)、赭曲霉毒素(ochratoxins,OTs)和单端孢霉烯族毒素(trichothecenes,TCTs)等最为常见,危害也最大[2]。这些真菌毒素具有致畸性、致癌性、免疫毒性、细胞毒性、生殖毒性、肝毒性以及肾毒性等毒性作用,严重威胁农产品和食品质量安全[3-4]。
作为我国居民日常饮食不可或缺的基本组成部分,蔬菜富含人体必需的膳食纤维、矿物质以及多种维生素等营养成分[5],其质量安全问题历来备受社会各界的关注与高度重视。因富含水分和营养物质,蔬菜在生长、收获、运输、加工和贮藏等过程中均极易受到病原真菌污染而腐烂变质[6],造成严重经济损失的同时积累真菌毒素,经由食物链的传递危害人畜健康[7-8]。在法国第2次总膳食调查中,除马铃薯外的蔬菜中检出AFs、TCTs、赭曲霉毒素A(ochratoxin A,OTA)和玉米赤霉烯酮(zearalenone,ZEN)等真菌毒素,平均含量为0.05~6 μg/kg[9]。在我国第6次总膳食调查中,蔬菜中也检出AFs、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)、3-乙酰基-脱氧雪腐镰刀菌烯醇(3-acetyl-deoxynivalenol,3-ADON)、ATs、赭曲霉毒素B(ochratoxin B,OTB)、杂色曲霉素(sterigmatocystin,SMC)、白僵菌素(beauverin,BEA)、恩镰孢菌素(enniatin,ENN)和ZEN及其衍生物等多种真菌毒素,含量为0.04~8.76 μg/kg[10]。JI等[11]调查了我国果蔬及其制品中ATS的污染情况,并在番茄、菠菜粉、番茄粉、南瓜粉、胡萝卜粉和混合蔬菜泥等中检测到链格孢酚(alternariol,AOH)、交链孢霉甲基醚(alternariol-methylether,AME)、腾毒素(tentoxin,Ten),细交链孢菌酮酸(tenuazonic acid,TeA)毒素和链格孢霉素(altenuene,ALT)等毒素,检出含量为1.0~639.5 μg/kg。ZHAO等[12]也在我国的番茄酱和番茄汁中检出AOH、AME、Ten和TeA等4种毒素,污染平均含量为1.42~338 μg/kg。因此,蔬菜中真菌毒素污染比较普遍,对其具体浓度水平和分布情况进行调查研究,对于保障农产品和食品安全和维护消费者身体健康有着至关重要的作用。
上海市位于长江三角洲东缘,是典型的北亚热带季风气候,日照量充足,降水量充沛,温和湿润的环境非常适宜产毒真菌侵染农作物并产生真菌毒素[13]。生菜、茼蒿属于绿叶类蔬菜,其生长周期短,具有较高的经济价值;番茄、黄瓜等作为主要茄果类蔬菜品种,营养丰富、美味可口。4种蔬菜广受上海市居民喜好,是上海地产蔬菜的重要组成部分。本研究通过超高效液相色谱串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)技术测定上海市部分地区常见蔬菜(生菜、番茄、黄瓜、茼蒿等)中35种真菌毒素的含量,旨在揭示其污染状况与分布特点,从而为蔬菜中真菌毒素的风险监测和安全预警等提供基础数据和参考依据。
1 材料和方法
1.1 样品采集
本研究根据蔬菜种植方式、生产周期和地理位置等,采用随机抽样方法采集上海市不同地区的代表性农贸市场或种植基地的蔬菜样品。于2021年5月—2023年4月共采集蔬菜样品391份(101份生菜、90份番茄、100份黄瓜和100份茼蒿),具体信息见表1。种植基地采样时,按照NY/T 2103—2011《蔬菜抽样技术规范》要求,确定抽样批次,每个批次内采取五点法采集,每点采集500 g样品并混合为一份样品;市场采样时,同一摊位抽取的同一产地、同一种类蔬菜样品为一个批次,每个抽样批次内采集1份代表性样本,每份样品不少于2 kg。采回的蔬菜样品及时处理,按照四分法将每份样品混匀和缩分直至剩余500 g左右。用流水将蔬菜样品表面的泥土等冲洗干净,滤纸吸干表面水分,粉碎并混匀后,装入500 mL广口瓶,-20 ℃冰箱保存待测。
表1 本研究采集的蔬菜样品 单位:份
Table 1 Vegetable samples collected in this study
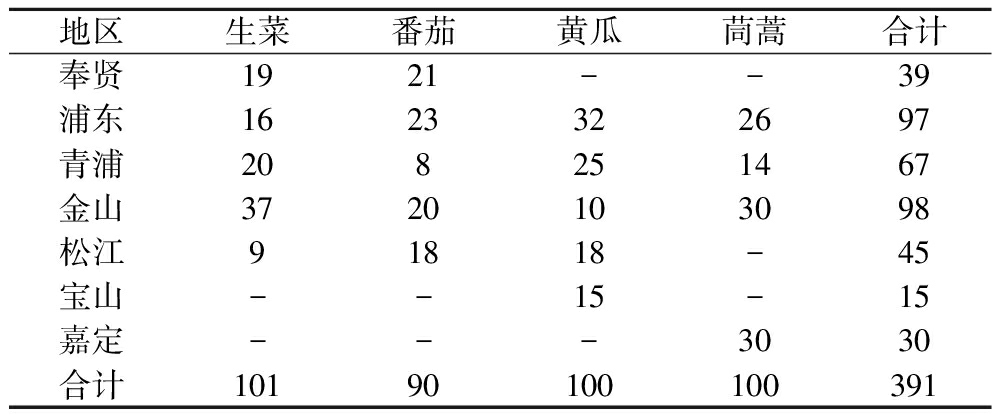
地区生菜番茄黄瓜茼蒿合计奉贤1921--39浦东1623322697青浦208251467金山3720103098松江91818-45宝山--15-15嘉定---3030合计10190100100391
注:“-”表示未采样。
1.2 实验试剂
乙腈、甲醇、乙酸铵、乙酸(质谱纯),德国默克公司;无水硫酸镁、氯化钠(分析纯),美国Sigma-Aldrich公司;十八烷基硅烷键合硅胶(C18,40~60 μm)、乙二胺-N-丙基硅烷(primary secondary amine,PSA,50 μm),苏州纳谱分析技术有限公司;35种真菌毒素标准品,纯度均在98%以上:黄曲霉毒素B1(aflatoxin B1,AFB1)、黄曲霉毒素B2(aflatoxin B2,AFB2)、黄曲霉毒素G1(aflatoxin G1,AFG1)、黄曲霉毒素G2(aflatoxin G2,AFG2)、黄曲霉毒素M1(aflatoxin M1,AFM1)、黄曲霉毒素M2(aflatoxin M2,AFM2)、OTA、OTB、赭曲霉毒素C(ochratoxin C,OTC)、SMC、AOH、AME、ALT、Ten、TeA、桔青霉素(citrinin,CIT)、DON、15-乙酰基-脱氧雪腐镰刀菌烯醇(15-acetyl-deoxynivalenol,15-ADON)、3-ADON、蛇形毒素(diacetoxyscirpenol,DAS)、HT-2毒素(HT-2)、T-2毒素(T-2)、ZEN、玉米赤霉酮(zearalanone,ZAN)、α-玉米赤霉醇(α-zearalanol,α-ZAL)、α-玉米赤霉烯醇(α-zearalenol,α-ZOL)、β-玉米赤霉醇(β-zearalanol,β-ZAL)、β-玉米赤霉烯醇(β-zearalenol,β-ZOL)、麦考酚酸(mycophenolic acid,MPA)、展青霉素(patulin,PAT)、恩镰孢菌素A(enniatin A,ENNA)、BEA、恩镰孢菌素A1(enniatin A1,ENNA1)、恩镰孢菌素B(enniatin B,ENNB)、恩镰孢菌素B1(enniatin B1,ENNB1),青岛普瑞邦生物工程有限公司。
1.3 仪器与设备
XEVO TQ-S超高效液相色谱串联质谱联用仪,美国Waters公司;MVM2800多管漩涡混合仪,上海亚霖科技有限公司;5424R离心机,德国Eppendorf公司;AL104分析天平,美国梅特勒-托利多仪器有限公司;N-EVAP-12水浴氮吹仪,美国Organomation公司;2500TH超声波清洗仪,上海科导超声仪器有限公司;Milli-Q超纯水仪,美国Millipore公司。
1.4 实验方法
参照课题组前期建立的水果中真菌毒素的分析方法[14]:
1.4.1 样品前处理
精确称取2 g粉碎后的蔬菜样品,置于50 mL离心管,加入10 mL含1%体积分数乙酸的乙腈水溶液(80∶20,体积比)超声提取40 min后,加入2.0 g无水硫酸镁和0.5 g氯化钠并剧烈振摇1 min,继续超声提取10 min后,8 000 r/min离心10 min。吸取6 mL上清液于10 mL离心管中,加入85 mg C18和15 mg PSA,剧烈振摇30 s后,8 000 r/min离心10 min,吸取上清液5 mL,40 ℃下氮气吹干,1 mL 5 mmol/L乙酸铵水溶液-乙腈(50∶50,体积比)复溶,过0.22 μm滤膜,UPLC-MS/MS测定。
1.4.2 UPLC-MS/MS检测条件
色谱条件:色谱柱为Waters XBridge BEH C18色谱柱(3 mm×100 mm, 2.5 μm),柱温为40 ℃;流动相A为5 mmol/L乙酸铵溶液,流动相B为甲醇;梯度洗脱程序为:0~0.2 min,30% B;0.2~5 min,30%~90% B;5~7 min,90% B;7~7.5 min,90%~30% B;7.5~8.5 min,30% B;流速为0.4 mL/min;进样量为3 μL。
质谱条件:电喷雾电离源(electron spray ionization, ESI),正负离子模式同时扫描,多反应监测(multiple reaction monitoring, MRM)模式定量;碰撞气为高纯氩气,脱溶剂气、锥孔气均为高纯氮气,离子源温度为150 ℃,脱溶剂温度为500 ℃。35种真菌毒素的质谱参数参见文献[1],标准溶液中的MRM图谱见图1。
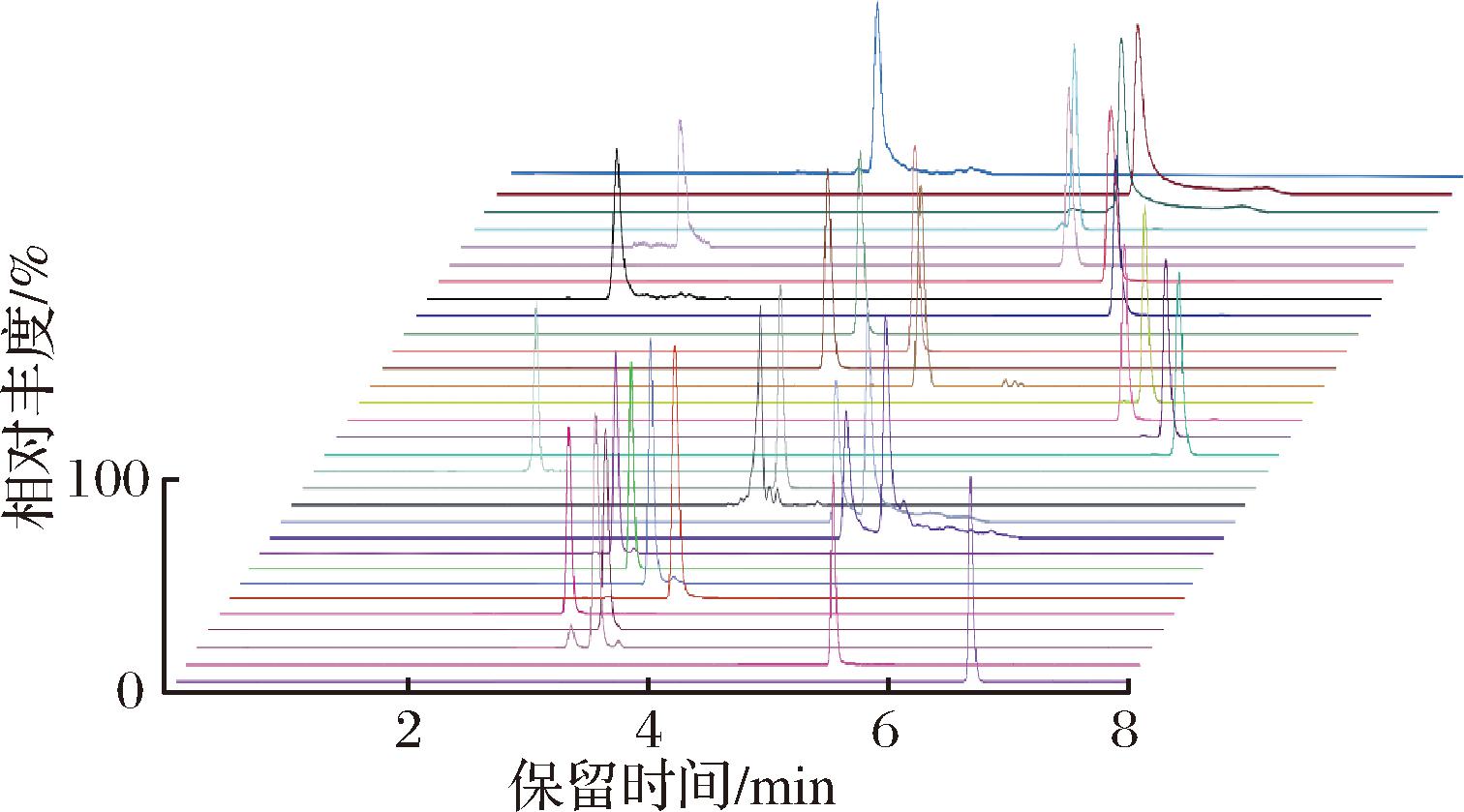
图1 标准溶液35种真菌毒素中的MRM图谱
Fig.1 MRM chromatograms of 35 mycotoxins in standard solution
注:标准溶液的质量浓度为100 μg/L。
1.5 方法学验证
精确吸取适量的35种真菌毒素的标准样品,将其溶解于乙腈中,配制成1 mg/L的质量浓度混合标准溶液。选取不含目标真菌毒素的蔬菜样品,采用1.4.1节前处理方法获得基质空白溶液并稀释混合标准工作液,获得基质混合标准溶液。建立35种真菌毒素的基质标准曲线,通过基质标准曲线斜率与溶剂标准曲线斜率的比值考察4种蔬菜基质中目标真菌毒素的信号增强/抑制程度(signal suppression/enhancement, SSE)来评估基质效应[15]。分别以3倍信噪比(S/N=3)和10倍信噪比(S/N=10)确定方法的检出限(limits of detection, LOD)和定量限(limits of quantitation, LOQ)。采用加标回收率试验来评估回收率和精密度:选取4种蔬菜的空白基质样品,按低、中、高3个水平(5、20和100 μg/kg)分别加入混合标准溶液,按照1.4.1节和1.4.2节的方法处理样品和测定浓度,回收率为测定值和理论值的百分比(n=5),日内精密度为同一天5次平行试验结果的相对标准偏差(relative standard deviation, RSD),日间精密度则是连续5 d独立测定结果的RSD。
1.6 数据处理
采用MS Office 365 Excel对蔬菜样品中真菌毒素的污染水平进行初步的数据整理,运用SPSS 22.0软件开展进一步统计分析。在计算毒素含量平均值及进行相关统计时,仅考虑检测结果呈阳性的蔬菜样本(毒素含量>LOD)。运用卡方检验和因素方差分析法(One-Way ANOVA)考察不同地域及蔬菜品种中真菌毒素污染水平的差异,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 方法学验证
实验结果表明,35种真菌毒素在生菜、番茄、黄瓜和茼蒿基质中的SSE分别为9.45%~232.92%、1.04%~114.78%、4.15%~151.46%、4.15%~138.15%(图2),大部分呈现较强的基质效应,故采用基质标准曲线进行定量。
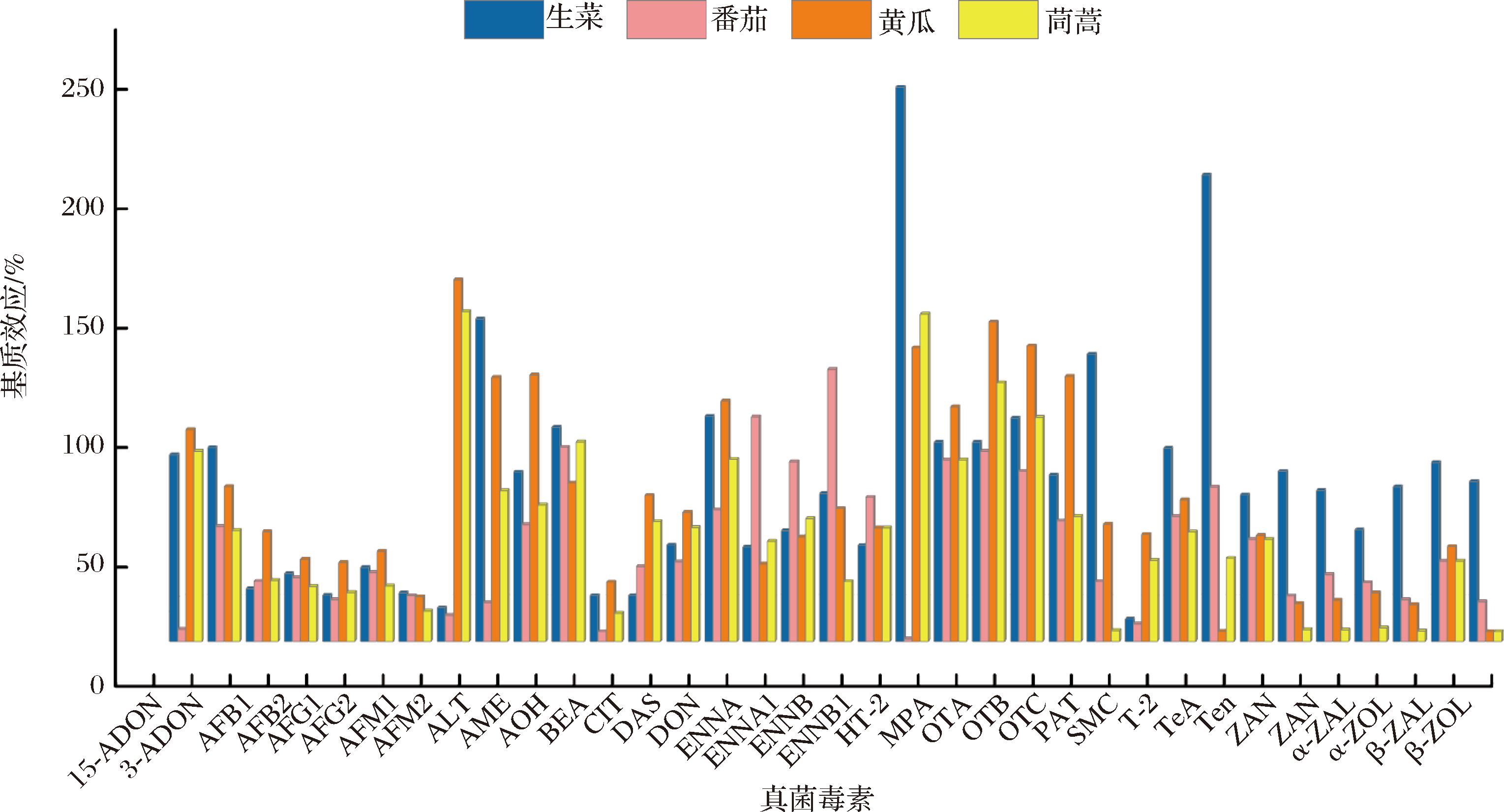
图2 不同蔬菜中35种真菌毒素的基质效应
Fig.2 Matrix effects of 35 mycotoxins in different vegetables
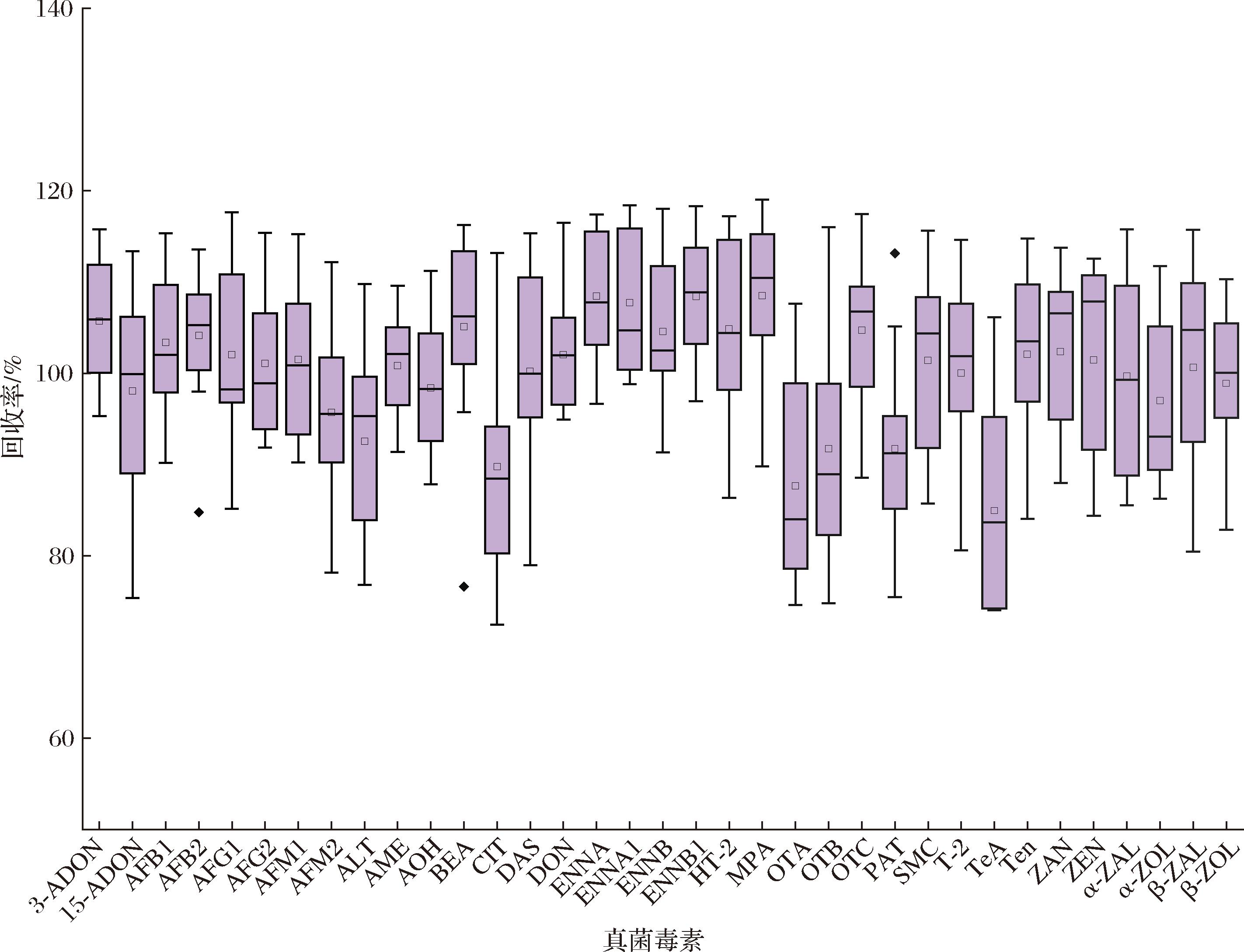
图3 35种真菌毒素在蔬菜基质中的回收率
Fig.3 Recoveries of 35 mycotoxins in vegetable matrices
注:图中黑点表示异常值。
线性试验结果表明,标准溶液中35种真菌毒素的线性关系良好,决定系数R2>0.990,LODs和LOQs分别为0.02~2 μg/kg和0.1~5 μg/kg;4种蔬菜基质中35种真菌毒素的R2均大于0.990,LODs和LOQs分别为0.05~5 μg/kg和0.1~10 μg/kg(表2)。加标回收试验结果表明,35种真菌毒素在生菜、番茄、黄瓜和茼蒿等蔬菜基质中的平均回收率为70.83%~119.05%(图2),日内精密度为0.06%~17.9%,日间精密度为0.46%~19.8%。以上结果表明所建立的检测方法具有较好的灵敏度和准确度,可用于生菜、番茄、黄瓜和茼蒿等蔬菜样品中35种真菌毒素的实际筛查和定量检测要求。
表2 35种真菌毒素在标准溶液和不同蔬菜基质中的检出限和定量限 单位:μg/kg
Table 2 Limits of detection and quantification of 35 mycotoxins in standard solution and different vegetable matrices

真菌毒素标准溶液生菜番茄黄瓜茼蒿LODLOQLODLOQLODLOQLODLOQLODLOQ15-ADON0.51510510355103-ADON0.10.212121235AFB10.20.50.30.50.050.11212AFB20.10.20.30.50.050.11235AFG10.10.20.30.50.30.51212AFG2250.510.10.21212AFM1250.10.20.10.21212AFM20.050.10.30.5120.510.51ALT0.20.512353535AME0.050.112120.10.212AOH0.050.112351212BEA0.10.20.050.10.050.112510CIT0.10.2510253512DAS0.10.2120.511212DON0.513512120.51ENNA0.510.050.10.050.11212ENNA10.510.050.10.10.23535ENNB120.10.20.30.51212ENNB10.10.20.30.50.050.13512HT-20.10.20.51120.510.51MPA0.10.20.30.50.30.51212OTA0.030.10.10.20.050.10.510.10.2OTB0.020.10.30.50.30.51212OTC120.30.50.050.10.050.112PAT0.20.5353535510SMC0.10.20.510.511212T-20.10.20.10.20.10.2120.51TeA1235353535Ten0.510.30.50.10.2120.51ZAN120.30.50.51120.51ZEN120.30.50.30.50.510.51α-ZAL0.5112120.5112α-ZOL120.510.51120.51β-ZAL0.5112350.10.235β-ZOL120.30.5121212
表3 不同蔬菜样品中真菌毒素的污染水平
Table 3 Contamination levels of mycotoxins in different vegetable samples
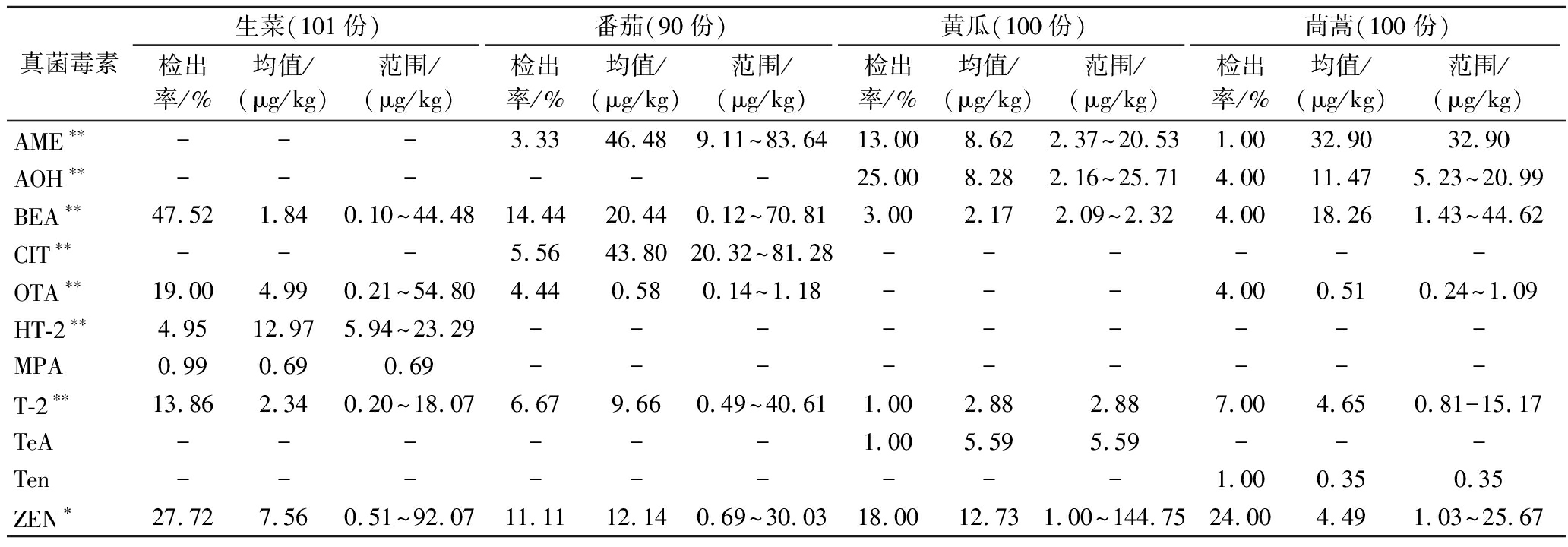
真菌毒素生菜(101份)番茄(90份)黄瓜(100份)茼蒿(100份)检出率/%均值/(μg/kg)范围/(μg/kg)检出率/%均值/(μg/kg)范围/(μg/kg)检出率/%均值/(μg/kg)范围/(μg/kg)检出率/%均值/(μg/kg)范围/(μg/kg)AME∗∗---3.3346.489.11~83.6413.008.622.37~20.531.0032.9032.90AOH∗∗------25.008.282.16~25.714.0011.475.23~20.99BEA∗∗47.521.840.10~44.4814.4420.440.12~70.813.002.172.09~2.324.0018.261.43~44.62CIT∗∗---5.5643.8020.32~81.28------OTA∗∗19.004.990.21~54.804.440.580.14~1.18---4.000.510.24~1.09HT-2∗∗4.9512.975.94~23.29---------MPA0.990.690.69---------T-2∗∗13.862.340.20~18.076.679.660.49~40.611.002.882.887.004.650.81-15.17TeA------1.005.595.59---Ten---------1.000.350.35ZEN∗27.727.560.51~92.0711.1112.140.69~30.0318.0012.731.00~144.7524.004.491.03~25.67
注:“-”表示未检出;*代表显著性P<0.05;**代表显著性P<0.01。
2.2 蔬菜中真菌毒素的总体污染水平
根据所建立的方法,对来自上海不同地区的391份蔬菜样品中的真菌毒素含量进行测定。结果显示(图4),共有185份蔬菜样品中检测出真菌毒素,总检出率为47.06%。共有11种真菌毒素被检出,按检出率高低依次为ZEN(20.46%)、BEA(17.39%)、AOH(7.42%)、T-2(7.16%)、OTA(6.91%)、AME(4.35%)、CIT(1.28%)、HT-2(1.28%)、MPA(0.26%)、TeA(0.26%)和Ten(0.26%),平均含量为0.35~43.80 μg/kg。61份(15.60%)蔬菜样品同时检出2种或以上的真菌毒素,其中11份生菜样品检出3种真菌毒素,3份生菜和1份茼蒿样品检出4种真菌毒素。
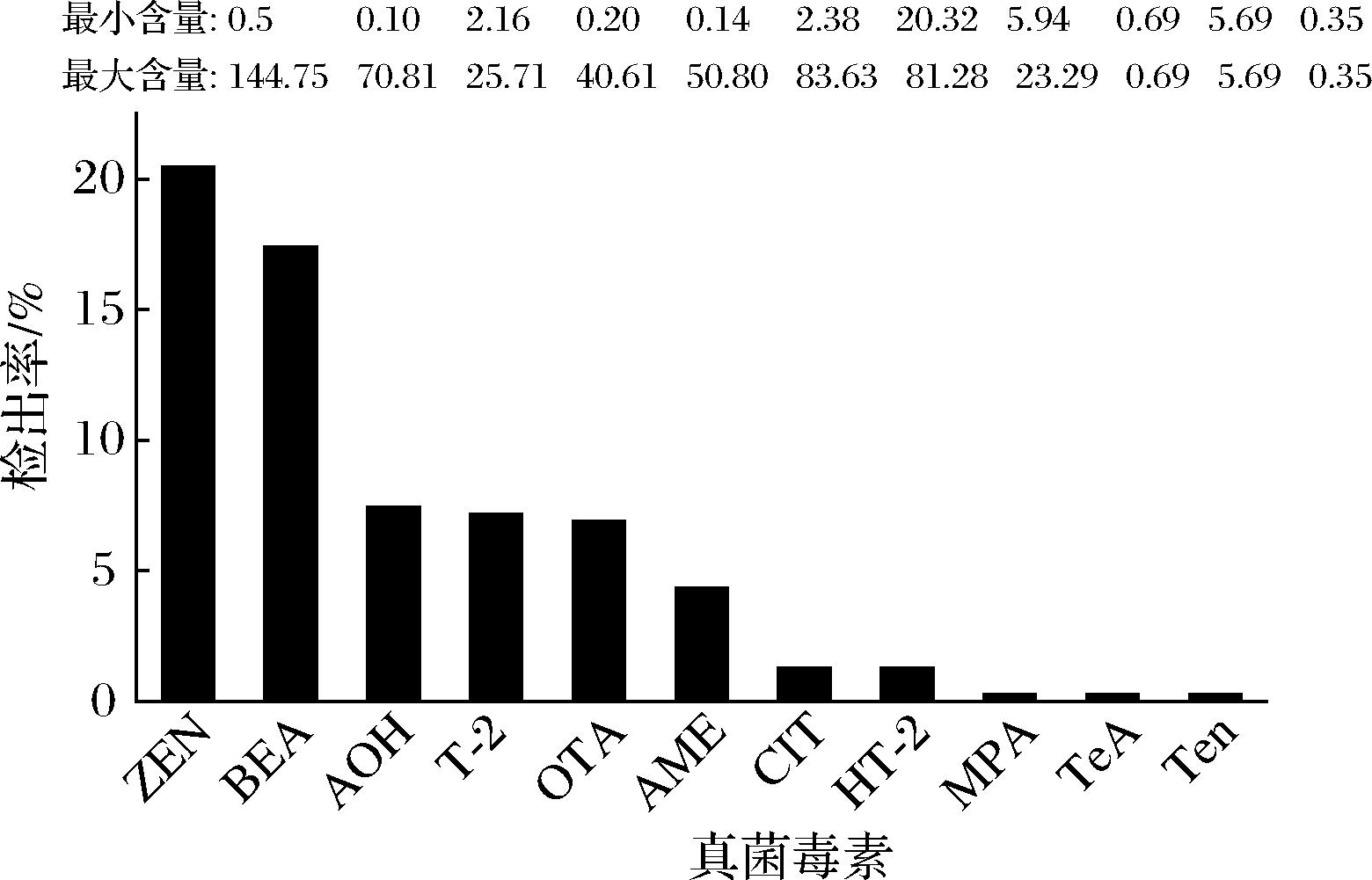
图4 上海市常见蔬菜样本中真菌毒素的检出情况
Fig.4 Detection of mycotoxins in samples of common vegetables in Shanghai
注:图的顶部数据为阳性样本中真菌毒素的最小和最大含量(μg/kg)。
2.3 不同蔬菜中真菌毒素的污染情况
生菜、番茄、黄瓜、茼蒿四种蔬菜基质中真菌毒素的检出率分别为64.35%、34.44%、50.00%和38.00%,具体各毒素的污染情况见表2。不同品种蔬菜中毒素的污染水平存在一定差异。链格孢霉毒素(AME、AOH、TeA和Ten)是果蔬中常检出的毒素,本研究中AME在番茄、黄瓜和茼蒿中检出,在黄瓜中的检出率高于番茄和茼蒿,但污染水平显著低于另2种蔬菜;AOH在黄瓜和茼蒿中检出,检出率分别为25.00%和4.00%,但污染浓度无显著差异;TeA和Ten则分别在1份黄瓜和1份茼蒿样品中检出。BEA、T-2和ZEN在4种蔬菜中均有检出,BEA在生菜中检出率最高(47.52%),但番茄和茼蒿中BEA含量显著高于生菜和黄瓜;4种蔬菜中T-2和ZEN的检出率存在明显差异,但污染水平无显著差异。OTA在3种蔬菜中检出,按检出率依次为生菜(19.00%)、番茄(4.44%)和黄瓜(4.00%),但不同蔬菜中的污染水平无显著差异。CIT和MPA则分别只在少量番茄和生菜中检出。
2.4 不同地区蔬菜中真菌毒素的污染情况
进一步对不同地区蔬菜样品中真菌毒素的污染情况进行分析。生菜中(图5-A、图6-A),BEA、OTA和HT-2在不同区样本中的检出率和污染水平均无显著差异;ZEN在金山区样本的检出率(51.35%)显著高于其他地区,但污染浓度无显著差异;而T-2在奉贤样品中含量(12.26 μg/kg)显著高于其他区域;MPA则仅在奉贤区的一个样品中检出。番茄中(图5-B、图6-B),不同地区间样品中真菌毒素的检出率无显著差异,但污染水平表现出一定的差异,如金山区样品中BEA的污染含量(39.19 μg/kg)显著高于奉贤(0.27 μg/kg)和浦东(0.18 μg/kg),金山区样品的CIT(72.85 μg/kg)和青浦区样品的T-2(40.61 μg/kg)的污染含量则显著高于其他区域。黄瓜中(图5-C、图6-C),AME在浦东、青浦、宝山和松江区的样品检出,检出率分别为12.50%、8.00%、5.56%、40.00%;ZEN在浦东、青浦、松江和金山区检出,检出率分别为15.63%、16.00%、50.00%、22.22%,不同地区样本中2种毒素的检出率均存在显著差异,但污染水平无显著差异;AOH在浦东、青浦、宝山和松江区样品中检出,但检出率和污染水平均无显著差异;此外,BEA、T2和TeA仅在部分地区的个别样品中检出。茼蒿中(图5-D、图6-D),T-2和ZEN两种毒素的检出率表现出显著的地区差异:T-2分别在19.23%的浦东样品、7.14%的青浦样品和3.33%的金山区样本中检出,而青浦区样本中的污染含量(6.54 μg/kg)显著高于其他地区;ZEN在浦东和青浦两地区检出,检出率分别为75.08%和35.71%,但两地区间污染浓度无明显差异;其他毒素仅在部分地区的个别样品中检出,检出率和污染浓度均无显著差异。
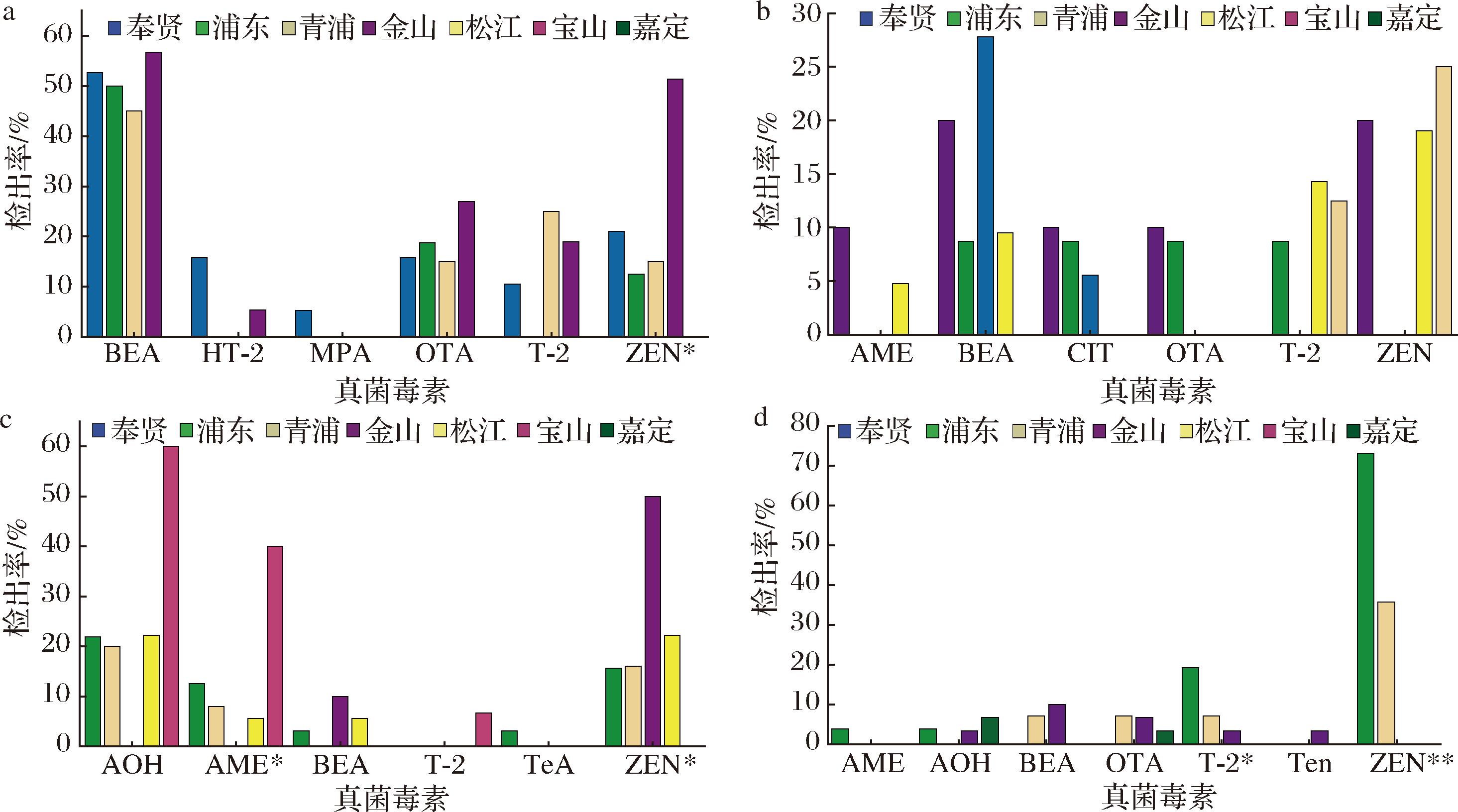
a-生菜;b-番茄;c-黄瓜;d-茼蒿
图5 不同地区蔬菜样品中真菌毒素的检出率
Fig.5 Detection rates of mycotoxins in vegetable samples from different regions
注:*代表显著性P<0.05;**代表显著性P<0.01(下同)。
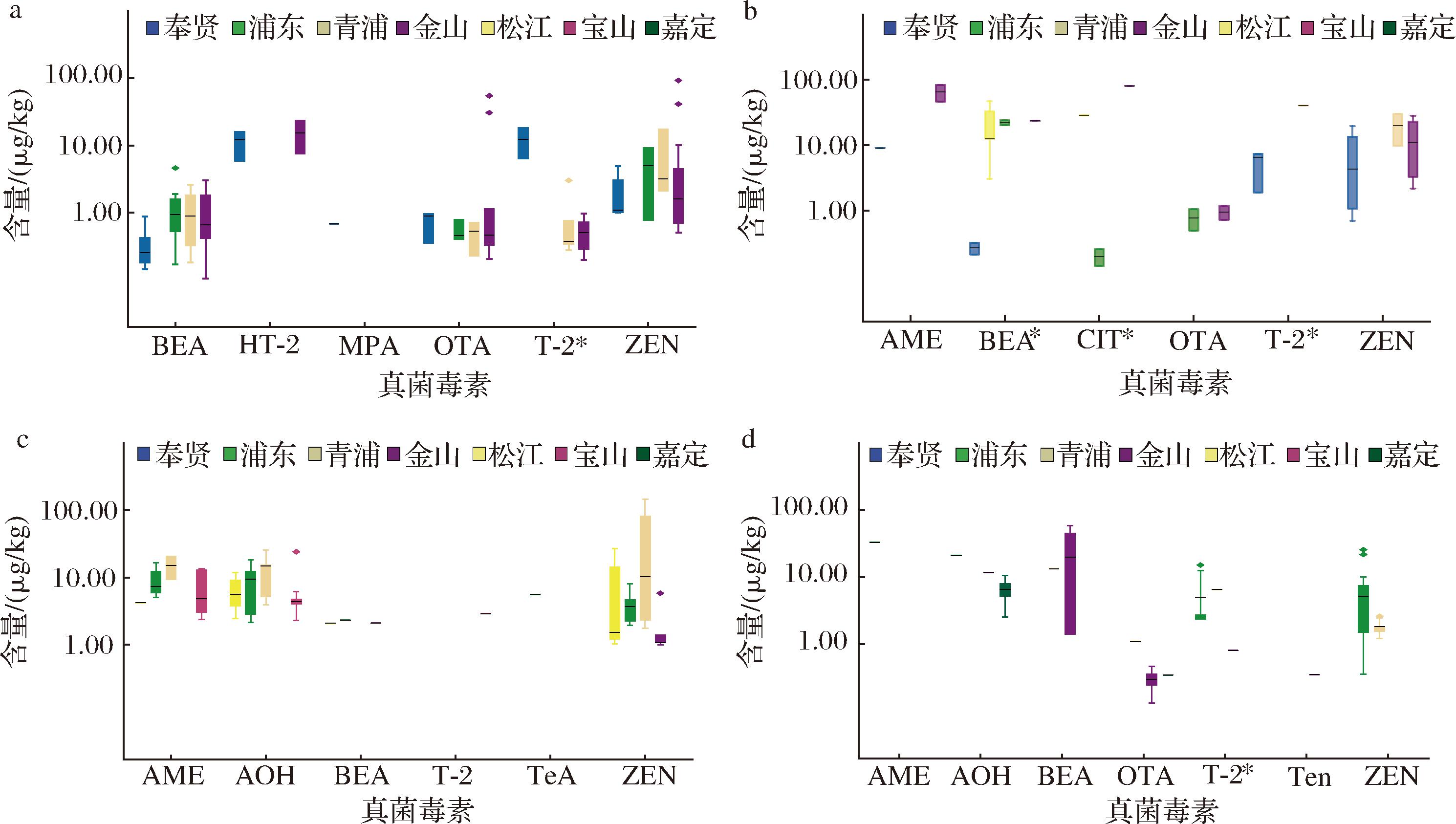
a-生菜;b-番茄;c-黄瓜;d-茼蒿
图6 不同地区蔬菜样品中真菌毒素的污染浓度
Fig.6 Contamination concentrations of mycotoxins in vegetable samples from different regions
3 讨论与结论
在采前种植、生长过程及采后的生产加工、运输和贮藏等过程中,蔬菜均易被病原真菌感染而腐烂变质,导致大量真菌毒素积累,严重威胁消费者健康。本研究利用UPLC-MS/MS检测方法调查了上海市不同地区中生菜、番茄、黄瓜、茼蒿等蔬菜中35种真菌毒素的污染情况,研究结果显示调查分析的蔬菜样品中真菌毒素污染比较普遍,总检出率为47.06%,主要污染毒素包括ZEN、BEA、AOH、AME、TeA、Ten、T-2和HT-2等。
与既往研究结果相比,本研究发现上海地区蔬菜总体污染水平较低,但部分毒素的污染浓度相对较高,如本调查发现蔬菜中ZEN的污染水平(检出率20.46%,平均含量8.37 μg/kg)高于法国第2次总膳食调查中蔬菜样品(平均含量0.4~2.4 μg/kg)[2]、我国第6次总膳食调查中蔬菜样品(检出率66.67%,含量0.23~0.99 μg/kg)[10]和课题组前期长三角地区番茄样品(检出率4.70%,平均含量0.39 μg/kg)[16]中的结果;新型真菌毒素BEA的污染水平(检出率17.39%,平均含量6.38 μg/kg)高于尼日利亚市场豇豆样品(检出率7.41~11.1%,平均含量1.15~1.30 μg/kg)[17]、荷兰番茄产品(平均含量2.4 μg/kg)[18]和西班牙蔬菜制品(检出率9%,平均含量0.87 μg/kg)[19]中的结果,低于上海市甜椒样品中的水平(检出率50%,含量15~57 μg/kg)[20];而AFs和DON及其衍生物等在法国[9]、波兰[7]、越南[21]、巴基斯坦[22]、毛里求斯[23]、西非[24]、印度[25]和我国[10]等不同地区多种蔬菜样品中常检出的真菌毒素在本研究中均未检出,AOH、OTA、AME、CIT、TeA和Ten等果蔬中常见真菌毒素[8]也仅在本研究的个别样本中检出。需要指出的是,虽然此次调查和上述多项既往研究均发现蔬菜中存在多种真菌毒素污染,但目前国内外尚未制定蔬菜中真菌毒素的限量标准,如我国仅制定了果蔬汁类及其饮料中PAT的限量标准(50 μg/kg)(GB 2761—2017《食品安全国家标准食品中真菌毒素限量》),给蔬菜质量安全带来了潜在的安全风险。
真菌毒素的产生与污染状况和真菌、宿主以及环境因素等密切相关[8]。与谷物不同,蔬菜富含水分,产毒真菌不仅能在收获前通过伤口或表面的天然小孔成功进入蔬菜内部,也能在采摘后通过损伤部位或与损伤蔬菜接触进入内部从而生长和定植,并在适宜的温、湿度等环境条件下产生真菌毒素[4]。本研究发现不同品种蔬菜中真菌毒素的污染情况存在一定差异,如生菜中BEA、ZEN和单端孢霉烯类毒素检出较多,而黄瓜和茼蒿中链格孢霉毒素污染水平较高,这可能是不同蔬菜对产毒真菌和真菌毒素的抗性有所区别。此外,本研究也发现部分蔬菜中毒素的污染水平存在一定的地区差异。由于同属上海地区,地理和气候条件类似,污染水平的差异可能是不同种植基地的菌群结构、种植方式和环境以及采收后的运输、贮存和加工条件等的不同引起的[23]。考虑到本次研究中调查蔬菜品种有限、样品数目较少、毒素检出率较低,在后续研究中需继续更多品种、更大样本和更大范围的长期跟踪监测,从而更全面、真实地反映上海地区蔬菜样品中真菌毒素的污染状况。
本研究建立了生菜、番茄、黄瓜和茼蒿等蔬菜中35种真菌毒素的UPLC-MS/MS检测方法,方法学验证结果表明该方法灵敏、准确、可靠,能够满足实际蔬菜样品检测的要求。使用该方法对上海市地区常见蔬菜样品进行检查,结果显示生菜、番茄、黄瓜和茼蒿等蔬菜受真菌毒素污染比较普遍,主要检出毒素包括ZEN、BEA、AOH、AME、TeA、Ten、T-2和HT-2等,总体上污染水平较低,但部分毒素浓度相对较高,且呈现一定的蔬菜种类和地域差异。后续研究将扩大监测地区和蔬菜品种,全面反映蔬菜中真菌毒素实际污染情况,更精确和科学的评估其健康风险,为制定和完善真菌毒素限量标准提供参考依据,有力保障农产品和食品质量安全。
[1] FAN K, QIAN S N, ZHANG Z Q, et al. Recent advances in the combinations of plant-sourced natural products for the prevention of mycotoxin contamination in food[J]. Critical Reviews in Food Science and Nutrition, 2024, 64(29):10626-10642.
[2] MARIN S, RAMOS A J, CANO-SANCHO G, et al. Mycotoxins: Occurrence, toxicology, and exposure assessment[J]. Food and Chemical Toxicology, 2013, 60:218-237.
[3] ALSHANNAQ A, YU J H. Occurrence, toxicity, and analysis of major mycotoxins in food[J]. International Journal of Environmental Research and Public Health, 2017, 14(6):632.
[4] EDITE BEZERRA DA ROCHA M, DA CHAGAS OLIVEIRA FREIRE F, ERLAN FEITOSA MAIA F, et al. Mycotoxins and their effects on human and animal health[J]. Food Control, 2014, 36(1):159-165.
[5] 郭长江, 高蔚娜, 谢宗恺, 等. 中国蔬菜、水果抗氧化作用与有效成分的研究进展[J]. 生命科学, 2015, 27(8): 1000-1004.GUO C J, GAO W N, XIE Z K, et al. Research advances in antioxidant capacity and components of vegetables and fruits in China[J]. Chinese Bulletin of Life Sciences, 2015, 27(8): 1000-1004.
[6] YOU Y L, ZHOU Y N, DUAN X W, et al. Research progress on the application of different preservation methods for controlling fungi and toxins in fruit and vegetable[J]. Critical Reviews in Food Science and Nutrition, 2023, 63(33):12441-12452.
[7] ![]() T, W
T, W JCIK-FATLA A, FARIAN E, et al. Levels of filamentous fungi and selected mycotoxins in leafy and fruit vegetables and analysis of their potential health risk for consumers[J]. Annals of Agricultural and Environmental Medicine, 2021, 28(4):585-594.
JCIK-FATLA A, FARIAN E, et al. Levels of filamentous fungi and selected mycotoxins in leafy and fruit vegetables and analysis of their potential health risk for consumers[J]. Annals of Agricultural and Environmental Medicine, 2021, 28(4):585-594.
[8] NAN M N, XUE H L, BI Y. Contamination, detection and control of mycotoxins in fruits and vegetables[J]. Toxins, 2022, 14(5):309.
[9] SIROT V, FREMY J M, LEBLANC J C. Dietary exposure to mycotoxins and health risk assessment in the second French total diet study[J]. Food and Chemical Toxicology, 2013, 52:1-11.
[10] QIU N N, SUN D L, ZHOU S, et al. Rapid and sensitive UHPLC-MS/MS methods for dietary sample analysis of 43 mycotoxins in China total diet study[J]. Journal of Advanced Research, 2022, 39:15-47.
[11] JI X F, DENG T, XIAO Y P, et al. Evaluation of Alternaria toxins in fruits, vegetables and their derivatives marketed in China using a QuEChERS method coupled with ultra-high performance liquid chromatography-tandem mass spectrometry: Analytical methods and occurrence[J]. Food Control, 2023, 147:109563.
[12] ZHAO K, SHAO B, YANG D J, et al. Natural occurrence of four Alternaria mycotoxins in tomato- and Citrus-based foods in China[J]. Journal of Agricultural and Food Chemistry, 2015, 63(1):343-348.
[13] MENG J J, LI R J, HUANG Q W, et al. Survey and toxigenic abilities of Aspergillus, Fusarium, and Alternaria fungi from wheat and paddy grains in Shanghai, China[J]. Frontiers in Plant Science, 2023, 14:1202738.
[14] 赵芮, 黄晴雯, 余智颖, 等. QuEChERS-超高效液相色谱-串联质谱法同时测定水果中36种真菌毒素[J]. 色谱, 2023, 41(9):760-770, 823-830.ZHAO R, HUANG Q W, YU Z Y, et al. Simultaneous determination of 36 mycotoxins in fruits by QuEChERS coupled with ultra performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2023, 41(9):760-770, 823-830.
[15] HUANG L C, ZHENG N, ZHENG B Q, et al. Simultaneous determination of aflatoxin M1, ochratoxin A, Zearalenone and α-Zearalenol in milk by UHPLC-MS/MS[J]. Food Chemistry, 2014, 146:242-249.
[16] 范楷, 祭芳, 徐剑宏, 等. 长三角地区市场常见农产品中40种真菌毒素的污染状况和特征分析[J]. 中国农业科学, 2021, 54(13):2870-2884.FAN K, JI F, XU J H, et al. Natural occurrence and characteristic analysis of 40 mycotoxins in agro-products from Yangtze Delta Region[J]. Scientia Agricultura Sinica, 2021, 54(13):2870-2884.
[17] AFOLABI C G, EZEKIEL C N, OGUNBIYI A E, et al. Fungi and mycotoxins in cowpea (Vigna unguiculata L.) on Nigerian markets[J]. Food Additives &Contaminants. Part B, Surveillance, 2020, 13(1):52-58.
[18] L PEZ P, DE RIJK T, SPRONG R C, et al. A mycotoxin-dedicated total diet study in the Netherlands in 2013: Part Ⅱ-occurrence[J]. World Mycotoxin Journal, 2016, 9(1):89-108.
PEZ P, DE RIJK T, SPRONG R C, et al. A mycotoxin-dedicated total diet study in the Netherlands in 2013: Part Ⅱ-occurrence[J]. World Mycotoxin Journal, 2016, 9(1):89-108.
[19] CARBALLO D, MOLT J C, BERRADA H, et al. Presence of mycotoxins in ready-to-eat food and subsequent risk assessment[J]. Food and Chemical Toxicology, 2018, 121:558-565.
J C, BERRADA H, et al. Presence of mycotoxins in ready-to-eat food and subsequent risk assessment[J]. Food and Chemical Toxicology, 2018, 121:558-565.
[20] ZHAO Z Y, YANG X L, ZHAO X Y, et al. Method development and validation for the analysis of emerging and traditional Fusarium mycotoxins in pepper, potato, tomato, and cucumber by UPLC-MS/MS[J]. Food Analytical Methods, 2018, 11(6):1780-1788.
[21] HUONG B T M, TUYEN L D, TUAN D H, et al. Dietary exposure to aflatoxin B1, ochratoxin A and fuminisins of adults in Lao Cai province, Viet Nam: A total dietary study approach[J]. Food and Chemical Toxicology, 2016, 98(Pt B):127-133.
[22] NAJMUS S, MUBARIK A, ZAHIDA P, et al. Screening of mycotoxins in wheat, fruits and vegetables grown in Sindh, Pakistan[J]. PAKISTAN JOURNAL OF BOTANY, 2009, 41(1):337-341.
[23] TAKOOREE S D, MAMODE ALLY N, BIBI AMEERKHAN A, et al. Surveillance of mycotoxin contaminants and mycotoxigenic fungi in agricultural produce[J]. Quality Assurance and Safety of Crops &Foods, 2023, 15(4):89-98.
[24] HELL K, GNONLONFIN B G J, KODJOGBE G, et al. Mycoflora and occurrence of aflatoxin in dried vegetables in Benin, Mali and Togo, West Africa[J]. International Journal of Food Microbiology, 2009, 135(2):99-104.
[25] HARIPRASAD P, DURIVADIVEL P, SNIGDHA M, et al. Natural occurrence of aflatoxin in green leafy vegetables[J]. Food Chemistry, 2013, 138(2-3):1908-1913.