挤压组织化蛋白是采用高水分挤压(物料水分含量>40%)或者低水分挤压技术制造的一种具有纤维状结构和类似动物肉口感的蛋白产品,目前已大量应用于模拟肉产品、各类方便面调味品以及以降低成本为目标的肉制品等食品产品中[1-3]。现有的工业化组织蛋白的原料大多是从富含蛋白的油脂或者淀粉加工产出的副产物如豆粕中提取而出的各种浓缩蛋白或分离蛋白、谷朊粉等,以及其他一些低成本富含蛋白的产物如真菌蛋白。无论是高水分还是低水分挤压,挤压加工的过程都处在一种高温高剪切的环境中,富含蛋白和还原糖的体系在高温高压条件下,发生美拉德反应导致赖氨酸、半胱氨酸等损失几乎不可避免[4]。有报道显示,玉米颗粒挤压过程赖氨酸的保留率大约为51%~89%[5]。
一方面,对于植物基食品尤其是谷物而言,赖氨酸相对含量比较低,是限制性氨基酸之一,高温挤压过程美拉德反应导致的赖氨酸损失会使得植物基食品尤其是谷物的氨基酸评分进一步下降。另一方面,美拉德反应也会使得产物蛋白消化率下降。赵谋明等[6]的研究显示,美拉德反应程度越高,胃蛋白酶消化率越高,胰蛋白酶消化率越少,总消化率越低。GONZ LEZ-VEGA等[7]的研究显示,高压蒸汽处理豆粕的氨基酸消化率,随着125 ℃蒸汽热处理时间延长,呈线性降低,降低原因可能与热处理导致豆粕产生美拉德反应相关[8]。
LEZ-VEGA等[7]的研究显示,高压蒸汽处理豆粕的氨基酸消化率,随着125 ℃蒸汽热处理时间延长,呈线性降低,降低原因可能与热处理导致豆粕产生美拉德反应相关[8]。
目前,控制美拉德反应的主要途径是通过抗氧化途径(包括捕获或者清除活性二羰基化合物)、清除自由基、还原作用等阻断糖与氨基酸、肽或者蛋白质的糖基化反应[9]。抗氧化剂有很多种,其中酚类抗氧化剂在一定的添加量下由于与蛋白质存在相互作用,会导致蛋白质溶解度的变动,因此,不仅对美拉德反应有影响,也对质构有影响。而还原剂,则会改变二硫键,理论上,在挤压过程也会对美拉德反应和质构有同步影响[10]。但迄今为止,很少有研究探讨各类不同的抗氧化剂对于挤压过程产物氨基酸组成、质构和消化率的影响。
因此,本文选择了3种不同的抗氧化剂(抗氧化肽、迷迭香提取物以及维生素C)作为代表,探究3种不同抗氧化剂对于挤压过程产物氨基酸组成、质构和消化率的影响,并将之与美拉德反应进行关联分析,以期为有效提升挤压组织化产物和植物基模拟肉产物的营养价值和质构等提供理论基础。
1 材料与方法
1.1 材料与试剂
食品级大豆浓缩蛋白(soy protein concentrate,SPC,蛋白含量65%),秦皇岛金海食品工业有限公司;食品级麦麸蛋白(wheat gluten,WG,蛋白质含量81%),滨州中宇食品有限公司;大豆还原肽(食品级),宁陕国圣生物科技有限公司;迷迭香水提物(食品级),湖南先伟阳光科技有限公司;维生素C(分析纯),国药集团药业股份有限公司;胃蛋白酶、胰蛋白酶(均为分析纯),源叶生物科技有限公司;甲醇(谱纯),美国TEDIA公司;d4-CML、d4-CEL、硼酸钠、四氢味喃、三乙胺、盐酸、结晶乙酸钠、三氯乙酸、1 nmol/μL的17种氨基酸标准品(天门冬氨酸、组氨酸、谷氨酸、丝氨酸、甘氨酸、苏氨酸丙氨酸、精氨酸、酪氨酸、胱氨酸、缅氨酸、蛋氨酸、苯丙氨酸、异亮氨酸、亮氨酸、赖氨酸脯氨酸)及邻苯二甲醛(o-phthalaldehyde,OPA)、芴甲氧羰基(fluorene methoxycarbonyl,FMOC)(均为分析纯),Sigma公司。
1.2 仪器与设备
同向双螺杆挤压机,中国ATS纳米科技(苏州)有限公司;PL2002型电子天平以及FE20型pH计,瑞士Mettler Toledo公司;TA-XT Plus质构仪,英国Stable Micro Systems公司;Agilent1100高效液相谱系统包括在线脱气装置(G1322A)、四元泵(G1311A)、自动进样器(G1313A)、VWD检测器(G1314A) 和AgilentHypersilODS柱 (5 μm,4.0 mm×250 mm),美国安捷伦公司;WB-2000IXA全自动色差计,北京同德创业科技有限公司;JYL-C23料理机,九阳股份有限公司;Waters Acquity超高效液相色谱串联三重四极杆质谱联用仪,ESI源、Waters Acquity UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),美国Waters公司;Oasis MCX(60 mg/3 cc)固相萃取小柱,沃特世科技(上海)有限公司;厚壁耐压瓶(48 mL/15 mL),欣维尔玻璃仪器(北京)有限公司。
1.3 实验方法
1.3.1 原料配比
将SPC和WG粉末以6∶4的质量比混合配制挤压原料[11],分别添加0.5%的大豆还原肽、0.5%的迷迭香水提物以及0.5%的维生素C并混合均匀。
1.3.2 挤压工艺
使用同向双螺杆挤压机进行挤出实验,挤压机末端附有利用循环水保持温度的2 394 mm×37 mm×5 mm冷却段。螺杆直径15.6 mm,挤出段分为6段,除了第一段均可自主加热,并附有温度检测器。使用给料机将物料添加到挤压机的第一部分,并用活塞泵向挤压机供水。
螺杆转速设置为150 r/min,原料以10 g/min的速度进入挤压机,泵和进料都经过提前校准,进料含水量设定为为60%,同时从开始段起的6个部分的温度分别为30、40、60、140、150、150 ℃,最后经过85 ℃的冷却段。
1.3.3 质构分析
使用质构仪分析挤出物的质地特性。质构测定参考ZHANG等[12]的方法,拉丝蛋白样品以挤压机物料的挤出流方向为基础,将垂直于挤出流的方向定义为垂直方向;将平行于挤出流的方向定义为平行方向。将样品切成10 mm×10 mm×10 mm的正方形,放置在质构仪的平台上。使用A/CKB探头,分别沿垂直方向或平行方向各进行5次切割,以1 mm/s对样品剪切,每个样品剪切程度为95%,检测垂直方向的剪切力峰值和平行方向的剪切力峰值,即为水平或者垂直于样品的硬度,垂直硬度和平行硬度的比值定义为组织化度。
1.3.4 色差分析
参考杨竺红[13]的方法并修改,将样品表面水分擦干后利用色差仪对拉丝蛋白的亮度L*、红绿值a*和黄蓝值b*进行测定,每个样品重复测定3次。拉丝蛋白与标准版的色差值ΔE*计算如公式(1)所示:
(1)
式中:ΔE*为拉丝蛋白与标准版的色差值;L0*为标准白板亮度值;a0*为标准白板红绿色度;![]() 为标准板的黄度值。
为标准板的黄度值。
1.3.5 pH值测定
参照GB 5009.237—2016 《食品安全国家标准 食品pH值的测定》略微改动,取3 g拉丝蛋白于烧杯中,加入30 mL的1 mol/L氯化钾溶液,用料理机研磨粉碎得到均匀分散溶液,用pH计测量。
1.3.6 氨基酸组成
酸水解氨基酸样品处理[14]:液体样品取4 mL消化液加入酸水解管中,之后加入4 mL 12 mol/L浓HCl;固体样品取100 mg待测样品加入酸水解管中,之后加入8 mL 6 mol/L HCl,摇匀后置于120 ℃烘箱中反应22 h,之后加入4.8 mL氢氧化钠溶液中和多余HCl,过滤,定容至25 mL备用。上样的流动相配比如下:流动相A(pH=7.2):27.6 mmol/L醋酸钠-三乙胺-四氢呋喃(体积比为500∶0.11∶2.5),流动相B(pH=7.2):80.9 mmol/L醋酸钠-甲醇-乙睛(体积比为1∶2∶2)。紫外检测器(variable wavelength detector,VWD)检测波长为338 nm,脯氨酸以262 nm检测;氨基酸含量以外标法定量。
将原料与挤压拉丝蛋白产物酸水解得出17种氨基酸,以每种氨基酸在拉丝蛋白含量除以40%原料中的含量,得出每种氨基酸在挤压后未被美拉德反应的留存率,计算如公式(2)所示:
(2)
式中:X,每种氨基酸的留存率;X1,每种氨基酸在挤压拉丝蛋白中的质量,mg;X2,每种氨基酸在原料的质量。
1.3.7 美拉德反应产物分析
参考焦叶等[15]的方法提取组织化蛋白中的羧甲基赖氨酸(carboxy methyl lysine,CML)与羧乙基赖氨酸(carboxethyllysine,CEL)。精确称取50 mg样品,加入1.5 mL硼酸钠缓冲溶液(0.2 mol/L,pH 9.2)和1 mL硼氢化钠(1.0 mol/L在0.1 mol/L氢氧化钠中)在4 ℃下还原过夜。还原后,向样品中加入2.6 mL的12 mol/L盐酸(HCl),并将样品在110 ℃下水解24 h。将冷却的酸水解液过滤,用超纯水定容至10 mL。取500 μL定容后的水解液,用氮气吹干。将吹干后的水解液在2 mL 0.1 mol/L HCl中复溶,并加入150 μL含有71.25 ng的d4-CML和66 ng的d4-CEL的内标物。固相萃取:采用固相萃取对上述的复溶后样品进行净化。首先,用3 mL甲醇和3 mL 0.1 mol/L HCl对Oasis MCX固相萃取柱进行活化。上样后用3 mL 0.1 mol/L HCl和3 mL超纯水洗去杂质。最后,用3 mL洗脱液[V(甲醇)∶V(氨水)=95∶5]洗脱CML、CEL和它们相应的内标物。将洗脱液在40 ℃下用氮气吹干,然后用300 μL的5 mmol/L九氟戊酸复溶,并用0.22 μm 的针头式滤器过滤,进行LC-MS/MS分析。LC-MS/MS分析条件:色谱柱为Waters X-Bridge C18柱(2.1 mm×100 mm,3.5 μm),柱温35 ℃。色谱流动相:A相为乙腈,B相为5 mmol/L九氟戊酸,流速为0.3 mL/min。梯度洗脱程序为:0~0.1 min,5%A;0.1~5 min,60%A;5~7 min,100%A;7~9 min,100%A;9~10 min,5%A;5%A保持10 min以在下一次进样前平衡色谱柱。进样体积定为5 μL。质谱电离源采用电喷雾电离(electrospray ionization,ESI),正离子模式,多反应监测模式(multiple response monitoring,MRM)。锥孔温度和脱溶剂温度分别为110、400 ℃。毛细管电压为3.55 kV。锥孔气体和脱溶剂气均为氮气,流速分别为50、600 L/h。碰撞气为氩气,流速为0.15 mL/min。CML、d4-CML、CEL和d4-CEL分别用m/z 205→84、m/z 209→88、m/z 219→84和m/z 223→88来定量。
1.3.8 模拟体外消化
参考CAO等[16]的方法配制pH值1.5的0.25%(体积分数)的稀HCl溶液,加入312.5 mg的胃蛋白酶(底物与酶的质量比为1∶20),充分溶解后得到消化液。将空白组、维生素C组、大豆还原肽组、迷迭香水提物组分别粉碎后,称取1 g样品加入80 mL的消化液中,加入恒温振荡水浴锅模拟胃部消化,并且每30 min调整pH值至1.5。在消化2 h后,取出,调整pH值至7.5,在100 ℃中恒温水浴5 min灭酶。之后分别加入400 mg胰蛋白酶,继续消化4 h。分别在消化时间0.5、1、2、3、4、6 h收集消化液样品,通过添加1 mol/L的氢氧化钠调整消化液pH值至7,并且在100 ℃中恒温水浴5 min灭酶。将不同时间的消化液定容至100 mL。
1.3.9 可溶蛋白分析
取定容完的消化液以10 000 r/min离心10 min,之后用0.22 μm注射过滤器过滤[17],取10 mL以凯氏定氮法测定清液中蛋白含量,除以原料中蛋白含量得出蛋白溶解率并绘制成表。计算如公式(3)、公式(4)所示:
(3)
式中:X,每克拉丝蛋白的消化液中上清液可溶性蛋白含量,mg;V1,滴定HCl溶液终点的体积,mL;V2,滴定HCl溶液起点的体积,mL;c,测定使用标准的滴定HCl溶液的浓度,mol/L;0.01401,氮的毫摩尔质量数值;m,试样的质量,g。
(4)
式中:X,上清液中蛋白溶出率,X1,每克拉丝蛋白的消化液中上清液可溶性蛋白含量,mg;X2,每克原料中的蛋白含量,mg。
1.4 数据分析
数据用“平均值±标准偏差”表示,所有处理重复3次。采用Excel 2016进行数据分析,并用Origin 8.0作图。使用Statistics 9软件对数据进行显著性分析,P<0.05为具有显著性差异。
2 结果与分析
2.1 色泽和pH值
通过对拉丝蛋白的色差分析,探究还原剂对挤压拉丝蛋白色泽的影响。拉丝蛋白的颜色与pH值如表1所示,利用还原剂抑制美拉德反应促使蛋白质的亮度L*有所提升,同时导致ΔE有所变化。推测迷迭香的L*值变低是由于迷迭香水提物中存在的迷迭香酸等深色显色物质使得原料与拉丝蛋白产生颜色变化[18]。由于美拉德反应产物中生成了一些有机酸等酸性成分,因此通常导致体系pH值的下降[19-20]。由表1可知,添加还原剂对挤压中的美拉德反应有一定的抑制作用,从而导致pH值上升。
表1 拉丝蛋白色拉丝蛋白样品的色度值和pH值
Table 1 Colorimetric parameters and pH values of extrudates
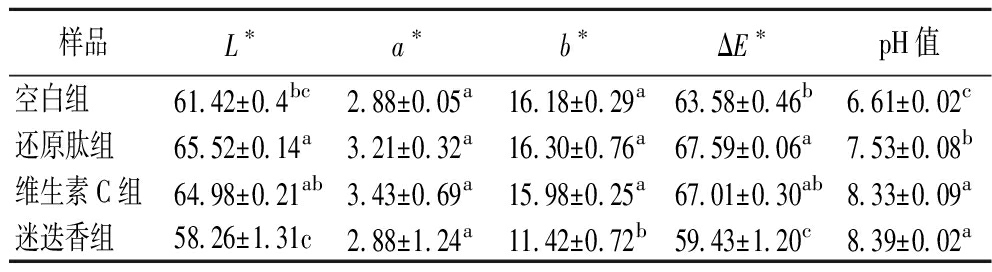
样品L∗a∗b∗ΔE∗pH值空白组61.42±0.4bc2.88±0.05a16.18±0.29a63.58±0.46b6.61±0.02c还原肽组65.52±0.14a3.21±0.32a16.30±0.76a67.59±0.06a7.53±0.08b维生素C组64.98±0.21ab3.43±0.69a15.98±0.25a67.01±0.30ab8.33±0.09a迷迭香组58.26±1.31c2.88±1.24a11.42±0.72b59.43±1.20c8.39±0.02a
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 质构分析
研究表明[21],消化动力学强烈依赖于硬度类别。因此,硬度是调整豆类中蛋白质消化现象的合适食品设计变量。表2为拉丝蛋白的质构,添加迷迭香会降低拉丝蛋白表面的硬度,同时略微提升内部的硬度。因为当pH值偏离7.5时,蛋白的溶解度较低,导致拉丝蛋白的硬度降低[18],所以维生素C组与迷迭香组的内部硬度都有一定程度的降低(P<0.05)。图1表征了拉丝蛋白的组织化度,用于定量表征拉丝蛋白纤维化程度的大小。添加大豆还原肽会同时提升内外部的纤维化程度,添加维生素C会显著提升拉丝蛋白外部的纤维化程度,对拉丝蛋白有正向作用,添加迷迭香水提物则会降低内部的组织化度,对质构有负面作用。
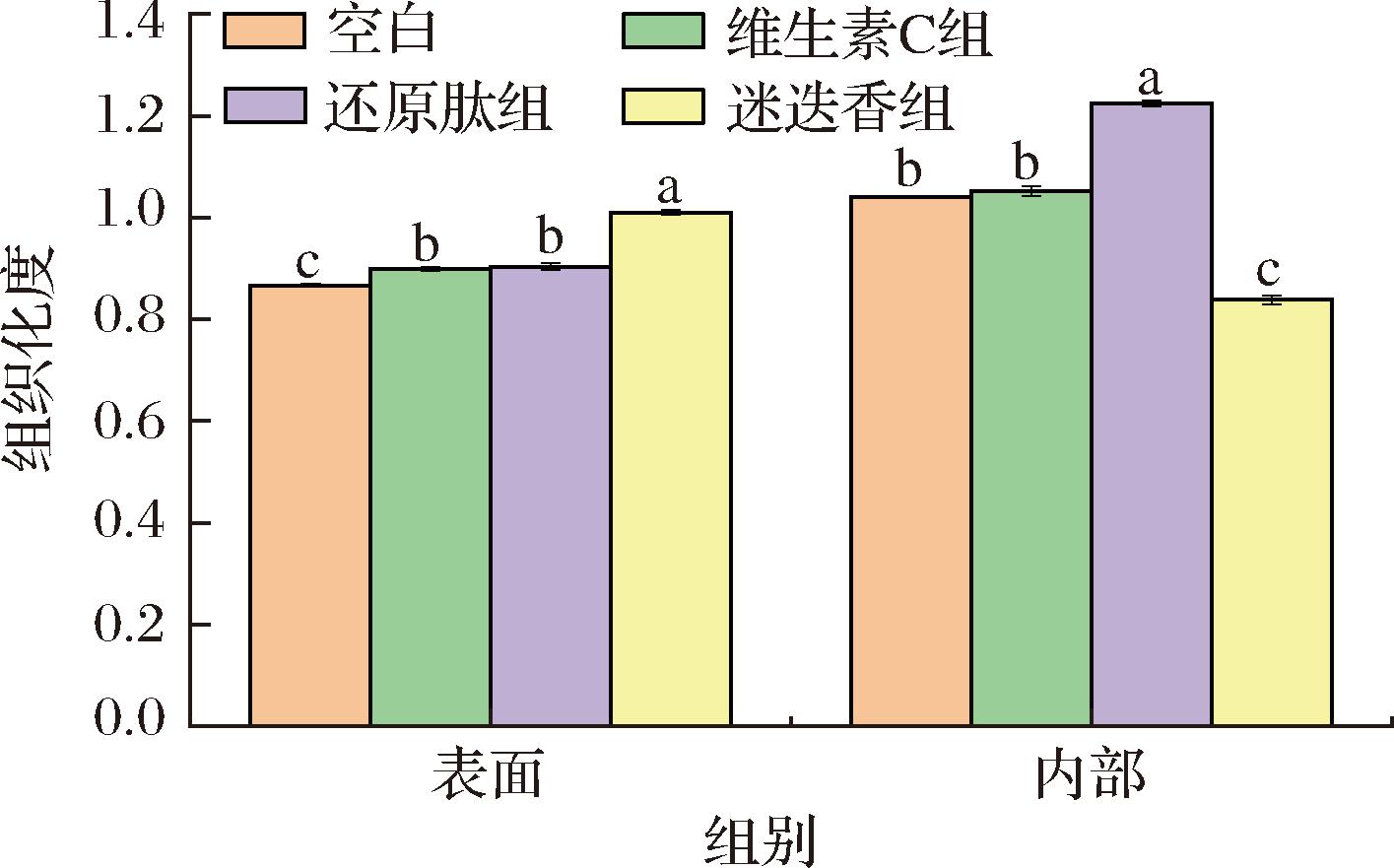
图1 拉丝蛋白的组织化度
Fig.1 Extural properties of extrudates’ texturization degree
注:图中不同字母表示差异显著(P<0.05)(下同)。
表2 拉丝蛋白的平行硬度与垂直硬度
Table 2 Textural properties of extrudates’ perpendicular hardness and parallel hardness
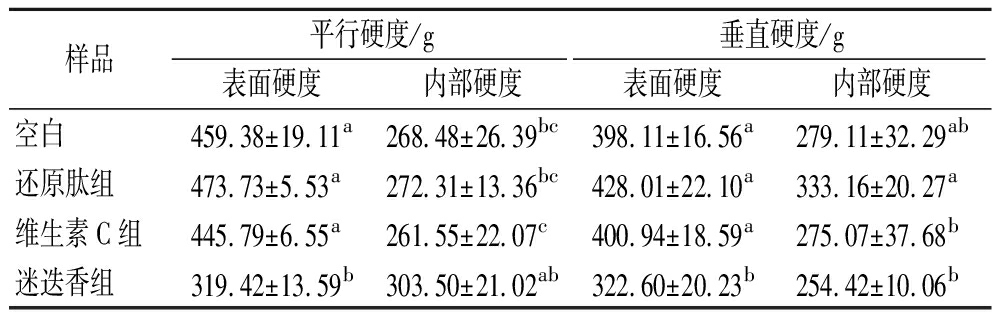
样品平行硬度/g垂直硬度/g表面硬度内部硬度表面硬度内部硬度空白459.38±19.11a268.48±26.39bc398.11±16.56a279.11±32.29ab还原肽组473.73±5.53a272.31±13.36bc428.01±22.10a333.16±20.27a维生素C组445.79±6.55a261.55±22.07c400.94±18.59a275.07±37.68b迷迭香组319.42±13.59b303.50±21.02ab322.60±20.23b254.42±10.06b
2.3 氨基酸留存率
氨基酸留存率反映了各个氨基酸经过加压后的损失程度,在挤压过程中,氨基酸与还原糖发生美拉德反应,消耗了部分氨基酸,通过对各个氨基酸的损失,可以得出挤压过程中的美拉德反应程度。由于空间位阻效应小,氨基在末端或Σ-位(赖氨酸Lys)的氨基酸比氨基在Σ-位的氨基酸更易发生美拉德反应;碱性氨基酸(赖氨酸、精氨酸Arg、组氨酸His)更易发生美拉德反应[22]。如表3所示,添加还原剂后,还原性氨基酸氨基酸(色氨酸Ser、苏氨酸Thr、精氨酸Arg、缬氨酸Cys)的留存率大多高于空白组。还原剂在挤压过程中,对还原性氨基酸起到了保护作用,因为抑制了美拉德反应的发生,同时对其余氨基酸也有一定的保护作用。
表3 挤压拉丝蛋白氨基酸留存率 单位:%
Table 3 Amino acid retention rate of extrusion products

氨基酸空白维生素C组还原肽组迷迭香组Asp84.33±2.12b87.63±2.12ab94.54±1.11a94.63±1.52aGlu84.82±1.12b86.33±3.11a93.14±1.53a92.70±1.71aSer82.43±2.54b83.51±2.16b92.51±1.75a91.95±2.15aHis84.26±2.11b96.27±2.41ab98.11±1.52a95.21±2.16abGly87.21±2.32b99.04±0.11a99.00±0.23ab97.13±2.12abThr83.79±0.12b85.64±0.53b96.03±0.92a94.79±0.37aArg79.14±0.11b81.54±0.76b88.82±0.53a88.88±2.71aAla85.57±1.51b87.74±1.47ab94.18±1.72a94.97±1.12aTyr75.67±1.27bc70.76±1.24c88.77±2.11ab91.57±2.21aCys63.50±1.12b68.22±3.12b86.68±2.11a93.00±4.13aVal84.06±3.21a88.05±2.25a96.89±2.49a95.53±2.11aMet70.69±2.21b70.08±2.15b73.98±2.71b87.93±1.7aPhe84.04±1.16b87.64±1.32a95.79±1.58a94.51±2.19aIle86.22±1.57b88.17±1.21ab95.87±1.26a95.82±2.16aLeu84.72±1.41c86.73±1.21bc92.98±1.49ab94.07±0.22aLys85.18±0.57b89.01±1.32ab92.03±0.27a92.76±0.72aPro82.38±1.21b89.40±1.12ab86.31±1.43ab92.98±1.97a
2.4 美拉德反应产物分析
通过对挤压拉丝蛋白中的CML与CEL进行进行检测可以表征挤压过程种蛋白发生的美拉德反应剧烈程度,结果如表4所示。表4数据表明,添加3种还原剂都对挤压过程中的美拉德反应发生了显著性的抑制作用,其中维生素C对美拉德反应的抑制率最大,迷迭香水提物次之,大豆还原肽对美拉德反应的抑制最低,符合3种物质抗氧化性能力的排序。
表4 挤压拉丝蛋白种CML和CEL含量
Table 4 Content of CML and CEL in extruded drawing protein species

样品CML含量/(μg/g)CEL含量/(μg/g)空白23.87±4.01a24.20±2.98a维生素C组14.92±5.65d15.43±7.18d还原肽组21.97±3.99b18.80±2.50b迷迭香组17.86±4.03c16.79±0.92c
2.5 蛋白溶出曲线
消化液中的蛋白含量如图2所示,经过0~2 h胃蛋白酶酶切后,3种添加物质均未对蛋白的消化率形成显著影响,在胃蛋白酶消化结束时,蛋白溶出率从高到低排序为还原肽组(55.75%),维生素C组(55%)、空白组(53.82%)和迷迭香组(53.39%)。在2~6 h的胰蛋白酶消化过程中,在胰蛋白酶消化2 h后,还原肽组蛋白溶出率显著高于空白组,迷迭香组蛋白溶出率相较于空白组更高但无显著性,维生素C组显著小于空白组。表明在相同的条件下,添加还原肽能够提升蛋白溶出量,而添加迷迭香无明显变化,添加维生素C可能导致拉丝蛋白蛋白溶出量降低。还原肽组添加了可溶多肽,易于消化液中溶解,但是多肽与拉丝蛋白竞争,导致胃蛋白酶优先剪切肽段上的肽键[23],因此开始胃消化后蛋白溶出率开始时最低,之后溶出率保持第一。迷迭香组与空白组溶出率相近。维生素C组相比于其他3组蛋白溶出率均较低,在胰消化阶段有显著性差异,可能是维生素C的过强的还原性影响挤压拉丝蛋白中巯基与二硫键之间发生交换反应导致蛋白质亚基的交联、聚合,形成小分子,降低蛋白质的溶解度[23-24]。
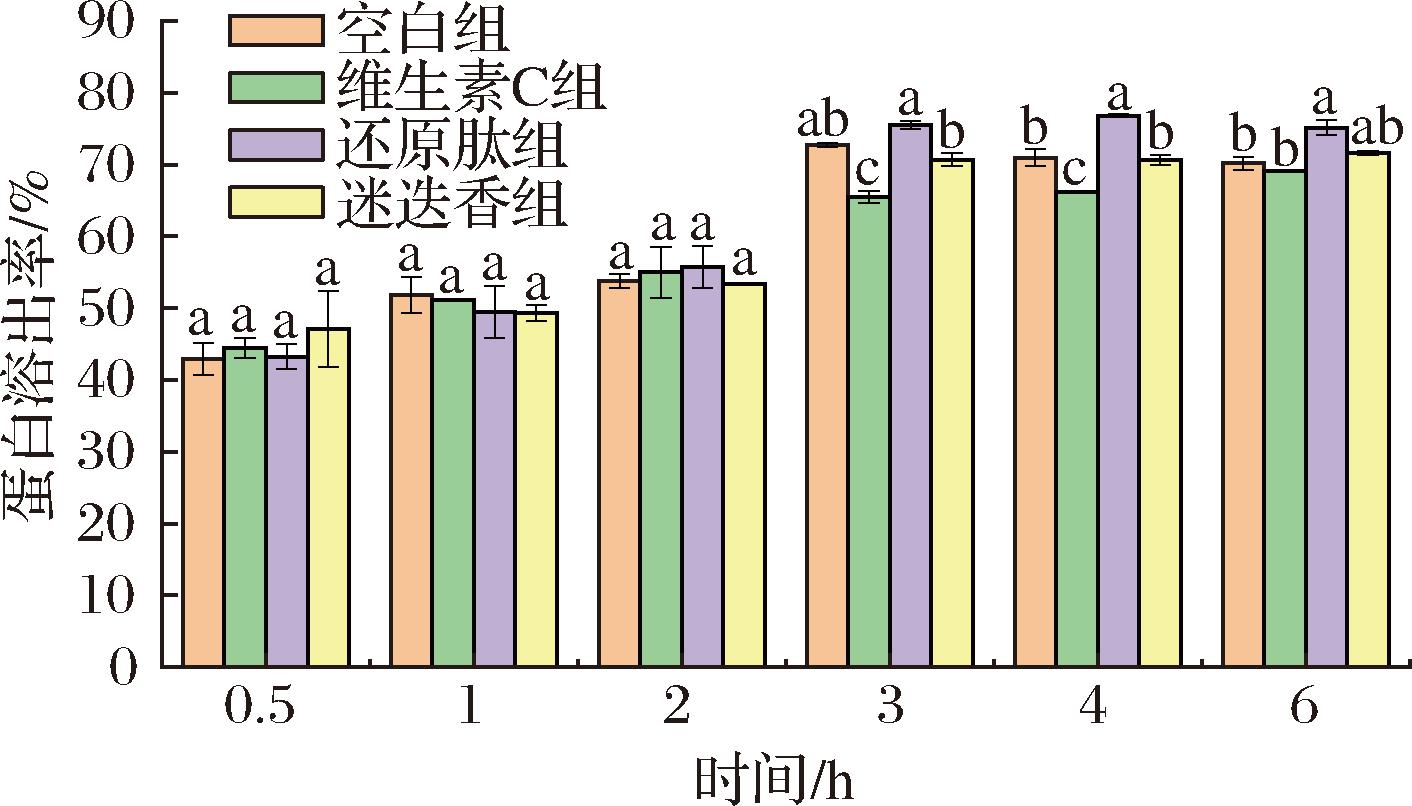
图2 蛋白溶出率
Fig.2 Protein dissolution curve
注:0~2 h为模拟胃部消化,2~6 h为模拟胰脏消化,其中大豆还原 肽组的数值在计算时已扣除0.2%的大豆还原肽自身的含氮物质(下同)。
2.6 酸水解氨基酸
如图3中所示,经过0~2 h的胃部模拟消化,大豆还原肽添加组的酸水解氨基酸含量有所提升。在加入胰蛋白酶反应后,大豆还原肽组显著大于空白对照组,迷迭香组比空白组略高但无显著性,维生素C组显著小于空白组。该结果与蛋白溶出率的结果类似,由于大豆还原肽组对美拉德反应的抑制,且小肽改善质构导致消化性质提升。由于维生素C的添加强还原性导致的二硫键交联反而降低了拉丝蛋白的消化性质。
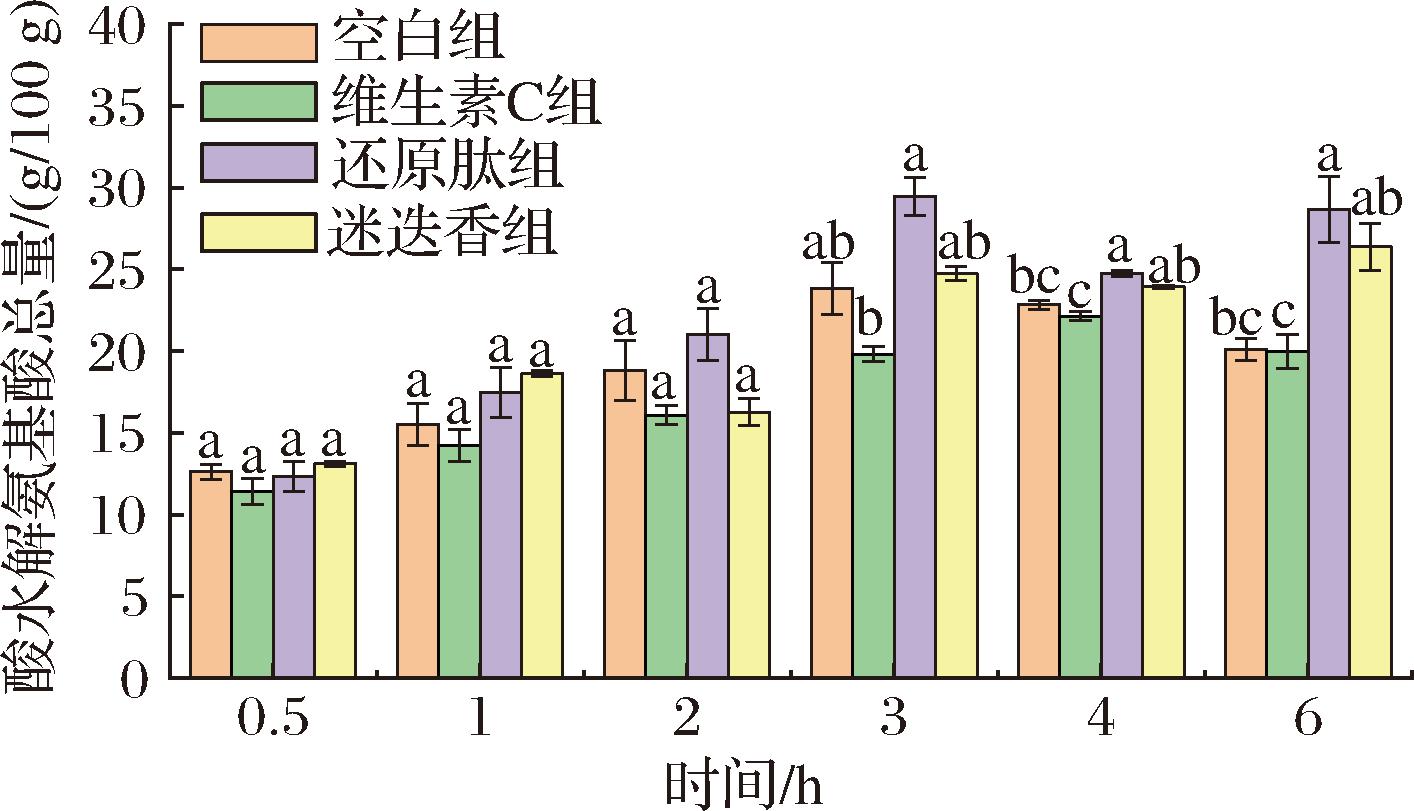
图3 酸水解氨基酸含量
Fig.3 Acid hydrolyzed amino acid content
3 结论
本研究发现,在挤压前添加迷迭香水提物会导致拉丝蛋白颜色亮度和内部纤维化下降,同时并未对消化性质有显著性提升;添加维生素C可能因为过强的还原性减少拉丝蛋白美拉德反应但更易生成二硫键交联导致分子聚集,从而降低消化率;大豆还原肽的添加使拉丝蛋白内部纤维化程度增加,挤压前后产物的氨基酸包括色氨酸、苏氨酸、精氨酸、缬氨酸、脯氨酸等还原氨基酸留存率显著上升,抑制了美拉德反应减少了氨基酸的损失,消化性质也得到显著提升。以上结论表明挤压前添加大豆还原肽是一种可以提升拉丝蛋白产物消化率的有效途径,同时有助于提高挤压组织化产品和植物基模拟肉产品的营养价值和质地。
[1] VAN DER WEELE C, FEINDT P, JAN VAN DER GOOT A, et al.Meat alternatives:An integrative comparison[J] Trends in Food Science &Technology, 2019, 88:505-512.
[2] KUMAR P, CHATLI M K, MEHTA N, et al.Meat analogues:Health promising sustainable meat substitutes[J] Critical Reviews in Food Science and Nutrition, 2017, 57(5):923-932.
[3] 董萍, 冯叙桥, 冯帆, 等.一种大豆组织蛋白产品的市场调查分析[J].中国粮油学报, 2014, 29(5):10-13.DONG P, FENG X Q, FENG F, et al.Market analysis of a textured soy protein product[J].Journal of the Chinese Cereals and Oils Association, 2014, 29(5):10-13.
[4] MASATCIOGLU T M, NG P K W, KOKSEL H.Effects of extrusion cooking conditions and chemical leavening agents on lysine loss as determined by furosine content in corn based extrudates[J].Journal of Cereal Science, 2014, 60(2):276-281.
[5] PATIL S S, BRENNAN M A, MASON S L, et al.The effects of fortification of legumes and extrusion on the protein digestibility of wheat based snack[J].Foods, 2016, 5(2):26.
[6] 赵谋明, 刘雷, 赵亚琦, 等.美拉德反应对花生分离蛋白体外消化特性的影响[J].四川大学学报(自然科学版), 2017, 54(5):1101-1106.ZHAO M M, LIU L, ZHAO Y Q, et al.Effect of thermal treatment on the in vivo digestion characteristics and antioxidant activity of PPI-glucose[J].Journal of Sichuan University (Natural Science Edition), 2017, 54(5):1101-1106.
[7] GONZ LEZ-VEGA J C, KIM B G, HTOO J K,等.热处理豆粕饲喂生长猪的氨基酸消化率[J].中国饲料, 2015(24):32-37.GONZ
LEZ-VEGA J C, KIM B G, HTOO J K,等.热处理豆粕饲喂生长猪的氨基酸消化率[J].中国饲料, 2015(24):32-37.GONZ LEZ-VEGA J C, KIM B G, HTOO J K, et al.Amino acid digesti bility of heat-treated soybean meal for growing pigs[J].China Feed, 2015(24):32-37.
LEZ-VEGA J C, KIM B G, HTOO J K, et al.Amino acid digesti bility of heat-treated soybean meal for growing pigs[J].China Feed, 2015(24):32-37.
[8] PENG X F, MA J Y, CHEN F, et al.Naturally occurring inhibitors against the formation of advanced glycation end-products[J].Food &Function., 2011, 2(6):289-301.
[9] ALI M, HOMANN T, KHALIL M, et al.Milk whey protein modification by coffee-specific phenolics:Effect on structural and functional properties[J].Journal of Agricultural and Food Chemistry, 2013, 61(28):6911-6920.
[10] PENG H H, ZHANG J, WANG S H, et al.High moisture extrusion of pea protein:Effect of l-cysteine on product properties and the process forming a fibrous structure[J].Food Hydrocolloids, 2022, 129:107633.
[11] 贾旭. 小麦谷朊粉在大豆蛋白挤压组织化中的应用研究[D].郑州:河南工业大学, 2011.JIA X.Study on the application of wheat gluten in soybean protein extrusion texturing[D].Zhengzhou:Henan University of Technology, 2011.
[12] ZHANG J C, LIU L, JIANG Y R, et al.High-moisture extrusion of peanut protein-/carrageenan/sodium alginate/wheat starch mixtures:Effect of different exogenous polysaccharides on the process forming a fibrous structure[J].Food Hydrocolloids, 2020, 99:105311.
[13] 杨竺红. 即食小麦拉丝蛋白素肉饼的研究[D].无锡:江南大学, 2022.YANG Z H.Study on instant wheat fibroin patties[D].Wuxi:Jiangnan university, 2022.
[14] 胡梦姣. 绿原酸水解酶的发酵制备及其在葵花籽水媒法加工中的应用[D].无锡:江南大学, 2017.HU M J.Fermentation preparation of chlorogenic acid hydrolase and its application in aqueous media processing of sunflower seeds[D].Wuxi:Jiangnan University, 2017.
[15] 焦叶. 茶叶中晚期糖基化终末产物的形成及影响因素的研究[D].无锡:江南大学, 2019.JIAO Y.Study on the formation and influencing factors of advanced glycation end products in tea[D].Wuxi:Jiangnan University, 2019.
[16] CAO Y Y, XIONG E M, TRUE A D, et al.The pH-dependent protection of α-galactosidase activity by proteins against degradative enzymes during soymilk in vitro digestion[J].LWT, 2016, 69:244-250.
[17] 马爽. 无机盐对大豆蛋白溶解度及构象影响的研究[D].杭州:浙江工商大学, 2023.MA S.Study on the effect of inorganic salts on the solubility and conformation of soybean protein[D].Hangzhou:Zhejiang Gongshang University, 2023.
[18] ZHANG T, CHEN T T, JIANG H Y, et al.Effect of pH treatment on egg white protein digestion and the peptidomics of their in vitro digests[J].Food Research International, 2023, 173(P1):113327.
[19] ELLIS G P. Advances in Carbohydrate Chemistry[M]. Amsterdam: Elsevier, 1959:63-134.
[20] ERIC K, RAYMOND L V, ABBAS S, et al.Temperature and cysteine addition effect on formation of sunflower hydrolysate Maillard reaction products and corresponding influence on sensory characteristics assessed by partial least square regression[J].Food Research International, 2014, 57:242-258.
[21] GWALA S, PALLARES PALLARES A, P LCHEN K, et al.In vitro starch and protein digestion kinetics of cooked Bambara groundnuts depend on processing intensity and hardness sorting[J].Food Research International, 2020, 137(11):109512.
LCHEN K, et al.In vitro starch and protein digestion kinetics of cooked Bambara groundnuts depend on processing intensity and hardness sorting[J].Food Research International, 2020, 137(11):109512.
[22] 戚繁. 美拉德反应在食品工业中的研究进展[J].现代食品, 2020,26(19):44-46.QI F.Research progress of Maillard reaction in food industry[J].Modern Food, 2020,26(19):44-46.
[23] 韦志彦, 王金水, 张艳, 等.新收获小麦后熟过程中蛋白质和氨基酸含量的变化[J].中国粮油学报, 2010, 25(2):23-30.WEI Z Y, WANG J S, ZHANG Y, et al.Content changes of proteins and amino acids in newly harvested wheat grains during post-maturation[J].Journal of the Chinese Cereals and Oils Association, 2010, 25(2):23-30.
[24] CUI X H, XIONG Y L, KONG B H, et al.Hydroxyl radical-stressed whey protein isolate:Chemical and structural properties[J].Food and Bioprocess Technology, 2012, 5(6):2454-2461.