肌醇又名环已六醇,是一种水溶性维生素,属维生素B族中的一种,是葡萄糖的同分异构体[1]。肌醇是人、动物与微生物生长的必需物质,广泛应用于饲料、医药、食品等行业。传统的肌醇生产方法有水解法和化学合成法[2-3]。随着工艺研究的深入及酶的应用,最近几年又发展出微生物发酵法、酶法、微波辐射法、离子交换法和电渗析法等制取肌醇的方法[4-6]。然而水解法原料和产品分离复杂、成本高、产量低,且污染严重[7]。
体外多酶级联催化体系是遵循所设计的多酶催化路径,由若干生物酶元件构成,在体外将特定的底物转化为目标化合物的生物催化系统[8]。即不同来源的多个纯化/部分纯化的酶和/或(仿生)辅酶在一个反应罐中协同作用,以实现生物级联反应[9]。与传统的生物制造方式及微生物发酵相比,采用耐热酶构建的体外多酶催化级联系统具有很多优点,如产率高、反应速度快、副反应少、易于过程控制和优化,且能耐受微生物无法生存的极端反应环境[10]。迄今为止,体外合成酶生物系统已用于制造各种产品,例如醇(如 2,3-丁二醇)、有机酸(如苹果酸)、异戊二烯、肌醇、生物塑料、氢气和电[11]。
本研究旨在通过体外多酶催化途径高效制备肌醇,该途径包括4个连续的反应步骤(图1)。首先,α-葡聚糖磷酸化酶(α-glucan phosphorylase,αGP)催化淀粉和磷酸盐生成葡萄糖1-磷酸(glucose 1-phosphate,G1P);其次,磷酸葡萄糖变位酶(glucophosphomutase,PGM)将G1P转化为葡萄糖-6-磷酸(glucose-6-phosphate,G6P);再次,肌醇-1-磷酸合酶(inositol-1-phosphate synthase,IPS)将 G6P 异构化为肌醇-1-磷酸(inositol 1-phosphate,I1P);最后,肌醇单磷酸酶(inositol monophosphatase,IMP)将 I1P 去磷酸化为肌醇和磷酸根(Pi),而 Pi 则在反应体系中循环利用。然而,这一转化过程依赖于至少4种酶的协同作用,且酶制剂消耗量大,导致整体成本偏高。IPS是该途径的限速酶,其极低的酶活力是制约该过程反应效率和经济性的关键因素。尽管课题组前期重组表达了来源于闪烁古生球菌(Archaeoglobus fulgidus)的IPS-Af,但是研究发现,该酶活力低,是多酶催化转化过程中酶用量最大的部分。为解决上述问题,本研究在前期研究的基础上,筛选并重组表达了嗜热古菌(Caldivirga maquilingensis)和嗜热新芽孢杆菌(Novibacillus thermophilus)来源的2种IPS,并优化了多酶催化反应条件,以期提高肌醇的转化效率。
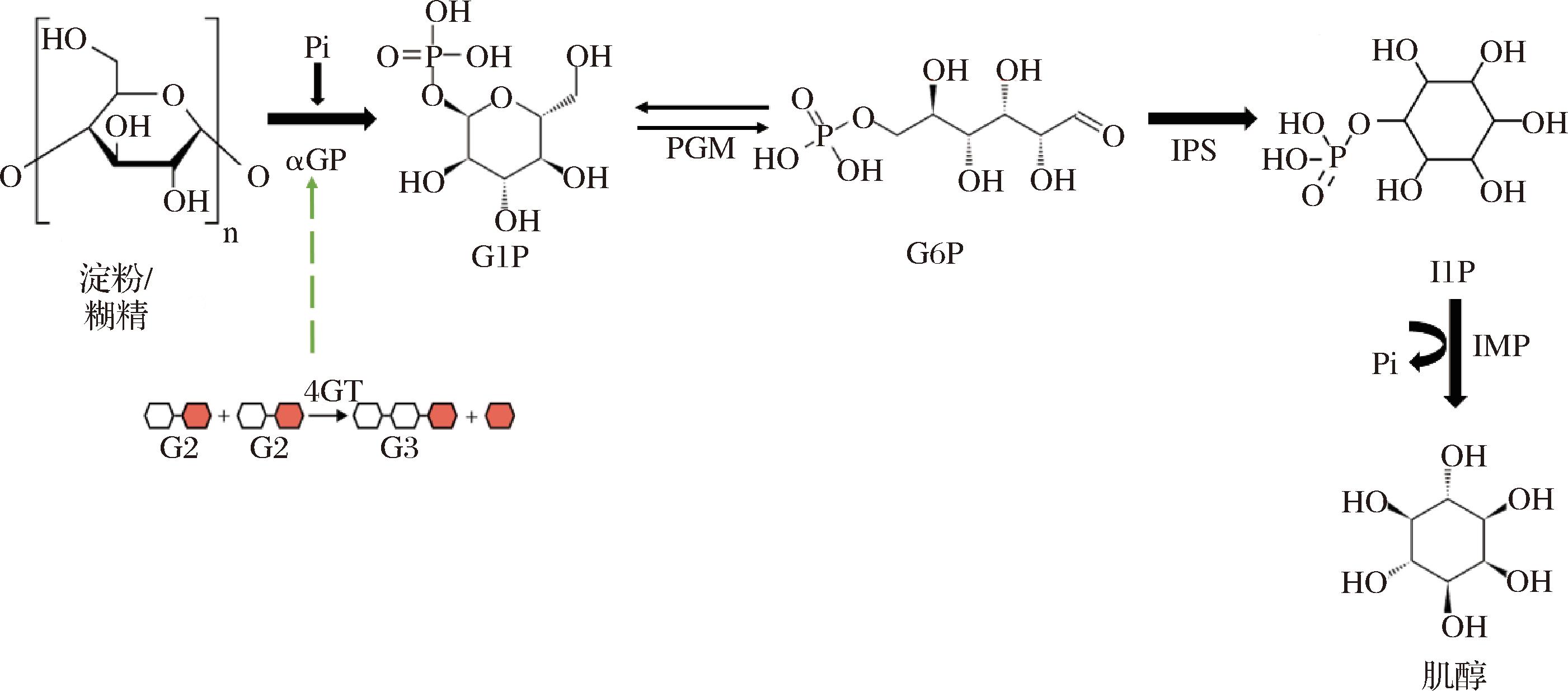
图1 体外多酶级联催化淀粉/糊精制备肌醇的反应途径
Fig.1 In vitro multi-enzyme cascade catalysis for inositol synthesis from starch and dextrin
1 材料与方法
1.1 菌株和质粒
菌株大肠杆菌(Echerichia coil) JM109、E.coli BL21(DE3)为实验室保藏。重组菌株E.coli BL21(DE3)(pET24a/IPS-Af)为前期构建,重组菌株E.coli BL21(DE3)(pET24a/IPS-Cm)和E.coli BL21(DE3)(pET24a/IPS-Nt)由本研究构建。
1.2 试剂与仪器
酵母粉、蛋白胨,英国 Oxoid 公司;蛋白 Marker、SDS-PAGE 电泳试剂,上海碧云天生物技术有限公司;卡那霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactoside,IPTG)、Tris,上海生工生物工程股份有限公司;磷酸氢二钠、磷酸二氢钠、磷酸二氢钾、磷酸氢二钾、氯化钠、甘油、氯化镁、氢氧化钠、盐酸,国药集团化学试剂有限公司;酶制剂αGP、4-α-葡聚糖转移酶(4-α-glucanotransferase,4GT)、PGM、IMP和异淀粉酶(isoamylase,IA),课题组前期制备。
蛋白电泳仪,美国Bio-Rad公司;SBA-40C生物传感分析仪,山东省科学院生物研究所;高效液相色谱仪,美国 Waters 公司。
1.3 培养基
LB 培养基(g/L):酵母粉5.0,胰蛋白胨10,NaCl 10,终质量浓度50 μg/mL的卡那霉素。
TB 培养基(g/L):酵母粉24.0,胰蛋白胨12.0,K2HPO4·3H2O 16.4,KH2PO4 2.3,甘油 5.0,终质量浓度50 μg/mL的卡那霉素。
1.4 实验方法
1.4.1 摇瓶发酵
种子培养:取适量甘油菌接入LB种子培养基,在 37 ℃,200 r/min 条件下培养 8~9 h。培养基使用前添加终质量浓度为50 μg/mL的卡那霉素。
摇瓶发酵培养:将种子液以5% (体积分数)的接种量接入TB发酵培养基中,于 37 ℃、200 r/min 条件下培养 3~4 h后,加入 0.05 mmol/L IPTG 进行诱导表达,继续在30 ℃培养 30 h。培养基使用前添加终浓度为50 μg/mL的卡那霉素。
将摇瓶发酵所得菌液,于4 ℃离心收集菌体、8 000 r/min离心10 min弃上清液,收集菌体;用0.02 mol/L pH 7.0磷酸缓冲溶液进行充分悬浮,在4 ℃下进行超声细胞破碎仪处理细胞,处理方式是:200 W,工作3 s,间歇5 s,共处理10 min。在此过程中,菌液始终置于冰水混合浴中。将细胞破碎液于4 ℃、8 000 r/min离心10 min除去细胞碎片沉淀,上清液即为粗酶液。SDS-PAGE分离胶浓度为12%,浓缩胶浓度为5%,电泳采用pH 8.3的Tris-HCl缓冲体系。电泳后用0.1%考马斯亮蓝G250染色液染色2 h。中间换1次脱色液,然后脱色过夜。
1.4.2 肌醇-1-磷酸合酶活力测定
1.4.2.1 标准曲线的测定
精确称取一定质量的KH2PO4标准品,用0.2 mol/L pH 5.0醋酸缓冲液溶解并混合均匀,配制成0.5 mmol/L的母液。以母液稀释制备0、0.5、1、2、3、4、5、6 μmol/L浓度的标准液,用可见光分光光度计测660 nm处吸光度,以磷浓度为横坐标,660 nm处吸光度为纵坐标,绘制标准曲线,如图2所示。
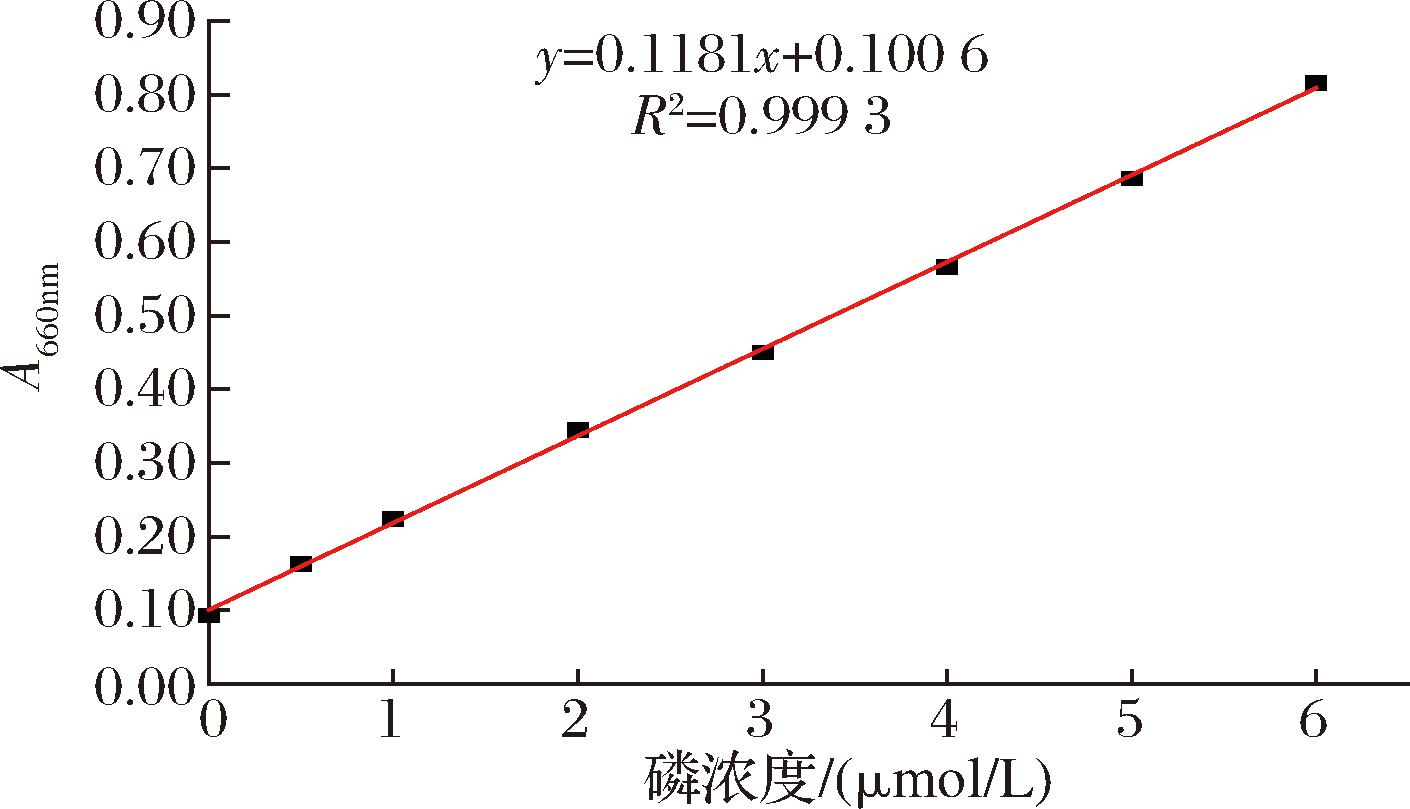
图2 酶活力测定标准曲线
Fig.2 Standard curve for determination of enzyme activity
1.4.2.2 酶活力测定方法
肌醇-1-磷酸合酶活力测定方法参考SAHEKI等[12]并根据所用酶的特点进行调整。先在试管中加入10 mmol/L G6P、32 mmol/L pH 7.0 HEPES缓冲液和100 μL IMP酶液,70 ℃预热 5 min。然后在体系中加入100 μL适当稀释的肌醇-1-磷酸合酶酶液,70 ℃水浴锅中反应10 min,煮沸10 min,停止反应。然后,向试管中移取2 mL钼酸盐试剂和0.2 mL上述反应液,在30 ℃下预热5 min,向各个试管中移取0.5 mL pH 5.0 10%抗坏血酸溶液,30 ℃下反应15 min,取出后测量660 nm 处吸光度。一个酶活力单位(U)被定义为每分钟产生1 μmol产物的酶量。
1.4.3 酶法转化制备肌醇
初始条件为:以50 g/L麦芽糊精为原料,加入aGP 3 U/mL,PGM 3 U/mL,IPS-Cm 0.4 U/mL,IMP 23 U/mL,4GT 0.384 U/mL,0.05 mol/L pH 7.0 PBS缓冲液,0.005 mol/L pH 7.0 Tris-HCl缓冲液,2.5 mmol/L Mg2+,在pH 7.0,70 ℃条件下,反应24 h。后续在初始条件基础上对该途径进行优化,主要考察了加酶量、缓冲液浓度、Mg2+浓度、底物浓度、IA添加、pH、温度和反应时间等条件对肌醇产量的影响。
1.4.4 反应产物的检测
采用HPLC测定反应体系中的肌醇含量,液相设备为Waters e2695,2414 RI 检测器,色谱柱为赛默飞氨基柱Hypersil APS-2(250 mm×4.6 mm,5 μm),流动相为75%乙腈(750 mL乙腈+250 mL纯水),柱温40 ℃,进样量10 μL,流速0.8 mL/min。
2 结果与分析
2.1 肌醇-1-磷酸合酶的重组表达及初步应用
2.1.1 肌醇-1-磷酸合酶的重组表达
首先,以A.fulgidus IPS-Af序列为模板对UniProt蛋白数据库进行blast搜索,筛选潜在的新的肌醇-1-磷酸合酶蛋白。然后,模拟筛选到蛋白的结构,并通过分子对接计算酶与底物结合自由能,选择耐热性和活力可能比较高的两种肌醇-1-磷酸合酶蛋白IPS-Cm和IPS-Nt进行基因合成并构建表达载体。转化宿主菌,得到重组菌株E.coli BL21(DE3) (pET24a/IPS-Af)、E.coli BL21(DE3)(pET24a/IPS-Cm)和E.coli BL21(DE3)(pET24a/IPS-Nt)。
重组菌株在37 ℃条件下进行培养并经过0.05 mmol/L IPTG诱导,30 ℃培养30 h。将摇瓶发酵所得菌液,离心收集菌体,超声细胞破碎仪后得到粗酶液。对重组菌的破碎上清液和破碎沉淀进行SDS-PAGE蛋白电泳检测。如图3所示,重组菌的发酵上清液和全细胞在35~45 kDa有明显条带,与目的重组蛋白理论分子质量相一致。酶活力检测结果表明IPS-Af、IPS-Cm及IPS-Nt酶活力分别为0.2、0.3、1.1 U/mL。酶活力测定及蛋白电泳结果都表明重组肌醇-1-磷酸合酶成功实现了表达。

M-蛋白分子质量标准;S-破碎上清液;T-破碎沉淀
图3 重组酶SDS-PAGE 电泳图
Fig.3 SDS-PAGE electrophoretic diagram of recombinant enzymes
2.1.2 肌醇-1-磷酸合酶在肌醇酶法制备中的初步应用
以50 g/L麦芽糊精为原料,加酶量αGP 3 U/mL,PGM 3 U/mL,IPS 0.4 U/mL,IMP 23 U/mL,4GT 0.384 U/mL,PBS缓冲液浓度0.05 mol/L,Tris-HCl缓冲液浓度0.005 mol/L,Mg2+ 2.5 mmol/L,在pH 7.0,温度70 ℃,反应时间24 h条件下进行了肌醇的初步合成。HPLC检测结果显示,3种肌醇-1-磷酸合酶(IPS-Af、IPS-Cm和IPS-Nt)分别与其他酶复配后,肌醇的产量分别为16.91、20.35、12.72 g/L(表1)。对比3种肌醇-1-磷酸合酶的活力和转化能力,选择IPS-Cm用于后续实验。
表1 不同来源IPS的酶活力及转化效果
Table 1 Enzyme activity and conversion effect of IPS from different sources
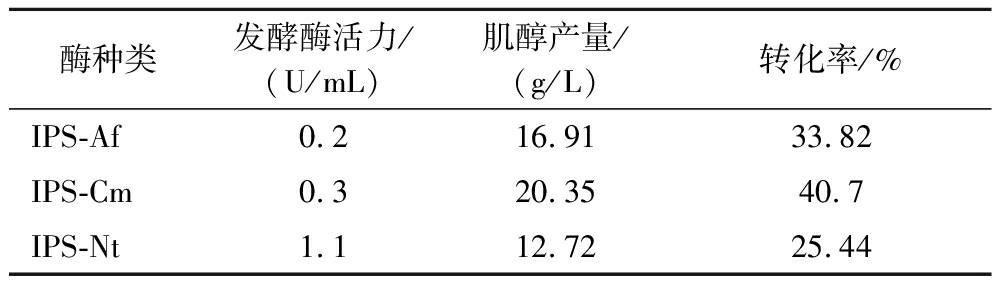
酶种类发酵酶活力/(U/mL)肌醇产量/(g/L)转化率/%IPS-Af0.216.9133.82IPS-Cm0.320.3540.7IPS-Nt1.112.7225.44
此外,为了进一步提高肌醇的产量,本文反应条件进行了优化,考察了加酶量、缓冲液浓度、金属离子浓度、底物浓度、pH值、温度和反应时间等条件对肌醇产量的影响。
2.2 酶法制备肌醇的反应体系优化
2.2.1 PGM加酶量对肌醇产量的影响
为了考察PGM加酶量对肌醇产量的影响,本文选择了0~40 U/mL PGM不同加酶量进行转化制备肌醇。由图4-a可知,随着PGM加酶量的增加,肌醇的产量也在逐渐升高,当PGM加酶量为30 U/mL时,肌醇产量最高,为21.43 g/L,转化率为42.86%。

a-PGM;b-aGP;c-4GT;d-IPS-Cm;e-IMP
图4 加酶量对肌醇产量的影响
Fig.4 Effect of enzyme addition on inositol yield
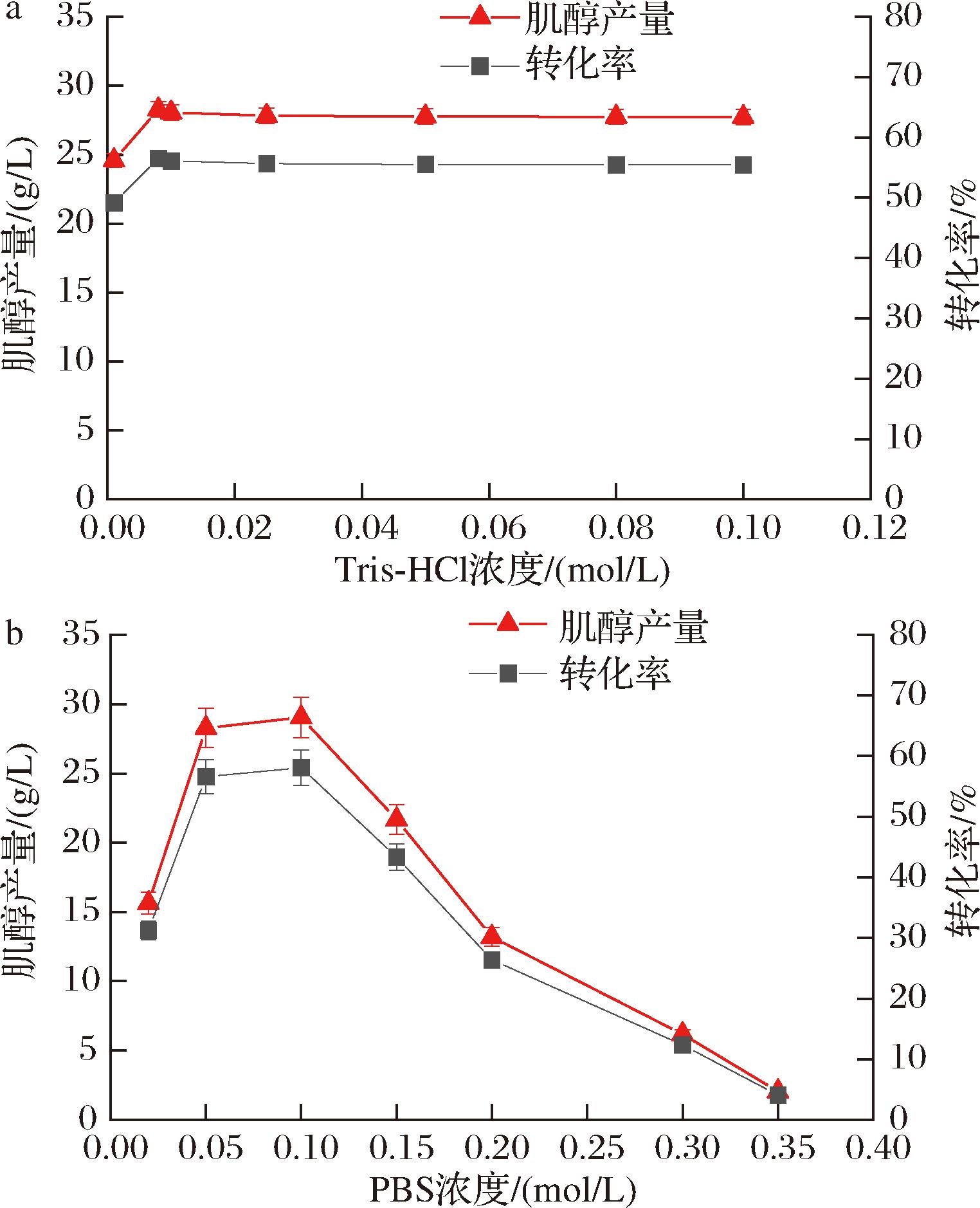
a-Tris-HCl;b-PBS
图5 缓冲液浓度对肌醇产量的影响
Fig.5 Effect of buffer concentration on inositol yield
但是当PGM加酶量为40 U/mL时,肌醇产量不再增加,甚至开始出现下降趋势,这可能是因为PGM加酶量为30 U/mL时,已经使第一步αGP转化麦芽糊精生成的G1P全部转化为G6P,继续增加PGM的加酶量也不会生成更多的肌醇,需要优化第一步αGP的加酶量,使其产生更多的G1P作为PGM的底物;也可能是因为下一步IPS的加酶量不够,无法将PGM转化的G6P全部转化为I1P,因此需要进一步优化IPS的加酶量。
2.2.2 αGP加酶量对肌醇产量的影响
为了考察αGP加酶量对肌醇产量的影响,在PGM加酶量30 U/mL的条件下,选择了0~35 U/mL αGP不同加酶量进行转化制备肌醇。由图4-b可知,随着αGP加酶量的增加,肌醇的产量也逐渐增加。当αGP加酶量为20 U/mL时,肌醇产量最高,为22.01 g/L,转化率为44%。
2.2.3 4GT加酶量对肌醇产量的影响
αGP催化淀粉发生可逆性磷酸解反应形成葡萄糖-1-磷酸时伴随着麦芽糖的生成,但是αGP对长链麦芽糖低聚糖(如麦芽糖四糖或更长)比对麦芽糖更有效。随着反应的进行,麦芽糖含量增加导致G1P合成效率降低,从而影响肌醇的进一步合成。4GT可以将麦芽糖或麦芽糖的无水葡萄糖单元转移到另一个麦芽糖上,产生更长的链,使αGP可以继续利用这种长链糊精生成G1P,提高了底物的利用率。因此,考察了0~1.4 U/mL的4GT加酶量对肌醇产量的影响。由图4-c所示,随着4GT加酶量的增加,肌醇产量先增加后减少,这可能是因为4GT具有多种活性,可以催化环化和歧化等其他反应。加酶量过大时,也可以将淀粉转化为环糊精或者胶状物,反而不利于G1P和肌醇的合成。当4GT加酶量为0.5 U/mL时,肌醇产量最高,为25.72 g/L,转化率为51.45%。
2.2.4 IPS-Cm加酶量对肌醇产量的影响
为了考察IPS-Cm加酶量对肌醇产量的影响,在PGM加酶量30 U/mL,aGP加酶量为20 U/mL的条件下,选择了0~0.84 U/mL IPS-Cm不同加酶量进行转化制备肌醇。如图4-d可知,随着IPS-Cm加酶量的增加,肌醇的产量也在逐渐升高,并趋于稳定,当IPS-Cm加酶量为0.7 U/mL时,肌醇产量达到最高,为26.09 g/L,转化率52.18%。继续增加IPS-Cm加酶量,肌醇产量不再升高。这可能是因为目前体系中IMP加酶量太少导致反应不完全,因此后续继续对IMP的加酶量进行优化。
2.2.5 IMP加酶量对肌醇产量的影响
为了考察IMP加酶量对肌醇产量的影响,在PGM加酶量30 U/mL,αGP加酶量为20 U/mL,IPS加酶量为0.7 U/mL的条件下,选择了0~60 U/mL IMP不同加酶量进行转化制备肌醇。由图4-e所示,随着IMP加酶量的增加,肌醇的产量先增加后趋于稳定。当IMP加酶量为9.7 U/mL时,肌醇产量达到最高,为27.64 g/L,转化率55.27%。继续增加IMP加酶量,肌醇产量不再升高。
2.2.6 缓冲液类型和浓度对肌醇产量的影响
程琨[15]的研究表明,在反应体系中可能存在美拉德反应影响肌醇产量,而Tris-HCl的美拉德反应最轻,因此,本研究选用pH 7.0 Tris-HCl缓冲液来补足体系,维持体系pH值。因此,本研究以0~0.1 mol/L Tris-HCl缓冲液浓度为研究对象,考察了其对肌醇产量的影响。由图5-a可知,随着Tris-HCl缓冲液浓度的升高,肌醇产量先升高后轻微降低并趋于平稳,当Tris-HCl浓度为0.008 mol/L时,肌醇产量最高,为28.28 g/L,转化率56.57%。因此,认为Tris-HCl的最佳浓度为0.008 mol/L。
由图1可知,体外多酶级联催化淀粉生成肌醇的途径需要提供Pi,但是在IMP将I1P去磷酸化这一步中会生成肌醇和Pi,使得体系中的Pi循环利用。因此,本研究采用的是pH 7.0 PBS缓冲液,以0~0.35 mol/L的PBS缓冲液浓度为研究对象,考察了其对肌醇产生的影响。由图5-b可知,随着PBS浓度的增加,肌醇的产量先增加后减少,当PBS浓度为0.1 mol/L时,肌醇产量最高,为29.04 g/L,转化率提高至58.09%。这是因为较高浓度的Pi会抑制IPS的活性,限制了G6P向I1P的生物转化,从而造成肌醇产量下降。
2.2.7 Mg2+浓度对肌醇产量的影响
据报道,αGP和IPS的催化反应都需要Mg2+的参与,Mg2+是αGP和IPS的最佳激活剂[16-17]。因此以0~20 mmol/L Mg2+浓度为研究对象,考察了Mg2+浓度对肌醇产量的影响。如图6-a所示,随着Mg2+浓度的升高,肌醇产量先升高后降低,然后趋于平稳。这可能是因为当Mg2+浓度过低时,αGP和IPS未被全部激活,从而影响酶催化反应;当Mg2+浓度过高时,过量的未与酶分子结合的Mg2+与磷酸盐形成沉淀,从而导致肌醇的产量降低[18]。当Mg2+浓度为5 mmol/L时,肌醇产量最高,为29.75 g/L。
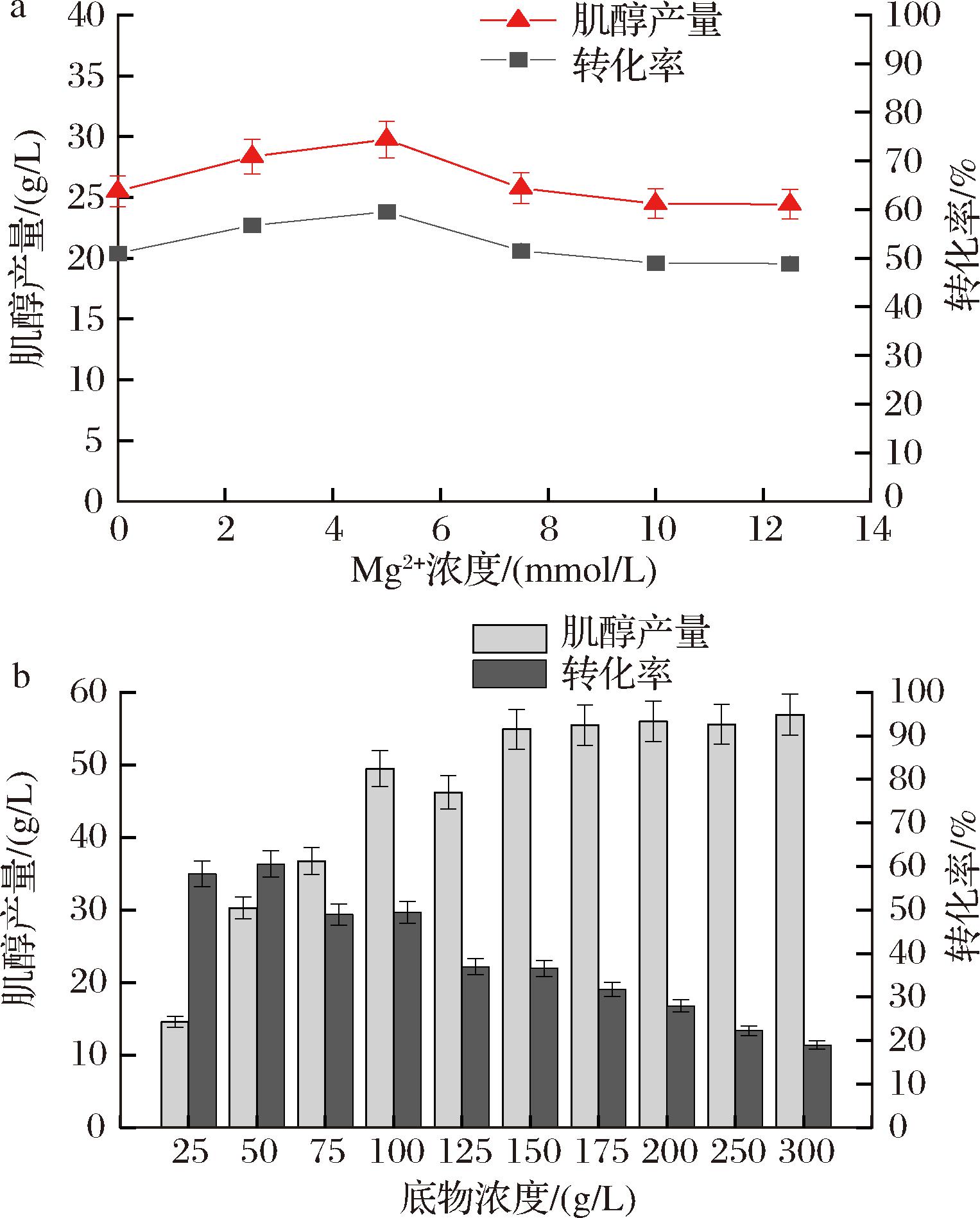
a-Mg2+浓度;b-底物浓度
图6 Mg2+浓度和底物浓度对肌醇产量的影响
Fig.6 Effect of Mg2+ concentration and substrate concentration on inositol yield
2.2.8 底物浓度对肌醇产量的影响
由化学平衡可知,提高底物浓度,可推动反应朝正向进行,促进肌醇的生产。此外,在酶促反应中,如果底物的量超过酶量,则随着底物浓度的增加,酶促反应速率逐渐加快,但是当达到某一值后,酶分子已经全部被底物饱和,反应将不再随着底物浓度的增加而增加,而是保持最大反应速度。为了确定反应最佳底物浓度,以25~300 g/L底物浓度为研究对象,考察了其对肌醇产生的影响。如图6-b所示,随着底物浓度的升高,肌醇产量也在逐渐升高,当底物质量浓度为300 g/L时,肌醇产量最高56.89 g/L,但其转化率仅仅为18.96%。当底物质量浓度为50 g/L时,转化率最高为60.55%,但肌醇产量仅有30.27 g/L。综合考虑后,选择50 g/L的麦芽糊精作为转化的最佳质量浓度。
2.3 IA在酶法制备肌醇的应用
进一步分析发现,上述优化过程对肌醇的产量的提高幅度有限,原因可能是因为底物中存在α-1,6糖苷键[19],αGP对含有α-1,6糖基键底物的利用率有限,导致G1P合成效率低,最终影响到肌醇产量[20]。IA可以水解糖原和支链淀粉中的α-1,6-糖苷支键,产生线性糊精,对αGP的转化具有促进作用[21]。
由图7可知,在转化前添加IA进行脱支,肌醇产量大幅提高,当IA加酶量为19 U/mL时,肌醇产量为35.34 g/L,转化率为70.68%。与对照(不加IA)相比,产量提高了约1.2倍。
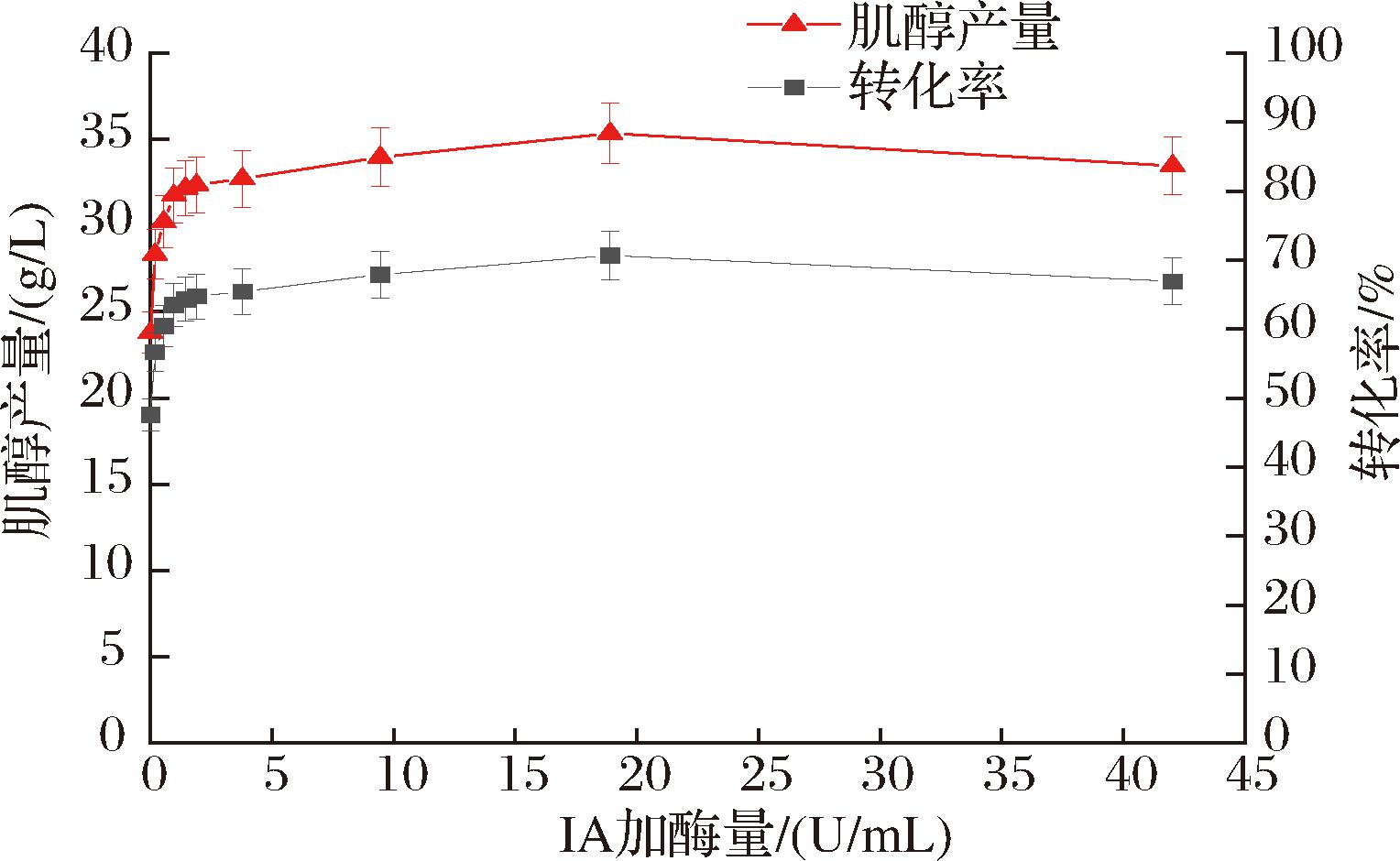
图7 IA加酶量对肌醇产量的影响
Fig.7 Effects of IA enzyme dosage on inositol yield
2.4 酶法制备肌醇的反应条件优化
2.4.1 pH值对肌醇产量的影响
在酶促反应过程中,pH值对酶活力的影响非常重要。在强酸或强碱的环境下酶蛋白会变性失活;其次,环境的酸碱性对酶活性基团和底物的解离程度有着很大的影响。只有当底物和酶活性基团的解离程度最佳时,反应速度才会最快。因此,分别选择不同pH值条件,考察pH值对肌醇产量的影响。结果发现,在pH 3.0、5.0、6.0、9.0、10.0时,没有肌醇产生,说明本文中所用到的几种酶协同作用的pH值范围较窄,较高或者较低的pH都会使酶反应无法进行。由图8-a可知,pH值为7.0时,肌醇产量最高,为36.92 g/L,转化率73.84%。
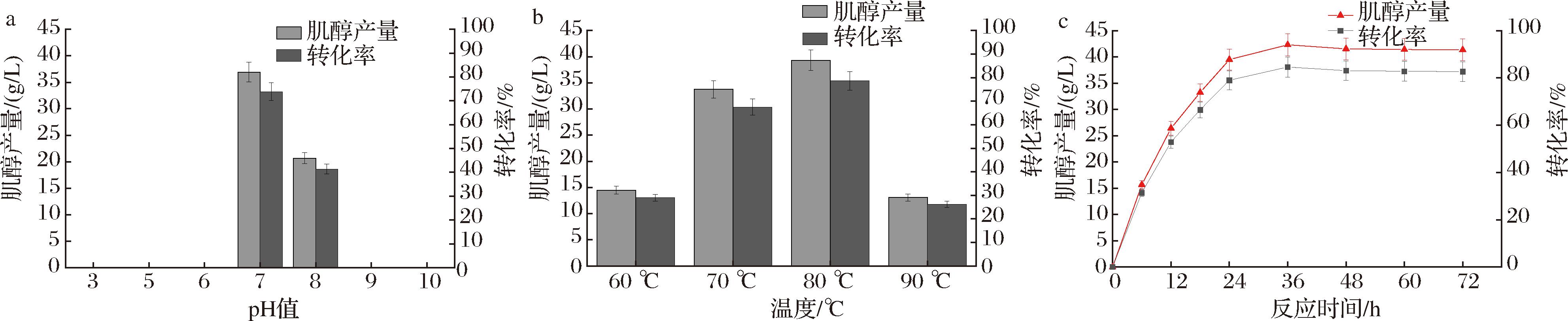
a-pH值;b-温度;c-反应时间
图8 反应条件对肌醇产量的影响
Fig.8 Effect of reaction conditions on inositol yield
2.4.2 反应温度对肌醇产量的影响
反应温度对产量有着至关重要的作用。酶都有最适催化温度,若超过该温度,就会影响酶的活性,破坏自身结构,造成酶的失活;若低于最适温度,酶活就会被抑制,从而减少产物的产量。由图8-b可知,随着温度的升高,肌醇产量先升高后降低,当温度为80 ℃时,肌醇产量最高,可达到39.3 g/L,转化率升高至78.6%。这可能是因为80 ℃时该多酶催化体系中各个酶协同性最好,转化效果最好。因此,转化的最佳温度为80 ℃。
2.4.3 反应时间对肌醇产量的影响
反应时间对酶催化反应也有重要影响。时间太短,酶催化反应进行的不完全,导致产物产量低;时间太长,底物逐渐消耗,产物逐渐增多,从而抑制了酶促反应进行,反应速率下降。因此,本研究以0~72 h为研究对象,考察了反应时间对肌醇产量的影响。由图8-c所示,随着反应时间的延长,肌醇的产量先升高然后趋于平稳。这可能是酶的稳定性与反应时间有关,随着时间变长,酶的空间结构会变化,酶活性降低,所以肌醇产量不再增多[22]。当反应时间为36 h时,肌醇产量最高,达到42.3 g/L,转化率为84.6%,较初始转化条件提高了2.1倍。
3 结论
体外多酶催化级联系统制备肌醇具有绿色环保、产率高和反应速度快等许多优势。然而,酶制剂用量大、成本较高的问题阻碍了这一新兴生物制造平台的发展。主要原因是限速酶IPS活力极低,导致成本较高,肌醇产量较低。因此,本文在课题组前期重组表达了肌醇-1-磷酸合酶IPS-Af的基础上,通过基因挖掘,获得了两种肌醇-1-磷酸合酶蛋白IPS-Cm和IPS-Nt,在大肠杆菌中实现了其可溶性表达,并对比了3种肌醇-1-磷酸合酶的酶活力和转化制备肌醇的能力(表1)。结果表明,酶活力由高到低分别为IPS-Nt,IPS-Cm,IPS-Af。其中IPS-Cm转化制备肌醇的效果最好。尽管IPS-Nt的酶活力最高,但是其转化制备肌醇的能力较差,这可能是因为,IPS-Nt的来源并不是极端嗜热菌,其在70 ℃温度下稳定性较差。综合考虑,选择IPS-Cm用于肌醇的制备。在初始条件下,肌醇产量为20.35 g/L,转化率40.7%。
为了进一步提高肌醇的产量,分别对加酶量、缓冲液浓度、金属离子、底物浓度、温度、pH值和反应时间等条件进行了优化。得到体外多酶级联催化制备肌醇的最佳条件为PGM 30 U/mL,αGP 20 U/mL,IPS-Cm 0.7 U/mL,IMP 9.7 U/mL,4GT 0.5 U/mL,PBS缓冲液浓度0.1 mol/L,Tris-HCl缓冲液浓度0.008 mol/L,Mg2+ 5 mmol/L,50 g/L底物,IA 19 U/mL,pH 7.0,温度80 ℃,反应36 h。在此条件下,肌醇产量最高,达到42.3 g/L,转化率为84.6%,较初始转化条件提高了2.1倍。
本研究证明了将IPS-Cm应用于体外多酶级联催化制备肌醇途径的可行性,并实现了肌醇的高效制备,对未来肌醇的生产具有一定的参考价值。后续研究可以从酶的蛋白质改造手段入手,对IPS蛋白质分子结构进行改造,以构建出稳定性更好、酶活力更高的突变体,进一步提高肌醇的生产效率。
[1] 张芹, 王芳, 陈雅蕾, 等.肌醇生产及应用研究进展[J].中国稻米, 2012, 18(3):19-21.ZHANG Q, WANG F, CHEN Y L, et al.Research progress on inositol production and application[J].China Rice, 2012, 18(3):19-21.
[2] SHAFIE N H, MOHD ESA N, ITHNIN H, et al.Preventive inositol hexaphosphate extracted from rice bran inhibits colorectal cancer through involvement of Wnt/β-catenin and COX-2 pathways[J].BioMed Research International, 2013,2013:681027.
[3] 孙灵霞, 陈锦屏.肌醇生产, 应用研究及前景展望[J].粮食与油脂, 2004, (11):6-8.SUN L X, CHEN J P.The production, application and prospect of inositol[J].Journal of Cereals &Oils, 2004, (11):6-8.
[4] YOU R, WANG L, SHI C R, et al.Efficient production of myo-inositol in Escherichia coli through metabolic engineering[J].Microbial Cell Factories, 2020, 19(1):109.
[5] GUNASHREE B S, VENKATESWARAN G.Enhanced phytase production through interspecific protoplast fusion of Aspergillus niger CFR 335 and Aspergillus ficuum SGA 01 auxotrophic mutants[J].Enzyme and Microbial Technology, 2010, 46(7):562-567.
[6] 潘声龙. 由玉米浸渍水制取肌醇的工艺研究[D].天津:天津大学, 2008.PAN S L.Study on technology of producing inositol from corn impregnated water[D].Tianjin:Tianjin University, 2008.
[7] 刘文宝, 金玉坤, 游松.肌醇制备方法的现状与进展[J].沈阳药科大学学报, 2012, 29(3):234-240.LIU W B, JIN Y K, YOU S.Current situation and development of the study on preparation methods of myo-inositol[J].Journal of Shenyang Pharmaceutical University, 2012, 29(3):234-240.
[8] 魏欣蕾, 游淳.体外多酶分子机器的现状和最新进展[J].生物工程学报, 2019, 35(10):1870-1888.WEI X L, YOU C.In vitro multi-enzyme molecular machines-a review[J].Chinese Journal of Biotechnology, 2019, 35(10):1870-1888.
[9] MENG D D, WEI X L, ZHANG Y H P J, et al.Stoichiometric conversion of cellulosic biomass by in vitro synthetic enzymatic biosystems for biomanufacturing[J].ACS Catalysis, 2018, 8(10):9550-9559.
[10] ZHANG Y H.Production of biocommodities and bioelectricity by cell-free synthetic enzymatic pathway biotransformations:Challenges and opportunities[J].Biotechnology and Bioengineering, 2010, 105(4):663-677.
[11] LIU M X, HAN P P, ZHANG L L, et al.Biofilm-mediated immobilization of a multienzyme complex for accelerating inositol production from starch[J].Bioconjugate Chemistry, 2021, 32(9):2032-2042.
[12] SAHEKI S, TAKEDA A, SHIMAZU T.Assay of inorganic phosphate in the mild pH range, suitable for measurement of glycogen phosphorylase activity[J].Analytical Biochemistry, 1985, 148(2):277-281.
[13] YOU C, SHI T, LI Y J, et al.An in vitro synthetic biology platform for the industrial biomanufacturing of myo-inositol from starch[J].Biotechnology and Bioengineering, 2017, 114(8):1855-1864.
[14] LI Y J, HAN P P, WANG J, et al.Production of myo-inositol:Recent advance and prospective[J].Biotechnology and Applied Biochemistry, 2022, 69(3):1101-1111.
[15] 程琨. 肌醇体外合成途径的构建及其对小麦抗逆性影响的研究[D].河南:河南农业大学, 2019.CHENG K.Construction of in vitro synthesis pathway of inositol and its effect on wheat stress resistance[D].Henan:Henan Agricultural University, 2019.
[16] YE X H, ROLLIN J, ZHANG Y H P.Thermophilic α-glucan phosphorylase from Clostridium thermocellum:Cloning, characterization and enhanced thermostability[J].Journal of Molecular Catalysis B:Enzymatic, 2010, 65(1-4):110-116.
[17] CHEN L, ZHOU C, YANG H, et al.Inositol-1-phosphate synthase from Archaeoglobus fulgidus is a class II aldolase[J].Biochemistry, 2000, 39(40):12415-12423.
[18] MENG Q L, ZHANG Y F, JU X Z, et al.Production of 5-aminolevulinic acid by cell free multi-enzyme catalysis[J].Journal of Biotechnology, 2016, 226:8-13.
[19] RAIGOND P, EZEKIEL R, RAIGOND B.Resistant starch in food:A review[J].Journal of the Science of Food and Agriculture, 2015, 95(10):1968-1978.
[20] ZHOU W, YOU C, MA H W, et al.One-pot biosynthesis of high-concentration α-glucose 1-phosphate from starch by sequential addition of three hyperthermophilic enzymes[J].Journal of Agricultural and Food Chemistry, 2016, 64(8):1777-1783.
[21] CHENG K, ZHANG F, SUN F F, et al.Doubling power output of starch biobattery treated by the most thermostable isoamylase from an archaeon Sulfolobus tokodaii[J].Scientific Reports, 2015, 5:13184.
[22] OVISSIPOUR M, ABEDIAN A, MOTAMEDZADEGAN A, et al.The effect of enzymatic hydrolysis time and temperature on the properties of protein hydrolysates from Persian sturgeon (Acipenser persicus) viscera[J].Food Chemistry, 2009, 115(1):238-242.