河鲈作为中国最主要的淡水鱼之一,它脂肪含量低,蛋白质丰富,且含有矿物质、维生素、必需氨基酸和必需脂肪酸等多种营养物质。因其水分含量较高,在冷冻和贮藏过程中易受内源酶的影响,引起品质劣变[1]。为了降低河鲈的品质劣变,通常使用不同的冷冻手段以延长其保质期[2-3]。但是河鲈在冷冻过程中仍会发生品质劣变。在冷冻过程中,冰晶的形成和生长会对细胞和组织造成机械损伤并形成冷冻浓缩效应,加快河鲈体内的生化反应速率并影响相关理化指标,如水分损失、脂质氧化、ATP代谢等[4]。
冷冻食品的品质与冰晶的大小、形态和分布密切相关。缓慢冻结容易形成大而不规则的细胞外冰晶,对细胞产生了较大的机械损伤;快速冻结使细胞内和细胞外形成细小冰晶,均匀地分布在肌纤维内,从而减小了对细胞的机械损伤[5-6]。因此,速冻通常用于冷冻水产品的保鲜[7]。与传统空气冻结(air freezing, AF)相比,浸渍冻结(immersion freezing, IF)和液氮冻结(liquid nitrogen freezing, LNF)使用液体冷却剂作为传热介质,由于其高传热系数而具有较高的冻结速率,进而改善了冷冻食品的品质。TENG等[8]研究发现使用液氮冻结到-80 ℃,能有效改善冷冻太平洋牡蛎的品质。
为了揭示不同冷冻速率对贮藏期间河鲈鱼片品质特性的影响,本研究探究了液氮冻结、浸渍冻结、空气冻结对河鲈鱼片理化指标的影响。这项研究将为河鲈在冷冻贮藏过程中品质变化提供理论依据,并为改善河鲈冷冻贮藏过程中的品质劣变提供新见解。
1 材料与方法
1.1 材料与试剂
无水乙醇、三氯甲烷、冰醋酸、二甲苯、切片石蜡、三氯乙酸、EDTA、丙二醛、硫代巴比妥酸、高氯酸、磷酸二氢钠、磷酸氢二钠、氢氧化钠、盐酸(均为分析纯),国药集团化学试剂有限公司;液氮,无锡太湖气体有限公司。
1.2 仪器与设备
BC/BD-301HD冰箱(-18 ℃)、DW/BD-55 W321EU1冰箱(-60 ℃),青岛海尔特种电冰柜有限公司;XODC-4030低温恒温槽,南京先欧仪器制造有限公司;UT322高精度接触式温度计,优利德集团有限公司;EL204电子天平、PL2002电子天平、Seven Compact型pH计,梅特勒-托利多仪器(上海)有限公司;TA.XT-Plus物性分析仪,英国Stable Micro System公司;X1R型高速冷冻离心机,美国赛默飞世尔科技有限公司;T18 basic高速分散机,德国IKA公司;石蜡包埋机、手动轮转切片机、光学显微镜,德国徕卡公司;DZK型恒温水浴锅,中国上海一恒科学仪器有限公司;UV-2700型紫外-可见分光光度计,日本岛津公司;Waters 1525EF型高效液相色谱仪,美国沃特世公司。
1.3 实验方法
1.3.1 样本处理及分组
新鲜河鲈购于无锡市京沪时代超市。敲晕、去鳞、去内脏,将其对半切开,去除鱼骨,得到长15 cm、宽11 cm的鱼片,质量为(115±10) g。将处理好的河鲈鱼片随机分为6组,对照组(新鲜河鲈,Fresh);液氮冻结组(LNF);浸渍冻结组:-40 ℃浸渍冻结(IF-40 ℃)、-18 ℃浸渍冻结(IF-18 ℃);空气冻结组:-60 ℃空气冻结(AF-60 ℃)、-18 ℃空气冻结(AF-18 ℃)。
本研究采用3种冻结方式。LNF样品浸没到液氮中进行冷冻,当样品中心温度达到-18 ℃时,立即转移到-18 ℃冰箱贮存;IF样品采用装有无水乙醇的低温恒温槽中进行冷冻,将低温恒温槽的运行温度调到-40、-18 ℃,当样品中心温度达到-18 ℃时,立即转移到-18 ℃冰箱贮存;AF样品在-60、-18 ℃的冰箱中进行冷冻并贮存。冷冻样品采用20 ℃流水解冻方式进行解冻,在0、30、60、120 d取样进行指标测定。
1.3.2 冻结曲线
冻结曲线的测定参考WU等[9]的方法,并稍作修改。在鱼体中心位置插入热电偶探头后装入自封袋内,分别置于-18 ℃冰箱、-60 ℃冰箱,-18 ℃低温恒温槽、-40 ℃低温恒温槽、液氮中。采用热电偶实时记录不同冻结过程中河鲈鱼片的中心温度。以冻结时间为横坐标、中心温度为纵坐标绘制河鲈鱼片的冻结曲线。
1.3.3 解冻损失
解冻损失的测定参照李冬妮[10]的方法,并稍作修改。将样品冻结前称重记录为m1,将冷冻样品装入密封袋于20 ℃流水中解冻至样品中心温度达到4 ℃ 取出。用滤纸吸干表面水分称重记录为m2。解冻损失的计算如公式(1)所示:
解冻损失![]()
(1)
1.3.4 冰晶分布
冰晶的分布采用DIAO等[11]的方法,并稍作修改。将冷冻样品切成5 mm×5 mm×2 mm的立方体,浸入预冷Carnoy溶液中(30%氯仿-60%无水乙醇-10%冰醋酸,体积分数),并在-20 ℃下固定24 h。取出样品分别在70%、85%、95%(体积分数)乙醇中脱水30 min,再转入无水乙醇中脱水15 min 2次。浸没于二甲苯中透明组织20 min 2次,使组织块透明。浸蜡3 h,进行包埋、切片、HE染色、光学显微镜观察并分析。
1.3.5 微观组织结构
将解冻样品切成5 mm×5 mm×3 mm的立方体(取鱼背部分),在多聚甲醛(4%,质量分数)中浸泡24 h以固定。在室温下用75%(体积分数)乙醇脱水,然后用二甲苯中透明组织20 min/2次,使组织块透明。浸蜡3次,进行包埋、切片、HE染色、光学显微镜观察并分析。
1.3.6 质构
河鲈鱼片蒸制完成后,取河鲈背部肌肉。测定参数如下:TDT模式,P2探头,一次形变量30%,二次形变量50%,触发力5 g,测定前速度1 mm/s,测试中及测试后速度3 mm/s。共设定3组平行,每组测定6次,计算表面硬度、弹性。
1.3.7 硫代巴比妥酸值(thiobarbituric acid reactive substances, TBARs)
TBARs值的测定参照CHAI等[12]的方法,并稍作修改。取10 g搅碎的肉,加入25 mL三氯乙酸混合溶液(75 g/L三氯乙酸、1 g/L的EDTA)均质30 s,将样品置于恒温振荡器上50 ℃振摇30 min,冷却至室温,用双层定量慢速滤纸过滤,弃去初滤液。
准确移取5 mL滤液和标准系列溶液于25 mL具塞试管中,在试管中分别加入5 mL 0.02 mol/L的硫代巴比妥酸溶液,90 ℃水浴加热30 min,于532 nm处测定吸光度值。TBARs的测定结果由样品中丙二醛(malondialdehyde, MDA)的质量分数(mg/kg)表示,其计算如公式(2)所示:
(2)
式中:c,由标准曲线计算出的试样溶液丙二醛的浓度,μg/mL;V,试样溶液定容体积,mL;m,最终试样溶液所代表的试样质量,g;1 000,换算系数。
1.3.8 K值
K值的测定参照WEI等[13]的方法,并稍作修改。取2.0 g搅碎的肉,加入20 mL 5%(体积分数)高氯酸,均质30 s,于4 ℃下8 000 r/min离心10 min,收集上清液。将上清液pH值调至6.0~6.4,用4 ℃水定容至50 mL。取1 mL溶液0.22微孔滤膜过滤。采用HPLC进行分析。K值的计算如公式(3)所示:
(3)
式中:MATP、MADP、MAMP、MIMP、MHxR、MHx,ATP、ADP、AMP、IMP、HxR、Hx的含量,μmol/g。
1.4 数据处理
实验数据采用IBM SPSS Statistics 26进行单因素分析、邓肯方差分析法,同时使用Origin 2024软件进行图表绘制。
2 结果与分析
2.1 冻结曲线
冷冻过程分为预冷阶段、相变阶段和过冷阶段[14]。相变阶段,会出现一段较为平缓的曲线,这是由于冷冻过程中晶核向冰晶转变并释放潜热导致的。当样品通过相变阶段时,即通过最大冰晶生成带(-5~0 ℃),80%以上的水分被冷冻[15]。
如图1-A所示,冷冻速率从大到小依次为:LNF>IF-40 ℃>IF-18 ℃>AF-60 ℃>AF-18 ℃。AF-18 ℃和AF-60 ℃组冻结曲线在0 ℃前逐渐下降、0 ℃时呈现一段极为平缓的阶段,而LNF、IF-40 ℃、IF-18 ℃组因初始温差大、热交换剧烈,几乎无平缓阶段,温度急剧下降。如图1-B所示,通过最大冰晶生成带(-5~0 ℃)的时间:LNF为18 s,IF-40 ℃为5 min,IF-18 ℃为7 min,AF-60 ℃为46 min,AF-18 ℃为225 min。结果显示,LNF组通过最大冰晶生产带的时间最短,极大地加快了鱼片的冻结速率。

A-不同冻结速率下河鲈鱼片的冻结曲线; B-通过最大冰晶生成带(-5~0 ℃)的时间
图1 不同冻结速率下河鲈鱼片的冻结曲线以及通过 最大冰晶生成带(-5~0 ℃)的时间
Fig.1 Freezing curves of Perca fluviatilis fillets under different freezing methods and time to pass through the zone of maximum ice crystal production
2.2 解冻损失
解冻损失代表了肌肉的持水能力,是评价鱼肉品质变化的重要指标[16]。冷冻河鲈鱼片肌肉的持水能力会随着冷冻贮藏时间的延长而下降(图2)。AF-18 ℃和AF-60 ℃组具有较大的解冻损失,特别是在60 d后。这是由于AF处理使样品形成大而不规则的冰晶,对细胞结构造成了严重的机械损伤;解冻后,融化的水很难被肌纤维完全吸收,导致解冻损失增加。此外,LNF、IF组在贮藏前期解冻损失显著高于AF组,这可能是由于较快的冻结速率对细胞结构的机械损伤较小,但会使样品变得脆弱,承受应力的能力减弱[4],当解冻速率较快时,冰晶的融化和水分的迁移产生的内应力破坏了原本脆弱的细胞结构,使水分大量流失[17]。与AF相比,LNF、IF解冻损失的增长缓慢,这可能是由于LNF、IF的冻结速率较快,冰晶小而均匀,贮藏过程中冰晶生长对细胞结构和肌原纤维的破坏程度较小。120 d时,IF-40 ℃组的解冻损失显著低于其他处理组(P<0.05),表明IF-40 ℃组在缓解样品解冻损失方面最具优势。
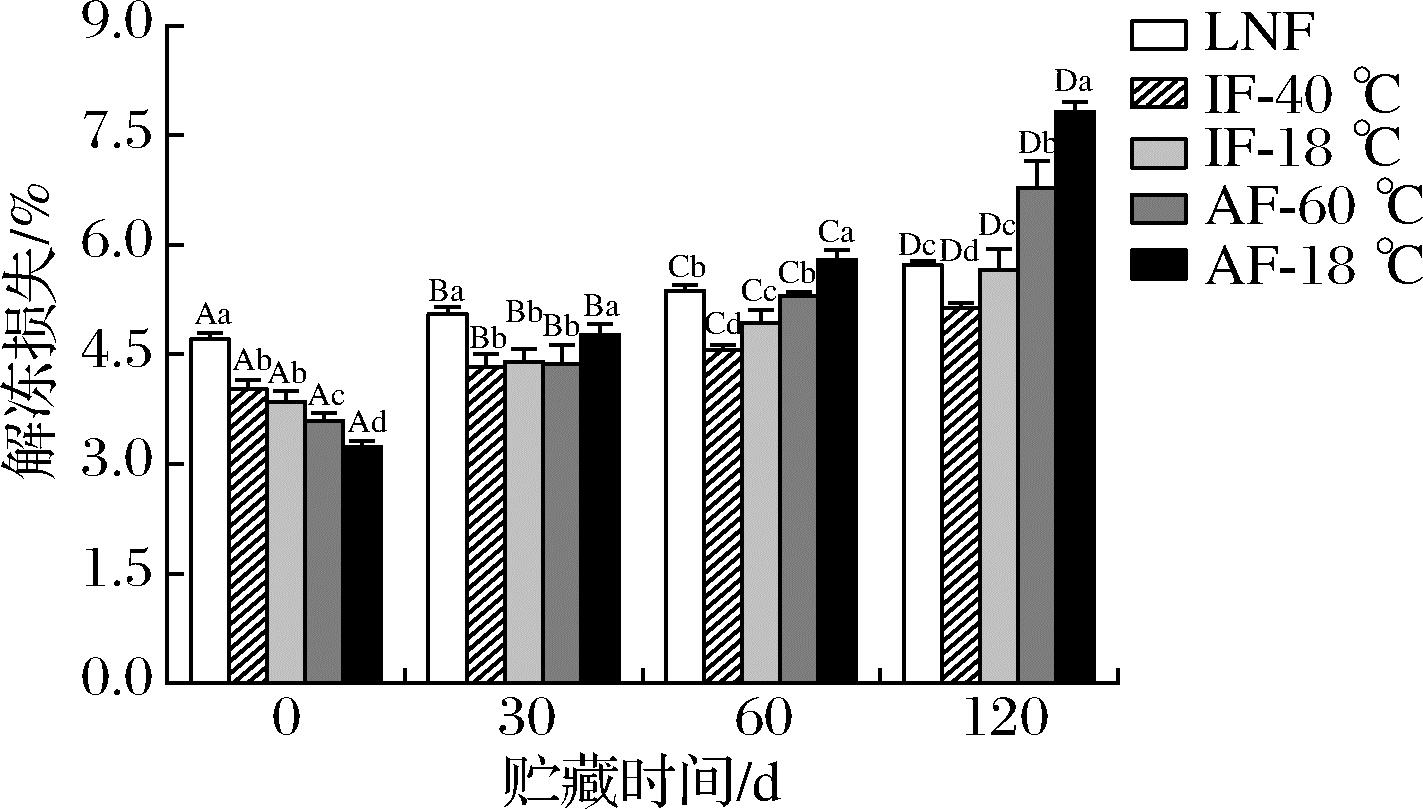
图2 不同冻结速率对贮藏期间河鲈鱼片解冻损失的影响
Fig.2 Effect of different freezing rates on thawing loss of Perca fluviatilis fillets during storage
注:图中小写字母表示不同冻结速率之间存在显著性差异, 大写字母表示不同贮藏时间之间存在显著性差异(P<0.05)(下同)。
2.3 冰晶分布
冰晶生长是冻结过程中造成冻品肌肉纤维结构受损、持水力下降、色泽和质构改变等的重要原因[4],而冻结速率对冰晶的尺寸、数量和分布形态有重要作用[5,18]。图3显示了河鲈鱼片肌肉中冰晶结构。红色区域表示肌肉纤维,白色区域表示冰晶形成的空白区域。在0 d时,AF冷冻处理后的样品观察到不规则、大而不均匀的冰晶,细胞内部出现较大冰晶造成的大空白区域,更易对细胞造成不可逆的组织破裂和细胞内容物泄露;LNF和IF冷冻处理后的样品形成的冰晶细小而均匀,肌纤维分布均匀而规则,肌肉组织受到损伤较小[19]。
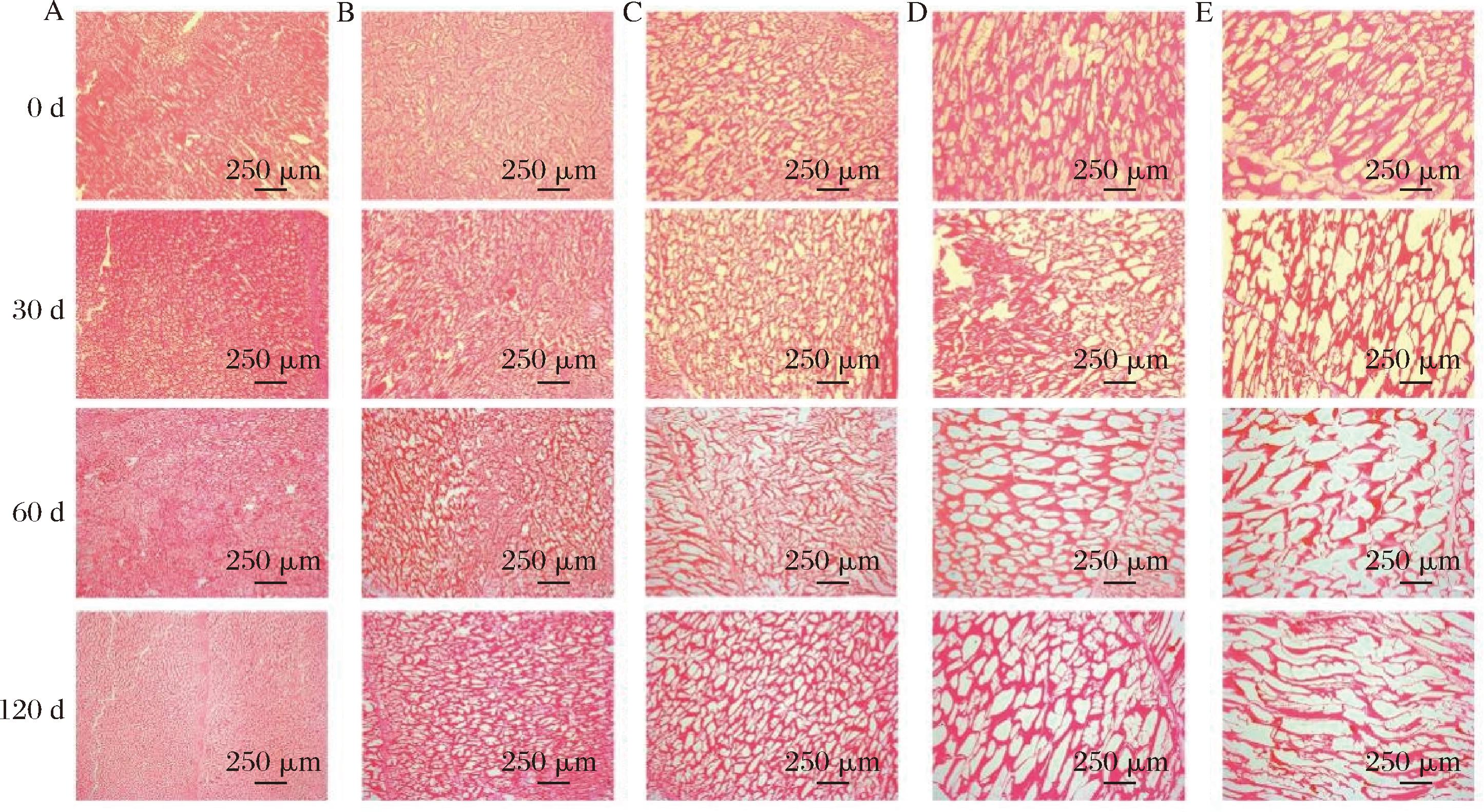
A-LNF;B-IF-40 ℃;C-IF-18 ℃;D-AF-60 ℃;E-AF-18 ℃
图3 不同冻结速率对贮藏期间河鲈鱼片冰晶结构的影响
Fig.3 Effect of different freezing rates on microstructure of ice crystals in Perca fluviatilis fillets during storage
注:图中标出为250 μm,放大倍数为4倍。
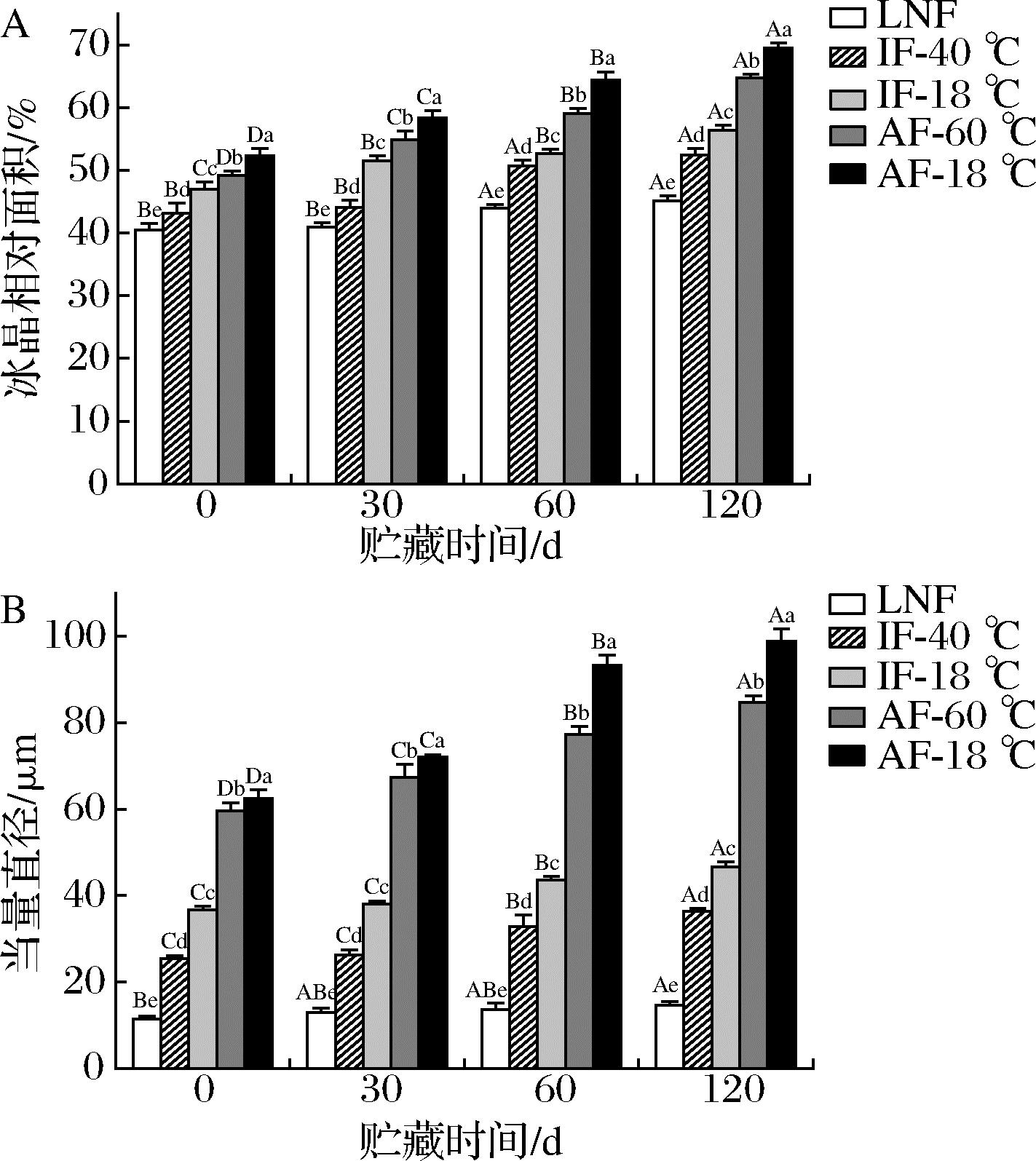
A-冰晶相对面积;B-当量直径
图4 不同冻结速率对贮藏期间河鲈鱼片冰晶相对 面积和当量直径的影响
Fig.4 Effect of different freezing rates on ice crystals area ratio and equivalent diameter in Perca fluviatilis fillets during storage
如图4所示,AF-18 ℃组的当量直径和冰晶相对面积显著高于其他处理组;随着贮藏时间的延长,AF-18 ℃组的当量直径和冰晶相对面积显著增加(P<0.05),这是因为在贮藏过程中,冰晶的相互作用使冰晶面积不断增大。LNF和IF-40 ℃组当量直径的增长速率明显小于AF-18 ℃、AF-60 ℃,且120 d时LNF组的当量直径较AF组低85.23%,表明快速冻结可以促进冰晶细化和均匀分布,保持较小的冰晶生长速度,从而抑制冰晶对肌肉细胞的破坏作用,维持河鲈鱼片的肌肉品质。
2.4 微观组织结构
由图5可知,与对照组相比,不同处理组的微观结构孔隙更大,密度更小,样品的肌纤维均表现出不同程度的偏移[11]。AF-18 ℃组具有较大的细胞间隙和不完整的细胞结构,可能是由于样品的冷冻速度较慢,导致细胞收缩并形成更大的细胞外冰晶,破坏了细胞的组织结构;60 d时,AF-18 ℃组肌纤维有破碎的迹象,这可能是由于冰晶相互作用导致形成了更大冰晶,对细胞的较大压力影响了解冻后微观结构的恢复,最终导致细胞结构的物理损伤和严重变形[20],这与质构中IF-18 ℃硬度和弹性的劣变结果相吻合。LNF和IF组显示出较为完整的肌肉细胞结构和明显较小的间隙,表明快速冷冻导致形成小而规则的冰晶,减少了对细胞结构的破坏。向迎春等[21]的研究表明,液氮冻结的组织的冰晶小而均匀,细胞组织间隙细小紧密;而冰箱冻结的组织出现不同程度的大孔洞和细胞损坏,肌肉组织出现扭曲变形。
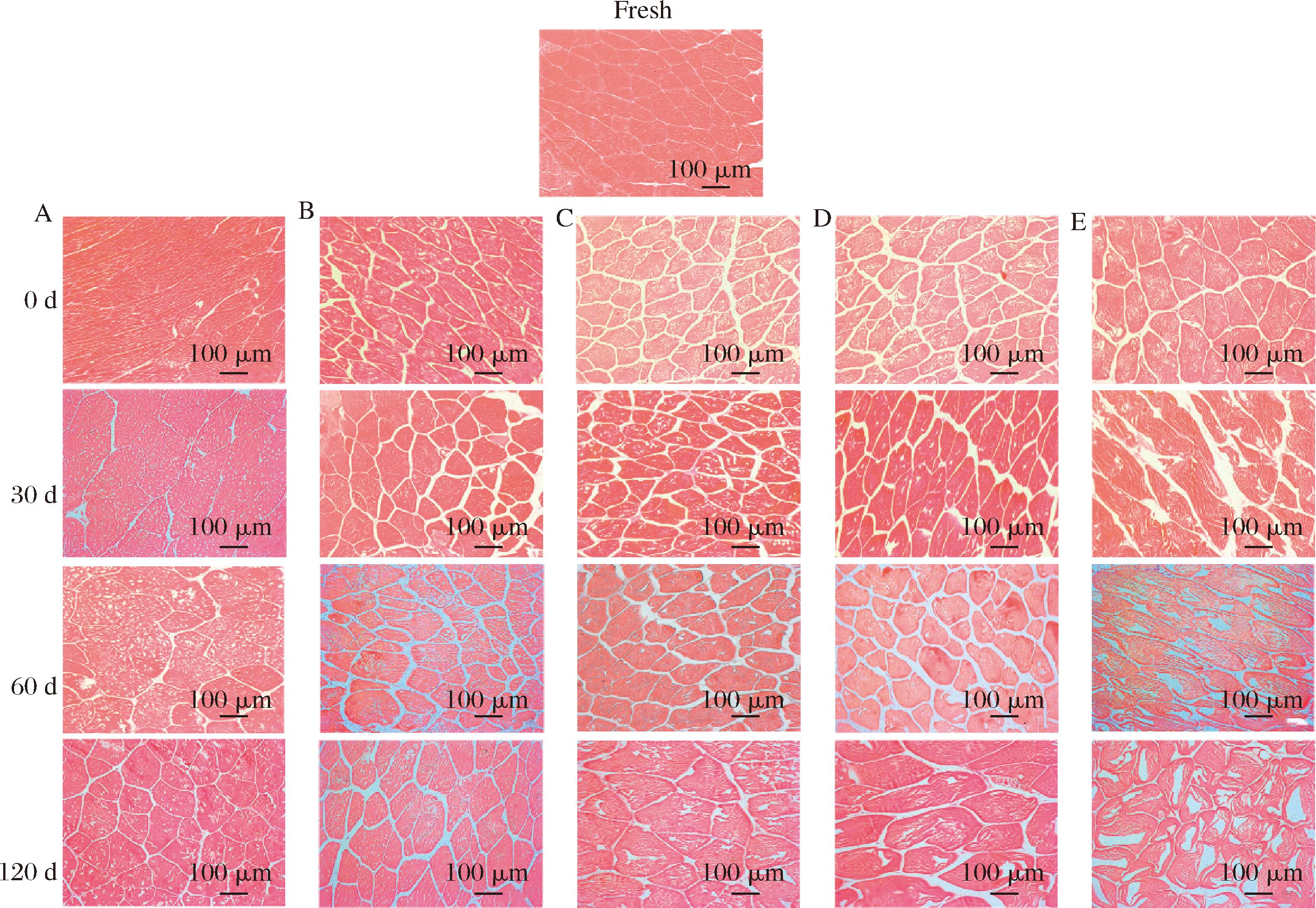
A-LNF;B-IF-40 ℃;C-IF-18 ℃;D-AF-60 ℃;E-AF-18 ℃
图5 不同冻结速率对贮藏期间河鲈鱼片微观组织结构的影响
Fig.5 Effect of different freezing rates on microstructure in Perca fluviatilis fillets during storage
注:图中标出为100 μm,放大倍数10倍。
2.5 质构
如图6所示,不同处理组样品的质构在熟制后均发生了劣变,弹性呈下降趋势,硬度呈上升趋势。120 d时,LNF和IF组的样品质构优于AF组。这是因为LNF和IF-40 ℃条件下,冰晶的形成速度高于水迁移的速度,因此在细胞内外形成了细小而均匀的冰晶,缓解了溶质浓缩效应和冰晶对细胞膜的机械损伤。
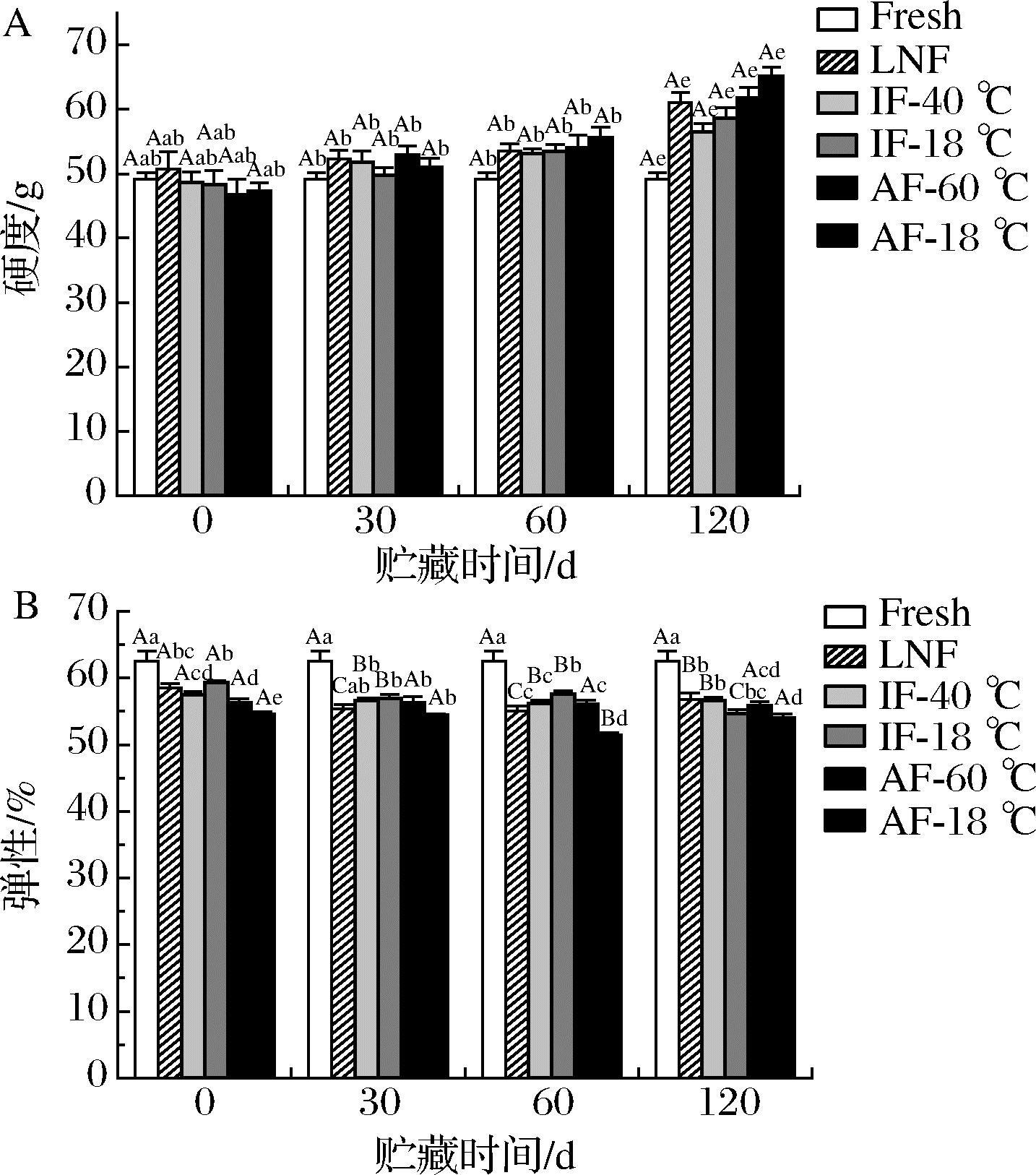
A-鱼片硬度;B-鱼片弹性
图6 不同冻结速率对贮藏期间河鲈鱼片硬度和弹性的影响
Fig.6 Effect of different freezing rates on hardness and springiness of Perca fluviatilis fillets during storage
熟制鱼肉样品的硬度变化,是由于经过热处理后,肌肉组织内部结构的氢键、疏水键等被打断,肌原纤维蛋白变性,水分流失,肌纤维收缩,使得样品硬度增加。贮藏期间,AF-18 ℃、AF-60 ℃组样品硬度增长的速度显著高于LNF和IF组(P<0.05);120 d时AF-18 ℃、AF-60 ℃组硬度较对照组分别上升了32.65%、25.63%。这一结果与解冻损失的结果相一致,汁液流失越多,样品的硬度越大。AF-18 ℃组样品弹性下降的速度显著高于其他处理组(P<0.05);0~60 d时,除AF-18 ℃组外,其他处理组样品的弹性差异较小;贮藏120 d时,AF-18 ℃组弹性较对照组下降了13.5%。ZHOU等[20]研究发现发现在贮藏初期,冰箱冷冻组的弹性显著低于浸渍冷冻和磁场辅助浸泡冷冻组(P<0.05)。
2.6 TBARs值
TBARs值越大,说明脂质氧化降解程度越深[22]。如图7所示,新鲜样品的TBARs值为0.072 mg/kg。贮藏过程中,TBARs随着贮藏时间的延长缓慢增加。其中AF-18 ℃、AF-60 ℃组样品TBARs值的增长速度显著高于LNF和IF组。0~30 d,不同处理组样品的TBARs值差异较小;120 d时,不同处理组样品的TBARs值均显著上升(P<0.05),其中AF-18 ℃组较对照组TBARs值增加了211.88%。这是由于贮藏期间脂肪不断水解,使游离脂肪酸积累,进而促进了脂质氧化[23];说明初级脂质氧化发生在0~60 d,次级脂质氧化发生在60 d之后。120 d时IF-40 ℃组的TBARs值显著低于其他处理组,表明IF-40 ℃能有效缓解脂质氧化。
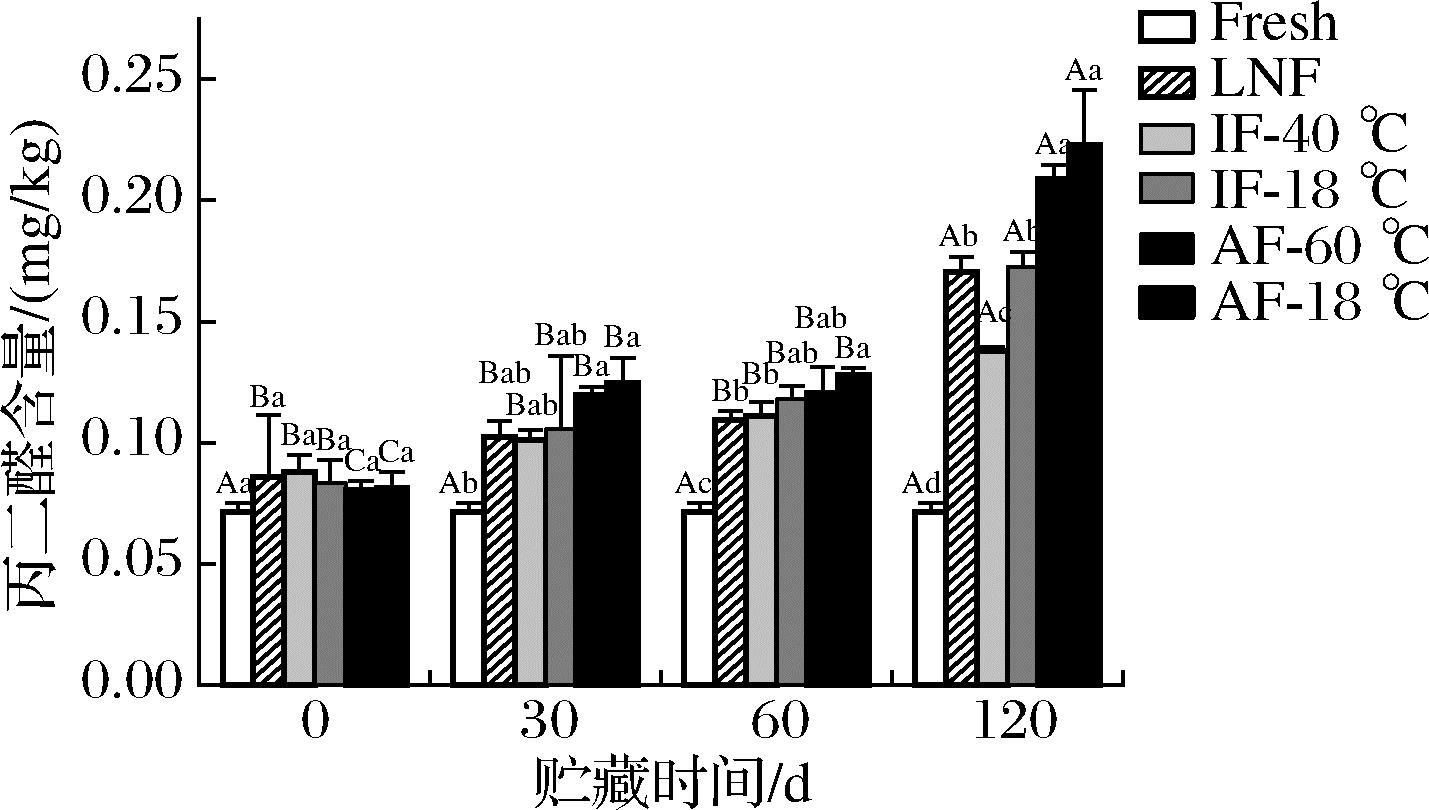
图7 不同冻结速率对贮藏期间河鲈鱼片TBARs的影响
Fig.7 Effect of different freezing rates on TBARs of Perca fluviatilis fillets during storage
2.7 K值
如图8所示,新鲜河鲈鱼片的K值为10.20%。随着贮藏时间的延长,60 d后不同处理组样品K值呈显著上升(P<0.05),这是因为在贮藏前期Hx和HxR含量较低,而在贮藏后期,Hx和HxR含量不断积累,ATP、IMP等物质含量不断降低,使K值不断上升[24]。贮藏期间,AF-18 ℃和AF-60 ℃组样品K值的增长速度大于LNF和IF-40 ℃组。120 d时,IF-40 ℃显著低于AF-18 ℃和AF-60 ℃组(P<0.05),这可能是因为IF-40 ℃组样品形成细小冰晶,对细胞结构的机械损伤较小,抑制了ATP相关酶的作用;LNF组K值显著高于IF-40 ℃组(P<0.05)。这可能是因为,快速冻结使LNF组样品变得脆弱,贮藏使LNF样品逐渐变差,快速解冻也会进一步加剧不良反应的发生。这也与其他文献报道一致,YANG等[25]研究不同液氮冻结温度对冷冻金鲳鱼的影响,结果显示-90 ℃冻结是最好的,低于-90 ℃样品品质反而劣化。综上所述,IF-40 ℃可以有效减低ATP的降解速度,对河鲈冻藏保鲜有良好作用。
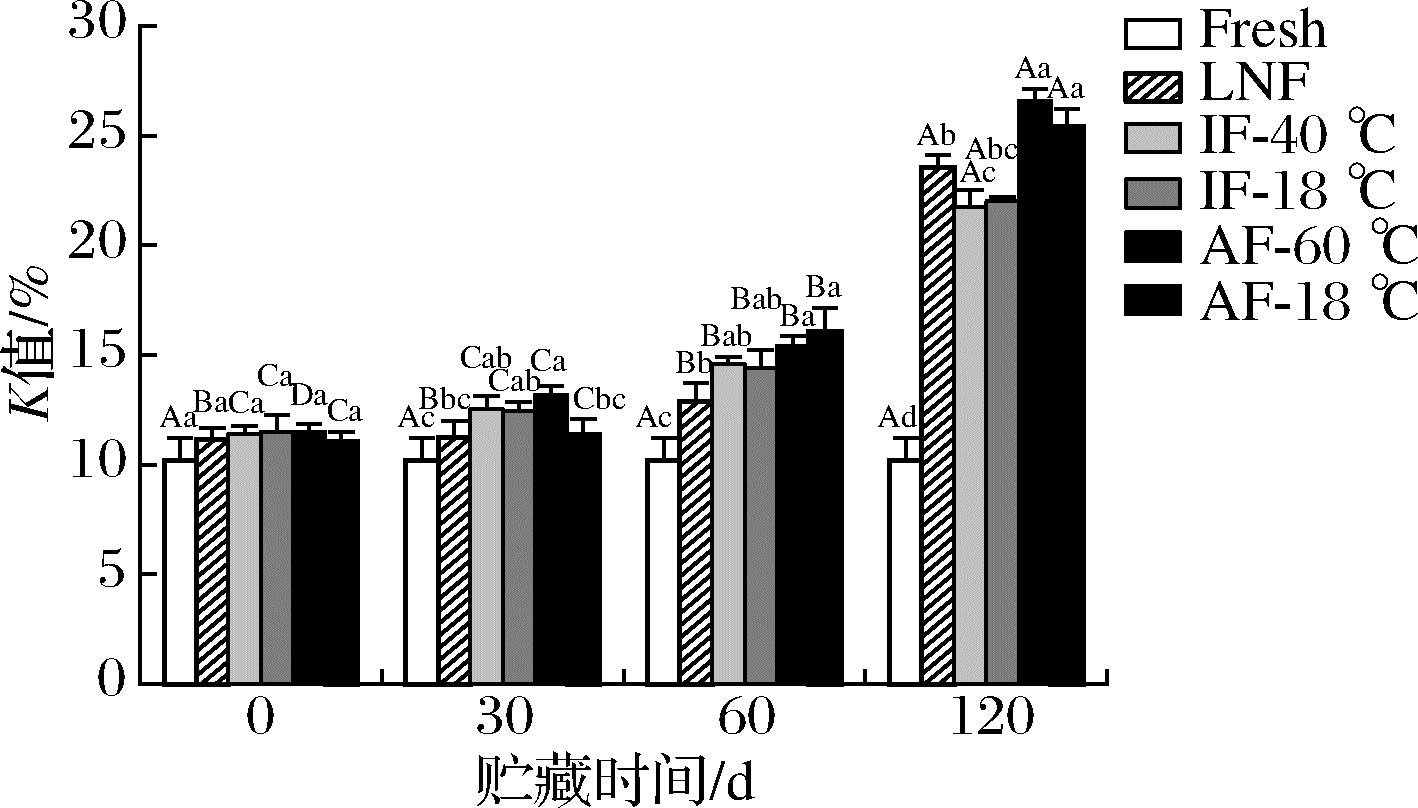
图8 不同冻结速率对贮藏期间河鲈鱼片K值的影响
Fig.8 Effect of different freezing rates on K-value of Perca fluviatilis fillets during storage
3 结论
结果表明,贮藏期间解冻损失、冰晶当量直径、TBARs值与K值呈上升趋势,弹性呈下降趋势。在0 d时,LNF和IF组的解冻损失显著高于AF组;120 d时,LNF和IF的解冻损失显著低于AF组(P<0.05)。这可能是由于较快的冻结速率使样品变得脆弱,承受应力的能力减弱;当快速解冻产生的较大内应力破坏了原本脆弱的细胞结构,使水分大量流失;贮藏后期,冰晶生长对细胞结构的破坏逐渐大于快速解冻对其的影响。冰晶的相对面积和当量直径随着冻结速率的增大而减小,且不同处理组之间存在显著性差异(P<0.05);LNF和IF-40 ℃在贮藏时冰晶相对面积和当量直径增长最缓慢。不同处理组TBARs和K值在0~60 d期间变化较小,120 d后均显著上升(P<0.05),说明次级脂质氧化于60 d后逐渐开始。120 d时,IF-40 ℃的解冻损失、TBARs值、K值最低,硬度、弹性与对照组最为接近。综上所述,在20 ℃流水解冻条件下,IF-40 ℃冻结有效地维持了河鲈鱼片的品质特性,缓解了河鲈冷冻及贮藏过程中的品质劣变。
[1] YU H, XIE J.Effect of different orthogonal double frequency ultrasonic assisted freezing on the quality of sea bass[J].Food Chemistry:X, 2023, 18:100704.
[2] S NCHEZ-VALENCIA J, S
NCHEZ-VALENCIA J, S NCHEZ-ALONSO I, MARTINEZ I, et al.Estimation of frozen storage time or temperature by kinetic modeling of the Kramer shear resistance and water holding capacity (WHC) of Hake (Merluccius merluccius, L.) muscle[J].Journal of Food Engineering, 2014, 120:37-43.
NCHEZ-ALONSO I, MARTINEZ I, et al.Estimation of frozen storage time or temperature by kinetic modeling of the Kramer shear resistance and water holding capacity (WHC) of Hake (Merluccius merluccius, L.) muscle[J].Journal of Food Engineering, 2014, 120:37-43.
[3] AGUILERA BARRAZA F A, LE N R A Q,
N R A Q,  LVAREZ P X L.Kinetics of protein and textural changes in Atlantic salmon under frozen storage[J].Food Chemistry, 2015, 182:120-127.
LVAREZ P X L.Kinetics of protein and textural changes in Atlantic salmon under frozen storage[J].Food Chemistry, 2015, 182:120-127.
[4] LEYGONIE C, BRITZ T J, HOFFMAN L C.Impact of freezing and thawing on the quality of meat:Review[J].Meat Science, 2012, 91(2):93-98.
[5] ZHU Z W, ZHOU Q Y, SUN D W.Measuring and controlling ice crystallization in frozen foods:A review of recent developments[J].Trends in Food Science &Technology, 2019, 90:13-25.
[6] ZHU M M, ZHANG J, JIAO L X, et al.Effects of freezing methods and frozen storage on physicochemical, oxidative properties and protein denaturation of porcine longissimus dorsi[J].LWT, 2022, 153:112529.
[7] 周俊鹏, 朱萌, 章蔚, 等.不同冷冻方式对淡水鱼品质的影响[J].食品科学, 2019, 40(17):247-254.ZHOU J P, ZHU M, ZHANG W, et al.Effect of different freezing methods on the quality of freshwater fish[J].Food Science, 2019, 40(17):247-254.
[8] TENG X Y, LIU Y, CHEN L P, et al.Effects of liquid nitrogen freezing at different temperatures on the quality and flavor of Pacific oyster (Crassostrea gigas)[J].Food Chemistry, 2023, 422:136162.
[9] WU G Y, YANG C, BRUCE H L, et al.Effects of alternating electric field during freezing and thawing on beef quality[J].Food Chemistry, 2023, 419:135987.
[10] 李冬妮. 液氮速冻和超声辅助解冻对鳙鱼片品质影响的研究[D].杭州:浙江大学, 2021.LI D N.Study on liquid nitrogen fast freezing and ultrasound-assisted thawing on quality of bighead carp fillets[D].Hangzhou:Zhejiang University, 2021.
[11] DIAO Y D, CHENG X Y, WANG L S, et al.Effects of immersion freezing methods on water holding capacity, ice crystals and water migration in grass carp during frozen storage[J].International Journal of Refrigeration, 2021, 131:581-591.
[12] CHAI T T, HUANG Y N, REN S T, et al.Inhibitory effects of ultrasonic and rosmarinic acid on lipid oxidation and lipoxygenase in large yellow croaker during cold storage[J].Ultrasonics Sonochemistry, 2023, 92:106229.
[13] WEI H M, TIAN Y Y, YAMASHITA T, et al.Effects of thawing methods on the biochemical properties and microstructure of pre-rigor frozen scallop striated adductor muscle[J].Food Chemistry, 2020, 319:126559.
[14] EGELANDSDAL B, ABIE S M, BJARNADOTTIR S, et al.Detectability of the degree of freeze damage in meat depends on analytic-tool selection[J].Meat Science, 2019, 152:8-19.
[15] 孙光全, 冯耀泽, 朱明, 等.面向长途冷链下不同冷冻方式对大口黑鲈品质的影响[J].农业工程学报, 2023, 39(24):316-326.SUN G Q, FENG Y Z, ZHU M, et al.Effects of different freezing methods on the quality of Micropterus salmoides oriented to long-distance cold chain[J].Transactions of the Chinese Society of Agricultural Engineering, 2023, 39(24):316-326.
[16] SUN Q X, KONG B H, LIU S C, et al.Ultrasound-assisted thawing accelerates the thawing of common carp (Cyprinus carpio) and improves its muscle quality[J].LWT, 2021, 141:111080.
[17] LI D N, ZHAO H H, MUHAMMAD A I, et al.The comparison of ultrasound-assisted thawing, air thawing and water immersion thawing on the quality of slow/ fast freezing bighead carp (Aristichthys nobilis) fillets[J].Food Chemistry, 2020, 320:126614.
[18] JIA G L, HE X L, NIRASAWA S, et al.Effects of high-voltage electrostatic field on the freezing behavior and quality of pork tenderloin[J].Journal of Food Engineering, 2017, 204:18-26.
[19] 赵波, 应晓国, 张美超, 等.贮运过程中刺身鱼水分的变化[J].食品与发酵工业, 2021, 47(22):184-190.ZHAO B, YING X G, ZHANG M C, et al.Study on water change of sashimi during storage and transportation[J].Food and Fermentation Industries, 2021, 47(22):184-190.
[20] ZHOU J Q, SUN Q X, WEI S, et al.Changes in microstructure, quality and water distribution of golden pompano (Trachinotus ovatus) muscles subjected to magnetic field-assisted immersion freezing during long-term frozen storage[J].Journal of Food Engineering, 2023, 354:111566.
[21] 向迎春, 黄佳奇, 杨志坚, 等.冻结方式对凡纳滨对虾贮藏中组织冰晶及品质的影响[J].食品工业科技, 2018, 39(5):280-287.XIANG Y C, HUANG J Q, YANG Z J, et al.Effect of different freezing methods on the ice crystals and quality of white shrimp (Penaeus Vannamei) in the storage[J].Science and Technology of Food Industry, 2018, 39(5):280-287.
[22] 石钢鹏, 高天麒, 钱晓庆, 等.不同速冻处理方式对大口黑鲈鱼肉冻藏期间品质变化影响[J].肉类研究, 2020, 34(12):68-74.SHI G P, GAO T Q, QIAN X Q, et al.Effects of different quick-freezing treatments on the quality changes of largemouth bass meat during frozen storage[J].Meat Research, 2020, 34(12):68-74.
[23] XIE X, ZHAI X Q, CHEN M Y, et al.Effects of frozen storage on texture, chemical quality indices and sensory properties of crisp Nile tilapia fillets[J].Aquaculture and Fisheries, 2023, 8(6):626-633.
[24] LI Q, ZHANG L T, LU H, et al.Comparison of postmortem changes in ATP-related compounds, protein degradation and endogenous enzyme activity of white muscle and dark muscle from common carp (Cyprinus carpio) stored at 4 ℃[J].LWT, 2017, 78:317-324.
[25] YANG Z M, LIU S C, SUN Q X, et al.Insight into muscle quality of golden pompano (Trachinotus ovatus) frozen with liquid nitrogen at different temperatures[J].Food Chemistry, 2022, 374:131737.