聚酯材料是由多元醇和多元酸缩聚而成的高分子材料,主要包括聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)和聚对苯二甲酸丁二醇酯(polybutylene terephthalate,PBT),被广泛用于食品包装材料[1-2]。在与食品接触的过程中,包装材料内的化学物质可能通过迁移作用进入食品,威胁食品安全[3-4]。聚酯材料中的危害物可能来自添加剂,用于改善材料的加工性能和物理机械性能,也可能来自材料本身[5]。聚酯低聚物是来自聚酯材料本身的一类代表性物质,在材料制备和加工过程中产生,聚合度通常为2~7,分子质量<1 000 Da[6-7]。常见的聚酯低聚物包括PET低聚物和PBT低聚物,按结构可划分为环状低聚物和线性低聚物,具有不同的毒理学特征,环状低聚物的安全风险较高[6]。
研究表明,包装材料中的聚酯低聚物可通过迁移作用进入各类食品模拟物。其中,油性食品模拟物中的迁移量大于水性食品模拟物[8]。环状低聚物可在溶液中水解形成线性低聚物,线性低聚物比环状低聚物更容易向水性食品模拟物迁移[9-12]。除了食品模拟物,聚酯低聚物也可通过迁移作用进入真实食品,主要迁移物为环状PET低聚物和PBT低聚物,不同类型食品中迁移量有所不同[13-18]。聚酯材料被用作食品包装材料时,其使用条件通常为室温下接触水性食品、酸性食品和酒精食品,聚酯低聚物的迁移风险较低[19-20]。近年来,聚酯材料被用于生产覆膜铁,作为包括肉类食品在内的各类罐头食品的包装材料。覆膜铁用聚酯薄膜的生产工艺可能使材料内产生更多聚酯低聚物,增加向食品中迁移的风险。此外,罐头食品灭菌时的高温高压等因素,也会加剧聚酯低聚物向食品中的迁移。随着聚酯材料在食品包装领域应用的拓展,以及使用条件的多样化,其迁移风险及人群暴露风险也在不断升高,需引起高度重视。
开展包装材料内危害物的迁移检测是确保食品安全的重要手段。由于食品基质的复杂性,通常采用食品模拟物代替真实食品开展迁移检测。聚酯低聚物具有较强的亲油性,其向油性食品中的迁移更值得关注。我国在GB 31604.1—2023《食品安全国家标准 食品接触材料及制品迁移试验通则》中推荐采用植物油(橄榄油或精制玉米油)作为油性食品模拟物,需要建立模拟物中迁移物的检测方法以测定迁移量。目前,聚酯低聚物常用的提取方法有溶剂萃取法和固相萃取法[14-15]等,检测方法包括超高效液相色谱-飞行时间质谱(ultra-high performance liquid chromatography-time of flight mass spectrometry,UPLC-QTOF-MS)[12]、超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)[20]、高效液相色谱-紫外检测法(high performance liquid chromatography-ultraviolet detection,HPLC-UV)和高效液相色谱-荧光光谱(High performance liquid chromatography-fluorescence spectrometry,HPLC-FLD)[16],但涉及的低聚物种类单一,数量较少。本研究旨在建立橄榄油中聚酯低聚物的检测方法,包括基于溶剂萃取和净化的样品前处理方法,以及基于液相色谱-串联质谱(liquid chromatography-mass spectrometry,LC-MS/MS)的仪器分析方法。共选取7种聚酯低聚物,包括1种线性PET低聚物、3种环状PET低聚物和3种环状PBT低聚物,涵盖了聚酯包装材料中常见的低聚物种类。该检测方法的建立可为聚酯包装材料的迁移检测及安全性评价提供技术支撑。
1 材料与方法
1.1 材料与试剂
7种聚酯低聚物的标准品(纯度>99%),包括1种线性PET低聚物、3种环状PET低聚物和3种环状PBT低聚物,加拿大TRC公司,具体信息见表1。甲醇和甲酸(色谱纯),赛默飞世尔科技有限公司;二氯甲烷(色谱纯),上海吉至生化科技有限公司;六氟异丙醇(纯度99.5%),上海阿拉丁生化科技股份有限公司;橄榄油(分析纯),上海麦克林生化科技股份有限公司。C18净化柱,采用TUP C18净化填料,装填量为250 mg/6 mL,天津诚轴生物科技有限公司;聚四氟乙烯(polytetrafluoroethylene,PTFE)针式过滤器(0.22 μm),津腾实验设备有限公司。
表1 七种聚酯低聚物的基本信息
Table 1 Information of seven polyester oligomers

低聚物CAS#分子式分子量/(g/mol)线性PET二聚体2144-69-6C22H22O10446.4环状PET二聚体24388-68-9C20H16O8384.3环状PET三聚体7441-32-9C30H24O12576.5环状PET四聚体16104-96-4C40H32O16768.7环状PBT二聚体63440-93-7C24H24O8440.4环状PBT三聚体63440-94-8C36H36O12660.7环状PBT四聚体29278-72-6C48H48O16880.9
1.2 仪器与设备
4500高效液相色谱-串联质谱仪,美国SCIEX公司;YP502 N电子分析天平,上海精密科学仪器有限公司;VORTEX05涡旋混匀器,上海达姆实业有限公司;Neofuge 15R台式高速冷冻离心机,上海力申科学仪器有限公司;DC150-1干式氮吹仪,北京沃格东方科技有限公司。
1.3 实验方法
1.3.1 标准溶液的配制
线性PET二聚体、环状PET二聚体、环状PET三聚体、环状PBT二聚体、环状PBT三聚体标准储备液(1 000 mg/L):分别准确称取低聚物标准品1 mg(精确至0.01 mg)至棕色小瓶中,加入1 mL二氯甲烷,混匀。
PET/PBT环状四聚体标准储备液(1 000 mg/L):分别准确称取低聚物标准品1 mg(精确至0.01 mg)至棕色小瓶中,加入1 mL六氟异丙醇,混匀。
标准混合储备液(100 mg/L):分别准确量取7种低聚物标准储备溶液(1 000 mg/L)0.1 mL至棕色小瓶中,用二氯甲烷稀释至1 mL,混匀。
标准混合工作溶液:准确吸取一定量的标准混合储备液,用甲醇或空白基质逐级稀释至10、20、50、100、200、500 μg/L,作为标准混合工作溶液。
单一低聚物的标准储备液(1 000 mg/L)和标准混合储备液均在4 ℃冰箱保存,可以稳定存放6个月,标准混合工作溶液现配现用。
1.3.2 样品前处理
准确称取橄榄油1.0 g,置于50 mL离心管中,加入10 μL标准混合储备液(100 mg/L),涡旋后加入0.2 mL二氯甲烷,涡旋静置,然后加入20 mL甲醇(含0.1%甲酸,体积分数),涡旋5 min,离心(5 000 r/min,5 min)后取一半上清液(10 mL),过C18净化柱(控制流速约3 s/滴),之后用1 mL甲醇洗脱,将滤液和洗脱液收集于15 mL离心管中,在40 ℃条件下氮吹至干,加入1 mL乙醇复溶,溶液过PTFE滤膜后转移至进样小瓶中,供LC-MS/MS分析。
1.3.3 仪器分析
1.3.3.1 色谱条件
采用Agilent Zorbax Eclipse Plus C8色谱柱(3.0 mm×100 mm,1.8 μm)对聚酯低聚物进行分离,柱温设置为40 ℃。采用梯度洗脱,其中流动相A为水(含0.1%甲酸和2 mmol/L甲酸铵),流动相B为甲醇(含0.1%甲酸和2 mmol/L甲酸铵),流速为0.4 mL/min。梯度洗脱程序为:0 min(5% B),2 min(70% B),6 min(100% B),18 min(100% B),18.1 min(5% B),20 min(5% B)。进样量为5 μL。每个标准溶液注射3次,每个样品溶液注射1次。
1.3.3.2 质谱条件
采用电喷雾离子源(electrospray ionization,ESI)正离子模式和多反应监测(multiple reaction monitoring,MRM)模式对聚酯低聚物进行扫描。离子源参数:离子源温度为500 ℃,喷雾电压为5 500 V,加热气(GS1)为50 psi,辅助加热气(GS2)为50 psi,气帘气(curtain gas)为35 psi,碰撞气(collision gas)为7 psi。为了获取较好的稳定性和灵敏度,各化合物监测离子对的去簇电压(declustering potential,DP)和碰撞电压(collision energy,CE),目标物定量离子对和定性离子对等参数均经过系统优化,具体参数见表2。其他质谱参数采用仪器推荐值。数据采集和处理通过SCIEX MultiQuant软件完成。
表2 七种聚酯低聚物的质谱参数
Table 2 Mass spectrometry parameters of seven polyester oligomers
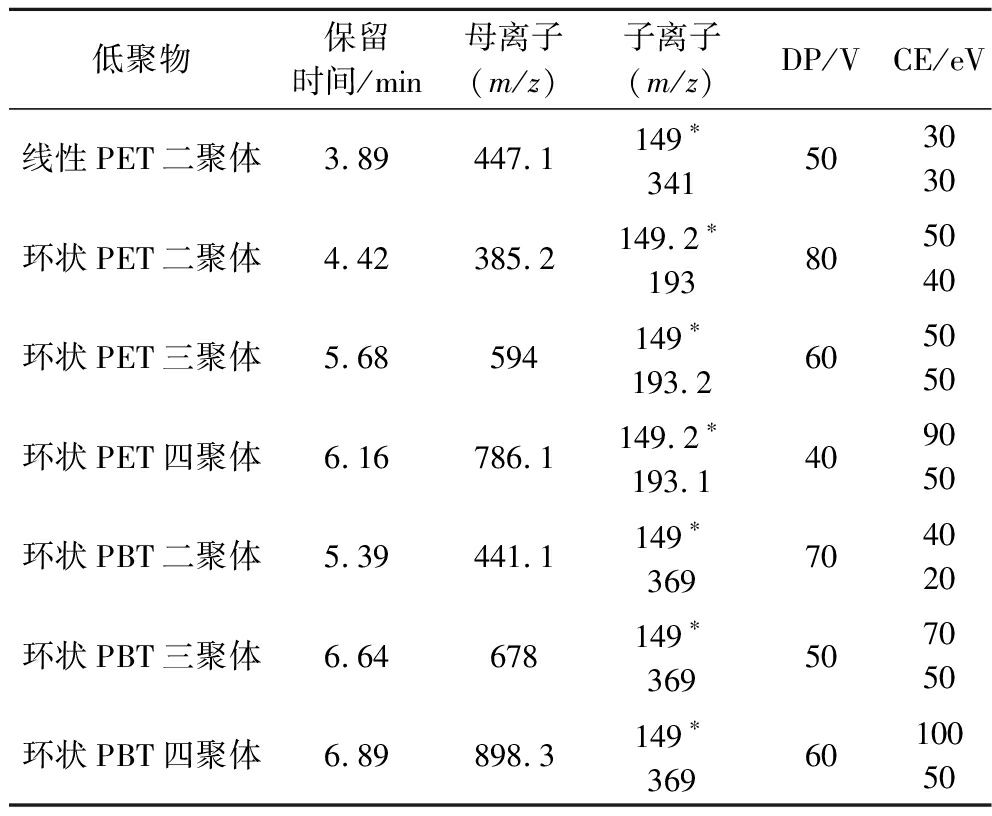
低聚物保留时间/min母离子(m/z)子离子(m/z)DP/VCE/eV线性PET二聚体3.89447.1149∗341503030环状PET二聚体4.42385.2149.2∗193805040环状PET三聚体5.68594149∗193.2605050环状PET四聚体6.16786.1149.2∗193.1409050环状PBT二聚体5.39441.1149∗369704020环状PBT三聚体6.64678149∗369507050环状PBT四聚体6.89898.3149∗3696010050
注:*为定量离子。
2 结果与分析
2.1 前处理条件的优化
本实验采用溶剂提取法将聚酯低聚物从橄榄油基质中分离,提取剂的选择及提取条件的优化对分离效果至关重要。考虑到橄榄油和聚酯低聚物的特性,选择甲醇做为主要提取剂,在保证目标物提取效果的同时最大限度降低提取液中油脂的含量。此外,甲醇沸点低,挥发性强,可大大降低氮吹时间,从而缩短样品前处理所需时间。开展提取条件的优化时,选择1.0 g称样量(橄榄油),加标浓度为1 000 μg(标准品)/kg(橄榄油)。
2.1.1 溶剂体积的优化
考察5、10、20 mL甲醇对橄榄油中聚酯低聚物的提取效果,每个条件平行测定3次。如图1所示,甲醇对环状PET二聚体和线性PET二聚体的提取效果较好,3个甲醇体积下的回收率为80%~100%。其他5种聚酯低聚物的回收率受甲醇体积影响较大,且与甲醇体积呈现明显的正相关。当甲醇体积为5 mL时,回收率均低于50%。随着甲醇体积的增加,回收率显著上升,当甲醇体积为20 mL时,回收率为50%~80%。因此,甲醇体积宜采用20 mL。
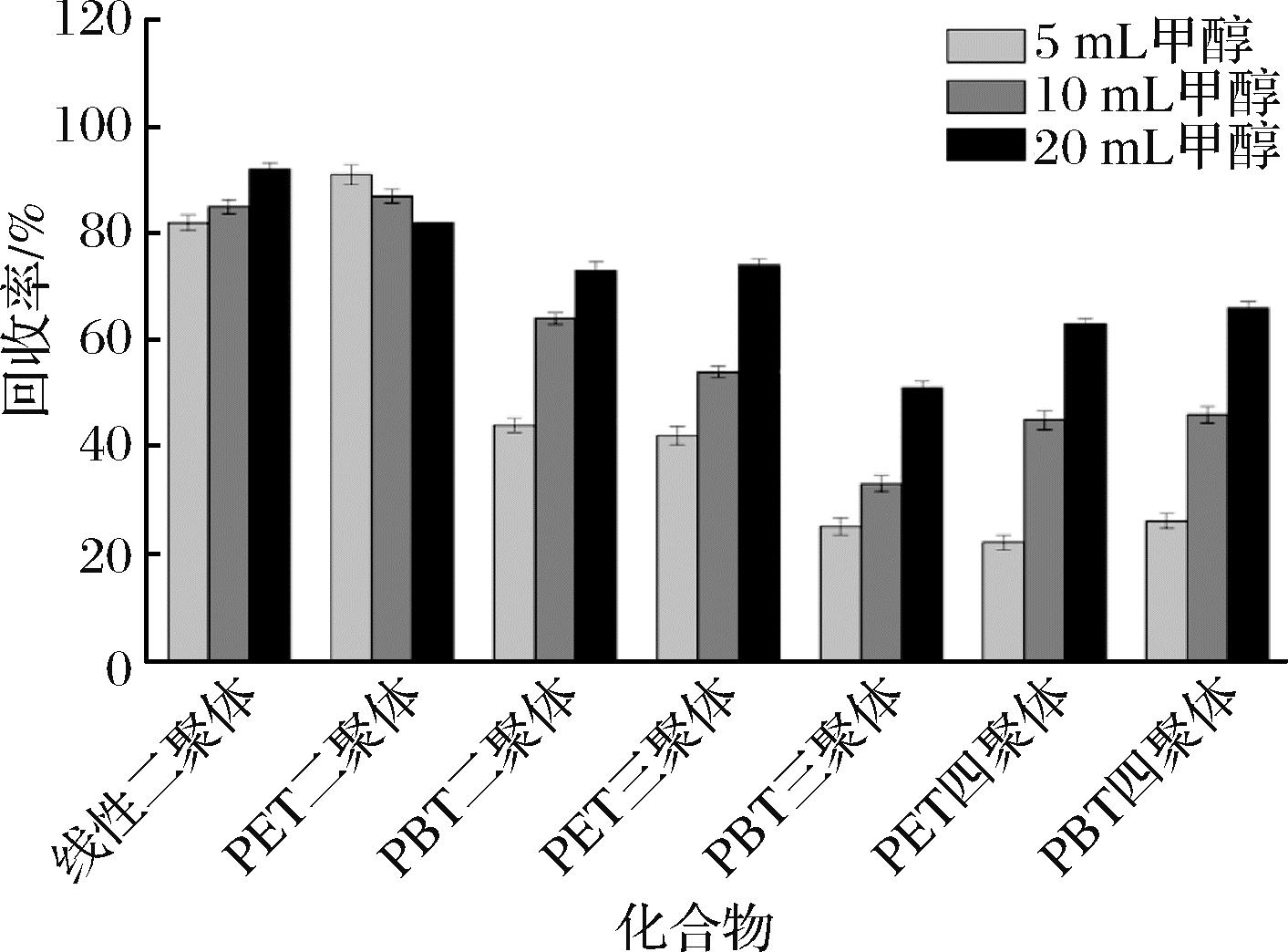
图1 甲醇体积对聚酯低聚物回收率的影响
Fig.1 Effect of methanol volume on the recovery of polyester oligomers
2.1.2 溶剂加酸比例的优化
在确定甲醇体积(20 mL)之后,考察甲醇中加入0.1%、0.5%、1.0%(体积分数)甲酸对橄榄油中聚酯低聚物的提取效果,每个条件平行测定3次。如图2所示,甲醇中加入甲酸对环状PET二聚体和线性PET二聚体的回收率无明显影响,但可显著提高其他聚酯低聚物的回收率,其中,当甲酸添加量为0.1%时,回收率提升效果最为显著,相比不加酸(图1)的回收率提高5.4%~19.6%。另外,甲醇中加入0.1%甲酸时7种聚酯低聚物的回收率总体好于加入其他体积分数(0.5%和1.0%)甲酸的回收率,除环状PBT三聚体和环状PET四聚体外,其他聚酯低聚物的回收率为70%~100%。因此,当甲醇中甲酸添加量为0.1%(体积分数)时,提取效果最佳。
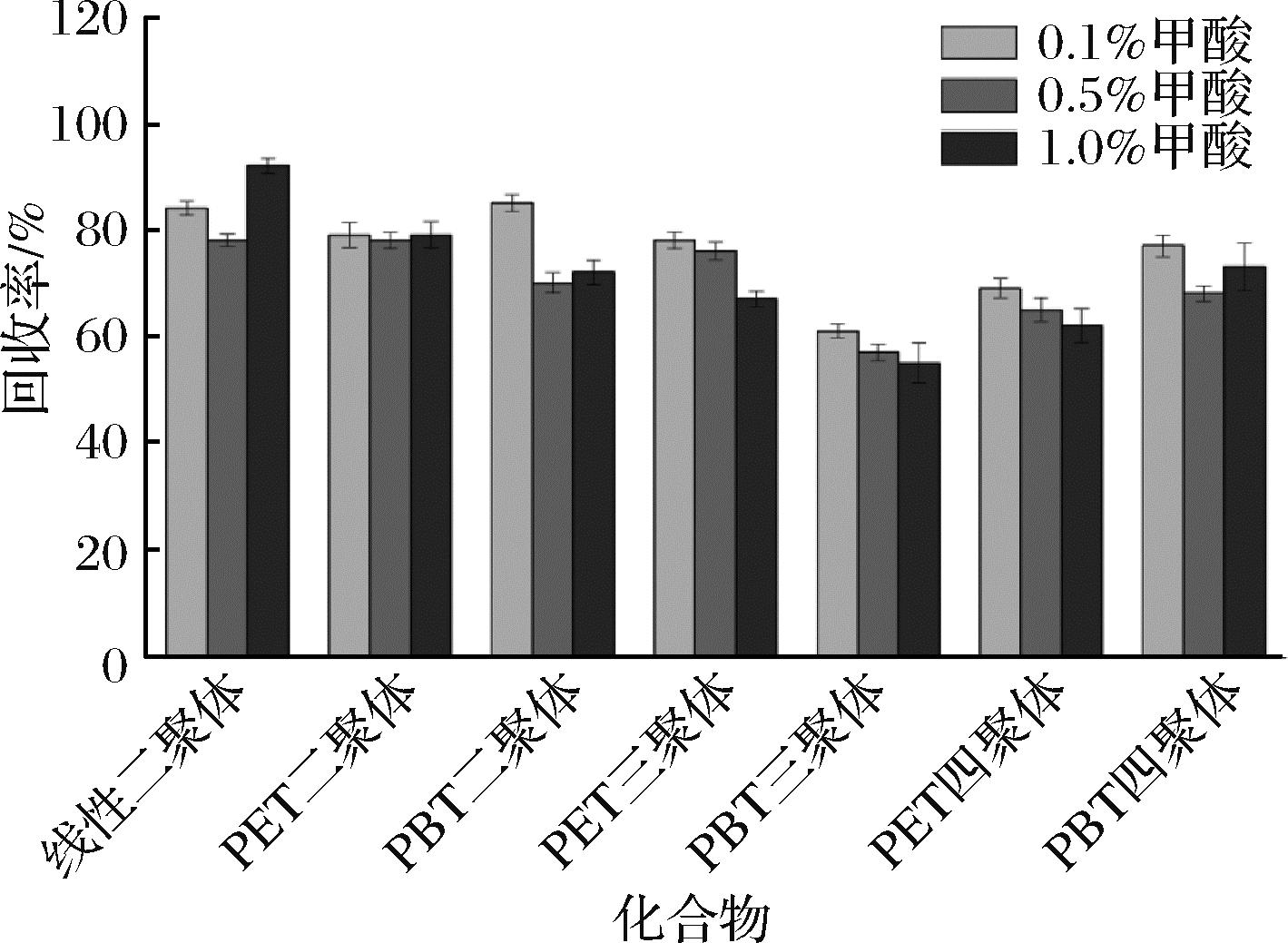
图2 添加甲酸对聚酯低聚物回收率的影响
Fig.2 Effect of formic acid addition on the recovery of polyester oligomers
2.1.3 溶剂加碱比例的优化
在确定甲醇体积(20 mL)之后,考察甲醇中加入0.1%、0.2%、0.5%(体积分数)乙二胺对橄榄油中聚酯低聚物的提取效果,每个条件平行测定3次。如图3所示,当甲醇中加入乙二胺后,所有聚酯低聚物的回收率均出现明显下降,相比加酸条件下的回收率,普遍降低20%~50%。造成回收率大幅下降的原因可能是聚酯低聚物在碱性环境下易发生降解。前处理环节的涡旋和离心步骤会促进聚酯低聚物的降解。此外,氮吹过程中溶剂挥发,剩余溶液的碱性不断加强,也会促进聚酯低聚物的降解。因此,不宜采用含有碱性试剂(如乙二胺)的甲醇作为聚酯低聚物的提取剂。
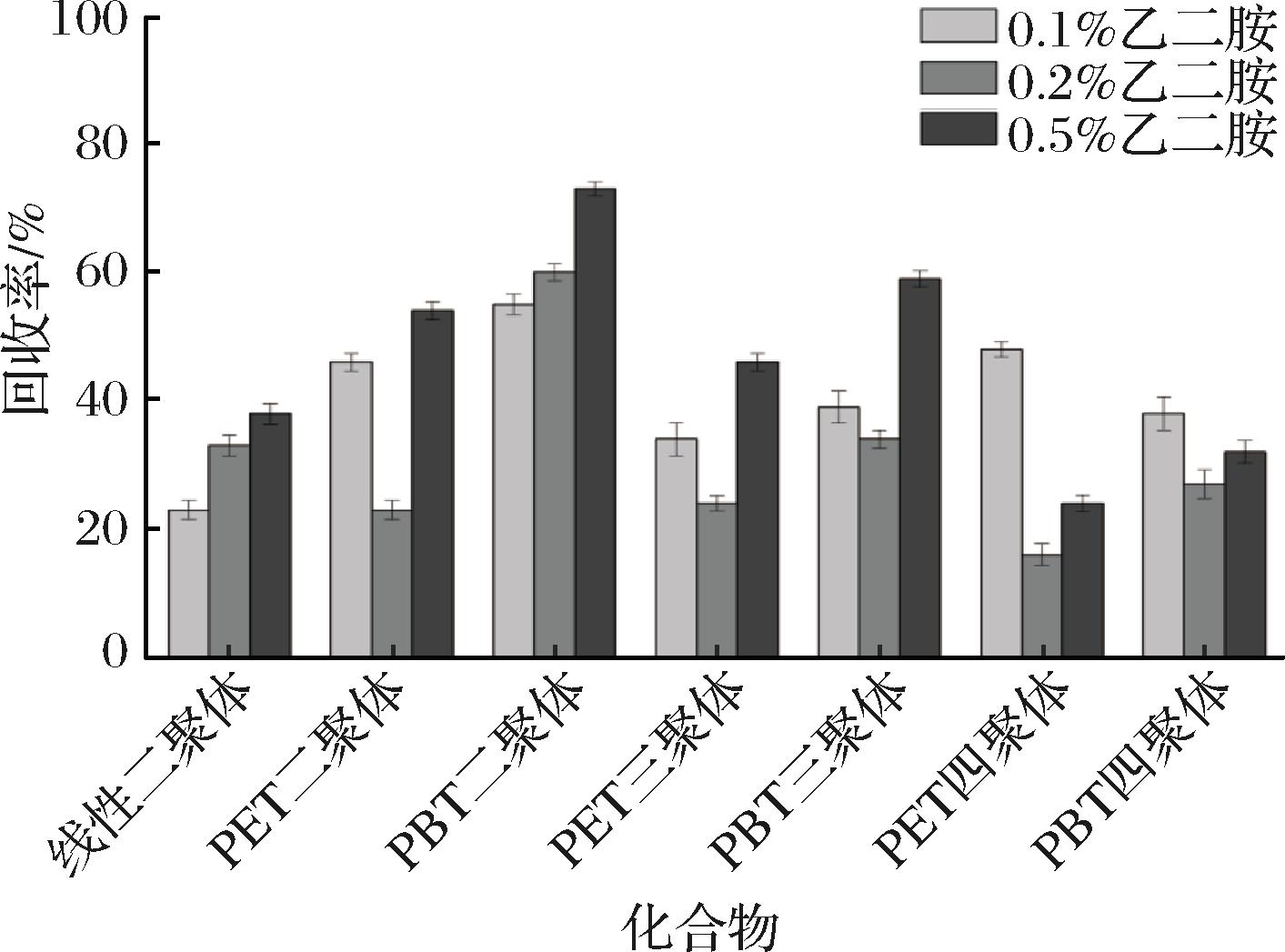
图3 添加乙二胺对聚酯低聚物回收率的影响
Fig.3 Effect of ethylenediamine addition on the recovery of polyester oligomers
2.1.4 溶剂加二氯甲烷的优化
在确定甲醇体积(20 mL)和甲酸添加量(0.1%)后,考察二氯甲烷作为辅助提取剂对橄榄油中聚酯低聚物的提取效果。相比甲醇,二氯甲烷对聚酯低聚物具有更好的溶解性,可促进橄榄油中聚酯低聚物的提取。在增强提取效果的同时,为避免二氯甲烷的过量使用导致过多油脂进入提取剂,本研究采用的二氯甲烷体积为0.2 mL(占甲醇体积的1%)。首先向橄榄油中加入二氯甲烷稀释橄榄油,然后加入甲醇(含0.1%甲酸)进行提取。如图4所示,以二氯甲烷为辅助提取剂可有效提升所有聚酯低聚物的回收率,普遍提升10%以上,其中对线性PET二聚体和环状PET二聚体回收率的提升最为显著(>15%)。此外,所有聚酯低聚物的回收率为70%~120%。
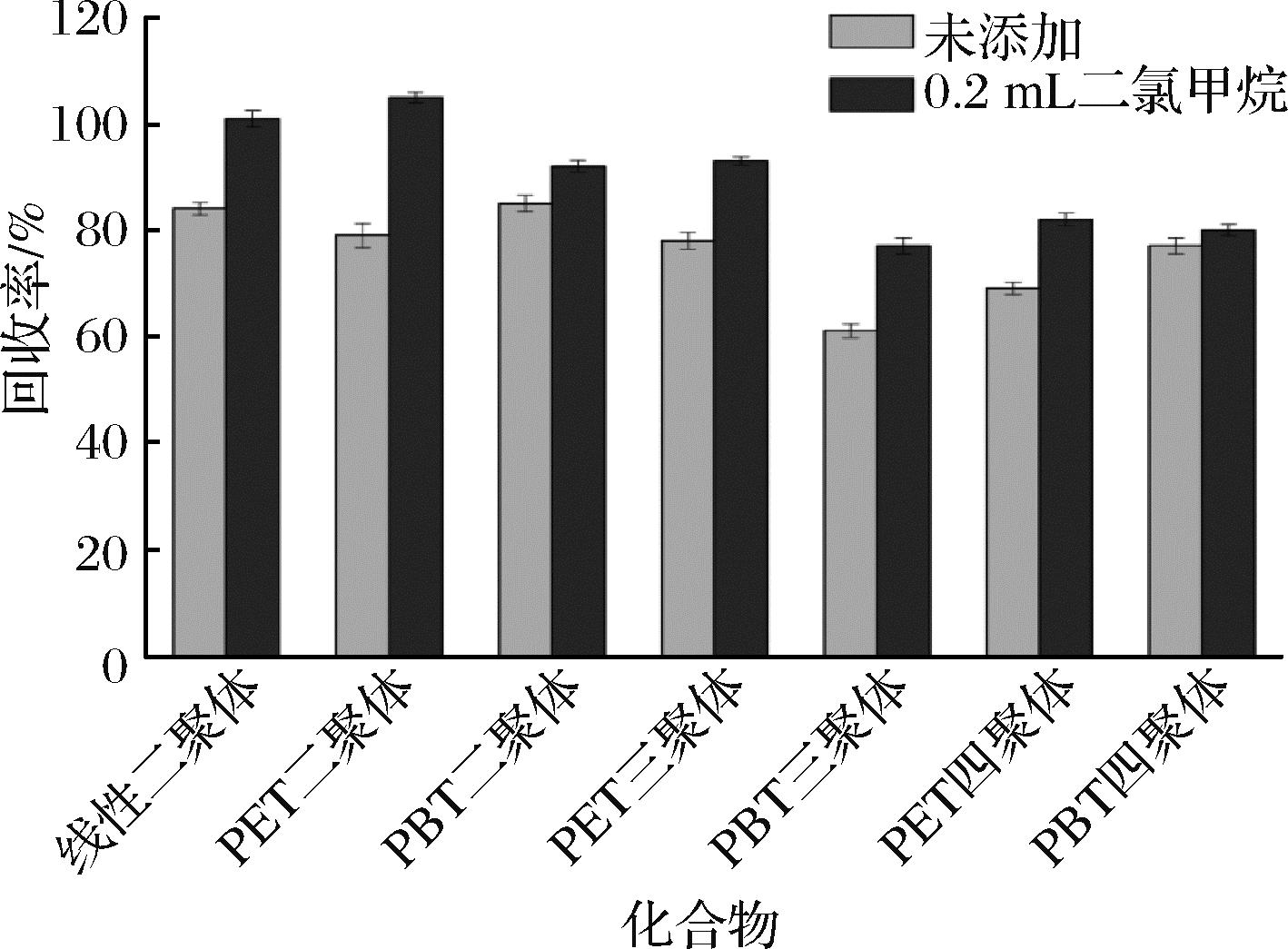
图4 添加二氯甲烷对聚酯低聚物回收率的影响
Fig.4 Effect of dichloromethane addition on the recovery of polyester oligomers
经过一系列优化后,确定最佳提取条件为:1.0 g橄榄油对应0.2 mL二氯甲烷(辅助提取剂,先加入橄榄油中)和20 mL甲醇(主提取剂,含0.1%甲酸)。
2.2 基质效应
基质效应(matrix effect,ME)指样品中除目标化合物以外的其他组分所引起的检测信号增强或减弱。可通过考察某浓度水平下溶剂标准溶液和基质标准溶液的响应强度关系来评估基质效应,计算如公式(1)所示:
(1)
式中:Ispike为基质标准溶液的响应强度(峰面积);Isolvent为溶剂标准溶液的响应强度(峰面积);Ibk为空白基质的响应强度(峰面积)。
当ME<80%时为基质抑制效应;当ME>120%时为基质增强效应;当ME为80%~120%且RSD<20%时,可认为无显著基质效应。如图5所示,所有聚酯低聚物均呈现明显的基质增强效应,ME>200%。为准确测量橄榄油中聚酯低聚物的含量,需采用基质标准溶液进行定量。
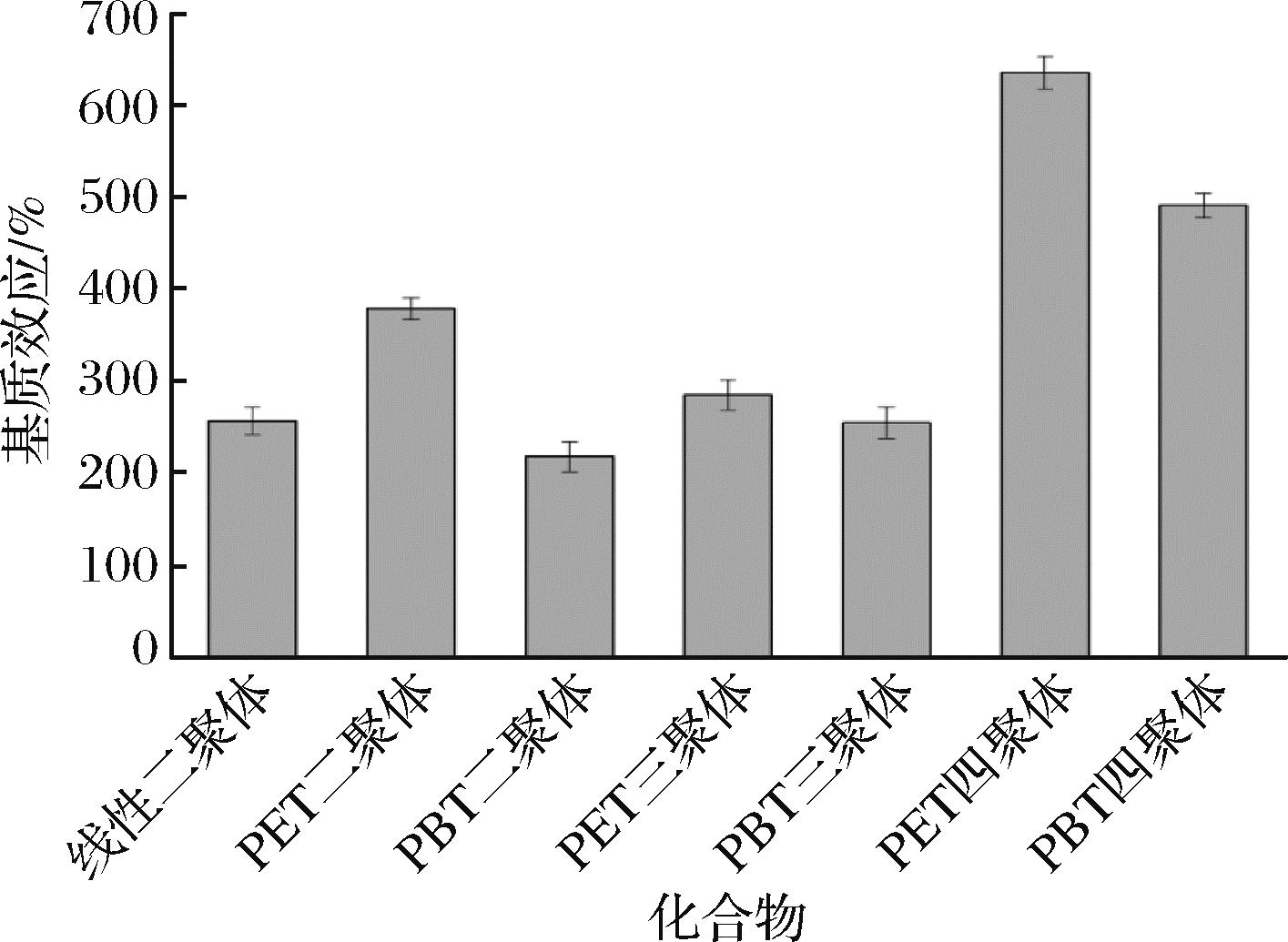
图5 橄榄油中聚酯低聚物的基质效应
Fig.5 Matrix effect of polyester oligomers in olive oil
2.3 方法学验证
2.3.1 线性范围、检测限和定量限
采用优化后的条件进行样品前处理,得到的空白基质溶液用于配制一系列基质标准溶液,质量浓度为10、20、50、100、200和500 μg/L,进LC-MS/MS分析,每个浓度测定3次。以浓度为横坐标(x),峰面积为纵坐标(y),绘制标准曲线。7种聚酯低聚物的线性范围、线性回归方程、相关系数(correlation coefficient,R2)、检测限(limit of detection,LOD,信噪比S/N=3)和定量限(limit of quantitation,LOQ,信噪比S/N=10)见表3。所有聚酯低聚物在10~500 μg/L范围内呈现良好的线性关系(R2>0.99),检测限为0.90~2.49 μg/L,定量限为2.99~8.29 μg/L。因此,所建立的LC-MS/MS方法可较好得满足橄榄油中聚酯低聚物的检测。
表3 聚酯低聚物的线性范围、标准曲线、相关系数、检测限和定量限
Table 3 Linear range, standard curve, correlation coefficient, LOD, and LOQ of polyester oligomers
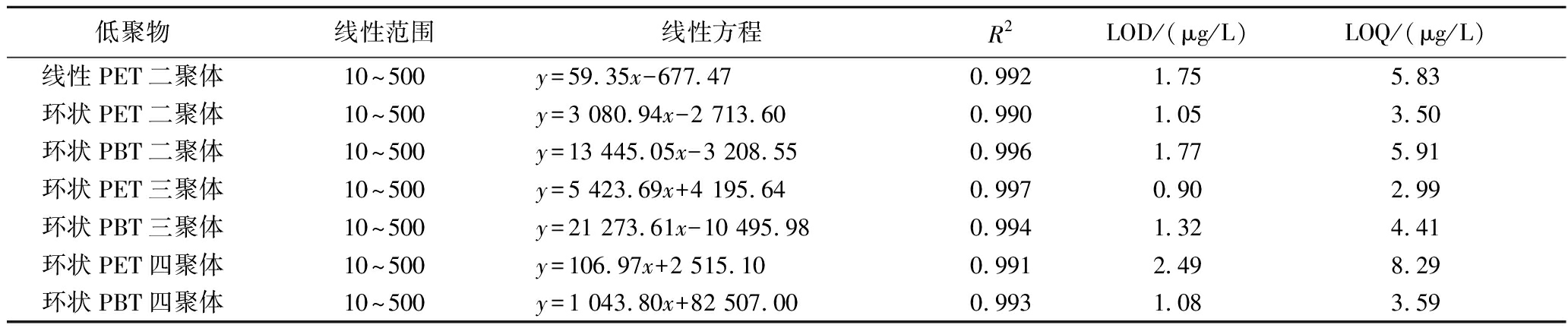
低聚物线性范围线性方程R2LOD/(μg/L)LOQ/(μg/L)线性PET二聚体10~500y=59.35x-677.470.9921.755.83环状PET二聚体10~500y=3 080.94x-2 713.600.9901.053.50环状PBT二聚体10~500y=13 445.05x-3 208.550.9961.775.91环状PET三聚体10~500y=5 423.69x+4 195.640.9970.902.99环状PBT三聚体10~500y=21 273.61x-10 495.980.9941.324.41环状PET四聚体10~500y=106.97x+2 515.100.9912.498.29环状PBT四聚体10~500y=1 043.80x+82 507.000.9931.083.59
2.3.2 回收率和精密度
不同聚酯低聚物在包装材料中的含量可能存在较大差异,其向食品中的迁移量也存在较大差异。为了更好地反映食品中聚酯低聚物的暴露情况,本研究对空白橄榄油进行5个浓度水平(50、100、200、500、1 000 μg/kg)的加标回收实验,每个浓度平行测定3次。如表4所示,所有聚酯低聚物在5个加标浓度下的回收率为70%~120%,RSD<12%,表明所建立的聚酯低聚物的检测方法具有较好的可靠性和稳定性。造成回收率差异的主要因素为聚酯低聚物的添加浓度及其在提取剂中的溶解性不同。低加标浓度(如50、100 μg/kg)下的回收率总体好于高加标浓度(如1 000 μg/kg)。分子质量较低的聚酯低聚物(如环状二聚体)更容易溶于甲醇提取剂,因此回收率要高于分子质量较高的聚酯低聚物(如环状四聚体)。
表4 聚酯低聚物的回收率和精密度
Table 4 Recovery and precision values of polyester oligomers
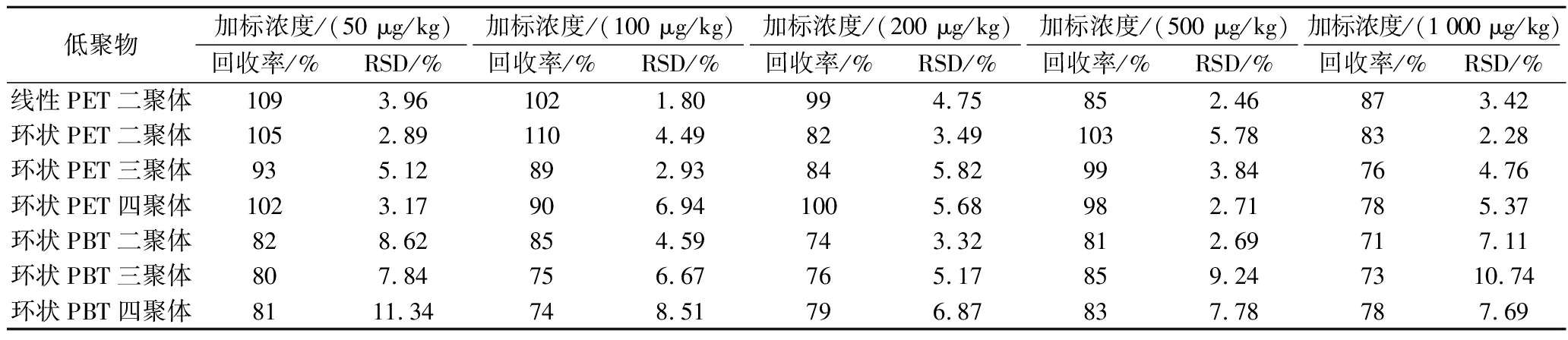
低聚物加标浓度/(50 μg/kg)加标浓度/(100 μg/kg)加标浓度/(200 μg/kg)加标浓度/(500 μg/kg)加标浓度/(1 000 μg/kg)回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%线性PET二聚体1093.961021.80994.75852.46873.42环状PET二聚体1052.891104.49823.491035.78832.28环状PET三聚体935.12892.93845.82993.84764.76环状PET四聚体1023.17906.941005.68982.71785.37环状PBT二聚体828.62854.59743.32812.69717.11环状PBT三聚体807.84756.67765.17859.247310.74环状PBT四聚体8111.34748.51796.87837.78787.69
3 结语
本研究关注食品中聚酯低聚物的暴露导致的食品安全风险,以橄榄油为油性食品模拟物建立了包含线性和环状低聚物在内的7种聚酯低聚物的检测方法,包括基于溶剂萃取和净化的样品前处理方法和基于液相色谱-串联质谱的仪器分析方法。通过对前处理过程中的溶剂提取条件和仪器分析过程中的参数进行优化,以达到最佳检测效果。研究结果表明,所建立的橄榄油中聚酯低聚物的检测方法,操作简单、灵敏度高,在大范围的加标浓度下具有较好的回收率和精密度。该方法的建立可为食品接触材料中聚酯低聚物的迁移检测提供技术支持,也可为相关检测标准的制定提供参考。
[1] ZHANG M Y, BIESOLD G M, CHOI W, et al.Recent advances in polymers and polymer composites for food packaging[J].Materials Today, 2022, 53(Suppl C):134-161.
[2] ABID U, SUN G, SOONG Y H V, et al.Evaluation of enzymatic depolymerization of PET, PTT, and PBT polyesters[J].Biochemical Engineering Journal, 2023, 199:109074.
[3] OUYANG X Y, LU Z C, HU Y L, et al.Research progress on sample pretreatment methods for migrating substances from food contact materials[J].Journal of Separation Science, 2021, 44(4):879-894.
[4] SHIN C, KIM D G, KIM J H, et al.Migration of substances from food contact plastic materials into foodstuff and their implications for human exposure[J].Food and Chemical Toxicology, 2021, 154:112373.
[5] COLOMBO G, CORREDIG M, UYSAL ÜNALAN I, et al.Untargeted screening of NIAS and cyclic oligomers migrating from virgin and recycled polyethylene terephthalate (PET) food trays[J].Food Packaging and Shelf Life, 2024, 41:101227.
[6] HOPPE M, DE VOOGT P, FRANZ R.Identification and quantification of oligomers as potential migrants in plastics food contact materials with a focus in polycondensates-A review[J].Trends in Food Science &Technology, 2016, 50:118-130.
[7] UBEDA S, AZNAR M, NER N C.Determination of oligomers in virgin and recycled polyethylene terephthalate (PET) samples by UPLC-MS-QTOF[J].Analytical and Bioanalytical Chemistry, 2018, 410(9):2377-2384.
N C.Determination of oligomers in virgin and recycled polyethylene terephthalate (PET) samples by UPLC-MS-QTOF[J].Analytical and Bioanalytical Chemistry, 2018, 410(9):2377-2384.
[8] UBEDA S, AZNAR M, ROSENMAI A K, et al.Migration studies and toxicity evaluation of cyclic polyesters oligomers from food packaging adhesives[J].Food Chemistry, 2020, 311:125918.
[9] TSOCHATZIS E D, ALBERTO LOPES J, KAPPENSTEIN O, et al.Quantification of PET cyclic and linear oligomers in teabags by a validated LC-MS method-In silico toxicity assessment and consumer’s exposure[J].Food Chemistry, 2020, 317:126427.
[10] BRENZ F, LINKE S, SIMAT T J. Linear and cyclic oligomers in PET, glycol-modified PET and TritanTM used for food contact materials[J]. Food Additives &Contaminants. Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2021, 38(1):160-179.
[11] BRENZ F, LINKE S, SIMAT T.Linear and cyclic oligomers in polybutylene terephthalate for food contact materials[J].Food Additives &Contaminants.Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2018, 35(3):583-598.
[12] XU T T, QIU K, GAO H B, et al.Simultaneous determination of cyclic PET and PBT oligomers migrated from laminated steel cans for food[J].Food Control, 2021, 130:108396.
[13] 吴刚, 潘家杰, 徐彤彤, 等.覆膜铁罐装食品中聚对苯二甲酸乙二醇酯及聚对苯二甲酸丁二酯环状低聚物的测定研究[J].食品与发酵工业, 2023, 49(19):312-318.WU G, PAN J J, XU T T, et al.Determination of polyethylene terephthalate and polybutylene terephthalate cyclic oligomers in laminated steel canned food[J].Food and Fermentation Industries, 2023, 49(19):312-318.
[14] 王全新, 赵丹, 张宇含, 等.迁移至食品中的覆膜铁容器低聚物的检测方法[J].中国口岸科学技术, 2023, 5(6):21-29.WANG Q X, ZHAO D, ZHANG Y H, et al.Detection method of oligomers migrating from laminated steel food containers to food[J].China Port Science and Technology, 2023, 5(6):21-29.
[15] 李倩云, 吴刚, 王亚, 等.覆膜金属罐中PBT/PET环状低聚物在食品中的迁移测试及基于膳食暴露量的风险评估[J].分析测试学报, 2022, 41(10):1494-1500.LI Q Y, WU G, WANG Y, et al.Migration test and risk assessment based on dietary exposure of PBT/PET cyclic oligomers in polymer-laminated metal cans[J].Journal of Instrumental Analysis, 2022, 41(10):1494-1500.
[16] ALBERTO LOPES J, TSOCHATZIS E D, KARASEK L, et al.Analysis of PBT and PET cyclic oligomers in extracts of coffee capsules and food simulants by a HPLC-UV/FLD method[J].Food Chemistry, 2021, 345:128739.
[17] TSOCHATZIS E D, ALBERTO LOPES J, GIKA H, et al.Development and validation of an UHPLC-qTOF-MS method for the quantification of cyclic polyesters oligomers in pasta by applying a modified QuEChERS clean-up[J].Food Chemistry, 2021, 347:129040.
[18] FRANZ R, WELLE F.Migration measurement and modelling from poly (ethylene terephthalate) (PET) into soft drinks and fruit juices in comparison with food simulants[J].Food Additives &Contaminants. Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2008, 25(8):1033-1046.
[19] ![]() S, AZNAR M, VERA P, et al.Overall and specific migration from multilayer high barrier food contact materials-kinetic study of cyclic polyester oligomers migration[J].Food Additives &Contaminants. Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2017, 34(10):1784-1794.
S, AZNAR M, VERA P, et al.Overall and specific migration from multilayer high barrier food contact materials-kinetic study of cyclic polyester oligomers migration[J].Food Additives &Contaminants. Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2017, 34(10):1784-1794.
[20] HOPPE M, FORNARI R, DE VOOGT P, et al.Migration of oligomers from PET:Determination of diffusion coefficients and comparison of experimental versus modelled migration[J].Food Additives Contaminants.Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2017, 34(7):1251-1260.