三文鱼是世界著名的高值经济鱼类,而且是世界范围内广泛食用的一种油性鱼类,其肉质鲜嫩,口感绵柔,味道鲜美。鱼肉中富含ω-3不饱和脂肪酸、蛋白质和氨基酸,营养丰富,深受消费者喜爱[1-5]。“三文鱼”并非科学的分类名称,其汉语名称来源于我国粤港地区对于英文“salmon”的音译,只有大西洋鲑、帝王鲑、银鲑、粉鲑、红鲑、狗鲑这6种在海洋中栖息成长,达到性成熟后,再从海洋到河流进行迁徙洄游的鱼类,才能称之为真三文鱼[6]。这6种鲑鱼都为鲑形目鲑科鱼中的鲑亚科,却分属2个属,大西洋鲑(Salmo salar)为鲑属(Salmo);帝王鲑(大鳞大马哈鱼,Oncorhynchus tshawytscha)、银鲑(银大马哈鱼,Oncorhynchus kisutch)、粉鲑(驼背大马哈鱼,Oncorhynchus gorbuscha)、红鲑(红大马哈鱼,Oncorhynchus nerka)、狗鲑(大马哈鱼,Oncorhynchus keta)为大马哈鱼属(Oncorhynchus)[7]。在中国市场上,被称为“三文鱼”的淡水虹鳟鱼(Oncorhynchus mykiss)也属大马哈鱼属(Oncorhynchus)。帝王鲑号称“三文鱼中的劳斯莱斯”,帝王鲑刺身肉质丰腴,口感绵密,口感好于其他三文鱼和虹鳟鱼。帝王鲑刺身一斤的零售价约为300元,其价格大约是其他三文鱼和虹鳟鱼的4~8倍不等,由于这几种鱼的纹理和外观极为相似,消费者无法通过外观进行区别,不法商贩便有了可乘之机,将价格较低的三文鱼或虹鳟鱼冒充帝王鲑刺身,极大地损害了消费者的身体健康和合法权益。自2023年8月以来,媒体相继报道日本向大海排放核污水以及英国核泄漏事件后[8-9],淡水虹鳟鱼的价格直线上升,已超过部分价格较低的三文鱼,在不久的将来,不法商贩很可能会利用价格较低的三文鱼冒充淡水虹鳟鱼。目前根据线粒体基因设计特异性引物和探针组合,利用实时荧光PCR手段检测鱼类源性成分,已经成为鱼肉鉴别最常见的方法[10-15]。国家质量监督检验检疫总局于2014年出台了SN/T 3589《出口食品中常见鱼类及其制品的鉴伪方法》,以金枪鱼线粒体cytb基因、鳕鱼线粒体16S rRNA、安康鱼和石斑鱼线粒体COI基因、黄鱼线粒体ND6基因为靶基因,利用实时荧光PCR技术检测上述鱼类源性成分的检测标准方法[16]。国家市场监督管理总局于2019年发布了《鳕鱼及其制品中裸盖鱼、油鱼和南极犬牙鱼源性成分检测》(BJS 201907),此方法利用实时荧光PCR技术,能够检测鳕鱼及其制品中裸盖鱼(Anoplopoma fimbria)、油鱼(Lepidocybium flavobrunneum、Ruvettus pretiosus)和南极犬牙鱼(Dissostichus eleginoides、Dissostichus mawsoni)的源性成分[17]。周露等[18]通过实时荧光PCR法鉴别大西洋鲑鱼和虹鳟鱼,可以对大西洋鲑鱼和虹鳟鱼进行真伪鉴别。王楠[19]通过DNA条形码技术,特异性扩增鲑科鱼类线粒体COI基因和16S rRNA基因,达到鉴别鲑科鱼类的方法。刘莎莎[20]采用实时荧光PCR法鉴别大西洋鲑鱼、虹鳟鱼、狗鲑和红鲑;但是通过实时荧光PCR法鉴别帝王鲑、银鲑、粉鲑真伪的方法还未见报道。
本研究从帝王鲑、银鲑、粉鲑的遗传背景分析,根据帝王鲑和银鲑的线粒体cytb基因序列以及粉鲑的线粒体COI基因序列设计TaqMan特异性引物和探针组合,采用实时荧光PCR技术对帝王鲑、银鲑、粉鲑进行源性成分检测,从而达到鉴别帝王鲑、银鲑、粉鲑真伪和定量分析的目的。
1 材料与方法
1.1 材料与试剂
DNA提取试剂:QIAamp Fast DNA Tissue Kit组织基因组DNA提取试剂盒,德国凯杰公司;实时荧光PCR试剂:Premix Ex TaqTM(Probe qPCR),日本宝生物公司;帝王鲑、银鲑、粉鲑、大西洋鲑鱼、虹鳟鱼、大马哈鱼、红大马哈鱼、真鲷鱼(Pagrosomus major)、大西洋鳕鱼(Gadus morhua)、巴沙鱼(Pangasius bocourti)、半滑舌鳎(Cynoglossus semilaevis),京东商城;草鱼(Ctenopharyngodon idella)、鲤鱼(Cyprinus carpio)、猪肉(Sus scrofa)、牛肉(Bos taurus)、山羊肉(Capra hircus)、鸡肉(Gallus gallus),临沂当地超市。
1.2 仪器与设备
LightCycler96实时荧光PCR仪,瑞士罗氏公司;GTUFB500电热恒温干燥箱,德国墨尔特公司;ND2000超微量分光光度计,美国Thermo公司;MJ-BL25B3搅拌机,广东美的生活电器制造有限公司;MIKRO 200R微量管离心机,德国Hettich公司;XPE105万分之一电子天平,意大利梅特勒-托利多公司。
1.3 实验方法
1.3.1 样品DNA的提取
万分之一电子天平称取样品约10 mg,置于DNA提取试剂盒提供的管中,按照DNA提取试剂盒说明书进行操作,用100 μL TAE Buffer或ddH2O溶解。
1.3.2 引物设计
通过GenBank下载帝王鲑、银鲑、粉鲑、大西洋鲑鱼、虹鳟鱼、大马哈鱼、红大马哈鱼、真鲷鱼、尼罗罗非鱼、大西洋鳕鱼、太平洋鳕鱼、巴沙鱼、半滑舌鳎、草鱼、鲤鱼、猪、牛、山羊、绵羊、鸡的cytb和COI基因序列,利用clustalx软件对上述物种cytb和COI基因序列进行比对,找出序列差异处,通过NCBI网站的引物设计工具Primer-BLAST和探针设计软件Primer Express 3.0设计一组帝王鲑和银鲑cytb基因特异性引物和探针,粉鲑COI基因特异性引物和探针,如表1所示。
表1 特异性引物和探针
Table 1 Specific primers and probes

样品引物序列(5′-3′)帝王鲑上游引物FGTTGTTCCTATCTTACACACTTCC下游引物RGCCGATGATGATGAATGGGTG探针序列PFAM-CGACCACTGACCCAATTCTT-MGB银鲑 上游引物FGCCCGAGTGGTACTTCTTGTT下游引物RTTTGGAGGTGTGTAAGATTGGT探针序列PFAM-ACGCAATCCTACGATCTATCCC-MGB粉鲑 上游引物FAGCATCCGTCGACTTGACTA下游引物RAGATTGCCGGTGGTTTTATGT探针序列PFAM- TCTTCTCCCTTCATTTAGCGGG-MGB
1.3.3 实时荧光PCR体系的构建
实时荧光PCR反应体系如表2所示。
表2 实时荧光PCR反应体系(20 μL)
Table 2 Real-time PCR reaction system(20 μL)
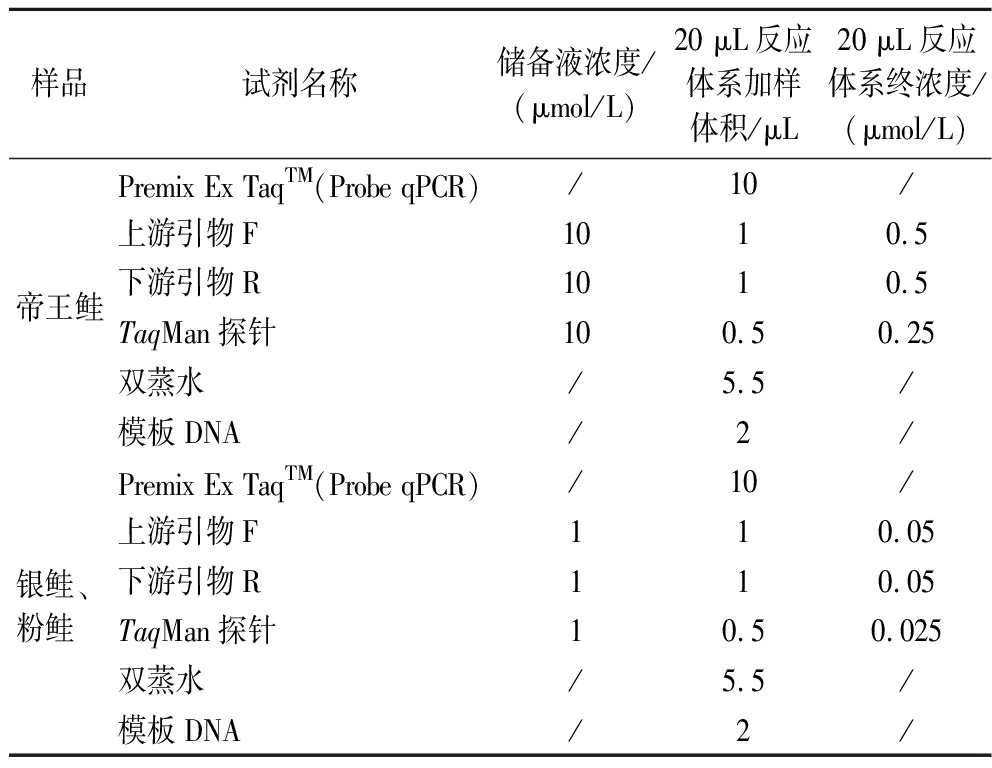
样品试剂名称储备液浓度/(μmol/L)20 μL反应体系加样体积/μL20 μL反应体系终浓度/(μmol/L)帝王鲑Premix Ex TaqTM(Probe qPCR)/10/上游引物F1010.5下游引物R1010.5TaqMan探针100.50.25双蒸水/5.5/模板DNA/2/银鲑、粉鲑Premix Ex TaqTM(Probe qPCR)/10/上游引物F110.05下游引物R110.05TaqMan探针10.50.025双蒸水/5.5/模板DNA/2/
PCR反应程序:95 ℃预变性30 s;95 ℃ 15 s,59 ℃ 30 s, 40个循环。
1.3.4 特异性实验
分别以帝王鲑、银鲑、粉鲑、大西洋鲑鱼、虹鳟鱼、大马哈鱼、红大马哈鱼、真鲷鱼、大西洋鳕鱼、巴沙鱼、半滑舌鳎、草鱼、鲤鱼、猪肉、牛肉、山羊肉、鸡肉动物的DNA为模板,利用超微量分光光度计测定上述样品DNA浓度,将DNA浓度稀释成5 ng/μL,以纯水为模板作为空白对照,按照1.3.2节中帝王鲑、银鲑、粉鲑特异性引物和探针以及1.3.3节的步骤进行实时荧光PCR检测,验证引物的特异性。并对帝王鲑、银鲑、粉鲑样品的扩增产物进行测序,将测序结果在NCBI中进行比对。
1.3.5 基因组灵敏度实验
利用超微量分光光度计测定帝王鲑样品DNA浓度,用ddH2O十倍梯度稀释帝王鲑、银鲑、粉鲑DNA,每个稀释级分别做3个平行重复,使每个稀释级的模板DNA含量分别为102 ng、10 ng、1 ng、10-1 ng、10-2 ng;按照1.3.2节中帝王鲑、银鲑、粉鲑特异性引物和探针以及1.3.3节的步骤进行实时荧光PCR检测。
1.3.6 帝王鲑、银鲑、粉鲑质量分数灵敏度与定量实验
取帝王鲑和罗非鱼样品,置于电热恒温鼓风干燥箱中,105 ℃烘干,搅拌机打磨成干粉,将帝王鲑和罗非鱼干粉按照干重质量以不同比例混合,再置于搅拌机中充分打磨混合,使用电子天平称量样品约 10 mg, 称量质量、帝王鲑干粉的质量分数以及帝王鲑干粉的质量分别为(10.06 mg,100%,10.06 mg)、(10.70 mg,75.5%,8.08 mg)、(10.00 mg,60.4%,6.04 mg)、(10.28 mg,38.5%,3.96 mg)、(10.03 mg,19.3%,1.94 mg)、(10.08 mg,10%,1.008 mg)、(10.05 mg,1%,0.100 5 mg)、(10.06 mg,0.1%,0.0100 6 mg)、(10.08 mg,0.01%,0.001 008 mg),每个浓度分别做4个平行重复,按照1.3.1节、1.3.2节帝王鲑特异性引物和探针、1.3.3节帝王鲑PCR反应体系的方法进行DNA提取和实时荧光PCR检测;以帝王鲑干粉质量的对数值为横坐标,平均Ct值为纵坐标做标准曲线。
分别取不同质量分数的帝王鲑干粉约10 mg,称量质量和帝王鲑干粉的质量分数分别为(10.06 mg,100%)、(10.70 mg,75.5%)、(10.00 mg,60.4%)、(10.18 mg,49.4%)、(10.28 mg,38.5%)、(10.03 mg,19.3%)、(10.08 mg,10%)、(10.05 mg,1%)、(10.06 mg,0.1%)、(10.08 mg,0.01%),每个浓度分别做4个平行重复,按照1.3.1节、1.3.2节帝王鲑特异性引物和探针、1.3.3节帝王鲑PCR反应体系的方法进行DNA提取和实时荧光PCR检测;将平均Ct值带入上述标准曲线,算出帝王鲑质量与质量分数,并与实际质量分数进行比较。
银鲑、粉鲑质量分数灵敏度与定量实验方法同帝王鲑质量分数灵敏度与定量实验方法。
1.3.7 市售三文鱼制品帝王鲑、银鲑、粉鲑源性成分检测
于京东商城和超市采购5份帝王鲑产品、5份银鲑产品、3份粉鲑产品和5份大西洋鲑鱼产品,按照1.3.1节、1.3.2节、1.3.3节的方法进行DNA提取和实时荧光PCR检测。
1.3.8 质量控制标准
当Ct值≤35,说明样品阳性。当Ct值≥40或无数值,说明样品阴性;当35 检测结果如图1所示,帝王鲑、银鲑、粉鲑荧光通道均出现典型的扩增曲线,Ct值分别为26.32、31.09、26.10,其他样品荧光通道无典型的扩增曲线,相应的Ct值无数值。将帝王鲑阳性样本扩增产物的测序序列在NCBI进行BLAST比对,样本序列与帝王鲑、银鲑cytb基因序列和粉鲑鲑COI基因相似度>99%,说明上述引物具有良好的特异性。 a-帝王鲑;b-银鲑;c-粉鲑 图1 特异性实验曲线 各稀释级的Ct值如表3所示,当帝王鲑DNA量≥10-1 ng时,荧光通道均可出现特异性扩增曲线,模板DNA含量对数值与平均Ct值呈线性相关,标准曲线为y=-3.381x+29.873,相关系数R2=0.999 6,扩增效果达到要求,4个浓度Ct值的标准偏差为0.050~0.11,相对标准偏差为0.22~0.35,具有良好的重复性。 表3 实时荧光PCR灵敏度实验 样品DNA量/ngCt值平均Ct值标准偏差相对标准偏差/%帝王鲑10223.1023.1623.2023.150.0500.221026.5726.4526.4426.490.0720.27129.6529.7729.8629.760.110.3510-133.2033.3733.4133.330.110.3310-2------银鲑 10226.6826.7626.7226.720.0330.121030.9630.8931.2631.040.160.52134.8934.7534.6834.770.0870.2510-1------粉鲑 10222.4622.5222.6122.530.0620.271026.1626.3726.3226.280.0900.34129.8429.7029.8129.780.0600.2010-1------ 注:-代表阴性。 当银鲑DNA量≥1 ng时,荧光通道均可出现特异性扩增曲线,模板DNA含量对数值与平均Ct值呈线性相关,标准曲线为y=-4.025x+34.868,相关系数R2=0.998 2,扩增效果达到要求,3个浓度Ct值的标准偏差为0.033~0.16,相对标准偏差为0.12~0.52,具有良好的重复性。 当粉鲑DNA量≥1 ng时,荧光通道均可出现特异性扩增曲线,模板DNA含量对数值与平均Ct值呈线性相关,标准曲线为y=-3.625x+29.822,相关系数R2=0.999 6,扩增效果达到要求,3个浓度Ct值的标准偏差为0.060~0.090,相对标准偏差为0.20~0.34,具有良好的重复性。 当帝王鲑质量分数≥0.1%时荧光通道均出现典型的扩增曲线且Ct值<35,说明帝王鲑的质量分数灵敏度为0.1%。 当待测样品的平均Ct值<27时,以帝王鲑干粉的质量(分别为10.06、8.08、6.04、3.96、1.94、1.008 mg)的对数值为横坐标,相应的平均Ct值为纵坐标做标准曲线,如图2-a所示。 a-平均Ct值<27;b-平均Ct值≥27 图2 帝王鲑质量分数标准曲线 将待测样品的平均Ct值带入标准曲线方程,得出待测样品的帝王鲑的质量和质量分数,并与实际质量分数进行比较,如表4所示,所有浓度的误差均≤±5.0%。 表4 帝王鲑质量分数定量实验 待测样品平均Ct值待测样品中测定的帝王鲑质量/mg待测样品的质量/mg待测样品中测定的帝王鲑质量分数/%待测样品中实际帝王鲑质量分数/%误差/%22.382 511.0910.06100.0100.0022.962 58.2110.7076.775.51.223.717 55.5410.0055.460.4-5.024.084.6410.1845.649.4-3.824.597 53.5110.2834.138.5-4.425.677 52.0010.0319.919.30.626.691.1810.0811.710.01.730.187 50.1110.051.11.00.134.060.0110.060.10.10 当待测样品的平均Ct值≥27时,以帝王鲑干粉的质量(分别为10.06、8.08、6.04、3.96、1.94、1.008、0.100 5、0.010 06 mg)的对数值为横坐标,相应的平均Ct值为纵坐标做标准曲线,如图2-b所示。 将待测样品的平均Ct值带入标准曲线方程,得出待测样品的帝王鲑的质量和质量分数,并与实际质量分数进行比较,如表4所示,所有浓度的误差均≤±0.1%。 当银鲑质量分数≥1%时荧光通道均出现典型的扩增曲线且Ct值<35,说明银鲑的质量分数灵敏度为1%。 当待测样品的平均Ct值<32时,以银鲑干粉的质量(分别为9.93、8.06、6.00、3.98、1.984、1.009 mg)的对数值为横坐标,相应的平均Ct值为纵坐标做标准曲线,如图3-a所示。 a-平均Ct值<32;b-平均Ct值≥32 图3 银鲑质量分数标准曲线 将待测样品的平均Ct值带入标准曲线方程,得出待测样品的银鲑的质量和质量分数,并与实际质量分数进行比较,如表5所示,所有浓度的误差均≤±7.7%。 表5 银鲑质量分数定量实验 待测样品平均Ct值待测样品中测定的银鲑质量/mg待测样品的质量/mg待测样品中测定的银鲑质量分数/%待测样品中实际银鲑质量分数/%误差/%25.98513.659.93100.0100.0027.287 57.5010.0974.378.3-4.027.952 55.5210.1054.759.4-4.728.542 54.2010.1041.649.3-7.728.902 53.569.9835.739.9-4.230.402 51.789.9218.020.0-2.031.341.1610.0911.510.01.532.430.489.934.85.0-0.234.775 0.1310.061.31.00.3 当待测样品的平均Ct值≥32时,以银鲑干粉的质量(分别为9.93、8.06、6.00、3.98、1.984、1.009、0.496 5、0.100 6 mg)的对数值为横坐标,相应的平均Ct值为纵坐标做标准曲线,如图3-b所示。 将待测样品的平均Ct值带入标准曲线方程,得出待测样品的银鲑的质量和质量分数,并与实际质量分数进行比较,如表5所示,所有浓度的误差均≤±0.3%。 当粉鲑质量分数≥1%时荧光通道均出现典型的扩增曲线且Ct值<35,说明粉鲑的质量分数灵敏度为1%。 当待测样品的平均Ct值<28时,以粉鲑干粉的质量(分别为10.04、8.032、6.006、4.04、2.002、1.008 mg)的对数值为横坐标,相应的平均Ct值为纵坐标做标准曲线,如图4-a所示。 a-平均Ct值<28;b-平均Ct值≥28 图4 粉鲑质量分数标准曲线 将待测样品的平均Ct值带入标准曲线方程,得出待测样品的粉鲑的质量和质量分数,并与实际质量分数进行比较,如表6所示,所有浓度的误差均≤±2.8%; 表6 粉鲑质量分数定量实验 待测样品平均Ct值待测样品中测定的粉鲑质量/mg待测样品的质量/mg待测样品中测定的粉鲑质量分数/%待测样品中实际粉鲑质量分数/%误差/%24.88512.0110.04100.0100.0025.412 57.7810.0477.580.0-2.525.787 55.7510.0157.560.0-2.525.897 55.2010.0651.750.01.726.2953.7610.1037.240.0-2.827.002.0710.0120.720.00.727.851.0210.0810.110.00.128.740.6410.106.35.01.331.577 50.08210.040.81.0-0.2 当待测样品的平均Ct值≥28时,以粉鲑干粉的质量(分别为10.04、8.032、6.006、4.04、2.002、1.008、0.505、0.100 4 mg)的对数值为横坐标,相应的平均Ct值为纵坐标做标准曲线,如图4-b所示。 将待测样品的平均Ct值带入标准曲线方程,得出待测样品的粉鲑的质量和质量分数,并与实际质量分数进行比较,如表6所示,所有浓度的误差均≤±1.3%。 结果如表7所示,采用实时荧光PCR法,5份帝王鲑产品全部检出帝王鲑源性成分,未检出银鲑和粉鲑源性成分;5份银鲑产品全部检出银鲑源性成分,未检出帝王鲑和粉鲑源性成分;3份粉鲑产品全部检出粉鲑源性成分,未检出帝王鲑和银鲑源性成分;5份大西洋鲑鱼产品未检出帝王鲑、银鲑、粉鲑源性成分,说明目前市售帝王鲑、银鲑、粉鲑掺假率较低;以上结果表明本研究所建立方法在市售三文鱼制品帝王鲑、银鲑、粉鲑源性成分检验中具有很好应用效果,并且具有良好应用前景。 表7 市售三文鱼制品帝王鲑、银鲑、粉鲑源性成分检测 序号样品名称qPCR法帝王鲑引物和探针银鲑引物和探针粉鲑引物和探针1~5帝王鲑刺身+--6~10银鲑刺身-+-11~13粉鲑刺身、熏粉鲑、粉鲑罐头--+14~18大西洋鲑鱼刺身--- 注:+、-分别代表阳性、阴性。 近几年,有部分不法商贩用巴沙鱼冒充龙利鱼、用油鱼冒充鳕鱼的“海鲜欺诈”时有发生,严重侵犯了消费者的知情权和经济利益,一旦消费者有喜食刺身的爱好,将假冒的淡水鱼作为海水鱼食用,极有可能会患上寄生虫病,严重危害消费者的身体健康。李杰等[21-22]利用巴沙鱼线粒体cytb基因和龙利鱼线粒体16S rRNA基因,建立了巴沙鱼和龙利鱼源性成分的实时荧光PCR快速检测方法,能够有效解决用淡水巴沙鱼冒充海水龙利鱼的掺假问题。李进波等[23]利用鲑亚科鱼类生长激素基因,建立了利用实时荧光PCR技术鉴定鲑亚科鱼类成分的方法。刘立兵等[24]利用日本鲭、金枪鱼、秋刀鱼和沙丁鱼的线粒体基因,建立了利用实时荧光PCR技术检测上述4种高组胺鱼成分的方法;实时荧光PCR技术已成为肉类源性成分检测最常见、简单、高效、环保的方法。 本研究建立了一种可以快速检测帝王鲑、银鲑、粉鲑源性成分的实时荧光PCR技术。根据帝王鲑和银鲑的线粒体cytb基因序列以及粉鲑的线粒体COI基因序列设计特异性引物和探针,通过优化扩增反应体系进行实时荧光PCR扩增,达到快速检测产物的目的。 陈晨等[25]利用微滴式数字PCR对肉制品中羊肉和猪肉进行定量分析,但是由于微滴式数字PCR价格昂贵,动辄上百万,并不适合很多基层的检测机构,本研究利用实时荧光PCR,通过对不同质量分数的帝王鲑、银鲑和粉鲑样品进行分析,不仅降低了实验成本,而且质量的对数值与平均Ct值均呈线性相关,相关系数R2均>0.9,帝王鲑质量分数误差≤±5.0%,银鲑质量分数误差≤±7.7%,粉鲑质量分数误差≤±2.8%,质量分数误差较低,说明可以通过Ct值判断样品中是否掺入其他肉类或杂质,本研究所建立的鱼肉制品定量分析方法具有操作简单、成本低的优点,在鱼肉制品的定量分析方面具有良好的应用前景;由于不同的温度和时间、不同的基因组DNA提取试剂盒都会影响基因组DNA的提取效率,所以在进行质量分数定量实验时,需要用同一DNA提取试剂盒在同一时间提取标准品和待测样品的DNA,以保证标准品和待测样品的DNA提取效率相同;当用于做标准曲线的相关系数R2<0.9时,说明某一质量分数的标准品的DNA提取效率出现偏差,需要重新进行DNA的提取;由于不同位置的鱼肉脂肪、蛋白质等含量不同,不同位置的鱼肉干粉中DNA含量也有所不同,例如脂肪含量较高的部位DNA含量会比脂肪含量较低的部位DNA含量低,所以用于做标准曲线的标准品需要与待测样品取自同一部位。 本研究引物和探针组合特异性强,使用此引物和探针可以特异性地检出帝王鲑、银鲑和粉鲑源性成分,与之同属大马哈鱼属且亲缘较近的其他大马哈鱼以及大西洋鲑鱼均无法检出;耗时短,反应时间仅为1 h,节约了时间和成本;灵敏度高,帝王鲑基因组DNA灵敏度可达到10-1 ng,在与罗非鱼粉混合的鱼肉制品中可检测,质量分数灵敏度达到0.1%,银鲑和粉鲑的基因组DNA灵敏度均可达到1 ng,在与罗非鱼粉混合的鱼肉制品中均可检测,质量分数灵敏度均达到1%。本研究为加强鱼肉制品的监管力度,鉴定三文鱼真伪,打击三文鱼的造假行为,保护消费者的合法权益提供了有效的技术手段,并且在鱼肉制品的快速检测方面具有良好的应用前景。 [1] 周井娟, 陈林兴. 世界三文鱼的贸易格局及发展预测[J]. 农业经济与管理, 2012(2):86-92.ZHOU J J, CHEN L X. Analysis on international salmon trade structure and future development trend[J]. Agricultural Economics and Management, 2012(2):86-92. [2] 张静, 陶宁萍, 王明福. 三文鱼头、金枪鱼头及鳙鱼头脂质组成及脂肪酸组成分析[C]. 中国食品科学技术学会第十五届年会论文集。青岛: 2018:267-268.ZHANG J, TAO N P, WANG M F. Characterization of lipids composition and fatty acids profile from three fish heads [C]. The 15th Annual Meeting of Chinese Institute of Food Science and Technology.Qingdao: 2018:267-268. [3] 徐玉兰, 牛洪波. 三文鱼多不饱和脂肪酸分析及稳定性研究[J]. 烟台职业学院学报, 2018, 13(3):90-92.XU Y L, NIU H B. Analysis and stability of polyunsaturated fatty acids in salmon[J]. Journal of Yantai Vocational College, 2018, 13(3):90-92. [4] 罗刚. 三文鱼营养研究概况[J].畜牧与饲料科学,2009,30(5):23.LUO G. Overview of salmon nutrition research[J]. Animal Husbandry and Feed Science, 2009, 30(5):23. [5] 王杰. 低盐三文鱼方便食品加工过程中磷脂组学与品质变化研究[D]. 杭州: 浙江工商大学, 2021: 1.WANG J. Study on the changes of phospholipidomics and quality of low-salt salmon convenience food[D]. Hangzhou: Zhejiang Gongshang University, 2021: 1. [6] 一个男人在流浪. 如何看待龙羊峡三文鱼养殖厂寄生虫检测采访?[EB/OL]. (2018-05-27)[2024-03-04]. https://daily.zhihu.com/story/9684396?utm_campaign=in_app_share&utm_medium=Android&utm_source=com.tencent.mm.ui.tools.AddFavoriteUI.A man is wandering. How to view the interview on parasite detection in Longyangxia salmon farming plant? [EB/OL]. (2018-05-27)[2024-03-04]. https://daily.zhihu.com/story/9684396?utm_campaign=in_app_share&utm_medium=Android&utm_source=com.tencent.mm.ui.tools.AddFavoriteUI. [7] 孙大江, 王炳谦. 鲑科鱼类及其养殖状况[J]. 水产学杂志, 2010, 23(2):56-63.SUN D J, WANG B Q. Aquaculture of salmonids in China[J]. Chinese Journal of Fisheries, 2010, 23(2):56-63. [8] 齐倩. 英国塞拉菲尔德核设施被曝出现核泄漏,“官方已掩盖至少三年”[EB/OL]. (2023-12-06) [2024-03-04]. https://www.guancha.cn/internation/2023_12_06_718109.shtml.QI Q. The Selafield nuclear facility in the UK has been exposed to have a nuclear leak, and “the authorities have been covering it up for at least three years.”[EB/OL]. (2023-12-06) [2024-03-04]. https://www.guancha.cn/internation/2023_12_06_718109.shtml. [9] 新华社记者. 新华时评:日本核污染水强排入海贻害无穷[EB/OL]. (2023-08-24) [2024-03-04]. http://www.xinhuanet.com/2023-08/24/c_1129820631.htm.Xinhua News Agency reporter. Xinhua News Review: Japan’s Nuclear Pollution Water Discharged into the Sea, Endless Harm[EB/OL]. (2023-08-24) [2024-03-04].http://www.xinhuanet.com/2023-08/24/c_1129820631.htm. [10] LIU S S, XU K H, WU Z G, et al. Identification of five highly priced tuna species by quantitative real-time polymerase chain reaction[J]. Mitochondrial DNA. Part A, DNA Mapping, Sequencing, and Analysis, 2016, 27(5):3270-3279. [11] XIONG X, YUAN F Y, HUANG M H, et al. Development of a rapid method for codfish identification in processed fish products based on SYBR Green real-time PCR[J]. International Journal of Food Science &Technology, 2020, 55(4):1843-1850. [12] 万超, 代弟, 屈菲, 等. 实时荧光定量PCR法鉴别俄罗斯鲟鱼子酱分子[J]. 食品安全质量检测学报, 2021, 12(2):514-518.WAN C, DAI D, QU F, et al. Identification of Acipenser gueldenstaedtii caviar molecules by real-time fluorescence quantitative PCR[J]. Journal of Food Safety &Quality, 2021, 12(2):514-518. [13] 许随根, 李家鹏, 李金春, 等. 多重实时聚合酶链式反应熔解曲线法同步鉴别蓝鳍金枪鱼、裸盖鱼、异鳞蛇鲭[J]. 食品科学, 2020, 41(24):259-266.XU S G, LI J P, LI J C, et al. A multiplex real-time polymerase chain reaction combined with melting curve analysis method for simultaneous identification of the meat of bluefin tuna, sablefish and oilfish[J]. Food Science, 2020, 41(24):259-266. [14] 万超, 王雷, 王贵滨, 等. TaqMan荧光PCR法快速检测太平洋鳕鱼源性成分[J]. 食品安全质量检测学报, 2019, 10(7):2012-2015.WAN C, WANG L, WANG G B, et al. Rapid identification of Gadus macrocephalus source componentsby TaqMan fluorescent PCR[J]. Journal of Food Safety &Quality, 2019, 10(7):2012-2015. [15] 陈轩, 廖秀云, 陶旻, 等. Taqman探针荧光PCR检测鲨鱼源性成分[J]. 食品与生物技术学报, 2015, 34(10):1083-1088.CHEN X, LIAO X Y, TAO M, et al. Detection of shark derived materials by taqman probe fluorescent PCR[J]. Journal of Food Science and Biotechnology, 2015, 34(10):1083-1088. [16] 中华人民共和国国家质量监督检验检疫总局. SN/T 3589—2013出口食品中常见鱼类及其制品的鉴伪方法 [S]. 北京: 中国标准出版社, 2014. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 3589Method for Identification of Common Fish and Their Products in Export Food [S]. Beijing: China Standards Publishing House, 2014. [17] 国家市场监督管理总局食品安全抽检监测司.BJS 201907鳕鱼及其制品中裸盖鱼、油鱼和南极犬牙鱼源性成分检测[S]. 2019.Food Safety Sampling and Monitoring Department of the State Administration for Market Regulation. BJS 201907 Detection of Naked Cap Fish, Oil Fish, and Antarctic Canine Tooth Fish Derived Components in Cod and Its Products [S]. 2019. [18] 周露, 丁清龙, 杨晨, 等. 双重实时荧光PCR法鉴别大西洋鲑鱼和虹鳟鱼[J]. 食品安全质量检测学报, 2019, 10(13):4145-4151.ZHOU L, DING Q L, YANG C, et al. Simultaneous identification of Salmo salar and Oncorhynchus mykiss by dual real-time PCR[J]. Journal of Food Safety &Quality, 2019, 10(13):4145-4151. [19] 王楠. 基于DNA条码技术的食品中鲑科鱼物种成分鉴别研究[D]. 泰安: 山东农业大学, 2019: 1.WANG N. Indentification of Salmonid (Salmonidae) Species in Food Using DNA Baecoding[D]. Taian: Shandong Agricultural University, 2019: 1. [20] 刘莎莎. 大洋性金枪鱼和三文鱼的分子鉴定技术研究[D]. 杭州: 浙江理工大学, 2016: 40-54.LIU S S. Research on the molecular identification methods of oceanic tuna and salmon species[D]. Hangzhou: Zhejiang Sci-Tech University, 2016: 40-54. [21] 李杰, 钱云开, 张新, 等. 鱼肉制品中巴沙鱼源性成分的实时荧光聚合酶链式反应快速检测法[J]. 中国食品卫生杂志, 2021, 33(4):426-429.LI J, QIAN Y K, ZHANG X, et al. Real-time polymerase chain reaction method for rapid detection of Pangasius bocourti-derived components in fish products[J]. Chinese Journal of Food Hygiene, 2021, 33(4):426-429. [22] 李杰, 钱云开, 王建昌. 鱼肉制品中龙利鱼和巴沙鱼的鱼源性成分的双重实时荧光PCR快速检测法[J]. 中国食品卫生杂志, 2022, 34(3): 539-545.LI J, QIAN Y K, WANG J C. Dual real-time PCR method for rapid detection of sole fish and Pangasius bocourti-derived components in fish products[J]. Chinese Journal of Food Hygiene, 2022, 34(3): 539-545. [23] 李进波, 李想, 谌鸿超, 等. 实时荧光PCR法鉴定食品中鲑亚科鱼成分[J]. 食品科学, 2013, 34(20):194-198.LI J B, LI X, CHEN H C, et al. Identification of salmoninae in foods by real-time PCR[J]. Food Science, 2013, 34(20):194-198. [24] 刘立兵, 周藏, 付琦, 等. 实时荧光PCR技术检测4种常见高组胺鱼成分方法的建立及初步应用[J]. 中国口岸科学技术, 2023, 5(3):50-58.LIU L B, ZHOU C, FU Q, et al. Establishment and preliminary application of real-time PCR for detecting four common histamine-rich fish ingredient[J]. China Port Science and Technology, 2023, 5(3):50-58. [25] 陈晨, 张岩, 李永波, 等. 微滴式数字PCR对肉制品中羊肉和猪肉定量分析[J]. 现代食品科技, 2018, 34(1):221-226; 194.CHEN C, ZHANG Y, LI Y B, et al. Quantitative analysis of mutton and pork in meat products by micro digital PCR[J]. Modern Food Science and Technology, 2018, 34(1):221-226; 194.2 结果与分析
2.1 特异性实验结果

Fig.1 Curves of specific test2.2 基因组灵敏度实验结果
Table 3 Real-time PCR sensitivity test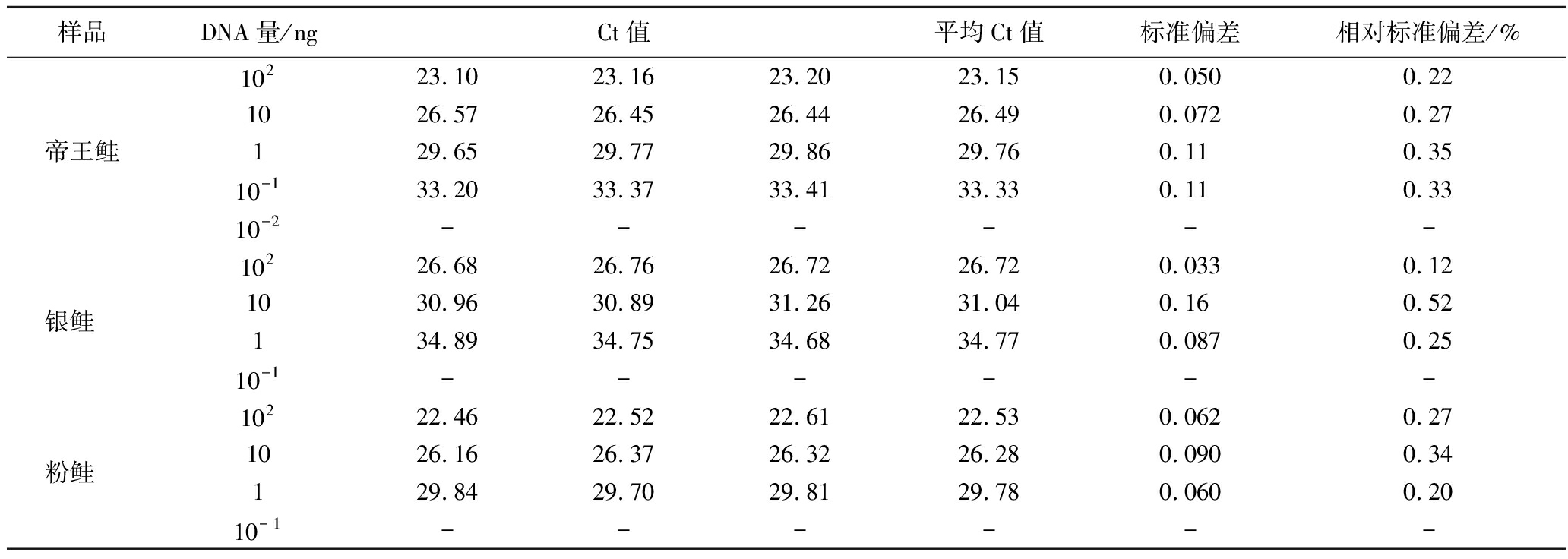
2.3 帝王鲑质量分数灵敏度与定量实验结果
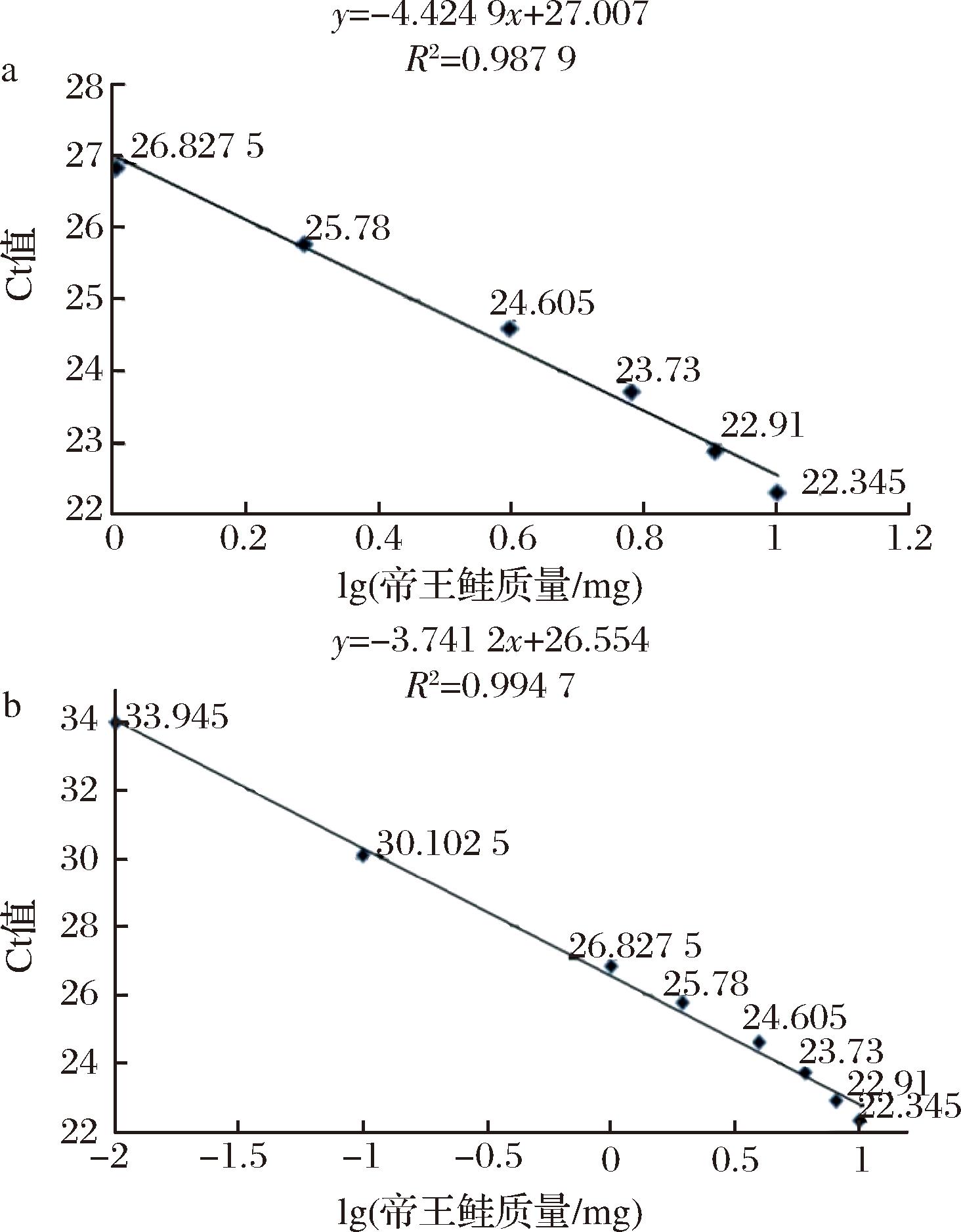
Fig.2 King salmon standard curve of mass fraction
Table 4 King salmon qualitative testing of mass fraction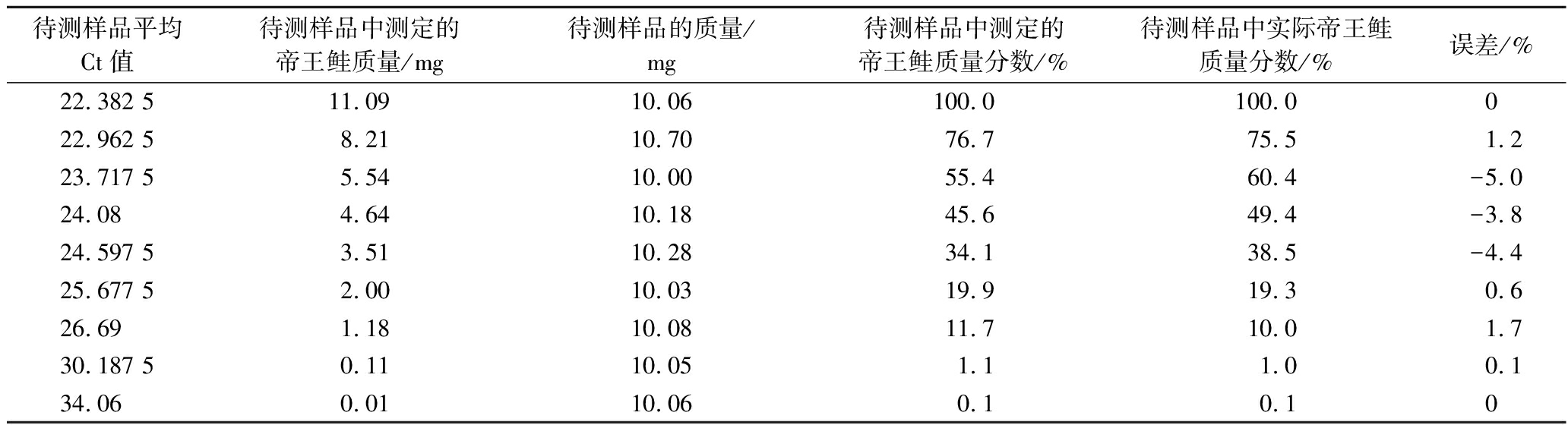
2.4 银鲑质量分数灵敏度与定量实验结果
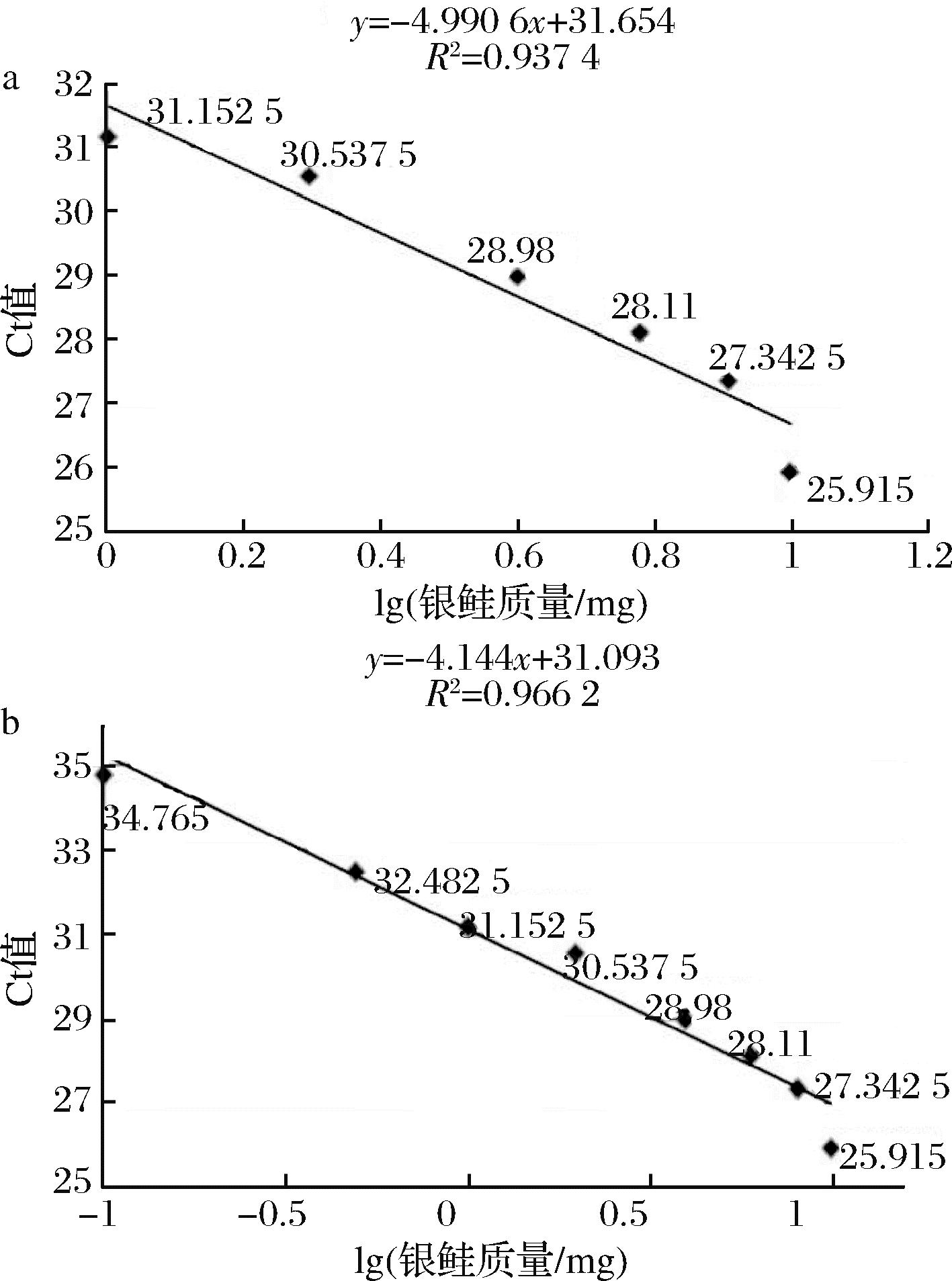
Fig.3 Silver salmon standard curve of mass fraction
Table 5 Silver salmon qualitative testing of mass fraction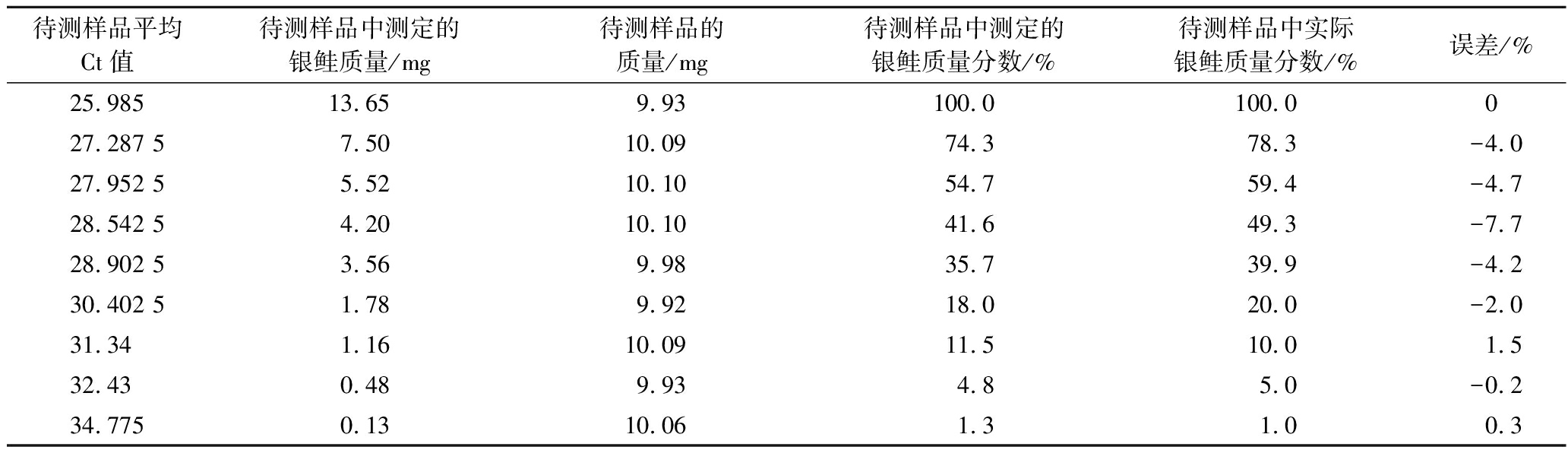
2.5 粉鲑质量分数灵敏度与定量实验结果
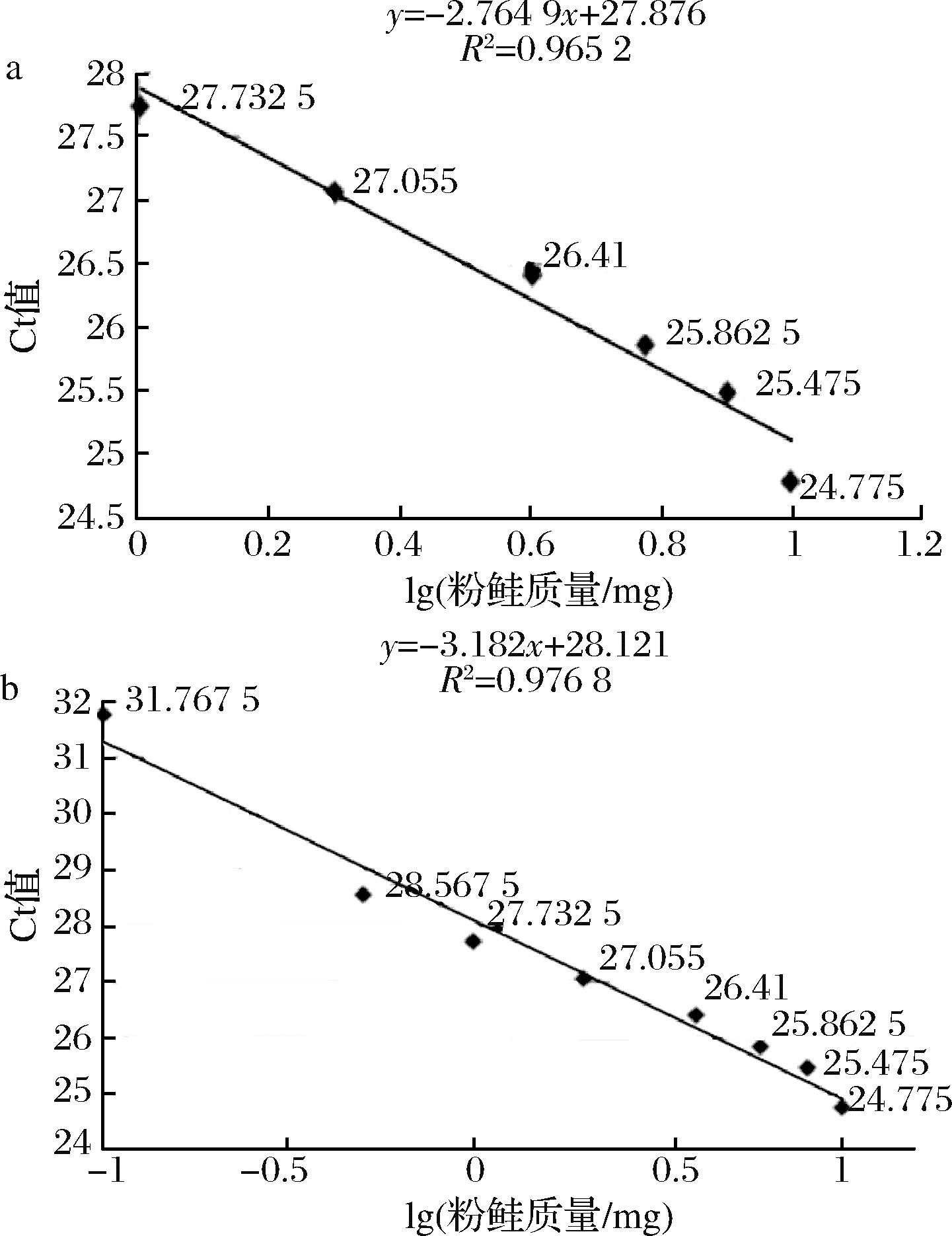
Fig.4 Pink salmon standard curve of mass fraction
Table 6 Pink salmon qualitative testing of mass fraction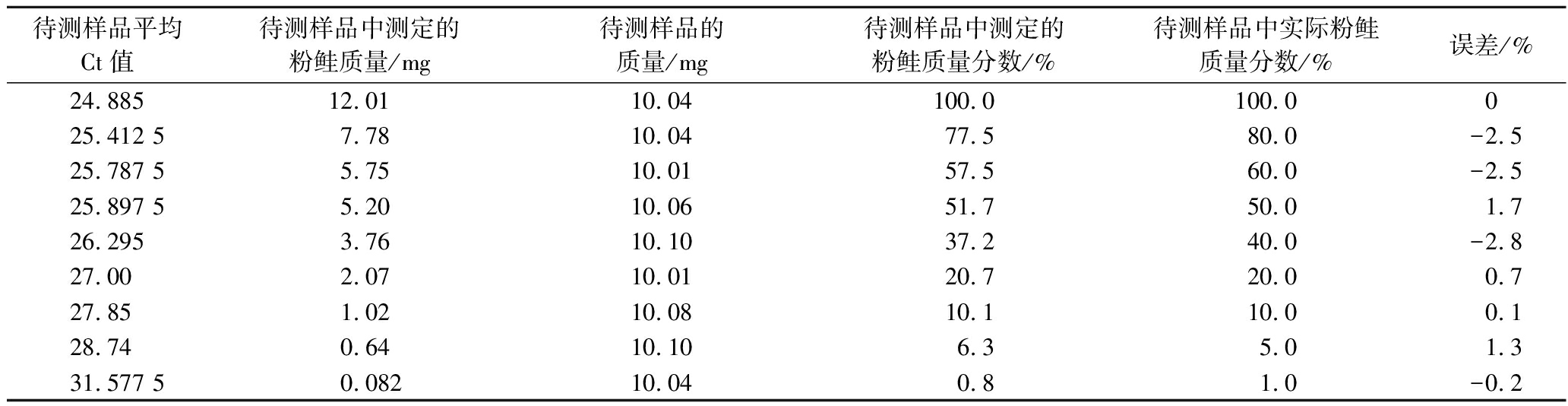
2.6 市售三文鱼制品帝王鲑、银鲑、粉鲑源性成分检测结果
Table 7 Detection for king salmon, silver salmon, and pink salmon-derived components in commercially available salmon products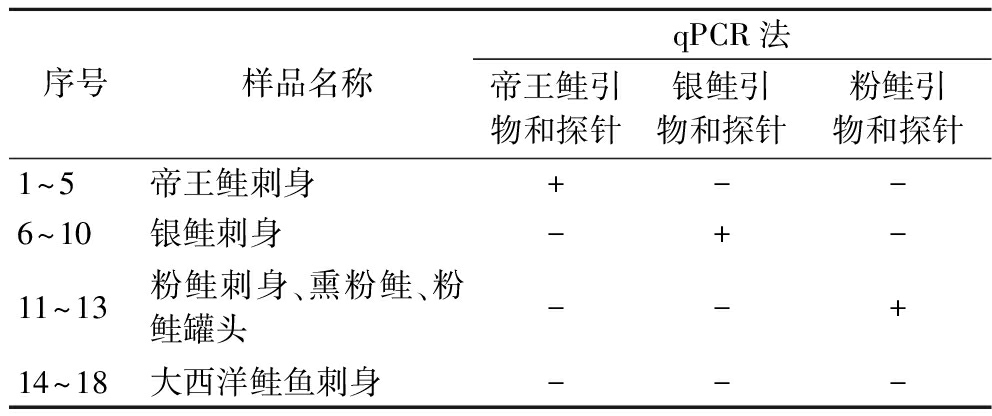
3 讨论
4 结论