脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),属于单端孢霉烯族化合物,主要由禾谷镰刀菌、尖孢镰刀菌、串珠镰刀菌、拟枝孢镰刀菌、粉红镰刀菌、雪腐镰刀菌等镰刀菌从受污染的玉米、小麦和其他谷物中产生[1-2]。DON最早由VERDERS在美国从被镰刀菌污染的玉米中发现,因食用了被DON污染的谷物饲料可以引起猪呕吐,故命名为呕吐毒素[3]。DON是食品中常见的真菌毒素,主要污染粮食作物和牧草,如大麦、小麦和玉米等,DON理化性质较为稳定,可以长时间存在于受污染的食物和饲料中,从而对人群和圈养动物健康产生威胁[4]。DON因其高水平的细胞毒性和强免疫抑制特性而被世界卫生组织列为重要的食品污染物[5]。根据DON的剂量和暴露时间的不同可引起人类或动物不同程度的免疫抑制或免疫刺激。当人摄入了被DON污染的食物后,会导致厌食、呕吐、腹泻、发烧、站立不稳、反应迟钝等急性中毒症状,严重时损害造血系统造成死亡[6]。因此,寻找一种快速、灵敏、选择性高和实用的检测方法,以监测食品中呕吐毒素的污染情况,从而保证食品安全和公共卫生安全。
由于中国传统饮食习惯中粮谷比例大大高于西方,使得DON的危害更为突出。为了监测食品和饲料中呕吐毒素的污染情况,以防止对人类健康造成损伤,迫切需要开发快速、灵敏的筛检方法。在国际癌症研究机构公布的评价报告中,DON被列为3类致癌物,欧盟已将DON的最高限量设定为500 μg/kg,而美国食品和药物管理局建议人类食品中DON允许水平为1 000 μg/kg。中国国家标准GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》规定,谷物和谷类产品(包括玉米、玉米粉、大麦、小麦、谷物和小麦粉)中DON的限量标准为1 000 μg/kg[7]。目前,食品和饲料中传统的DON检测方法如高效液相色谱法[8]、薄层色谱法[9]仍然是主流检测方法。然而,这些方法依赖复杂的高精密仪器和专业的操作人员,极大地限制了这些方法在经济或实验环境受限地区的推广执行。因此,开发一种高效、快速的检测方法至关重要。借助于小分子半抗原单克隆抗体制备技术的快速发展,酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)已被应用于毒素、农药、抗生素等小分子检测领域,并展现出高灵敏度、低成本和高通量的优点[10]。基于多种纳米材料构建的免疫生物传感器,在兼具传统ELISA优势的基础上,依赖纳米材料独特的光学、电学、传感和生物化学特性,逐渐被认为是食品安全领域最有前途的一类检测方法[11-12]。石墨烯量子点(N-200)是一种纳米(2~10 nm)半导体晶体,可以发射更加稳定的荧光,成为近年来在纳米技术中备受关注的材料[13]。与其他荧光材料相比,N-200的荧光是其他普通荧光材料的20倍,并且不需要避光[14]。金纳米粒子(gold nanoparticles,AuNPs)作为一种制备方便的贵金属无机纳米粒子具有极高的生物相容性,能对其粒径尺寸、形状实现较为灵活地调控,从而展现出多变的光学、电学和传感特性[15-17]。目前,AuNPs已被广泛应用于生物医学领域,如诊断、生物传感和药物递送。
免疫荧光生物传感器已成为检测各种小分子物质的主要方法,其操作简单、结果稳定、灵敏度高、且无须复杂仪器即可检测小分子物质[18]。与传统的间接竞争ELISA(ic-ELISA)不同,本研究将碱性磷酸酶(alkaline phosphatase,ALP)标记的抗体代替传统的辣根过氧化物酶(horseradish peroxidase,HRP-IgG)标记的二抗,并制备了二氧化锰包金(manganese dioxide coated with gold,AuNP@MnO2)纳米片,它是由二氧化锰纳米片包裹在AuNPs周围形成的二维纳米材料。ALP与HRP相比,具有更强的还原性,酶催化效率更高,响应信号更强。AuNP@MnO2可以快速猝灭N-200的荧光,这种特性可以用于构建检测呕吐毒素的免疫荧光生物传感器(DON-icELISA)。将呕吐毒素完全抗原(DON-BSA)包被在固相载体上,靶标物DON与DON-BSA竞争结合呕吐毒素单抗后,通过ALP-IgG引入高催化活性蛋白酶,构建免疫荧光生物传感器。反应过程中ALP将2-(磷酸二氢钾)-L-抗坏血酸[2-(dihydrogen phosphate)-L-ascorbic acid,AAP]转化为抗坏血酸(ascorbic acid,AA),诱导AuNP@MnO2片层结构分解,N-200的荧光恢复。通过测量荧光强度实现对DON定量、灵敏、准确地检测。
1 材料与方法
1.1 材料与试剂
DON、3-脱氧雪腐镰刀菌烯醇(3-DON)、5-乙酰脱氧雪腐镰刀菌烯醇(5-DON)、黄曲霉毒素B1(aflatoxin B1,AFB1)、伏马菌素B1(fumonisin B1,FB1)、玉米赤霉烯酮(zearalenone,ZEN)、T-2毒素和赭曲霉毒素A(ochratoxin A,OTA),Pribolab有限公司(中国青岛);DON-BSA、呕吐毒素单克隆抗体(DON mAb),深圳市安提生物技术有限公司;四氯金酸三水合物(HAuCl4·3H2O)、牛血清白蛋白(bovine serum albumin,BSA),美国Sigma有限公司;柠檬酸三钠(C6H5Na3O7),天津光复精细化工研究所;三羟甲基氨基甲烷盐酸盐(Tris-HCl)、AAP、过硫酸铵[(NH4)2S2O8]、高锰酸钾(KMnO4)、乙二胺四乙酸二钠二水合物(Na2EDTA·2H2O),北京鼎国生物技术有限责任公司;ALP标记的山羊抗小鼠IgG(ALP-IgG),北京博奥森生物工程有限公司;N-200,北京索莱宝生物科技有限公司;玉米面样品,当地超市(中国吉林省长春市)。
1.2 仪器与设备
MicroPure UV/UF多功能超纯水系统,赛默飞世尔科技公司;Elx800型全波长酶标仪、SynergyTM 4型多功能酶标仪,BioTek公司;Floviewfv 1000激光共聚焦显微镜,奥林巴斯公司;REF 3590型96孔酶标记板,美国Costar公司。
1.3 实验方法
1.3.1 AuNP@MnO2纳米片层的制备与表征
取100 mL超纯水放入硅化后的锥形瓶中,加入100 μL 250 mmol/L HAuCl4·3H2O溶液,在电磁炉上煮沸;将3.5 mL 1%(质量分数)C6H5Na3O7溶液用0.22 μm孔径滤膜过滤后,一次性迅速加入上述溶液中;持续加热,溶液颜色由淡黄至黑色再至酒红色,酒红色稳定不变后持续加热5 min;室温冷却后,加入超纯水定容至100 mL,放置4 ℃保存,即可得到AuNPs溶液。取20 mL 10 mmol/L KMnO4溶液缓慢滴加至所制得的64 mL AuNPs溶液中;强搅拌1 h后,放入水浴锅(80 ℃)中加热30 min;室温冷却后,放置4 ℃保存,即可得到AuNP@MnO2溶液。利用透射电镜分析N-200、AuNPs和AuNP@MnO2的微观结构,观察并记录样品形态[19-20]。
1.3.2 AuNP@MnO2纳米片紫外-可见光谱分析、N-200荧光光谱分析
将配制的AuNP@MnO2纳米片层溶液备用。室温条件下,混匀静置反应后,在300~700 nm波长范围内,使用全波长酶标仪进行扫描。
将购买的N-200溶液备用。室温条件下,混匀静置,随后使用多功能酶标仪,记录300~600 nm波长范围内的荧光发射光谱与激发光谱。
1.3.3 最适DON-BSA、DON mAb用量的选择
采用棋盘法,每孔加入稀释好的64、32、16、8、4 μg/mL DON-BSA溶液,并在4 ℃下包被过夜。以下反应步骤在37 ℃下进行。用磷酸盐吐温缓冲溶液溶液洗涤3次后,将200 μL 1 mg/mL BSA溶液加入96孔板中并密封0.5 h。洗涤3次之后,将50 μL PBS溶液和50 μL 64、32、16、8、4、0 μg/mL DON mAb溶液。用建立的DON-icELISA进行后续试验,通过酶标仪读取416 nm处的荧光值,计算P/N值(加入ALP-IgG溶液孔荧光值/未加入ALP-IgG溶液孔荧光值),以最大P/N值为筛选标准,重复3次试验。
1.3.4 最适ALP-IgG用量的选择
每孔加入1.25、2.5、5、10、20 μg/mL ALP-IgG溶液100 μL,37 ℃孵育1 h,同时设置一组阴性对照组,进行后续试验。通过酶标仪读取416 nm处的荧光值,计算P/N值,重复3次试验。
1.3.5 最适AAP用量的选择
分别取10 μL ALP-IgG加上孔中,共6孔,每孔分别加入25、50、100、200、400、800 mmol/L AAP溶液80 μL,37 ℃孵育30 min。通过酶标仪读取416 nm处的荧光值,计算P/N值,重复3次试验。
1.3.6 AAP最适孵育时间的选择
加入80 μL AAP后,设定6组孵育时间,分别为37 ℃ 15 min、37 ℃ 30 min、37 ℃ 45 min、37 ℃ 60 min、37 ℃ 75 min和37 ℃ 90 min,同时设置阴性对照组,进行后续试验。通过酶标仪读取416 nm处的荧光值,计算P/N值,重复3次试验。
1.3.7 DON-icELISA方法标准曲线的建立
采用上述优化好的反应条件,进行DON的免疫荧光测定。用于竞争的DON质量浓度分别为0.227 8、0.151 8、0.101 2、0.067 5、0.045 0、0 ng/mL。以DON浓度的对数为横坐标,以抑制率(IC)为纵坐标,建立标准曲线。
本实验以IC10(抑制率10%时检测的DON浓度)作为最低检测限(limit of detection,LOD),检测范围为IC20~IC80。LOD计算如公式(1)所示[21]:
(1)
式中:SD为不加入DON进行竞争测得空白值的标准差;S为所建立标准曲线的斜率。
1.3.8 DON-icELISA方法的准确度检测
采用上述优化好的条件以及DON标准品进行加标回收率测定,标准品加标质量浓度分别设置为0、15、30、60、120、240 pg/mL。以DON标准品质量浓度为横坐标,以本方法结果为纵坐标,进行加标回收相关性比较。
1.3.9 DON-icELISA方法的特异性试验
采用上述优化好的反应条件,分别检测呕吐毒素及其结构类似物3-DON、5-DON、AFB1、FB1、ZEN、T-2和OTA,按照上述优化好的检测方法进行检测,进行3组重复试验。根据公式(2)对1.3.8节部分的检测结果进行了计算,计算结果中的交叉反应率可以进行特异性分析。交叉反应率计算如公式(2)所示:
交叉反应率![]()
(2)
1.3.10 加标回收
采用上述优化好的DON-icELISA的反应条件进行试验,对从中国长春的超市购买的玉米样品进行加标回收。加标浓度分别设置为30、150、270 pg/mL。回收率计算如公式(3)所示:
回收率![]()
(3)
1.3.11 DON-icELISA方法的稳定性测定
寻找3名经专业培训后的试验人员采用上述优化好的条件进行加标回收率测定。加标质量浓度分别设置为20、120、240 pg/mL,进行DON-icELISA方法的稳定性测定。
2 结果与分析
2.1 纳米材料的鉴定
透射电镜(transmission electron microscope,TEM)结果显示:N-200是一种13~15 nm左右,尺寸均匀和分布分散的材料(图1-a)。AuNPs是直径大小约为13 nm的球形纳米材料,其大小均匀、均匀分布,尺寸与N-200相似(图1-b)。AuNP@MnO2是一种直径大小约为40 nm的片层材料,由二氧化锰纳米片均匀包裹在AuNPs周围而形成(图1-c)。紫外-可见光光谱扫描结果如图1-d所示,于520 nm处存在最大吸收峰,AuNPs溶液呈粉红色。AuNP@MnO2在300~450 nm处存在一个较宽的吸收峰(图1-e),溶液呈现棕色。荧光光谱扫描结果显示N-200最大荧光激发波长324 nm,最大荧光发射波长为412 nm(图1-f)。
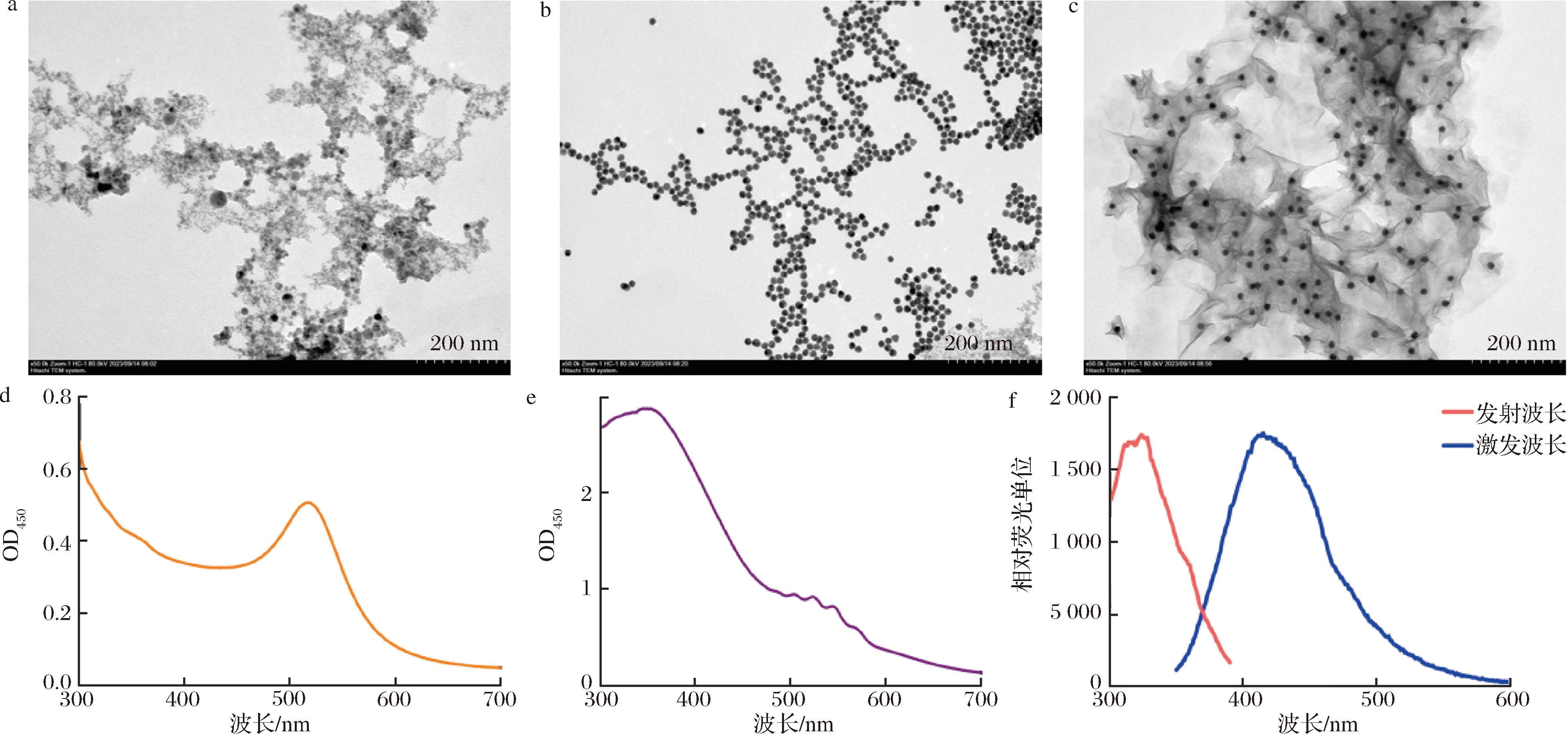
a-N-200的TEM鉴定;b-AuNPs的TEM鉴定;c-AuNP@MnO2的TEM鉴定;d-AuNPs紫外可见光光谱; e-AuNP@MnO2紫外可见光光谱;f-N-200荧光光谱
图1 纳米材料的TEM鉴定(100 k×)及光谱扫描
Fig.1 TEM identification and the UV-Vis spectra of nanomaterials
2.2 最适DON-BSA、DON mAb用量的选择
采用棋盘法进行优化,设置DON-BSA溶液质量浓度为64、32、16、8、4 μg/mL共5个梯度,DONmAb质量溶液浓度为64、32、16、8、4 μg/mL共5个梯度。用建立的免疫荧光传感器进行试验。根据棋盘试验的结果(表1),荧光强度随着DON-BSA和DON mAb浓度的增加而逐渐增加。以最大P/N值为筛选标准,考虑经济节约原则,本实验选择DON-BSA的最佳质量浓度为32 μg/mL,DON mAb的最佳质量浓度是64 μg/mL。
表1 棋盘法确定抗原抗体浓度
Table 1 Determination of antigen antibody concentration using chessboard method
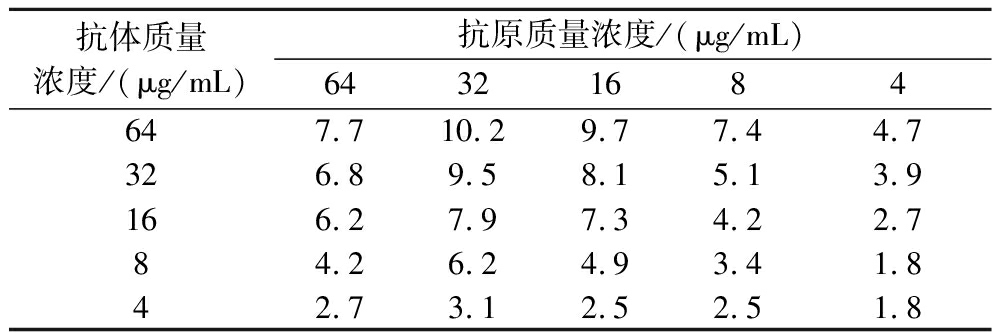
抗体质量浓度/(μg/mL)抗原质量浓度/(μg/mL)64321684647.710.29.77.44.7326.89.58.15.13.9166.27.97.34.22.784.26.24.93.41.842.73.12.52.51.8
2.3 ALP-IgG最适用量的确定
将ALP-IgG浓度倍比稀释以确定ALP-IgG最适用量。随着ALP-IgG质量浓度的增加,AAP转化为AA,使AuNP@MnO2可被AA完全还原为Mn2+,AuNP@MnO2片层材料的分解可使N-200荧光恢复。如图2所示,当ALP-IgG质量浓度为10 μg/mL时,P/N值最大,故选择10 μg/mL为ALP-IgG最佳质量浓度。
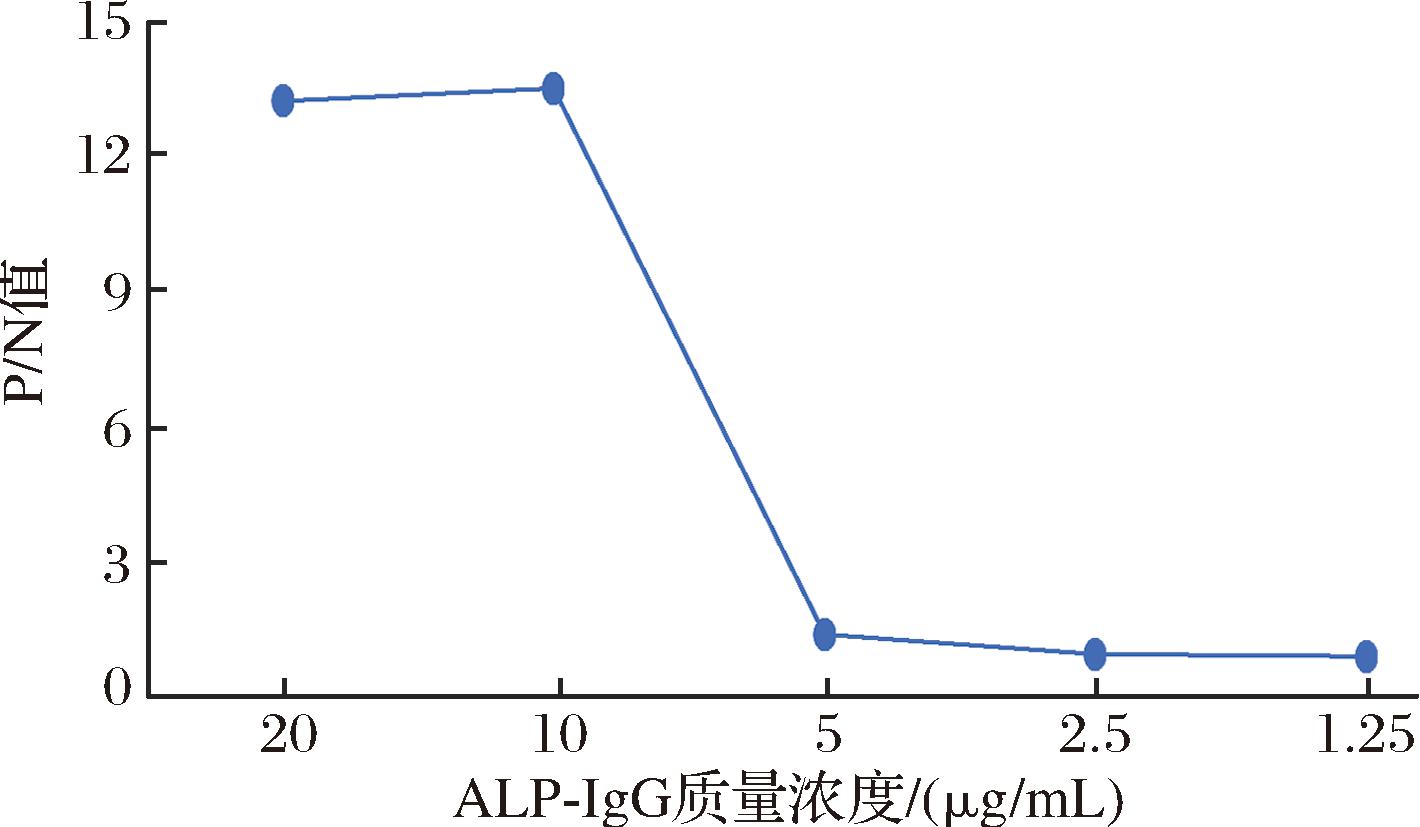
图2 ALP-IgG最佳用量的确定
Fig.2 Selection of ALP-IgG optimum volume
2.4 AAP最适用量的确定
将AAP浓度倍比稀释以确定AAP最适用量。随着AAP浓度的增加,N-200荧光值越大。如图3所示,当AAP浓度为100 mmol/L时,P/N值最大,故选择100 mmol/L为AAP的最佳用量。
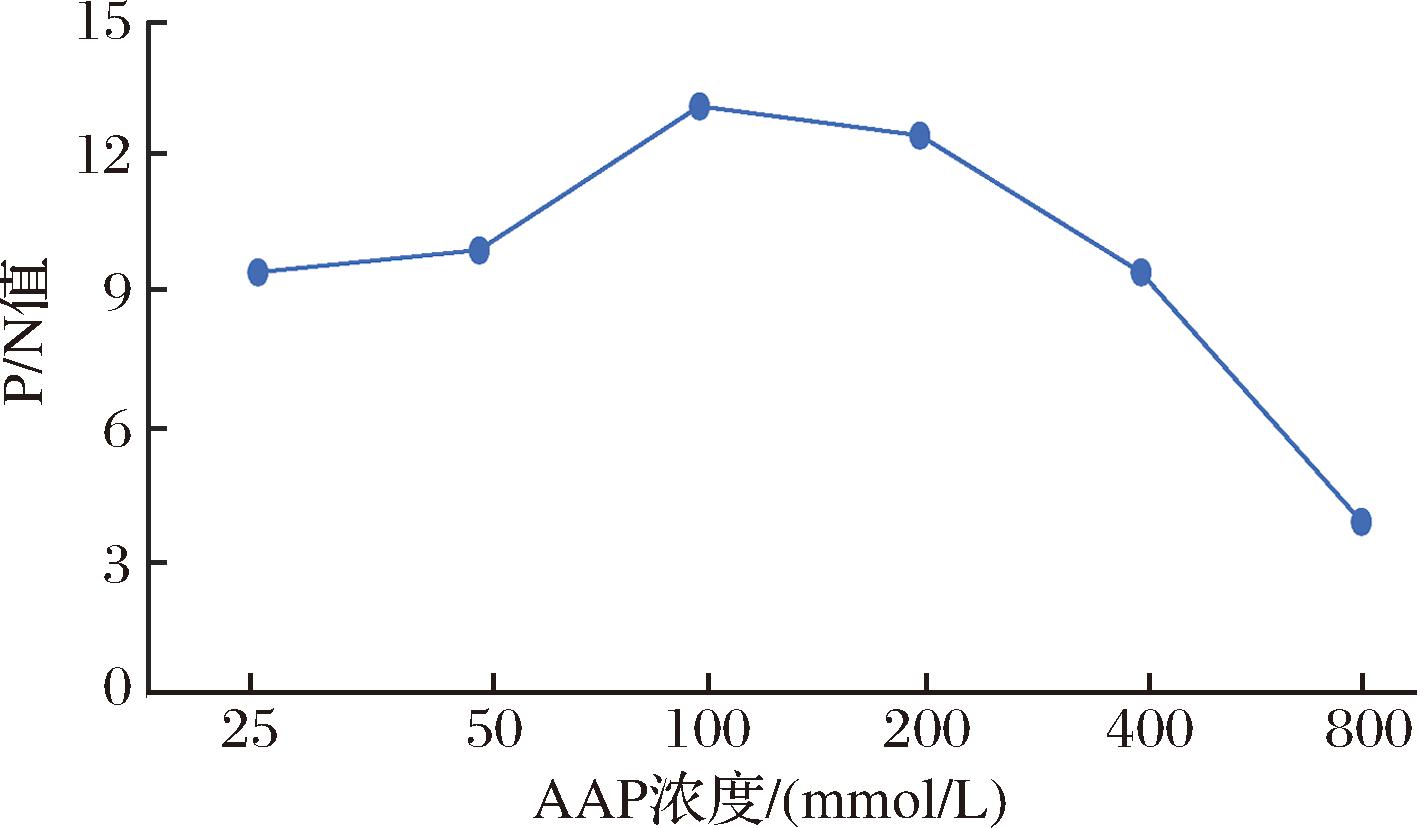
图3 AAP最佳用量的确定
Fig.3 Selection of AAP optimum volume
2.5 AAP最适孵育时间的确定
将AAP分别以37 ℃ 15 min、37 ℃ 30 min、37 ℃ 45 min、37 ℃ 60 min、37 ℃ 75 min和37 ℃ 90 min条件进行孵育,优化AAP孵育时间。当AAP孵育时间为37 ℃ 60 min时(图4),P/N值最大,故选择37 ℃ 60 min为AAP的最佳孵育时间。
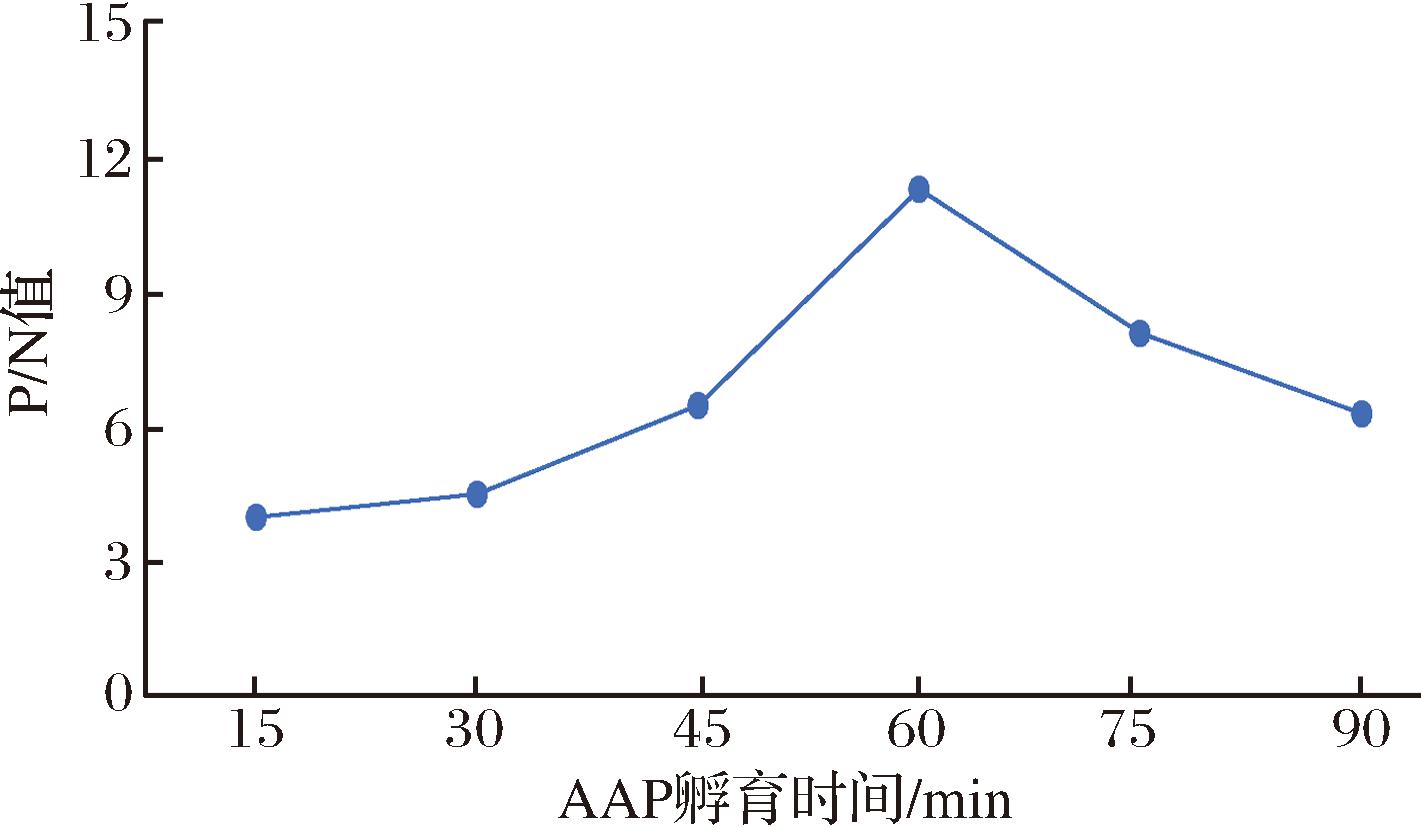
图4 AAP孵育时间的确定
Fig.4 Selection of AAP incubation time
2.6 DON-icELISA方法标准曲线的建立
采用上述优化好的反应条件,进行DON的免疫荧光测定。用于竞争的DON质量浓度分别为0.227 8、0.151 8、0.101 2、0.067 5、0.045 0、0 ng/mL。以DON质量浓度的对数为横坐标,以抑制率为纵坐标,建立标准曲线。如图5所示,线性回归方程为Y=54.116X+110.53(R2=0.990 6)。检测范围(IC20~IC80)为0.021~0.273 ng/mL,LOD为0.013 ng/mL。这表明在不使用复杂仪器的情况下具有高灵敏度。所建立的新方法的灵敏度符合中国、欧盟、美国和粮食及农业组织对DON[6-7]的限制。
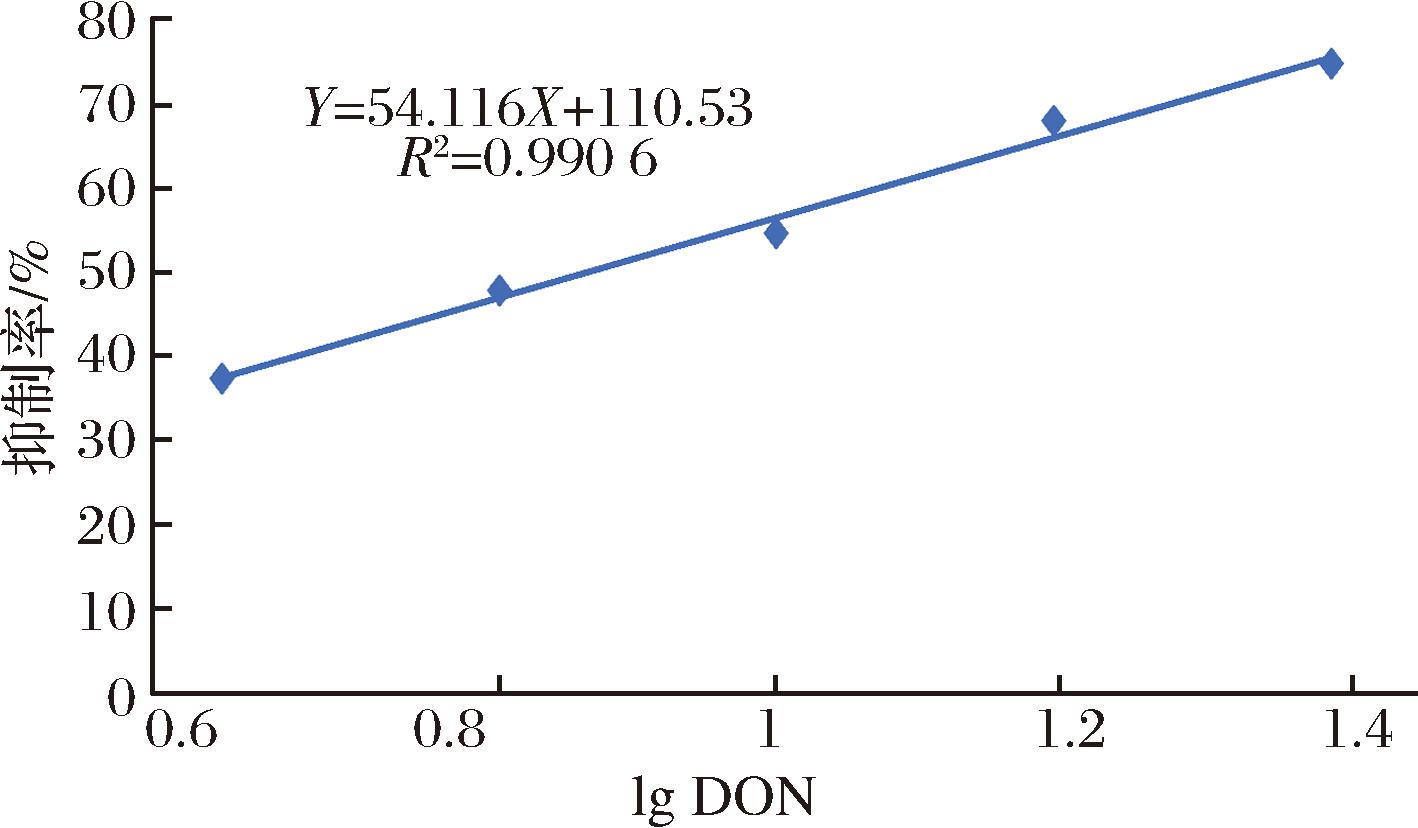
图5 标准曲线的建立
Fig.5 Establishment of standard curve
2.7 DON-icELISA方法准确度检测
采用上述优化好的条件以及DON标准品进行加标回收率测定,标准品加标质量浓度分别设置为0、15、30、60、120、240 pg/mL。以DON标准品质量浓度为横坐标,以本方法结果为纵坐标,建立标准曲线,进行加标回收相关性比较。如图6所示,线性回归方程为Y=0.999 3X+0.534 3(R2=0.999 9),通过线性回归方程显示,该方法准确度较高。
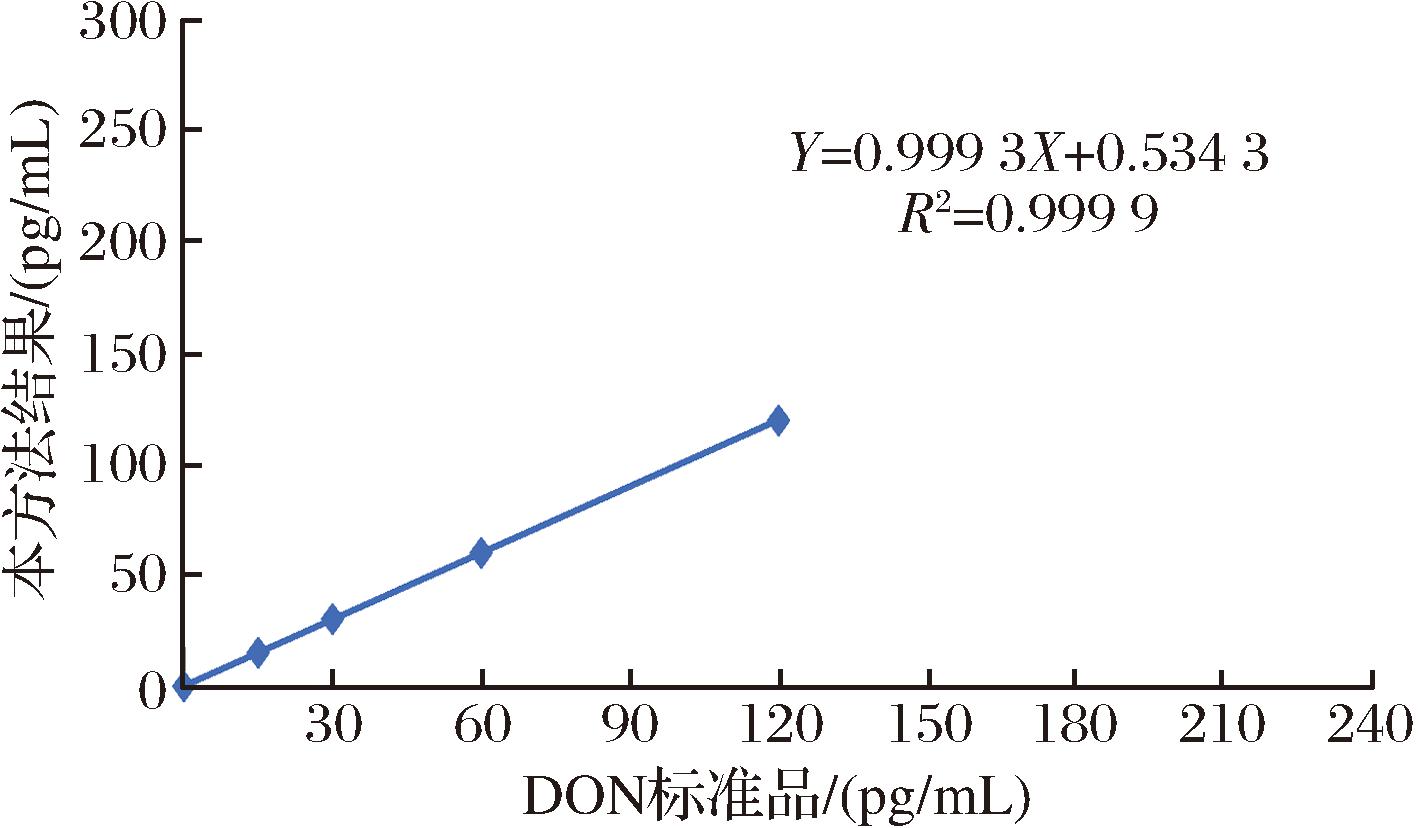
图6 方法准确度检测
Fig.6 Method accuracy detection
2.8 DON-icELISA方法的特异性试验
采用上述优化好的条件对DON及其结构类似物3-DON、5-DON、AFB1、FB1、ZEN、T-2和OTA进行检测。结果如表2所示,通过交叉反应率的计算可知,DON与其他结构类似物均无交叉反应,说明本方法特异性良好。
表2 交叉反应率的测定
Table 2 Determination of cross reaction rate
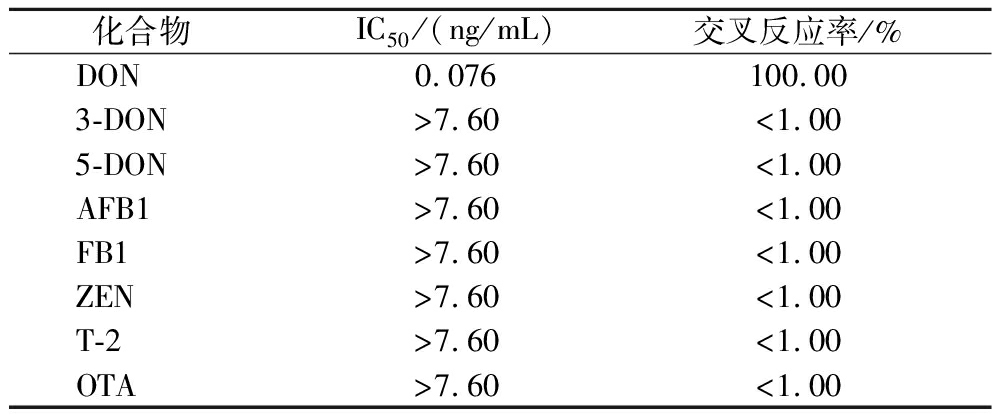
化合物 IC50/(ng/mL)交叉反应率/%DON0.076100.003-DON>7.60<1.005-DON>7.60<1.00AFB1>7.60<1.00FB1>7.60<1.00ZEN>7.60<1.00T-2>7.60<1.00OTA>7.60<1.00
2.9 加标回收率的测定
采用上述优化好的条件对从中国长春的一家粮食采购机构购买的玉米样品进行加标回收率测定。加标质量浓度分别设置为30、150、270 pg/mL。如表3 所示,该方法回收率为94.74%~103.46%,变异系数(coefficient of variance,CV)为5.88%。
表3 用DON-icELISA程序的加标回收
Table 3 Spiked recovery by DON-icELISA

加标回收/(pg/mL)所提出方法的回收率/%CVa/%27099.05±3.713.7515097.34±6.766.9430101.40±7.046.94
注:aCV/%=(标准偏差/平均值)×100。
2.10 DON-icELISA方法的稳定性测定
寻找3名经专业培训后的试验人员采用上述优化好的条件进行加标回收率测定。加标质量浓度分别设置为20、120、240 pg/mL,进行DON-icELISA方法的稳定性测定。如表4所示,变异系数均小于5.00%。
表4 DON-icELISA方法稳定性测定
Table 4 Stability determination by DON-icELISA
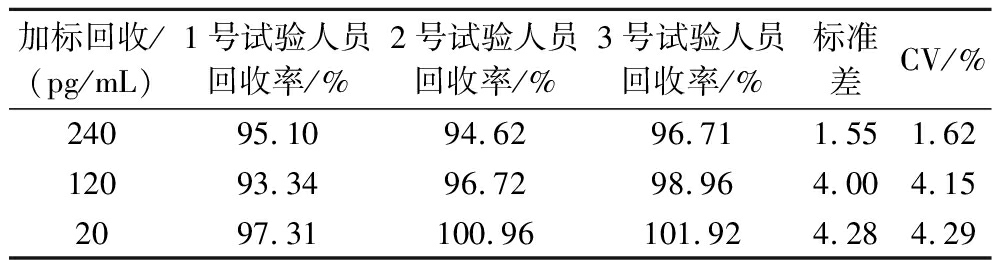
加标回收/(pg/mL)1号试验人员回收率/%2号试验人员回收率/%3号试验人员回收率/%标准差CV/%24095.1094.6296.711.551.6212093.3496.7298.964.004.152097.31100.96101.924.284.29
3 结论与讨论
DON是镰刀菌种产生的真菌毒素之一,属于真菌毒素的毛霉烯家族成员,DON广泛存在于自然界中,易对粮食和饲料造成严重污染,并造成巨大的经济损失。一旦人类和动物摄入被DON污染的食物或饲料,不仅会对养殖业造成巨大的经济损失,还对动物性食品安全及人类健康存在重要威胁。王倩等[22]研究结果显示玉米副产物中DON的检出率可达到100%,说明玉米副产物受霉菌毒素污染严重。丁燕玲等[23]在2015—2020年饲料霉菌毒素污染调查中表明,小麦及麸皮中DON检出率均在90%以上,并指出小麦及副产物易受DON污染。因此寻找一种快速、灵敏、选择性和实用的检测方法,以监测谷类制品中呕吐毒素的污染情况,从而保证食品安全和公共卫生安全。针对DON污染现状,尽管已有较为灵敏的检测方法,如HPLC[24]和GC-MS[25],但是这些检测方法与本研究相比要求专业人员操作、试验仪器昂贵、操作繁琐复杂、耗时长。而薄层色谱法(thin layer chromatography,TLC)是一种已被纳入国家标准(GB 5009.111—2016《食品安全国家标准 食品中脱氧雪腐镰刀菌烯醇及其乙酰化衍生物的测定》)的毒素检测方法,与本研究相比,TLC检测过程中所采用的试剂用量较大,样品前处理略显繁琐,且结果稳定性较差,重复率较低。
ELISA法由于灵敏度高、特异性高以及高通量的优势成为当前推荐的小分子检测方法。近年来,纳米材料由于其易于合成、易于表面修饰、较高的生物相容性、独特的光学、电学、传感和生物化学特性,已被应用于各种免疫传感检测。石墨烯量子点更是近年来在纳米技术中发光物质中备受关注的材料。与其他荧光材料不同,石墨烯量子点的荧光不需要避光,具有稳定性。基于MnO2纳米片的氧化能力和催化活性,MnO2纳米片被广泛用于构建生物传感器。本研究制备的AuNP@MnO2具有较宽的吸收峰(300~450 nm),可作为一种高效的猝灭剂,快速、稳定地猝灭荧光。根据荧光共振能量转移(fluorescence resonance energy transfer,FRET)原理,N-200最大荧光激发光(324 nm)和发射光(416 nm)均落在AuNP@MnO2的吸收光谱中,能高效发生荧光猝灭。
本研究中二氧化锰纳米片制备方法简单,且具有优越的光学特性。AuNP@MnO2可以高效地猝灭N-200的荧光。同时,由于ALP的催化活性高,将ALP引入免疫荧光反应中,ALP可将AAP转化为大量的AA,AA能够高效诱导AuNP@MnO2分解产生Mn2+,AuNP@MnO2片层结构分解,使得N-200荧光恢复。采用酶标仪读取荧光值,从而实现检测信号的量化。所建立的DON-icELISA免疫荧光生物传感器无须避光,用酶标仪即可快速判定结果,且结果稳定,有利于对呕吐毒素的快速筛检。与现有DON免疫荧光检测方法相比,更加快速、高效、稳定、无需避光。但荧光反应时间仍具有局限性,荧光反应时间不可反应过长[26]。基于此项研究,可以寻求一种荧光反应时间过长时,反应物质更为稳定的方法。由于荧光值可以直接用酶标仪读取、无需避光,因此所提出的免疫荧光传感器读取试验结果简单易行,检测时间较快,成本效益较高且显示出较高的灵敏度。
本研究建立的DON-icELISA方法线性回归方程为Y=54.116X+110.53(R2=0.990 6)。检测范围为0.021~0.273 ng/mL,检测限为0.013 ng/mL。与其他DON检测方法相比,所提出的免疫荧光传感器更具灵敏度。ZHAO等[27]基于β-CD@AgNP表面增强拉曼光谱(Raman spectra,SERS)的传感器尽管显示出较大的检测范围,但是SERS会受到样品条件和不稳定性的影响。此外,所提出的免疫荧光传感器的LOD也低于SUNDAY等[28]所提出的基于AuNp/G/PhNO2的生物传感器,该方法LOD是本研究LOD的23 076倍。FENG等[29]提出的基于OIP-v2的生物传感器的LOD是本研究的266倍,与纳入GB 5009.111—2016《食品安全国家标准 食品中脱氧雪腐镰刀菌烯醇及其乙酰化衍生物的测定》的TLC呕吐毒素检测方法方法相比,该方法LOD是本研究LOD的770倍。本研究特异性高,与DON结构类似物3-DON、5-DON、AFB1、FB1、ZEN、T-2和OTA均无交叉反应。另外,所建立的方法回收率为94.74%~103.46%,变异系数为5.88%,证明本方法稳定性良好。通过3名不同专业试验人员进行加标回收试验,变异系数均小于5.00%,证明该方法稳定性好。因此,本研究建立了一种快速、高效、稳定、无需避光的检测DON的免疫荧光传感器,为食品、饲料中DON筛检提供了有意义的参考方法。
[1] 章铜, 沈央红, 张雯, 等.基于普鲁士蓝纳米粒子的免疫层析法检测小麦中的呕吐毒素[J].食品与发酵工业, 2024, 50(4):286-293.ZHANG T, SHEN Y H, ZHANG W, et al.Based on Prussian blue nanoparticles for immunochromatographic detection of deoxynivalenol in wheat[J].Food and Fermentation Industries, 2024, 50(4):286-293.
[2] NOTENBOOM S, HOOGENVEEN R T, ZEILMAKER M J, et al.Development of a generic PBK model for human biomonitoring with an application to deoxynivalenol[J].Toxins, 2023, 15(9):569.
[3] YUE J M, GUO D W, GAO X G, et al.Deoxynivalenol (vomitoxin)-induced anorexia is induced by the release of intestinal hormones in mice[J].Toxins, 2021, 13(8):512.
[4] 苗银萍, 赵光升, 赵林萍, 等.呕吐毒素荧光免疫层析检测卡在谷物产品快速检测中的应用[J].农产品质量与安全, 2023(5):74-78.MIAO Y P, ZHAO G S, ZHAO L P, et al.Application of fluorescence immunochromatographic detection card for vomitoxin in rapid detection of grain products[J].Quality and Safety of Agro-Products, 2023(5):74-78.
[5] GEREZ J R, DESTO S S, BRACARENSE A P F R L.Deoxynivalenol induces toxic effects in the ovaries of pigs:An ex vivo approach[J].Theriogenology, 2017, 90:94-100.
[6] SANEI S, KASGARI M B, ABEDINZADEH F, et al.Microcapsules loaded with date seed extract and its inhibitory potential to modulate the toxic effects of mycotoxins in mice received mold-contaminated diet[J].Environmental Science and Pollution Research International, 2023, 30(20):58654-58662.
[7] 王振芳, 王平东, 邓庆, 等.高灵敏度呕吐毒素时间分辨荧光快速定量检测卡的研发和应用[J].粮食加工, 2024, 49(1):102-107.WANG Z F, WANG P D, DENG Q, et al.Development and application of high sensitivity time-resolved fluorescent rapid quantitative detection card for deoxynivalenol[J].Grain Processing, 2024, 49(1):102-107.
[8] SUN Y H, SONG Y Q, LONG M, et al.Immunotoxicity of three environmental mycotoxins and their risks of increasing pathogen infections[J].Toxins, 2023, 15(3):187.
[9] ISLAM M R, ROH Y S, KIM J, et al.Differential immune modulation by deoxynivalenol (vomitoxin) in mice[J].Toxicology Letters, 2013, 221(2):152-163.
[10] 王欣, 刘硕, 马骏, 等.以金黄色葡萄球菌重组IsdB137-361为抗原的牛血清抗体间接ELISA检测方法建立[J].黑龙江八一农垦大学学报, 2022, 34(4):46-52.WANG X, LIU S, MA J, et al.Establishment of an indirect ELISA for detection of antibody in bovine serum using IsdB137-361 of Staphylococcus aureus as antigen[J].Journal of Heilongjiang Bayi Agricultural University, 2022, 34(4):46-52.
[11] ISHIDA T, MURAYAMA T, TAKETOSHI A, et al.Importance of size and contact structure of gold nanoparticles for the genesis of unique catalytic processes[J].Chemical Reviews, 2020, 120(2):464-525.
[12] SHI Z Z, LI Y P, WU X S, et al.Graphdiyne chelated AuNPs for ultrasensitive electrochemical detection of tyrosine[J].Chemical Communications, 2023, 59(91):13647-13650.
[13] LE N, ZHANG M, KIM K.Quantum dots and their interaction with biological systems[J].International Journal of Molecular Sciences, 2022, 23(18):10763.
[14] HENNA T K, PRAMOD K.Graphene quantum dots redefine nanobiomedicine[J].Materials Science and Engineering:C, 2020, 110:110651.
[15] ZHAI W Y, WANG C X, YU P, et al.Single-layer MnO2 nanosheets suppressed fluorescence of 7-hydroxycoumarin:Mechanistic study and application for sensitive sensing of ascorbic acid in vivo[J].Analytical Chemistry, 2014, 86(24):12206-12213.
[16] LI W, CAO Z W, LIU R, et al.AuNPs as an important inorganic nanoparticle applied in drug carrier systems[J].Artificial Cells, Nanomedicine, and Biotechnology, 2019, 47(1):4222-4233.
[17] BORKER S, POKHARKAR V.Engineering of pectin-capped gold nanoparticles for delivery of doxorubicin to hepatocarcinoma cells:An insight into mechanism of cellular uptake[J].Artificial Cells, Nanomedicine, and Biotechnology, 2018, 46(sup2):826-835.
[18] CHEN X Y, HAN W W, ZHAO X, et al.Epirubicin-loaded marine carrageenan oligosaccharide capped gold nanoparticle system for pH-triggered anticancer drug release[J].Scientific Reports, 2019, 9(1):6754.
[19] LI C Y, CHOI P G, MASUDA Y.Highly sensitive and selective gas sensors based on NiO/MnO2@NiO nanosheets to detect allyl mercaptan gas released by humans under psychological stress[J].Advanced Science, 2022, 9(27):e2202442.
[20] ZHA Y H, LU S Y, HU P, et al.Dual-modal immunosensor with functionalized gold nanoparticles for ultrasensitive detection of chloroacetamide herbicides[J].ACS Applied Materials &Interfaces, 2021, 13(5):6091-6098.
[21] XU X, YING Y B, LI Y B.One-step and label-free detection of alpha-fetoprotein based on aggregation of gold nanorods[J].Sensors and Actuators B:Chemical, 2012,175:194-200.
[22] 王倩, 谢全喜, 侯楠楠, 等.2020年全国部分地区饲料及原料霉菌毒素污染状况调查[J].广东饲料, 2021, 30(10):16-19.WANG Q, XIE Q X, HOU N N, et al.Investigation on mycotoxin pollution of feed in some areas of China in 2020[J].Guangdong Feed, 2021, 30(10):16-19.
[23] 丁燕玲, 李孟聪, 钟名琴, 等.2015—2020年国内饲料霉菌毒素污染调查报告统计分析[J].中国动物检疫, 2021, 38(3):29-36.DING Y L, LI M C, ZHONG M Q, et al. Statistical analysis on the investigation reports concerning mycotoxin contamination in animal feed in China during 2015 to 2020[J]. China Animal Health Inspection, 2021, 38(3):29-36.
[24] 张正炜, 成玮, 沈慧梅, 等.小麦粉中脱氧雪腐镰刀菌烯醇(DON)毒素的气相色谱法检测及毒素污染去除分析[J].农药科学与管理, 2018, 39(4):33-39.ZHANG Z W, CHENG W, SHEN H M, et al.Determination of deoxynivalenol (DON) toxin in wheat flour by gas chromatography and analysis of toxin pollution removal[J].Pesticide Science and Administration, 2018, 39(4):33-39.
[25] 曾运婷, 李再新.小麦中呕吐毒素检测方法的研究进展[J].广东化工, 2023, 50(21):142-144.ZENG Y T, LI Z X.Review on detection methods for vomiting toxins in wheat[J].Guangdong Chemical Industry, 2023, 50(21):142-144.
[26] 顾雨熹, 马志, 唐颜苹, 等.基于超导体包被的免疫荧光快检试纸法同时测定玉米中3种毒素的适用性研究[J].粮油食品科技, 2023, 31(2):137-145.GU Y X, MA Z, TANG Y P, et al.Study on the applicability of simultaneous determination of three mycotoxin in maize by superconductor coated immunofluorescence rapid detection[J].Science and Technology of Cereals, Oils and Foods, 2023, 31(2):137-145.
[27] ZHAO X D, SHEN H J, HUO B Y, et al.A novel bionic magnetic SERS aptasensor for the ultrasensitive detection of Deoxynivalenol based on “dual antennae” nano-silver[J].Biosensors and Bioelectronics, 2022, 211:114383.
[28] SUNDAY C E, MASIKINI M, WILSON L, et al.Application on gold nanoparticles-dotted 4-nitrophenylazo graphene in a label-free impedimetric deoxynivalenol immunosensor[J].Sensors, 2015, 15(2):3854-3871.
[29] FENG J K, XUE Y, WANG X W, et al.Sensitive, simultaneous and quantitative detection of deoxynivalenol and fumonisin B1 in the water environment using lateral flow immunoassay integrated with smartphone[J].Science of the Total Environment, 2022, 834:155354.