食品是否安全对民众身体健康造成直接影响,而真菌毒素污染则是导致食品污染的主要因素之一,其中由黄曲霉(Aspergillus flavus)、寄生曲霉(Aspergillus parasiticus)、集蜂曲霉(Aspergillus nonius)[1]等真菌皆可产生极具致癌、致病性的次级代谢产物-黄曲霉毒素,黄曲霉毒素B1作为最常见的黄曲霉毒素,其毒性为剧毒药品氰化钾 10 倍,约为等量砒霜毒性的 68 倍,且黄曲霉和寄生曲霉为常见黄曲霉毒素产生菌[2],在全球玉米、花生、大豆等粮油农作物中存在广泛污染可能性[3-4]。粮食收购贮藏过程中,目前大多针对黄曲霉毒素超标进行检测排查[5-6],检测关口相对滞后,一旦毒素超标造成巨大浪费。在加工贮藏前及早发现隐藏在谷物中的黄曲霉,针对产毒真菌的及时检测,能够提早发现污染风险实施防控,减损增质[7]。
如今,酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)[8-9]、高效液相色谱法[10],可用于黄曲霉毒素检测,但由于ELISA方法对样品和实验操作环境要求高,检测试剂昂贵,其在粮食现场检测的应用具有很大局限性,应用并不广泛。高效液相色谱法,检测仪器不菲,并且耗时长,成本高,更适用于疑似被污染食品进行检测[11]。另一类最为常用的微生物快速检测方法是以聚合酶链式反应(PCR)[12]为主的核酸检测方法,是针对生物危害的常见快速检测方法,采用琼脂糖凝胶电泳法和荧光探针法进行判断是否有目标菌体存在,前者依赖热循环温度控制的PCR仪,操作繁琐,容易发生交叉污染,且特异性较低;后者则需要依赖昂贵的荧光修饰探针和实时荧光定量PCR仪,成本高昂,两者均难以在基层实验室普及应用,在现场检测方面具有很强局限性。在2000年日本学者NOTOMI首次提出环介导等温扩增技术(loop-mediated isothermal amplification, LAMP),是一种不依赖专业设备、适用于现场和基层的核酸扩增方法[13-14]。该方法采用的Bst DNA聚合酶(Bst DNA polymerase large fragment)具有较强链置换活性,并且通过针对目标模板的6个区域设计4~6条特异性引物,可在短时间(60 min内)、恒温(60 ℃)条件下1 h内实现109~1010倍的核酸扩增[15-17]。目前已在食品安全、临床诊断与法医鉴定等方面得到了广泛应用,但基于 LAMP 技术的粮食产毒真菌检测的相关研究尚不多见。
黄曲霉毒素(aflatoxin, AF)生物合成过程非常复杂,涉及 23 种酶促反应以及 30 种不同基因,目前已经有 20 多种基因被发现并被确定结构[18-20],并非所有黄曲霉菌均产生黄曲霉毒素,参考SN/T 2582—2010 《产黄曲霉毒素真菌PCR检测方法》,当aflR、omt-1、ver-1共存时可被判定为产黄曲霉毒素真菌,其中aflR是生物合成过程中最主要的调节基因,是其他相关AF合成基因可以表达的前提,并可对ver-1、omt-1结构基因的转录起到激活作用,同时可编码具有锌指结构的分子质量为47 ku的DNA结合蛋白(AFLR),aflR的中断也会造成其他AF合成相关基因无法表达[21];ver-1基因的表达产物在AF合成过程中催化杂色曲霉素A转变为杂色曲霉素,是一种更具毒性的中间产物,此过程为至少需要5个反应步骤的复杂过程[22];omt-1基因编码曲霉素转甲氨基酶,通过编码一个特异性的DNA结合蛋白,进而活化生物合成途径[23-25]。更有文献表明,通过精油处理,黄曲霉毒素降低,经PCR检测ver-1、omt-1、aflR 基因表达显著下调[26-28]。上述3种基因在AF合成过程中缺一不可[9]。aflR是菌株产 AF 的能力直接相关的基因,ver-1、omt-1这2种结构基因所表达的 AFLM、AFLP蛋白分别在毒素合成中后期起着关键作用,毒素合成含量高低与这2种基因相关[29]。在现有研究表明,常见的产AF霉菌,如黄曲霉,寄生曲霉均含有aflR、omt-1、ver-1这3种基因[30],因此针对黄曲霉毒素合成关键调控基因aflR、omt-1、ver-1通过生物信息学手段设计LAMP引物,同时对AMP检测体系以及反应条件进行优化,建立具有强灵敏度、高特异性、快速高效的黄曲霉毒素产毒菌的LAMP检测方法。
本研究针对黄曲霉毒素合成关键调控基因aflR、omt-1、ver-1通过生物信息学手段设计 LAMP 引物,通过对产毒真菌的检测,达到未发生毒素污染时便检出产黄曲霉毒素真菌的目的[31],同时优化反应体系,建立更为灵敏特异、快速高效的黄曲霉毒素产生菌检测方法。LAMP 反应灵敏度高,生成产物浓度大,若通过开盖进行琼脂糖凝胶电泳判断 LAMP 反应是否发生,则会造成气溶胶污染[17],因此本文选择无需开盖的实时荧光LAMP方法,并通过荧光 LAMP 曲线以及指示剂颜色变化,代替传统电泳判读结果,样品无需开盖,能够有效避免气溶胶污染而造成假阳性反应的产生,具有灵敏度高、特异性强、仪器设备适配范围广等优点并可应用于用于现场检测。
1 材料与方法
1.1 材料与试剂
10×LAMP 缓冲溶液;Bst DNA 聚合酶,南京诺唯赞生物科技有限公司;引物(ULTRAPAGE级别),上海生工生物有限公司。
黄绿青霉(Penicillium citreo-viride Biourge)、指状青霉(Penicillium digitatum)、直立毛霉(Mucor erectus Bainier)、米根霉(Rhizopus oryzae)、黑曲霉(Aspergillus niger)、禾谷镰刀菌(Fusarium graminis)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、稻帚枝霉菌(Sarocladium oryzae)、寄生曲霉(Aspergillus parasiticus Speare)均为实验室贮藏标准菌株。黄曲霉菌(Aspergillus flavus)为实验室贮藏菌株。
1.2 仪器与设备
H1850小型高速离心机,日本HITACHI公司;S1010E掌上离心机,SCILOGEX公司;A28134实时荧光定量PCR仪,美国QuantStudio5。
1.3 实验方法
1.3.1 DNA模板制备
实验所用全部菌体DNA模板皆遵循Plant DNA Isolation Mini Kit-BOX2 试剂盒说明书进行提取。
1.3.2 引物设计
针对柄曲霉转甲基酶基因omt-1、杂色曲霉素A脱氢酶基因ver-1以及蛋白活化基因aflR(此基因与寄生曲霉中apa-2为同源基因)这3种目的基因进行BLAST比对分析,选择保守性特异性较好片段,并采用Primer Explorer V5软件进行引物设计,并通过荧光LAMP反应的起峰时间Ct值进行引物筛选(表1)。
表1 产黄曲霉毒素目的基因及其LAMP引物
Table 1 Aflatoxins genes and their LAMP primers

目的基因引物名称引物(5′-3′)F3-133GCCCCGAAGACCATAAACTCB3-133TGGCAGCAGCTAGACAGGFIP-133CGCAGGTACGCACGATCTCCAAGTGAGAGAACTCCCTCCTBIP-133CCGCATCGGCTCCTTGGTTCGCTATCGAGATGGGACAACGF3-47TTCAGAGCAGGTAAAGCGTT对柄曲霉转甲基酶基因omt-1B3-47CGCTATCGAGATGGGACAACFIP-47TCGTTGGAGGAGGGAGTTCTCTAGACGAAGAGCCCCGAAGBIP-47CACAGGCCTGGGAGATCGTGCTTAGGAGCCAAGGAACCGF3-4TTCAGAGCAGGTAAAGCGTTB3-4CGCTATCGAGATGGGACAACFIP-4TCGTTGGAGGAGGGAGTTCTCTAGACGAAGAGCCCCGAAGBIP-4CACAGGCCTGGGAGATCGTGCTTAGGAGCCAAGGAACCGF3-133TGCGCCATTTTGGCTACCB3-133GAGCTGGTCAGGATAATCCGFIP-133TCTGGGGTCACGTCTTTCAGGTGACATTGTGTCATCGAACGCBIP-133GAGTTTGACCGGGTCTTCCGGCGCATATGGCGATAGGCCF3-159TGTCATCGAACGCTGGAATT杂色曲霉素A脱氢酶基因ver-1B3-159GCTTGGGTACCCCTTTGACFIP-159AGAACTGGCCACGAGTGTTGACGAAAGACGTGACCCCAGAAGBIP-159GGCCTATCGCCATATGCGGG-GCAAGCGGTGTTAGAGCTF3-218GTTTGACCGGGTCTTCCGB3-218TTGTCTCCGCAGTCAATGGFIP-218CCTCCTTCCCGCATATGGCGCAACACTCGTGGCCAGTTBIP-218CCGCTTGCGTCAAAGGGGTATGCAGCGAACAAAGGTGTCF3-40TCCGTTCCTCCCAGACTCB3-40CCTGGCTGAAGGAAGACTCTFIP-40CCGGTTTCTCCTTGGTGCATCGCGAAAGCTCCGGGATAGCBIP-40ACATGGTCTCCAAGCGGATGGTGATGGTCGCCGAGTTGAAF3-954CACCCAGTGTACCTCAACG蛋白活化基因aflRB3-954TCACCAGCGACTGGACTCFIP-954ACGCGCTCTTCCGTCAGACACCAACAGTGGCAGCTGTAGBIP-954ATGATGGGCGAGGATTGTGTGGGGTGCAGTTCACTCAGAACAF3-73CTCCGGGATAGCTGTACGAB3-73CCTGGCTGAAGGAAGACTCTFIP-73GTTCGATACACCGAGCACAGGCGTTGTGCCAGCTCAAAAGTGBIP-73ACATGGTCTCCAAGCGGATGGTGATGGTCGCCGAGTTGAA
1.3.3 LAMP 引物的验证及反应体系的优化
LAMP基础反应体系为:10×LAMP 缓冲溶液(含20 mmol/L MgSO4)2.5 μL;dNTP Mix(10 mol/L)3.5 μL;内引物(FIP/BIP,10 μmol/L)4 μL;外引物(F3/B3,10 μmol/L)0.5 μL;Bst DNA 聚合酶(8 U/μL)1 μL;EVA Green(20×)1 μL,及 DNA 模板1 μL,观察其显色性时将EVA Green替换为羟基萘酚蓝,按顺序依次添加,最后使用灭菌水将体系补齐至25 μL。将配制完成的 LAMP 体系置于60 ℃ 进行 1 h恒温加热,并应用实时荧光PCR仪监测反应过程。
在基础反应体系的基础上对部分条件进行优化:甜菜碱终浓度 0、0.4、0.6、0.8、1.0、1.2 mol/L;Mg2+终浓度 2、3、4、5、6、7、8 mmol/L;dNTP终浓度0.8、1.0、1.2、1.4、1.6、1.8、2.0、2.2 mol/L;内外引物比1∶1、2∶1、3∶1、4∶1、5∶1、6∶1、7∶1、8∶1;反应温度分别为60、61、62、63、64、65 ℃,根据优化的结果确定各组分的最优反应体系。
1.3.4 LAMP检测DNA灵敏度
本试验将10.0 ng/μL黄曲霉菌DNA用灭菌的纯净水进行十倍梯度稀释至1.0×10-6 ng/μL,应用于本研究所建立的LAMP体系进行灵敏度检测。扩增完成后,通过扩增曲线,得出DNA最低检出限。
1.3.5 精密度实验
以最高反应浓度10.0 ng/μL和3组引物分别可产生反应的最低检测限浓度的黄曲霉菌DNA为反应模板,各重复30次,计算每个Ct值平均值,标准偏差,进行变异系数(coefficient of variance,CV)的计算,以确定该方法的重复性和精密度。
1.3.6 特异性实验
采用上述已经优化后的LAMP反应体系及条件,进行通用性和特异性验证,将引物与表2所列举的13株菌株所提取的DNA模板进行结合检测,其中 ZYX-3、ZYX-6、AS3.124为黄曲霉毒素产生菌,其余菌株不产黄曲霉毒素。
表2 实验所用菌种
Table 2 Species used in the experiment
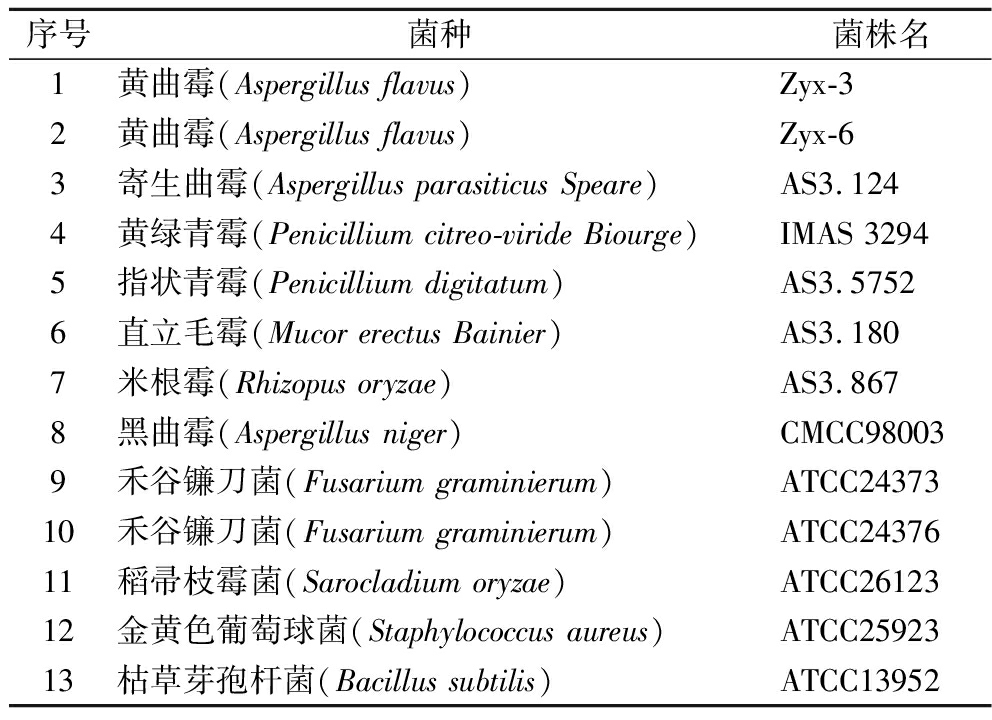
序号菌种菌株名1黄曲霉(Aspergillus flavus)Zyx-32黄曲霉(Aspergillus flavus)Zyx-63寄生曲霉(Aspergillus parasiticus Speare)AS3.1244黄绿青霉(Penicillium citreo-viride Biourge)IMAS 32945指状青霉(Penicillium digitatum)AS3.57526直立毛霉(Mucor erectus Bainier)AS3.1807米根霉(Rhizopus oryzae)AS3.8678黑曲霉(Aspergillus niger)CMCC980039禾谷镰刀菌(Fusarium graminierum)ATCC2437310禾谷镰刀菌(Fusarium graminierum)ATCC2437611稻帚枝霉菌(Sarocladium oryzae)ATCC2612312金黄色葡萄球菌(Staphylococcus aureus)ATCC2592313枯草芽孢杆菌(Bacillus subtilis)ATCC13952
1.3.7 抗干扰性能评价
为了保证对产黄曲霉毒素真菌在复杂环境下检测的准确性,同时进行了3组实验来验证该技术的抗干扰能力,在反应体系完全相同的情况下,第一组实验中以黄曲霉菌及寄生曲霉菌的混合DNA为阳性模板作为对照组;第二组实验中将阳性模板、黑曲霉、毛霉、青霉、禾谷镰刀菌和根霉等共6种真菌的基因组DNA稀释到相同浓度按1∶1∶1∶1∶1∶1的比例混合均匀作为模板;第三组实验将黑曲霉、毛霉、青霉、禾谷镰刀菌和根霉和灭菌水按1∶1∶1∶1∶1∶1的比例混匀作为靶标,同时放入实时荧光PCR仪扩增仪中进行LAMP扩增反应。
2 结果与分析
2.1 引物筛选
将所设计的所有引物按照 LAMP 基础体系进行荧光 LAMP 反应,分别以产毒黄曲霉菌 DNA 为阳性模板,无菌水作为阴性对照,通过 Ct 值的大小对引物扩增能力进行验证。结果如图1所示,对于这3种目的基因来说,aflR-73、omt-1-47、ver-1-218起峰时间最早,并且空白不起峰,没有因引物的二聚体而造成的假阳性问题。
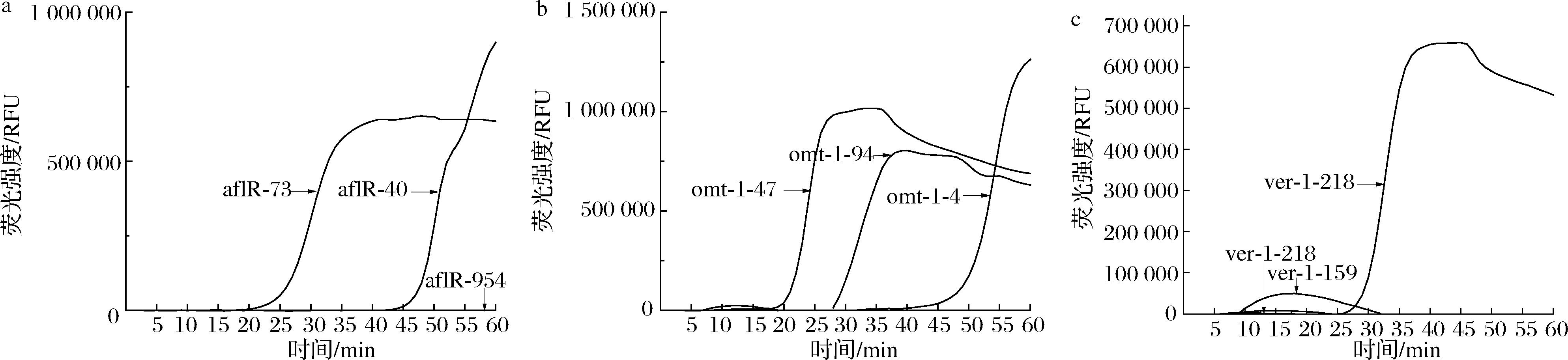
a-aflR;b-omt-1;c-ver-1
图1 实时荧光LAMP引物筛选
Fig.1 Real-time fluorescent LAMP primer screening
2.2 LAMP反应体系的优化
2.2.1 甜菜碱浓度的优化
通过对反应体系中各个单因素进行优化筛选,可获得最佳LAMP反应体系,结果显示甜菜碱浓度为0时Ct值最小,起峰时间最早,随甜菜碱浓度增加起峰时间递增,说明甜菜碱的添加会干扰并抑制LAMP反应,所以实时荧光LAMP中甜菜碱浓度最佳为0 mol/L(图2)。
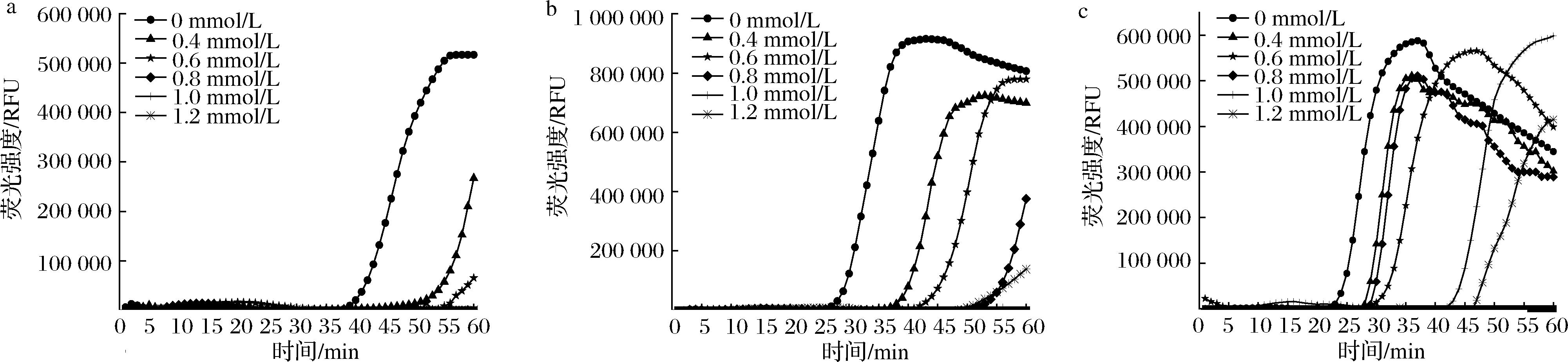
a-aflR-73;b-omt-1-47;c-ver-1-218
图2 实时荧光LAMP体系中甜菜碱浓度的优化
Fig.2 Betaine concentration in the real-time fluorescent LAMP system
2.2.2 Mg2+浓度优化
如图3所示,在Mg2+浓度优化中对于目的基因aflR、omt-1、ver-1的引物来说最优浓度分别为6、6、5 mmol/L;在2、3 mmol/L时不发生LAMP反应,超过6 mmol/L普遍扩增效率逐步递减,抑制反应,Mg2+浓度过低过高均不利于反应的进行,使荧光曲线出峰时间变长。

a-aflR-73;b-omt-1-47;c-ver-1-218
图3 实时荧光LAMP体系中Mg2+浓度的优化
Fig.3 Mg2+ concentration in the real-time fluorescent LAMP system
2.2.3 dNTPs浓度优化
如图4所示,在dNTPs浓度筛选中,对于目的基因aflR、ver-1所设计的引物1.4 mmol/L可达到最大扩增效率,起峰时间最早,Ct值最小,并且达到最大荧光强度;对于omt-1基因所筛选的引物来说dNTPs在1.6 mmol/L时起峰最早,在1.4 mmol/L荧光强度最大,此体系的建立会应用于现场检测,相比荧光强度,起峰时间早,反应更迅速,更有利于现场检测的高效判断,所以对于omt-1引物,选择1.6 mmol/L为最优浓度。
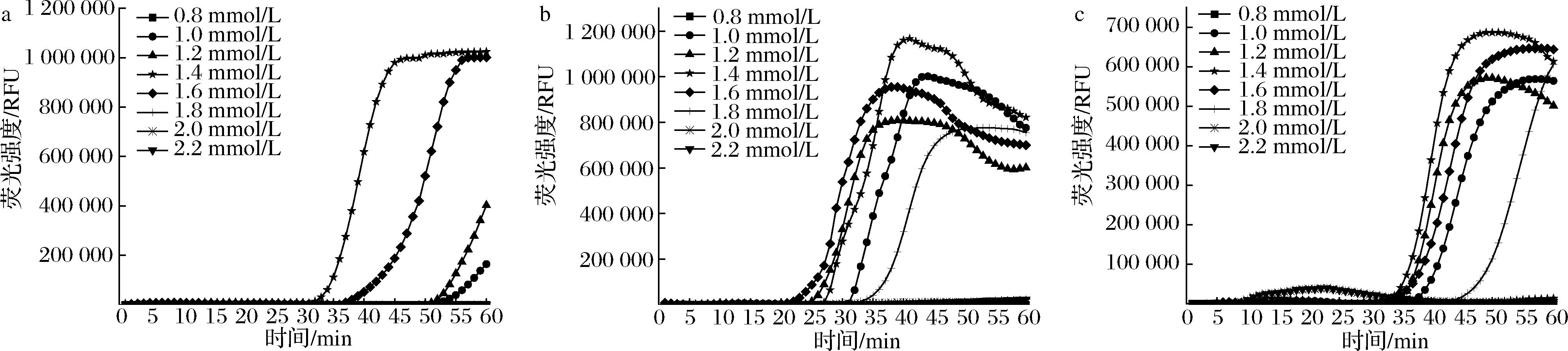
a-aflR-73;b-omt-1-47;c-ver-1-218
图4 实时荧光LAMP体系中dNTPs浓度的优化
Fig.4 dNTPs concentration in the real-time fluorescent LAMP system
2.2.4 内外引物比优化
如图5所示,在内外引物比中,引物的比例对环介导等温扩增效率有所影响,aflR-73,omt-1-47在内外引物比为8∶1时反应体系效率较高,对于ver-1-218内外引物比7∶1、8∶1时起峰时间相差不大,均在27 min左右,荧光强度开始大幅度增大,同时增长曲线斜率增强,在45 min达到最大值。因此aflR-73、omt-1-47、ver-1-218最优内外引物比为8∶1、7∶1、7∶1。
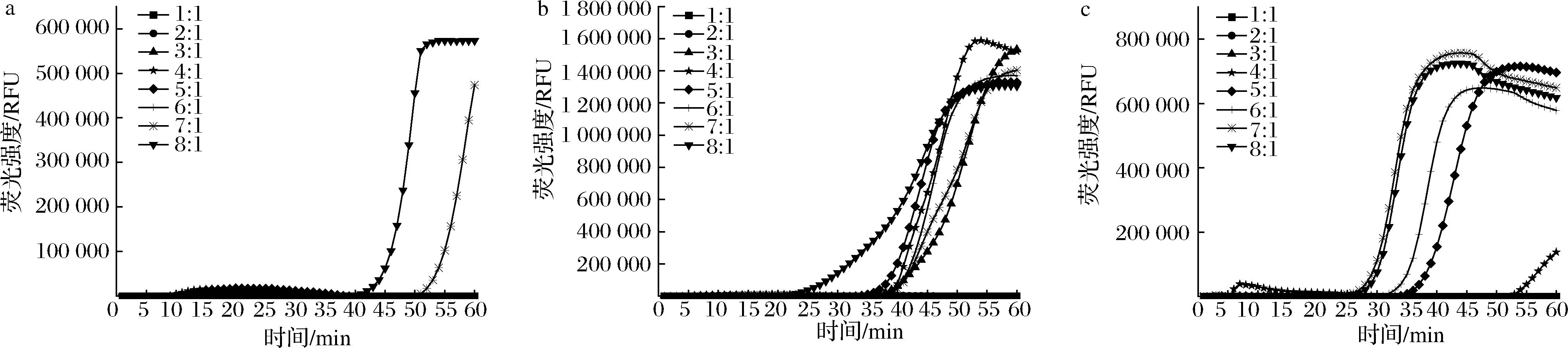
a-aflR-73;b-omt-1-47;c-ver-1-218
图5 实时荧光LAMP体系中内外引物比的优化
Fig.5 Inner and outer primer ratios in the real-time fluorescent LAMP system
2.2.5 反应温度的筛选
Bst DNA聚合酶最适温度通常在60~65 ℃,本实验中分别选取60、61、62、63、64及65 ℃ 6个温度,进行最适温度筛选,实验结果如图6所示,对于aflR-73、omt-1-47、ver-1-218这3组引物最适反应温度分别为65、60、63 ℃ 在后续灵敏度实验中,aflR引物与阳性模板结合较差于其他引物,在筛选温时可发现温度对aflR-73影响较大,65 ℃可达到最高检测效率,但综合比较最优温度选择64 ℃,因在64 ℃条件下,三组引物Ct值均在25 min以内。因统一温度更有利于现场检测,所以将最适温度定为64 ℃。
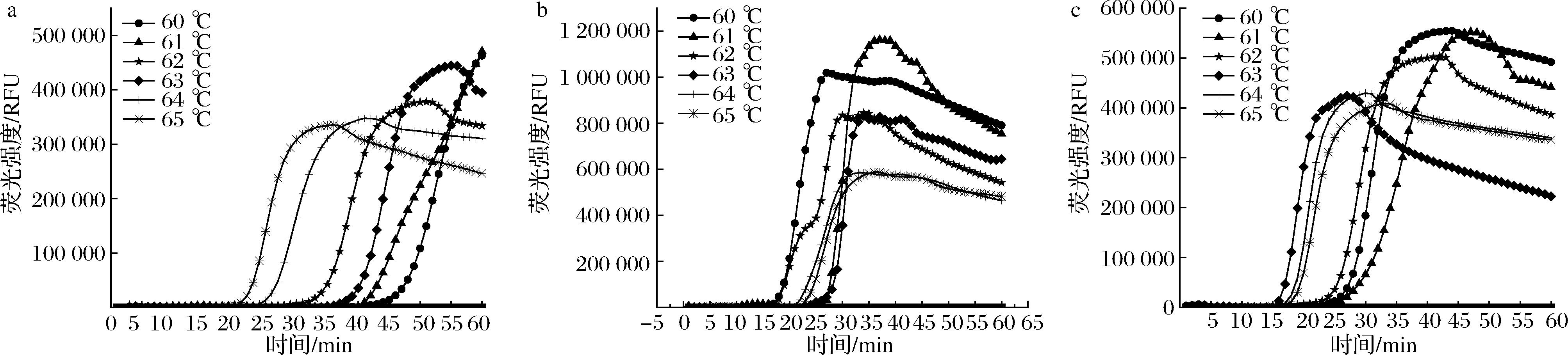
a-aflR-73;b-omt-1-47;c-ver-1-218
图6 实时荧光LAMP反应温度优化
Fig.6 Optimization results for the real-time fluorescent LAMP reaction temperature
2.3 灵敏度检测
当阳性样本DNA质量浓度从10.0 ng/μL进行稀释,本实验所建立的实时荧光LAMP检测方法均能在60 min内检出,aflR、omt-1、ver-1检测限分别为1.0×10-2、1.0×10-3和1.0×10-4 ng/μL,通过对反应体系染荧光料替换为羟基萘酚蓝,可观察出阳性反应体系由紫罗兰色变为天蓝色,未发生反应体系为紫色,可视化反应可在灵敏度检测中与实时荧光LAMP中相对应,因只有3种基因同时存在时才可证明被检测样本中含有产黄曲霉毒素的真菌,说明本实验建立的LAMP 检测方法的最低检测限为1.0×10-2 ng/μL (图7)。

a-aflR-73;b-omt-1-47;c-ver-1-218;d-aflR-73、omt-1-47、ver-1-218体系灵敏度检测可视化结果
图7 实时荧光LAMP灵敏度检测
Fig.7 Real-time fluorescence LAMP sensitivity detection results
注:1~8-10.0 ng/μL~1.0×10-6 ng/μL。
2.4 精密度实验
由表3、4、5 可以看出,对于aflR、ver-1、omt-1三种基因的CV 值均小于5%,说明精密度良好,证明此方法具有高重复性和强稳定性。
表3 10 ng/μL和1×10-2 ng/μL DNA 的Ct及CV值
Table 3 Ct and CV values of 10 ng/μL and 1×10-2 ng/μL DNA
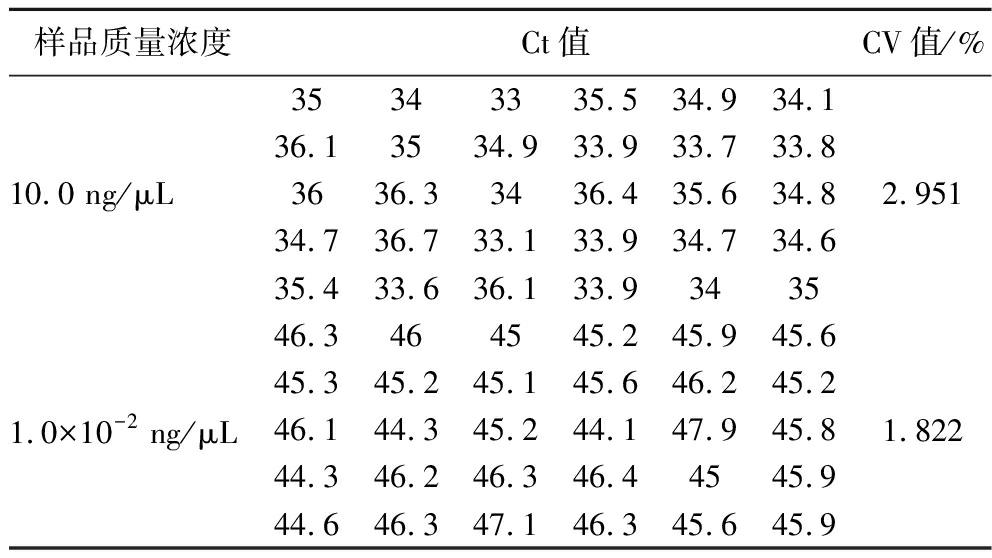
样品质量浓度Ct值CV值/%10.0 ng/μL35343335.534.934.136.13534.933.933.733.83636.33436.435.634.834.736.733.133.934.734.635.433.636.133.934352.9511.0×10-2 ng/μL46.3464545.245.945.645.345.245.145.646.245.246.144.345.244.147.945.844.346.246.346.44545.944.646.347.146.345.645.91.822
表4 10 ng/μL 和1×10-3 ng/μL DNA 的Ct及CV值
Table 4 Ct and CV values of 10 ng/μL and 1×10-3 ng/μL DNA
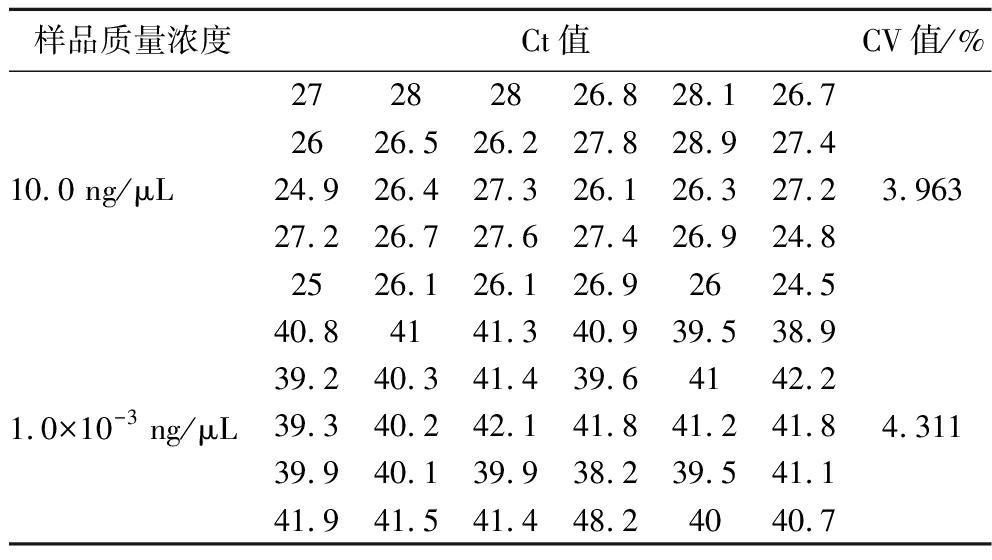
样品质量浓度Ct值CV值/%10.0 ng/μL27282826.828.126.72626.526.227.828.927.424.926.427.326.126.327.227.226.727.627.426.924.82526.126.126.92624.53.9631.0×10-3 ng/μL40.84141.340.939.538.939.240.341.439.64142.239.340.242.141.841.241.839.940.139.938.239.541.141.9 41.541.448.24040.74.311
表5 10 ng/μL 和1×10-4 ng/μL DNA 的Ct及CV值
Table 5 Ct and CV values of 10 ng/μL and 1×10-5 ng/μL DNA
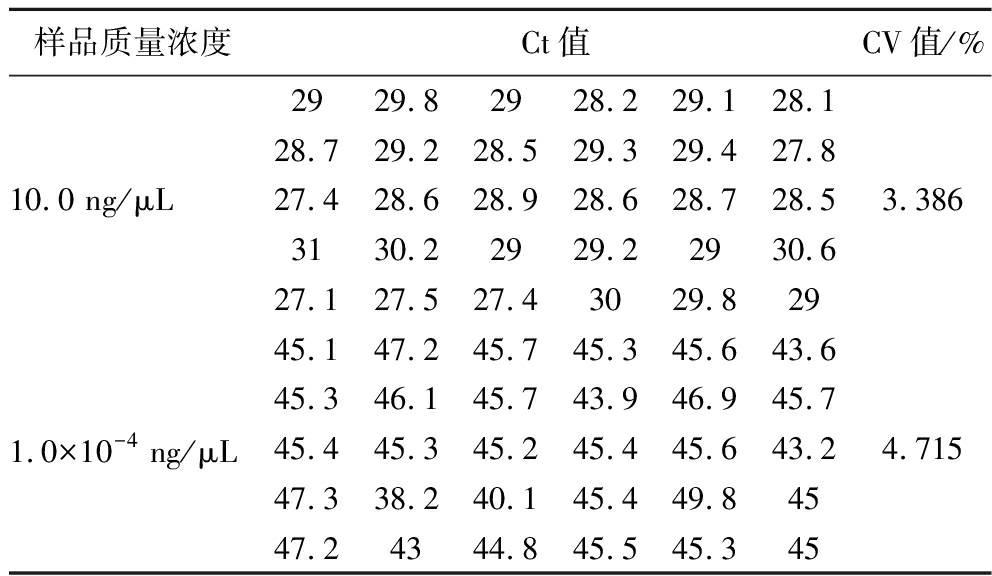
样品质量浓度Ct值CV值/%10.0 ng/μL2929.82928.229.128.128.729.228.529.329.427.827.428.628.928.628.728.53130.22929.22930.627.127.527.43029.8293.3861.0×10-4 ng/μL45.147.245.745.345.643.645.346.145.743.946.945.745.445.345.245.445.643.247.338.240.145.449.84547.24344.845.545.3454.715
2.5 特异性检测
本文建立的实时荧光LAMP方法与13株菌反应结果如图8,在该反应体系下,aflR-73、omt-1-47、ver-1-218与产毒菌DNA模板均能结合,发生等温扩增反应,但无法与非产毒菌发生反应,证明了该反应体具有良好特异性和通用性。图9为该反应体系的可视化结果,与荧光反应曲线可一一对应,阴性为紫罗兰色,而阳性为天蓝色,进一步说明本实验方法的合理性。
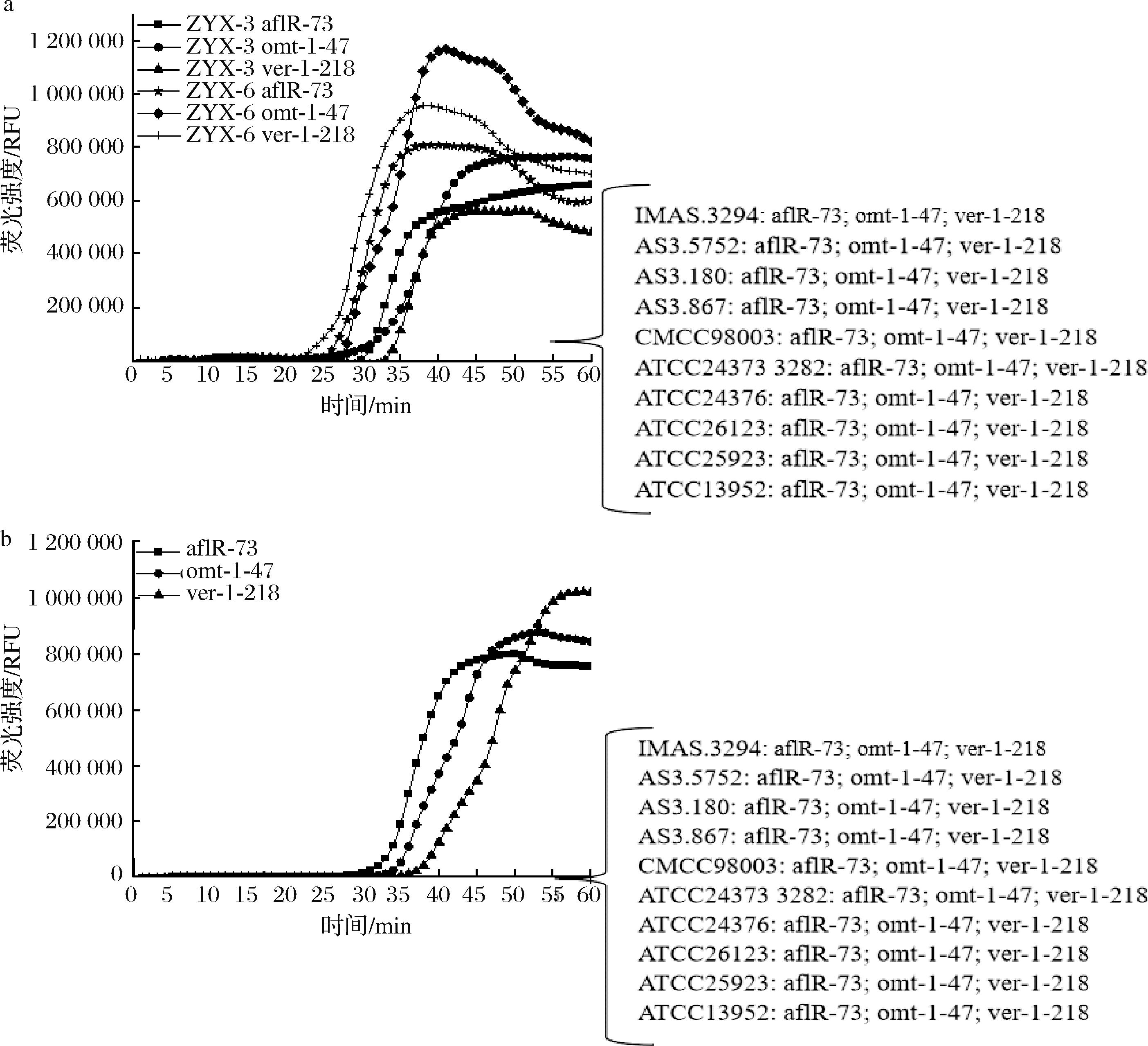
a-黄曲霉菌ZYX-3,ZYX-6特异性;b-寄生曲霉特异性
图8 实时荧光LAMP特异性检验
Fig.8 Real-time fluorescent LAMP specific assays
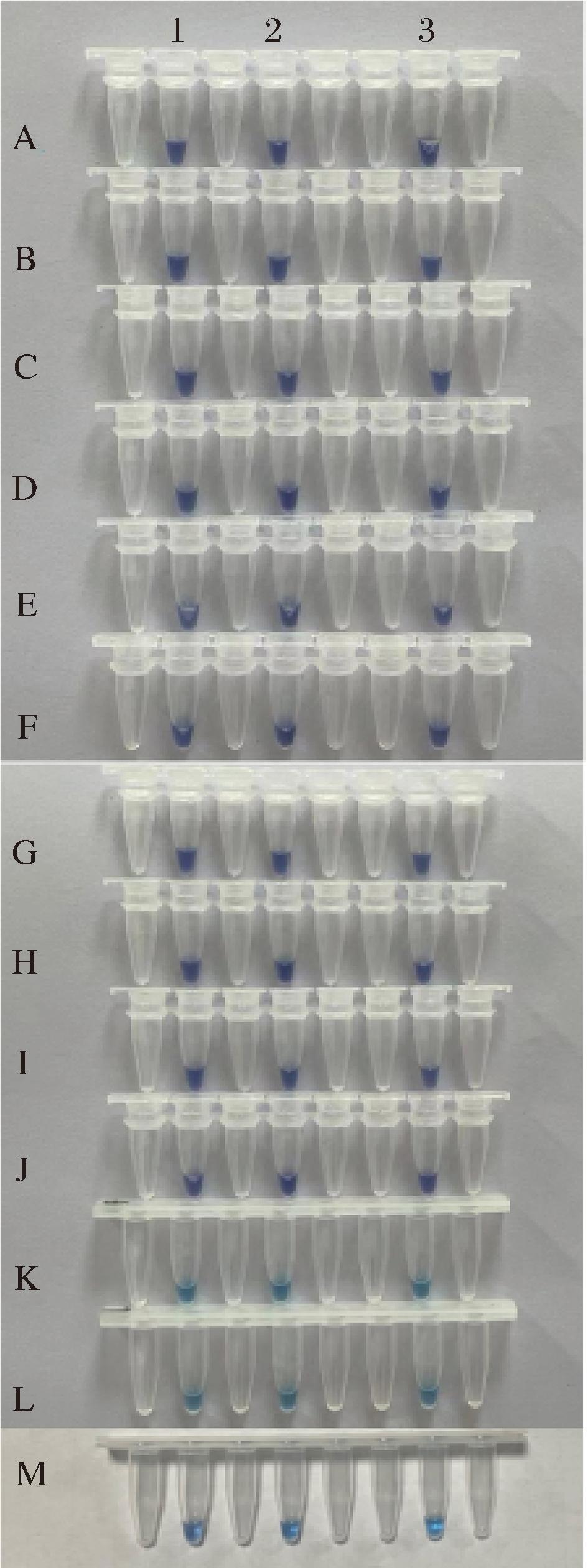
A-金黄色葡萄球菌ATCC25923;B-枯草芽孢杆菌ATCC13952; C-直立毛霉AS3.180;D-禾谷镰刀曲霉ATCC24373; E-禾谷镰刀曲霉ATCC24376;F-米根霉AS3.867; G-指状青霉AS3.5752;H-黄绿青霉IMAS 3294; I-黑曲霉CMCC98003;J-稻帚枝霉ATCC26123; K-黄曲霉ZYX-3;L-黄曲霉ZYX-6;M-寄生曲霉AS3.124
图9 可视化LAMP特异性检测结果
Fig.9 Visualize the LAMP-specific detection results
注:1~3-aflR-3-74、omt-1-47、ver-1-218(下同)。
2.6 抗干扰性研究
由图10显示,第一组只有阳性菌与第二组有阳性菌和其他几种干扰菌共同存在的情况下均有荧光信号产生,而且起峰时间较接近,第二组在加入其他非目标菌模板后起峰时间虽略有推迟但在可接受的检测范围内(图10-B),而没有黄曲霉菌存在的情况下和空白对照一样没有荧光信号出现,因此未在图片中表示,证明该方法对检测产黄曲霉毒素真菌具有很强的抗干扰能力。
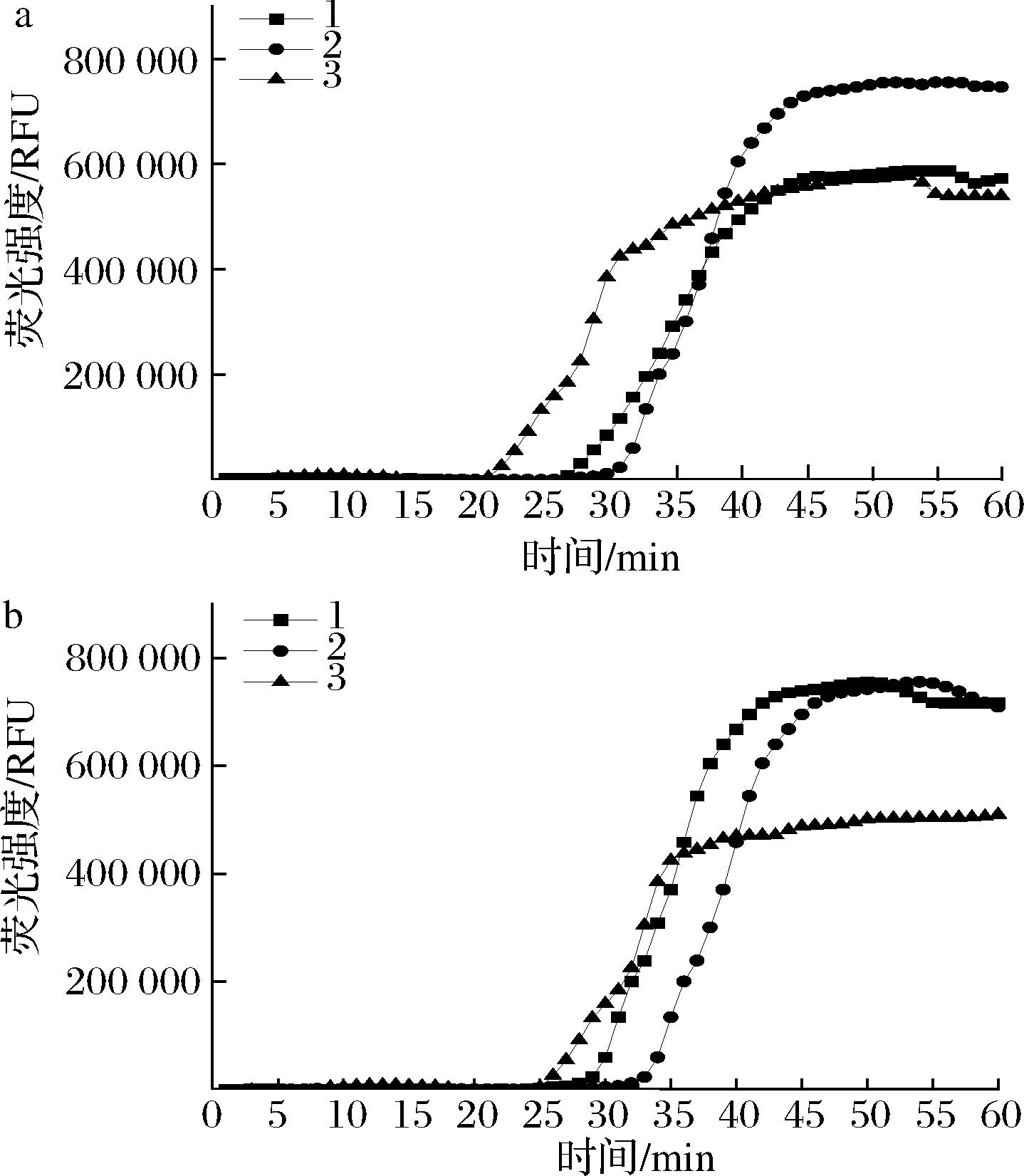
a-阳性菌;b-阳性菌+干扰菌
图10 实时荧光LAMP抗干扰性能研究
Fig.10 Anti-interference performance of real-time fluorescent LAMP
3 结论与讨论
在近几年黄曲霉菌检测研究成果中,陈冠果等[32]针对aflR基因和nor-1基因设计特异性引物和探针,建立双重荧光定量PCR检测产毒黄曲霉菌方法,此方法添加探针,成本较高,且无法进行可视化检测,冯优妍等[33]建立实时荧光PCR方法检测黄曲霉菌与寄生曲霉菌,灵敏度达到10-2ng/μL, 但无法进行可视化检测;刘启君等[34]人仅针对黄曲霉菌转录间隔区(internal transcribed spacer,ITS) 保守序列,建立重组酶聚合酶等温扩增技术(recombinase polymerase amplification,RPA) 的现场可视化快速检测黄曲霉菌的检测体系,检测基因单一,可证明检出菌为黄曲霉菌,但无法证明为产毒黄曲霉菌。本文根据黄曲霉毒素生化合成途径中关键调控基因aflR、柄曲霉素转甲基酶基因omt-1、杂色曲霉素A脱氢酶基因ver-1分别设计3对LAMP引物,建立了快速、高灵敏度、高特异性的实时荧光 LAMP 方法,若3组引物均发生反应,则证明该菌为黄曲霉毒素产生菌,且通过羟基萘酚蓝的添加可实现对产黄曲霉毒素真菌的可视化快速检测,且该方法对aflR、ver-1和omt-1基因灵敏度分别为1×10-2、1×10-3、1×10-4 ng/μL,均高于SN/T 2582—2010《产黄曲霉毒素真菌PCR检测方法》中普通 PCR 方法 (0.1 ng/μL),同时无需采取传统琼脂糖凝胶电泳,有效避免了气溶胶污染造成的假阳性,并可将反应时间控制在 60 min 以内。此方法针对黄曲霉菌、寄生曲霉菌这两种常见黄曲霉毒素产生菌均有明显反应,与10株不产生黄曲霉毒素阴性菌株均不结合,证明引物具有良好特异性,能够很好地满足实际样品的检测需求。
[1] YU J J, CHANG P K, EHRLICH K C, et al. Clustered pathway genes in aflatoxin biosynthesis[J]. Applied and Environmental Microbiology, 2004, 70(3):1253-1262.
[2] 高晶. 饲料源寄生曲霉和纯绿青霉菌落生长及产毒的调控研究[D].兰州:兰州大学, 2023.GAO J. Studies on the growth and toxin production of Aspergillus parasitica and Penicillium viridis in feed[D].Lanzhou:Lanzhou University, 2023.
[3] WANG C, SUN L L, ZHAO Q. A simple aptamer molecular beacon assay for rapid detection of aflatoxin B1[J]. Chinese Chemical Letters, 2019, 30(5):1017-1020.
[4] HE S, HUANG Q T, ZHANG Y, et al. Magnetic beads-based multicolor colorimetric immunoassay for ultrasensitive detection of aflatoxin B1[J]. Chinese Chemical Letters, 2021, 32(4):1462-1465.
[5] 刘楚君, 张莉蕴, 吴聪明, 等. 四极杆-线形离子阱液相色谱质谱联用法快速检测玉米油中黄曲霉毒素[J]. 食品安全导刊, 2023(20):84-88.LIU C J, ZHANG L Y, WU C M, et al. Determination of aflatoxin in corn oil by liquid chromatography-quadrupole-linear ion trap mass spectrometry[J]. China Food Safety Magazine, 2023(20):84-88.
[6] 邹邵华. 粮食中黄曲霉毒素的产生机制和检测方法探究[J]. 粮食加工, 2023, 48(5):148-151.ZOU S H. Exploration on the production mechanism and detection methods of aflatoxins in grain[J]. Grain Processing, 2023, 48(5):148-151.
[7] LIU Q J, LI X, WU R Q, et al. Development of an on-spot and rapid recombinase polymerase amplification assay for Aspergillus flavus detection in grains[J]. Food Control, 2021, 125:107957.
[8] 唐颂, 李岩松, 尚翠玲, 等. 玉米赤霉烯酮间接竞争ELISA方法的建立[J]. 食品工业科技, 2022, 43(4): 300-304.TANG S, LI Y S, SHANG C L, et al. Establishment of an indirect competitive ELISA for zearalenone[J]. Science and Technology of Food Industry, 2022, 43(4): 300-304.
[9] 段春宇. 酶联免疫吸附法和免疫亲和柱-高效液相色谱法在检测饲料中黄曲霉毒素B1含量中的比对研究[J]. 中国动物保健, 2022, 24(5):131-132, 104.DUAN C Y. Comparative study of enzyme-linked immunosorbent assay and immunoaffinity column high-performance liquid chromatography for detecting aflatoxin B1 content in feed [J]. China Animal Health, 2022, 24(5):131-132, 104.
[10] 刘颖, 金永鹏, 罗荪琳, 等. 高效液相色谱同步检测饲料中黄曲霉毒素B1、玉米赤霉烯酮及呕吐毒素的方法[J]. 动物营养学报, 2021, 33(8):4684-4693.LIU Y, JIN Y P, LUO S L, et al. A method for simultaneous determination of aflatoxin B1, Zearalenone and deoxynivalenol in feed by high performance liquid chromatography[J]. Chinese Journal of Animal Nutrition, 2021, 33(8):4684-4693.
[11] 高志存, 石露莎, 余舒宁, 等. 酶联免疫吸附法与高效液相色谱法检测玉米中黄曲霉毒素B1的比较[J]. 云南畜牧兽医, 2023(6):10-12.GAO Z C, SHI L S, YU S N, et al. Comparison of enzyme-linked immunosorbent assay and high performance liquid chromatography in detecting aflatoxin B1 in corn[J]. Yunnan Journal of Animal Science and Veterinary Medicine, 2023(6):10-12.
[12] 张欣悦. 中药材中黄曲霉菌及其毒素检测新技术研究[D]. 北京: 北京中医药大学, 2017.ZHANG X Y. Research on new technologies for detection of Aspergillus flavus and its toxins in Chinese medicinal materials[D]. Beijing: Beijing University of Chinese Medicine, 2017.
[13] WONG Y P, OTHMAN S, LAU Y L, et al. Loop-mediated isothermal amplification (LAMP): A versatile technique for detection of micro-organisms[J]. Journal of Applied Microbiology, 2018, 124(3):626-643.
[14] 张照茹. 水稻纹枯病菌及稻曲病菌LAMP检测体系的建立与应用[D].沈阳:沈阳农业大学,2020.ZHANG Z R. Establishment and application of LAMP detection system for rice sheath blight pathogen and rice smut pathogen[D].Shenyang: Shenyang Agricultural University, 2020.
[15] 于佳. 作物土传病害病原真菌和卵菌的三种分子检测方法研究[D]. 南京: 南京农业大学, 2019.YU J. Research on three molecular detection methods for pathogenic Fungi and Egg Fungi of soil borne crop diseases[D]. Nanjing: Nanjing Agricultural University, 2019.
[16] 杜文芳. 环介导等温扩增及生物分析新方法研究[D]. 长沙: 湖南大学, 2018.DU W F. A new method for loop mediated isothermal amplification and bioanalysis[D]. Changsha: Hunan University, 2018.
[17] 周思妍. 以LAMP-CRISPR/Cas12a为基础的儿童呼吸道病原检测方法的建立与应用[D]. 长春: 吉林大学, 2023.ZHOU S Y. Establishment and application of a detection method for respiratory pathogens in children based on LAMP coupling CRISPR/Cas12a[D]. Changchun: Jilin University, 2023.
[18] 任显凤. 粮油黄曲霉与毒素同步检测及木霉阻控技术研究[D]. 北京: 中国农业科学院, 2020.REN X F. Simultaneous detection and trichoderma’s biocontrol on Aspergillus flavus and aflatoxins in grains and oil[D]. Beijing: Chinese Academy of Agricultural Sciences, 2020.
[19] 孙长坡, 常晓娇, 伍松陵, 等. 利用PCR-RFLP方法鉴别黄曲霉毒素产毒菌株[J]. 中国农业科学, 2014, 47(18):3675-3683.SUN C P, CHANG X J, WU S L, et al. Identification of aflatoxin producing strains by using PCR-RFLP method[J]. Scientia Agricultura Sinica, 2014, 47(18):3675-3683.
[20] 李雨薇, 吕家硕, 于一凡, 等. 黄曲霉毒素降解技术研究及应用进展[J]. 生物技术进展, 2023, 13(6):853-862.LI Y W, LYU J S, YU Y F, et al. Research and application progress in degradation of aflatoxin[J]. Current Biotechnology, 2023, 13(6):853-862.
[21] 马慧慧. 寄生曲霉菌在不同饲料原料中产生黄曲霉毒素B1的差异性及其机制研究[D]. 武汉: 华中农业大学, 2015.MA H H. The study on difference and mechanisim of different feedstuff on afatoxin B1 production by Aspergillus parasiticus[D].Wuhan: Huazhong Agricultural University, 2015.
[22] 凌莉, 叶正茂, 王溯源, 等. 成都市售辣椒中产黄曲霉毒素菌株的分离及其基因分析[J]. 四川大学学报(医学版), 2015, 46(5):684-687.LING L, YE Z M, WANG S Y, et al. Isolation and study on the aflatoxin genes of aflatoxin-producing fungi in paprika samples in Chengdu[J]. Journal of Sichuan University (Medical Science Edition), 2015, 46(5):684-687.
[23] LIANG S H, SKORY C D, LINZ J E. Characterization of the function of the ver-1A and ver-1B genes, involved in aflatoxin biosynthesis in Aspergillus parasiticus[J]. Applied and Environmental Microbiology, 1996, 62(12):4568-4575.
[24] YU J, CARY J W, BHATNAGAR D, et al. Cloning and characterization of a cDNA from Aspergillus parasiticus encoding an O-methyltransferase involved in aflatoxin biosynthesis[J]. Applied and Environmental Microbiology, 1993, 59(11):3564-3571.
[25] 王欢, 薛健. 寄生曲霉快速分子检测方法的研究[J]. 农业与技术, 2022, 42(17):19-22.WANG H, XUE J. Research on rapid molecular detection method for Parasitic aspergillus [J]. Agriculture and Technology, 2022, 42(17):19-22.
[26] 张桂枝,刘俊杰,潘梦洋,等. 复合植物精油和有机酸盐对发酵饲料的防霉效果及发酵品质的影响[J]. 黑龙江畜牧兽医, 2023(14): 91-95;101. ZHANG G Z, LIU J J, PAN M Y, et al. The effect of compound plant essential oils and organic acid salts on the antifungal effect and fermentation quality of fermented feed[J]. Heilongjiang Animal Science and Veterinary Medicine, 2023(14): 91-95;101.
[27] 张宁慧, 王瑱, 毛垣元, 等. 植物精油及活性成分防控黄曲霉生长及其毒素产生的研究进展[J]. 中草药, 2020, 51(20):5348-5359.ZHANG N H, WANG T, MAO Y Y, et al. Research progress on growth of Aspergillus flavus and its toxins production controlled by plant essential oils and its active ingredients[J]. Chinese Traditional and Herbal Drugs, 2020, 51(20):5348-5359.
[28] 徐丹, 郭芮, 贺竹梅, 等. 九种植物精油对黄曲霉抑制作用的比较[J]. 保鲜与加工, 2020, 20(2):79-84.XU D, GUO R, HE Z M, et al. Comparison of the inhibitory effect of nine plant essential oils on Aspergillus flavus[J]. Storage and Process, 2020, 20(2):79-84.
[29] 王婷. 黄曲霉菌及其毒素合成关键酶抗体的研制[D]. 北京: 中国农业科学院, 2017.WANG T. Preparation of antibodies against key enzymes of Aspergillus flavus and its toxin synthesis[D]. Beijing: Chinese Academy of Agricultural Sciences, 2017.
[30] 晏丽. 黄曲霉毒素产毒菌检测方法的研究及其应用[D]. 无锡: 江南大学, 2012.YAN L. Development and application of detection methods for aflatoxins toxin-producing bacteria[D]. Wuxi: Jiangnan University, 2012.
[31] 张庆, 赵晓美, 王娉, 等. 食品中产毒真菌核酸检测方法的研究进展[J]. 中国农业科技导报, 2021, 23(3):91-98.ZHANG Q, ZHAO X M, WANG P, et al. Advance on detection methods of nucleic acid for toxin-producing fungi in food[J]. Journal of Agricultural Science and Technology, 2021, 23(3):91-98.
[32] 陈冠果, 李可, 陆金虎,等.产黄曲霉毒素真菌双重荧光定量PCR检测技术的建立与应用[J]. 中国粮油学报, 2024, 39(2):188-195.CHEN G G, LI K, LU J H, et al. Development and application of dual fluorescent quantitative PCR for detection of aflatoxins fungi[J]. Journal of the Chinese Cereals and Oils Association, 2024, 39(2):188-195.
[33] 冯优妍, 杨爱馥, 郑秋月, 等. 粮食中主要霉菌实时荧光PCR检测方法建立[J]. 粮食与饲料工业, 2020(4):1-3;9.FENG Y Y, YANG A F, ZHENG Q Y, et al. Establishment of a real-time PCR method for detection of main fungus in grain[J]. Cereal &Feed Industry, 2020(4):1-3; 9.
[34] 刘启君. 食品中黄曲霉菌及黄曲霉毒素B1的快速检测方法研究[D]. 广州: 华南理工大学, 2021.LIU Q J. Rapid detection of Aspergillus flavus and aflatoxins B1 in food[D].Guangzhou: South China University of Technology, 2021.