L-高丝氨酸又名2-氨基-4-羟基丁酸,是一种非必需氨基酸。尽管不参与蛋白质的合成,但它是 L-苏氨酸、L-蛋氨酸合成的重要前体[1-2]。同时,L-高丝氨酸还是合成L-草铵膦除草剂的一种重要中间体[3]。与天然保湿剂中的氨基酸相比,L-高丝氨酸能结合更多水分子,在皮肤保湿方面有巨大潜能[4]。故L-高丝氨酸在化工、农业、生物医药等领域有重要价值。目前生产L-高丝氨酸常用的方法有化学合成法[5]和微生物发酵法[6]。化学合成法有很大的局限性,如安全性低、易对环境造成污染。相比之下,微生物发酵法效率高、反应条件温和并且绿色环保,已被长期应用于生产氨基酸。
微生物发酵法生产L-高丝氨酸常用的菌株有大肠杆菌和谷氨酸棒杆菌。目前,通过对L-高丝氨酸合成路径进行改造从而提高L-高丝氨酸的产量一直是研究热点[7-9],但对其产物的分泌关注较少。由于L-高丝氨酸在细胞内积累产生的毒性会抑制菌体的生长,故L-高丝氨酸的高效分泌可有效降低胞内产物浓度对代谢途径重要节点的阻遏作用。氨基酸的分泌主要通过细胞膜上的转运蛋白完成的,有研究证明[10]rhtA基因编码一种膜蛋白,该蛋白在大肠杆菌中参与L-高丝氨酸的外排,并且过表达rhtA基因可提高大肠杆菌对L-高丝氨酸的抗性,增加L-高丝氨酸产量。这说明L-高丝氨酸外排蛋白的过表达可以作为提升L-高丝氨酸发酵产量的一个重要策略。DING等[11]通过对rhtA进行体内连续定向进化和生长偶联选择,得到了RhtA蛋白的3个突变体,含有益突变体的工程菌株产生的L-高丝氨酸比对照菌株提高了约48%~108%。
谷氨酸棒杆菌是一种食品安全性菌株,由于其具有营养需求低、生长速度快、底物谱广等优势[12],已被广泛应用于氨基酸的生产。目前在谷氨酸棒杆菌中发现了6种氨基酸转运蛋白,它们参与12种氨基酸的转运(如赖氨酸、精氨酸等)[13],但却很少有关于谷氨酸棒杆菌中L-高丝氨酸转运蛋白的研究。因此,本研究通过生物信息学分析挖掘谷氨酸棒杆菌中潜在的L-高丝氨酸转运蛋白,综合体外和体内L-高丝氨酸耐受性生长实验,最终选择lysE进行L-高丝氨酸外排能力测试,并通过摇瓶发酵实验探究了lysE对L-高丝氨酸发酵产量的影响,最终确定LysE蛋白具有转运L-高丝氨酸的能力。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
表1为本研究所用菌株。大肠杆菌(Escherichia coli)DH5α和谷氨酸棒杆菌(Corynebacterium glutamicum)ATCC 13032均由中国科学院天津工业生物技术研究所保存。
表1 本研究所用的菌株
Table 1 Strains used in this study
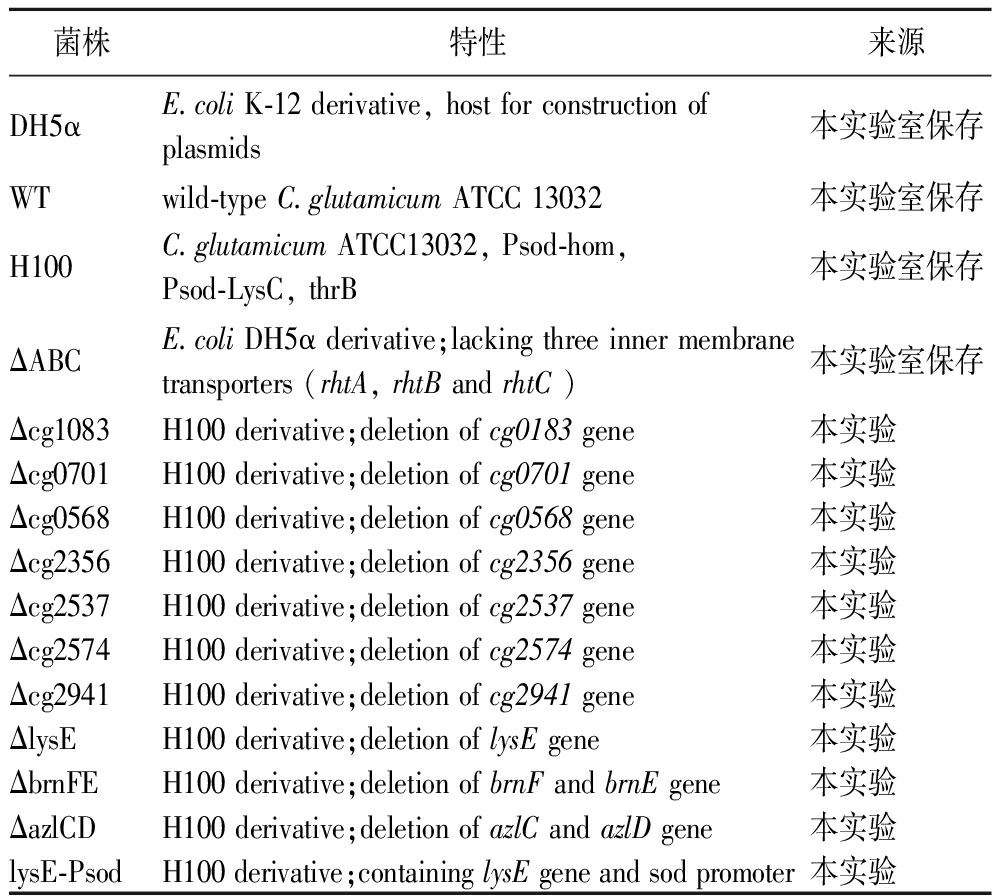
菌株特性来源DH5αE.coli K-12 derivative, host for construction of plasmids本实验室保存WTwild-type C.glutamicum ATCC 13032本实验室保存H100C.glutamicum ATCC13032, Psod-hom, Psod-LysC, thrB本实验室保存ΔABCE.coli DH5α derivative;lacking three inner membrane transporters (rhtA, rhtB and rhtC )本实验室保存Δcg1083H100 derivative;deletion of cg0183 gene本实验Δcg0701H100 derivative;deletion of cg0701 gene本实验Δcg0568H100 derivative;deletion of cg0568 gene本实验Δcg2356H100 derivative;deletion of cg2356 gene本实验Δcg2537H100 derivative;deletion of cg2537 gene本实验Δcg2574H100 derivative;deletion of cg2574 gene本实验Δcg2941H100 derivative;deletion of cg2941 gene本实验ΔlysEH100 derivative;deletion of lysE gene本实验ΔbrnFEH100 derivative;deletion of brnF and brnE gene本实验ΔazlCDH100 derivative;deletion of azlC and azlD gene本实验lysE-PsodH100 derivative;containing lysE gene and sod promoter本实验
表2为本研究所用质粒。大肠杆菌表达质粒pMW118由本实验室保存,大肠杆菌-谷氨酸棒杆菌穿梭载体pECXK-99E用于基因表达,pCRD206用于基因敲除,皆由本实验室保管。
表2 本研究所用的质粒
Table 2 Plasmids used in this study

质粒特性来源pCRD206temperature-sensitive replicon;gene sacB of Bacillus subtilis;Kanr本实验室保存pMW118low copy cloning vector;Ampr本实验室保存pECXK-99Eshuttle expression vector of C.glutamic-E.coli; Kanr本实验室保存pCRD206-cg1083pCRD206 derivative;deletion of cg0183 gene本实验pCRD206-cg0701pCRD206 derivative;deletion of cg0701 gene本实验pCRD206-cg0568pCRD206 derivative;deletion of cg0568 gene本实验pCRD206-cg2356pCRD206 derivative;deletion of cg2356 gene本实验pCRD206-cg2537pCRD206 derivative;deletion of cg2537 gene本实验pCRD206-cg2574pCRD206 derivative;deletion of cg2574 gene本实验pCRD206-cg2941pCRD206 derivative;deletion of cg2941 gene本实验pCRD206-lysEpCRD206 derivative;deletion of lysE gene本实验pCRD206-brnFEpCRD206 derivative;deletion brnF and brnE gene本实验pCRD206-azlCDpCRD206 derivative;deletion azlC and azlD gene本实验pCRD206-Psod-lysEpCRD206 derivative;containing lysE gene and sod promoter本实验pECXK99E-cg0183pECXK99E derivative;overexpression of cg0183gene本实验pECXK99E-cg0701pECXK99E derivative;overexpression of cg0701 gene本实验pECXK99E-cg0568pECXK99E derivative;overexpression of cg0568 gene本实验pECXK99E-cg2356pECXK99E derivative;overexpression of cg2356 gene本实验pECXK99E-cg2537pECXK99E derivative;overexpression of cg2537 gene本实验pECXK99E-cg2574pECXK99E derivative;overexpression of cg2574 gene本实验pECXK99E-cg2941pECXK99E derivative;overexpression of cg2941 gene本实验pECXK99E-lysEpECXK99E derivative;overexpression of lysE gene本实验pECXK99E-brnFEpECXK99E derivative;overexpression of brnF and brnE gene本实验pECXK99E-azlCDpECXK99E derivative;overexpression of azlC andazlD gene本实验pMW118-lysEpMW118 derivative;overexpression of lysE本实验
1.1.2 试剂
无缝克隆试剂盒(Minerva Super Fusion Cloning Kit),US EVERBRIGHT;BamH I、Xba I、EcoR I、Phusion DNA 聚合酶,Thermo Fisher Scientific;dNTPs、Fly DNA 聚合酶,全式金;DMSO,吉至;质粒提取试剂盒、胶回收试剂盒、基因组提取试剂盒,天根生化;L-高丝氨酸,希恩思;氨苄青霉素钠,硫酸卡那霉素,索莱宝。
1.1.3 培养基
LB培养基(g/L):酵母提取物5、胰蛋白胨10、NaCl 10;固体培养基加1.5%(质量分数,下同)琼脂粉。
LBHIS培养基(g/L):酵母提取物2.5、胰蛋白胨5、NaCl 5、D-山梨醇91、脑心浸液18.5;固体培养基加1.5%琼脂粉。
M9培养基(g/L):Na2HPO4·12H2O 12.8、KH2PO4 3、NaCl 0.5、NH4Cl 1、0.4%(质量分数)葡萄糖、CaCl2 0.1 mmol/L、MgSO4 2 mmol/L。
CGXⅡ培养基(g/L):(NH4)2SO4 20、尿素5、KH2PO41、K2HPO4·3H2O1.3、MOPS42、CaCl21、MgSO4·7H2O25、FeSO4·7H2O 1、MnSO4·H2O 1、ZnSO4·7H2O 0.1、CuSO4 20 mg/L、NiCl·6H2O 2、原儿茶酸3、生物素20 mg/L、维生素B1 10 mg/L、葡萄糖40、苏氨酸1。
种子培养基(g/L):葡萄糖25、玉米浆30、尿素5、(NH4)2SO4 5、K2HPO4 1、MgSO4 0.5、苏氨酸0.4,将pH值调至7.2~7.3。
发酵培养基(g/L):葡萄糖50、玉米浆30、磷酸0.225 ml/L、K2HPO4 0.25、MgSO4 0.5、乙酸钾0.5、苏氨酸0.4、铁-柠檬酸0.55 ml/L(20 FeSO4、18.14 柠檬酸)、维生素母液7 mL/L(500 mg/L 维生素B1、500 mg/L生物素、2 泛酸钙、600 mg/L烟酰胺)。定容后调pH值至7.2~7.3,再加入15 g/L CaCO3。
1.2 仪器与设备
全自动微生物生长曲线分析仪,杰灵仪器制造(天津)有限公司;高速冷冻离心机,德国Eppendoff;Agilent 1260高效液相色谱仪,美国Agilent公司;振荡培养箱,上海知楚仪器有限公司;生化培养箱,上海一恒科学仪器有限公司;分析天平、pH计,梅特勒托利多(上海)有限公司;超声波清洗机,鼎泰恒胜。
1.3 实验方法
1.3.1 过表达质粒的构建
利用Fly聚合酶以谷氨酸棒杆菌ATCC 13032基因组的DNA为模板,通过PCR方法获得目的基因片段。用EcoR I、Xba I对pECXK-99E质粒进行双酶切,得到pECXK-99E骨架。(以pMW118质粒为模板,利用Phusion聚合酶通过PCR方式扩增获得pMW118骨架),再用无缝克隆的方法将骨架和片段连接,得到重组质粒。
1.3.2 敲除菌株的构建
以谷氨酸棒杆菌ATCC 13032基因组的DNA为模板扩增目标基因,使用Fly聚合酶通过PCR扩增片段。骨架使用BamH I、Xba I对pCRD206质粒进行双酶切,得到骨架用无缝克隆的方法与目的基因片段进行连接。根据OKIBE等[14]报道的方法,通过两步同源重组法构建谷氨酸棒杆菌的基因缺失菌株。(H100-pCRD206-Psod-lysE构建方法同理,Psod启动子以谷氨酸棒杆菌ATCC 13032基因组的DNA为模板,使用Fly聚合酶通过PCR方法获得。)
1.3.3 L-高丝氨酸对谷氨酸棒杆菌的胁迫测定
将谷氨酸棒杆菌ATCC 13032单菌落划线于LBHIS固体板上,32 ℃过夜培养。挑取适当大小的单菌落转接于3 mL LBHIS液体培养基中,32 ℃,220 r/min过夜培养。将含有0、80、120、140、160 g/L的L-高丝氨酸CGXⅡ培养基加入到48孔板中,菌液以起始OD值0.1转接至孔板,使用全自动微生物生长曲线分析仪振荡培养。
1.3.4 体外与体内菌株对不同浓度L-高丝氨酸耐受性评价
1.3.4.1 体外实验
在大肠杆菌三重高丝氨酸转运缺陷突变体(ΔABC)中异源过表达基因,将得到菌株划线于含有50 mg/mL的硫酸卡那霉素LB固体板上(pMW118-lysE使用的抗生素为100 mg/mL氨苄青霉素钠),32 ℃过夜培养。从平板上挑选单克隆菌株接种至含有50 mg/mL硫酸卡那霉素的3 mL LB液体培养基,32 ℃,220 r/min过夜培养。将含有0、1 g/L L-高丝氨酸M9培养基加入到48孔板中,菌液以起始OD值0.1转接至孔板,使用全自动微生物生长曲线分析仪振荡培养。
1.3.4.2 体内实验
在L-高丝氨酸生产底盘菌谷氨酸棒杆菌H100中分别敲除候选蛋白基因,将得到的菌株划线于LBHIS固体板上,32 ℃过夜培养。从平板上挑选单克隆菌株转接于3 mL LBHIS液体培养基中,32 ℃,220 r/min过夜培养。以起始OD值0.1将活化后的菌液转接于含有0、1 g/L L-高丝氨酸CGXⅡ培养基的48孔板中,使用全自动微生物生长曲线分析仪振荡培养。
1.3.5 L-高丝氨酸外排量的测定
根据LIVSHITS等[10]报道的方法并进行微小修改。挑取H100、ΔlysE、lysE-Psod单菌落接到3 mL LBHIS液体培养基中,220 r/min,32 ℃过夜培养。以OD值为0.1接种到10 mL新鲜的LBHIS液体培养基中,待OD长到0.4~0.6时,向培养基中加入40 g/L L-高丝氨酸,继续培养4 h,使L-高丝氨酸在细胞中积累。孵育结束后,用高速冷冻离心机5 000 r/min,10 min 收集菌体,后用冰冷的LBHIS液体洗涤2次,并重悬于LBHIS培养基中,以启动L-高丝氨酸流出过程。之后在5、30 min、1 h分别取500 mL溶液,12 000 r/min离心10 min,取上清液通过HPLC分析上清液中细胞外L-高丝氨酸的含量。
1.3.6 摇瓶发酵
挑取H100、ΔlysE、lysE-Psod单菌落接到3 mL LBHIS液体培养基中,220 r/min,32 ℃过夜培养,以0.1% 接种量接种至10 mL 种子培养基中,220 r/min,32 ℃培养12~14 h 后,以起始OD值1转接到发酵培养基中,220 r/min,32 ℃培养36 h。取1 mL发酵液,使用离心机12 000 r/min离心10 min,取上清液通过HPLC测试L-高丝氨酸产量。
1.4 指标测定
1.4.1 生物量检测
生物量OD600值的检测方法:使用紫外分光光度计测定λ=600下稀释多倍的样品的吸光值(读数范围为0.2~0.9),所测得吸光值乘稀释倍数则为单位时间的菌体量。
1.4.2 L-高丝氨酸产量检测
采用OPA柱前在线衍生高效液相色谱法定性定量分析上清液中的L-高丝氨酸。用L-高丝氨酸标品配制标准液并绘制标准曲线。色谱条件:色谱柱为Agilent ZORBAX Eclipse AAA色谱柱(4.6 mm×150 mm, 5 μm);检测器为紫外检测器,检测波长280 nm;流动相为A:40 mmol/L磷酸二氢钠溶液(pH=7.8),B:V(甲醇)∶V(乙腈)∶V(水)=45∶45∶10。检测波长338 nm;柱温箱温度为40 ℃。
1.4.3 全自动微生物生长曲线分析仪检测
将不同L-高丝氨酸梯度的培养基与菌液加入到全自动微生物生长曲线分析仪配套的48孔板中,每个浓度设置3个重复孔,每孔加入1 mL培养基,以OD值0.1接种菌液,封闭后放置在全自动微生物生长曲线分析仪振荡培养。设置培养温度为32 ℃,振荡速度为800 r/min,每隔2 h自动扫描读取每个孔菌液的OD600值。测量结束后导出数据,绘制生长曲线。
2 结果与分析
2.1 谷氨酸棒杆菌对L-高丝氨酸胁迫响应
微生物在发酵过程中会面临不同类型的环境胁迫,包括pH值、温度、渗透压胁迫等。然而,高水平的终产物积累不可避免地导致渗透胁迫,并阻碍L-高丝氨酸产量的进一步提高[15]。为了探讨L-高丝氨酸对谷氨酸棒杆菌的影响,我们监测了谷氨酸棒杆菌ATCC 13032在含有不同浓度L-高丝氨酸的CGXII培养基中的生长情况。如图1所示,谷氨酸棒杆菌生长前期会受到L-高丝氨酸的抑制,并且随着L-高丝氨酸浓度的增加,对菌株生长抑制明显增强。24 h 120 g/L处理条件下的菌株生物量较未处理组降低36%,160 g/L处理条件下该菌的生物量较未处理组降低91%。虽然随着时间增加,抑制效果减弱,但是60 h 160 g/L L-高丝氨酸处理组菌株的生物量仍比0 g/L处理组降低17%。这表明高浓度的L-高丝氨酸会抑制细胞生长,因此L-高丝氨酸外排蛋白的挖掘尤为重要。
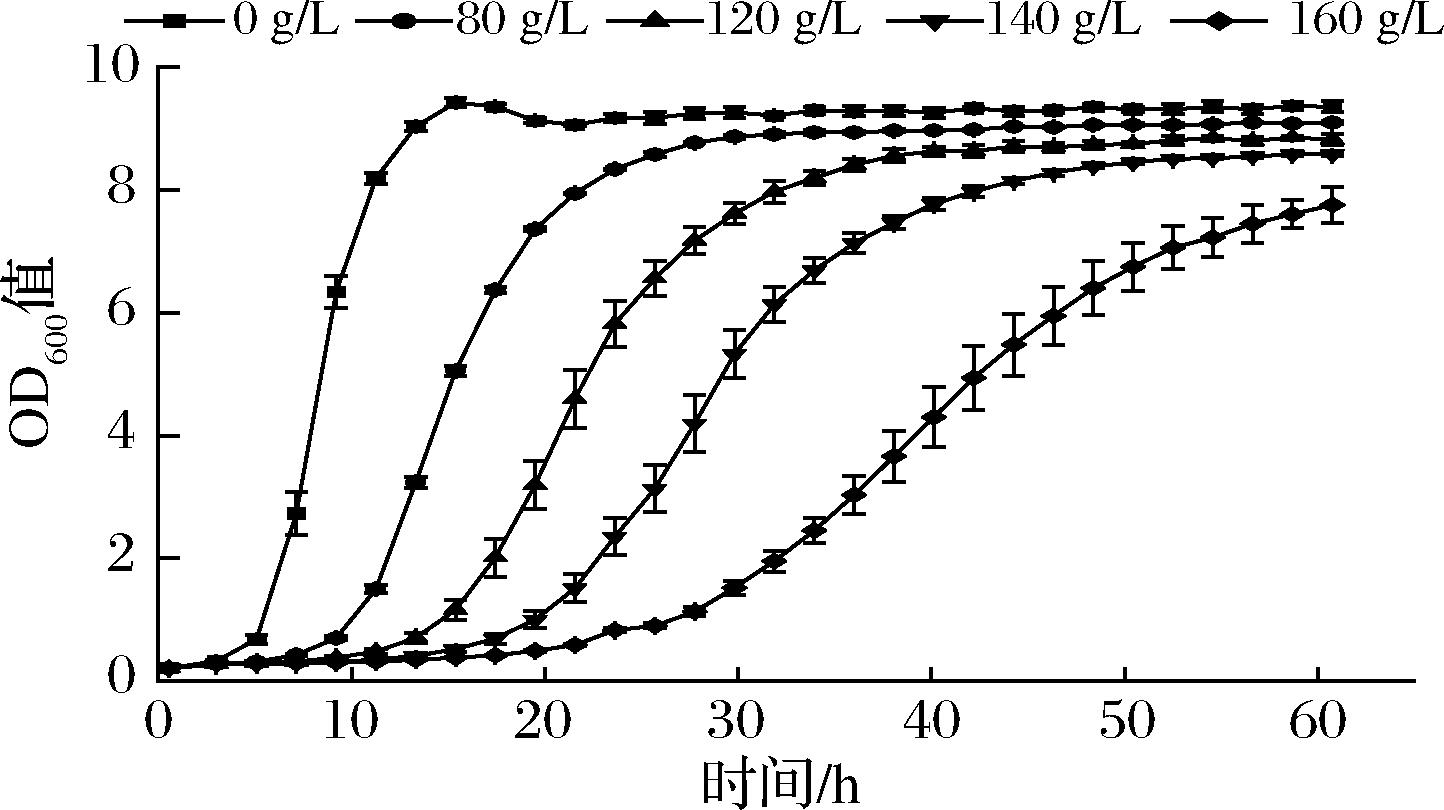
图1 谷氨酸棒杆菌在不同浓度L-高丝氨酸迫胁迫下的细胞生长情况
Fig.1 Cell growth of C.glutamicum under different concentrations of L-homoserine stress
2.2 谷氨酸棒杆菌L-高丝氨酸转运蛋白的挖掘
系统挖掘谷氨酸棒杆菌中L-高丝氨酸转运蛋白对解除细胞负反馈抑制、进一步提升L-高丝氨酸的产量至关重要,而基于蛋白序列的相似性挑选合适的转运蛋白也是常用手段。最初在大肠杆菌中发现RhtA、RhtB、RhtC可外排L-苏氨酸和其他支链氨基酸[16],后来有研究表明这3种蛋白对L-高丝氨酸同样有效[11]。BrnQ直接参与L-苏氨酸转运[17],SdaC是已知特异性转运L-丝氨酸的蛋白[18],由于L-苏氨酸和L-丝氨酸之间的结构相似性,它们通常具有相同的运输系统,而L-高丝氨酸作为L-苏氨酸合成的前体,被认为与其有相似的结构。故推测BrnQ蛋白、SdaC蛋白可能对L-高丝氨酸有一定的转运能力。基于以上推测,在NCBI数据库中进行BLAST序列同源性比对,挖掘谷氨酸棒杆菌中与RhtA、RhtB、RhtC、BrnQ、SdaC有较高同源性的蛋白,筛选出7个谷氨酸棒杆菌中可能参与L-高丝氨酸转运的蛋白。由brnF和brnE双组分编码的支链氨基酸转运蛋白能够非特异性向胞外转运支链氨基酸和蛋氨酸,已有研究表明过表达brnFE基因可使L-高丝氨酸的产量提高2倍,达到3 g/L[19]。AzlCD与BrnFE同属于LIV-E家族[20];LysE是谷氨酸棒杆菌中第一个被鉴定出来的氨基酸转运蛋白[21],与RhtB同属LysE家族[22],所以推测AzlCD、BrnFE和LysE也可能参与L-高丝氨酸的转运。10个候选谷氨酸棒杆菌L-高丝氨酸转运蛋白的详细信息见表3。
表3 候选谷氨酸棒杆菌L-高丝氨酸转运蛋白
Table 3 Candidate C.glutamicum L-homoserine transporter

查询描述(protein from C.glutamicum ATCC 13032)识别/%E值E.coli RhtACg0701:permease of the drug/metabolite transporter(DMT)superfamily;EamA domain;multidrug resistance efflux transporter39.623e-37E.coli RhtACg2356:permease of the drug/metabolite transporter(DMT)superfamily;EamA domain;multidrug resistance efflux transporter31.884e-21E.coli RhtBCg2941:LysE type translocator;amino acid exporter protein29.763e-14E.coli RhtBCg0183:LysE type translocator;amino acid exporter protein24.346e-08E.coli RhtCCg2574:LysE type translocator;amino acid exporter protein30.001e-28E.coli BrnQCg2537:branched-chain amino acid uptake carrier;isoleucine uptake carrier31.975e-60E.coli SdaCCg0568:tryptophan/tyrosine permease family;permease for amino acids and related compounds33.330.018 -BrnFE:two-component export permease specific for aliphatic hydrophobic amino acid-- -AzlCD:branched-chain amino acid transport protein-- -LysE:L-lysine exporter family protein LysE/ArgO;lysine efflux permease--
2.3 候选L-高丝氨酸外排蛋白基因的鉴定和表征
2.3.1 候选蛋白基因过表达对大肠杆菌L-高丝氨酸耐受性影响
转运蛋白间会有功能冗余或互补,以一个特定转运蛋白缺陷菌为出发菌,筛选某种转运蛋白是常用的策略。ΔABC是实验室保存的一个大肠杆菌三重高丝氨酸转运缺陷突变体(敲除rhtA、rhtB、rhtC)。RhtA是大肠杆菌中L-高丝氨酸高效且主要的转运蛋白,而RhtB和RhtC对L-高丝氨酸的转运活性相对较弱[11]。三敲菌株对L-高丝氨酸培养基最为敏感,适合筛选L-高丝氨酸转运蛋白。构建10个候选蛋白基因的过表达质粒并转化到ΔABC中,监测各菌株在不同浓度L-高丝氨酸的M9培养基中的生长情况。如图2所示,在0 g/L L-高丝氨酸的处理组中,所有菌株的生长情况并没有明显差异。但是在1 g/L L-高丝氨酸处理组中,brnFE和azlCD过表达菌株的生物量明显高于其他菌株,24 h brnFE过表达菌株的OD600值为4.86,azlCD过表达菌株的值OD600值为4.27,而空对照组菌株的OD600值仅为0.32。推测BrnFE和AzlCD为谷氨酸棒杆菌潜在的L-高丝氨酸转运蛋白。
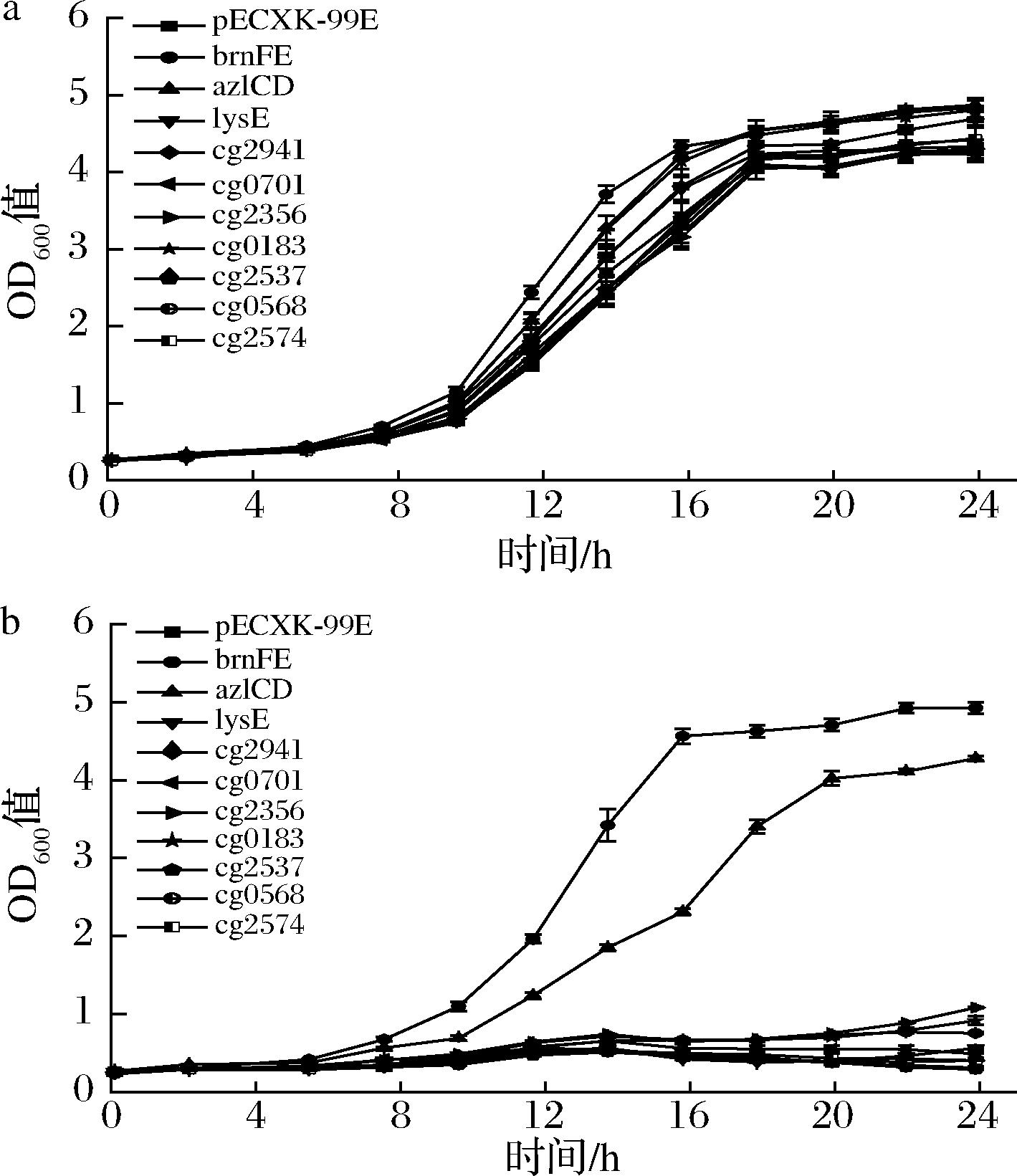
a-0 g/L L-高丝氨酸;b-1 g/L L-高丝氨酸
图2 候选蛋白基因过表达对大肠杆菌ΔABC L-高丝 氨酸耐受性影响
Fig.2 Tolerance effects of L-homoserine of E.coli ΔABC strain with overexpression candidate protein gene
2.3.2 候选蛋白基因敲除对谷氨酸棒杆菌L-高丝氨酸耐受性影响
在谷氨酸棒杆菌H100中分别敲除了10个待测蛋白的基因,将得到的菌株在添加了不同浓度L-高丝氨酸的CGXⅡ培养基中培养并监测其生长情况。结果如图3所示,在0 g/L L-高丝氨酸处理组中,所有菌株的生长情况并无明显差异。在1 g/L L-高丝氨酸处理24 h后,lysE敲除菌的生物量较对照组下降了16%,这可能是由于L-高丝氨酸在胞内的过度积累所导致。而brnFE、azlCD的生物量相对于对照组均无明显差异,推测LysE是谷氨酸棒杆菌中重要的L-高丝氨酸转运蛋白。
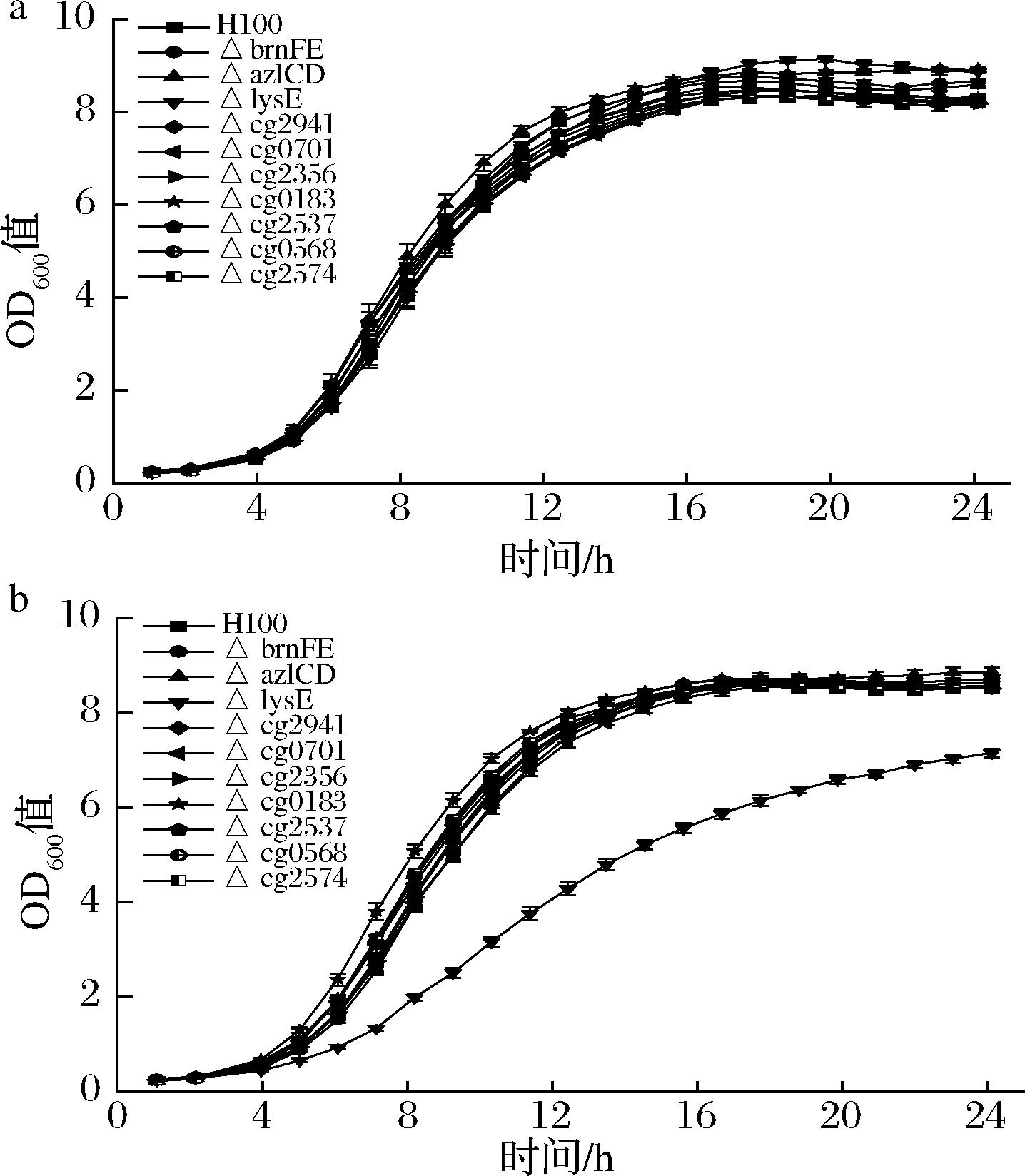
a-0 g/L L-高丝氨酸;b-1 g/L L-高丝氨酸
图3 候选转运蛋白基因敲除菌株对谷氨酸棒杆菌H100 L-高丝氨酸耐受性影响
Fig.3 Tolerance effects of L-homoserine of C.glutamicum H100 strain with deletion of candidate protein gene
2.3.3 低拷贝质粒pMW118-lysE对大肠杆菌L-高丝氨酸耐受性的影响
经过研究发现过表达LysE没有明显提高大肠杆菌ΔABC对L-高丝氨酸耐受能力,但敲除lysE会使谷氨酸棒杆菌H100对L-高丝氨酸耐受能力显著增强,推测可能是由于pECXK-99E质粒拷贝数太高,lysE基因表达不合适。所以本研究使用低拷贝质粒pMW118-lysE,在大肠杆菌ΔABC中以相同的条件测试。结果如图4所示,在0 g/L L-高丝氨酸处理的条件下菌株的生物量无明显差异,在1 g/L L-高丝氨酸处理条件下pMW118-lysE菌株生物量较空白对照提高了近2倍,与体内实验结果相吻合。
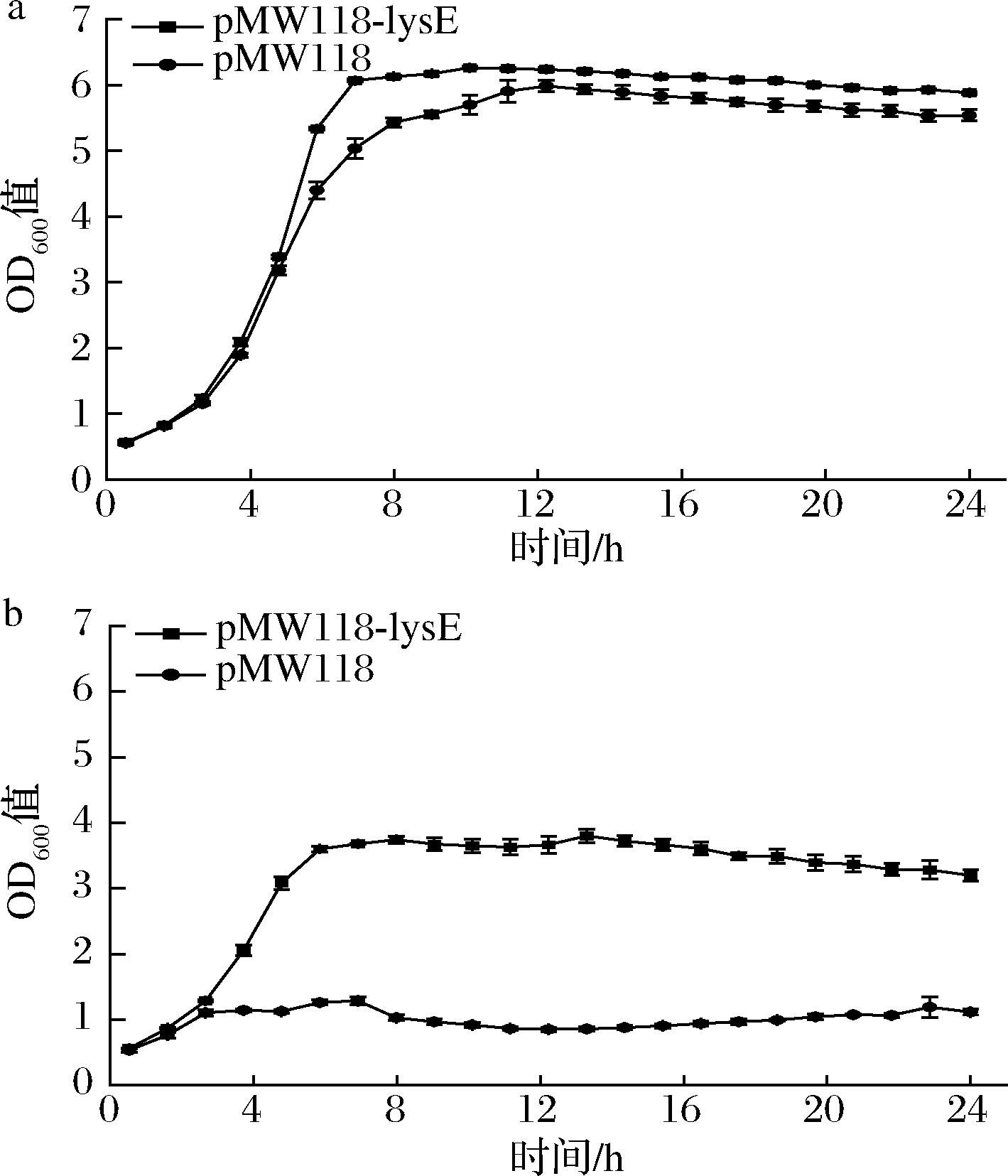
a-0 g/L L-高丝氨酸;b-1 g/L L-高丝氨酸
图4 低拷贝质粒对大肠杆菌ΔABC L-高丝氨酸耐受性影响
Fig.4 Tolerance effects of L-homoserine of E.coli ΔABC strain with low-copy plasmid
2.4 LysE的结构预测及跨膜区分析
使用SWISS-MODEL在线网站进行LysE结构预测,发现目的蛋白与lysine exporter LysE(P94633.1A)之间的序列覆盖度为1,同源性为100%,故认为目的蛋白与lysine exporter LysE的结构一致(图5-a);使用UniProt在线网站对LysE的生物学信息进行分析。LysE属于LysE/ArgO transporter family,由233个氨基酸残基组成。在运输过程受膜电位、赖氨酸的化学电位和质子梯度3种力的调节。使用TMpred Sever 2.0对LysE跨膜结构进行预测,如图5-b所示,LysE蛋白第4~27位氨基酸形成第一个跨膜螺旋(TM1),第35~58位氨基酸形成第2个跨膜螺旋(TM2),第66~88位氨基酸形成第3个跨膜螺旋(TM3),第143~166位氨基酸形成第4个跨膜螺旋(TM4),第178~201位氨基酸形成第5个跨膜螺旋(TM5),第213~233位氨基酸形成第6个跨膜螺旋(TM6)。
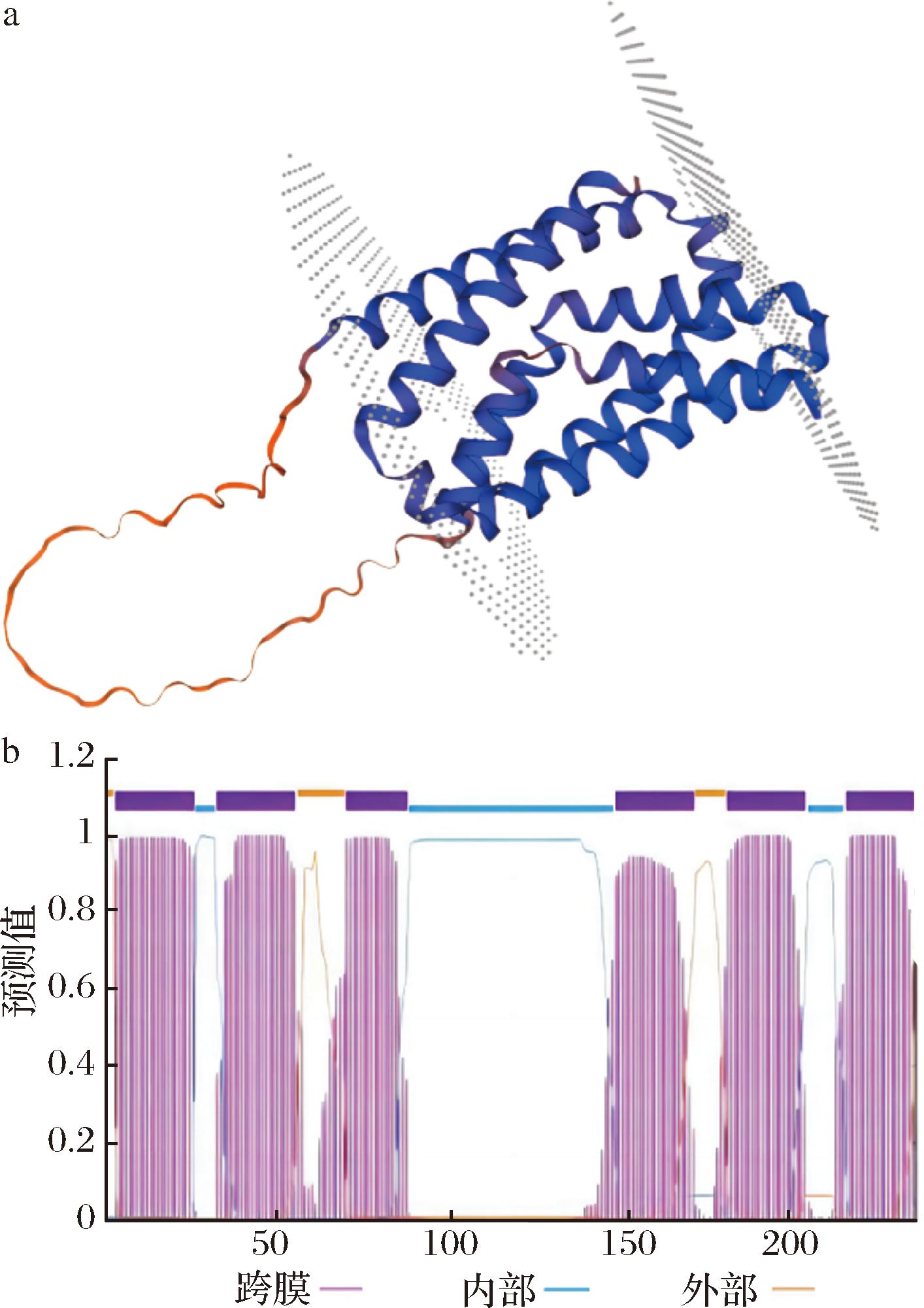
a-LysE的3D结构预测图;b-LysE的跨膜螺旋区预测图
图5 LysE的结构预测及跨膜区分析
Fig.5 Structure prediction and transmembrane analysis of LysE
2.5 LysE外排转运活性的测试
结合体外体内菌株对L-高丝氨酸耐受性的实验结果,推测LysE为谷氨酸棒杆菌L-高丝氨酸转运蛋白,故进一步对LysE进行外排转运活性测试。由图6 可知,谷氨酸棒杆菌H100和lysE基因敲除菌的L-高丝氨酸排出量均随着时间的增加而增加,但lysE基因敲除菌的L-高丝氨酸的外排量均不及H100。在60 min时,lysE基因缺失菌排出的L-高丝氨酸的含量较对照组H100降低了18%。综上所述,LysE具有外排L-高丝氨酸的能力。
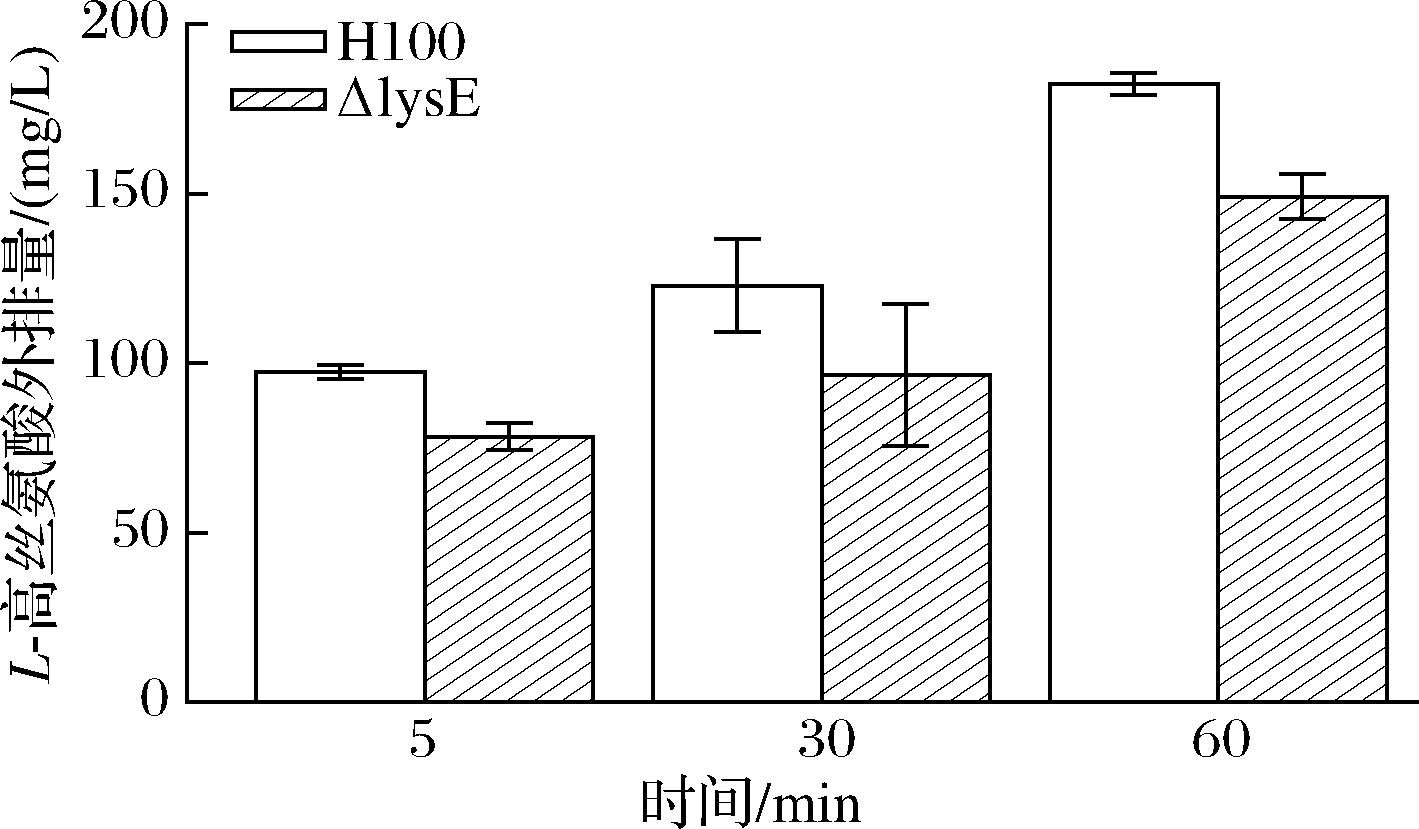
图6 LysE的L-高丝氨酸输出活性测定
Fig.6 Determination of L-homoserine efflux activity of LysE
2.6 LysE对L-高丝氨酸发酵产量的影响
氨基酸的高效外排不仅能增强菌株对底物氨基酸的耐受性,还能提升氨基酸的产量,是构建高效微生物细胞工厂的有效方法。本研究中,将启动子Psod整合到谷氨酸棒杆菌H100基因组中的lysE基因前,以增强lysE基因的表达。将得到的菌株进行摇瓶发酵,探究lysE敲除和过表达对L-高丝氨酸产量的影响。结果如图7所示,lysE基因敲除菌的生物量较H100提高31%,L-高丝氨酸产量较H100降低了65%;lysE过表达菌株生物量与H100差异不大而L-高丝氨酸产量较对照组提高了22%。这不仅进一步验证了LysE参与L-高丝氨酸转运,更为后续建立L-高丝氨酸细胞工程提供有效靶点。
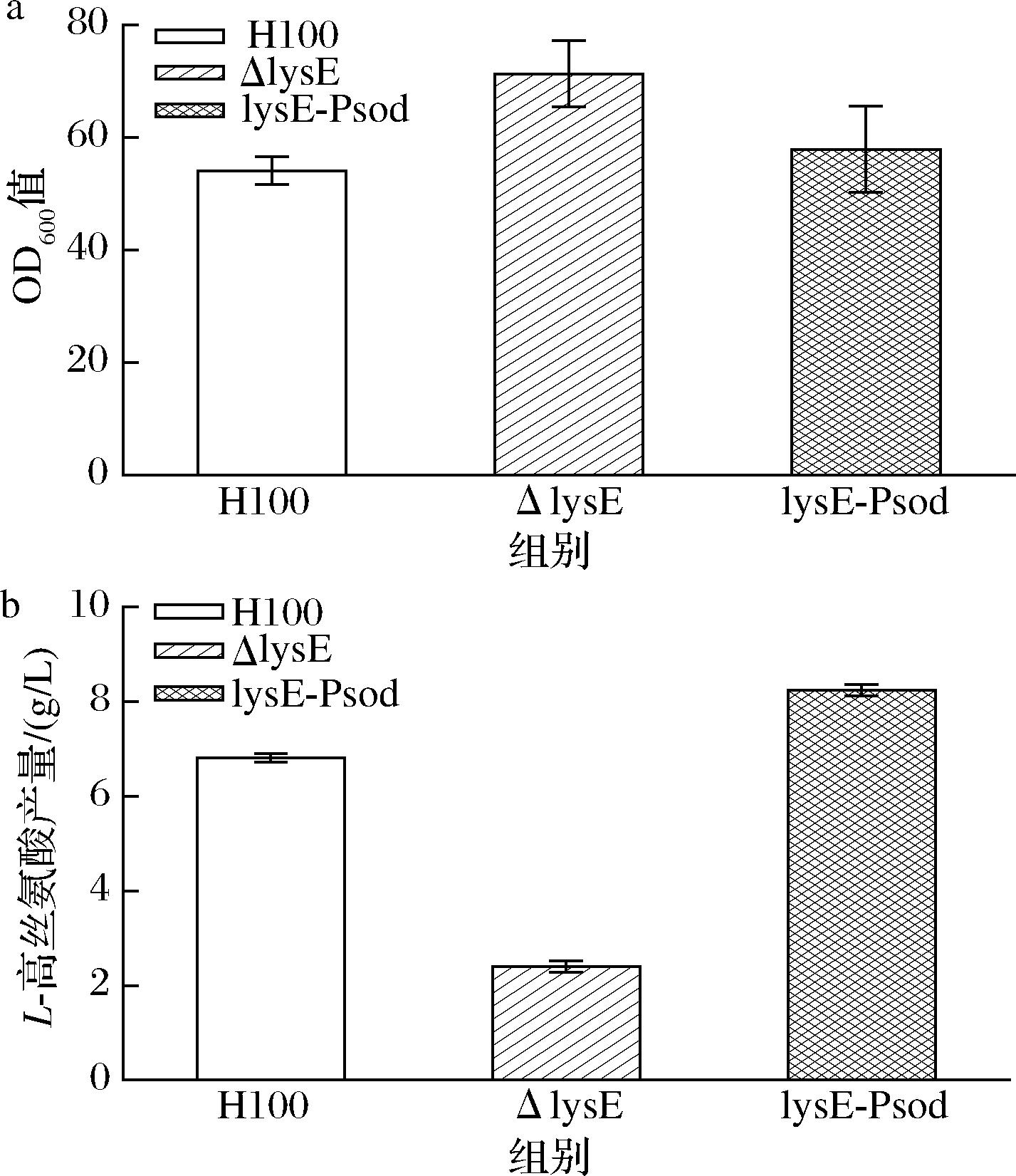
a-生物量(OD600值);b-L-高丝氨酸产量
图7 lysE敲除和过表达对L-高丝氨酸产量的影响
Fig.7 Effects of L-homoserine production with deletion and overexpression lysE
3 结论与讨论
本研究通过生物信息学分析筛选出10个候选L-高丝氨酸转运蛋白的基因,结合体外体内L-高丝氨酸耐受性生长实验推测LysE可能是谷氨酸棒杆菌中有效的L-高丝氨酸转运蛋白。接着对LysE进行外排能力测试后发现与对照组相比,lysE基因敲除菌外排L-高丝氨酸的能力显著下降,说明LysE具有转运L-高丝氨酸的能力。最后,我们探究了lysE对L-高丝氨酸产量的影响。在L-高丝氨酸生产菌中敲除lysE可显著降低L-高丝氨酸产量,而过表达lysE则使L-高丝氨酸产量较对照组有明显提高。之前的研究表明,LysE属于LysE超家族,RhtB、CadD都属于此家族成员[22]。LysE的转录受LysG调控,可转运L-赖氨酸、L-精氨酸等氨基酸[23]。LysE在转运赖氨酸的过程中并不识别手性,所以既能转运L-赖氨酸也能转运D-赖氨酸[24]。LysE还参与了L-瓜氨酸和L-鸟氨酸的转运,过表达lysE可增强L-瓜氨酸和L-鸟氨酸的产量[25]。本研究综合实验结果得出LysE在谷氨酸棒杆菌中具有转运L-高丝氨酸的能力,扩展了对LysE转运蛋白的认识,为开发高效的L-高丝氨酸细胞工厂提供了新靶点。
随着高效微生物细胞工厂的建立,终产物的过度积累不可避免的引发细胞内的渗透胁迫,对细胞的生长产生不利影响。转运蛋白的挖掘和改造是提升微生物菌株耐受性和生物制造效率的有效策略。后续将对LysE进行蛋白质工程改造,筛选高丝氨酸转运活性提高的突变体,解析其转运催化机制,为进一步提升L-高丝氨酸产量奠定基础。
[1] PARK S D, LEE J Y, SIM S Y, et al.Characteristics of methionine production by an engineered Corynebacterium glutamicum strain[J].Metabolic engineering, 2007, 9(4):327-336.
[2] SUN B Y, WANG F Q, ZHAO J, et al.Engineering Escherichia coli for L‐homoserine production[J].Journal of Basic Microbiology, 2023, 63(2):168-178.
[3] 张辉, 朱莉莉.L-草铵膦化学合成研究进展[J].农药学学报, 2024, 26(1):1-7.ZHANG H, ZHU L L.Research progress on chemical synthesis of L-glufosinate[J].Chinese Journal of Pesticide Science, 2024, 26(1):1-7.
[4] AREZKI N R, WILLIAMS A C, COBB A J A, et al.Design, synthesis and characterization of linear unnatural amino acids for skin moisturization[J].International Journal of Cosmetic Science, 2017, 39(1):72-82.
[5] 陶德良, 邓燕, 谢维跃, 等.L-高丝氨酸的合成[J].化工时刊, 2007,21(1):33-34.TAO D L, DENG Y, XIE W Y, et al.Synthesis of L-homoserine[J].Chemical Industry Times, 2007,21(1):33-34.
[6] LIU M, LOU J, GU J L, et al.Increasing L-homoserine production in Escherichia coli by engineering the central metabolic pathways[J].Journal of biotechnology, 2020, 314-315:1-7.
[7] LIU Z F, CAI M M, ZHOU S Q, et al.High-efficient production of L-homoserine in Escherichia coli through engineering synthetic pathway combined with regulating cell division[J].Bioresource Technology, 2023, 389:129828.
[8] VO T M, PARK S.Metabolic engineering of Escherichia coli W3110 for efficient production of homoserine from glucose[J].Metabolic Engineering, 2022, 73:104-113.
[9] MU Q X, ZHANG S S, MAO X J, et al.Highly efficient production of L-homoserine in Escherichia coli by engineering a redox balance route[J].Metabolic Engineering, 2021, 67:321-329.
[10] LIVSHITS V A, ZAKATAEVA N P, ALESHIN V V, et al.Identification and characterization of the new gene rhtA involved in threonine and homoserine efflux in Escherichia coli[J].Research in Microbiology, 2003, 154(2):123-135.
[11] DING C, ZHANG J W, QIAO J F, et al.Identification and engineering efflux transporters for improved L-homoserine production in Escherichia coli[J].Journal of Applied Microbiology, 2023, 134(4):lxad075.
[12] 王钰, 郑平, 孙际宾.谷氨酸棒杆菌的代谢工程使能技术研究进展[J].生物工程学报, 2021, 37(5):1603-1618.WANG Y, ZHENG P, SUN J B.Recent advances in developing enabling technologies for Corynebacterium glutamicum metabolic engineering[J].Chinese Journal of Biotechnology, 2021, 37(5):1603-1618.
[13] 张晓梅, 高宇洁, 杨玲, 等.谷氨酸棒杆菌中氨基酸分泌转运蛋白及其代谢改造研究进展[J].生物工程学报, 2020, 36(11):2250-2259.ZHANG X M, GAO Y J, YANG L, et al.Amino acid exporters and metabolic modification of Corynebacterium glutamicum—A review[J].Chinese Journal of Biotechnology, 2020, 36(11):2250-2259.
[14] OKIBE N, SUZUKI N, INUI M, et al.Efficient markerless gene replacement in Corynebacterium glutamicum using a new temperature-sensitive plasmid[J].Journal of Microbiological Methods, 2011, 85(2):155-163.
[15] LI H, WANG B S, ZHU L H, et al.Metabolic engineering of Escherichia coli W3110 for L-homoserine production[J].Process Biochemistry, 2016, 51(12):1973-1983.
[16] 沈观宇, 吴绵斌, 林建平, 等.氨基酸生产菌的氨基酸外向转运蛋白研究进展[J].高校化学工程学报, 2018, 32(6):1245-1254.SHEN G Y, WU M B, LIN J P, et al.Advances in amino acid exporters of amino acid-producing bacteria[J].Journal of Chemical Engineering of Chinese Universities, 2018, 32(6):1245-1254.
[17] KHOZOV A A, BUBNOV D M, PLISOV E D, et al.A study on L-threonine and L-serine uptake in Escherichia coli K-12[J].Frontiers in Microbiology, 2023, 14:1151716.
[18] KRINER M A, SUBRAMANIAM A R.The serine transporter SdaC prevents cell lysis upon glucose depletion in Escherichia coli[J].Microbiology Open, 2020, 9(2):e960.
[19] LI N, XU S, DU G C, et al.Efficient production of L-homoserine in Corynebacterium glutamicum ATCC 13032 by redistribution of metabolic flux[J].Biochemical Engineering Journal, 2020, 161:107665.
[20] KENNERKNECHT N, SAHM H, YEN M R, et al.Export of L-isoleucine from Corynebacterium glutamicum:A two-gene-encoded member of a new translocator family[J].Journal of Bacteriology, 2002, 184(14):3947-3956.
[21] VRLJIC M, SAHM H, EGGELING L.A new type of transporter with a new type of cellular function:L-lysine export from Corynebacterium glutamicum[J].Molecular microbiology, 1996, 22(5):815-826.
[22] TSU B V, JR SAIER M H.The LysE superfamily of transport proteins involved in cell physiology and pathogenesis[J].PloS One, 2015, 10(10):e0137184.
[23] ST BLER N, OIKAWA T, BOTT M, et al.Corynebacterium glutamicum as a host for synthesis and export of D-amino acids[J].Journal of Bacteriology, 2011, 193(7):1702-1709.
BLER N, OIKAWA T, BOTT M, et al.Corynebacterium glutamicum as a host for synthesis and export of D-amino acids[J].Journal of Bacteriology, 2011, 193(7):1702-1709.
[24] BELLMANN A, ![]() M, P
M, P TEK M, et al.Expression control and specificity of the basic amino acid exporter LysE of Corynebacterium glutamicum[J].Microbiology, 2001, 147(Pt7):1765-1774.
TEK M, et al.Expression control and specificity of the basic amino acid exporter LysE of Corynebacterium glutamicum[J].Microbiology, 2001, 147(Pt7):1765-1774.
[25] ZHANG B, REN L Q, YU M, et al.Enhanced L-ornithine production by systematic manipulation of L-ornithine metabolism in engineered Corynebacterium glutamicum S9114[J].Bioresource Technology, 2018, 250:60-68.