姜黄为药食同源食物,姜黄素是一种从姜黄根茎提取的天然的植物多酚,具有二酮结构。姜黄素在酸性条件下性质稳定,在中性和碱性条件下易分解。姜黄素的提取方法主要包括溶剂提取法和微波辅助提取法[1],目前最准确的定量定性检测方法为高效液相色谱法。姜黄素作为一种世界销量第一的天然食用色素,其着色能力强,是世界卫生组织和多国准许使用的食品添加剂。姜黄素的应用领域包括食品、医学与动物生产。在食品领域,主要用于复合调味料、面制品、肉制品的染色与保鲜。在中医领域中,姜黄素被认为是具有良好医疗药用价值的药食同源原料,在慢性疾病和癌症方面有一定的预防和治疗作用。此外,在动物生产方面,在饲料里添加姜黄素可提升动物的生产性能与抵抗能力,有效提高畜禽产品的质量和安全性。现有的研究皆指出姜黄素具有抗肿瘤、抗炎、降血糖、抗氧化、抗菌和调节机体代谢等广泛的功能特性[2],但由于姜黄素较不稳定且水溶性差,导致其应用范围具有局限性。目前提高姜黄素水溶性主要体现在制剂过程中的增溶技术,现有的增溶技术主要包含固体分散技术、脂质体技术、包合技术、多重包埋微胶囊化技术、乳液凝胶技术等。增溶技术的开发有助于改善姜黄素水溶性差的特性,然而这些增溶技术具有包埋率低、制备工艺繁杂等缺点。近年来,纳米递送系统发展迅速,与传统技术相比,其载体尺寸小、能够同时负载多种药物及提高药物靶向性,从而提高生物利用率。
1 姜黄素的理化性质与提取
1.1 姜黄素的理化性质
姜科姜黄属植物根茎的提取物中,除姜黄素(77%)之外,主要成分还包括脱甲氧基姜黄素(17%)以及双脱甲氧基姜黄素(3%)[1]。3种成分的分子结构类似,其结构式见图1。姜黄素的着色力较好,被我国列为准许食用的天然着色剂,但是姜黄素的性质较不稳定,易受pH值的影响。例如在酸性条件下姜黄素的性质较稳定,但在中性和碱性条件下,姜黄素色泽由黄变红是由于分子两端的羟基会发生电子云偏离的共轭效应[3],造成着色变化。不仅如此,姜黄素在光、热等环境下也会发生降解,容易与金属离子发生螯合反应,所以在贮存时色素性能损失较多[1]。
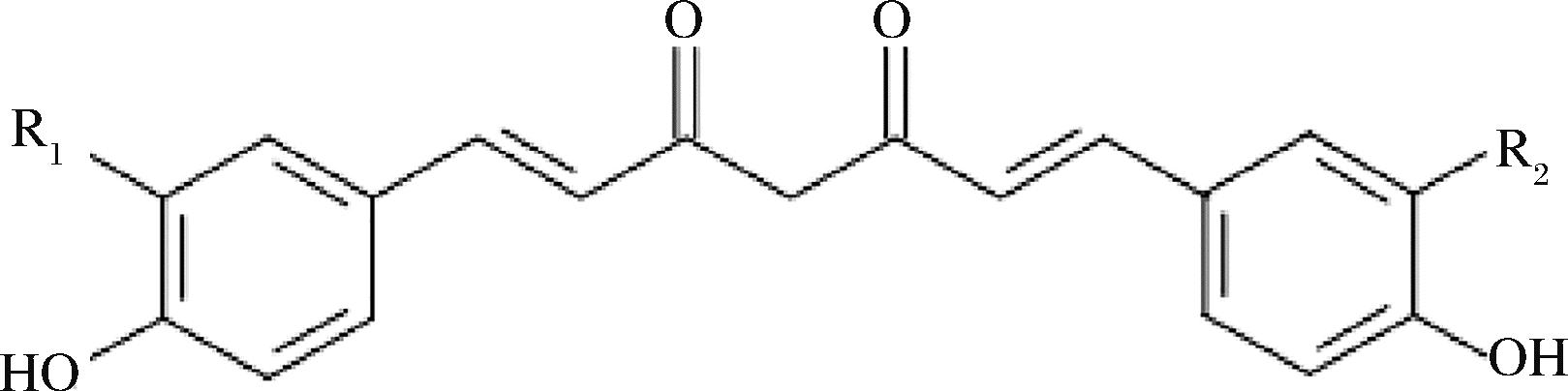
图1 类姜黄素的分子结构式
Fig.1 Molecular structure of curcuminoids
注:姜黄素R1=R2=OCH3;去甲氧基姜黄素R1=H,R2=OCH3; 去二甲氧基姜黄素R1=R2=H。
1.2 姜黄素的提取
目前,溶剂提取法、微波辅助提取法、超声强化微乳提取法、超声波辅助提取法、离子液体辅助酶法、酶协同超声波法、闪式提取法和超临界二氧化碳提取法等都是常见的姜黄素提取方法[4](表1)。其中应用较为广泛的是溶剂提取法和微波辅助提取法,而离子液体辅助酶法是现在较新颖的方法。
表1 姜黄素提取方法的特点
Table 1 Features of curcumin extraction methods

提取方法萃取率/%特点参考文献溶剂提取法1.80~3.56操作简单,反应条件可控,但反应温度过高会破坏所需结构,得到的姜黄素浸膏不易干燥[5]微波辅助提取法1.01~4.98微波辅助提取与传统提取方法相比,其具有提取姜黄素精密度高,得率高、耗时短、溶剂消耗小的特点[6]超声波辅助提取法0.92~4.69该方法可缩短提取时间、提高提取率,且可避免有效成分因高温被破坏,操作方便[7]酶提取法3.58~5.73该方法产物回收率高、溶剂用量少,但酶的反应条件要求较高,酶解反应时间长[6,8]离子液体提取法5.30~6.14该方法绿色环保,稳定性好,与传统溶剂提取相比提取时间减少[9]超临界流体提取法1.46~4.30操作简单,无有机溶剂残留,产品稳定性强,但设备昂贵,不利于批量应用[10]
2 姜黄素的功能特性
2.1 抗肿瘤
根据研究及大量实验证明姜黄素具有抑制多种肿瘤细胞的能力。姜黄素被报道可以减少血管生成、肿瘤生长和转移,对放疗和化疗中引起的炎症有明显的缓解作用。这种促使肿瘤细胞对放疗和化疗敏感的能力,使姜黄素成为了癌症治疗辅佐剂的良好选择[11]。2022年,张雅文等[12]通过Cell Counting Kit-8试剂(CCK8法)检测不同浓度的姜黄素对骨肉瘤细胞的作用效果,研究姜黄素对骨肉瘤细胞增殖以及相关蛋白表达的影响,实验证明姜黄素能够显著抑制骨肉瘤细胞的增殖。慢性炎症会增加患癌风险,姜黄素凭借其抗炎特性,在一定程度上预防癌症的发生。姜黄素对各个时期的癌症都有一定的抑制作用,有研究表明姜黄素和其他类型的化疗药物复配使用具有协同作用,可以增强化疗效果,且可以在一定程度上削弱其他化疗药物带来的副作用如改善化疗引起的胃肠道毒性、心脏毒性、肝肾毒性、骨髓抑制、神经毒性和遗传毒性[13],但由于姜黄素的生物利用率较低,无法靶向到达目的组织,导致姜黄素可发挥的功效降低。因此,利用新型包埋复配技术,对姜黄素进行保护,使其到达目的组织正常释放或持续缓释,是目前较为热门的研究方向。最近一项研究通过静电纺丝纳米纤维包封姜黄素,实行药物递送,可以长期提供治疗浓度的姜黄素,对诱导乳腺癌细胞凋亡有显著的效果[14]。在对于结肠癌的治疗方面,CORRIE等[15]利用姜黄素与粪便菌群结合,形成结肠靶向固体自纳米乳化给药系统,使其在结肠处特异性进行姜黄素释放,避开胃肠消化代谢,针对结肠部位进行治疗,结果表明姜黄素的结肠靶向固体自纳米乳化给药系统能够有效治疗结肠直肠类疾病。姜黄素有着显著的抗癌活性,这一类新型姜黄素治疗产品的研发,也为治疗癌症提供了更多的选择。
2.2 抗炎
姜黄素具有抗炎作用,特别是针对肿瘤细胞引发的炎症和创伤性关节炎等具有良好的治疗效果。姜黄素作为一种非甾体类抗炎药[16],主要通过抑制环氧化酶、脂氧化酶等酶的生理活性从而抑制细胞内各种炎症介质的产生。姜黄素的主要靶标是在调节炎症方面发挥着重要作用的核因子κB(nuclear factor kappa-B,NF-κB)和诱导型一氧化氮合酶(iNOS)。姜黄素通过抑制NF-κB的表达,改善前列腺素和脂氧合酶的代谢,降低自由基的产生。另有研究表明iNOS具有通过专一的DNA糖基化酶降低硝化DNA损伤产物生成的作用,而硝化的DNA损伤产物是炎症驱动肿瘤生成的关键物质。因此,姜黄素通过诱导iNOS的表达,具有缓解诱导肿瘤细胞凋亡期间引发的慢性炎症反应的潜能。同时,姜黄素还通过抑制炎症细胞因子如白细胞介素-1(interleukin-1,IL-1)和坏死因子-α(tumor necrosis factor-α,TNF-α)的表达,缓解炎症的发生与发展[11]。此外,姜黄素作为一种天然膳食抗炎化合物,可有效参与调节关节炎发病过程中的一系列自身免疫反应[17]。WANG等[18]等证明了姜黄素通过抑制NF-κB信号通路抑制巨噬细胞的炎症反应,进而对由胶原蛋白诱导的大鼠关节炎有显著的改善。同时,姜黄素还显著诱导巨噬细胞的凋亡,有效减轻大鼠关节肿胀和关节炎病的进一步发展[19]。另外,姜黄素在其他炎症中也起着重要的调节作用。PORRO等[20]通过脂多糖诱导小鼠小胶质细胞炎症模型,探究姜黄素对其中炎症相关因子的表达调控。结果显示姜黄素可以促进小胶质细胞抗炎因子IL-4和IL-10的产生。同时还通过激活上调细胞因子信号转导抑制因子-1的表达,降低Janus蛋白酪氨酸激酶2的信号传导和转录激活因子3的磷酸化,抑制小胶质细胞抗炎反应,改善神经炎症的发生[20]。简单来说,姜黄素抗炎功效的发挥通过多种调控机制达成,如调节机体内炎症相关因子的表达,抑制促炎因子的产生和调节炎症因子相关酶的活性。因此,姜黄素是典型的抗炎药物成分。
2.3 降血糖
在调节血糖水平和改善胰高血糖症方面,姜黄素主要是通过促进胰岛素分泌和增加胰岛素靶细胞对胰岛素的敏感性2种作用机制改善胰岛素抵抗,从而起到改善血糖水平的作用[16]。刘虎军等[21]经研究实验发现降低患糖尿病大鼠的血糖水平,姜黄素通过抑制NF-κB 信号通路激活来保护胰岛β细胞,维持胰岛素的正常分泌。NF-κB 是激活炎症反应的主要调控因子,细胞核转录因子 κB抑制蛋白激酶是 NF-κB 活化的调节器,同时也是胰岛素受体和胰岛素受体底物丝氨酸磷酸化激酶,是姜黄素抗炎的主要靶点[22]。SHEHZAD 等[23]通过实验证明姜黄素可以抑制 IκB激酶,从而NF-κB的核位移,改善患糖尿病大鼠的胰岛素抵抗,抑制炎症的发生。另外,姜黄素和胰岛素协同治疗,还可以避免慢性胰岛素的不良反应,有效减少单独胰岛素治疗引起的血脂异常、组织损伤和氧化应激反应,为预防和治疗糖尿病相关并发症提供一个新的研究[24]。除此之外,姜黄素还可有效改善胰高血糖症诱导的脊髓小胶质细胞形态学变化,并改善高血糖环境对机体脊髓损伤后功能恢复的抑制作用。研究表明在大鼠脊髓损伤模型中,姜黄素显著改善高血糖症脊髓损伤引发的炎症反应和氧自由基水平的同时,抑制星形胶质的增生,在助于神经功能恢复方面起到了潜在的保护作用[25]。因此,姜黄素不仅可以有效降低机体血糖水平,还可以改善由高血糖引起的机体损伤。
2.4 抗氧化
姜黄素对氧自由基的清除作用和促进抗氧化酶的合成作用,是其发挥抗氧化活性作用的根本,因此姜黄素具有改善机体氧化损伤的潜能。有研究表明姜黄素作为一种强大的抗氧化剂,在许多细胞和动物模型中都可降低机体内丙二醛、蛋白质碳基和硫醇等过氧化物产物的水平。欧海龙等[26]经高脂饮食对小鼠诱导实验证明了超氧化物歧化酶、过氧化氢酶等各种抗氧化酶在细胞内的含量显著提高,其可清除自由基、减少体内过氧化脂质、丙二醛等过氧化物的生成。进一步说,姜黄素还通过刺激抗氧化酶如超氧歧化酶和谷胱甘肽过氧化物酶的酶活性,发挥抗氧化作用[27]。除此之外,姜黄素还可以与其他物质协同作用,有效增加其稳定性和抗氧化活性。王明明等[28]在提升姜黄素生物利用率研究时发现,通过将姜黄素和亲水性的羟乙基淀粉偶联形成的两亲性偶联物组装成胶束纳米颗粒时,这种新型复配材料不仅显著提高姜黄素的抗氧化活性,还具有较好的载药效率和贮存稳定性,在提升姜黄素的生物利用率方面,发挥了重要作用[29]。同时在白藜芦醇与姜黄素协同治疗大鼠氧化损伤的试验中发现,相较于单独作用,协同作用不仅在抑制氧化损伤过程中起到积极的作用,同时还通过自由基清除有效逆转了由氟虫腈诱导的大鼠组织损伤[30]。因此,姜黄素的抗氧化活性在不同的体内和体外实验中得到证实,是一种既能有效减少过氧化物产物的生成,又可提高抗氧化酶的酶活性的多角度发挥抗氧化活性的多酚物质。
2.5 抗凋亡
细胞凋亡,也称为细胞编程性死亡,是一种由基因控制的细胞自我调节的过程,它可以在特定的生理环境中维持细胞内环境的稳定性[31]。HE等[30]在研究姜黄素对庆大霉素诱导的急性肾损伤大鼠时发现,姜黄素通过上调关键因子(核因子相关因子2和血红素加氧酶-1)的同时,沉默调节蛋白1等因子的表达,改善肾小管细胞的凋亡,从而改善急性肝损伤症状。同时在肾脏保护,特别是顺铂诱导大鼠肾损伤保护方面,姜黄素通过其抗细胞凋亡特性也起到了积极地肾脏保护作用。顺铂作为癌症化疗药物,会引起肾脏组织炎症的发生和细胞的凋亡,从而对机体造成一定的损伤。SOETIKNO等[32]的实验证实姜黄素通过抑制肾小管中Bax2(Bcl-2-associated X protein)蛋白的蛋白质和B淋巴细胞瘤-2比率的升高,有效减少肾脏细胞的凋亡。除了抑制化疗药物对肾脏保护细胞的损伤之外,在由神经毒性污染物丙烯酰胺诱导的大鼠脑损伤模型中,姜黄素的介入显著降低了中毒大鼠大脑中凋亡细胞的数量,说明姜黄素还被证明具有改善神经毒性诱导细胞凋亡的作用。因此,姜黄素可以通过调控细胞内的凋亡因子的表达和抑制信号通路传导2方面抑制细胞凋亡。
2.6 抗菌
此外,姜黄素还具有良好的抑菌作用,可以抑制多种细菌、真菌及部分寄生虫的生长。研究发现,姜黄素主要是通过诱导细菌发生膜去极化、诱导钙离子流入和利用生物膜渗透率这3种途径破坏细菌生物膜结构从而达到抑菌效果[33]。
有研究发现姜黄素达到其抑菌效果主要是通过细菌细胞膜去极化,同时破坏细菌的细胞膜结构。刘锋等[34]联合姜黄素与根皮素作用后显著降低细胞内乳酸脱氢酶的活性,导致细胞膜损伤程度加深,减少生物膜的生成,从而达到抑菌效果。任娇艳等[35]通过研究证明,姜黄素可以通过渗透作用破坏幽门螺杆菌的细胞膜结构,从而对其产生抑制作用。并且TYAGI等[36]研究指出姜黄素能够增加细菌细胞膜对药物的渗透性,破坏其内环境,增强杀菌作用。不过,有研究证实姜黄素通过破坏生物膜结构达到抑菌效果对以大肠杆菌为代表的革兰阴性菌作用欠佳。但是姜黄素与大多数测试的抗生素之间存在协同作用,尤其与头孢他啶组合效果最好,因此姜黄素也可作为一种组合策略,减少抗生素的耐药性[37]。现有研究主要集中于姜黄素与抗生素组合抑菌,既能更好发挥抗生素本身的抑菌活性,还可以增加对目标菌的易感性和减少机体对抗生素的耐药性。
2.7 代谢调节
姜黄素在机体的代谢调节特别是降低血脂和利胆等方面也起到了积极作用。姜黄素通过降低血浆中脂质的含量从而抑制脂质过氧化反应的进行[38]。脂质过氧化会导致一系列的新陈代谢紊乱和免疫功能降低,如糖尿病、气管炎等。另外,姜黄素还具有通过抑制过氧化物酶活性从而调控脂肪细胞分化的潜能[33],有助于促进血清总胆固醇、三酰甘油的分解和转化,进而实现脂质代谢紊乱的调节作用而达到降脂减肥的目的。姜黄素可以在维持脂肪酸含量不变的前提下刺激胆汁溢出,从而促进胆汁盐、胆固醇和胆红素总量的增加[38]。因此姜黄素也是典型的代谢絮乱调节剂。
3 姜黄素的应用
3.1 姜黄素在食品领域的应用
3.1.1 姜黄素在复合调味料的应用
标准GB 2760—2014《食品安全国家标准 食品添加剂使用标准》中规定在复合调味料中姜黄素含量不得大于0.1 g/kg。姜黄素在复合调料中的应用比较广泛,如膨化调味料、火锅调味酱等复合调料,使调味料颜色趋于纯正,具有独特色泽[39]。姜黄色素和β-胡萝卜素是鸡精复合调味料中使用较多的天然色素。姜黄素能提高鸡精的黄色,用量越大,色泽越偏向黄色。黎超等[40]检测出鸡精中的姜黄素含量为0.010~0.035 g/kg,符合国家标准。另一个姜黄素作为主要香料成分的调味料是咖喱,陈曦等[41]测得在柠檬咖喱粉、咖喱膏、油咖喱和咖喱块中,姜黄素的含量分别是0.743、0.118、2.408、0.257 g/kg,其中油咖喱中的姜黄素含量超出国家标准。并且在实验中发现芥末也有姜黄素(0.068 6 g/kg)的存在。姜黄素以色素和增香剂的角色,广泛存在于市面多种复合调味料产品中,在食品防腐保鲜和增色增香等领域具有广阔的应用前景。
3.1.2 姜黄素在面制品中的应用
姜黄素在面制品中的应用具有多种优势,首先其热稳定性与着色能力较好,能使面饼保持新鲜色泽。其次,在酸性条件下,姜黄素的耐酸性会使面饼鲜艳且稳定。此外,按照不同比例添加姜黄素能使面饼呈现出蛋黄色、金黄色、橘黄色等多种色泽,可操作空间大[39]。不仅如此,姜黄素价格较低廉,其应用能使方便面企业提升质量,压缩成本, 大大提高市场竞争力,具有广阔的应用前景[42]。方恩华等[43]使用高效液相色谱法检测市面上多种面饼,发现均含有姜黄素(<500 mg/kg)。WANG等[18]发现姜黄素对小米鲜面条在贮藏过程中有一定的保鲜作用,姜黄素能减少小米鲜面条的总菌落数,延长了20~30 h的保质期(25 ℃)。其中,姜黄素对蜡样芽胞杆菌和大肠杆菌的最低抑制浓度分别为0.125、0.5 mg/mL,生长曲线显示其对2种细菌均表现出良好的抗菌作用。在面制品加工中,姜黄素利用其酸性稳定的优势,可以调节面制品的黄色色泽强度,还能延长面制品的贮藏时长,抑制细菌生长。
3.1.3 姜黄素在肉制品上的应用
肉制品在加工、贮藏、运输和销售过程中易受到环境和微生物的污染导致其发生变质,从而失去其原有的营养和食用价值。姜黄素作为天然防腐剂,在肉制品的保鲜方面有非常大的应用空间。例如,雷昌贵等[44]选用天然防腐剂姜黄色素为原材料,研究其对西式腊肠、腊肉、五香牛肉、酱卤肉4种肉制品的防腐作用。结果表明,对于上述肉制品具有良好的防腐性能需质量浓度在0.6 g/L以上的姜黄色素碱溶液。另外,对于色泽影响方面,刘学军等[45]对猪肘的天然上色剂进行实验研究,由实验结果得出姜黄素的最适添加量为0.7 g/L,且随着姜黄色素添加量的增加,猪肘的红度值逐渐下降,但不明显。除了姜黄素单独使用之外,还可以与其他材料复配结合,提高功能活性。肌原纤维蛋白和姜黄素结合形成的纳米复合物降低了生鸡肉和熟鸡肉的硫代巴比妥酸反应物和羰基值,这一现象意味着姜黄素纳米复合物可以降低鸡肉在贮存过程中受到的氧化影响[46]。对于姜黄素在减少脂质氧化方面的研究,还出现在鸭肉制品中,喂养姜黄素的鸭子,鸭肉中的化学成分没有显著变化,但在贮藏期间,鸭胸肌的脂质和蛋白质氧化现象,有明显的减少趋势[47]。姜黄素在肉制品加工中主要是调节色泽的作用,但在贮藏期间,有着良好的防腐性能和减少脂质氧化功效。
3.1.4 姜黄素在甜食中的应用
目前在糖果中应用最广的天然色素为姜黄素[45],而且与其他色素相比,姜黄素的染色性表现良好。姜黄素添加在糖果中具有资源优势、安全性优势、价格优势、多元化优势以及调配方便的优势。马诗经等[48]以姜黄提取物为主要原料,再加入功能性晶体麦芽糖醇等辅料制备功能性姜黄硬糖。得到的产品具有低热量、口感良好的特点,对慢性炎症及疾病起到预防的作用,适合于不同人群对保健食品的需求。
此外,姜黄素在糕点中起抗氧化作用,使产品保质期有效延长。SOWBHAGYA等[49]表明姜黄素是一种用于水果面包的安全天然着色剂。通过实验得出在丙二醇中添加姜黄素与面粉制备得的溶液,能使含有姜糖的水果面包呈现淡黄色。而且经过面团混合、发酵和烘烤等加工阶段后,姜黄素的保留率(84%)与柠檬黄(85%)相当。LIM等[50]制作姜黄小麦面包时使用不同含量的姜黄粉替代小麦粉。结果表明,添加了姜黄粉的面包含有更多的酚类化合物,且其含量随着姜黄粉的增加而显著增加,面包的抗氧化活性随之增加。在风味干扰考虑方面,4 g/kg的姜黄粉包含在面包配方中,不会对面包的感官特性产生任何显著干扰。任二芳等[38]研制的姜黄淮山米饼也充分利用了姜黄和淮山的药用价值,其色泽呈淡黄色,香味浓郁,在室温(25 ℃)下的贮存期至少为320 d。不仅如此,姜黄的加入还可以有效延缓黄油蛋糕中霉菌的生长,进而延缓了黄油蛋糕的酸败,将其有效期从2周延长到4周以上[51]。因此,姜黄素不仅可以在甜品中提亮色泽,还可以增添风味和充当功能性成分物质。
3.1.5 姜黄素在腌制品中的应用
酱渍和盐渍的各种蔬菜使用姜黄着色和调味是我国的传统加工步骤。夏春[52]用高效液相色谱法测出常见酱腌菜酸黄瓜和雪里红腌菜中分别含有0.008、0.012 g/kg的姜黄素,可见姜黄素在酱腌菜中也是常见的添加物质。牟先云等[53]添加含量为0.025 g/kg的姜黄素到产品中,既能有效得到与柠檬黄相当的颜色,又能使姜黄素含量不高于国家标准,使产品颜色鲜艳的同时,又安全可放心食用。另外,高慧等[54]将姜黄副产品与果脯蜜饯的生产加工相结合,研究姜黄副产品对果脯蜜饯加工生产过程中常见腐败菌如灰葡萄孢菌和扩展青霉菌的抑制效果以及其对于桃脯杨梅的保存影响和抗氧化褐变效果。研究表明,姜黄副产品中姜黄精油对于延长果脯蜜饯原料糖渍前的贮藏时间效果最佳。姜黄素在腌制菜肴中,不仅能起到增色调味的作用,还可以有效抑制腐败菌生长和腌制果蔬氧化,起到保鲜作用。
3.1.6 姜黄素在饮品中的应用
果汁饮料中的常用色素有柠檬黄、姜黄、栀子黄、β-胡萝卜素。叶小红等[55]使用植物物料与食用酒精制备姜黄露酒,酒液色泽金黄透明,且具有自然的金黄色和植物芳香。此外,张洁[56]以玫瑰花和姜黄为主要原料,研制玫瑰姜黄复合饮料,发现姜黄素含量为18 g/L时,保健功效得到最优发挥。玫瑰花发挥醒酒解酒功效,能降低乙醇对肝的损害,姜黄能养肝护胃,解宿醉,对身心疲惫、经常应酬人群尤为适宜。姜黄素可以令果汁果酒饮品增色增香,还可以经过合适配比,与其他食材协同发挥保健功效。
3.2 姜黄素在医药学领域的应用
在中医领域上姜黄性温,味辛辣、苦涩,具有广泛的药理作用,主要包括行气活血、治疗痛经闭经、缓解疼痛肿痛、调理肝胆疾病和治疗风湿病等疾病。除此之外,姜黄素也被发现可用于预防或治疗一些慢性疾病、神经疾病如鼻炎、厌食等[38]。姜黄素被认为是具有良好医疗药用价值的药食同源原料,药用价值显著,姜黄素在医疗领域的应用大有可为。
目前,姜黄素在市面上多应用于保健品行业,以护肝利胆、缓解创伤性关节炎为主[16],剂型主要集中在胶囊、片剂、口服剂、颗粒冲剂,也有相当一部分为软糖类制品。在医疗领域,姜黄素应用于癌症治疗方面在逐渐被关注后,不断被医药界接受,并开始以癌症预防治剂应用于医疗领域。
但通过调查可知,目前姜黄素产品具体应用在医药学领域和保健品领域的范围仍比较窄,产品形式较为单一(表2),未来应深入挖掘姜黄素在医药学和保健品领域的应用,开发更多针对不同功效剂型的功能食品及药品。
表2 姜黄素保健品
Table 2 Health products of curcumin

序号品牌产品名称保健作用剂型1Naturewise黑胡椒姜黄素解酒胶囊2Herbsofgold活性姜黄素片缓解关节炎片剂3Qunol liquid液体姜黄素养肝护肝口服液4安利纽崔莱姜黄素维生素C饮品增强免疫力冲剂5LemonBox姜黄素软糖解酒解腻软糖
3.3 姜黄素在畜牧领域的应用
随着时代的发展,人们越来越重视畜产品的品质,研究重点开始从畜产品的高产方面转变为畜产品的高质量和安全性方面。作为一种天然绿色的多酚类化合物,姜黄素具有抗肿瘤、抗氧化、抑菌抗炎、降脂肪、保肝利胆等多种重要作用,在动物生产中应用广泛。JAGUEZESKI等[57]在泌乳母羊的饮食中加入姜黄素后,发现试验组母羊血中活性氧物质水平下降,而产乳量明显提高,乳汁中体细胞量与蛋白质氧化显著下降。其中,体细胞数量和乳牛奶量损失与奶牛乳房炎发病率成正比,蛋白质氧化会造成乳汁蛋白质浓度减少,乳汁营养降低。因此,这一现象说明在饲料中加入姜黄素有助于增加绵羊羊奶的产量及品质。何进田[58]通过研究在母猪宫内发育迟缓(intrauterine growth retardation,IUGR)的断奶仔猪的饲料中添加姜黄素,发现姜黄素可通过调节肝脏胰岛素信号通路关键基因mRNA的表达和促进肝糖原的合成,从而有效缓解IUGR仔猪的胰岛素抵抗,提高仔猪的存活率。此外,LEE[52]等研究表明,姜黄油和辣椒油添加在商品肉鸡的饲养中,能够通过调整肉鸡肠道中炎性细胞因子的mRNA水平及减少人体血清中产气荚膜梭菌有毒药物的含量,从而降低肉鸡的肠道损伤程度,该结果表明把姜黄素添加在肉鸡粮食中能够增强肉鸡抵抗坏死性肠炎的能力。由此可见,姜黄素在猪牛羊鸡等畜禽产品的应用中,不仅缓解动物本身的部分疾病,增强其抵抗力,还可以提高畜肉及副产品的产量和质量。
4 姜黄素的增溶技术
4.1 固体分散技术
固体分散技术是指目标化合物以分子、无定形或微晶状态存在,分散在固体载体中。这种技术通过增加溶解的表面积,将结晶度降至几乎无定形状态,并增加药物的湿润性,从而提高了目标化合物的溶解度和溶解速率。然而,使用单一材料作为载体会可能带来某些局限性。因此,通常使用2种或多种载体材料的共混物,每种载体材料具有不同的亲水性、疏水性和肠溶性,以最大限度地提高目标化合物的溶解度。许洁等[60]制备姜黄素自胶束化固体分散体对小鼠进行实验,与原料药相比,自胶束化固体分散体的相对生物利用率显著提高,表明该试剂在小鼠体内水溶性更强。刘延敏等[61]研究表明,以姜黄素与聚乙二醇6000制备固体分散体,显著提高了姜黄素体外溶出度,促进其在体内的吸收。因此固体分散技术是增加溶解度、提升溶出速率及提高相对生物利用度的有效手段。然而,固体分散体中药物的分散状态多为分子状态、亚稳定态及无定型态、胶体和微晶等热力学亚稳定状态,有转化为稳定药物结晶的趋势,还有制剂老化等问题,很大程度上限制了固体分散技术的实际应用。
4.2 脂质体技术
脂质体是由单层或多层两亲性分子膜组成的微泡,类似于细胞结构,使其成为亲水性和疏水性物质的有效载体。例如,基因表达综合数据库装载的植物质体被用作酸奶产品中表现出抗菌活性的潜在天然防腐剂,并作为一种潜在的食品添加剂,主要用于不溶于水的营养丰富食品。类似的应用可以注意到2′,4′,5,7-四羟基黄烷酮,一种天然存在的黄烷酮,具有强大的酪氨酸酶抑制活性,主要存在于桑科植物中。由于姜黄素脂溶性较好,将姜黄素制成脂质体,可以明显改善其水溶性,提高生物利用度[62]。实践证明,各类姜黄素脂质体在提高姜黄素生物利用度方面有显著效果[63],例如,赵静等[64]采用乙醇注入法制备了姜黄素乙醇脂质体,经大鼠口服实验证明了姜黄素乙醇脂质体相比姜黄素单体吸收度更高。马德雪等[65]采用薄膜超声法构建共递送姜黄素和表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)的脂质体,探讨其对神经炎症的改善作用,结果显示共递送姜黄素和EGCG的脂质体显著提高了稳定性和抗氧化特性。因此,姜黄素制成脂质体能有效改善其水溶性差和稳定性弱等缺陷。
4.3 包合技术
包合技术是指一种分子包嵌于另一种分子的空穴结构中形成包合物。该技术将天然食品疏水功能因子嵌入载体的空隙结构内,使其形成超微粒分散物,从而提高食品疏水功能因子的水溶性。环糊精是由环糊精葡萄糖转移酶催化淀粉生成的环状低聚糖,具有表面亲水和疏水内腔结构[66],通常应用于包裹疏水性小分子化合物,促进活性物质水溶性和提高稳定性。因此,环糊精及其衍生物是包合技术主要的载体材料。有研究合成了姜黄素-羟丙基-β-环糊精(curcumin hydroxypropyl-β-cyclodextrin,CUR-HP-β-CD)包合物,姜黄素经包合后溶解度显著提高,包合物水溶性较姜黄素单体提高了9 255倍[67]。此外,把姜黄素与羟丙基-γ-环糊精[68]、二甲基-β-环糊精[69]包合,均能提高姜黄素的溶解度,并且显著改善姜黄素的抗氧化活性及稳定性。李香等[70]探究β-环糊精及其衍生物对姜黄素的增溶作用,实验表明,β-环糊精及其衍生物的包合物均能增强姜黄素的水溶性,其中HP-β-CD与β-CDS的包合物增溶效果最佳。其增溶机理是环糊精具有中空圆筒形结构,形状和大小合适的疏水性有机分子或官能团嵌入筒内疏水区,形成包合物。包合技术虽能改善姜黄素的水溶性及稳定性,但载体材料具有包合率低,制备工艺复杂,稳定性较差等局限性,且易受时间、反应温度和搅拌时间等因素的影响。
4.4 多重包埋微胶囊技术
微胶囊技术是一种利用成膜材料包裹在固体、气体和液体表面上形成微小粒子的技术,使其与外界不宜环境相隔绝,最大程度地保持原有的色、香、味性能和生物活性,防止原有物料的营养成分被破坏与损失[71]。姜黄素的生物利用率与其在介质中的分散度、粒径大小有关,由于姜黄素水溶性较低,只能通过减小粒径来提高姜黄素可吸收性。当姜黄素活性成分粒径减至10 μm以内时,才能达到提高生物利用率、改善可吸收性的目的[72]。周迪等[72]将姜黄素、抗氧化剂、乳化剂混合,通过单因素试验确定了多重包埋技术微囊化姜黄素的最佳工艺条件和配方。实验证明,与传统微胶囊技术相比,多重包埋技术微胶囊化姜黄素具有水溶性好、异构化程度少、溶剂残留无检出且稳定性好等特点。
4.5 乳液凝胶技术
乳液凝胶是一种被油滴填充且具有凝胶网络结构的半固体体系,其包含乳液结构和凝胶特性。乳液凝胶凭借良好的稳定特性,在功能食品及医药领域具有广阔的应用,可作为传递体系用来递送天然活性物质,以提高其稳定性[73]。刘玫君等[74]运用均质法制备了含油量80%的乳液凝胶,并用于负载姜黄素,发现姜黄素在乳液凝胶的负载下,其水溶性和生物利用率在模拟肠液消化过程中显著提高。同时,研究发现将姜黄素、花色苷单独负载于Pickering乳液中能显著提升其稳定性与生物利用率[75]。此外,杨翦秋等[76]研究结果表明,木薯淀粉基W1/O/W2型Pickering双重乳液在模拟消化过程中能有效提升姜黄素在体内的生物利用率,有利于后续的吸收利用与生理功能发挥。由此可知,以乳液凝胶为载体,姜黄素加工稳定性和贮藏稳定性均得到提高。乳液凝胶可用于负载功能因子,在食品增溶技术有一定的应用前景。
4.6 增溶技术的未来发展趋势
研究表明,传统的增溶技术具有工艺繁杂、包合率低、稳定性较差等缺点。近年来,纳米材料的研究和制备技术不断进步,使纳米载体的性能得到进一步提高。纳米增溶技术通过将药物包合在纳米载体中,提高药物的水溶性、稳定性及其生物利用度,实现药物靶向传输。目前,以纳米材料为载体的增溶技术主要有纳米递送系统、生物可降解材料、智能响应系统等。岳田等[77]制备纳米胶束包载的姜黄素,通过流式细胞仪检测、荧光染色验证包载好的姜黄素的微环境改善作用,结果表明,姜黄素纳米颗粒结合水凝胶能够提高姜黄素的水溶性和生物利用度,且还能改善心肌梗死后的高炎症,稳定性较好。张萍[78]通过制备万古霉素纳米粒-水凝胶缓释复合载体,研究其对药物释放和抑菌的作用效果。结果显示,万古霉素能够从水凝胶中释放,保持其对金黄色葡萄球菌的生物活性和抗菌作用,表明纳米颗粒和水凝胶能够保护万古霉素免受与周围环境的化学相互作用,从而保持了药物的效率。李函容[79]合成了智能响应递送体系CEL-Fe纳米颗粒(celastrol-Fe nanoparticles,CEL-Fe NPs),通过急性溶血实验、生物安全性测试、小鼠活体成像证明了CEL-Fe NPs的生物安全性较好,且在正常生理活动中,聚合物中的亲水聚乙二醇末端能够维持CEL-Fe NPs的体内循环稳定性,还建立了患者来源的异种移植瘤模型以评估 CEL-Fe NPs的体内治疗效果,实验证明纳米粒能够有效地在肿瘤积聚,且疗效更强。由此可知,生物可降解材料和智能响应系统皆对药物释放及其生物利用率有较好的效果,该增溶技术的应用能够有效提高姜黄素水溶性和生物利用率,还能促使姜黄素更好地被转运至目的组织,从而发挥其药效。因此,未来的研究重点可进一步深入探索纳米增溶技术对姜黄素理化性质的改善,提高纳米载体的稳定性、生物相容性和靶向性,以实现更精准的药物传递。
5 结论与展望
随着生活质量的提升,人们越来越注重个体的养生保健。姜黄素作为一种绿色天然多酚类物质,具有丰富的生理活性调节潜能。本文详细综述了姜黄素在抗肿瘤、抗炎、降血糖、抗氧化、抗菌和调节机体代谢等方面展现的功能特性及其在食品领域、医学领域和动物生产领域等方面的应用(图2)。然而,由于其较差的稳定性和较低的水溶性,导致其可用于人体的应用形式较为单一且生物利用率较低,故本文进一步综述固体分散体、脂质体、包合技术、多重包埋微胶囊化、乳液凝胶等5项增溶技术对姜黄素溶解度的影响,为提高姜黄素水溶性、稳定性及生物利用率提供参考。
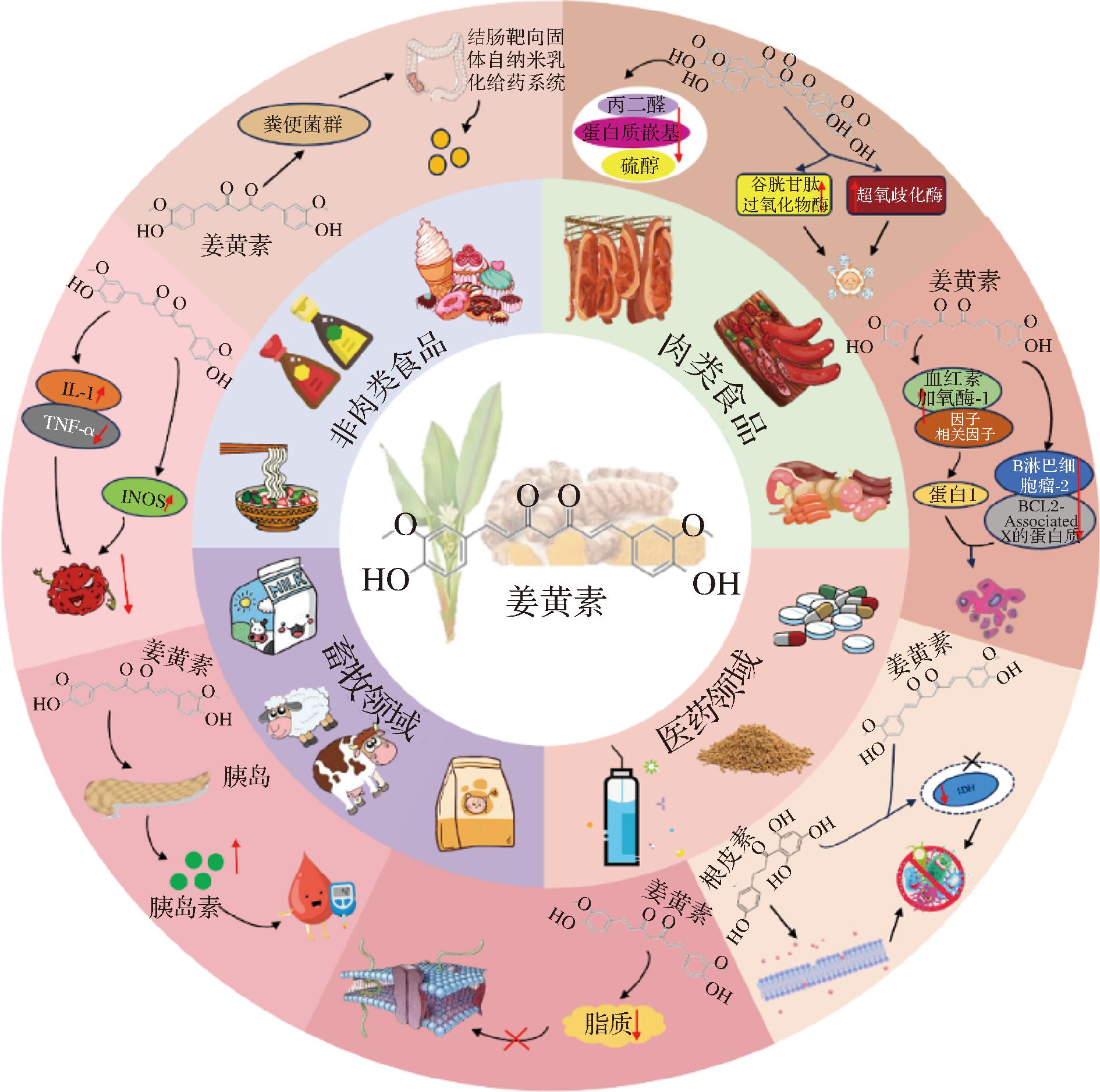
图2 姜黄素的功能特性及应用
Fig.2 Functional properties and applications of curcumin
[1] 曾庆晗, 陈帅, 高彦祥. 姜黄素乳液的研究进展[J]. 食品工业科技, 2020, 41(1):341-348.ZENG Q H, CHEN S, GAO Y X. Recent advances in research of curcumin emulsion[J]. Science and Technology of Food Industry, 2020, 41(1):341-348.
[2] 黄会所, 陈世杰. Application of turmeric yellow in confectionary[C]. 中国食品添加剂生产应用工业协会. 第十届中国国际食品添加剂和配料展览会学术论文集. 河北: 河北食品添加剂有限公司, 2006, 243-245.HUANG H S, CHEN S J. Application of turmeric yellow in confectionary[C]. China Food Additive Production and Application Industry Association. Proceedings of the 10th China International Exhibition on Food Additives and Ingredients. Hebei: Hebei Food Additives Co., Ltd., 2006, 243-245.
[3] 舒心, 郭擎, 高彦祥. 以蛋白质为基础物质的姜黄素传递体系研究进展[J]. 中国食品学报, 2022, 22(5):383-398.SHU X, GUO Q, GAO Y X. Research progress on protein-based delivery systems for curcumin[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(5):383-398.
[4] 杨柳. 姜黄中的姜黄素提取工艺研究进展[J]. 农业科技与装备, 2017(5):89-90.YANG L. Research progress on extraction technology of Cureumin from Turmeric[J]. Agricultural Science &Technology and Equipment, 2017(5):89-90.
[5] 周美, 陈华国, 周欣, 等. 正交实验法优化姜黄中姜黄素提取工艺及其抗氧化活性[J]. 医药导报, 2015, 34(10):1352-1355.ZHOU M, CHEN H G, ZHOU X, et al. Optimized extraction of curcuminoids from Curcuma longa l.by orthogonal designed method and its antioxidant activity[J]. Herald of Medicine, 2015, 34(10):1352-1355.
[6] 冯甜华, 侯长军, 霍丹群, 等. 姜黄素不同提取方法比较研究[J]. 应用化工, 2016, 45(6):1011-1014.FENG T H, HOU C J, HUO D Q, et al. Comparative research on the extraction of curcumin[J]. Applied Chemical Industry, 2016, 45(6):1011-1014.
[7] 徐广宽. 姜黄素提取及与牛血清白蛋白相互作用研究[D]. 西安: 陕西师范大学, 2017.XU G K. Study on curcumin extraction and interaction with bovine serum albumin[D]. Xi’an: Shaanxi Normal University, 2017.
[8] 谭索, 司瑞茹, 强悦越, 等. 离子液体辅助酶法提取姜黄素类化合物工艺优化[J]. 食品工业科技, 2022, 43(17):258-265.TAN S, SI R R, QIANG Y Y, et al. Optimization of the extraction process of curcuminoid by ionic liquid-assisted enzymatic method[J]. Science and Technology of Food Industry, 2022, 43(17):258-265.
[9] GÖKDEMIR B, BAYLAN N, ÇEHRELI S. Application of a novel ionic liquid as an alternative green solvent for the extraction of curcumin from turmeric with response surface methodology: Determination and optimization study[J]. Analytical Letters, 2020, 53(13):2111-2121.
[10] 宿树兰, 吴启南, 欧阳臻, 等. 超临界CO2萃取测定姜黄中姜黄素的实验研究[J]. 中国中药杂志, 2004, 29(9): 857-860.SU S L, WU Q N, OUYANG Z, et al. Study on the SFE condition for curcumin in Curcuma longa[J]. China Journal of Chinese Materia Medica, 2004, 29(9): 857-860.
[11] FARHOOD B, MORTEZAEE K, GORADEL N H, et al. Curcumin as an anti-inflammatory agent: Implications to radiotherapy and chemotherapy[J]. Journal of Cellular Physiology, 2019, 234(5):5728-5740.
[12] 张雅文, 孙元珏, 周琰. 姜黄素抑制骨肉瘤细胞增殖、迁移和侵袭并诱导凋亡的作用研究[J]. 九江学院学报(自然科学版), 2022, 37(2):98-102.ZHANG Y W, SUN Y J, ZHOU Y. Curcumin inhibits proliferation, migration and invasion of osteosarcoma cells and induces apoptosis[J]. Journal of Jiujiang University (Natural Science Edition), 2022, 37(2):98-102.
[13] LIU Z J, HUANG P Y, LAW S, et al. Preventive effect of curcumin against chemotherapy-induced side-effects[J]. Frontiers in Pharmacology, 2018, 9:1374.
[14] XU L G, LI W, SADEGHI-SOUREH S, et al. Dual drug release mechanisms through mesoporous silica nanoparticle/electrospun nanofiber for enhanced anticancer efficiency of curcumin[J]. Journal of Biomedical Materials Research. Part A, 2022, 110(2):316-330.
[15] CORRIE L, GULATI M, AWASTHI A, et al. Polysaccharide, fecal microbiota, and curcumin-based novel oral colon-targeted solid self-nanoemulsifying delivery system: Formulation, characterization, and in-vitro anticancer evaluation[J]. Materials Today Chemistry, 2022, 26:101165.
[16] 苟梦星, 卢安琪, 翟江洋. 姜黄素的功能特性及其在食品领域的应用现状[J]. 食品科技, 2021, 46(11):264-268.GOU M X, LU A Q, ZHAI J Y. The function and application of curcumin in the field of food[J]. Food Science and Technology, 2021, 46(11):264-268.
[17] MAKUCH S, WIECEK K, ![]() M. The immunomodulatory and anti-inflammatory effect of curcumin on immune cell populations, cytokines, and in vivo models of rheumatoid arthritis[J]. Pharmaceuticals, 2021, 14(4):309.
M. The immunomodulatory and anti-inflammatory effect of curcumin on immune cell populations, cytokines, and in vivo models of rheumatoid arthritis[J]. Pharmaceuticals, 2021, 14(4):309.
[18] WANG Z Y, JIA Y T, ZHANG M. Effect of curcumin on the quality properties of millet fresh noodle and its inhibitory mechanism against the isolated spoilage bacteria[J]. Food Science &Nutrition, 2020, 8(3):1451-1460.
[19] WANG Q R, YE C Q, SUN S K, et al. Curcumin attenuates collagen-induced rat arthritis via anti-inflammatory and apoptotic effects[J]. International Immunopharmacology, 2019, 72:292-300.
[20] PORRO C, CIANCIULLI A, TROTTA T, et al. Curcumin regulates anti-inflammatory responses by JAK/STAT/SOCS signaling pathway in BV-2 microglial cells[J]. Biology, 2019, 8(3):51.
[21] 刘虎军, 贾菲, 贺钰梅. 姜黄素调控NF-κB信号通路对糖尿病模型大鼠胰岛细胞形态和功能的影响[J]. 药物评价研究, 2023, 46(4):803-811.LIU H J, JIA F, HE Y M. Effects of curcumin regulating NF-KB signal pathway on morphology and function of pancreatic islet cells in diabetes model rats[J]. Drug Evaluation Research, 2023, 46(4):803-811.
[22] 许崇德, 成之福. 姜黄素改善2型糖尿病的机制研究进展[J]. 医药导报, 2016, 35(11): 1234-1237.XU C D, CHENG Z F. Research progress of the mechanism of curcumin in improving type 2 diabetes mellitus [J]. Herald of Medicine, 2016, 35(11): 1234-1237.
[23] SHEHZAD A, KHAN S, SHEHZAD O, et al. Curcumin therapeutic promises and bioavailability in colorectal cancer[J]. Drugs of Today (Barcelona, Spain, 2010, 46(7):523-532.
[24] GUTIERRES V O, ASSIS R P, ARCARO C A, et al. Curcumin improves the effect of a reduced insulin dose on glycemic control and oxidative stress in streptozotocin-diabetic rats[J]. Phytotherapy Research, 2019, 33(4):976-988.
[25] LEE Y S, CHO D C, KIM C H, et al. Effect of curcumin on the inflammatory reaction and functional recovery after spinal cord injury in a hyperglycemic rat model[J]. The Spine Journal, 2019, 19(12):2025-2039.
[26] 欧海龙, 张庆海. 姜黄素对apoE-/-小鼠抗氧化能力和血脂水平的影响[J]. 贵州医药, 2015, 39(10):874-876.OU H L, ZHANG Q H. Influence of curcumin on anti-oxidation and plasma lipid in apoE-/- mice[J]. Guizhou Medical Journal, 2015, 39(10):874-876.
[27] ABRAHAMS S, HAYLETT W L, JOHNSON G, et al. Antioxidant effects of curcumin in models of neurodegeneration, aging, oxidative and nitrosative stress: A review[J]. Neuroscience, 2019, 406:1-21.
[28] 王明明, 关二旗, 李萌萌, 等. 姜黄素-淀粉纳米微胶囊的研制及其抗氧化研究[J]. 河南工业大学学报(自然科学版), 2022, 43(4):38-45; 53.WANG M M, GUAN E Q, LI M M, et al. Preparation of curcumin-starch nano-microcapsules and its antioxidant research[J]. Journal of Henan University of Technology (Natural Science Edition), 2022, 43(4):38-45; 53.
[29] CHEN S T, WU J, TANG Q, et al. Nano-micelles based on hydroxyethyl starch-curcumin conjugates for improved stability, antioxidant and anticancer activity of curcumin[J]. Carbohydrate Polymers, 2020, 228:115398.
[30] HE L Y, PENG X F, ZHU J F, et al. Protective effects of curcumin on acute gentamicin-induced nephrotoxicity in rats[J]. Canadian Journal of Physiology and Pharmacology, 2015, 93(4):275-282.
[31] 何玉婷, 杨雯, 王改琴, 等. 细胞凋亡主要检测方法及其应用[J]. 医学综述, 2019, 25(4):774-778; 783.HE Y T, YANG W, WANG G Q, et al. Progress and application of main detection methods for apoptosis[J]. Medical Recapitulate, 2019, 25(4):774-778; 783.
[32] SOETIKNO V, SARI S D P, MAKNUN L U, et al. Pre-treatment with curcumin ameliorates cisplatin-induced kidney damage by suppressing kidney inflammation and apoptosis in rats[J]. Drug Research, 2019, 69(2):75-82.
[33] 张红, 肖定福. 姜黄素的生理功能及其在养殖业中的应用[J]. 饲料研究, 2021, 44(5):133-136.ZHANG H, XIAO D F. The physiological function of curcumin and its application in aquaculture industry[J]. Feed Research, 2021, 44(5):133-136.
[34] 刘锋, 陆殷明, 陶文静, 等. 姜黄素与根皮素联合作用对大肠杆菌的抑菌效果[J]. 中国食品学报, 2023, 23(8):75-83.LIU F, LU Y M, TAO W J, et al. Inhibition of curcumin combined with phloretin against Escherichia coli[J]. Journal of Chinese Institute of Food Science and Technology, 2023, 23(8):75-83.
[35] 任娇艳, 苟娜, 高立, 等. 姜黄素对幽门螺杆菌及其诱导人胃GES-1细胞损伤的影响[J]. 食品科学, 2019, 40(23):151-156.REN J Y, GOU N, GAO L, et al. Effect of curcumin on Helicobacter pylori and GES-1 cells injured by it[J]. Food Science, 2019, 40(23):151-156.
[36] TYAGI P, SINGH M, KUMARI H, et al. Bactericidal activity of curcumin I is associated with damaging of bacterial membrane[J]. PLoS One, 2015, 10(3): e0121313.
[37] ALBASHER G, ABDEL-DAIM M M, ALMEER R, et al. Synergistic antioxidant effects of resveratrol and curcumin against fipronil-triggered oxidative damage in male albino rats[J]. Environmental Science and Pollution Research International, 2020, 27(6):6505-6514.
[38] 任二芳, 牛德宝, 谢朝敏, 等. 姜黄开发与应用进展[J]. 轻工科技, 2014, 30(10): 10-11;14.REN E F, NIU D B, XIE C M, et al. Development and application progress of turmeric [J]. Light Industry Science and Technology, 2014, 30(10): 10-11; 14.
[39] 斯波. 天然色素在复合调味食品中的应用[J]. 中国调味品, 2011, 36(2):97-101.SI B. Application of natural pigment in complex flavor food[J]. China Condiment, 2011, 36(2):97-101.
[40] 黎超, 马跃龙, 党敏娜. 高效液相色谱法同时测定鸡精中四种黄色色素[J]. 中国调味品, 2016, 41(4):126-129.LI C, MA Y L, DANG M N. Simultaneous determination of four yellow pigments in chicken essence seasoning by high performance liquid chromatography[J]. China Condiment, 2016, 41(4):126-129.
[41] 陈曦, 马妍, 王同蕾, 等. 超高效液相色谱法测定调味品中姜黄素及其同系物[J]. 中国食物与营养, 2019, 25(10):42-44.CHEN X, MA Y, WANG T L, et al. Determination on curcuminoids in condiment by ultra-high performance liquid chromatography[J]. Food and Nutrition in China, 2019, 25(10):42-44.
[42] 张保军, 张卫. 姜黄素的生理功能及其在方便面中的应用[J]. 中国食品添加剂, 2001(4):37-38; 26.ZHANG B J, ZHANG W. The physiological functions of curcumin and its application in instant noodles[J]. China Food Additives, 2001(4):37-38; 26.
[43] 方恩华, 曾琪, 阮彩章, 等. HPLC法测定面制品中的姜黄色素[J]. 粮食与油脂, 2016, 29(7):76-78.FANG E H, ZENG Q, RUAN C Z, et al. Determination of curcumins in flour products by high performance liquid chromatography[J]. Cereals &Oils, 2016, 29(7):76-78.
[44] 雷昌贵, 孟宇竹. 姜黄色素对肉制品的防腐作用研究[J]. 肉类工业, 2012(3):32-36.LEI C G, MENG Y Z. Study on antiseptic effect of curcumin on meat products[J]. Meat Industry, 2012(3):32-36.
[45] 刘学军, 于欣, 路鑫. 适用于酱卤肉制品的天然复合上色剂的研究[J]. 肉类工业, 2013(3):25-27.LIU X J, YU X, LU X. Study on natural compound colorant applied to sauced meat products[J]. Meat Industry, 2013(3):25-27.
[46] WU C L, LI L Y, ZHONG Q X, et al. Myofibrillar protein-curcumin nano complexes prepared at different ionic strengths to improve oxidative stability of marinated chicken meat products[J]. LWT, 2019, 99:69-76.
[47] JIN S J, PANG Q, LIU R Q, et al. Dietary curcumin decreased lipid oxidation and enhanced the myofibrillar protein structure of the duck (Anas Platyrhynchos) breast muscle when subjected to storage[J]. LWT, 2020, 133:109986.
[48] 马诗经, 何燕, 黎永良, 等. 姜黄硬糖的研制及其抗氧化活性研究[J]. 食品研究与开发, 2016, 37(22):92-96.MA S J, HE Y, LI Y L, et al. Preparation and antioxidant activity of Curcuma longa L. candy[J]. Food Research and Development, 2016, 37(22):92-96.
[49] SOWBHAGYA H B, SAMPATHU S R, VATSALA C , et al. Stability of curcumin, a natural yellow colourant during processing and storage of fruit bread[J]. Beverage and Food World, 1998, 25(4): 40-43.
[50] LIM H S, PARK S H, GHAFOOR K, et al. Quality and antioxidant properties of bread containing turmeric (Curcuma longa L.) cultivated in South Korea[J]. Food Chemistry, 2011, 124(4):1577-1582.
[51] LEAN L P, MOHAMED S. Antioxidative and antimycotic effects of turmeric, lemon-grass, betel leaves, clove, black pepper leaves and Garcinia atriviridis on butter cakes[J]. Journal of the Science of Food and Agriculture, 1999, 79(13):1817-1822.
[52] 夏春.高效液相色谱法测定食品中的姜黄素[J].化学分析计量,2011,20(1):54-55.XIA C.Determination of the curcumin in food by HPLC[J].Chemical Analysis and Meterage,2011,20(1):54-55.
[53] 牟先云, 李春林. 姜黄色素在酱腌菜中的应用研究[J]. 食品工业科技, 2006, 27(8):154; 171.MOU X Y, LI C L. Application of Curcumin in the pickled vegetable[J]. Science and Technology of Food Industry, 2006, 27(8):154; 171.
[54] 高慧, 蒋晶, 孙亚芳, 等. 姜黄素副产品在果脯蜜饯生产中的防腐抑菌效果[J]. 食品与发酵工业, 2016, 42(6):112-116.GAO H, JIANG J, SUN Y F, et al. Inhibitory effects of curcumin by-product on preserving of dry fruits[J]. Food and Fermentation Industries, 2016, 42(6):112-116.
[55] 叶小红, 谈文诗, 李理. 高良姜露酒与姜黄露酒的研制及感官品质分析[J]. 食品与机械, 2018, 34(7):183-185, 220.YE X H, TAN W S, LI L. Development on the alcoholic drink mixed with extracts of Alpinia offcinarum and Turmeric circuma and its sensory quality[J]. Food &Machinery, 2018, 34(7):183-185, 220.
[56] 张洁. 玫瑰姜黄复合饮料的研制[J]. 中国食品工业, 2019(5): 65-67. ZHANG J. Development of rose turmeric compound beverage [J]. China Food Industry, 2019(5):65-67.
[57] JAGUEZESKI A M, PERIN G, BOTTARI N B, et al. Addition of curcumin to the diet of dairy sheep improves health, performance and milk quality[J]. Animal Feed Science and Technology, 2018, 246:144-157.
[58] 何进田. 姜黄素对IUGR断奶仔猪肝脏功能的调节作用及相关机制研究[D]. 南京: 南京农业大学, 2019.HE J T. Effects of curcumin on liver function of weaned piglets with IUGR and its related mechanisms [D]. Nangjing: Nanjing agricultural university, 2019.
[59] LEE S H, LILLEHOJ H S, JANG S I, et al. Dietary supplementation of young broiler chickens with Capsicum and turmeric oleoresins increases resistance to necrotic enteritis[J]. British Journal of Nutrition, 2013, 110(5):840-847.
[60] 许洁, 蒋岩, 董扬扬, 等. 姜黄素自胶束化固体分散体制备及其体内药动学研究[J]. 中成药, 2023, 45(5):1397-1403.XU J, JIANG Y, DONG Y Y, et al. Preparation and in vivo pharmacokinetics of curcumin self-micellizing solid dispersions[J]. Chinese Traditional Patent Medicine, 2023, 45(5):1397-1403.
[61] 刘延敏, 王传胜, 韩刚, 等. 姜黄素固体分散体的制备及体外溶出度测定[J]. 哈尔滨医科大学学报, 2006, 40(4):327-328.LIU Y M, WANG C S, HAN G, et al. Preparation of curcumin solid dispersion and determination of its dissolution in vitro[J]. Journal of Harbin Medical University, 2006, 40(4):327-328.
[62] 宏伟, 陈大为, 赵秀丽, 等. 姜黄素长循环脂质体的制备及评价[J]. 中国中药杂志, 2008, 33(8):889-892.HONG W, CHEN D W, ZHAO X L, et al. Preparation and study in vitro of long-circulating nanoliposomes of curcumin[J]. China Journal of Chinese Materia Medica, 2008, 33(8):889-892.
[63] HAUSS D J. Oral lipid-based formulations[J]. Advanced Drug Delivery Reviews, 2007, 59(7):667-676.
[64] 赵静, 李嫄, 石明芯, 等. 姜黄素乙醇脂质体大鼠体内药代动力学研究[J]. 四川大学学报(医学版), 2017, 48(2):290-294.ZHAO J, LI Y, SHI M X, et al. Pharmacokinetics of curcumin ethosomes in rats in vivo[J]. Journal of Sichuan University (Medical Science Edition), 2017, 48(2):290-294.
[65] 马德雪, 闫晓佳, 刘夫国, 等. 共递送姜黄素和EGCG脂质体的构建及其对神经炎症的作用[J]. 食品科学技术学报, 2024, 42(2):32-45.MA D X, YAN X J, LIU F G, et al. Construction of co-delivered curcumin and EGCG liposomes and their effects on neuroinflammation[J]. Journal of Food Science and Technology, 2024, 42(2):32-45.
[66] 申雨苗, 王倩, 郭瑜, 等. 基于环糊精及其衍生物的递送体系在食品领域的研究进展[J]. 食品工业科技, 2022, 43(24):496-505.SHEN Y M, WANG Q, GUO Y, et al. Recent progress of delivery systems based on cyclodextrin and its derivatives in food industry[J]. Science and Technology of Food Industry, 2022, 43(24):496-505.
[67] 鲍悦忻, 陈艳红, 马钰, 等. 羟丙基-β-环糊精-姜黄素包合物的制备及其光动力杀灭沙门氏菌的机制[J/OL]. 食品工业科技, 2024, 1-13. BAO Y X, CHEN Y H, MA Y, et al. Preparation of hydroxypropyl -β-cyclodextrin-curcumin inclusion complexes and their photodynamic killing mechanism of Salmonella [J]. Food industry science and technology, 2024, 1-13.
[68] CELEBIOGLU A, UYAR T. Fast-dissolving antioxidant curcumin/cyclodextrin inclusion complex electrospun nanofibrous webs[J]. Food Chemistry, 2020, 317:126397.
[69] 李霄. 姜黄素/二甲基-β-环糊精包合物的制备、表征及其性质[D]. 重庆: 重庆师范大学, 2019.LI X. Preparation, characterization and properties of curcumin/dimethyl-β-cyclodextrin inclusion complex[D]. Chongqing: Chongqing Normal University, 2019.
[70] 李香, 林秀丽. β-环糊精及其衍生物对姜黄素的增溶和荧光增强作用[J]. 中国医药工业杂志, 2008, 39(3):194-198.LI X, LIN X L. Influence of β-CD and its derivatives on solubilization and fluoresence enhancement of curcumin[J]. Chinese Journal of Pharmaceuticals, 2008, 39(3):194-198.
[71] 武花花. 包埋技术在天然产物中的应用研究[D]. 北京: 北京化工大学, 2010.WU H H. Study on the application of embedding technology in natural products[D]. Beijing: Beijing University of Chemical Technology, 2010.
[72] 周迪, 王永奇, 许新德, 等. 多重包埋技术在微囊化姜黄素中的应用[J]. 中国食品添加剂, 2024, 35(3):188-194.ZHOU D, WANG Y Q, XU X D, et al. Application of multiple-embedding technology in microencapsulated curcumin[J]. China Food Additives, 2024, 35(3):188-194.
[73] LIANG L, LEUNG SOK LINE V, REMONDETTO G E, et al. In vitro release of α-tocopherol from emulsion-loaded β-lactoglobulin gels[J]. International Dairy Journal, 2010, 20(3):176-181.
[74] 刘玫君, 乔蕾蕾, 杨敏. 酪蛋白-海藻酸钠基乳液凝胶性质及其在姜黄素负载中的应用[J]. 食品科学技术学报, 2024, 42(2):58-74.LIU M J, QIAO L L, YANG M. Properties of emulsion gels based on casein-sodium alginate and their application on curcumin delivery[J]. Journal of Food Science and Technology, 2024, 42(2):58-74.
[75] 张羽. 基于玉米醇溶蛋白/大米淀粉构建皮克林乳液及其营养输送特性研究[D]. 镇江: 江苏大学, 2021.ZHANG Y. Construction of Pickering emulsion based on zein/rice starch and its nutrient transport characteristics[D]. Zhenjiang: Jiangsu University, 2021.
[76] 杨翦秋, 毕会敏, 范方宇. 负载姜黄素/花色苷的木薯淀粉基W1/O/W2型Pickering双重乳液的制备及性质[J]. 食品科学技术学报, 2024, 42(2):46-57.YANG J Q, BI H M, FAN F Y. Preparation and properties of cassava starch-based W1/O/W2 Pickering double emulsions loading curcumin/anthocyanin[J]. Journal of Food Science and Technology, 2024, 42(2):46-57.
[77] 岳田, 黄刚, 杨佳丽, 等. 姜黄素纳米颗粒联合可注射水凝胶用于改善心肌梗死后微环境的体外效果评价研究[J]. 心血管病学进展, 2024, 45(2):187-192.YUE T, HUANG G, YANG J L, et al. Evaluation study of in vitro effect of curcumin nanopartrticle combined with injectable hydrogels for improving microenvironment after myocardial infarction[J]. Advances in Cardiovascular Diseases, 2024, 45(2):187-192.
[78] 张萍. 生物可降解纳米复合水凝胶载药体系的构建及药物递送研究[D]. 青岛: 青岛科技大学, 2023.ZHANG P. Construction of biodegradable nano-composite hydrogel drug delivery system and drug delivery study[D]. Qingdao: Qingdao University of Science &Technology, 2023.
[79] 李函容. 智能响应雷公藤红素递送体系的设计及其在肿瘤治疗中的应用[D]. 北京: 北京化工大学, 2023. LI H R. Design of intelligent response triptolide delivery system and its application in tumor treatment [D]. Beijing: Beijing University of Chemical Technology, 2023.