岩藻黄质(fucoxanthin, FX)是一种主要由褐藻、硅藻以及微藻产生的含氧类胡萝卜素,约占生物源类胡萝卜素总量的10%[1]。其分子式为C42H58O6,摩尔质量为658.91 g/mol,密度约1.1 g/cm3,熔点为166 ℃,颜色呈淡黄色至褐色,不溶于水,易溶于乙醇、丙酮等有机溶剂[2]。1990年,FX的手性完整结构被揭示[3],其不仅具有类胡萝卜素基本共轭结构,还具有丙二烯键、5,6-单环氧化合物、丰富的含氧官能团如羰基和羟基等[4],在分子层面上,还衍生了3种同分异构体[5]:9′Z-、13′Z-和13′Z-,赋予其抗氧化[6]、抗衰老[7]、抗炎[8]、抗肥胖[9]、抗增殖及抗肿瘤[10]等多种生理及药理功能。然而,由于FX水分散性差、在口腔/胃肠道中不稳定、易被快速降解[11],导致其生物转化吸收程度低[12],严重影响其生物学效价、健康益处的发挥,限制其在食品中的进一步应用。
研究报道,递送载体荷载疏水性食品营养因子能够有效提高其溶解度和稳定性[13]。通过调节递送载体的结构/成分,或对递送载体进行表面修饰,能够控制食品营养因子在消化道中的释放速率和位置,使其靶向特定细胞或组织,提高疏水性食品营养因子在目标部位的浓度[14]。目前,基于FX的稳态化递送系统,如纳米颗粒、纳米纤维、脂质体、微胶囊、胶束等已被开发以提高FX的生物利用度,最大限度地发挥其生物学功能[15]。同时,荷载FX的递送系统逐渐被应用于新型功能食品中,如荷载FX的纳米纤维/微胶囊添加到果汁、牛奶等食品体系中以提高功能食品的口感以及营养价值[16-17]。
本文介绍了岩藻黄质的理化性质、生物代谢及其应用局限性,总结了FX稳态化递送系统的构建方法、作用机理及技术特点,阐述了FX递送系统在功能食品开发和生物医药领域中的应用,并提出其在实际生产应用中面临的挑战与展望,旨在为疏水活性分子递送系统的设计和高营养附加值食品开发提供发展方向。
1 岩藻黄质生物代谢及其在应用中存在的主 要问题
FX作为一种重要海洋类膳食成分,与其他类胡萝卜素相似,首先从食物基质中释放,与具有两亲性以及疏水性的化合物(包括胆盐、胆固醇、脂肪酸、单酰基甘油酯和磷脂等)形成混合胶束[18]。随后,以混合形式被肠细胞吸收、再转化为代谢物,其代谢物以及未裂解的FX随着膳食脂质共同进入乳糜微粒,释放到淋巴中[19]。岩藻黄质醇(fucoxanthinol, FXOH)和amarouciaxanthin A是岩藻黄质的2种主要代谢物。如图1所示,FX在体内经胃肠道会被脂肪酶、胆固醇酯酶等水解为FXOH[20],大多数FXOH通过淋巴系统进入血液循环运输,少量FXOH在肝脏经脱氢/异构化转化为amarouciaxanthin A[21]。FXOH和amarouciaxanthin A在辅助因子作用下能够进一步发生脱氢、异构化、氧化和脱甲基等酶反应,代谢为具有部分岩藻黄质结构的类伪胡萝卜素[22]。
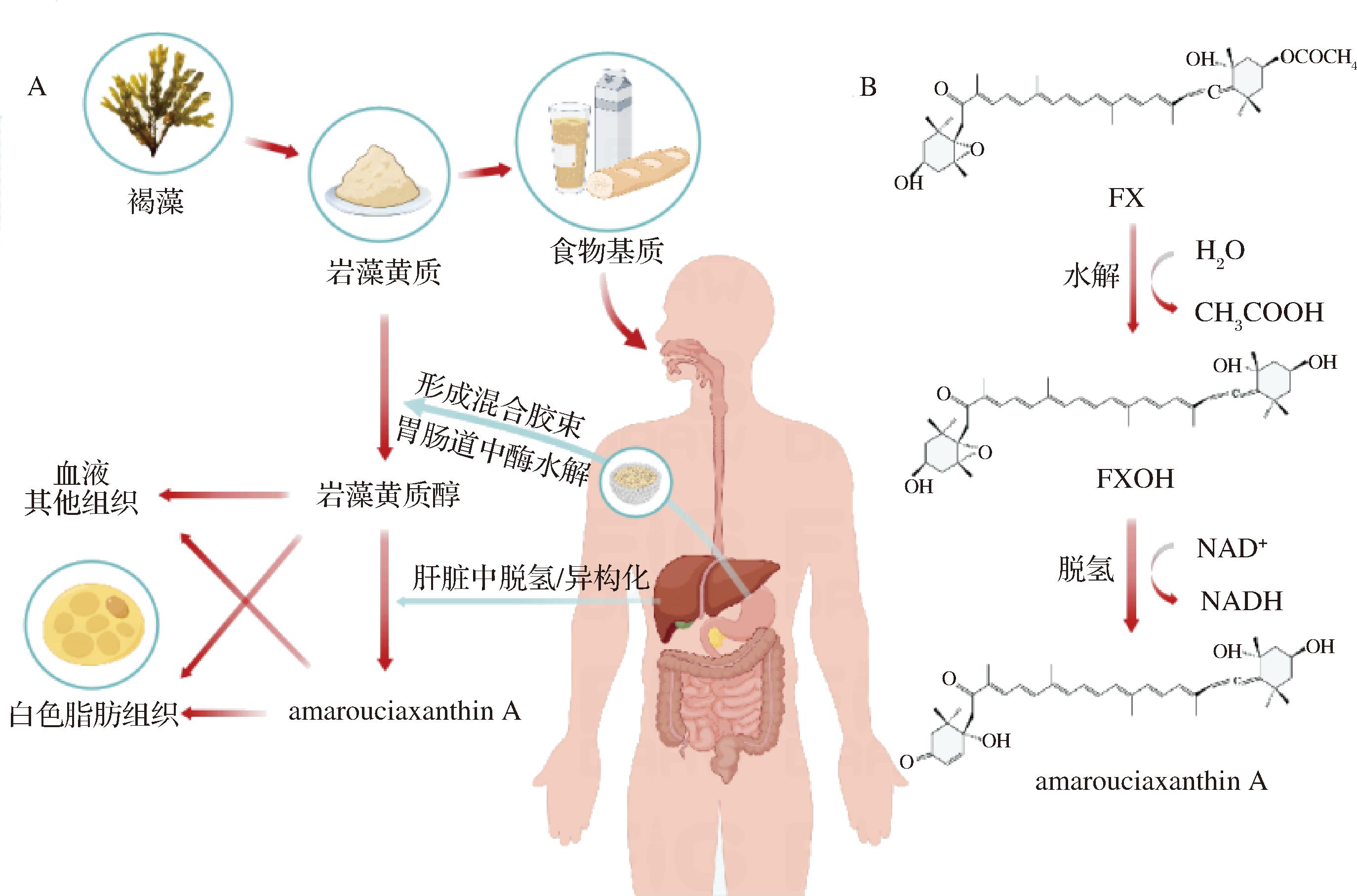
A-食物基质中FX的体内生物转化;B-FX代谢反应式及其主要产物
图1 岩藻黄质的体内生物转化途径
Fig.1 Biotransformation pathways of fucoxanthin in human body
然而,由于FX分子结构中的丙烯基团、环氧乙烷和共轭多烯长链,导致其极易受到氧气、温度、光照和pH值等环境因素影响,不稳定[23]。尤其在口服摄入FX后受胃酸、消化道蛋白酶等影响,FX被快速分解、代谢[11]。此外,由于FX是一种疏水性小分子,存在分子内或分子间的氢键、π-π堆积等相互作用,在水相中易发生聚集,导致其溶解度和渗透性较差,降低了FX在人体中的吸收效果,影响其健康效益的发挥,限制了FX在食品工业以及生物医药领域的实际应用。具体表现为:a)食品加工工艺通常涉及多种物理、化学和生物方法,如:热处理、酶处理等,易导致FX降解;b)FX对酸极其敏感,经胃肠道消化后,由于受到消化液(胃酸pH=1~2)和胃肠道中的消化酶及其他分泌物影响,导致FX化学结构严重破坏,丢失其原本生物活性;c)FX在肠黏液层容易与粘蛋白发生疏水相互作用,导致其扩散渗透能力差,肠道滞留时间缩短,降低其在肠道的吸收率;d)FX到达肠上皮细胞,由于受P-糖蛋白、多药耐药蛋白等外排泵主动向细胞外排除的转运机制的影响,极大程度限制了FX的胞内浓度,降低其生物利用度;e)由于FX的疏水性,导致消费者适口性差,限制其用于膳食干预策略或补充剂的应用。基于此,构建递送系统提高FX的稳定性、生物利用度、生物可及性、生物功效和靶向能力成为近年来的重要研究方向[24]。
2 岩藻黄质稳态化递送系统主要构建策略
为解决FX应用限制的问题,研究者们采用天然大分子构建递送载体以保护FX实现稳态化递送,最大限度提高其生物利用度。其中,递送载体通常指蛋白质/多肽、多糖、多酚、脂肪酸、聚合物等经氢键、二硫键、静电作用、疏水相互作用形成[25],不同类型的递送系统对FX的荷载方式和作用效果存在差异。目前,常见的FX稳态化递送策略如图2所示。
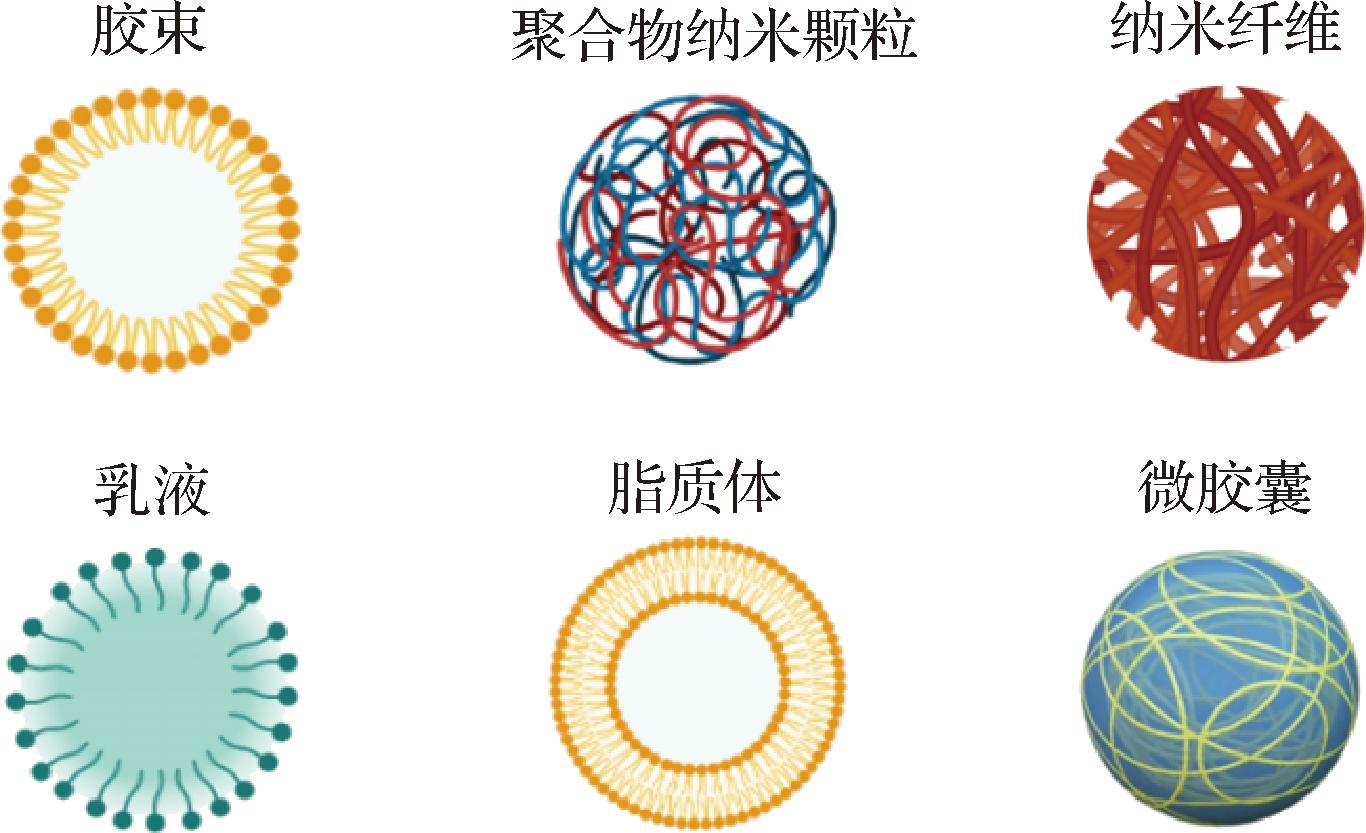
图2 常见的FX稳态化递送策略
Fig.2 Common stabilized delivery strategies of fucoxanthin
2.1 岩藻黄质递送系统的主要构建方法
2.1.1 反溶剂沉淀法协同自组装技术
反溶剂沉淀法,又称液-液分散法或相分离法,通过加入不溶于该有机溶剂的另一个溶剂,使目标化合物在反溶剂中沉淀出来。自组装是指基本结构单元在基于非共价键的相互作用下,自发地组织或聚集为一个稳定、具有一定规则几何外观的结构。驱动自组装的作用类型包括范德华力、静电作用、磁力作用、氢键、熵效应等多种相互作用。这2种方法常结合在一起用于制备荷载FX的两亲性蛋白质纳米颗粒,如图3 所示,FX先与两亲性蛋白质粉末共溶于乙醇相(70%~80%)中,再通过反溶剂法将去离子水滴入乙醇相中,通过降低两亲性蛋白溶解度,促使分子发生聚集自组装形成荷载FX的纳米颗粒,具有环境敏感性、靶向能力强的优势。WANG等[26]利用反溶剂沉淀法协同自组装技术制备了荷载FX的硫酸软骨素稳定的麦醇溶蛋白纳米颗粒,抑制了模拟胃液中FX的释放,增强了模拟肠液和模拟结肠液中FX的释放。
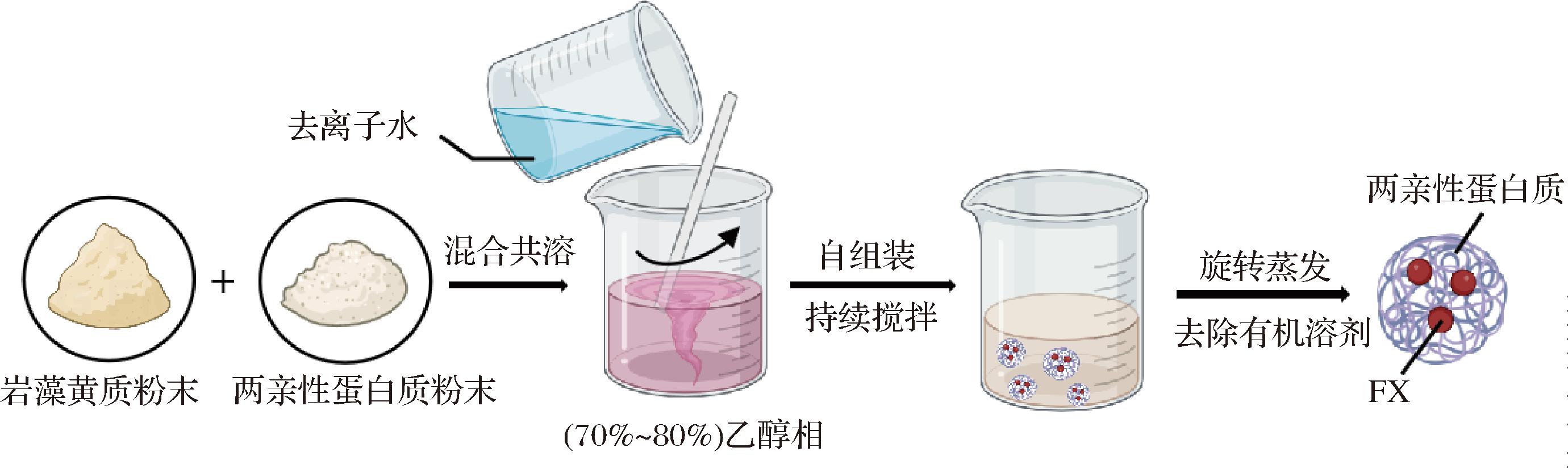
图3 反溶剂沉淀法协同自组装技术制备荷载FX的纳米颗粒
Fig.3 Antisolvent precipitation collaborative self-assembly technology for preparing the FX-loaded nanoparticles
2.1.2 静电纺丝法
静电纺丝法是通过在电场下拉伸合成或天然聚合物来生产纳米纤维的递送系统构建方法[27]。如图4所示,利用静电纺丝法制备荷载FX的聚合物基纳米纤维,FX首先与聚合物溶液混合,加入到注射器中,接着在聚合物溶液上施加强电场,电场作用产生的电力会降低聚合物的表面张力,针头处的聚合物液滴会由球形变为圆锥形,并从圆锥尖端延展得到纳米纤维。静电纺丝法制备的纳米纤维具有高表面体积比、高孔隙率、可变纤维尺寸和形状、无需使用温度的高荷载能力和提高荷载化合物稳定性等优点。如将FX荷载于鱼明胶中可形成具有良好的抗氧化和抗菌能力的纳米纤维[28]。
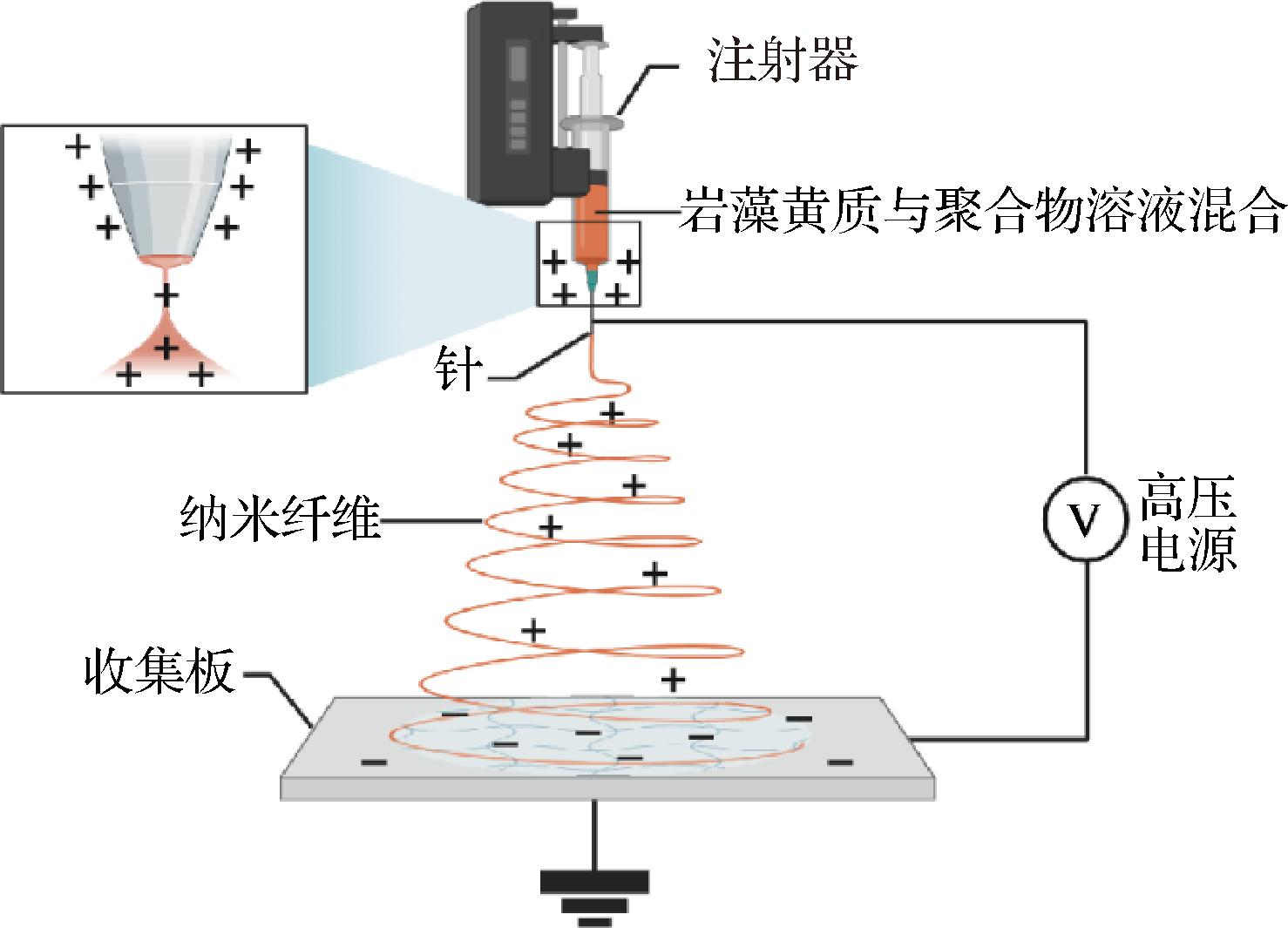
图4 静电纺丝法制备荷载FX的纳米纤维
Fig.4 Electrospinning for preparing the FX-loaded nanofibers
2.1.3 高压均质法
高压均质法是制备纳米乳液的一种常见物理方法,用于将2种或多种不相溶的液体相混合并形成稳定的乳状液。通常用于荷载FX的是水包油(oil-in-water, O/W)乳液,由图5可知,FX首先在油中溶解制备分散相,在高纯水中加入乳化剂制备分散相、再均质形成油水乳状液,最后利用高压均质的剪切力和湍流作用,将油相均匀地包裹在水相中以制备纳米乳液。该方法制备的纳米乳液具有较小的油滴尺寸、均匀的分散性以及乳化效率高等优点。MA等[29]以天然乳化剂乳清分离蛋白(whey protein isolates, WPI),改性卵磷脂和阿拉伯胶(gum arabic, GA)代替人工合成表面活性剂制备了可持续、环境友好型的荷载FX的O/W纳米乳液。

图5 高压均质法制备荷载FX的O/W纳米乳液
Fig.5 High pressure homogenization for preparing the FX-loaded O/W nanoemulsion
2.1.4 喷雾干燥法
喷雾干燥法是一种常见的微胶囊制备方法,该法较为经济。如图6所示,在制备荷载FX的微胶囊时,通常先合成荷载FX的粗乳液,与壁材原液混合后置于喷雾干燥器中,液滴经过液体蒸发、溶质扩散、干燥和沉淀等步骤,壁材充分荷载芯材,形成微胶囊粉末。蛋白质、低聚糖和多糖是常用的壁材,SUN等[30]基于喷雾干燥法制备了荷载FX的微胶囊,有利于保护FX免受热损伤,提高其热稳定性。
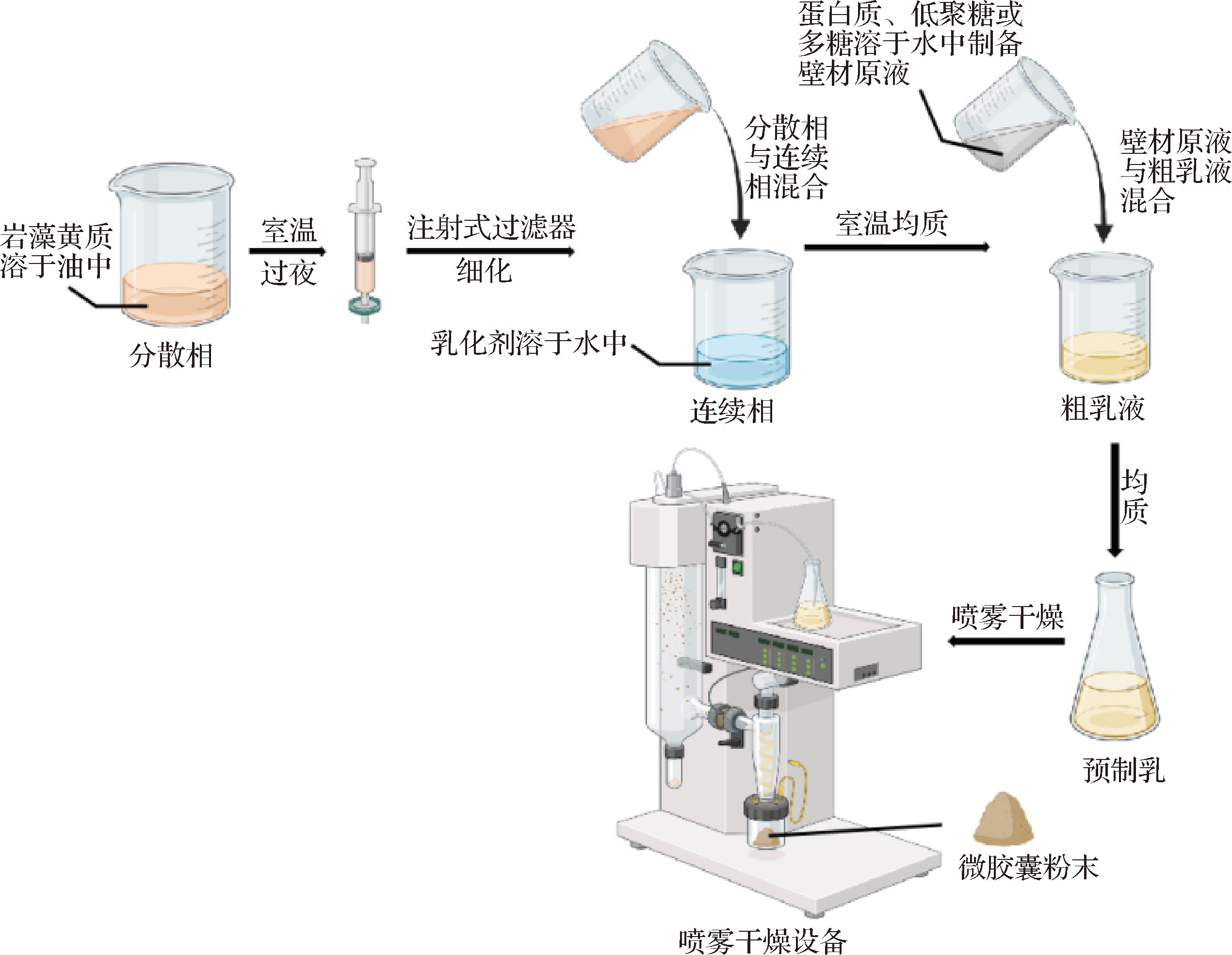
图6 喷雾干燥法制备荷载FX的微胶囊
Fig.6 Spray drying process for preparing the FX-loaded microcapsule
2.1.5 超声法
超声波在递送载体制备方面具有高效、可控、均匀等优势,常用于递送系统的构建。其中,超声乳化法常用于制备荷载FX的纳米乳液(图7)。OLIYAEI等[31]利用岩藻聚糖(fucoidan, Fuc)、GA、酪蛋白酸钠(casein sodium, Cas)制备了O/W纳米乳液,荷载后FX的稳定性较好,在体外胃肠道释放率较高。薄膜超声法常用于制备脂质体。首先选择适合的脂质(如:磷脂等)和辅助物质(如:胆固醇等)与FX混合,将其溶于有机溶剂中(通常是乙醇、乙醚),经水浴蒸除有机溶剂后形成薄膜,经探头超声可得到荷载FX的脂质体。DONG等[32]采用薄膜超声法制备了荷载FX的脂质体,并用海藻酸钠和壳聚糖(chitosan, CS)对其进行修饰。荷载后的FX在胃肠道消化后表现出更高的稳定性及抗氧化活性。此外,超声法通常与其他方法(如均质、脉冲等)协同使用,发挥辅助作用,有助于构建FX稳态化递送系统。

A-超声乳化法制备荷载FX的O/W纳米乳液;B-薄膜超声法制备荷载FX的脂质体
图7 超声法制备荷载FX的递送载体
Fig.7 Ultrasonic method for preparing the FX-loaded delivery vector
2.2 常见的岩藻黄质稳态化递送系统
2.2.1 纳米颗粒
纳米颗粒是指纳米尺度范围内的微粒。蛋白质、多糖、多酚等聚合物常用于构建纳米颗粒,FX与这些物质通过疏水、氢键、静电等相互作用以及范德华力形成荷载FX的纳米颗粒。如利用玉米醇溶蛋白(zein)水解肽基于自组装形成具有稳定结构和化学性质的荷载FX的纳米颗粒(fucoxanthin-loaded zein nanoparticles,FZNPs)[33]。又如以海藻酸盐(alginate, ALG)和CS为原料制备荷载FX的纳米颗粒,其生物利用度、胃肠道稳定性、抗氧化、抗炎活性等均有所提高[34]。相较于单独的蛋白质或多糖,蛋白质与多糖相互作用形成的静电复合物对pH和离子强度的变化更稳定,并且不同类型聚合物的多重包封能够赋予纳米颗粒递送FX的互补优势。KOO等[35]制备了以CS为涂层荷载FX的ALG-Cas纳米颗粒,不仅提高了FX稳定性,还实现了FX在模拟消化条件的可控释放,改善FX进入肠上皮细胞膜的输送。
2.2.2 纳米纤维
纳米纤维是指直径为纳米尺度而长度较大的具有一定长径比的线状材料。利用微流控同轴静电纺丝技术制备核-壳纳米纤维,和zein为壳层,FX和zein为核心层,该核-壳纳米纤维有效减轻了HepG2细胞中线粒体膜电位极化和脂质积累[36]。
2.2.3 乳液基递送系统
乳液基递送系统是由乳化剂稳定的2种不混相液体(即油和水)组成的双相系统,包括纳米乳液、Pcikering乳液以及高内向乳液。纳米乳液被报道粒径小,表面积大,通过与生物体内的细胞和组织充分接触提高FX的生物利用度。有研究采用多糖基(Fuc、GA)以及蛋白基(Cas)乳化剂基于超声乳化法荷载FX,表现出较高的荷载率和体外胃肠道中的高释放率[31]。同时,有研究发现在模拟胃肠道条件下,FX在含有长链三酰基甘油(long chain triacylglycerol, LCT)的纳米乳液中更容易被肠上皮细胞吸收[37]。BAI等[38]研究发现由藻蓝蛋白溶菌酶纳米配合物稳定的Pickering乳液形成紧密三维网状结构,提高了乳液的容量和黏弹性。JIAO等[39]使用CS降解后产生的壳寡糖和大豆分离蛋白为原料制备了一种食品级低聚糖蛋白纳米颗粒作为稳定剂用于Pickering乳液的制备,该乳液显著改善了FX的光照稳定性。此外,高内相乳液(high internal phase emulsions, HIPEs)是以脂质为基础且脂质相体积分数超过74%的递送系统。研究发现以明胶基微凝胶稳定荷载FX的HIPEs能有效保护FX在极端环境下不受化学降解,提高其生物利用度[40]。
2.2.4 脂质体
脂质体主要由磷脂组成,是一种小尺寸球形囊泡,其性质简单、易制备、可以实现跨膜运输,提供对肿瘤组织的靶向性。采用薄膜超声法制备并用海藻酸钠和CS进行修饰的荷载FX的脂质体,在胃肠道消化后表现出更高的贮藏稳定性、体外生物可利用度和抗氧化活性[32]。然而,由于脂质体的制备往往需要胆固醇作为稳定剂,但胆固醇与人体健康之间的关系饱受争议。WANG等[41]发现海参硫酸化甾醇在结构上与胆固醇相似,通过超声辅助薄膜分散法制备了一种以海参硫酸化甾醇代替胆固醇稳定的纳米脂质体,显著延长了FX在在血清中的保留时间,并且海参硫酸盐甾醇可以改善脂肪积累,减少肥胖小鼠的胰岛素抵抗和炎症,有助于功能食品的开发。
2.2.5 胶束
胶束是水溶液中的表面活性剂达到一定浓度时,分子自组装形成有序排列的热力学稳定胶状团聚体。研究发现蛋白质和膳食脂肪酸通过pH转换法形成的非共价连接胶束表现出高FX荷载率和热稳定性[42]。由于FAs的类型会影响FX的稳定性和吸收,在牛血清蛋白中引入了6种不同的FAs形成复合胶束荷载FX,发现LCT的添加进一步增强了FX在体内的代谢,证实LCT作为胶束中的材料更能促进FX的吸收。
2.2.6 其他新型递送系统
除了上述递送系统之外,细胞外囊泡是细胞自发或在一定条件下释放出的脂质双分子层包绕的球状膜性囊泡,具有易穿透生物膜、非免疫原性、天然靶向性以及本身提供生物活性分子(mRNA和脂质)协同发挥治疗作用的应用优势。如利用超声波从益生菌中制备工程化膜囊泡荷载FX,对葡聚糖硫酸钠盐(dextran sulfate sodium salt, DSS)诱导的小鼠结肠炎起到了良好干预作用[43]。
3 荷载岩藻黄质递送系统的应用
近年来,荷载活性物质的递送系统在食品工业和生物医药领域中的应用已成为研究热点。荷载FX的递送系统能改善功能食品的外观、风味,提高其加工贮藏稳定性,延长食品保质期,提高食品品质并增强功能食品的营养附加值。此外,部分递送载体本身也具有良好的抗氧化和抗菌活性,能与FX协同发挥作用,共同改善机体肥胖、糖尿病、癌症等状况。
3.1 荷载岩藻黄质的递送系统在食品工业中的应用
3.1.1 提高食品品质
食品加工中常用化学添加剂澄清果汁以防止酶褐变和浊度损失,然而,过多的澄清剂可能对果汁的风味有影响。FX呈现出明显的淡黄色至褐色,通过补充FX可以使果汁具有理想的外观,有助于解决氧化引起的褐变问题。LI等[16]基于微流控纺丝法将FX、羟丙基-γ-环糊精(2-hydroxypropyl-γ-cyclodextrin, HP-γ-CD)和聚乙烯吡咯烷酮(polyvinyl pyrrolidone, PVP)结合制备纳米纤维,将荷载FX的纳米纤维添加到苹果汁中,其自由基清除能力显著提高,果汁褐变指数降低,澄清效果更佳。WANG等[44]使用WPI、亚麻籽胶(flaxseed gum, FG)为壁材,Ca2+交联制备了荷载FX的纳米胶囊,添加到酸奶中进行发酵,纳米胶囊具有高度水分散性,可以改善酸奶微观结构,使其更加均匀致密。此外,FX还增强了酸奶的抗氧化活性,抑制了酸奶贮存过程中有害细菌生长,维持酸奶中乳酸菌在冷藏过程中的贮存稳定性,为延长食品的贮存寿命提供了新策略。
3.1.2 改善食品加工热稳定性
食品加工常涉及高温灭菌等热处理环节,为了提高FX的热稳定性,SUN等[30]基于喷雾干燥法使用6种生物聚合物制备荷载FX的微胶囊,发现在90 ℃加热24 h后,WPI、GA和麦芽糖糊精(maltodextrin, MD)荷载的FX残留率分别为60.72%、56.03%和54.57%,这可能是由于形成了致密层保护FX不受热损伤,提高了FX热稳定性。此外,在体外消化过程中,MD、GA和WPI使得FX在肠道中更容易释放。LI等[45]制备不同亲水性FAs-蛋白质颗粒荷载FX,发现FX在80 ℃加热200 min后的保留率均能增加2.16~4.06倍,说明荷载FX的递送系统有助于食品热加工改善及应用。
3.1.3 增强营养价值
将FX添加到食品或保健品中,可以为产品提供特殊的营养价值。如将FX加入脱脂牛奶(skim milk, SM)和全脂牛奶(whole milk, WM)中,改善了牛奶的风味并且提高其营养价值[17]。同时,牛奶蛋白与FX在包封过程中的结合特性提高了FX的稳定性和生物利用度。
3.2 荷载岩藻黄质的递送系统在生物医药领域中的应用
岩藻黄质递送系统能作为膳食补充剂用于结肠炎干预。通过超声辅助法制备荷载FX的细胞膜外囊泡,其发挥了强大的抗氧化以及抗炎能力,减轻了DSS诱导的结肠炎小鼠的体重减轻并缓解便血,通过恢复肠道菌群以及控制短链脂肪酸的产生延缓结肠炎发展[43]。将FZNPs荷载在淀粉基微粒中,其可在十二指肠(6%)、空肠(13%)、回肠(32%)和结肠(42%)中可控释放FX,该方法有潜力将FX靶向递送到肠道不同部位以发挥缓解溃疡性结肠炎的作用[46]。其次,LI等[47]基于静电纺丝法制备HP-β-CD荷载FX的纳米纤维,用于高脂饮食小鼠,其白色脂肪组织和血清总胆固醇分别降低了11%、23%。同样,将FX荷载于以岩藻聚糖和黑籽油为递送载体的O/W纳米乳液中,抑制了高脂饮食大鼠21天内的超重[48]。此外,ZHANG[33]等利用水解玉米蛋白短链肽基于自组装将FX荷载于单载体中形成FZNPs,有效降低了Ⅱ型糖尿病小鼠的空腹血糖水平以及机体的氧化应激。抗癌方面,SUI等[49]将FX荷载于PVP包被的纳米颗粒中,促进FX在Caco-2结肠癌细胞中积累,有效抑制Caco-2结肠癌细胞增殖分化。JASWIR等[50]以聚乙烯醇(polyvinyl alcohol, PVA)、聚乳酸聚乙醇酸[poly (lactic-co-glycolic) acid, PLGA]、二氯甲烷(dichloromethane, DCM)为水、油相制备荷载FX的微球,显著抑制了人肺癌H1299细胞系增殖。
荷载岩藻黄质递送系统在食品组和生物医药领域的应用见表1。
表1 荷载岩藻黄质的递送系统在食品工业及生物医药中的应用
Table 1 Applications of fucoxanthin-loaded delivery systems in food industry and biomedical fields

应用领域递送材料 递送系统/基质 递送技术结果 参考文献食品工业HP-γ-CD-PVP纳米纤维微流体纺丝增强果汁的抗氧化和澄清[16]食品工业WPI-FG-Ca2+纳米胶囊脉冲超声改善酸奶微观结构、抑菌、延长保质期[44]食品工业MD/GA/WPI微胶囊喷雾干燥改善食品加工热稳定性[30]食品工业 -SM/WM喷雾干燥改善牛奶风味[17]生物医药植物乳杆菌工程化膜囊泡超声辅助缓解DSS诱导的溃疡性结肠炎[43]生物医药HP-β-CD纳米纤维静电纺丝干预肥胖[47]生物医药Fuc、黑籽油O/W乳液超声均质干预肥胖[48]生物医药zein水解短链肽纳米颗粒自组装治疗Ⅱ型糖尿病[33]生物医药PVP纳米颗粒脉冲超声抗结肠癌[49]生物医药PVA-DCM-PLGA微球双乳液溶剂蒸发法抗肺癌[50]
注:-代表无。
4 结论与展望
岩藻黄质是存在于海藻中的一种丰富的类胡萝卜素,具有抗炎、抗氧化、抗肥胖和抗癌等多种生物学功能。然而,岩藻黄质的水溶性差、低生物利用度和不稳定性等难题严重制约了其工业化应用。纳米颗粒、纳米纤维、乳剂、脂质体和胶束等稳态化递送系统能够明显突破岩藻黄质应用瓶颈,有助于实现活性成分的精准营养和疾病干预,极大地拓展了岩藻黄质的应用范围。岩藻黄质递送系统还有许多亟待解决的问题:a)加强对递送系统的药代动力学以及安全性评价研究;b)研发智能化可控的岩藻黄质递送系统;c)优化岩藻黄质递送系统的大规模制备方法和装备研究。总之,设计与开发岩藻黄质稳态化营养递送系统,是赋予食品新特性、开发新型功能食品、满足精准化、个性化营养的要求,将进一步推动岩藻黄质递送系统在食品工业中的应用。
[1] D’ORAZIO N, GEMELLO E, GAMMONE M A, et al. Fucoxantin: A treasure from the sea[J]. Marine Drugs, 2012, 10(3):604-616.
[2] 吴跃, 林亲录, 战鑫. 岩藻黄质的功能特性及在食品工业中的应用[J]. 食品研究与开发, 2012, 33(10):203-206.WU Y, LIN Q L, ZHAN X. The functional properties of fucoxanthin and its application in food industry[J]. Food Research and Development, 2012, 33(10):203-206.
[3] ENGLERT G, BJØRNLAND T, LIAAEN-JENSEN S. 1D and 2D NMR study of some allenic carotenoids of the fucoxanthin series[J]. Magnetic Resonance in Chemistry, 1990, 28(6):519-528.
[4] WANG S K, LI Y, WHITE W L, et al. Extracts from New Zealand Undaria pinnatifida containing fucoxanthin as potential functional biomaterials against cancer in vitro[J]. Journal of Functional Biomaterials, 2014, 5(2):29-42.
[5] ZHANG Y P, FANG H, XIE Q L, et al. Comparative evaluation of the radical-scavenging activities of fucoxanthin and its stereoisomers[J]. Molecules, 2014, 19(2):2100-2113.
[6] SACHINDRA N M, SATO E, MAEDA H, et al. Radical scavenging and singlet oxygen quenching activity of marine carotenoid fucoxanthin and its metabolites[J]. Journal of Agricultural and Food Chemistry, 2007, 55(21):8516-8522.
[7] ZHENG J W, TIAN X X, ZHANG W, et al. Protective effects of fucoxanthin against alcoholic liver injury by activation of Nrf2-mediated antioxidant defense and inhibition of TLR4-mediated inflammation[J]. Marine Drugs, 2019, 17(10):552.
[8] ABDEL-RAFEI M K, THABET N M, EL TAWEL G, et al. Role of leptin/STAT3 signaling and RIP-kinases in fucoxanthin influences on mice exposed to LPS and gamma radiation[J]. Toxin Reviews, 2023, 42(1):18-39.
[9] WOO M N, JEON S M, KIM H J, et al. Fucoxanthin supplementation improves plasma and hepatic lipid metabolism and blood glucose concentration in high-fat fed C57BL/6N mice[J]. Chemico-Biological Interactions, 2010, 186(3):316-322.
[10] KOMBA S, KOTAKE-NARA E, TSUZUKI W. Degradation of fucoxanthin to elucidate the relationship between the fucoxanthin molecular structure and its antiproliferative effect on caco-2 cells[J]. Marine Drugs, 2018, 16(8):275.
[11] YUSOF Z, KHONG N M H, CHOO W S, et al. Opportunities for the marine carotenoid value chain from the perspective of fucoxanthin degradation[J]. Food Chemistry, 2022, 383:132394.
[12] GUO B B, OLIVIERO T, FOGLIANO V, et al. Gastrointestinal bioaccessibility and colonic fermentation of fucoxanthin from the extract of the microalga Nitzschia laevis[J]. Journal of Agricultural and Food Chemistry, 2020, 68(7):1844-1850.
[13] MCCLEMENTS D J. Nanoscale nutrient delivery systems for food applications: Improving bioactive dispersibility, stability, and bioavailability[J]. Journal of Food Science, 2015, 80(7): N1602-N1611.
[14] GHARIBZAHEDI S M T, SMITH B. Legume proteins are smart carriers to encapsulate hydrophilic and hydrophobic bioactive compounds and probiotic bacteria: A review[J]. Comprehensive Reviews in Food Science and Food Safety, 2021, 20(2):1250-1279.
[15] ZHANG Z M, WEI Z H, XUE C H. Delivery systems for fucoxanthin: Research progress, applications and future prospects[J]. Critical Reviews in Food Science and Nutrition, 2024, 64(14):4643-4659.
[16] LI J X, LI Y, ZHANG X D, et al. Microfluidic spinning of fucoxanthin-loaded nanofibers for enhancing antioxidation and clarification of fruit juice[J]. Food &Function, 2022, 13(3):1472-1481.
[17] MOK I K, YOON J R, PAN C H, et al. Development, quantification, method validation, and stability study of a novel fucoxanthin-fortified milk[J]. Journal of Agricultural and Food Chemistry, 2016, 64(31):6196-6202.
[18] VON LINTIG J, MOON J, LEE J, et al. Carotenoid metabolism at the intestinal barrier[J]. Biochimica et Biophysica Acta. Molecular and Cell Biology of Lipids, 2020, 1865(11):158580.
[19] O’BYRNE S M, BLANER W S. Retinol and retinyl esters: Biochemistry and physiology Thematic Review Series: Fat-soluble vitamins: Vitamin A[J]. Journal of Lipid Research, 2013, 54(7):1731-1743.
[20] SUGAWARA T, BASKARAN V, TSUZUKI W, et al. Brown algae fucoxanthin is hydrolyzed to fucoxanthinol during absorption by caco-2 human intestinal cells and mice[J]. The Journal of Nutrition, 2002, 132(5):946-951.
[21] ASAI A, SUGAWARA T, ONO H, et al. Biotransformation of fucoxanthinol into amarouciaxanthin A in mice and HepG2 cells: Formation and cytotoxicity of fucoxanthin metabolites[J]. Drug Metabolism and Disposition, 2004, 32(2):205-211.
[22] TAKATANI N, TAYA D, KATSUKI A, et al. Identification of paracentrone in fucoxanthin-fed mice and anti-inflammatory effect against lipopolysaccharide-stimulated macrophages and adipocytes[J]. Molecular Nutrition &Food Research, 2021, 65(2): e2000405.
[23] ZHAO D, YU D, KIM M, et al. Effects of temperature, light, and pH on the stability of fucoxanthin in an oil-in-water emulsion[J]. Food Chemistry, 2019, 291:87-93.
[24] GOMEZ-ZAVAGLIA A, BARROS L, PRIETO M A, et al. Recent progress in understanding the impact of food processing and storage on the structure-activity relationship of fucoxanthin[J]. Foods, 2023, 12(17):3167.
[25] PATEL R, KUWAR U, DHOTE N, et al. Natural polymers as a carrier for the effective delivery of antineoplastic drugs[J]. Current Drug Delivery, 2024, 21(2):193-210.
[26] WANG L H, WEI Z H, XUE C H, et al. Fucoxanthin-loaded nanoparticles composed of gliadin and chondroitin sulfate: Synthesis, characterization and stability[J]. Food Chemistry, 2022, 379:132163.
[27] MAHMOOD K, KAMILAH H, SUDESH K, et al. Study of electrospun fish gelatin nanofilms from benign organic acids as solvents[J]. Food Packaging and Shelf Life, 2019, 19:66-75.
[28] AZARSHAH A, MOOSAVI-NASAB M, KHORRAM M, et al. Characterization of the produced electrospun fish gelatin nanofiber containing fucoxanthin[J]. Food Science and Biotechnology, 2022, 32(3):329-339.
[29] MA Z X, KHALID N, SHU G F, et al. Fucoxanthin-loaded oil-in-water emulsion-based delivery systems: Effects of natural emulsifiers on the formulation, stability, and bioaccessibility[J]. ACS Omega, 2019, 4(6):10502-10509.
[30] SUN X W, XU Y, ZHAO L L, et al. The stability and bioaccessibility of fucoxanthin in spray-dried microcapsules based on various biopolymers[J]. RSC Advances, 2018, 8(61):35139-35149.
[31] OLIYAEI N, MOOSAVI-NASAB M, TANIDEH N. Preparation of fucoxanthin nanoemulsion stabilized by natural emulsifiers: Fucoidan, sodium caseinate, and gum Arabic[J]. Molecules, 2022, 27(19):6713.
[32] DONG H C, WANG S Y, FU C, et al. Sodium alginate and chitosan co-modified fucoxanthin liposomes: Preparation, bioaccessibility and antioxidant activity[J]. Journal of Microencapsulation, 2023, 40(8):649-662.
[33] ZHANG X, FAN M H, LUO K, et al. In vivo assessment of the effects of mono-carrier encapsulated fucoxanthin nanoparticles on type 2 diabetic C57 mice and their oxidative stress[J]. Antioxidants, 2022, 11(10):1976.
[34] SORASITTHIYANUKARN F N, MUANGNOI C, ROJSITTHISAK P, et al. Stability and biological activity enhancement of fucoxanthin through encapsulation in alginate/chitosan nanoparticles[J]. International Journal of Biological Macromolecules, 2024, 263:130264.
[35] KOO S Y, HWANG K T, HWANG S, et al. Nanoencapsulation enhances the bioavailability of fucoxanthin in microalga Phaeodactylum tricornutum extract[J]. Food Chemistry, 2023, 403:134348.
[36] TIAN X Y, LI J X, WANG K Y, et al. Microfluidic fabrication of core-shell fucoxanthin nanofibers with improved environmental stability for reducing lipid accumulation in vitro[J]. Food Chemistry, 2024, 442:138474.
[37] SALVIA-TRUJILLO L, SUN Q, UM B H, et al. In vitro and in vivo study of fucoxanthin bioavailability from nanoemulsion-based delivery systems: Impact of lipid carrier type[J]. Journal of Functional Foods, 2015, 17:293-304.
[38] BAI Y, SUN Y H, LI X, et al. Phycocyanin/lysozyme nano complexes to stabilize Pickering emulsions for fucoxanthin encapsulation[J]. Food Research International, 2023, 173:113386.
[39] JIAO B W, BI D C, ZHU N T, et al. Construction and application of the Pickering emulsion stabilized by genipin-crosslinked soybean protein isolate-chitooligosaccharide nanoparticle[J]. LWT, 2023, 184:115019.
[40] WANG C Y, JIN M R, SUN C H, et al. Rapeseed oil as the extraction solvent motivates fucoxanthin-loaded high internal phase emulsion preparation for food 3D printing[J]. LWT, 2023, 187:115349.
[41] WANG Y L, YANG J Y, WANG Y M, et al. Preparation and properties of fucoxanthin-loaded liposomes stabilized by sea cucumber derived cholesterol sulfate instead of cholesterol[J]. Journal of Bioscience and Bioengineering, 2023, 135(2):160-166.
[42] LI D H, LIU Y J, LIU Y X, et al. Encapsulation of fucoxanthin in fatty acid-bovine serum albumin micelles to improve the stability, bioavailability, and bioefficacy[J]. Colloids and Surfaces B: Biointerfaces, 2022, 220:112951.
[43] LIANG D, LIU C Y, LI Y, et al. Engineering fucoxanthin-loaded probiotics’ membrane vesicles for the dietary intervention of colitis[J]. Biomaterials, 2023, 297:122107.
[44] WANG C Y, WANG E Z, BAI Y, et al. Encapsulated fucoxanthin improves the structure and functional properties of fermented yogurt during cold storage[J]. Food Chemistry, 2023, 419:136076.
[45] LI D H, LIU Y J, MA Y, et al. Fabricating hydrophilic fatty acid-protein particles to encapsulate fucoxanthin: Fatty acid screening, structural characterization, and thermal stability analysis[J]. Food Chemistry, 2022, 382:132311.
[46] ZHAO Y Y, ZHI J L, HUANG S Y, et al. Fabrication of starch/zein-based microcapsules for encapsulation and delivery of fucoxanthin[J]. Food Chemistry, 2022, 392:133282.
[47] LI J X, LI Y, SU W T, et al. In vivo anti-obesity efficacy of fucoxanthin/HP-β-CD nanofibers in high-fat diet induced obese mice[J]. Food Chemistry, 2023, 429:136790.
[48] OLIYAEI N, TANIDEH N, MOOSAVI-NASAB M, et al. Development and characterization of a fucoidan-based nanoemulsion using Nigella sativa oil for improvement of anti-obesity activity of fucoxanthin in an obese rat model[J]. International Journal of Biological Macromolecules, 2023, 235:123867.
[49] SUI Y, GU Y, LU Y J, et al. Fucoxanthin@Polyvinylpyrrolidone nanoparticles promoted oxidative stress-induced cell death in caco-2 human colon cancer cells[J]. Marine Drugs, 2021, 19(2):92.
[50] JASWIR I, NOVIENDRI D, TAHER M, et al. Optimization and formulation of fucoxanthin-loaded microsphere (F-LM) using response surface methodology (RSM) and analysis of its fucoxanthin release profile[J]. Molecules, 2019, 24(5):947.