我国是世界上最大的肉类生产和消费国,据统计,2023年全国的肉类产量高达9 748万t[1],肉类是人类饮食中基本营养素的重要来源。然而,肉制品中存在的某些化合物(如饱和脂肪酸、胆固醇、盐和其他添加剂)能够引发非传染性慢性疾病,包括心血管疾病、糖尿病和结直肠癌等[2]。众所周知,益生菌在治疗腹泻、调节肠道菌群、增强免疫力、缓解肥胖、降低胆固醇、降低血压等方面发挥着重要作用。但是,益生菌对生存环境的要求较高,且益生菌携带的耐药基因具有转移的风险,这些问题阻碍了其在食品领域的应用[3]。
新的科学证据指出,益生菌的健康益处并不一定与活菌直接相关,其菌体本身、代谢产物或细胞裂解产物则是促进健康背后的驱动力[4]。因而,科学家们相继提出“后生元”的概念。后生元(postbiotics, P/PBS)是来源于益生菌细胞的可溶性化合物,包括细胞壁组分、细胞成分、细胞分泌物和代谢产物。近年来,“后生元”一词越来越多地出现在科学文献和商业产品中,但仍缺乏明确的定义。直至2021年,国际益生菌和益生元科学协会(International Scientific Association for Probiotics and Prebiotics,ISAPP)达成共识,将后生元定义为:对宿主健康有益的无生命微生物和/或其成分制剂[5]。
目前,后生元已在改善肉制品品质和开发功能性肉制品等方面展现出较大的潜力。因此,本文将从后生元主要活性成分、生物活性及其在肉制品中的应用研究现状进行综述,以期为后生元在肉制品中的开发应用上提供参考依据。
1 后生元中的活性成分
后生元按来源可分为菌体细胞组分、菌体代谢物和无细胞混合物。菌体细胞组分主要包括肽聚糖、脂磷壁酸、缩醛磷脂、膜蛋白、胞内多糖等,菌体代谢物包括短链脂肪酸(short-chain fatty acids,SCFAs)、胞外多糖(exopolysaccharides,EPS)、抗菌肽(antimicrobial peptide,AMP)、维生素、脂质、酵素等,而无细胞混合物包括培养基残留物、菌体结构成分和代谢物的混合物[6-7]。
1.1 短链脂肪酸
SCFAs是特定的肠道菌群(结肠厌氧菌)发酵膳食纤维和抗性淀粉而产生的主要代谢物,如乙酸、丙酸、丁酸等[8]。SCFAs有许多健康益处,包括抗炎、免疫调节、抗肥胖、抗糖尿病、抗癌、保护心血管和肝脏等[9]。研究表明,不同益生菌菌株产短链脂肪酸的能力有所不同。THANANIMIT等[10]发现副干酪乳杆菌(Lacticaseibacillus paracasei)SD1、鼠李糖乳杆菌(Lacticaseibacillus rhamnosus)SD11和L.rhamnosus GG均能表现出高丁酸产量,特别是L.paracasei SD1和L.rhamnosus SD11的复配组,且该组中的SCFAs通过多种途径在结肠中发挥积极的抗癌作用,包括抑制结肠癌相关病原体[如具核梭杆菌(Fusobacterium nucleatum)和牙龈卟啉单胞菌(Porphyromonas gingivalis)]的生长,抑制癌细胞的生长,以及刺激抗炎细胞因子IL-10和AMP,尤其是人β-防御素-2的产生。
1.2 胞外多糖
EPS是微生物中以紧密结合的胶囊或松散附着的黏液层形式排出的细胞外大分子,在抗氧化、抗肿瘤、抗菌或有毒化合物、抗渗透应激和调节免疫功能等方面发挥着显著作用[11]。蒋佳芸等[12]发现来自乳酸片球菌(Pediococcus acidilactici)HAO 2018的EPS对食源性致病菌志贺氏菌(Shigella)和阪崎克罗诺杆菌(Cronobacter sakazakii)具有显著的抑制效果,且EPS的抗氧化和抗肿瘤细胞HT-29的活性均呈浓度依赖性。KUMAR等[13]研究发现P.acidilactici NCDC 252的EPS为线性同多糖(α-葡聚糖),其总抗氧化活力为11.9%,且在10和100 μg/mL条件下对人结肠癌细胞HCT116的抑制率分别为67.1%和87.3%。LIU等[14]证实植物乳杆菌(Lactobacillus plantarum)WLPL04的EPS能够抑制人结肠癌细胞HT29的增殖,且对大肠杆菌(Escherichia coli)O157∶H7、铜绿假单胞菌(Pseudomonas aeruginosa)CMCC 10104、鼠伤寒沙门氏菌(Salmonella typhimurium)ATCC 13311和金黄色葡萄球菌(Staphylococcus aureus)CMCC 26003等病原菌的生物膜形成具有很强的抑制作用。KARACA等[15]发现L.plantarum EIR/IF-1的EPS含有葡萄糖、半乳糖和果糖,能通过降低细菌疏水性来抑制细菌聚集并与碳氢化合物的结合,从而对口腔细菌表现出抗生物膜活性。
1.3 抗菌肽
AMP可通过在细胞膜上形成孔隙或抑制细胞壁的合成而发挥抑菌作用[16],还可作为增强天然免疫的调节剂和内毒素的中和剂[17] 使用。其中,细菌素是一类被广泛研究的AMP,由革兰氏阳性菌和革兰氏阴性菌共同产生,具有广谱抗菌活性[18]。例如,从L.plantarum W3-2中分离出的细菌素具有良好的热稳定性和广谱抗菌能力[19];乳酸链球菌素能够抑制多种食品腐败菌和耐药性菌株的生长,包括耐甲氧西林S.aureus、肺炎链球菌(Streptococcus pneumoniae)、肠球菌(Enterococci)和艰难梭菌(Clostridium difficile)等[20]。
1.4 无细胞上清液
无细胞上清液(cell-free supernatant, CFS)中含有微生物代谢物和所用培养基的残余营养物质,主要包括有机酸、脂肪酸和蛋白质等,具有抗菌、抗氧化和抗炎特性[21]。LEE等[22]发现CFS对S.aureus和E.coli具有抗菌作用,并可通过调节角质细胞中透明质酸合成酶和丝状蛋白的mRNA表达来改善皮肤屏障功能。ESCAMILLA等[23]发现干酪乳杆菌(Lactobacillus casei)和L.rhamnosus的CFS降低了结肠癌细胞的体外侵袭率,显示出了抗癌效果。胡安琪等[24]发现枯草芽孢杆菌(Bacillus subtilis)的CFS中的肽类抑菌物质的疏水基团与单增李斯特菌(Listeria monocytogenes)No.118细胞膜成分中的疏水基团相互作用,使其极性降低,表现出疏水抑制,从而影响L.monocytogenes生物膜的形成。
2 后生元的功能特性
后生元的功能特性主要包括抗菌、抗氧化、抗炎、抗癌以及缓解骨质疏松、缓解皮肤炎症和缓解肥胖等(表1)[25-33]。
表1 后生元的主要功能特性
Table 1 The mainly functional characteristics of postbiotics

后生元活性成分后生元来源菌株功能特性参考文献CFS酿酒酵母菌(Saccharomyces cerevisiae)PTCC 5269抗菌(L.monocytogenes、变异链球菌Streptococcus mutans、伤寒沙门氏菌Salmonella typhi、E.coli);抗氧化(具有较高的酚类和类黄酮含量,具有显著的自由基清除能力);抑制α-葡萄糖苷酶活力;降低胆固醇;抗癌[25]乳酸杆菌(Lactobacillus)抗菌(E.coli、S.aureus、鲍曼不动杆菌Acinetobacter baumannii);抗氧化(总酚、总黄酮);抗炎[降低一氧化氮(NO)的产生][26]唾液链球菌(Streptococcus sali-varius)M18抗菌(P.aeruginosa、肺炎克雷伯菌Klebsiella pneumonia);抗癌(结肠癌细胞)[27]灭活的死细胞卷曲乳杆菌(Lactobacillus crispatus)CCFM1118抗菌(幽门螺杆菌Helicobacter pylori),影响人体内肠道菌丰度[28]L.plantarum MD35影响小鼠的破骨细胞,从而缓解骨质疏松[29]L.paracasei DCF 0429增加细胞活力和调节促炎细胞因子,缓解皮肤炎症[30]细菌素L.plantarum M4L1抗菌(嗜水气单胞菌Aeromonas hydrophila、L.monocytogenes、弗氏柠檬酸杆菌Citrobacter freundii、肠沙门氏菌Salmonella enterica、A.baumannii、副溶血性弧菌Vibrio parahaemolyticus等)[31]菌体代谢物魏斯氏菌(Weissella spp.)抗菌(地衣芽孢杆菌Bacillus licheniformis、L.monocytogenes、P.aeruginosa);抗氧化(总酚、总黄酮)[32]胞外多糖动物双歧杆菌(Bifidobacterium animalis)IPLA R1调节葡萄糖稳态促进脂质代谢,进而缓解肥胖[33]
2.1 抗菌作用
后生元中的SCFAs、EPS、AMP、CFS等成分因具有抗菌作用而被广泛应用于食品工业,其可能的抗菌机制如图1所示[34-36]。HOSSEINI等[25]构建了全脂牛奶和肉糜的食品模型,以评估S.cerevisiae PTCC 5269的CFS的抗菌活性。研究发现,该菌株的CFS对S.typhi、E.coli、S.mutans、L.monocytogenes均具有抗菌活性,源于其能够抑制受试细菌产生重要的酶,并破坏细胞壁。其中,该CFS对L.monocytogenes的抑菌能力最强,对E.coli的抑菌能力最弱,原因在于革兰氏阴性菌细胞壁的主要成分包括脂蛋白和脂多糖,这有助于增强细菌对抑菌物质的抵抗力。张晓妍等[31]从青岛市售腐乳中筛选出一株产细菌素的L.plantarum M4L1,发现该菌株的细菌素LP01对A.hydrophila Ah2的最小抑菌浓度(minimal inhibit concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)分别为12.94和25.88 μg/mL。经MBC浓度的LP01处理后的Ah2,溶血活性和细胞毒性均明显下降,扫描电镜观察LP01通过破坏Ah2的细胞壁而发挥抑菌作用。此外,细菌素LP01具备优良的抑菌性能,能够抑制多种水产病原菌、食物腐败菌及食源性致病菌等。陈峰等[28]以来自L.crispatus CCFM1118制备后生元,发现其可对H.pylori产生(12.25±0.29) mm的抑菌圈,且临床测评显示,后生元可显著降低患者的13C-尿素呼气值、抑制患者PGⅠ/PGⅡ升高,并影响患者拟杆菌属、瘤胃球菌等肠道菌的丰度,但不会影响受试者的正常生理状态。
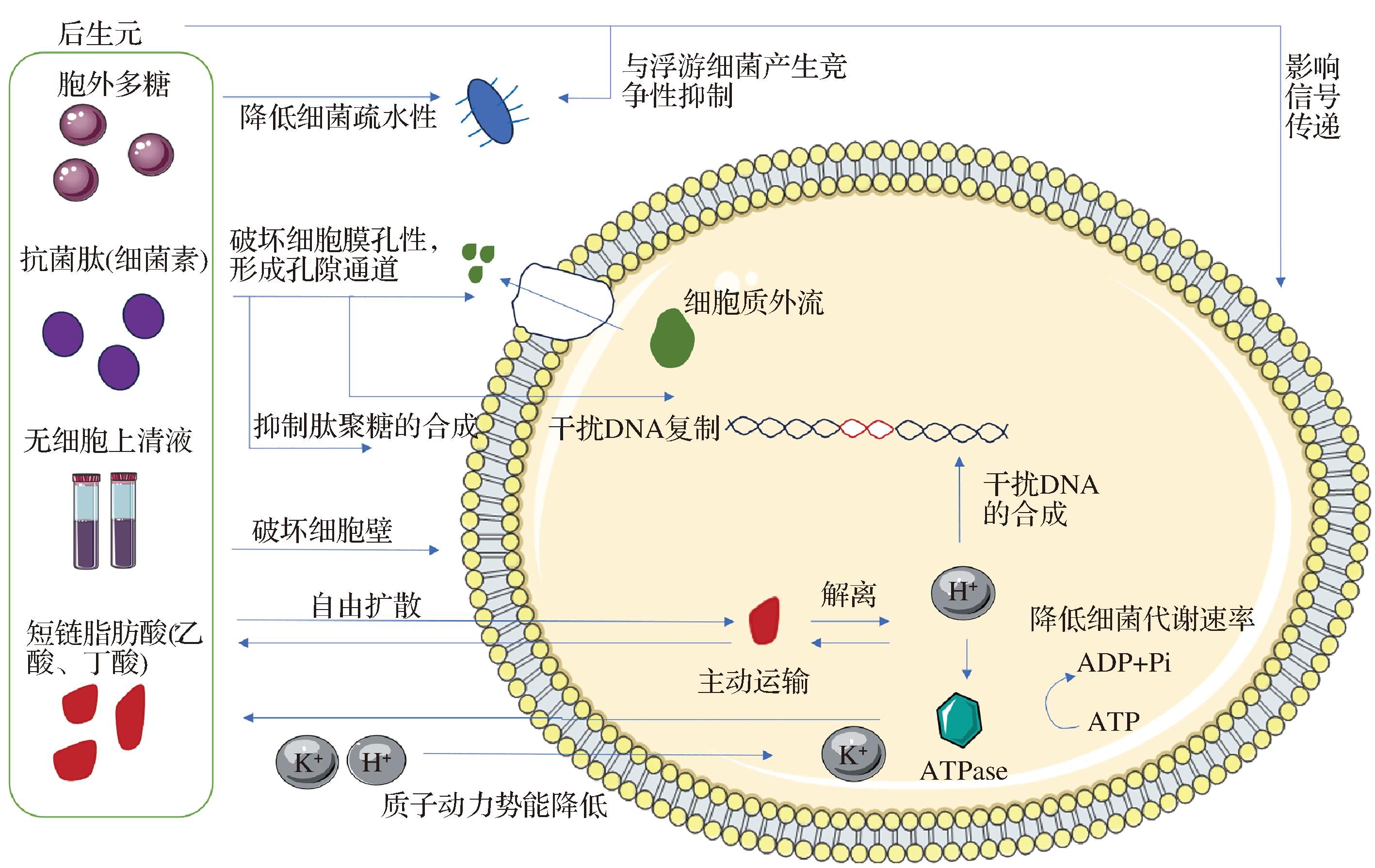
图1 后生元物质可能的抗菌机理
Fig.1 Possible antimicrobial mechanisms in postbiotic substances
2.2 抗氧化作用
研究表明,菌体代谢物中具有较高含量的酚类和黄酮化合物,可直接影响其抗氧化活性[37]。KIRAN等[32]从蜂花粉微生物群中分离出一些有益细菌,并研究了相应菌株代谢物的抗氧化和抗菌特性。结果表明,食窦魏斯氏菌(Weissela cibaria)29.1代谢物中的酚类含量最高(28.23 mg 没食子酸当量/g),融合魏斯氏菌(Weissela confusa)15.1代谢物中的黄酮含量最高(4.8 mg槲皮素当量/g)。此外,W.confusa 15.1、W.cibaria 18.3、W.cibaria 29.1的质量浓度>10 mg/mL时均具有很强的DPPH自由基清除能力,其IC50值分别为5.28、2.33和1.73 mg/mL。
2.3 抗炎作用
炎症是许多炎症性疾病的标志,如慢性消化性溃疡、克罗恩病和传染病。促炎细胞因子通常由革兰氏阴性菌细胞壁中的脂多糖诱导产生, NO是在炎症免疫反应中具有关键作用的多功能介质[38]。SORNSENEE等[26]通过构建脂多糖诱导小鼠巨噬细胞RAW 264.7炎症模型,研究了10株Lactobacillus的CFS对RAW 264.7细胞中NO产量的影响,以评估菌株的抗炎活性。结果表明,脂多糖诱导的RAW 264.7细胞培养液中的NO浓度为(39.89±0.91) μmol/L,而Lactobacillus的CFS均能将炎症细胞的NO产量降至10 μmol/L以下,可能是由于诱导型一氧化氮合酶(各种慢性炎症疾病的主要介质)的下调所致。
2.4 抗癌作用
癌细胞独特的糖酵解代谢会产生过量乳酸,酸碱调节因子(如Na+/H+交换器和单羧酸转运蛋白)将质子和乳酸从肿瘤细胞输出到细胞外环境,使得癌细胞外部pH值低于血液和组织的pH值,导致肿瘤微环境酸中毒[39]。KARAÇAM等[27]通过构建肿瘤细胞微环境模型(pH值5.5),发现S.salivarius M18的CFS对结肠癌细胞具有毒性,而在健康组织的pH值条件下则没有细胞毒性。研究结果表明,该菌株的CFS可降低抗凋亡标志物X连锁凋亡抑制蛋白的表达,增强细胞凋亡关键介质caspase-3的表达,从而促进结肠癌细胞凋亡。
2.5 其他
除了上述抗菌、抗氧化等特性外,后生元还被证明具有缓解骨质疏松、抗糖尿病、缓解皮肤炎症等功能。例如,MYEONG等[29]从萝卜水泡菜中分离出L.plantarum MD35,发现其后生元能够影响小鼠骨髓源性巨噬细胞培养物中的破骨细胞分化。并且,它还可以有效防止卵巢切除小鼠(绝经后骨质疏松症的动物模型)因雌激素缺乏引起的骨质流失。SALAZAR等[33]给高脂饮食大鼠喂食能够产胞外多糖的B.animalis IPLA R1,发现其可降低空腹血清胰岛素和肝脏中甘油三酯的含量,证明该菌株有助于调节葡萄糖稳态和促进脂质代谢,从而具有改善肥胖相关代谢紊乱的潜力。此外,LEE等[30]从韩国传统发酵泡菜中分离出L.paracasei DCF0429,发现其产生的后生元可以通过增加细胞活力和调节促炎细胞因子来保护表皮组织免受氧化应激。这一结果表明后生元可以在氧化应激诱导的表皮组织中发挥潜在的保护作用。
3 后生元在肉制品中的应用
后生元因其多种功能特性,在食品、保健品等领域具有广阔的应用前景。目前,在肉制品中多利用后生元抑菌特性以延长保质期,应用方式包括直接应用和间接应用,如表2所示。
表2 后生元对肉品品质的影响
Table 2 Effects of postbiotics on the quality of meat products

作用方式产品后生元来源菌株添加方法贮存条件对肉品品质的影响参考文献直接浸泡生牛肉、熟牛肉L.plantarum NRRL B-449610倍浓缩的L.plantarum CFS与质量分数0.35% NaCl、0.45% Hamine(商用磷酸钠混合物)复配成腌制剂,以料液比5∶1(g∶mL)的比例腌渍牛肉4 ℃下腌制14 h微生物:E.coli、S.aureus、桑氏志贺氏菌(Shigella sonnei)、荧光假单胞菌(Pseudomonas fluorescens)、S.typhimurium和L.monocytogenes的数量显著下降理化性质:L∗值显著下降,a∗值显著升高,肉品呈现暗棕色[40]直接浸泡鸡胸肉P.acidilactici添加体积分数为10%和50%的CFS,样品浸泡3 min后真空包装4 ℃下贮存15 d微生物:L.monocytogenes、S.typhimurium显著减少理化性质:对鸡胸肉的pH值和色泽没有显著影响[41]直接浸泡鸡胸肉P.acidilactici添加体积分数为50% WCP,样品浸泡10 min后真空包装(4±1) ℃下保存15 d微生物:S.typhimurium、E.coli O157∶H7、L.monocytogenes、总活菌数、乳酸菌、耐冷菌、霉菌和酵母菌数量明显降低理化性质:pH值变化不大,TBARS和TVB-N值降低,对样品的色泽(L∗、a∗和b∗)有显著影响,褐变指数显著升高[42]点种猪肉香肠弯曲乳杆菌(Lacto-bacillus curvatus)B67单独/联合使用后生元冻干粉(溶于200 mg/mL蒸馏水)和槲皮素(溶于1 mg/mL二甲基亚砜),在香肠的内表面(有肠衣)和外表面(无肠衣)接种100 μL10 ℃下贮存5 d微生物:L.monocytogenes、S.typhimurium显著降低理化性质:色泽(L∗、a∗和b∗)和硬度无显著变化感官品质:维持了香肠的感官特征[43]直接添加猪肉丸L.plantarum JL-A65诱变菌株细菌素后生元(8、16、24、32 mg/kg)复配双乙酸钠添加于肉泥中,搅拌均匀后成形分装4 ℃下贮藏14 d微生物:对照组的菌落总数在第8 天已超过6.0 lg CFU/g,含有细菌素(16、24、32 mg/kg)的样品组在第11 d达6.0 lg CFU/g理化性质:对照组的TVB-N值在第8 天已接近20 mg/100 g(开始腐败),含有细菌素(16、24、32 mg/kg)的样品组在第12 天才开始腐败;对照组的pH值在第6 天已达到6.4(接近腐败肉标准),处理组的pH值在12 d之后才接近6.4[44]直接添加猪肉火腿片戊糖片球菌(Pedio-coccus pentosaceus)ATCC 43200在人工污染的猪肉火腿片表面分别喷涂500 μL CFS和细菌素4 ℃下贮藏10 d微生物:L.monocytogenes数量从1.74降低至1 lg CFU/g以下理化性质:样品失重率和TBARS值显著降低,L∗、a∗、b∗值无显著变化[45]直接添加禽肉糜L.plantarum S61直接添加 CFS,其中最低杀真菌和杀细菌浓度分别为8%和10%(体积分数)4 ℃下贮藏7 d微生物:显著抑制L.monocytogenes ATCC19117、粘红酵母(Rhodotorula glutinis)UMP22生长理化性质:a∗值和b∗值显著升高,pH值显著降低;水分活度未发生显著变化[46]直接添加碎牛肉凝胶L.plantarum 90在制得的碎牛肉凝胶中添加 CFS(0%、0.5%、1%、2.5%、5%,体积分数)4 ℃下贮藏10 d微生物:显著抑制嗜中温需氧菌的生长理化性质:pH值随添加量增加而显著降低;添加量超过0.5%时,硬度、黏聚性、弹性、咀嚼性显著下降;添加量达到2.5%和5%时,蒸煮损失、L∗和a∗值显著降低[47]直接添加猪肉肌原纤维蛋白凝胶P.acidilactici S1在蛋白凝胶中添加不同量(0、30、60、90和120 g/L)的EPS溶液4 ℃下贮藏24 h理化性质:提升肉制品凝胶的保水性、强度和流变性[48]抗菌薄膜碎牛肉L.plantarumATCC 14917用浸渍法分别将体积分数为5%、20%、35%的后生元与细菌纳米纤维素制成抗菌薄膜(4±1) ℃下贮藏9 d微生物:L.monocytogenes、嗜温菌、嗜冷菌数量显著减少理化性质:pH值、TBARS值显著降低,L∗、a∗、b∗值无显著变化感官品质:各组间无显著差异[49]抗菌薄膜牛肉糜清酒乳杆菌(Lacto-bacillus sakei)ATCC 15521采用常规包衣法和超声辅助包衣法将 CFS和BNC制成抗菌薄膜8±1 ℃下保存9 d微生物:L.monocytogenes数量显著减少[50]抗菌薄膜牛肉L.sakei NRRL B-1917CFS与乳清分离蛋白制备薄膜5 ℃下贮存5 d微生物:E.coli、L.monocytogenes数量显著降低理化性质:L∗、a∗、b∗值显著降低感官品质:处理组的生牛肉颜色评分有所降低,而该组烤牛肉的风味、颜色、总体可接受度优于对照组[51]可食用涂层羊肉布拉迪酵母菌(Sac-charomyces cerevisiae var.boulardii)ATCC MYA-796吐温80(1.75 g)与MSM(5 g)混合并溶解于100 mL蒸馏水中,同时加热并搅拌,然后添加S.cerevisiae var.boulardii PSB(0%、2%、4%、6%、8%和10%,体积分数)制备涂层4 ℃下贮存10 d微生物:S.aureus、E.coli数量、总活菌数等显著减少理化性质:维持pH值稳定,延缓样品的水分含量降低、硬度下降和脂质氧化感官品质:MSM+10% PSB-制得的可食用涂层有助于维持样品的感官特性[52]
注:WCP:全细胞后生元(whole cell postbiotics);MSM:锦葵籽多糖黏液(Malva sylvestris seed polysaccharide mucilage);TVB-N:挥发性盐基氮(total volatile basic nitrogen);TBARS:硫代巴比妥酸反应物;BNC:细菌纳米纤维素(bacterial nano cellulose);PSB:布拉迪酵母菌的后生元(postbiotics from S.cerevisiae var. Boulardii)。
3.1 后生元对肉品中微生物的影响
ARRIOJA-BRET N等[40]评价了乳酸菌产生的CFS对E.coli、S.aureus、S.sonnei、P.fluorescens、S.Typhimurium和L.monocytogenes的体外抗菌效果。将接种有害菌的生牛肉置于CFS腌制剂中保存14 h(4 ℃),发现沙门氏菌(Salmonella)的数量由5.87 lg CFU/g降至2.13 lg CFU/g,E.coli数量由5.58 lg CFU/g降至4.28 lg CFU/g,L.monocytogenes数量由5.44 lg CFU/g降至3.14 lg CFU/g,S.aureus数量由5.84 lg CFU/g降至4.51 lg CFU/g。作者认为这些CFS的抑菌活性可能与产生的有机酸(如乙酸和乳酸)有关,因为有机酸可能会干扰细胞膜电位的维持、抑制主动转运、降低细胞内pH值,并影响多种代谢功能。类似地,DEL等[51]用L.sakei NRRL B-1917的CFS与乳清分离蛋白制备抗菌薄膜,并研究其对冷藏牛肉(5 ℃)品质的影响。样品在冷藏36 h后,CFS薄膜处理组中的E.coli数量已降至检测限以下(<10 CFU/g);冷藏120 h后,L.monocytogenes数量由3.50 lg CFU/g降至2.10 lg
N等[40]评价了乳酸菌产生的CFS对E.coli、S.aureus、S.sonnei、P.fluorescens、S.Typhimurium和L.monocytogenes的体外抗菌效果。将接种有害菌的生牛肉置于CFS腌制剂中保存14 h(4 ℃),发现沙门氏菌(Salmonella)的数量由5.87 lg CFU/g降至2.13 lg CFU/g,E.coli数量由5.58 lg CFU/g降至4.28 lg CFU/g,L.monocytogenes数量由5.44 lg CFU/g降至3.14 lg CFU/g,S.aureus数量由5.84 lg CFU/g降至4.51 lg CFU/g。作者认为这些CFS的抑菌活性可能与产生的有机酸(如乙酸和乳酸)有关,因为有机酸可能会干扰细胞膜电位的维持、抑制主动转运、降低细胞内pH值,并影响多种代谢功能。类似地,DEL等[51]用L.sakei NRRL B-1917的CFS与乳清分离蛋白制备抗菌薄膜,并研究其对冷藏牛肉(5 ℃)品质的影响。样品在冷藏36 h后,CFS薄膜处理组中的E.coli数量已降至检测限以下(<10 CFU/g);冷藏120 h后,L.monocytogenes数量由3.50 lg CFU/g降至2.10 lg ![]() 等[41]研究了P.acidilactici的后生元(P)以及壳聚糖(chitosan,CH)对鸡胸肉品质的影响,将鸡胸肉分别在不同处理组(10% P、50% P、1% CH、10% P+1% CH、50% P+1% CH,均为质量分数)中浸泡3 min后,置于4 ℃保存15天。结果表明,与对照组相比,10%和50%后生元处理可使鸡胸肉样品中的L.monocytogenes减少约1.3 lg CFU/g,10%后生元对S.typhimurium的数量无显著影响,而50%后生元处理组中的S.typhimurium减少了约1.0 lg CFU/g;当后生元和CH联合使用时,两种有害菌的减少量可达1.5~2.1 lg CFU/g。作者指出,后生元的抑菌特性源于细菌产生的有机酸,而后生元与CH表现出协同抗菌作用的原因可能是CH与细菌膜的脂多糖双分子层中的离子发生了螯合作用,这种螯合作用可能导致细胞壁渗透性增加,从而使抗菌物质进入细胞。
等[41]研究了P.acidilactici的后生元(P)以及壳聚糖(chitosan,CH)对鸡胸肉品质的影响,将鸡胸肉分别在不同处理组(10% P、50% P、1% CH、10% P+1% CH、50% P+1% CH,均为质量分数)中浸泡3 min后,置于4 ℃保存15天。结果表明,与对照组相比,10%和50%后生元处理可使鸡胸肉样品中的L.monocytogenes减少约1.3 lg CFU/g,10%后生元对S.typhimurium的数量无显著影响,而50%后生元处理组中的S.typhimurium减少了约1.0 lg CFU/g;当后生元和CH联合使用时,两种有害菌的减少量可达1.5~2.1 lg CFU/g。作者指出,后生元的抑菌特性源于细菌产生的有机酸,而后生元与CH表现出协同抗菌作用的原因可能是CH与细菌膜的脂多糖双分子层中的离子发生了螯合作用,这种螯合作用可能导致细胞壁渗透性增加,从而使抗菌物质进入细胞。
3.2 后生元对肉品理化性质的影响
3.2.1 pH值
pH值是反映肉品质量的一个重要指标,肉品在贮藏期间的蛋白质降解和微生物繁殖可能导致pH值升高。ABBASI等[52]以不同浓度的S.cerevisiae var.boulardii ATCC MYA-796的PSB和MSM制备可食用涂层,研究其对羊肉在贮存期间(4 ℃,10 d)的影响。结果表明,随着贮存时间的延长,对照组、MSM+0% (质量分数)PSB、MSM+2% PSB和MSM+4% PSB、MSM+6% PSB和MSM+8% PSB处理组样品的pH值总体呈上升趋势(P<0.05),MSM+10% PSB组的pH值则先升高后下降。羊肉pH值上升的原因在于内源酶和微生物酶分解蛋白质产生了含氮物质,而添加PSB的样品的pH值均低于对照组。其中,MSM+10% PSB组的pH值(5.69~6.02)较为稳定,可能是由于该菌株产生的二氧化碳的积累导致pH值下降以及抑制了样品中微生物繁殖。
3.2.2 TBARS
脂质氧化是肉类和肉制品在贮藏期间最重要的化学变化之一,脂质氧化初期产生的氢过氧化物会促进一系列降解反应,导致多种挥发性化合物的生成,从而使肉类出现异味。脂质氧化的副产物如丙二醛(malonaldehyde,MDA)可作为评估其氧化状态的生物标志物,肉品中的MDA含量通常用硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)来表示。SHAFIPOUR等[49]以L.plantarum ATCC 14917的后生元(P)和BNC制备了抗菌薄膜,用其包裹牛肉后置于无菌聚乙烯容器中贮存[(4±1) ℃,9 d]。研究发现,在贮藏第9 天时,BNC处理组样品的TBARS值(0.85 mg MDA/kg)与对照组(0.87 mg MDA/kg)之间无显著差异,而后生元抗菌膜处理组(P-BNC)的TBARS值(0.72 mg MDA/kg)则显著较低(P<0.05)。DE等[45]使用P.pentosaceus ATCC 43200的细菌素和CFS处理火腿片,发现样品在贮藏过程中(4 ℃,10 d)的TBARS值增加缓慢。在贮藏结束时,与对照组的TBARS值(1.25 mg MDA/kg)相比,CFS处理组(0.66 mg MDA/kg)和细菌素处理组(0.63 mg MDA/kg)显著较低(P<0.05)。作者认为,该菌株的这2种后生元成分都可能促进了脂肪酸链之间的疏水相互作用,通过减少脂质与氧气的接触从而延缓了氧化进程。
3.2.3 TVB-N
TVB-N是指肉品在贮藏过程中,由于肌肉中内源酶和微生物的共同作用,蛋白质分解而产生的氨及胺类等碱性含氮物质。TVB-N含量能够检验肉品的新鲜程度,其含量越高表明蛋白质的分解和变质越严重,肉品中的腐败味道也越浓。![]() 等[42]比较了P.acidilactici的WCP和CFS后生元的理化性质和抗菌性能,并发现WCP与CH和百里酚(thymol,Th)联用能够延长鸡胸肉的货架期。在样品贮藏期间[(4±1) ℃,15 d],与对照组相比,用WCP及其与CH、Th复配处理组的TVB-N含量相对较低,且随时间的延长增加缓慢。相关性分析显示,鸡胸肉的TVB-N含量与耐冷菌(r=0.647)和乳酸菌(r=0.537)之间均存在强正相关性(P<0.01),而TVB-N含量与霉菌和酵母菌(r=0.473)以及假单胞菌(r=0.338)之间均呈中度正相关(P<0.01)。作者认为,后生元处理样品可通过降低腐败菌数量和蛋白水解活性而减缓含氮成分的积累。
等[42]比较了P.acidilactici的WCP和CFS后生元的理化性质和抗菌性能,并发现WCP与CH和百里酚(thymol,Th)联用能够延长鸡胸肉的货架期。在样品贮藏期间[(4±1) ℃,15 d],与对照组相比,用WCP及其与CH、Th复配处理组的TVB-N含量相对较低,且随时间的延长增加缓慢。相关性分析显示,鸡胸肉的TVB-N含量与耐冷菌(r=0.647)和乳酸菌(r=0.537)之间均存在强正相关性(P<0.01),而TVB-N含量与霉菌和酵母菌(r=0.473)以及假单胞菌(r=0.338)之间均呈中度正相关(P<0.01)。作者认为,后生元处理样品可通过降低腐败菌数量和蛋白水解活性而减缓含氮成分的积累。
3.2.4 色泽
色泽是人们评价肉品质量的一个重要因素,良好的色泽能够激发消费者的购买欲。ARRIOJA-BRET N等[40]用乳酸菌的CFS腌制生牛肉和烤牛肉,发现2种牛肉的红度(a*)值均显著升高,亮度(L*)值均显著降低(P<0.05)。作者指出,CFS腌制剂的pH值低于标准腌料,而pH值降低时易使肌红蛋白氧化为高铁肌红蛋白,导致肉品呈现暗棕色。上述提到的
N等[40]用乳酸菌的CFS腌制生牛肉和烤牛肉,发现2种牛肉的红度(a*)值均显著升高,亮度(L*)值均显著降低(P<0.05)。作者指出,CFS腌制剂的pH值低于标准腌料,而pH值降低时易使肌红蛋白氧化为高铁肌红蛋白,导致肉品呈现暗棕色。上述提到的![]() 等在用P.acidilactici的CFS后生元和CH处理鸡胸肉时[41],发现各组样品的L*、a*和b*值无显著性差异;而在以该菌株的WCP和CH处理鸡胸肉时[42],发现其对样品的色泽具有显著影响(P<0.05)。其中,CH处理导致样品的褐变指数值在第一天显著下降(P<0.05),而WCP处理则提高了样品的褐变指数值(P<0.05),原因可能在于鸡胸肉曾在WCP溶液(呈褐色)中浸泡过10 min。
等在用P.acidilactici的CFS后生元和CH处理鸡胸肉时[41],发现各组样品的L*、a*和b*值无显著性差异;而在以该菌株的WCP和CH处理鸡胸肉时[42],发现其对样品的色泽具有显著影响(P<0.05)。其中,CH处理导致样品的褐变指数值在第一天显著下降(P<0.05),而WCP处理则提高了样品的褐变指数值(P<0.05),原因可能在于鸡胸肉曾在WCP溶液(呈褐色)中浸泡过10 min。
3.2.5 其他
肉制品的保水能力对于货架期具有重要影响,DE等[45]研究发现,经过P.pentosaceus ATCC 43200的CFS处理的火腿片在4 ℃下贮藏10 d后,其失水率(2.77%)低于对照组(3.00%)。WANG等[47]在碎牛肉凝胶中添加L.plantarum 90的CFS,发现CFS的添加量达到2.5% 和5%时,凝胶的蒸煮损失分别为50.08%和44.85%,显著低于对照组(51.80%)。分析发现,可能是由于酸性pH环境(pH值<5)导致肌纤维蛋白过早变性和聚集,导致形成的凝胶结构较为疏松,有助于截留更多的自由水,从而降低了蒸煮损失。另外,乳酸菌EPS也能够代替凝胶和磷酸盐来改善肉制品的质量属性[53]。例如,LU等[48]在猪肉肌原纤维蛋白中添加P.acidilactici S1的EPS以制备凝胶,发现EPS对凝胶的保水性、强度和流变性方面具有改善作用。EPS可通过增强疏水相互作用促进肌球蛋白的聚集,并加速凝胶蛋白的二级结构从无序转向有序,从而增强了热诱导凝胶结构。因此,EPS可作为低脂肉制品的胶凝剂,在低脂肉制品开发中具有重要意义。
3.3 后生元对肉品感官特征的影响
肉品中微生物增殖和理化特征改变会影响消费者的接受度。在上述提到ABBASI等[52]的研究中发现, MSM+10% PSB制备的可食用涂层有助于维持羊肉在4 ℃条件下贮藏期间的颜色、外观和总体可接受度(评分≈8分,满分=9分),而对照组和不含PSB涂层组的羊肉的总体可接受度分别在贮藏7 d(评分=4.03分)和10 d(评分=4.12分)后被认为不理想,因为感官评分>4分的肉品才能食用。作者指出,微生物繁殖和脂质氧化副产物的积累会引起肉类产生异味,MSM+PSB处理组的羊肉片的理化特征和微生物数量相对稳定,其感官评分也较理想。TOUSHIK等[43]使用L.curvatus后生元和槲皮素接种于香肠内外表面,并探究其对香肠贮存期间(10 ℃,5 d)品质的影响。感官评价结果表明,后生元及其与槲皮素联合处理有助于保持香肠的外观、颜色、质地、风味和总体可接受度,且感官评分>5分(满分=7分)。因此,在肉制品中添加后生元并不会改变原有的风味和质地,还可能有助于延缓脂质氧化、降低有害微生物的影响,从而延长产品的保质期。
4 总结与展望
后生元包括细胞壁组分、SCFAs、EPS、AMP、CFS等,具有抗菌、抗氧化、抗炎、免疫调节等功效。后生元在食品工业中已展现出较大的应用潜力,例如有助于丰富肉制品的营养、改善感官品质以及延长保质期等。然而,现阶段关于后生元发挥益生功能的作用机制尚不完全明确,在功能性肉制品的开发应用等方面也鲜有报道。因此,为了促进后生元及其在肉品工业中的发展,未来需要关注的研究方向包括:a)进一步探索后生元的功能活性,并在分子水平上挖掘其对人体消化吸收及健康的潜在作用机制;b)不断发现新的后生元来源菌株,并研究后生元在肉制品应用中的有效剂量和加工贮藏稳定性;c)关于后生元在功能性肉制品和抗菌包装中的研发方面主要停留在实验室阶段,应重视相关产品的工业化生产。
[1] 国家统计局. 畜产品产量 [DB/OL].https://data.stats.gov.cn/easyquery.htm?cn=C01&zb=A0D0P&sj=2023.[2024-01-17]/[2024-04-10].The National Bureau of Statistics.Livestock production [DB/OL].[1]https://data.stats.gov.cn/easyquery.htm?cn=C01&zb=A0D0P&sj=2023.[2024-01-17]/[2024-04-10].
[2] THØGERSEN R, BERTRAM H C.Reformulation of processed meat to attenuate potential harmful effects in the gastrointestinal tract-A review of current knowledge and evidence of health prospects[J].Trends in Food Science &Technology, 2021, 108:111-118.
[3] 刘红霞, 李雪利, 吴秀英, 等.后生元研究进展及应用现状[J].食品科学, 2024, 45(1):326-333.LIU H X, LI X L, WU X Y, et al.Progress on research and application of postbiotics[J].Food Science, 2024, 45(1):326-333.
[4] AGUILAR-TOAL J E, GARCIA-VARELA R, GARCIA H S, et al.Postbiotics:An evolving term within the functional foods field[J].Trends in Food Science &Technology, 2018, 75:105-114.
J E, GARCIA-VARELA R, GARCIA H S, et al.Postbiotics:An evolving term within the functional foods field[J].Trends in Food Science &Technology, 2018, 75:105-114.
[5] The International Scientific Association of Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of postbiotics | Nature Reviews Gastroenterology &Hepatology[EB].
[6] 李杨, 周湘人, 郭薇丹, 等.后生元的研究进展[J].食品安全质量检测学报, 2021, 12(16):6558-6564.LI Y, ZHOU X R, GUO W D, et al.Research progress of postbiotics[J].Journal of Food Safety &Quality, 2021, 12(16):6558-6564.
[7] 瞿茜楠, 兰冬雪, 黄天, 等.后生元的功能及应用研究进展[J].食品研究与开发, 2023, 44(7):6-13.QU X N, LAN D X, HUANG T, et al.Function and application of postbiotics:A review[J].Food Research and Development, 2023, 44(7):6-13.
[8] 杨雪, 高亚男, 王加启, 等.短链脂肪酸的功能研究进展[J].食品科学, 2023, 44(13):408-417.YANG X, GAO Y N, WANG J Q, et al.Research progress on the functions of short chain fatty acid[J].Food Science, 2023, 44(13):408-417.
[9] XIONG R G, ZHOU D D, WU S X, et al.Health benefits and side effects of short-chain fatty acids[J].Foods, 2022, 11(18):2863.
[10] THANANIMIT S, PAHUMUNTO N, TEANPAISAN R.Characterization of short chain fatty acids produced by selected potential probiotic Lactobacillus strains[J].Biomolecules, 2022, 12(12):1829.
[11] ANGELIN J, KAVITHA M.Exopolysaccharides from probiotic bacteria and their health potential[J].International Journal of Biological Macromolecules, 2020, 162:853-865.
[12] 蒋佳芸, 赵崇杰, 李雪宁, 等.乳酸片球菌HAO2018胞外多糖的生物活性研究[J].食品与发酵工业, 2023, 49(22):27-32.JIANG J Y, ZHAO C J, LI X N, et al.Biological activity of exopolysaccharides from Pediococcus acidilactici HAO2018[J].Food and Fermentation Industries, 2023, 49(22):27-32.
[13] KUMAR R, BANSAL P, SINGH J, et al.Purification, partial structural characterization and health benefits of exopolysaccharides from potential probiotic Pediococcus acidilactici NCDC 252[J].Process Biochemistry, 2020, 99:79-86.
[14] LIU Z Q, ZHANG Z H, QIU L, et al.Characterization and bioactivities of the exopolysaccharide from a probiotic strain of Lactobacillus plantarum WLPL04[J].Journal of Dairy Science, 2017, 100(9):6 895-6 905.
[15] KARACA B, HALISCELIK O, GURSOY M, et al.Analysis of chemical structure and antibiofilm properties of exopolysaccharides from Lactiplantibacillus plantarum EIR/IF-1 postbiotics[J].Microorganisms, 2022, 10(11):2200.
[16] SCOCCHI M, MARDIROSSIAN M, RUNTI G, et al.Non-membrane permeabilizing modes of action of antimicrobial peptides on bacteria[J].Current Topics in Medicinal Chemistry, 2016, 16(1):76-88.
[17] CHUNG P Y, KHANUM R.Antimicrobial peptides as potential anti-biofilm agents against multidrug-resistant bacteria[J].Journal of Microbiology, Immunology and Infection, 2017, 50(4):405-410.
[18] HOLS P, LEDESMA-GARC A L, GABANT P, et al.Mobilization of microbiota commensals and their bacteriocins for therapeutics[J].Trends in Microbiology, 2019, 27(8):690-702.
A L, GABANT P, et al.Mobilization of microbiota commensals and their bacteriocins for therapeutics[J].Trends in Microbiology, 2019, 27(8):690-702.
[19] WANG Z G, ZHANG Y X, CHEN C C, et al.A novel bacteriocin isolated from Lactobacillus plantarum W3-2 and its biological characteristics[J].Frontiers in Nutrition, 2023, 9:1111880.
[20] SHIN J M, GWAK J W, KAMARAJAN P, et al.Biomedical applications of nisin[J].Journal of Applied Microbiology, 2016, 120(6):1449-1465.
[21] MANI-L PEZ E, ARRIOJA-BRET
PEZ E, ARRIOJA-BRET N D, L
N D, L PEZ-MALO A.The impacts of antimicrobial and antifungal activity of cell-free supernatants from lactic acid bacteria in vitro and foods[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(1):604-641.
PEZ-MALO A.The impacts of antimicrobial and antifungal activity of cell-free supernatants from lactic acid bacteria in vitro and foods[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(1):604-641.
[22] LEE J Y, KIM Y, KIM J I, et al.Improvements in human keratinocytes and antimicrobial effect mediated by cell-free supernatants derived from probiotics[J].Fermentation, 2022, 8(7):332.
[23] ESCAMILLA J, LANE M A, MAITIN V.Cell-free supernatants from probiotic Lactobacillus casei and Lactobacillus rhamnosus GG decrease colon cancer cell invasion in vitro[J].Nutrition and Cancer, 2012, 64(6):871-878.
[24] 胡安祺, 杨慧轩, 姚现琦, 等.枯草芽孢杆菌无细胞上清液抑制单增李斯特菌生物被膜形成的研究[J].食品与发酵工业,2024,50(13):1-8.HU A Q, YANG H X, YAO X Q, et al.Inhibitory effect of Bacillus subtilis cell-free supernatant on biofilm formation of Listeria monocytogenes[J].Food and Fermentation Industries,2024,50(13):1-8.
[25] HOSSEINI H, ABBASI A, SABAHI S, et al.Assessing the potential biological activities of postbiotics derived from Saccharomyces cerevisiae:An in vitro study[J].Probiotics and Antimicrobial Proteins, 2024, 16(4):1348-1364.
[26] SORNSENEE P, CHATATIKUN M, MITSUWAN W, et al.Lyophilized cell-free supernatants of Lactobacillus isolates exhibited antibiofilm, antioxidant, and reduces nitric oxide activity in lipopolysaccharide-stimulated RAW 264.7 cells[J].PeerJ, 2021, 9:e12586.
[27] KARAÇAM S, TUNÇER S.Exploiting the acidic extracellular pH:Evaluation of Streptococcus salivarius M18 postbiotics to target cancer cells[J].Probiotics and Antimicrobial Proteins, 2022, 14(6):995-1011.
[28] 陈峰,李敏玉,刘玲,等.灭活卷曲乳杆菌CCFM1118缓解幽门螺杆菌感染的作用评价[J].食品与发酵工业,2024,50(9):1-8.CHEN F, LI M Y, LIU L, et al.Evaluation of the effect of inactivated Lactobacillus crispatus CCFM1118 against Helicobacter pylori infection[J].Food and Fermentation Industries,2024,50(9):1-8.
[29] MYEONG J Y, JUNG H Y, CHAE H S, et al.Protective effects of the postbiotic Lactobacillus plantarum MD35 on bone loss in an ovariectomized mice model[J].Probiotics and Antimicrobial Proteins, 2024, 16(2):541-551.
[30] LEE W, IM H C, LEE Y B, et al.Protective effect of soy germ-fermented postbiotics derived from Lacticaseibacillus paracasei DCF0429 (SGPB-DCF0429) in human reconstituted skin[J].Journal of Functional Foods, 2024, 113:106023.
[31] 张晓妍, 沙沈菲, 郭丽丹, 等.一株后生元菌株的抑菌特性研究及其细菌素基因簇的挖掘[J].食品工业科技, 2022, 43(17):1-10.ZHANG X Y, SHA S F, GUO L D, et al.Antimicrobial properties of A postbiotic strain and gene cluster mining of its bacteriocin[J].Science and Technology of Food Industry, 2022, 43(17):1-10.
[32] KIRAN F, KIBAR DEMIRHAN H, HALISCELIK O, et al.Metabolic profiles of Weissella spp.postbiotics with anti-microbial and anti-oxidant effects[J].Journal of Infection in Developing Countries, 2023, 17(4):507-517.
[33] SALAZAR N, NEYRINCK A M, BINDELS L B, et al.Functional effects of EPS-producing Bifidobacterium administration on energy metabolic alterations of diet-induced obese mice[J].Frontiers in Microbiology, 2019, 10:1809.
[34] 杨慧轩, 罗欣, 梁荣蓉, 等.乳酸菌作为生物抑菌剂在肉与肉制品中的应用研究进展[J].食品科学, 2022, 43(7):317-325.YANG H X, LUO X, LIANG X R, et al.Application of lactic acid bacteria as biological antibacterial agent in meat and meat products:A review[J].Food Science, 2022, 43(7):317-325.
[35] CHE J H, SHI J J, FANG C G, et al.Elimination of pathogen biofilms via postbiotics from lactic acid bacteria:A promising method in food and biomedicine[J].Microorganisms, 2024, 12(4):704.
[36] 吕懿超, 李香澳, 王凯博, 等.乳酸菌作为生物保护菌的抑菌机理及其在食品中应用的研究进展[J].食品科学, 2021, 42(19):281-290.LYU Y C, LI X A, WANG K B, et al.Antimicrobial mechanism of lactic acid bacteria as biopreservative organisms and their application in food industry:A review[J].Food Science, 2021, 42(19):281-290.
[37] BLAZHEVA D, MIHAYLOVA D, AVERINA O V, et al.Antioxidant potential of probiotics and postbiotics:A biotechnological approach to improving their stability[J].Russian Journal of Genetics, 2022, 58(9):1036-1050.
[38] SUN Z, ZHAO Z, FANG B, et al.Effect of thermal inactivation on antioxidant, anti-inflammatory activities and chemical profile of postbiotics[J].Foods, 2023, 12(19):3579.
[39] LEILI AGHEBATI-MALEKI, PANIZ H, AMIN A, et al..Antibacterial, antiviral, antioxidant, and anticancer activities of postbiotics:A review of mechanisms and therapeutic perspectives[J].Biointerface Research in Applied Chemistry, 2021, 12(2):2629-2645.
[40] ARRIOJA-BRET N D, MANI-L
N D, MANI-L PEZ E, PALOU E, et al.Antimicrobial activity and storage stability of cell-free supernatants from lactic acid bacteria and their applications with fresh beef[J].Food Control, 2020, 115:107286.
PEZ E, PALOU E, et al.Antimicrobial activity and storage stability of cell-free supernatants from lactic acid bacteria and their applications with fresh beef[J].Food Control, 2020, 115:107286.
[41] ![]() G K, KARATEPE P, AKGÖL M, et al.Characterization of Pediococcus acidilactici postbiotic and impact of postbiotic-fortified chitosan coating on the microbial and chemical quality of chicken breast fillets[J].International Journal of Biological Macromolecules, 2021, 184:429-437.
G K, KARATEPE P, AKGÖL M, et al.Characterization of Pediococcus acidilactici postbiotic and impact of postbiotic-fortified chitosan coating on the microbial and chemical quality of chicken breast fillets[J].International Journal of Biological Macromolecules, 2021, 184:429-437.
[42] ![]() G K, AKGÖL M, KARATEPE P, et al.Whole-cell postbiotics:An innovative approach for extending the shelf life and controlling major foodborne pathogens in chicken breast fillets[J].Food and Bioprocess Technology, 2023, 16(7):1502-1524.
G K, AKGÖL M, KARATEPE P, et al.Whole-cell postbiotics:An innovative approach for extending the shelf life and controlling major foodborne pathogens in chicken breast fillets[J].Food and Bioprocess Technology, 2023, 16(7):1502-1524.
[43] TOUSHIK S H, KIM K, PARK S H, et al.Prophylactic efficacy of Lactobacillus curvatus B67-derived postbiotic and quercetin, separately and combined, against Listeria monocytogenes and Salmonella enterica Ser.Typhimurium on processed meat sausage[J].Meat Science, 2023, 197:109065.
[44] 陈瑞龙, 庄莹, 贺彬彬, 等.植物乳杆菌细菌素高产菌株的诱变选育及其对肉丸的防腐保鲜作用[J].食品工业科技, 2018, 39(22):121-127.CHEN R L, ZHUANG Y, HE B B, et al.Screeging of high-yield plantaricin producing stains induced by mutations and the fresh-keeping effect of plantaricin on the preservation of meatballs[J].Science and Technology of Food Industry, 2018, 39(22):121-127.
[45] DE AZEVEDO P O S, MENDONÇA C M N, SEIBERT L, et al.Bacteriocin-like inhibitory substance of Pediococcus pentosaceus as a biopreservative for Listeria sp.control in ready-to-eat pork ham[J].Brazilian Journal of Microbiology, 2020, 51(3):949-956.
[46] ABOULOIFA H, HASNAOUI I, BEN SLIMA S, et al.Bio-preservation effect of probiotic Lactiplantibacillus plantarum S61 against Rhodotorula glutinis and Listeria monocytogenes in poultry meat[J].Current Microbiology, 2022, 79(8):232.
[47] WANG J, XU L L, GU L P, et al.Cell-free supernatant of Lactiplantibacillus plantarum 90:A clean label strategy to improve the shelf life of ground beef gel and its bacteriostatic mechanism[J].Foods, 2023, 12(22):4053.
[48] LU P R, MEI L, WANG X R, et al.Effects of exopolysaccharide by Pediococcus acidilactici S1 on the gelation properties and microstructure of porcine myofibrillar protein[J].Food Hydrocolloids, 2024, 149:109627.
[49] SHAFIPOUR YORDSHAHI A, MORADI M, TAJIK H, et al.Design and preparation of antimicrobial meat wrapping nanopaper with bacterial cellulose and postbiotics of lactic acid bacteria[J].International Journal of Food Microbiology, 2020, 321:108561.
[50] RASOULI Y, MORADI M, TAJIK H, et al.Fabrication of anti-Listeria film based on bacterial cellulose and Lactobacillus sakei-derived bioactive metabolites;application in meat packaging[J].Food Bioscience, 2021, 42:101218.
[51] DEL CARMEN BERISTAIN-BAUZA S, MANI-L PEZ E, PALOU E, et al.Antimicrobial activity of whey protein films supplemented with Lactobacillus sakei cell-free supernatant on fresh beef[J].Food Microbiology, 2017, 62:207-211.
PEZ E, PALOU E, et al.Antimicrobial activity of whey protein films supplemented with Lactobacillus sakei cell-free supernatant on fresh beef[J].Food Microbiology, 2017, 62:207-211.
[52] ABBASI A, SABAHI S, BAZZAZ S, et al.An edible coating utilizing Malva sylvestris seed polysaccharide mucilage and postbiotic from Saccharomyces cerevisiae var.boulardii for the preservation of lamb meat[J].International Journal of Biological Macromolecules, 2023, 246:125660.
[53] LOEFFLER M, HILBIG J, VELASCO L, et al.Usage of in situ exopolysaccharide-forming lactic acid bacteria in food production:Meat products-a new field of application?[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(6):2932-2954.