静止期细胞是指独立于细胞周期之外,可以暂停生长并在适当刺激下具备重新进入有丝分裂细胞周期潜能的细胞。在营养物质匮乏的条件下,酵母会利用自我保护机制形成一种静止期状态的细胞——酵母孢子[1]。与营养细胞相比,酵母孢子热稳定性增加、代谢活性降低,具有更强的抗逆性[2]。营养充足时,酵母孢子则会退出静止期并启动有丝分裂,形成更活跃的营养细胞,这个过程称为萌发[3]。在自然界中,超过70%的植物病原体属于真菌,它们能以孢子的形式存活多年,具有抗药性难以被杀死,极易引起传染病的发生[4]。在食品工业生产中,尽管会对反应釜进行高温消毒处理,但酵母及其他有害菌产生的孢子耐热性强故难以消灭,易导致食物污染或中毒情况发生[5-6]。
因此,研究酵母孢子退出静止期及调控萌发的机制有助于开发针对静止期细胞的新型抗真菌药物,控制传染病的发生和发展,同时挖掘细胞静止期的调控机制也有助于食品工业生产中更彻底地杀菌消毒,保障食品安全[6-7],这对食品行业的发展及传染病药物的开发具有极其重要的意义。
目前,关于静止期细胞如何感知营养物质及相关信号通路,人们已经进行了大量的研究[8-9]。有研究指出蛋白激酶A和雷帕霉素靶向复合物1信号通路是孢子启动萌发所必需的[9-11]。先前报道了一种细胞如何维持在静止期的负调控机制。在这一机制中,糖酵解酶Tpi1及其产物3-磷酸甘油醛(3-glyceraldehyde phosphate, GAP)共同参与抑制孢子进入有丝分裂。当对细胞进行加热处理时,热敏感的Tpi1会失去活性,从而解除对孢子萌发的抑制,导致孢子开始萌发。值得注意的是,即使在营养丰富的生长介质中,GAP也能有效抑制孢子的萌发[12]。而之后的实验也检测过糖酵解途径中的其他分子,但是这些分子对孢子的萌发都没有影响。虽然已阐明了细胞静止期调控的部分机制,但该途径仅涉及2个分子,目前完整的信号通路尚未阐明。因此,本研究旨在找出除Tpi1、GAP外其他参与负调控机制的分子,从而完善负调控途径。
三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)在能量代谢糖酵解途径中扮演着重要角色。最近的研究表明,GAPDH具有独立于能量代谢中的作用[13],例如在癌细胞自噬时的核易位以及作为促凋亡蛋白等[14-15]。证明了GAPDH作为糖酵解途径中Tpi1和GAP的下游分子,参与调控孢子萌发的负调控机制,且在该负调控途径中作为GAP的下游。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
本实验所用的酵母菌株为酿酒酵母细胞系中的SKI(高产孢型)背景的AN120(二倍体)、AN117-16D(单倍体)、AN117-4B(单倍体)[16]。实验中构建的菌株以AN117-16D和AN117-4B为野生型,使用PFA6a-HIS3-mx6质粒载体为片段扩增模板[17],通过同源重组的方法构建出tdh1Δ、tdh2Δ和tdh3Δ的GAPDH单个结构基因缺陷型菌株。
1.1.2 材料与试剂
酵母浸出粉胨腺嘌呤葡萄糖(yeast extract peptone adenine dextrose,YPAD)培养基(g/L):酵母提取物10、蛋白胨20、腺嘌呤3、葡萄糖20。
酵母浸出粉胨腺嘌呤醋酸钾(yeast extract peptone adenine acetic acid, potassium salt,YPACE)培养基(g/L):酵母提取物10、蛋白胨20、腺嘌呤3、醋酸钾20。
YPAD培养基、YPACE培养基2%(质量分数)醋酸钾、上海生工生物工程有限公司;β-actin鼠源抗体、GAPDH鼠源抗体,Protech有限公司;质粒提取试剂盒、基因组提取试剂盒、PCR产物纯化试剂盒,全式金生物工程有限公司;抗体显色液、聚偏二氟乙烯膜(polyvinyldene difluoride,PVDF)、蛋白Marker Blue plus Ⅱ,碧云天;qPCR试剂盒、同源重组酶、连接酶,宝生物(大连)有限公司。
1.2 仪器与设备
DS-Ri 2共聚焦显微镜,日本Nikon;光学显微镜,美国通用电器;LX-100手掌型通用离心机,海门市林贝尔仪器有限公司;PCR仪,德国艾德本有限公司;超净工作台,三发仪器有限公司;恒温摇瓶柜,太仓强乐设备厂。
1.3 实验方法
1.3.1 酵母培养以及产孢方法
培养酵母时,使用YPAD培养基来支持其正常生长。而酵母的整个产孢过程则需要依次经历YPAD、YPACE培养基的培养阶段,并在最后阶段添加2%的醋酸钾。产孢时先接种适量酵母菌于5 mL YPAD中过夜培养10~12 h,再取4 mL转至200 mL YPACE中培养24 h,自然沉降菌体倒出上清液,转至2%醋酸钾中30 ℃培养24 h,检验产孢率,确保产孢率>90%。
1.3.2 菌株构建
构建之初,以PFA6a-HIS3-mx6质粒为模板进行PCR扩增。接着,在NCBI中检索酿酒酵母SK1系的TDH1、TDH2和TDH3基因序列。针对每个基因,设计引物并选取50 bp同源臂,同时在同源臂后添加质粒HIS两端的扩增引物。通过PCR扩增,获取带有HIS标签和GAPDH结构基因同源臂的片段。
接下来收集OD值约1.2的酵母野生型AN117-4B、16D单倍体菌液,然后加入经95 ℃处理的ssDNA、带有HIS片段的PCR产物、PEG和LiAc,通过同源重组体系整合基因片段。30 ℃ 30 min和42 ℃ 20 min加热处理促进重组,利用SD-HIS平板筛选突变体。挑选单克隆进行菌落PCR验证,得到缺失目的基因的单倍体缺陷菌株。最后,融合2种单倍体缺陷菌株,获得缺失GAPDH单个结构基因的二倍体菌株:tdh1Δ、tdh2Δ和tdh3Δ。
1.3.3 质粒构建
本实验中构建了Prs426-tdh1和Prs426-tdh3质粒用于敲除缺陷菌株的回补实验,菌株构建过程中以Prs426作为原始质粒,根据酶切位点选择同源臂,设计带同源臂的引物,以酵母AN120野生型菌株基因组DNA为模板,PCR扩增出带相应质粒同源臂的TDH1和TDH3的片段,在同源重组的体系中构建重组质粒。利用菌落PCR和酶切验证,最后辅以测序确保质粒序列的正确。
1.3.4 孢子纯化
取50 mg产孢率90%以上的酵母四分体孢子,悬浮于1 mL山梨醇缓冲液,加入1 μL酵母破壁酶于37 ℃孵育1 h,破碎孢子外层的子囊壁,镜检子囊壁破碎情况。
用0.5%(体积分数)Tween 20洗涤破壁完全的子囊孢子,除去细胞碎片。离心去上清液,转速从3 500 r/min逐渐降低,直到上清液清澈。收集孢子,于-20 ℃保存。
1.3.5 孢子萌发处理以及荧光增白剂(calcofluor white, CFW)萌发检测
孢子的热激处理:取20 mg酵母孢子,重悬于20 μL无菌水中,95 ℃金属浴15 s热激。
孢子的YPAD处理:取20 mg酵母孢子悬浮于200 μL YPAD培养基,30 ℃温育2 h。
为了量化孢子的产孢率,采用荧光增白剂染色的方法。配制1 mg/mL的CFW溶液,取处理后的孢子悬浮于无菌水中,以1∶10的比例加入CFW染液,30 ℃温育30 min,荧光显微镜观察,被染上蓝色的孢子即被认为萌发。
1.3.6 酵母孢子蛋白提取与浓度检测
取对照组和按实验条件处理后的孢子约40 mg于1.5 mL微量离心管中,加入200 μL 8 mol/L尿素缓冲液、2 μL蛋白酶抑制剂及与孢子量相当的小玻璃珠。将样品置于冷冻破碎研磨机,设置1 min运行、1 min停止的循环,共30次。研磨结束后,以15 000 r/min离心10 min,取上清液。用Nanodrop 2000测定蛋白浓度,确保质量浓度超过20 mg/mL。
1.3.7 免疫印迹分析(western blot, WB)
按照4∶1的质量比在处理好的蛋白样品中加入蛋白SDS Loading buffer,95 ℃金属浴5 min。加入提前配制好的12%蛋白胶中,每个孔加5 μL样品。待蛋白胶样品跑到合适位置,半干法转膜30 min,50 g/L脱脂牛奶封闭1 h,一抗孵育1.5 h,二抗孵育1 h,洗膜3次。每张PVDF膜加300 μL显影液,显影检测蛋白量,拍摄图片。
1.3.8 Image J软件分析灰度值
将WB的显影结果导入Image J软件中,对图像进行必要的预处理,测量蛋白条带的灰度值。对照组灰度值定为1,计算其他实验组灰度的相对含量并绘制直方图。
1.3.9 酵母孢子mRNA提取与浓度检测
利用液氮研磨的方法,提取处理后样品的mRNA。提前准备液氮,将样品迅速放入液氮中保持状态,拿出液氮预冷的研钵,倒入一半的液氮,加入样品。始终保持研钵中液氮不少于1/5。待研磨样品呈粉末状,收取粉末于EP管中。利用Takara qPCR试剂盒提取液氮研磨后的孢子粉末的总mRNA,去除DNA以及反转录成cDNA,检测浓度。
1.3.10 qPCR荧光实时定量分析及结果处理
从NCBI上找到所属菌株的GAPDH 3个结构基因的序列以及β-actin作为内参序列,选取CDS序列,利用NCBI自带的引物设计工具,选取合适长度的前后引物。将反转录好的样品cDNA加入qPCR反应体系,加入qPCR仪器中,待qPCR反应结束,导出数据在Excel中分析,计算ΔCT以及-ΔΔCT值,利用Prism GraphPad画图。
1.4 统计学分析
本文涉及所有实验均采用至少3个独立数据样本,使用GraphPad Prism软件计算双尾非配对t-test检验分析统计学显著性,当P<0.05时表示数据差异具有统计学意义。
2 结果与分析
2.1 YPAD处理下孢子萌发过程中GAPDH表达量降低
酵母孢子包裹于子囊壳中[18],利用破壁酶处理子囊孢子,可以去除子囊壳从而释放出孢子。本实验所用孢子均为去除子囊壳之后的单个孢子,利用CFW特异性结合孢子壁壳聚糖层的特性来量化萌发率[12]。YPAD(高营养培养基)会诱导孢子萌发,萌发后的孢子在显微镜下被观察到与CFW结合,呈蓝色荧光(图1-a),通过蓝色荧光来计算孢子萌发率(图1-b)。在酵母孢子经过YPAD诱导后,进行WB时,作为内参蛋白的GAPDH其表达量存在波动。鉴于YPAD能够促使酵母孢子启动萌发程序,我们初步推测GAPDH的表达水平可能受到酵母孢子萌发过程的影响。
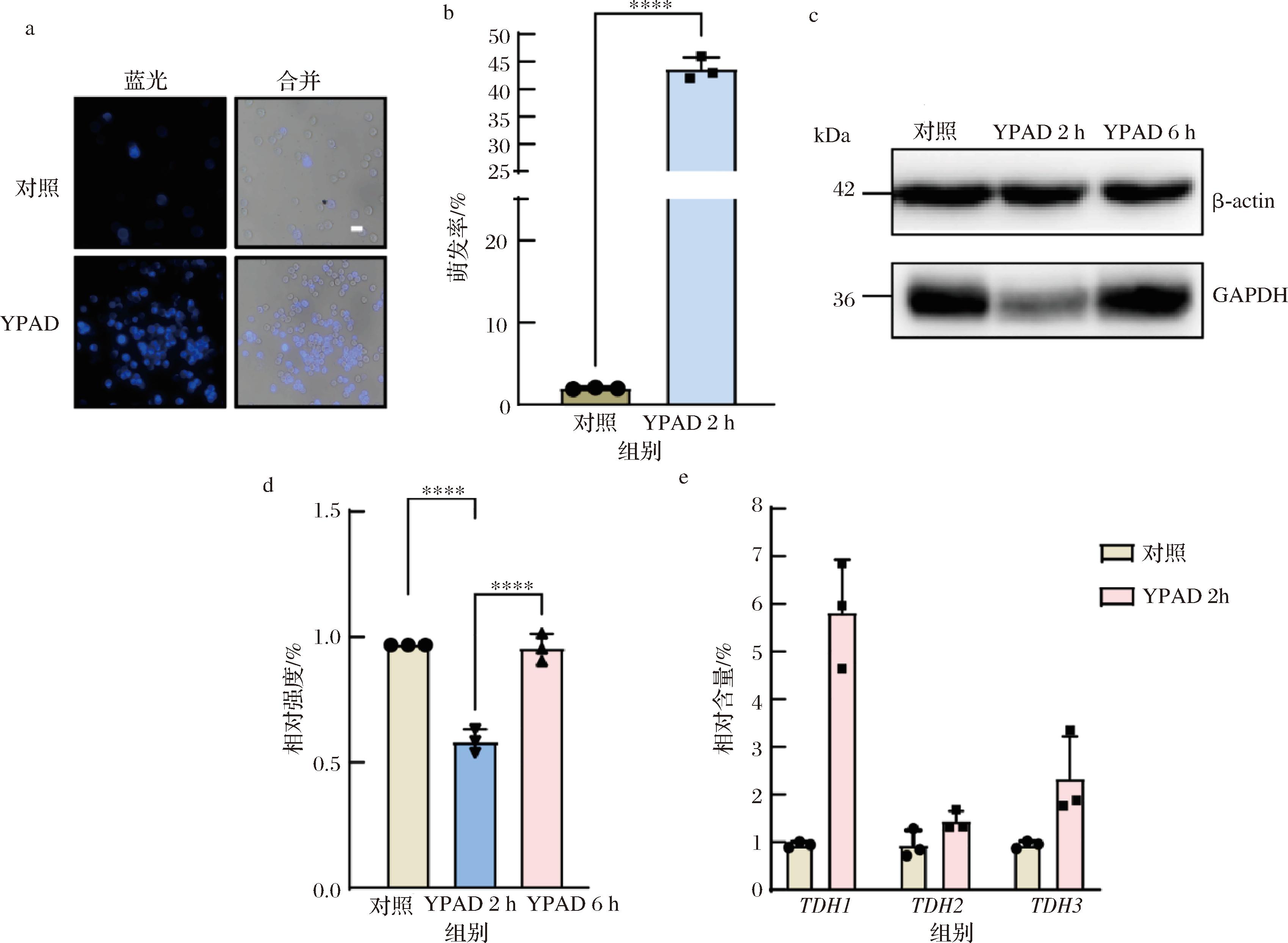
a-YPAD处理前后CFW染色对比(比例尺5 μm);b-YPAD处理前后萌发率直方图对比;c-YPAD处理的免疫印迹显影; d-Image J测量免疫印迹显影灰度值强度直方图对比;e-GAPDH 3个结构基因YPAD处理前后mRNA水平对比
图1 YPAD孵育诱导孢子萌发、GAPDH表达量降低
Fig.1 YPAD incubation induced spore germination, and the expression of GAPDH decreased
注:P≥0.05标记为ns;P<0.05标记为*;P<0.01标记为**;P<0.001标记为***;P<0.000 1标记为****(下同)。
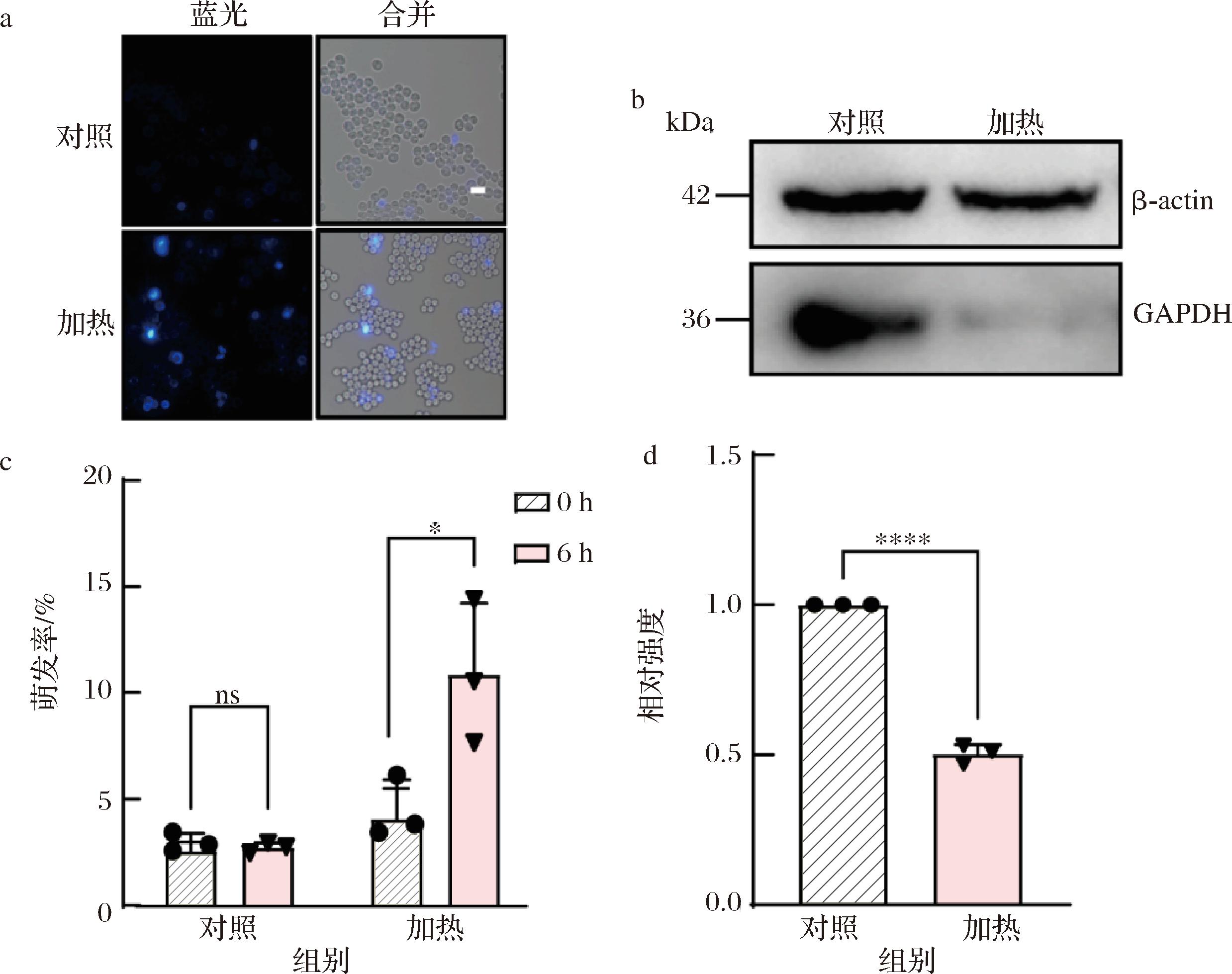
a-加热后CFW染色处理(显微镜观察萌发率,比例尺5 μm);b-加热处理孢子的免疫印迹分析; c-加热前后萌发率统计直方图对比;d-Image J测量加热前后免疫印迹灰度值强度直方图对比
图2 加热诱导孢子萌发,GAPDH表达量减少
Fig.2 Heating induced spore germination with reduced expression of GAPDH
为了验证GAPDH是否与萌发相关,本研究使用YPAD孵育酵母孢子,然后利用蛋白质印迹去检测GAPDH水平的变化,并利用Image J软件量化灰度值。结果表明,孢子在经过YPAD处理2 h后,GAPDH的水平会明显降低,相对表达量降低至对照组的一半(图1-c、图1-d)。但在延长YPAD的处理时间至6 h时,我们发现GAPDH的表达量又会增加到正常水平(图1-c、图1-d)。为了深入探究GAPDH水平变化的原因,我们利用qPCR方法检测了酵母孢子萌发过程中GAPDH在mRNA水平上的变化。由于GAPDH由3个结构基因TDH1、TDH2和TDH3编码,我们发现,在YPAD处理孢子2 h后,这3个结构基因的转录水平均呈现轻微增加。这一结果表明,孢子萌发导致的GAPDH水平下降并非由转录水平改变引起,而更可能是由蛋白自身降解所致。
2.2 热激诱导孢子萌发过程中GAPDH表达量降低
为了进一步确认GAPDH水平的减少是因为酵母孢子的萌发,本研究检测了加热对孢子GAPDH水平的影响。先前我们发现加热可促进孢子萌发[12],因此,我们对纯化后的孢子进行了95 ℃热激处理,持续15 s,随后在30 ℃条件下孵育6 h,以检验这种处理是否会增加孢子的萌发率。CFW染色结果显示,95 ℃,15 s处理后的酵母孢子在30 ℃孵育6 h之后与对照组相比萌发率有明显增加,由对照组的4%增加至12%(图2-a、图2-c)。
接下来,我们检测了在95 ℃、15 s热激条件下GAPDH表达量的变化。利用Image J软件对WB结果的灰度值进行量化后,结果显示加热后的GAPDH水平显著下降,这与YPAD处理的结果相似,其相对表达量降低至对照的50%(图2-b、图2-d)。这一结果进一步证实了孢子在萌发过程中,GAPDH的表达水平确实会降低。
2.3 GAP对孢子萌发的抑制作用及萌发过程中GAP对GAPDH减少的调控研究
在孢子萌发过程中,发现GAPDH的水平出现下降,这明确指示了GAPDH的变化与孢子萌发过程紧密相关。鉴于GAP在糖酵解途径中作为GAPDH的底物,并且同时参与调控孢子萌发的负调控途径,推测GAPDH可能也参与了这一机制的调控。先前已证明在营养充足条件下GAP仍可抑制萌发[12],CFW染色结果显示,在YPAD孵育时加入GAP,孢子萌发率从40%降低至5%(图3-a、图3-b)。
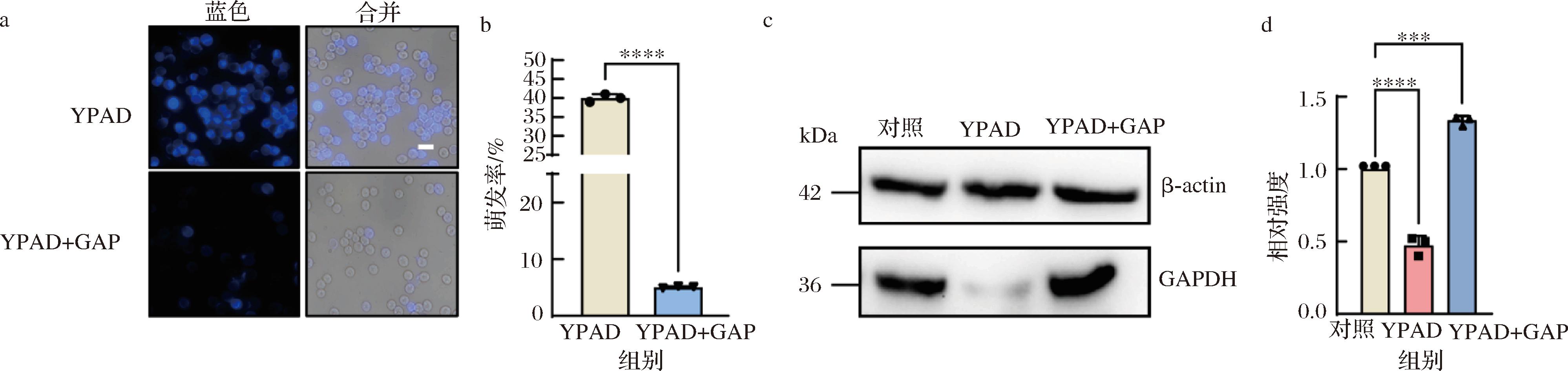
a-GAP处理孢子,CFW染色(荧光显微镜检测萌发率,比例尺5 μm);b-有无GAP处理萌发率直方图对比; c-萌发过程中加入GAP,GAPDH表达的免疫印迹分析;d-Image J量化免疫印迹结果直方图对比
图3 GAP抑制孢子萌发、在萌发过程中增加GAPDH的表达
Fig.3 GAP inhibited spore germination and increased the expression of GAPDH during germination
随后,利用WB检测了GAPDH的蛋白表达水平。在实验中,设立了用水孵育的孢子作为对照组。结果显示,与对照组相比,YPAD孵育的孢子中GAPDH的表达水平显著下降。(图3-c、图3-d)。然而,当同时用YPAD和GAP处理孢子时,发现GAPDH的表达量并没有减少,反而略有增加(图3-c、图3-d)。之前已经证明,在正常的营养细胞中,GAP对GAPDH的表达是没有影响的。
GAPDH作为管家基因,蛋白的表达十分稳定[19],但在孢子萌发的过程中却变得不够稳定。这两种细胞中,GAP影响GAPDH的差异性表明在酵母孢子萌发的过程中GAP诱导GAPDH的表达,外源添加GAP抑制孢子萌发主要是由于GAP调控GAPDH的表达导致的。
2.4 GAPDH结构基因缺失对孢子萌发率的提升作用研究
研究结果显示GAPDH在酵母孢子的萌发的过程中表达量会降低,接下来研究低水平的GAPDH是否会促进孢子萌发,从而检测了GAPDH基因的缺失对孢子萌发的影响。GAPDH是酵母生长的关键基因,全部敲除会影响酵母的正常生长[20]。GAPDH有3个结构基因,TDH1、TDH2和TDH3[21],单个结构基因的缺失对菌株正常生长没有影响[22]。本研究分别敲除了GAPDH的3个结构基因,得到了tdh1Δ、tdh2Δ和tdh3Δ 3种突变株。对突变体进行产孢,检测3种突变体的产孢率和萌发率。结果显示,与野生型相比,3种单缺突变株的产孢率较野生型没有明显差异(图4-a),这表明敲除单个结构基因后酵母细胞的生长状态没有受到影响。而敲除菌株的萌发率相较于野生型均有较大提升,且tdh1Δ和tdh3Δ 2种敲除菌株萌发率显著提高,均从5%左右提升到13%左右(图5-b)。
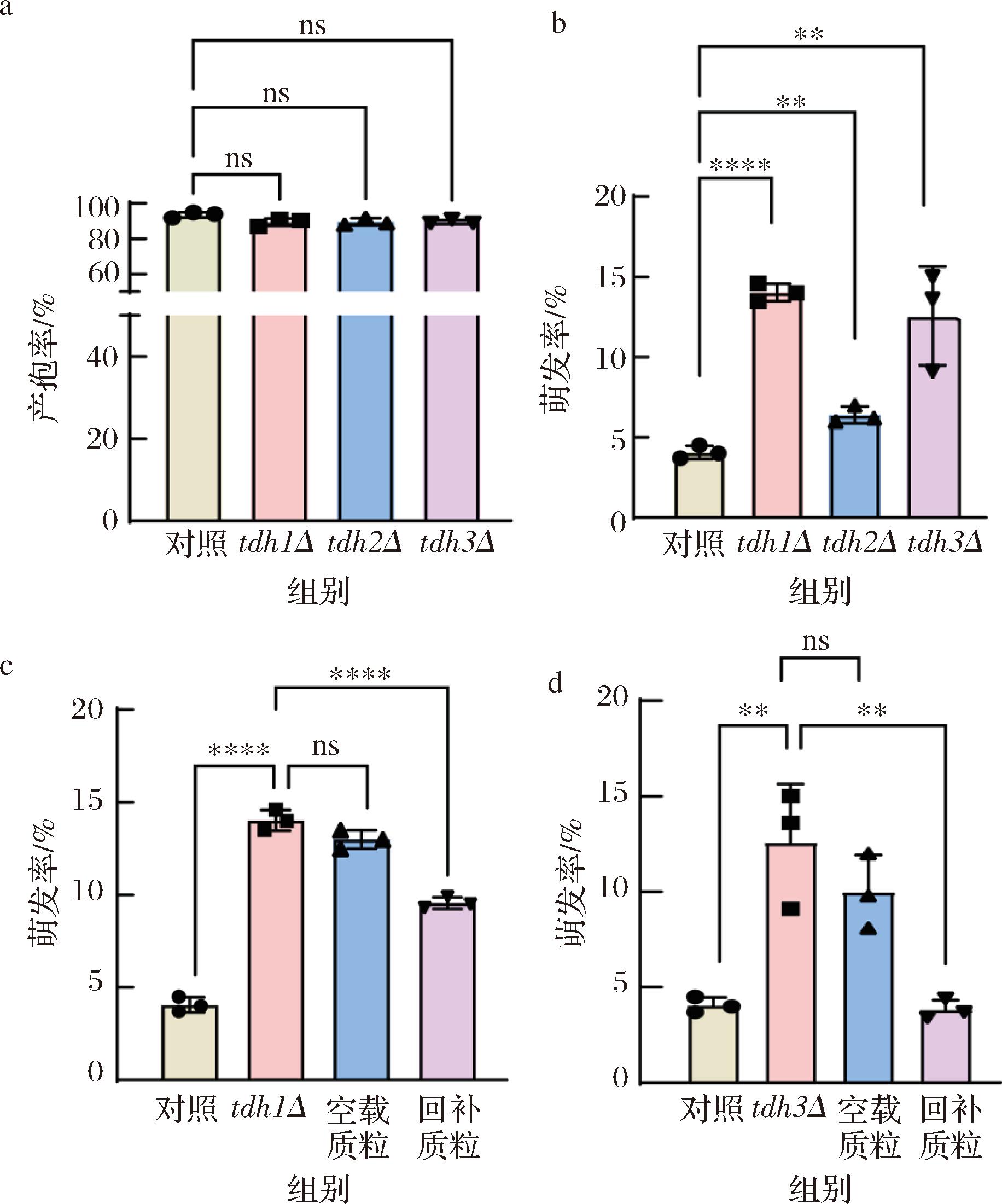
a-结构基因缺失菌株与野生型产孢率直方图对比;b-结构基因缺失菌株与野生型萌发率直方图对比; c-tdh1Δ菌株质粒回补萌发率直方图对比;d-tdh3Δ菌株质粒回补萌发率直方图对比
图4 敲除GAPDH单个结构基因萌发率增加
Fig.4 Knockout of GAPDH single structural gene increases germination efficiency
为了验证该结果,本研究选取了敲除后萌发率显著增强的tdh1Δ、tdh3Δ 2种突变体进行回补实验。分别构建了带有TDH1和TDH3两种基因的表达型质粒,在2种缺陷型菌株中分别转化空载和带有缺失基因的质粒对回补菌株进行产孢,检验2种回补菌株的萌发率。结果表明,回补空载质粒的实验组与基因缺失组的萌发率并无明显差异。而转化带有缺陷基因的高表达质粒后回补菌株的萌发率均有明显降低(图4-c和图4-d),尤其是tdh3Δ突变体回补之后,萌发率下降得更为显著,回落到与野生型更低的萌发率(图4-d),该结果表明高水平的GAPDH对孢子萌发有显著抑制作用。先前有文献报道,TDH3基因表达的GAPDH蛋白主要参与糖酵解途径[23],本研究结果与报道类似,表明低水平的GAPDH能够增加孢子的萌发率。
3 结论
本研究通过一系列实验揭示了GAPDH在酵母孢子萌发过程中的关键作用。GAPDH作为糖酵解中的关键分子,在孢子萌发时表达量显著降低,表明其与孢子退出静止状态进入萌发阶段存在紧密联系。此外,延长孵育时间和加热处理均可诱导孢子萌发并降低GAPDH表达量,进一步证实了GAPDH表达量的减少是由孢子萌发导致的。外源GAP的添加能阻止GAPDH水平的下降,甚至增加其表达,这在酵母营养细胞中并不发生。敲除GAPDH结构基因则能增加孢子萌发率,表明GAPDH参与抑制孢子萌发的负调控途径。
本研究不仅扩充了原有的负调控途径,还揭示了GAPDH作为多功能蛋白在孢子萌发过程中的潜在作用。尽管GAPDH是糖酵解途径的关键分子,但并非整个糖酵解过程都会影响孢子萌发,这进一步突显了GAPDH在调控萌发方面的特殊作用。本研究为真菌孢子退出静止期的机制提供了新的理论依据,也为食品工业生产中真菌孢子的彻底消除提供了新的方法。然而,GAPDH在这一过程中的具体作用机制仍需进一步研究。期待未来的研究能够更深入地探索GAPDH的功能及其在孢子萌发中的调控机制。
[1] WERNER-WASHBURNE M, BRAUN E, JOHNSTON G C, et al.Stationary phase in the yeast Saccharomyces cerevisiae[J].Microbiological Reviews, 1993, 57(2):383-401.
[2] PLANTE S, MOON K M, LEMIEUX P, et al.Breaking spore dormancy in budding yeast transforms the cytoplasm and the solubility of the proteome[J].PLoS Biology, 2023, 21(4):e3002042.
[3] MOIR A, COOPER G.Spore germination[J].Microbiology Spectrum, 2015, 3(6).
[4] ROZALI S N M, MILANI E A, DEED R C, et al.Bacteria, mould and yeast spore inactivation studies by scanning electron microscope observations[J].International Journal of Food Microbiology, 2017, 263:17-25.
[5] MANTZOURANI I, PLESSAS S, SAXAMI G, et al.Study of kefir grains application in sourdough bread regarding rope spoilage caused by Bacillus spp[J].Food Chemistry, 2014, 143:17-21.
[6] PINTO C A, MOREIRA S A, FIDALGO L G, et al.Effects of high-pressure processing on fungi spores:Factors affecting spore germination and inactivation and impact on ultrastructure[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2):553-573.
[7] DIJKSTERHUIS J.Fungal spores:Highly variable and stress-resistant vehicles for distribution and spoilage[J].Food Microbiology, 2019, 81:2-11.
[8] TSUYUZAKI H, UJIIE R, SATO M.Wake-up alarm:Virtual time-lapse gene expression landscape illuminates mechanisms underlying dormancy breaking of germinating spores[J].Current Genetics, 2021, 67(4):519-534.
[9] AKEKAWATCHAI C, JITRAPAKDEE S.Chapter Twelve Cellular signals integrate cell cycle and metabolic control in cancer[J].Advances in Protein Chemistry and Structural Biology, 2023, 135:397-423.
[10] ALFATAH M, WONG J H, KRISHNAN V G, et al.TORC1 regulates the transcriptional response to glucose and developmental cycle via the Tap42-Sit4-Rrd1/2 pathway in Saccharomyces cerevisiae[J].BMC Biology, 2021, 19(1):95.
[11] WIESE W, BARCZUK J, RACINSKA O, et al.PI3K/Akt/mTOR signaling pathway in blood malignancies-new therapeutic possibilities[J].Cancers, 2023, 15(21):5297.
[12] LIU G Y, YANG Y, YANG G L, et al.Triosephosphate isomerase and its product glyceraldehyde-3-phosphate are involved in the regulatory mechanism that suppresses exit from the quiescent state in yeast cells[J].Microbiology Spectrum, 2022, 10(4):e0089722.
[13] NICHOLLS C, LI H, LIU J P.GAPDH:A common enzyme with uncommon functions[J].Clinical and Experimental Pharmacology &Physiology, 2012, 39(8):674-679.
[14] BUTERA G, MULLAPPILLY N, MASETTO F, et al.Regulation of autophagy by nuclear GAPDH and its aggregates in cancer and neurodegenerative disorders[J].International Journal of Molecular Sciences, 2019, 20(9):2062.
[15] HUO J F, DONG W, XU J K, et al.Role of glyceraldehyde-3-phosphate dehydrogenase (GAPDH) in autophagy activation following subarachnoid hemorrhage[J].Experimental Neurology, 2024, 371:114577.
[16] HABER J E.Mating-type genes and MAT switching in Saccharomyces cerevisiae[J].Genetics, 2012, 191(1):33-64.
[17] LONGTINE M S, MCKENZIE A 3rd, DEMARINI D J, et al.Additional modules for versatile and economical PCR-based gene deletion and modification in Saccharomyces cerevisiae[J].Yeast, 1998, 14(10):953-961.
[18] ESCORCIA W, FORSBURG S L.Random spore analysis in fission yeast[J].Methods in Molecular Biology, 2018, 1721:189-195.
[19] SHEN C L, LI W J, WANG Y J.Research on the oncogenic role of the house-keeping gene GAPDH in human tumors[J].Translational Cancer Research, 2023, 12(3):525-535.
[20] HUANG T S, NAGY P D.Direct inhibition of tombusvirus plus-strand RNA synthesis by a dominant negative mutant of a host metabolic enzyme, glyceraldehyde-3-phosphate dehydrogenase, in yeast and plants[J].Journal of Virology, 2011, 85(17):9090-9102.
[21] VAN LEEMPUTTE F, VANTHIENEN W, WIJNANTS S, et al.Aberrant intracellular pH regulation limiting glyceraldehyde-3-phosphate dehydrogenase activity in the glucose-sensitive yeast tps1Δ mutant[J].mBio, 2020, 11(5):e02199-20.
[22] LINCK A, VU X K, ESSL C, et al.On the role of GAPDH isoenzymes during pentose fermentation in engineered Saccharomyces cerevisiae[J].FEMS Yeast Research, 2014, 14(3):389-398.
[23] RANDEZ-GIL F, S NCHEZ-ADRI
NCHEZ-ADRI I E, ESTRUCH F, et al.The formation of hybrid complexes between isoenzymes of glyceraldehyde-3-phosphate dehydrogenase regulates its aggregation state, the glycolytic activity and sphingolipid status in Saccharomyces cerevisiae[J].Microbial Biotechnology, 2020, 13(2):562-571.
I E, ESTRUCH F, et al.The formation of hybrid complexes between isoenzymes of glyceraldehyde-3-phosphate dehydrogenase regulates its aggregation state, the glycolytic activity and sphingolipid status in Saccharomyces cerevisiae[J].Microbial Biotechnology, 2020, 13(2):562-571.