在食品乳液中,营养性饮料乳液代表了高价值的产品类别,旨在为特定的消费群体提供特定的营养成分。营养性饮料乳液包括婴儿配方食品,临床、医学、老年人和运动营养产品,以及满足各种消费者健康、保健和感官满足需求的乳类饮料。作为一种多相分散体系,乳液的2个主要成分(即水和油)具有不混溶性,本质上是热力学不稳定的[1],随着时间的推移,倾向于破坏油相和水相(乳化、沉淀、絮凝、聚结和奥斯特瓦尔德现象)[2],因此,提高乳液体系稳定性一直是食品领域的研究重点。
目前磷酸盐作为一种添加剂常被用于食品行业中。研究中发现磷酸盐在肉类中可作为保水剂[3],在乳液中作为稳定剂增强乳液的热稳定性[4],但其具体如何作用于乳液体系中并未见大量报道,而且很少研究其在超高温条件下的作用。基于此,本文制备了一种新型营养性饮料乳液-高能量羊奶基乳液,并通过添加磷酸盐增强乳液的热稳定性并探明其稳定机理。本实验的开展可为食品乳液的开发与研究提供借鉴和新的思路。
1 材料与方法
1.1 材料与试剂
羊奶粉,昆明龙腾生物乳业有限公司;麦芽糊精(DE 16~18),孟州市金玉米有限责任公司;蔗糖脂肪酸酯11(亲水性非离子表面活性剂)、分子蒸馏单甘酯(亲油性非离子表面活性剂≥90%,食品级),张家港市中鼎添加剂有限公司;三聚磷酸钠、六偏磷酸钠、焦磷酸钠,食品级,万邦实业有限公司。
1.2 仪器与设备
FA25高速分散机,上海Fluko流体机械制造有限公司;NS1001L高压均质机,意大利Niro Soavi公司;IMJ-54A高压灭菌锅,上海施都凯仪器设备有限公司;Zetasizer Nano ZS激光粒度分析仪,英国Marvin公司;CR21GⅡ高速离心机,日立Hitachi公司;UV759紫外分光光度计,上海奥普勒仪器有限公司;Zeiss LSM 780激光共聚焦显微镜,德国卡尔蔡司公司;NDJ-5S数字黏度计,上海尼润智能科技有限公司;Kinexus lab旋转流变仪,德国耐驰仪器制造有限公司;NR10QC色差仪,广东三恩时科技有限公司。
1.3 实验方法
1.3.1 乳液的制备
乳液基本配方(每100 g中各组分含量):羊奶粉10 g,麦芽糊精10 g,玉米油2 g,蔗糖脂肪酸酯11 0.05 g,分子蒸馏单甘酯0.05 g,磷酸盐含量根据实验设计针对3种不同磷酸盐[酸式焦磷酸钠(disodium diphosphate,DDPP)、三聚磷酸钠(sodium tripolyphosphate,STP)与六偏磷酸钠(sodium hexametaphosphate,SHMP)]分别添加,添加量为0.02、0.04、0.06、0.08、0.10 g,去离子水补足100 g。其中对照组不添加磷酸盐,具体制备流程如图1所示,制备的乳液均经过121 ℃ 15 min灭菌。
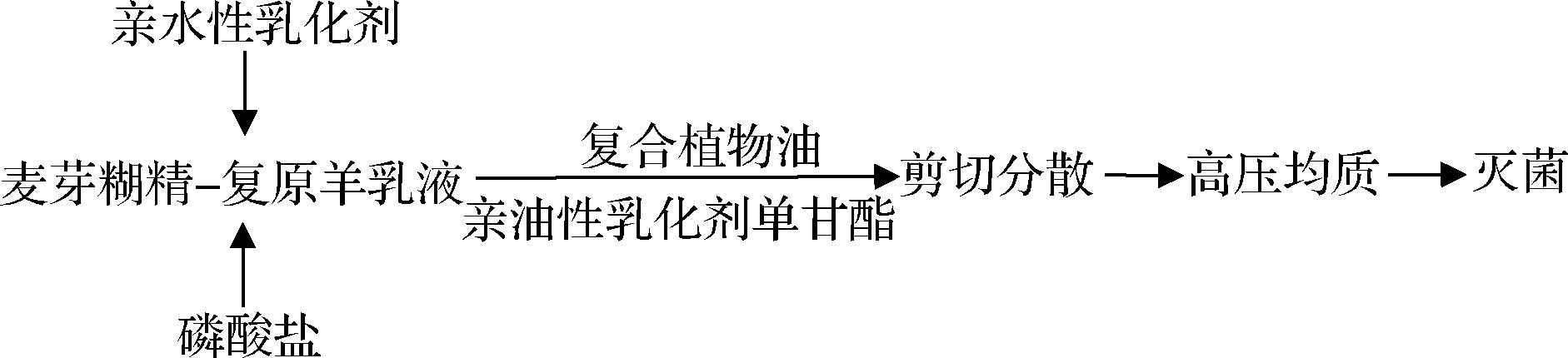
图1 乳液制备流程
Fig.1 Emulsion preparation
1.3.2 宏观及微观形貌的观测
宏观现象:观察经过121 ℃高压灭菌15 min后乳液的宏观现象,拍照并记录。
微观形貌:采用激光共聚焦显微镜观测[5],分别将尼罗红(质量分数0.1%)溶解在水中,固绿(质量分数1%)溶解在丙酮中,对乳液进行染色。染色结束后取 10 μL的乳液于载玻片上,采用激光共聚焦显微观测乳液的微观形貌(尼罗红激发波长为488 nm,固绿激发波长为633 nm)。
1.3.3 粒径的测定
利用激光粒度分析仪测定乳液粒径大小[6],采用平均粒径表征乳液液滴粒度大小。设定参数:颗粒的吸收指数为0.001,颗粒的折射率为1.460,分散剂的折射率为1.330。
1.3.4 离心稳定系数的测定
采用LI等[7]的方法,稍作改变:取1 mL样液于3 500 r/min离心15 min,取中间清液稀释100倍后,用分光光度计于500 nm波长下测定吸光度A2,与离心前吸光度A1的比值即为稳定系数R,计算如公式(1)所示:
(1)
1.3.5 热絮凝时间(hot coagulation time,HCT)测定
将新鲜样品(2.5 mL)装入玻璃管(长130 mm,外径10 mm,壁厚2 mm)中,并置于油浴中,HCT确定为将样品置于油浴和凝乳开始之间所经过的时间。样品以8 r/min的速度摇动,样品达到140 ℃的加热时间为2 min。
1.3.6 黏度的测定
表观黏度:通过使用数字黏度计测量新鲜制备的W/O乳液的黏度。试验期间所有样品的温度保持在25 ℃,转速控制在6 r/min,黏度值以mPa·s记录。
剪切黏度:通过旋转流变仪测定乳液的流变学。转子型号为PP25,测试温度为25 ℃,剪切速率为1~100 s-1。将样品加载到平行板几何形状上并使其平衡2 min后,将转子降低至指定的高度(1.0 mm)以进行测量。每个测试样品重复3次以取平均值。样品的表观黏度值表示为剪切速率的函数。
1.3.7 色差的测定
使用色差仪测定灭菌后样液,L*表示亮度,a*表示红绿值,b*表示黄蓝值[8]。颜色由亮度和色度共同表示,其中色度是不包括亮度在内的颜色性质。色调是由物体反射的光线中以哪种波长占优势来决定的,不同波长产生不同颜色感觉,色调是颜色的重要特征。色度Cab和色调Hab计算分别如公式(2)、公式(3)所示:
(2)
(3)
1.3.8 表面疏水性的测定
参照李春翼等[9]的方法并稍作改动,取4 mL样液加入80 μL 1 mg/mL溴酚蓝溶液(bromophenol blue,BPB,用去离子水溶解),混合均匀,室温下反应10 min,10 000×g离心10 min,将上清液稀释10倍后,在595 nm测吸光度值。以未加样品的溴酚蓝溶液作为空白样,其他均一致。表面疏水性(H0)计算如公式(4)所示:
(4)
1.3.9 吸附蛋白含量的测定
取1 mL乳液以室温10 000×g离心15 min,得到上下两层,其中上层为乳析层,下层为乳清层。用带针头的注射器取下清层,并过0.45 μm的滤膜,滤液采用考马斯亮蓝法以牛血清蛋白作标准曲线测定滤液中蛋白质含量[10]。蛋白吸附率(adsorbed protein,AP)的计算如公式(5)所示:
(5)
式中:Cs,用于乳液制备的初始蛋白分散液质量浓度,mg/mL;Cf,滤液中蛋白质质量浓度,mg/mL。
1.3.10 化学作用力的测定
取2 g样品,分别与20 mL SA溶液(0.05 mol/L 氯化钠)、SB溶液(0.6 mol/L氯化钠)、SC溶液(0.6 mol/L氯化钠+1.5 mol/L尿素)、SD溶液(0.6 mol/L氯化钠+8 mol/L尿素)和SE溶液(0.6 mol/L氯化钠+8 mol/L尿素+0.05 mol/L β-巯基乙醇)混合并均质1 min,4 ℃静置1 h,然后4 ℃ 8 000 r/min离心15 min,提取上清液。用考马斯亮蓝法测定上清液中蛋白含量[11]。
离子键的贡献:以溶解于SB与SA中蛋白质含量之差表示;氢键:以溶解于SC与SB中蛋白含量之差表示;疏水相互作用:以溶解于SD与SC中蛋白含量之差表示;二硫键:以溶解于SE与SD中含量之差表示。
1.3.11 游离钙含量测定
采用钙离子选择性电极测定。校准电极,以标准使用液浓度的lg值为横坐标,相应测得的电位值为纵坐标,进行制图及方程拟合。吸取样品50 mL,加入0.5 mL 3 mol/L KCl 溶液,充分混匀。插入钙离子选择性电极,待充分稳定后读取电位值。根据拟合方程即可求得样品中游离钙的含量[12]。
1.4 数据分析
所有乳液均在3个独立试验中制备,并且所有测量至少重复3次。利用IBM SPSS Statistics 26.0软件对数据进行分析,并用“均值±标准差”表示,采用单因素方差分析(analysis of variance,ANOVA)和Tukey多重比较确定均值之间的显著性差异(P<0.05)。绘图采用OriginPro 2024 10.1软件。
2 结果与分析
2.1 磷酸盐对乳液热稳定性的宏观及微观结果
选取六偏磷酸钠、三聚磷酸钠、酸式焦磷酸钠研究对乳液热稳定的影响,六偏磷酸钠组在试验范围内均出现热凝固现象,故只选取三聚磷酸钠和酸式焦磷酸钠组作为进一步研究对象。从宏观图像(图2)分析得出,与对照组相比,磷酸盐的添加在特定范围内可以一定程度上有效提高乳液的热稳定性。由图2可以明显看到,磷酸盐的添加量对121 ℃灭菌15 min的乳液稳定性有显著影响。低浓度磷酸盐的添加并不能有效提高乳液的热稳定性,而过量添加磷酸盐也会引起乳液失稳。酸式焦磷酸钠组添加量在0.06~0.08 g/100 g时能有效提高乳液热稳定性,抑制絮凝的产生,三聚磷酸钠在0.04~0.06 g/100 g时能有效抑制絮凝现象。

a-添加六偏磷酸钠,添加量分别为0、0.02、0.04、0.06、0.08、 0.10 g/100 g(对应编号分别为0#、1#、2#、3#、4#、5#); b-添加三聚磷酸钠,添加量分别为0.02、0.04、0.06、0.08、 0.10 g/100 g(对应编号分别为6#、7#、8#、9#、10#); c-添加酸式焦磷酸钠,添加量分别为0.02、0.04、0.06、0.08、 0.10 g/100 g(对应编号分别为11#、12#、13#、14#、15#)
图2 六偏磷酸钠、三聚磷酸钠、酸式焦磷酸钠对 乳液热稳定性影响
Fig.2 Effect of SHMP, STP, and DDPP on thermal stability of emulsion
使用激光共聚焦技术可以评估磷酸盐质量浓度增加对蛋白和脂滴分布的情况,如图3所示(油滴被尼罗红染成红色,蛋白质被固绿染成绿色)。

图3 不同磷酸盐种类及添加量对乳液界面结构的影响
Fig.3 Effect of different phosphate types and concentrations on the emulsion interface structure
注:标尺为10 μm;该图为激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)微观结构。
随着磷酸盐添加量的增加,蛋白分布从最初的絮凝态到分布均匀再到逐渐呈现网络结构;油滴也由大液滴逐渐减小且分布均一然后到液滴聚集。该结果与宏观现象一致,说明适量磷酸盐(0.06 g/100 g)的添加使得蛋白与脂滴的分布形态与方式更加有序。在高磷酸盐添加量(0.10 g/100 g)下网络状结构的产生很大程度上是由于液滴间相互作用力的增强导致桥连絮凝的产生,可能还促进了聚集颗粒凝胶的形成。结合宏观和共聚焦微观图像发现三聚磷酸钠和酸式焦磷酸钠添加量在0.06 g/100 g左右时乳液液滴分布较均匀,分析原因是蛋白质外层包裹了一层高电荷量磷酸基团,由于静电屏蔽作用,提高了液滴之间的静电排斥作用,抑制了液滴的聚集[13],因此添加了0.06 g/100 g左右的磷酸盐使得蛋白乳液在高温处理后仍能保持较高的稳定性。
2.2 磷酸盐对乳液粒径大小的影响
平均粒径反应了乳液体系中脂肪球体积大小,粒径越小,说明乳液稳定性越高。由表1看出,与宏观及微观图像基本一致,三聚磷酸钠最佳添加量为0.04~0.06 g/100 g,制备出的乳液经超高温灭菌后仍能保持较好的稳定性,粒径相对较小,约为0.83 μm,酸式焦磷酸钠最佳添加量为0.06~0.08 g/100 g,粒径约为0.84 μm,对照组中大粒径的出现表明发生了乳液液滴的聚集,从而说明磷酸盐的添加量能有效提高乳液体系的热稳定性。可能是因为适量的磷酸根基团使得乳蛋白带电基团发生了中和,增强了乳蛋白结构的热稳定性,油滴间的静电排斥力和相互吸引力的作用达到平衡,从而使得乳液液滴减小。XIONG等[14]同样发现磷酸化卵白蛋白的乳液更稳定,其体积平均直径D4,3由70.22 μm降至16.21 μm,微观图像也表明乳液液滴分布更密集、均匀。
表1 磷酸盐对乳液粒径大小的影响 单位:μm
Table 1 Effect of phosphate on the particle size of the emulsion

种类磷酸盐浓度/(g/100 g)00.020.040.060.080.10DDPP8.78±0.80aa3.56±0.23b1.06±0.13cd0.87±0.01d0.84±0.01d1.30±0.10cSTP8.78±0.80aa1.23±0.05b0.86±0.02c0.83±0.02c1.06±0.02bc1.27±0.03b
注:小写字母不同代表同一行数据间具有显著性差异(P<0.05)。
2.3 磷酸盐对乳液离心稳定系数的影响
磷酸盐对乳液离心稳定系数的影响如图4所示。与离心沉淀率相比,离心稳定系数R是反映乳液稳定性的优异指标,R值高时,乳液更稳定。
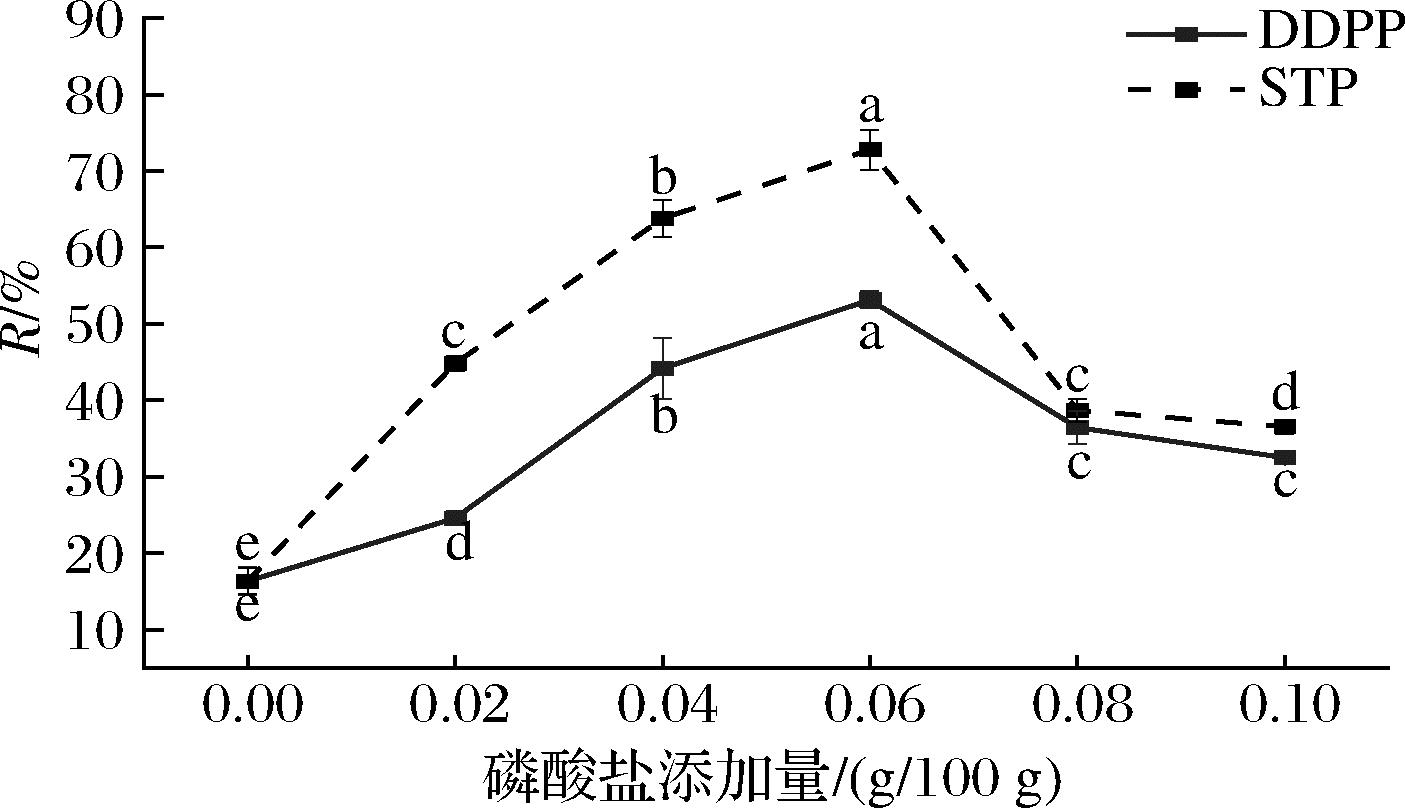
图4 磷酸盐对乳液离心稳定系数的影响
Fig.4 Effect of phosphate on the centrifugal stability coefficient of emulsion
注:不同小写字母代表差异显著,(P<0.05)(下同)。
通过对样液离心稳定系数R的测定结果(图4)发现,随着磷酸盐添加量的增加,R值呈现先上升后下降的趋势。R值越高表示乳液体系越稳定,即随着磷酸盐添加量的增加,乳液体系越来越稳定直至最高(STP 72.77%,DDPP 53.14%),但是随着磷酸盐过量的添加,体系出现热凝固等失稳现象,R值降低,可能是因为磷酸盐的过量添加影响了蛋白与油滴的相互作用,从而在油水界面处形成蛋白质的凝聚,或是油滴暴露聚集导致乳液稳定性下降。磷酸盐提高乳液体系稳定性的原因分析是磷酸盐与蛋白发生了(非)共价交联,复合物改善了乳蛋白的界面特性。WANG等[15]通过探究三聚磷酸钠对谷蛋白的结构影响发现,磷酸化蛋白的功能特性有所改善,热稳定性显著提高,与本实验结果相似。
2.4 磷酸盐对乳液热絮凝时间的影响
HCT是指从试管浸入油浴开始至出现肉眼可见絮凝现象的时间。HCT值越大则乳液热稳定性越高。由图5可以看出,磷酸盐的种类和浓度的变化对乳液的热稳定性的影响不同。三聚磷酸钠和酸式焦磷酸钠对乳液的热稳定性的影响趋势相近,随着磷酸盐浓度的增加,HCT 值呈现先上升后下降的趋势,磷酸盐添加量为0.06 g/100 g时乳液的热稳定性最高。与未加磷酸盐的对照组乳液相比,磷酸盐的添加能显著增强乳液的热稳定性,结果与乳液粒径大小、离心稳定系数、CLSM等结果一致。李妍等[16]通过研究磷酸盐对浓缩乳清蛋白(whey protein concentrate,WPC)热稳定性影响的研究同样发现,添加磷酸盐能够增强WPC的热稳定性。
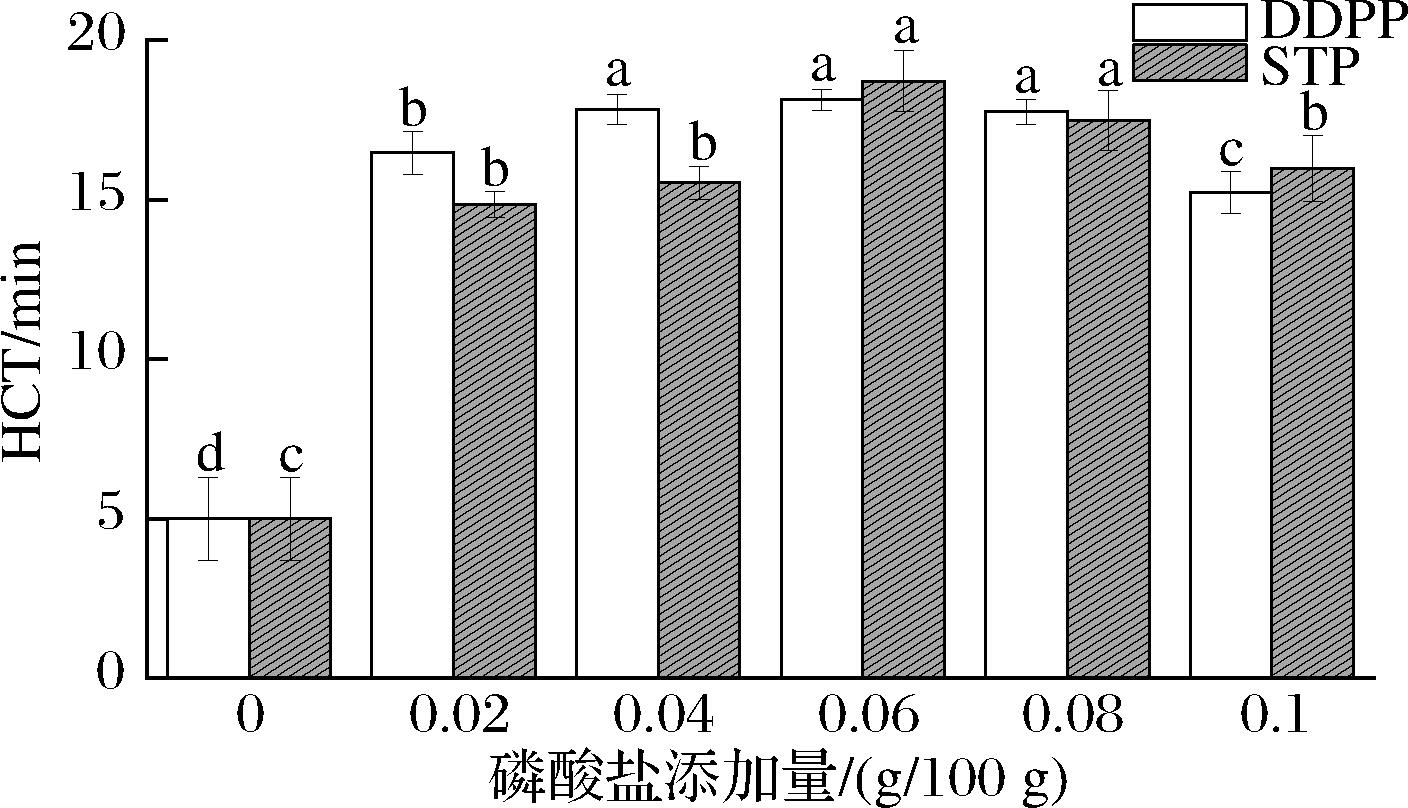
图5 磷酸盐对乳液HCT的影响
Fig.5 HCT changes of emulsion under different concentrations of phosphate
2.5 磷酸盐对乳液黏度的影响
由图6可知,低浓度磷酸盐(<0.08 g/100 g)的添加,灭菌后乳液的表观黏度呈现轻微的增长趋势,可能是因为磷酸根螯合了游离钙离子,导致乳液连续相黏度增加。但磷酸盐添加量超过0.08 g/100 g时,体系黏度值增加显著,可能是因为过量磷酸盐的添加导致蛋白交联,乳液呈现凝胶化状态,与本试验的宏观现象一致,即过量的磷酸盐添加后乳液呈现凝胶化等失稳现象。乳液的流变行为会受很多因素影响,比如连续相黏度、平均粒径及粒度分布、蛋白质浓度和液滴间相互作用的性质。HUANG等[17]研究表明,表观黏度与粒径大小及分布相关,粒径越大,表观黏度越高,与本实验中过量磷酸盐处理后的乳液表现出较高的表观黏度结果一致。
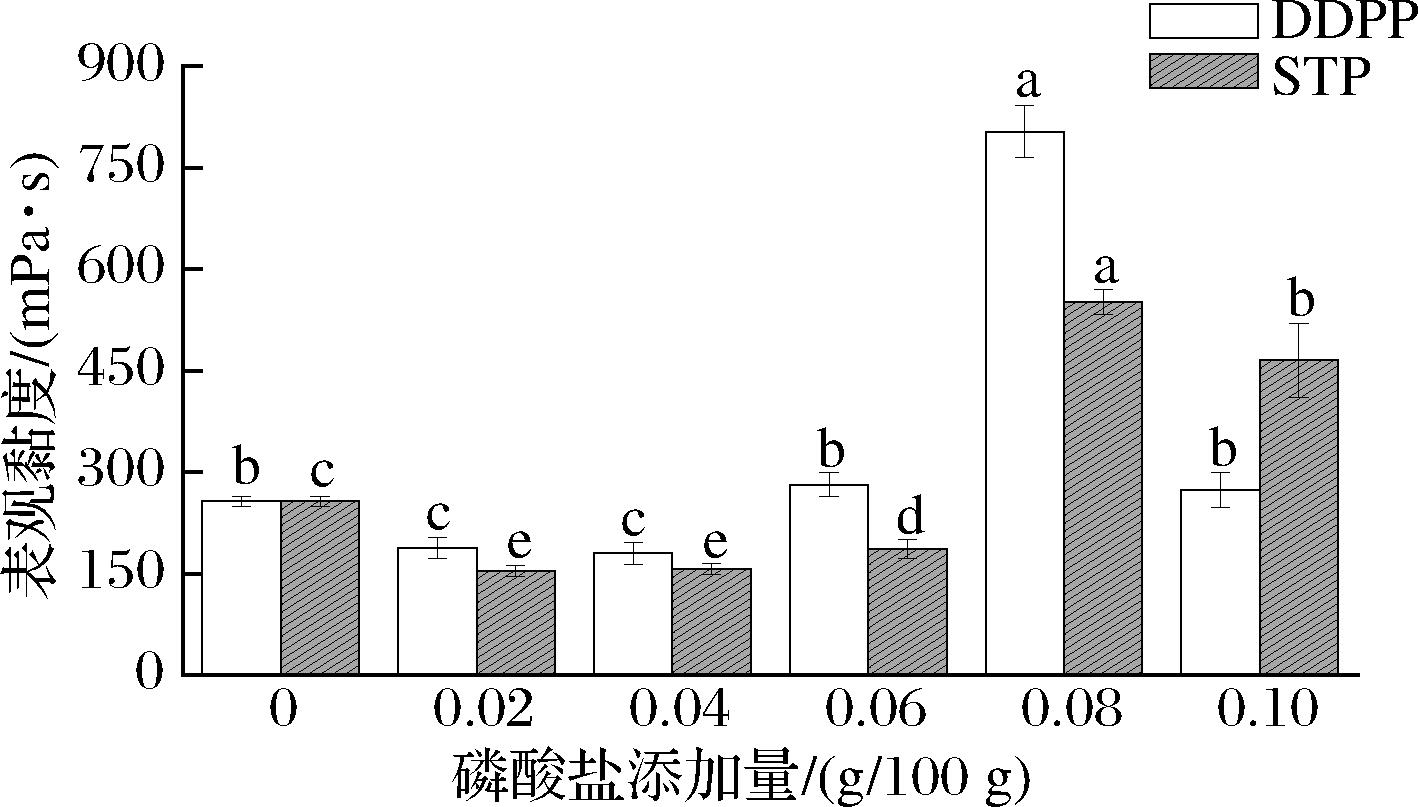
图6 磷酸盐对乳液表观黏度的影响
Fig.6 Effect of phosphate on the apparent viscosity of emulsion
剪切稀化行为是乳液的一个明显特征,它与聚合乳液中剪切作用引起的絮凝体大小和形状的变化有关。由图7可知,明显失稳的对照组(0组)、低磷酸盐添加量组(0.02 g/100 g)与高磷酸盐添加量组(0.10 g/100 g)的初始黏度较高,这是因为经过超高温灭菌处理后失稳的乳液体系由于热变性聚集,分子结构由有序变为无序,蛋白形状不规则、不对称性增大,蛋白分子间摩擦性增大,流动性变差,从而导致黏度增大,这与2.2节、2.3节的结果一致。而添加了0.06 g/100 g磷酸盐的乳液剪切黏度的始末状态差异较小,说明其抵抗剪切行为的能力较强,即表现出较高的稳定性能。
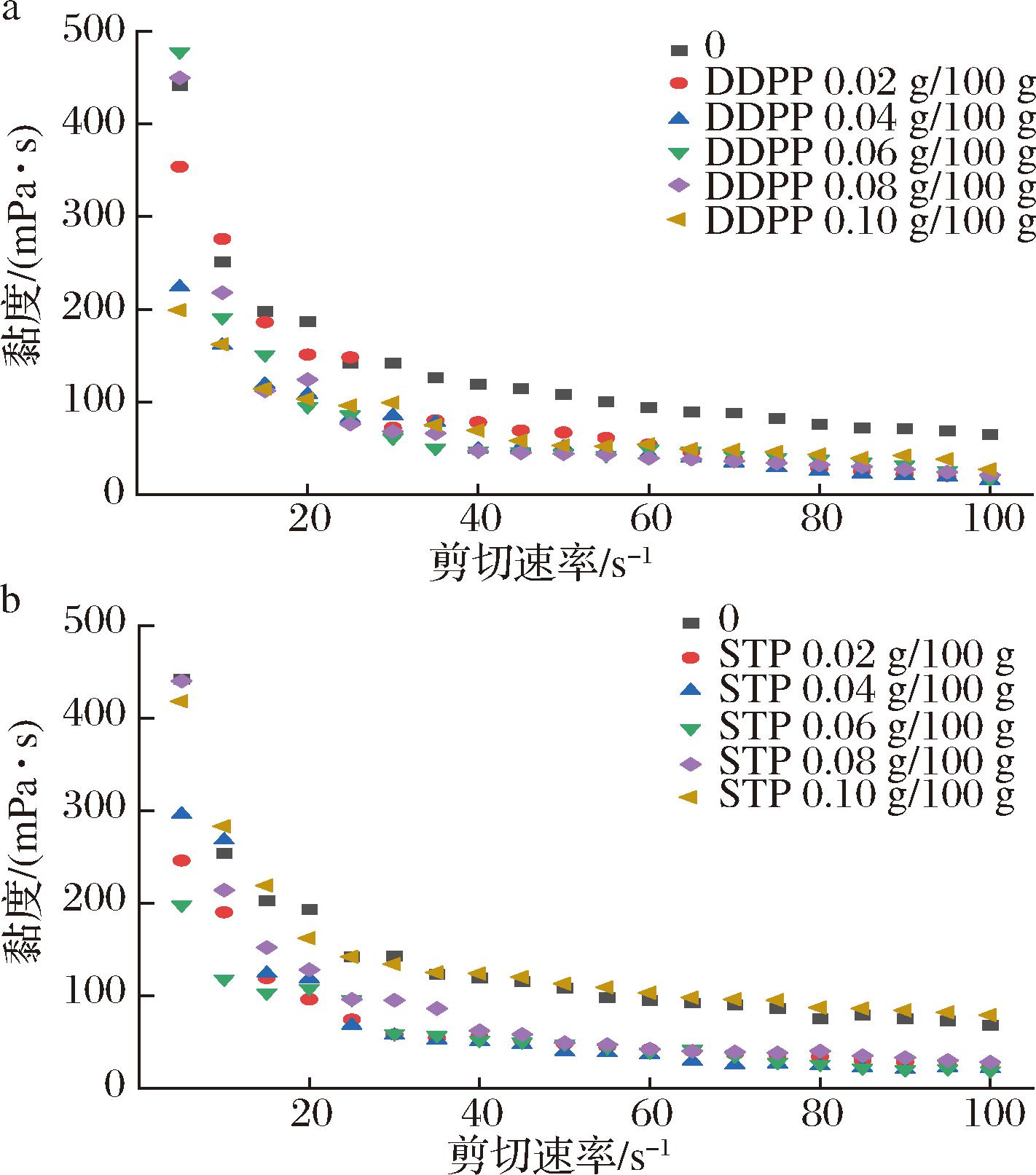
a-添加酸式焦磷酸钠;b-添加三聚磷酸钠
图7 磷酸盐对乳液剪切黏度的影响
Fig.7 Effect of phosphate on the shear viscosity of emulsion
2.6 磷酸盐对乳液色泽的影响
高温灭菌后的乳液颜色会由乳白色转变为焦糖色,从而相应反映了美拉德反应的程度。由图8-d、图8-e可见,高温灭菌后,乳液色度Cab和色调Hab作为颜色的重要特征均随着磷酸盐添加量的增加呈现显著增长趋势。乳液的亮度(L*)随着磷酸盐添加量的增加而降低,由最开始的74.56降至69.31(STP)和68.19(DDPP),这是由于存在大量吸收光波的生色团,使乳液显得更暗。随着磷酸盐添加量的增加,乳液的a*和b*值都变得越来越大,即乳液趋于红色和黄色,这种影响可能是由于乳液体系中的磷酸盐浓度提高时,磷酸盐的添加促进了蛋白和糖类的某些反应(如美拉德反应等),进而改变了乳液的色泽,改善了乳蛋白的结构特性,提高了乳液的稳定性。马灵等[18]也报道过磷酸盐缓冲液可以促进糖基化反应的进行。本实验中适量磷酸盐的添加能提高乳液的热稳定性的其中一个原因是形成的美拉德反应产物提高了乳液的热稳定性,与石云琪[19]将制备美拉德产物应用于水包油体系中发现能有效提高乳液的稳定性结论相似。本实验的目的是评估在高温高压处理后磷酸盐的存在对乳液体系光学性能的影响,同时侧面验证了磷酸盐的添加促进了美拉德反应的进行,改善了乳蛋白结构特性。许多食品在其生产或贮存过程中都会受到环境压力,因此有色乳液在受到这些压力后保持其所需颜色属性的能力是一项重要的质量标准[20],本实验中三聚磷酸钠的添加相较于酸式焦磷酸钠对乳液的色泽改变得较小。
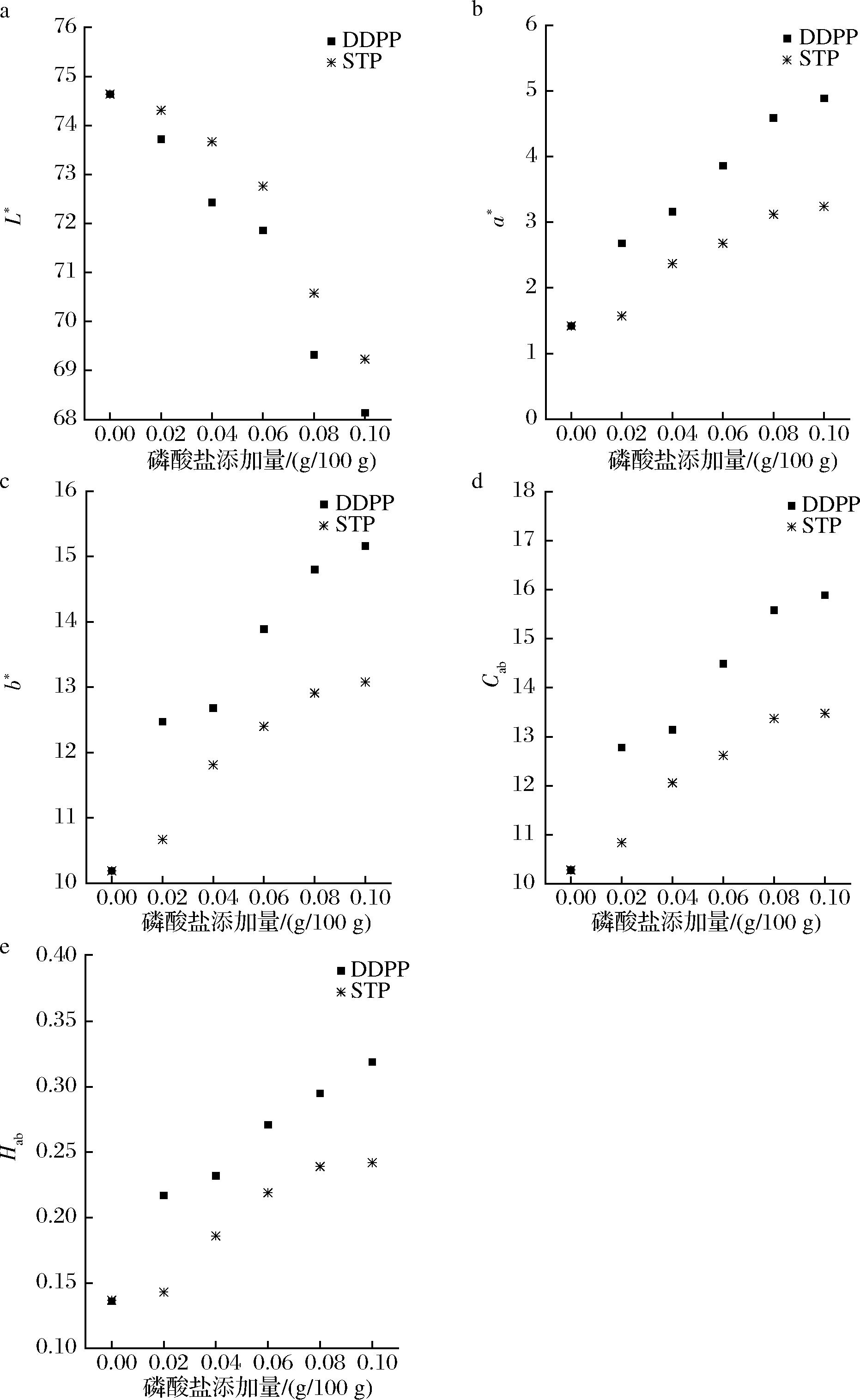
a-磷酸盐添加量对L*的影响;b-磷酸盐添加量对a*的影响; c-磷酸盐添加量对b*的影响;d-磷酸盐添加量对Cab的影响; e-磷酸盐添加量对Hab的影响
图8 磷酸盐对乳液色差的影响
Fig.8 Effect of phosphate on the color difference
2.7 磷酸盐对乳液蛋白吸附率的影响
蛋白质吸附率是影响乳液稳定性的一个重要的界面层性质。乳蛋白在界面的吸附量可能主要归因于酪蛋白和/或乳清蛋白在连续相中的不同分子结构和键合性质[21]。在O/W乳液形成过程中,蛋白质的疏水区迅速吸附到油滴表面,蛋白质构象的重排导致在油滴表面上形成膜(界面层)。双层或混合层系统易于捕获更多的蛋白质和/或多糖,从而增加了蛋白质的吸附[22]。由图9可知,在低浓度下,随着磷酸盐的增加,乳液界面蛋白的吸附量呈现下降的趋势;磷酸盐添加量超过0.08 g/100 g时,乳液体系呈现一种热凝固状态,界面蛋白吸附率反而增加。这与通常情况下,高稳定性的乳液具有较高的界面蛋白吸附率趋势相反,本试验结果可能是当在适当量的磷酸盐存在下乳蛋白吸附在界面上时,美拉德反应形成的乳蛋白-麦芽糊精复合物抑制了乳蛋白的聚集,也可能是由于减小的粒径和掩埋的疏水基团,乳蛋白-麦芽糊精复合物在界面处的扩散,展开和重排表现出改善的性能,更好地包裹住液滴,从而导致界面蛋白质吸附率下降[23]。吸附或分散的乳蛋白膜的表面性质的改变间接表明磷酸盐可能通过络合机制参与了界面行为[24]。
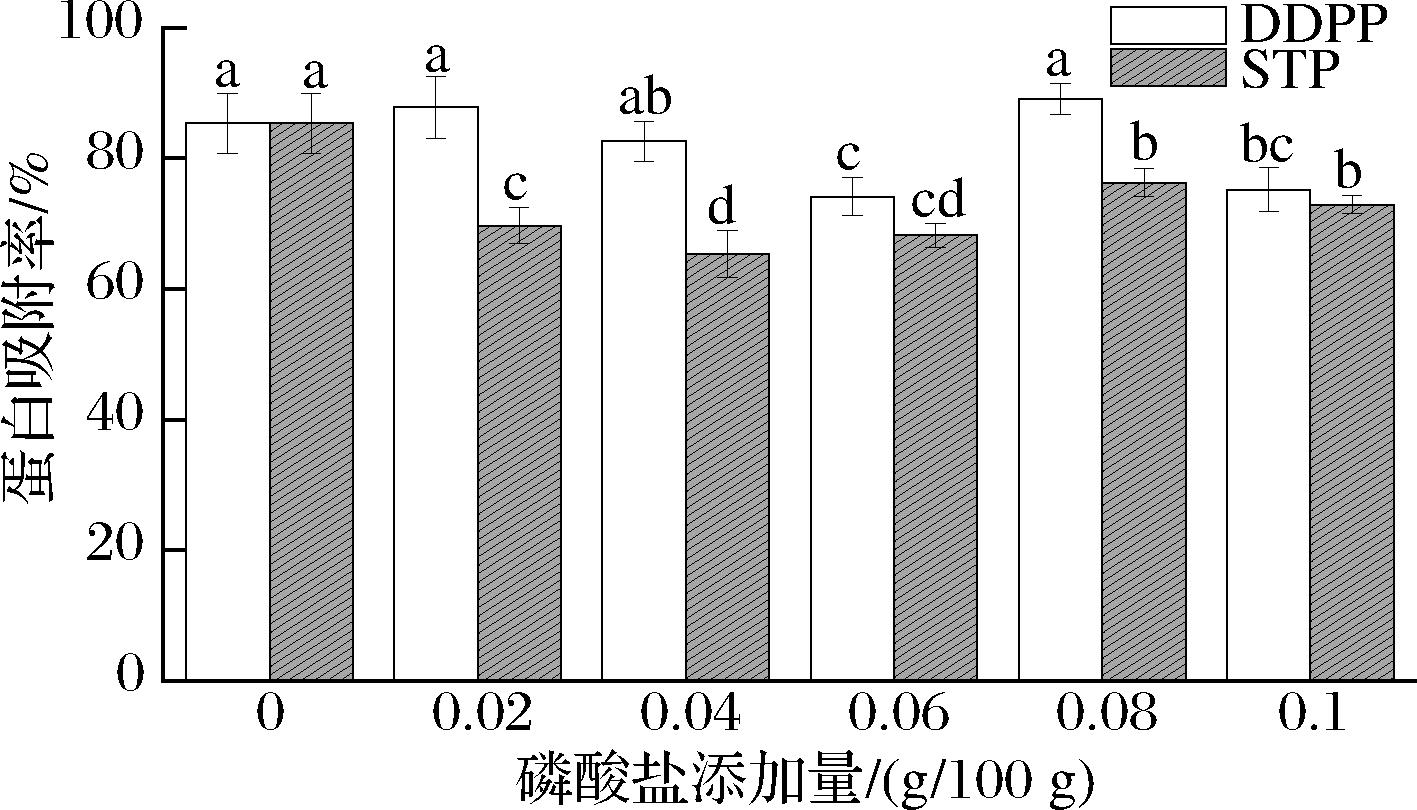
图9 磷酸盐对乳液界面蛋白吸附率的影响
Fig.9 Effect of phosphate on the amount of protein adsorbed at the interface
2.8 磷酸盐对乳液表面疏水性的影响
表面疏水性(H0)与蛋白质吸附到界面的能力密切相关[5],是评估蛋白质构象变化的结构特征之一,是蛋白质与其周围极性溶液环境之间相互作用的指标。通常试验中样液经过高温热处理,蛋白质结构部分展开,使裸露在球蛋白中的疏水基团暴露出来[25],从而呈现较高的表面疏水性。与覃小丽等[26]研究结果不一致的是本试验中高稳定性的乳液具有较低的表面疏水性。
由图10可知,本实验中当磷酸盐添加量为0.06 g/100 g时乳液呈现较高稳定性时反而具有较低疏水性。与对照组相比,磷酸盐添加量适量时(0.04~0.06 g/100 g),表面疏水性降低,可能是因为磷酸根是强亲水性基团与蛋白质相互作用,改变了蛋白质空间位阻,在油滴表面形成牢固的稳定粒子,乳蛋白的疏水基团被掩埋,从而表现出较低的表面疏水性。而继续增大添加量时,表面疏水性增加,可能是因为过量磷酸盐使得乳液体系失衡,油滴聚集,呈现热聚集状态,从而导致蛋白质疏水结构暴露,复合乳液体系的表面疏水性增大。在目前的研究中,都是假设大多数蛋白质吸附到乳液液滴的表面,而在连续相中只有很少的游离蛋白[27],因此也有可能是所有暴露的蛋白质疏水基团都与脂质相互作用,从而降低了液滴的表面疏水性。这种情况将降低液滴间相互作用的可能性,从而防止液滴彼此靠近并广泛聚集,与实验中粒径、宏观微观结果等一致。
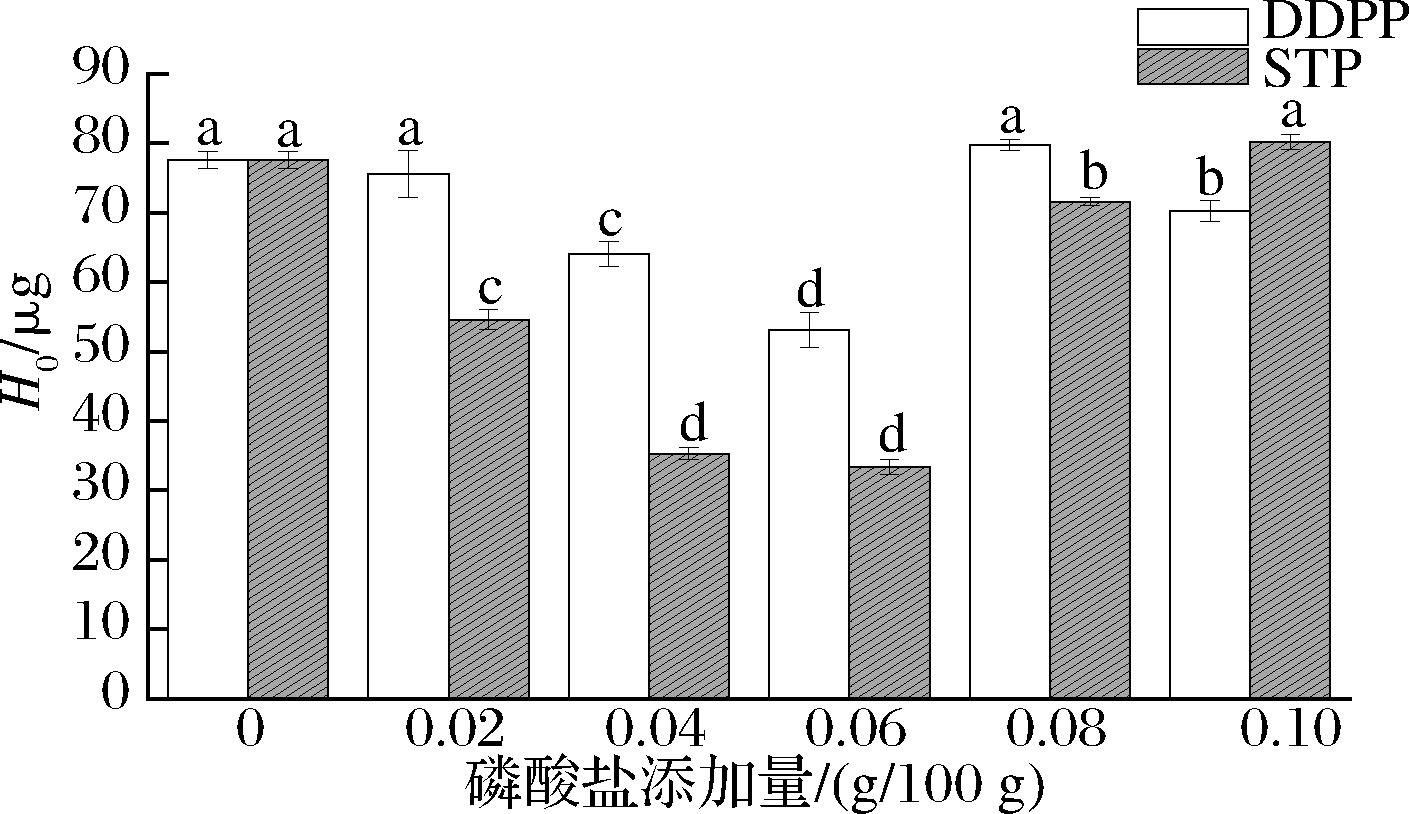
图10 磷酸盐对乳液表面疏水性的影响
Fig.10 Effect of phosphate on the hydrophobicity of the emulsion surface
2.9 磷酸盐对乳液化学相互作用力的影响
蛋白乳液在实际生产中易受温度等因素影响产生不稳定现象,因此多糖除了通过共价结合形成共轭物增加空间斥力增强乳液稳定性外,还可以通过非共价作用(静电、疏水、氢等)形成复合物,增强静电稳定性。蛋白分子间的相互作用力主要包括离子键、氢键、二硫键、疏水相互作用等。由图11可知,离子键、氢键和疏水作用所占比例较大。对照组与磷酸盐过量组(0.10)即失稳体系中氢键较小,表明体系中电荷数和静电斥力减少,蛋白质的疏水残基暴露,诱导蛋白质的完全展开和迅速聚集,乳液粒径也相应增大,从而导致蛋白质乳液液滴絮凝的发生。氢键能够结合水分子,与蛋白质的二级结构相关,对于稳定蛋白质构象有一定贡献。由图11可以看出,磷酸盐的添加能够增强氢键作用,说明磷酸盐的添加能一定程度增强吸附层之间的静电排斥作用,蛋白质趋于折叠化,疏水残基被掩埋,从而防止乳液絮凝。疏水作用总体随着磷酸盐的添加呈现先下降后上升的趋势,疏水作用的下降说明乳液正趋于稳定态,这与疏水基团被掩埋导致的表面疏水性下降一致。二硫键的增强说明蛋白质疏水基团的暴露,促进了凝胶结构形成。随着适量磷酸盐的添加,乳蛋白开始变性并有序聚集,而最终体系中蛋白质分子的相互作用力会达到一种新的平衡用于维持乳液的稳定。
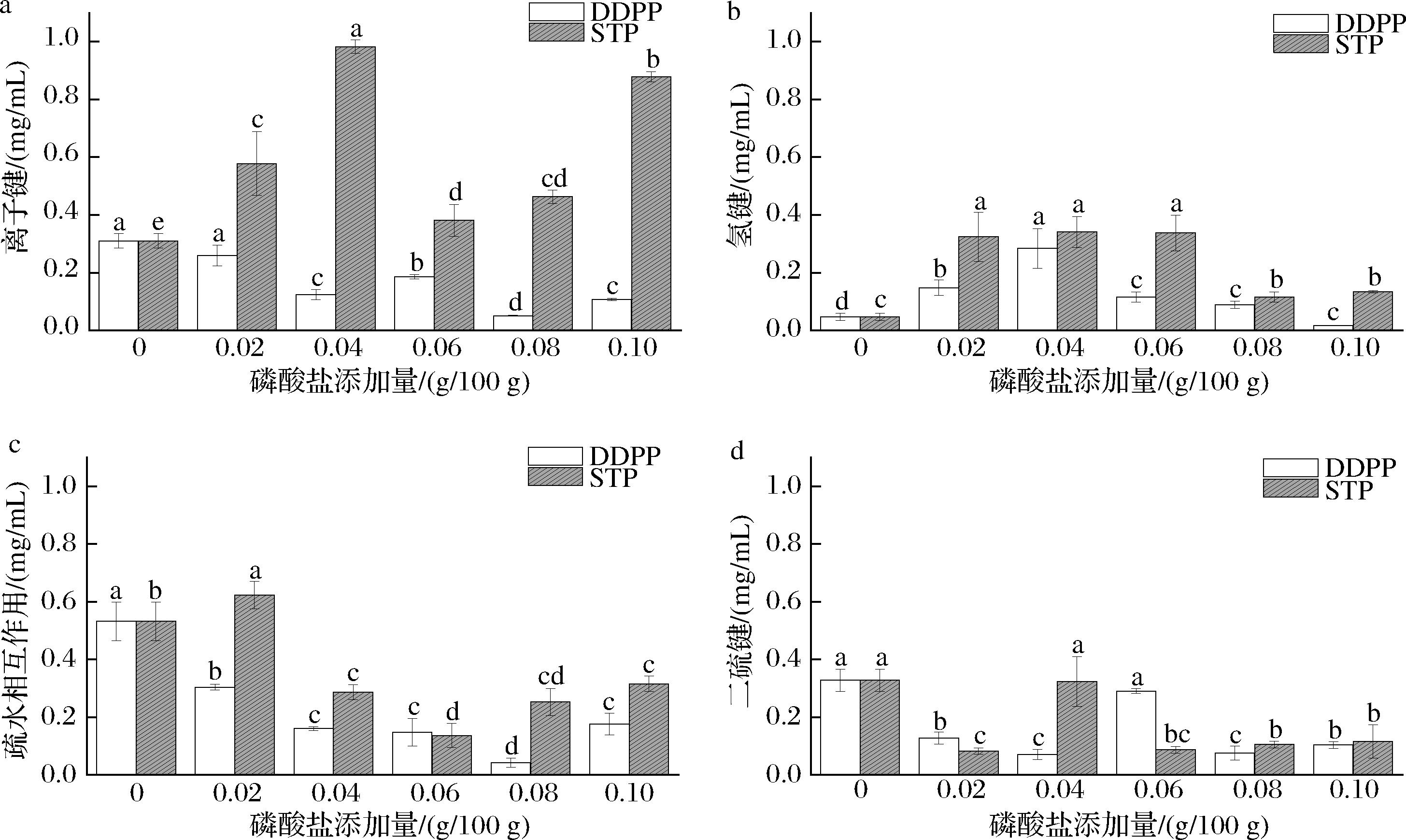
a-磷酸盐含量对离子键的影响;b-磷酸盐含量对氢键的影响;c-磷酸盐含量对疏水相互作用的影响;d-磷酸盐含量对二硫键的影响
图11 磷酸盐添加量对乳液体系相互作用力的影响
Fig.11 Effect of phosphate content on the interaction force of emulsion system
2.10 磷酸盐对乳液中游离钙离子含量的影响
钙离子和蛋白质结合降低分子之间的静电斥力,促进疏水区域之间的相互作用,降低能量壁垒,从而影响蛋白质在油水界面的吸附行为和形成乳液的稳定性[28]。RAVINDRAN等[13]发现乳清蛋白乳液中由于乳清蛋白与Ca2+的结合以及静电屏蔽作用导致分子间静电排斥力减少,从而产生蛋白质絮凝。
而钙离子含量与磷酸盐的添加有显著联系,由图12可知,随着磷酸盐添加量的增加,体系中游离钙离子含量下降。磷酸盐作为螯合剂能够起到螯合游离钙离子作用,从而降低体系中游离钙离子含量,乳液体系达到稳定状态。通过对乳液体系中游离钙离子的测定,发现随着磷酸盐添加量的增加,体系中游离钙离子呈现下降趋势,说明磷酸盐能有效减少体系中游离钙离子。但磷酸盐的螯合作用不是唯一改善乳液稳定性的作用机制,如图13所示,磷酸盐的添加能够增加体系的黏度,改变乳蛋白的界面特性(如表面疏水性、界面蛋白吸附率等),在适量磷酸盐的添加情况下,(非)共价形成的乳蛋白-麦芽糊精复合物也能抑制乳液液滴的聚集。
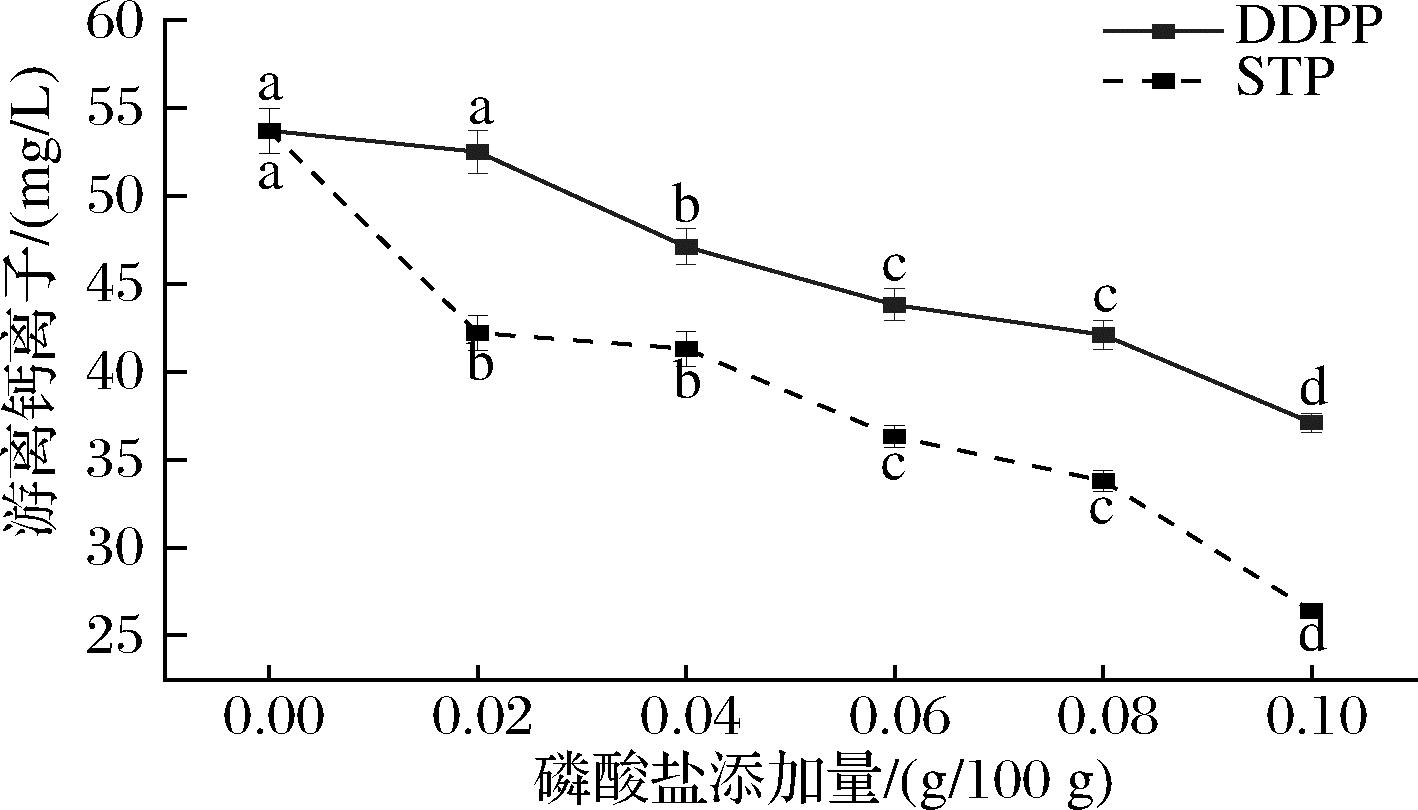
图12 磷酸盐添加量对乳液中游离钙离子的影响
Fig.12 Effect of phosphate addition on free calcium ion in emulsion
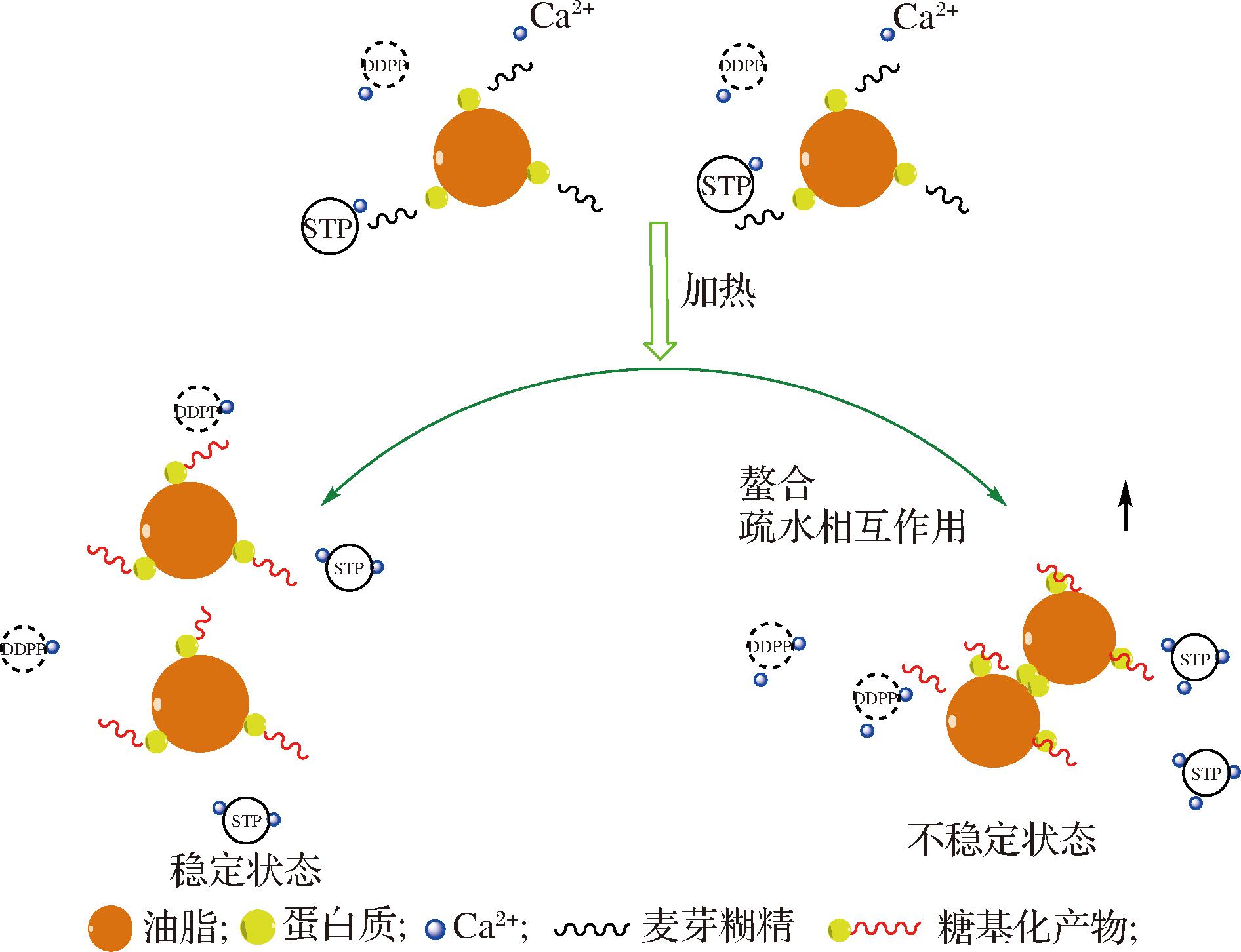
图13 磷酸盐作用机制
Fig.13 Mechanism of phosphate action
3 总结
通过对乳液粒径大小、絮凝指数和离心稳定系数等结果的分析,直观反映了适量的磷酸盐能有效提高高温灭菌后乳液的热稳定性。激光共聚焦和界面蛋白吸附量以及表面疏水性从界面结构分析了磷酸盐的种类及添加量对乳液热稳定性的影响。之前的研究大多从宏观层面简单阐述了磷酸盐能够增强乳液的热稳定性现象,本文则更深入地探究了磷酸盐的作用机制。通过对乳液体系中游离钙离子的测定发现,磷酸盐能够螯合乳液中游离钙离子,但螯合作用不是稳定乳液的唯一原因,磷酸盐的适量添加增加了体系的黏度,促进了乳蛋白与麦芽糊精(非)共价作用的发生,导致乳蛋白改性,改善了液滴吸附层的界面特性。但过量的磷酸盐可能会导致疏水基团暴露,蛋白产生桥连絮凝,油滴聚集,从而呈现凝胶化状态。本研究为高稳定性食品乳液的生产提供了一定的思路,适量磷酸盐的添加可以抑制超高温处理带来的絮凝等失稳现象。
[1] MCCLEMENTS D J, JAFARI S M.Improving emulsion formation, stability and performance using mixed emulsifiers:A review[J].Advances in Colloid and Interface Science, 2018, 251:55-79.
[2] MARHAMATI M, RANJBAR G, REZAIE M.Effects of emulsifiers on the physicochemical stability of oil-in-water nanoemulsions:A critical review[J].Journal of Molecular Liquids, 2021, 340:117218.
[3] 李振铎, 井月欣, 张健, 等.多磷酸盐在冷冻鳕鱼鲽鱼片加工中的安全应用[J].中国食品添加剂, 2019, 30(3):127-132.LI Z D, JING Y X, ZHANG J, et al.Study on the safety of sodium polyphosphates treatment in frozen Pollock Fillets and Flounder Fillets[J].China Food Additives, 2019, 30(3):127-132.
[4] 付徐芳, 邓源喜, 杨宁宁, 等.复合磷酸盐在食品工业中的应用进展[J].现代面粉工业, 2020, 34(5):18-22.FU X F, DENG Y X, YANG N N, et al.Application progress of composite phosphate in food industry[J].Modern Flour Milling Industry, 2020, 34(5):18-22.
[5] CHEN Y F, SUN Y, MENG Y L, et al.Synergistic effect of microfluidization and transglutaminase cross-linking on the structural and oil-water interface functional properties of whey protein concentrate for improving the thermal stability of nanoemulsions[J].Food Chemistry, 2023, 408:135147.
[6] REN Z Y, CHEN Z Z, ZHANG Y Y, et al.Characteristics of Pickering emulsions stabilized by tea water-insoluble protein nanoparticles at different pH values[J].Food Chemistry, 2022, 375:131795.
[7] LI Q, WANG Z G, DAI C X, et al.Physical stability and microstructure of rapeseed protein isolate/gum Arabic stabilized emulsions at alkaline pH[J].Food Hydrocolloids, 2019, 88:50-57.
[8] CHAN C K Y, ZEEB B, MCCLEMENTS D J, et al.Impact of laccase on the colour stability of structured oil-in-water emulsions[J].Food Research International, 2017, 97:223-230.
[9] 李春翼, 王启明, 唐瑜婉, 等.热诱导对麦醇溶蛋白/芦丁相互作用及其乳液流变学特性的影响[J].食品科学, 2020, 41(18):27-34.LI C Y, WANG Q M, TANG Y W, et al.Effects of heat treatment on interaction between gliadin and rutin and rheological properties of emulsion stabilized with their complex[J].Food Science, 2020, 41(18):27-34.
[10] SILVA M, ZISU B, CHANDRAPALA J.Interfacial and emulsification properties of sono-emulsified grape seed oil emulsions stabilized with milk proteins[J].Food Chemistry, 2020, 309:125758.
[11] 朱士臣, 陈小草, 郑佳妮, 等.圆苞车前子壳粉对鱼糜凝胶热稳定性的影响及机理研究[J].食品与发酵工业, 2022, 48(21):188-195.ZHU S C, CHEN X C, ZHENG J N, et al.The effect of psyllium husk powder on the thermal stability of surimi gel and its mechanisms[J].Food and Fermentation Industries, 2022, 48(21):188-195.
[12] 吴伟都, 王雅琼, 朱慧, 等.钙离子选择性电极法测定饮料中游离钙含量的影响因素及其应用[J].包装与食品机械, 2016, 34(3):66-69.WU W D, WANG Y Q, ZHU H, et al.Application and influencing factors on the content of free calcium in beverage of Ca2+ selective electrode method[J].Packaging and Food Machinery, 2016, 34(3):66-69.
[13] RAVINDRAN S, WILLIAMS M A K, WARD R L, et al.Understanding how the properties of whey protein stabilized emulsions depend on pH, ionic strength and calcium concentration, by mapping environmental conditions to Zeta potential[J].Food Hydrocolloids, 2018, 79:572-578.
[14] XIONG Z Y, ZHANG M J, MA M H.Emulsifying properties of ovalbumin:Improvement and mechanism by phosphorylation in the presence of sodium tripolyphosphate[J].Food Hydrocolloids, 2016, 60:29-37.
[15] WANG Y R, ZHANG B, FAN J L, et al.Effects of sodium tripolyphosphate modification on the structural, functional, and rheological properties of rice glutelin[J].Food Chemistry, 2019, 281:18-27.
[16] 李妍, 李海梅, 杨与争, 等.磷酸盐及钙离子对浓缩乳清蛋白热稳定性的影响[J].中国乳品工业, 2015, 43(7):13-15;25.LI Y, LI H M, YANG Y Z, et al.Effect of phosphates and calcium on the heat stability of whey protein concentrate[J].China Dairy Industry, 2015, 43(7):13-15;25.
[17] HUANG L H, CAI Y J, LIU T X, et al.Stability of emulsion stabilized by low-concentration soybean protein isolate:Effects of insoluble soybean fiber[J].Food Hydrocolloids, 2019, 97:105232.
[18] 马灵, 孙冬雪, 李天齐, 等.金属离子、半胱氨酸、磷酸盐和乙醇对菊粉糖基化乳清分离蛋白褐变和抗氧化活性的影响(英文)[J].食品科学, 2020, 41(12):36-45.MA L, SUN D X, LI T Q, et al.Impacts of metal ions, cysteine, phosphate and ethanol on browning and antioxidant activity of glycosylated whey protein isolate-inulin conjugate[J].Food Science, 2020, 41(12):36-45.
[19] 石芸琪. 基于美拉德反应的改性复合物在水包油乳液中的抗氧化作用研究[D].无锡:江南大学, 2018.SHI Y Q.Study on antioxidant effect of modified compound based on Maillard reaction in oil-in-water emulsion[D].Wuxi:Jiangnan University, 2018.
[20] ZEEB B, FISCHER L, WEISS J.Cross-linking of interfacial layers affects the salt and temperature stability of multilayered emulsions consisting of fish gelatin and sugar beet pectin[J].Journal of Agricultural and Food Chemistry, 2011, 59(19):10546-10555.
[21] HINDERINK E B A, MÜNCH K, SAGIS L, et al.Synergistic stabilisation of emulsions by blends of dairy and soluble pea proteins:Contribution of the interfacial composition[J].Food Hydrocolloids, 2019, 97:105206.
[22] YUAN Y, WAN Z L, YIN S W, et al.Formation and dynamic interfacial adsorption of glycinin/chitosan soluble complex at acidic pH:Relationship to mixed emulsion stability[J].Food Hydrocolloids, 2013, 31(1):85-93.
[23] CHENG J J, DUDU O E, WANG D, et al.Influence of interfacial adsorption of glyceryl monostearate and proteins on fat crystallization behavior and stability of whipped-frozen emulsions[J].Food Chemistry, 2020, 310:125949.
[24] MARTINEZ K D, CARRERA SANCHEZ C, PIZONES RUIZ-HENESTROSA V, et al.Soy protein-polysaccharides interactions at the air-water interface[J].Food Hydrocolloids, 2007, 21(5-6):804-812.
[25] CHEN M S, LU J H, LIU F, et al.Study on the emulsifying stability and interfacial adsorption of pea proteins[J].Food Hydrocolloids, 2019, 88:247-255.
[26] 覃小丽, 杨溶, 钟金锋, 等.超声作用下乳蛋白-磷脂复合体系对人乳脂类似物乳液形成与稳定的影响[J].食品与发酵工业, 2020, 46(8):20-26.QIN X L, YANG R, ZHONG J F, et al.Effect of milk protein-lecithin system treated by ultrasound on the formation and stabilization of human milk fat analog emulsion[J].Food and Fermentation Industries, 2020, 46(8):20-26.
[27] MUSTAPHA N A, RUTTARATTANAMONGKOL K, RIZVI S S H.The effects of supercritical fluid extrusion process on surface hydrophobicity of whey protein concentrate and its relation to storage and heat stability of concentrated emulsions[J].Food Research International, 2012, 48(2):470-477.
[28] ![]() M, GÖKSEL SARAÇ M, ASLAN TÜRKER D.Effect of salt on the inter-relationship between the morphological, emulsifying and interfacial rheological properties of O/W emulsions at oil/water interface[J].Journal of Food Engineering, 2020, 275:109871.
M, GÖKSEL SARAÇ M, ASLAN TÜRKER D.Effect of salt on the inter-relationship between the morphological, emulsifying and interfacial rheological properties of O/W emulsions at oil/water interface[J].Journal of Food Engineering, 2020, 275:109871.