在母乳喂养不足甚至不可获取的情况下,婴儿配方奶粉是一种有效的替代品。羊乳具有致敏性低等特点,适合婴幼儿食用,近年来羊乳基婴配奶粉的市场份额逐渐增加[1]。酪蛋白是羊乳中的主要蛋白,占总蛋白的比例达70%,含有κ、β、αs1和αs2亚组分,配比为12∶46∶24∶18[2]。母乳中的酪蛋白主要含有κ、β和αs1亚组分,配比为20∶68∶12[3]。羊乳和母乳中酪蛋白亚组分配比不同,使得羊乳基婴儿配方奶粉与母乳在消化、吸收等方面存在差异[4]。
按照母乳中酪蛋白亚组分配比,对牛羊乳酪蛋白亚组分配比进行调控,可促进婴幼儿配方奶粉的迭代升级[5]。目前,已有关于牛乳酪蛋白亚组分配比调控及消化性的报道。HUANG等[6]在脱脂牛乳中添加β-酪蛋白浓缩物,将β亚组分在总酪蛋白中的配比提高到66%,在进行婴幼儿体外模拟消化时,形成的胃凝块更加松散,酪蛋白水解更快。ZHANG等[7]将β-酪蛋白浓缩物和κ-酪蛋白浓缩物混合,进一步制备得到κ和β亚组分配比为20∶68的配方奶粉,经婴幼儿体外模拟消化形成的胃凝块小,蛋白水解快。目前,关于羊乳酪蛋白亚组分配比调控及消化性的研究较少,且尚未见同时调控羊乳酪蛋白κ和β亚组分配比的相关报道。
本研究以山羊乳胶束态酪蛋白(micellar casein,MCC)为原料,采用选择性沉淀技术分离制备κ-酪蛋白富集物、β-酪蛋白富集物和αs-酪蛋白富集物,按母乳酪蛋白亚组分配比进行复配,得到复配酪蛋白,以羊乳全酪蛋白为对照,采用激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)、十二烷基硫酸钠-丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、高效液相体积排阻色谱等手段,进行婴幼儿体外模拟胃肠消化性研究。本研究将为羊乳基婴幼儿配方奶粉的开发提供依据。
1 材料与方法
1.1 材料与试剂
山羊乳,杭州彩洋牧业有限公司;乙酸、盐酸、三氯乙酸、氢氧化钠、氯化钙、氯化钾、氯化钠,均为分析纯级别,国药集团化学试剂有限公司;胃蛋白酶、胰蛋白酶、胆盐、苯甲磺酰氟、二硫苏糖醇、邻苯二甲醛、三氟乙酸、异硫氰酸荧光素,美国Sigma公司;电泳试剂盒,碧云天生物科技有限公司;L-亮氨酸、柠檬酸三钠二水、尿素、1,3-双(三羟甲基)甲基氨基丙烷,生工生物工程(上海)技术服务有限公司。
1.2 仪器与设备
Heraeus Multifuge XIR台式高速冷冻离心机,赛默飞世尔科技(中国)有限公司;E2695 Separations Module高效液相色谱分析仪,美国Waters公司;UV-2700紫外分光光度计,日本Shimadzu公司;ChemiDoc XRS+化学发光凝胶成像仪,美国Bio-rad公司;TCS SP8型超高分辨率多光子激光共聚焦扫描显微镜,德国徕卡公司;ZORBAX 300SB-C8色谱柱(250 nm×4.6 nm, 5 μm),美国Agilent公司;TSK gel 2000SWXL(300 mm×7.8 mm)色谱柱,日本TOSOH公司。
1.3 实验方法
1.3.1 MCC分离制备
将山羊乳在45 ℃和9 000 r/min转速下离心脱脂,采用1.4 μm孔径的陶瓷膜进行微滤,收集透过液,采用100 nm孔径的陶瓷膜于45 ℃进行微滤,体积浓缩倍数为4,加水洗滤3次,收集截留液,冷冻干燥,即得MCC粉体。将MCC复溶于超纯水中,调节pH值至4.3后离心,即得酸沉去除酪蛋白后的上清液。
1.3.2 酪蛋白样品分离制备
将MCC溶于超纯水中,至酪蛋白浓度为4%(质量分数);在25 ℃和300 r/min搅拌转速下,采用2 mol/L氢氧化钠溶液调节pH值至11.0,加入2 mol/L氯化钙溶液至加入钙的浓度为60 mmol/L,平衡60 min后,采用2 mol/L乙酸溶液调节pH值至7.0,于3 000×g离心10 min,收集第一上清液和第一沉淀物[8];调节第一上清液pH值至3.8,离心收集沉淀,复溶于超纯水中,采用1 mol/L柠檬酸调节pH值至3.8,离心收集沉淀,透析后冻干,即得κ-酪蛋白富集物。
取第一沉淀物,于超纯水中复溶至初始MCC溶液体积,采用2 mol/L氢氧化钠溶液调节pH值至8.5,于2 ℃平衡120 min后,采用2 mol/L乙酸调节pH值至5.0,平衡12 h后,离心收集第二上清液和第二沉淀物[8];于45 ℃调节第二上清液pH值至4.2,离心收集沉淀,复溶于超纯水中,采用1 mol/L柠檬酸调节pH值至4.2,离心收集沉淀,透析后冻干,即得β-酪蛋白富集物。取第二沉淀物复溶于超纯水中,采用1 mol/L柠檬酸调节pH值至5.0,离心收集沉淀,透析后冻干,即得αs-酪蛋白富集物。
取κ-酪蛋白富集物、β-酪蛋白富集物、αs-酪蛋白富集物,按母乳酪蛋白亚组分配比进行复配,即得到复配酪蛋白。取MCC溶液,采用2 mol/L盐酸溶液调节pH值至4.3,离心收集沉淀,复溶于超纯水中,采用1 mol/L柠檬酸调节pH值至4.3,离心收集沉淀,透析后冻干,即得全酪蛋白。
1.3.3 婴幼儿体外模拟胃肠消化
参考MÉNARD等[9]的方法,将酪蛋白样品溶于超纯水,至蛋白浓度为1.2%(质量分数),与含724.3 U/mL胃蛋白酶酶活、94 mmol/L氯化钠和13 mmol/L氯化钾的模拟胃液,按体积比63∶37混合,调节pH值为5.3,于37 ℃保持60 min,调节pH值至7.0;之后与含42.1 U/mL胰蛋白酶酶活、249 mmol/L氯化钠、10 mmol/L氯化钾和8.2 mmol/L胆盐的模拟肠液混按体积比62∶38混合,调节pH值为6.6,于37 ℃保持60 min,加入5 mmol/L苯甲磺酰氟终止反应。
1.3.4 蛋白测定
蛋白含量的测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》。蛋白组成的测定采用反相高效液相色谱法[10]。取酪蛋白溶液与含0.1 mol/L 1,3-双(三羟甲基)甲基氨基丙烷、8 mol/L尿素、20 mmol/L二硫苏糖醇和1.3%(体积分数)柠檬酸钠的缓冲液(pH 7)混合,过0.45 μm孔径尼龙膜。流动相A和B分别以水、乙腈和三氟乙酸按950∶50∶1和200∶800∶1的体积比配制。采用C8色谱柱,柱温为40 ℃,流动相流速为0.8 mL/min,检测波长是220 nm。色谱积分采用Empower软件。
1.3.5 胃消化物中凝块微观结构分析
参考LIU等[11]的方法,取胃消化过程0、0.5、5、20、60 min的胃液混合物,按照100∶1的体积比加入0.2 mg/mL的异硫氰酸荧光素,避光保持30 min,采用激光共聚焦显微镜,于10倍镜、488 nm激发波长、498~532 nm发射波长下拍照。
1.3.6 胃消化凝块持水量测定
参考YE等[12]的方法,取胃消化0.5 min的样品,于100×g离心10 min,收集沉淀于105 ℃烘干至恒重,样品烘干前后的质量差占烘干前质量的百分比,即为持水量。
1.3.7 消化物中残留蛋白分析
采用电泳试剂盒,制备4%(体积分数)的浓缩胶和13%(体积分数)的分离胶。取消化物,采用超纯水稀释至当量蛋白质量浓度为2 mg/mL,与含10%(体积分数) β-巯基乙醇的样品缓冲液按体积比1∶1混合,沸水浴3 min,上样量为10 μL。分离胶与浓缩胶的运行电压分别为60、120 V。
采用化学发光成像仪对电泳条带中酪蛋白对应的灰度值进行测定,消化后酪蛋白条带的灰度值占消化前酪蛋白条带的灰度值的百分比,即为蛋白残留率。
1.3.8 消化物中游离氨基含量测定
参考BAVARO等[13]的方法,配制0~10 mmol/L不同浓度的标准L-亮氨酸溶液,取0.15 mL标准液与3 mL 邻苯二甲醛溶液混合,避光保持15 min,采用紫外分光光度计于340 nm处检测吸光度并绘制标准曲线。取消化物,与5%(质量分数)三氯乙酸溶液按体积比1∶1混合,于10 000×g离心30 min,将离心后的上清液按上述方法检测吸光度。
1.3.9 消化物中多肽分子质量分布分析
参考ZHANG等[14]的方法,采用高效液相体积排阻色谱测定消化物中多肽分子质量分布。相对分子质量校正曲线所使用的标品分别为:细胞色素C(相对分子质量为12 384 Da)、抑制酶(相对分子质量为6 500 Da)、杆菌肽(相对分子质量为1 422 Da)、乙氨酸-乙氨酸-酪氨酸-精氨酸(相对分子质量为451 Da)、乙氨酸-乙氨酸-乙氨酸(相对分子质量为189 Da)。取消化物,采用超纯水稀释至当量蛋白质量浓度为2 mg/mL,与8 mol/L尿素溶液按体积比1∶1混合,过0.45 μm孔径尼龙膜。流动相以水、乙腈和三氟乙酸按体积比600∶400∶1配制。设置柱温为30 ℃,流动相流速为0.5 mL/min,检测波长为220 nm。
1.4 数据分析
采用SPSS 20.0软件进行数据统计分析,采用Duncan检验比较均值之间的差异,P<0.05表示差异显著。
2 结果与分析
2.1 MCC的基本组成
将山羊乳MCC复溶后的MCC溶液采用2 mol/L盐酸调节pH值至4.3,离心去除酪蛋白,取上清液经过反相高效液相色谱检测如图1所示。参考MOATSOU等[15]利用反相高效液相色谱(reversed phase liquid chromatographic,RP-HPLC)检测山羊乳酪蛋白时对于不同亚组分峰的归属划分,由图1可知,MCC中含有15.4%κ亚组分、35.1%αs亚组分、48.5%β亚组分,且RP-HPLC检测不到酸沉上清液中乳清蛋白组分,说明分离制备的山羊乳MCC中乳清蛋白去除完全,因此可以忽略不计。
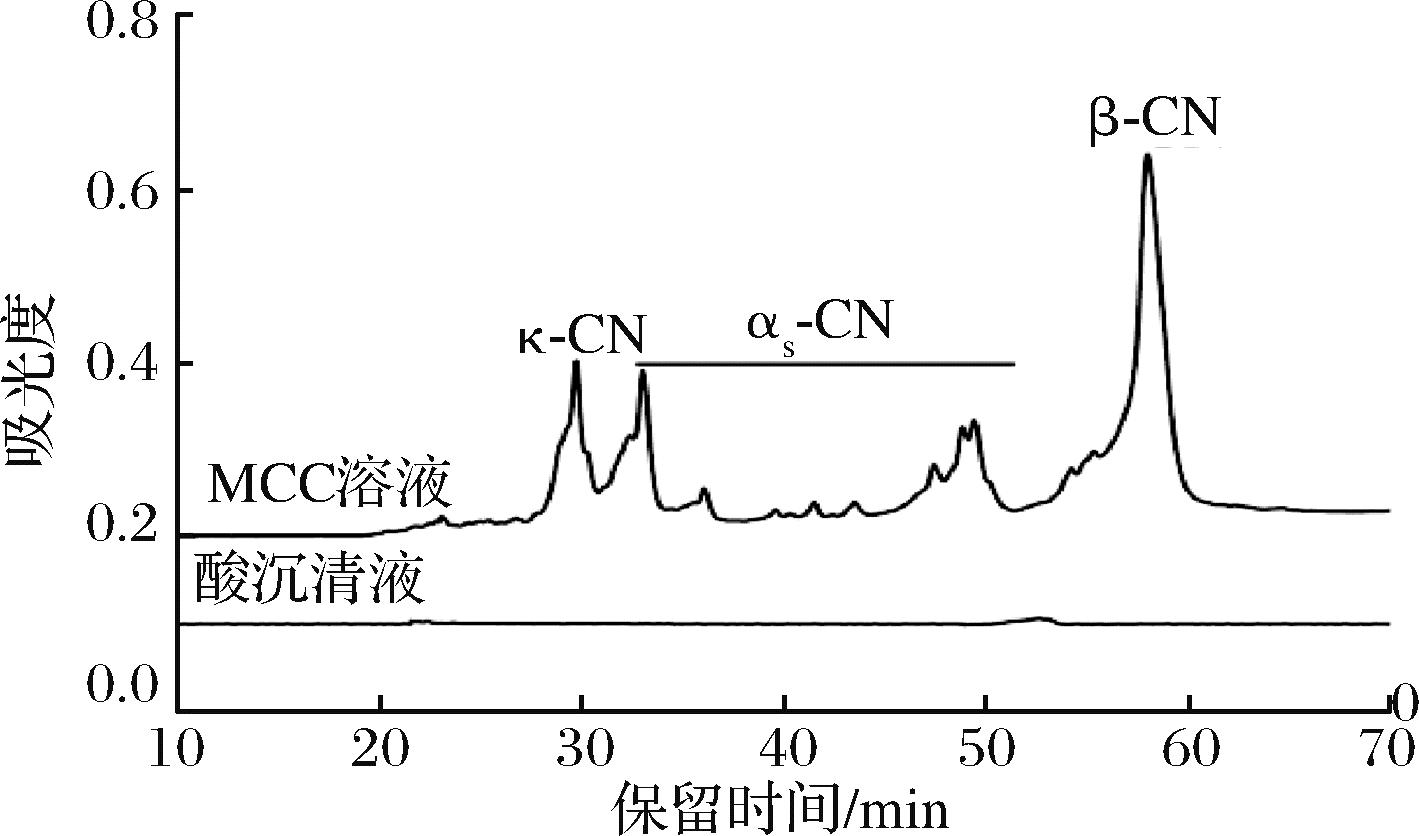
图1 羊乳MCC中酪蛋白亚组分和pH 4.3酸沉淀后 上清液的反相高效液相色谱检测图谱
Fig.1 RP-HPLC chromatogram of casein subfractions in caprine MCC and the pH 4.3 soluble fraction of the MCC dispersion
2.2 五种酪蛋白样品中亚组分配比
5种酪蛋白样品的反相高效液相色谱图如图2所示。采用Empower软件对色谱积分计算各样品中酪蛋白亚组分配比,其结果如表1所示。在κ-酪蛋白富集物中,κ亚组分的占比达66.8%;在β-酪蛋白富集物中,β亚组分占比达88.4%;在αs-酪蛋白富集物中,αs亚组分的占比达60%。在复配酪蛋白中,κ、β和αs亚组分的配比为19.6∶69.3∶11.1;在全酪蛋白中,κ、β和αs亚组分的配比为15.4∶48.5∶35.1。相较于全酪蛋白,复配酪蛋白中κ和β亚组分的占比显著提高,与母乳酪蛋白中κ和β亚组分的配比相同[3]。
表1 五种酪蛋白样品中亚组分配比
单位:%
Table 1 Subfraction ratios of five casein samples
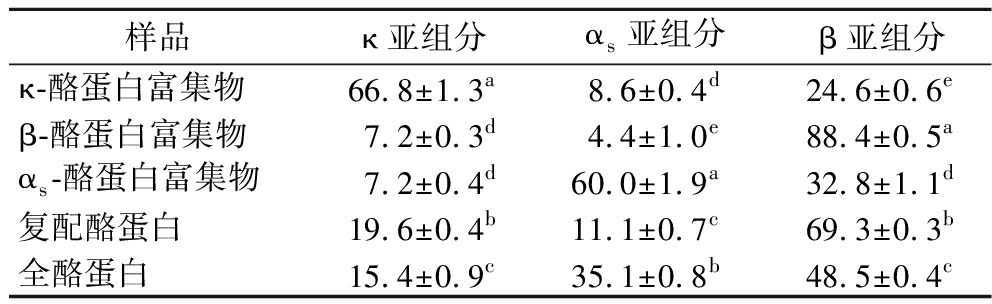
样品κ亚组分αs亚组分β亚组分κ-酪蛋白富集物66.8±1.3a8.6±0.4d24.6±0.6eβ-酪蛋白富集物7.2±0.3d4.4±1.0e88.4±0.5aαs-酪蛋白富集物7.2±0.4d60.0±1.9a32.8±1.1d复配酪蛋白19.6±0.4b11.1±0.7c69.3±0.3b全酪蛋白15.4±0.9c35.1±0.8b48.5±0.4c
注:同一列中小写字母不同表示对应数据之间差异性显著(P<0.05)。

a-κ、β、αs酪蛋白富集物;b-复配酪蛋白、全酪蛋白
图2 五种酪蛋白样品的反相高效液相色谱检测图谱
Fig.2 RP-HPLC chromatogram of five casein samples
2.3 五种酪蛋白样品胃消化物中凝块的微观结构
5种酪蛋白样品在婴幼儿体外模拟胃消化过程中,形成凝块的微观结构如图3所示。5种酪蛋白样品均形成凝块,且随消化的进行凝块均逐渐变小。对于κ-酪蛋白富集物、β-酪蛋白富集物和αs-酪蛋白富集物,前2种样品在胃消化过程中均形成小而松散的凝块,且两者凝块的大小相近,而后者的凝块颗粒尺寸大,较为致密。相比于形成凝块较大的全酪蛋白,复配酪蛋白的絮凝程度低,形成的凝块略小,在20 min后其颗粒尺寸的大小接近κ-酪蛋白富集物和β-酪蛋白富集物形成的凝块。

图3 五种酪蛋白样品胃消化物的CLSM图
Fig.3 CLSM micrographs of the gastric digests from five casein samples
5种酪蛋白样品胃消化物中凝块的持水量如图4所示。持水量的多少反映了絮凝结构的松散程度,持水量高的凝块具有质软疏松的结构。κ-酪蛋白富集物和β-酪蛋白富集物形成的凝块中持水量几乎相同,显著高于αs-酪蛋白富集物形成凝块的持水量。复配酪蛋白形成的凝块持水量显著高于全酪蛋白。5种酪蛋白样品形成的凝块中持水量排序为αs-酪蛋白富集物<全酪蛋白<复配酪蛋白<β-酪蛋白富集物<κ-酪蛋白富集物。
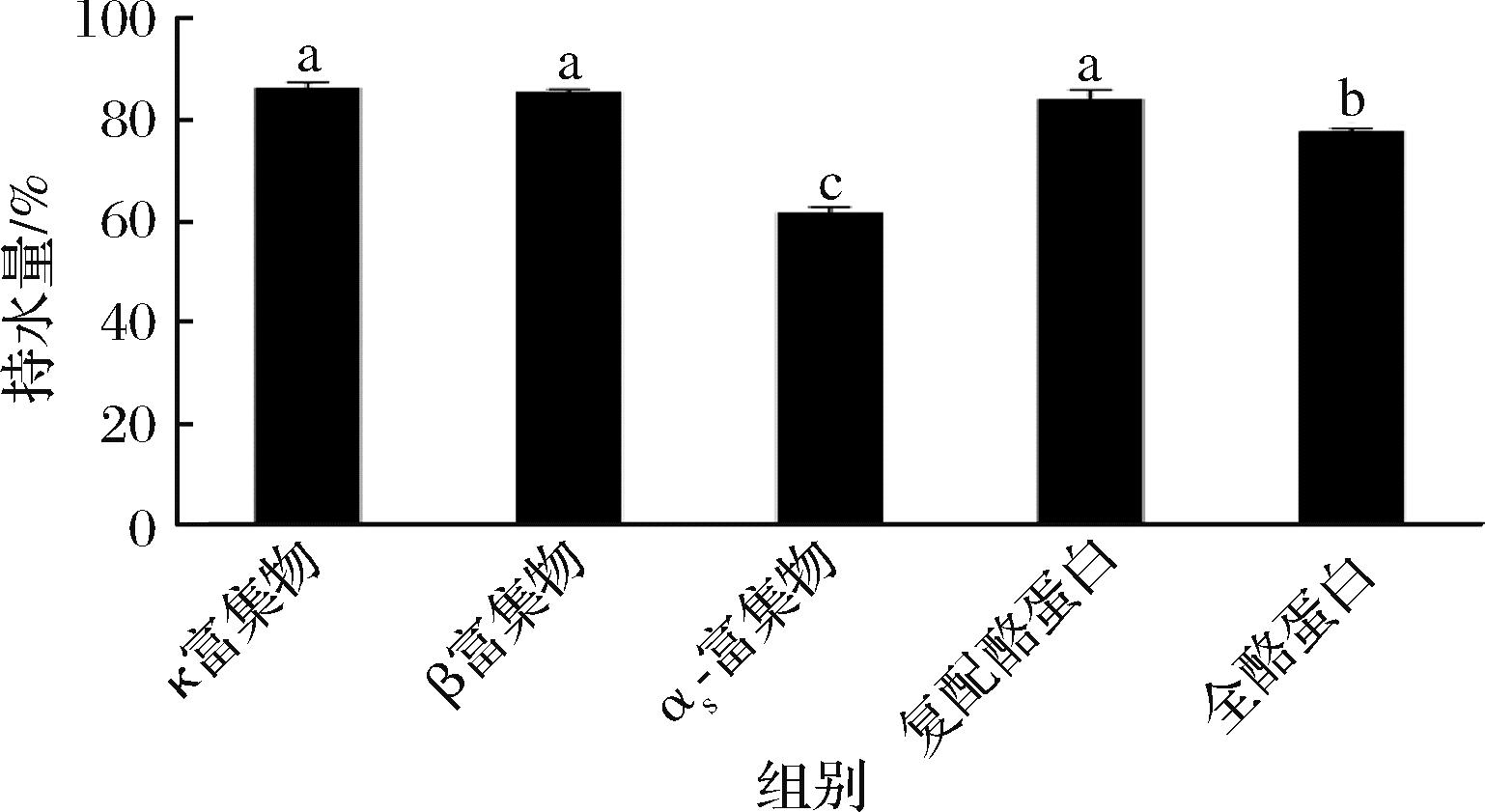
图4 五种酪蛋白样品胃消化物中凝块的持水量
Fig.4 The weight of clot moisture in gastric digests from five casein samples
注:图中不同小写字母表示显著性差异(P<0.05)。
5种酪蛋白样品在胃消化过程中,形成的凝块大小在很大程度上会受到蛋白组成的影响。在婴幼儿体外模拟胃消化的条件下,使用的pH接近酪蛋白亚组分的等电点[16],使得酪蛋白分子所带净电荷减少,形成凝块。β亚组分占比的提高有助形成小而疏松的胃凝块。ZHANG等[7]在婴幼儿体外模拟不同酪蛋白成分婴儿配方粉的胃消化性,结果发现随着酪蛋白成分中β亚组分含量的增加,婴儿配方粉的胃凝块颗粒逐渐减少。综述,相比于αs-酪蛋白富集物,β-酪蛋白富集物和κ-酪蛋白富集物的胃凝块颗粒尺寸小。相比于全酪蛋白,复配酪蛋白在胃消化过程中形成凝块的尺寸小且结构松散。
2.4 五种酪蛋白样品胃消化物中蛋白的残留率
在婴幼儿体外模拟胃消化过程中,5种酪蛋白样品在胃蛋白酶作用下蛋白的降解和残留率如图5所示。在整个胃消化期间,样品中的蛋白被逐步降解,酪蛋白条带均逐渐变浅,蛋白条带下方出现多个新条带,且随着消化的进行条带逐渐向下迁移。κ-酪蛋白富集物和β-酪蛋白富集物在胃消化前2 min内,蛋白残留率下降迅速,随后缓慢降低,对应的蛋白条带分别在60、20 min完全消失,而αs-酪蛋白富集物在整个胃消化过程中,蛋白残留率的降低速率平缓,对应的蛋白条带直到胃消化60 min结束时仍有残留,蛋白残留率约5%,此结果与REN等[17]报道的αs-酪蛋白条带较稳定,胃消化60 min时仍有残留相一致。对于复配酪蛋白和全酪蛋白,对应的蛋白残留率逐渐下降,分别在30、60 min条带完全消失。复配酪蛋白在胃消化前10 min内蛋白残留率的下降速率快,随后下降速率减慢。5种酪蛋白样品随胃消化的进行,蛋白的降解速率整体趋势为:αs-酪蛋白富集物<全酪蛋白<复配酪蛋白<κ-酪蛋白富集物<β-酪蛋白富集物。
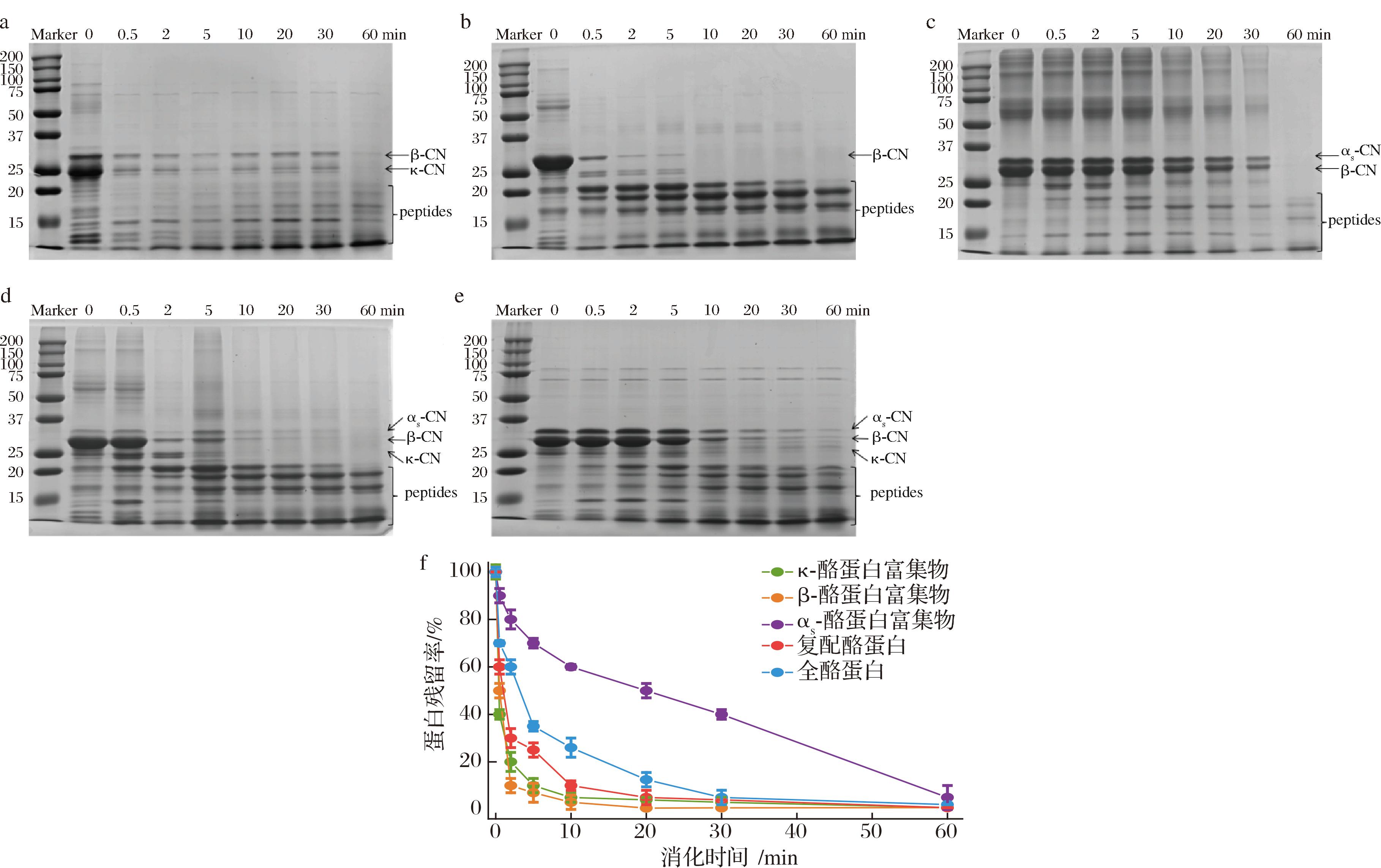
a-κ-酪蛋白富集物;b-β-酪蛋白富集物;c-αs-酪蛋白富集物;d-复配酪蛋白;e-全酪蛋白;f-蛋白残留率
图5 五种酪蛋白样品胃消化物的SDS-PAGE图及蛋白残留率
Fig.5 SDS-PAGE diagram and protein residue rate of gastric digests of five casein samples
注:κ-CN为κ-酪蛋白;β-CN为β-酪蛋白;αs-CN为αs-酪蛋白;peptides为肽。
胃消化过程中,形成凝块结构的大小和松散程度会对蛋白的降解产生影响。凝块颗粒的大小是决定样品中酪蛋白降解的关键因素,如果形成大颗粒且致密,颗粒比表面积低,消化酶通过颗粒的扩散将成为限速步骤,由此酪蛋白降解缓慢[18]。ZOU等[19]研究发现在婴儿胃消化条件下,牛乳胶束在消化过程中形成密集而坚硬的凝块,而人乳在胃肠道过程中没有明显的蛋白质聚集,后者更容易消化和水解。母乳中蛋白降解速率快,这与婴幼儿胃中形成的质软、细腻和松散的凝乳特性相关[20-21]。WANG等[22]也报道在婴幼儿胃消化过程中,随着脱钙率的提高,胃凝块的颗粒逐渐变小,结构逐渐疏松,增加了胃蛋白酶对酪蛋白肽键的可及性,样品的酪蛋白降解率得到显著提高。在αs-酪蛋白富集物和全酪蛋白中,絮凝程度高,形成的凝块颗粒尺寸大且较为致密,由此蛋白降解的速率较低。相较于全酪蛋白,复配酪蛋白在胃消化过程中形成的凝块小而松散,蛋白降解速率快。
2.5 五种酪蛋白样品胃消化物中蛋白的水解度
5种酪蛋白样品在婴幼儿体外模拟胃消化过程中产生的游离氨基含量如图6-a所示。随着时间的延长,5种酪蛋白样品释放的游离氨基的含量均逐渐增加,表明蛋白质水解程度不断提高。对于κ-酪蛋白富集物、β-酪蛋白富集物和αs-酪蛋白富集物,前两者的游离氨基含量在胃消化0~60 min内快速增加,而αs-酪蛋白富集物的游离氨基含量增加缓慢。复配酪蛋白在胃消化过程中产生的游离氨基含量显著高于全酪蛋白,且增加速率较快,而全酪蛋白的增加速率较缓慢。胃消化结束时,游离氨基含量依次为:αs-酪蛋白富集物<全酪蛋白<复配酪蛋白<κ-酪蛋白富集物<β-酪蛋白富集物。上述结果与蛋白的残留率结果相对应。
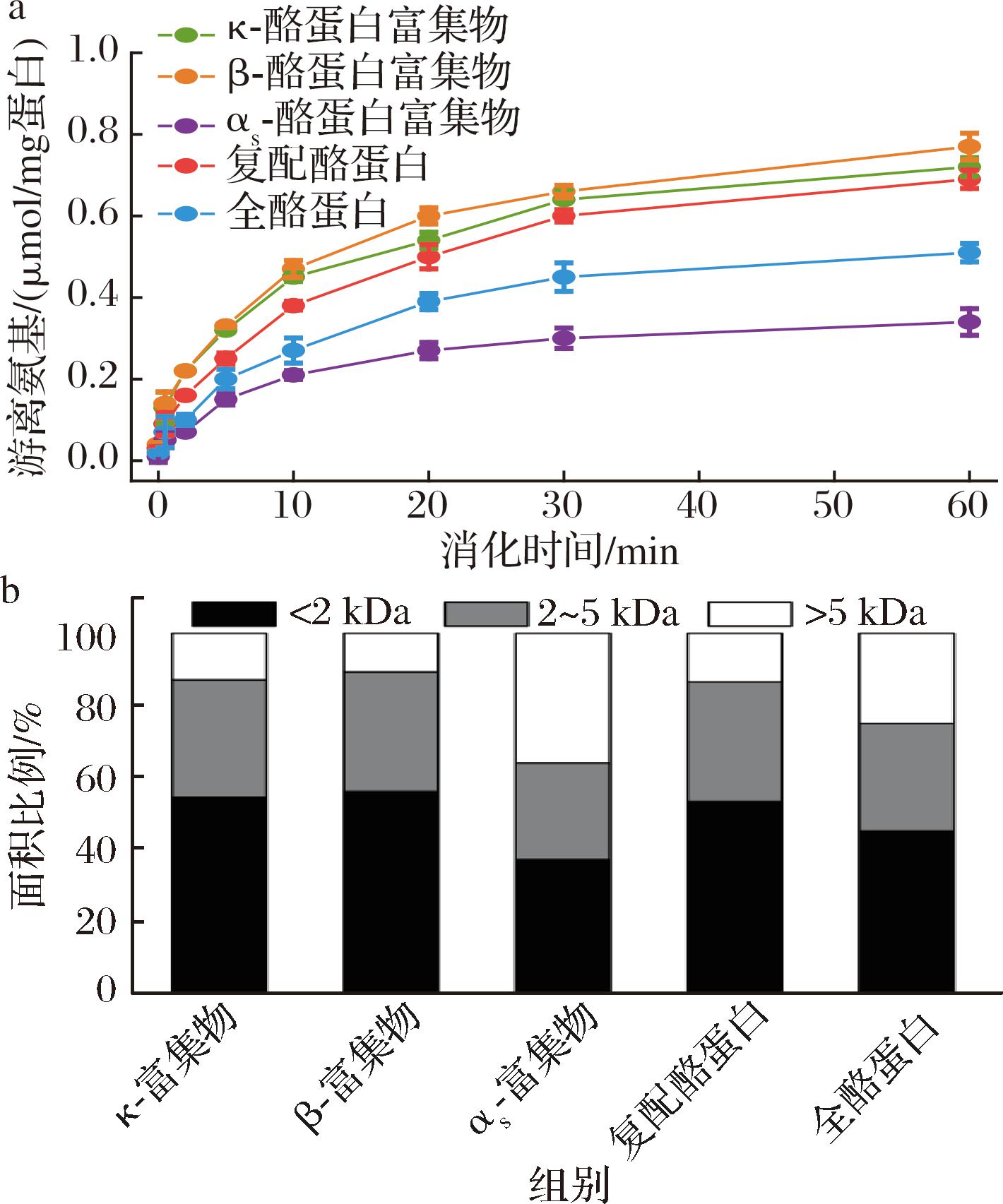
a-游离氨基含量;b-多肽分子质量分布
图6 五种酪蛋白样品胃消化物中游离氨基 含量及多肽分子质量分布
Fig.6 Free amino group contents and molecular weight distribution of polypeptides in gastric digests of five casein samples
5种酪蛋白样品胃消化物中的多肽分子质量分布如图6-b所示。5种酪蛋白样品的多肽分子质量分布差异均主要体现在<2 kDa和>5 kDa区间。αs-酪蛋白富集物消化物中,相对分子质量小于2 kDa和大于5 kDa占比均为三分之一。相比之下,κ-酪蛋白富集物和β-酪蛋白富集物的消化物中相对分子质量小于2 kDa的面积占比均达到50%~55%,而分子质量大于5 kDa的占比仅为10%~14%。相比于全酪蛋白,复配酪蛋白胃消化物中的的多肽分子质量分布与κ-酪蛋白富集物的相似,其中小于2 kDa的肽段多于全酪蛋白,大于5 kDa的肽段少于全酪蛋白。
在胃消化过程中,随着时间的推移,蛋白水解会产生更多的游离氨基和小分子的肽段。有研究比较了婴儿配方奶粉和母乳在胃消化过程中蛋白水解动力学,发现随蛋白的水解度增加,将释放出更多的小肽[23]。YANG等[3]也报道不同样品在胃消化过程中蛋白水解产生游离氨基的含量逐渐增加,释放出更多的小分子肽段。相比β-酪蛋白,κ-酪蛋白糖基化蛋白,不利于胃蛋白酶水解[24],使得κ-酪蛋白富集物的蛋白水解程度略低于β-酪蛋白富集物。
2.6 五种酪蛋白样品肠消化物中蛋白的水解度
5种酪蛋白样品在婴幼儿体外模拟肠消化过程中产生的游离氨基含量如图7-a所示。与胃消化终点相比,随着消化时间的推移,5种酪蛋白样品游离氨基含量均逐渐增加。肠消化开始时游离氨基的含量仍大致为:αs-酪蛋白富集物<全酪蛋白<复配酪蛋白<κ-酪蛋白富集物<β-酪蛋白富集物。随着时间的推移,κ-酪蛋白富集物和β-酪蛋白富集物以及复配酪蛋白之间游离氨基含量的差异逐渐减小,到最后基本无差异。与κ-酪蛋白富集物和β-酪蛋白富集物相比,αs-酪蛋白富集物的肠消化物中游离氨基含量显著较低。复配酪蛋白的肠消化物中游离氨基含量较高于全酪蛋白。
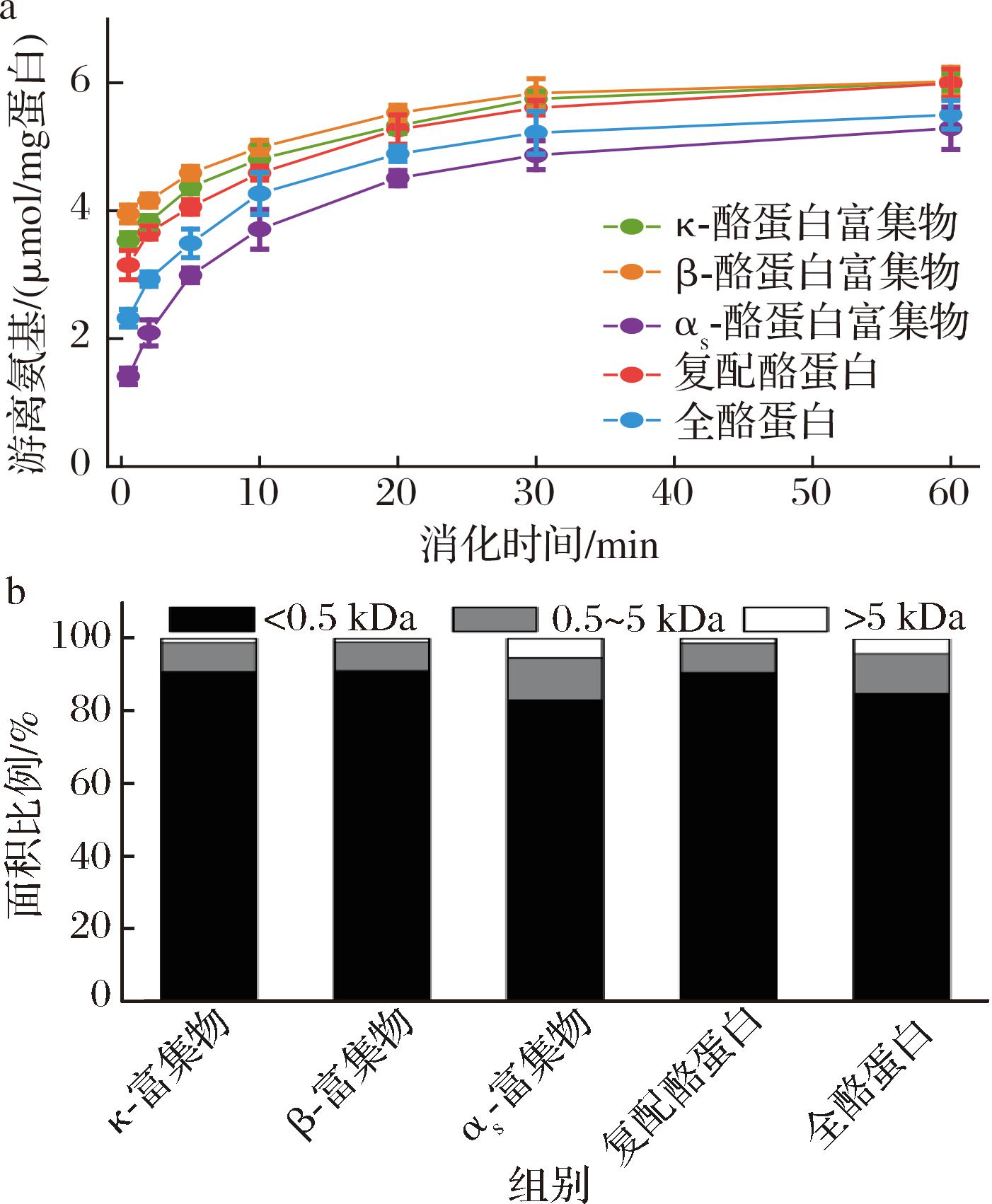
a-游离氨基含量;b-多肽分子质量分布
图7 五种酪蛋白样品肠消化物中游离氨基含量及 多肽分子质量分布
Fig.7 Free amino group contents and molecular weight distribution of polypeptides in intestinal digests of five casein samples
5种酪蛋白样品肠消化物中的多肽分子质量分布如图7-b所示。肠消化60 min结束时,5种酪蛋白样品消化物中的多肽分子质量分布小于0.5 kDa的占比均最大。κ-酪蛋白富集物和β-酪蛋白富集物的肠消化物中几乎不含有大于5 kDa的肽段,而αs-酪蛋白富集物中占比较高。对于复配酪蛋和全酪蛋白,全酪蛋白肠消化物中小于0.5 kDa的肽段占比少于复配酪蛋白。
在肠消化阶段,pH的升高引起分子间的静电斥力的增加,胃消化剩余的凝块会逐渐溶解,导致胰蛋白酶对肽键的可及性增加,从而加速蛋白的水解[25-26]。由于在模拟婴幼儿肠消化条件下,胰蛋白酶的添加水平较低,在最初的30 min内,5种酪蛋白样品之间的蛋白水解差异仍然存在,肠消化结束时,复配酪蛋白的蛋白水解度更接近κ-酪蛋白富集物和β-酪蛋白富集物,高于全酪蛋白。WANG等[22]也报道了不同矿化程度的牛乳酪蛋白胶束,蛋白水解的差异在胃消化过程中逐渐增加,随后在肠消化过程中逐渐减小。
3 结论
本研究利用选择性沉淀技术从羊乳MCC中分离制备了κ亚组分占比66.8%的富集物、β亚组分占比88.4%的富集物和αs亚组分占比60.0%的富集物,并按照母乳酪蛋白亚组分配比进行复配,最终得到含有19.6%κ亚组分和69.3%β亚组分的复配酪蛋白。以羊乳全酪蛋白为对照,进行体外婴幼儿模拟胃肠消化性研究。与αs-酪蛋白富集物相比,κ-酪蛋白富集和β-酪蛋白富集物在胃消化过程中均形成小而松散的凝块,有利于蛋白的降解并产生更多的游离氨基和小分子肽段;与全酪蛋白相比,复配酪蛋白在胃消化过程中形成颗粒尺寸更小、结构更质软松散的凝块,在蛋白降解、游离氨基和小肽的形成方面速率快。在肠消化过程中,复配酪蛋白产生更多的游离氨基和小分子的肽段。κ-酪蛋白富集物和β-酪蛋白富集物的消化性优于αs-酪蛋白富集物,按照母乳酪蛋白亚组分配比调控的复配酪蛋白的消化性优于全酪蛋白。本研究为羊乳基婴幼儿配方奶粉的开发提供依据。
[1] ZHANG K, ZHANG L N, ZHOU R Y, et al.Cow’s milk αS1-casein is more sensitizing than goat’s milk αS1-casein in a mouse model[J].Food &Function, 2022, 13(12):6 484-6 497.
[2] ROY D, YE A Q, MOUGHAN P J, et al.Composition, structure, and digestive dynamics of milk from different species-a review[J].Frontiers in Nutrition, 2020, 7:577759.
[3] YANG T T, LIU D S, TANG J, et al.Formation of casein micelles simulating human milk casein composition from bovine caseins:Micellar structure and in vitro infant gastrointestinal digestion[J].Food Hydrocolloids, 2024, 149:109610.
[4] MAATHUIS A, HAVENAAR R, HE T, et al.Protein digestion and quality of goat and cow milk infant formula and human milk under simulated infant conditions[J].Journal of Pediatric Gastroenterology and Nutrition, 2017, 65(6):661-666.
[5] JIANG H Y, GALLIER S, FENG L F, et al.Development of the digestive system in early infancy and nutritional management of digestive problems in breastfed and formula-fed infants[J].Food &Function, 2022, 13(3):1062-1077.
[6] HUANG J L, ZHANG L N, LAN H L, et al.How to adjust α-lactalbumin and β-casein ratio in milk protein formula to give a similar digestion pattern to human milk?[J].Journal of Food Composition and Analysis, 2022, 110:104536.
[7] ZHANG J P, DU X Y, JIANG S L, et al.Formulation of infant formula with different casein fractions and their effects on physical properties and digestion characteristics[J].Food &Function, 2022, 13(2):769-780.
[8] 罗桂心. 山羊乳酪蛋白组分的分离及消化性研究[D].无锡:江南大学, 2023.LUO G X.Study on separation and digestibility of goat cheese protein components[D].Wuxi:Jiangnan University, 2023.
[9] MÉNARD O, BOURLIEU C, DE OLIVEIRA S C, et al.A first step towards a consensus static in vitro model for simulating full-term infant digestion[J].Food Chemistry, 2018, 240:338-345.
[10] 张杰龙, 潘丽娜, 彭小雨, 等.4 ℃诱导解离对山羊乳酪蛋白胶束结构的影响[J].食品与发酵工业, 2024, 50(7):131-139.ZHANG J L, PAN L N, PENG X Y, et al.Effect of dissociation induced by 4 ℃ on caprine casein micelle structures[J].Food and Fermentation Industries, 2024, 50(7):131-139.
[11] LIU D S, ZHANG J, WANG L L, et al.Membrane-based fractionation, enzymatic dephosphorylation, and gastrointestinal digestibility of β-casein enriched serum protein ingredients[J].Food Hydrocolloids, 2019, 88:1-12.
[12] YE A Q, LIU W L, CUI J, et al.Coagulation behaviour of milk under gastric digestion:Effect of pasteurization and ultra-high temperature treatment[J].Food Chemistry, 2019, 286:216-225.
[13] BAVARO S L, MAMONE G, PICARIELLO G, et al.Thermal or membrane processing for infant milk formula:Effects on protein digestion and integrity of the intestinal barrier[J].Food Chemistry, 2021, 347:129019.
[14] ZHANG J, LIU D S, XIE Y Q, et al.Gastrointestinal digestibility of micellar casein dispersions:Effects of caprine vs bovine origin, and partial colloidal calcium depletion using in vitro digestion models for the adults and elderly[J].Food Chemistry, 2023, 416:135865.
[15] MOATSOU G, SAMOLADA M, PANAGIOTOU P, et al.Casein fraction of bulk milks from different caprine breeds[J].Food Chemistry, 2004, 87(1):75-81.
[16] O’MAHONY J A, FOX P F.Advanced Daing Chemistry[M].4th ed.Boston, MA:Springer US, 2012:43-85.
[17] REN Q, BOIANI M, HE T, et al.Heating affects protein digestion of skimmed goat milk under simulated infant conditions[J].Food Chemistry, 2023, 402:134261.
[18] HUPPERTZ T, LAMBERS T T.Influence of micellar calcium phosphate on in vitro gastric coagulation and digestion of milk proteins in infant formula model systems[J].International Dairy Journal, 2020, 107:104717.
[19] ZOU Z Z, DULEY J A, COWLEY D M, et al.Digestibility of proteins in camel milk in comparison to bovine and human milk using an in vitro infant gastrointestinal digestion system[J].Food Chemistry, 2022, 374:131704.
[20] NAKAI S, LI-CHAN E.Effect of clotting in stomachs of infants on protein digestibility of milk[J].Food Structure, 1987, 6:8.
[21] PETIT V, FUERER C, HETTIARACHCHI C, et al.In vitro protein digestion of infant formula manufactured with β-casein-enriched whey[J].International Dairy Journal, 2023, 146:105740.
[22] WANG K Y, LIU D S, TAO X M, et al.Decalcification strongly affects in vitro gastrointestinal digestion of bovine casein micelles under infant, adult and elderly conditions[J].Food Hydrocolloids, 2023, 139:108515.
[23] ABRAHAMSE E, THOMASSEN G G M, RENES I B, et al.Gastrointestinal protein hydrolysis kinetics:Opportunities for further infant formula improvement[J].Nutrients, 2022, 14(7):1512.
[24] RAWLINGS N D, BARRETT A J, THOMAS P D, et al.The MEROPS database of proteolytic enzymes, their substrates and inhibitors in 2017 and a comparison with peptidases in the PANTHER database[J].Nucleic Acids Research, 2018, 46(D1):D624-D632.
[25] BOUZERZOUR K, MORGAN F, CUINET I, et al.In vivo digestion of infant formula in piglets:Protein digestion kinetics and release of bioactive peptides[J].British Journal of Nutrition, 2012, 108(12):2105-2114.
[26] HALABI A, CROGUENNEC T, MÉNARD O, et al.Protein structure in model infant milk formulas impacts their kinetics of hydrolysis under in vitro dynamic digestion[J].Food Hydrocolloids, 2022, 126:107368.