银条(Stachys flordana Schuttl.ex Benth.)属于唇形科水苏属多年生草本植物,在河南偃师种植广泛,属于地理标志性产品。银条呈白色,风味独特,口感清脆爽口,富含多糖、氨基酸、矿物质、维生素、膳食纤维等多种营养成分,是药食兼用的名特蔬菜,对于软化血管、改善血液循环等具有独特功效,开发利用价值大[1]。但银条水分含量高,采后呼吸旺盛,无外表皮保护层,易发生褐变、软化、腐烂等现象,给银条的销售、贮藏及加工带来了极大困难[2]。目前银条贮藏保鲜技术主要有低温贮藏、涂膜保鲜贮藏、气调贮藏等,但贮藏过程中易出现低温伤害、涂膜层易破坏、气调贮藏气体成分难以控制等问题,均会降低银条贮藏保鲜效果。因此,开发简便、有效、易操作的保鲜技术提高银条贮藏保鲜效果对于银条产业的发展至关重要。
草酸是一种广泛分布于果蔬体内的小分子有机酸,能调控采后果蔬的多种代谢活动[3],MART NEZ-ESPL
NEZ-ESPL 等[4]发现2 mmol/L草酸能抑制洋蓟呼吸强度降低代谢速率,延缓衰老进程;ZHENG等[5]采用10 mmol/L草酸处理竹笋,延缓木质化过程,保持竹笋食用品质;RAZAVI等[6]采用5 mmol/L草酸处理桃果实,诱导提高其抗氧化能力,延缓衰老;ZHU等[7]采用5 mmol/L草酸处理猕猴桃能增强抗病性,减轻腐烂发生;LI等[8]采用5 mmol/L草酸处理芒果,维持较高能荷水平而降低冷害发生。由此可见,草酸对采后果蔬贮藏保鲜具有较好效果。
等[4]发现2 mmol/L草酸能抑制洋蓟呼吸强度降低代谢速率,延缓衰老进程;ZHENG等[5]采用10 mmol/L草酸处理竹笋,延缓木质化过程,保持竹笋食用品质;RAZAVI等[6]采用5 mmol/L草酸处理桃果实,诱导提高其抗氧化能力,延缓衰老;ZHU等[7]采用5 mmol/L草酸处理猕猴桃能增强抗病性,减轻腐烂发生;LI等[8]采用5 mmol/L草酸处理芒果,维持较高能荷水平而降低冷害发生。由此可见,草酸对采后果蔬贮藏保鲜具有较好效果。
硬度影响采后果蔬质地,对采后果蔬贮藏品质影响较大。细胞壁降解是一个复杂的生理过程,随着果蔬衰老的进行,果蔬细胞壁中原果胶、纤维素等物质在细胞壁降解酶的共同作用下发生水解,导致果蔬细胞壁结构破坏,果蔬硬度下降,品质发生劣变[9-10]。采用褪黑素[9]、水杨酸[11]、赤霉素[12]等处理能减轻采后果蔬细胞壁降解程度而维持果蔬较好贮藏品质。近年来发现,草酸处理对果蔬硬度具有较大影响,能调节果蔬细胞壁代谢而延缓果蔬软化[13]。LI等[8]采用5 mmol/L草酸处理芒果、RETAMAL-SALGADO等[14]采用2 mmol/L草酸处理蓝莓能降低果实硬度下降速率;张琴等[13]采用5 mmol/L草酸处理蜂糖李果实能抑制细胞壁降解酶活力而维持较高硬度。然而,目前草酸处理对采后银条贮藏品质及细胞壁代谢的影响还鲜见研究报道,因此,本试验以“两细一粗”银条为试材,研究草酸处理对银条硬度、失重率、可溶性固形物(soluble solids,SSC)、可滴定酸(titratable acid,TA)、抗坏血酸(维生素C)含量、细胞壁组分、细胞壁降解酶活力等指标的影响,并通过相关性分析和通径分析得到影响银条硬度下降的主要因素,以期为提高银条采后贮藏品质提供理论依据。
1 材料与方法
1.1 材料与试剂
以河南省偃师许庄村“两细一粗”银条为材料,选择表面无褐变、无机械伤、无病原菌感染、无腐烂、粗细均匀的银条备用。
草酸、咔唑、2,6-二氯酚靛酚钠、水杨苷、半乳糖醛酸、果胶、羧甲基纤维素、3,5-二硝基水杨酸、硝基苯-β-D-吡喃半乳糖苷等,上海源叶生物科技有限公司;α-L-阿拉伯呋喃糖苷酶测试盒,上海酶联生物科技有限公司。
1.2 仪器与设备
UV-1800紫外可见分光光度计,日本岛津公司;食品物性分析仪,英国Stable Micro Systemes公司;HWS-300智能恒温恒湿箱,浙江托普云农科技股份有限公司;TGL-20M台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;WYT手持折光仪,成都光学厂。
1.3 实验方法
1.3.1 材料处理
银条采用10 mmol/L草酸溶液(预实验确定最佳浓度)浸泡处理20 min,以蒸馏水处理为对照,室温下(20 ℃)阴干4 h,每筐装0.5 kg银条(外套0.05 mm聚乙烯薄膜,袋不扎口),在85%~90%相对湿度、(10±1) ℃贮藏温度条件下贮藏30 d,实验设置3次重复。
1.3.2 硬度的测定
采用质构仪测定银条硬度[2]。银条形变量设置为70%,测试起始力为10 g,测试速度为10 mm/s,采用2 mm 柱形探头,每根银条测定3次,结果取平均值。
1.3.3 失重率测定
失重率采用党东阳等[2]方法测定。银条样品100 g,测定贮藏前后银条质量,以质量损失占初始质量的百分比表示银条失重率(%)。
1.3.4 SSC、TA和维生素C含量的测定
SSC采用手持折光仪测定,TA含量采用碱液滴定法测定[15],维生素C含量采用2,6-二氯酚靛酚法测定[16]。
1.3.5 原果胶、可溶性果胶和纤维素含量的测定
原果胶和可溶性果胶含量参照LI等[12]方法测定。1 mL原果胶或可溶性果胶加入6 mL浓硫酸和0.2 mL咔唑-乙醇溶液,测定530 nm处吸光度值,以生成半乳糖醛酸占样品质量百分比表示,单位为%。
纤维素含量参照石玲等[17]方法测定。10 g银条样品分别经1.25%硫酸和12.5%氢氧化钠处理后,于105 ℃烘干至恒重,之后550 ℃灰化完全,纤维素含量以残留物质量占银条样品质量的百分比表示(%)。
1.3.6 细胞壁降解酶活性测定
多聚半乳糖醛酸酶(polygalacturonase,PG)活力测定参照宁密密等[18]方法。1 mL乙酸-乙酸钠溶液加入0.5 mL多聚半乳糖醛酸和0.5 mL银条酶液,之后加入1.5 mL 3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS),测定540 nm下吸光度值,以单位时间内催化(37 ℃)多聚半乳糖醛酸水解生成的半乳糖醛酸量表示,酶活力单位为U/(h·g FW)。
果胶甲基酯酶(pectin methylesterase,PME)活力测定参照ZHAO等[19]方法。2 mL 0.5%果胶中加入1 mL银条酶液,用0.01 mol/L NaOH滴定维持pH值为7.2,记录消耗NaOH毫升数,以每克银条样品每小时消耗1 μmol NaOH的酶量表示,酶活力单位为U/(h·g FW)。
β-半乳糖苷酶(β-galactosidase,β-Gal)活力测定参照CAO等[20]方法。1 mL 硝基苯-β-D-吡喃半乳糖苷加入100 μL银条酶液反应后,再加入2 mL 1 mol/L碳酸钠,测定400 nm下吸光度值,以单位时间内产生的对硝基苯酚量表示,酶活力为U/(min·g FW)。
β-葡萄糖苷酶(β-glucosidase,β-Glu)活力测定参照党东阳等[2]方法。1.5 mL水杨苷溶液加入0.5 mL银条酶液,37 ℃保温1 h,加入1.5 mL DNS终止反应,测定540 nm下吸光度值。以每小时每克银条样品在37 ℃下催化水杨苷生成1 μg葡萄糖所需的酶量表示,酶活力单为U/(h·g FW)。
采用试剂盒测定α-L-阿拉伯呋喃糖苷酶(α-L-arabinofuranosidase,α-L-Af)活力,单位为U/(h·g FW)。
采用DNS比色法测定纤维素酶(cellulase,Cx)活力[20]。1.5 mL羧甲基纤维素加入0.5 mL银条酶液和1.5 mL DNS,测定540 nm下吸光度值,以每小时每克银条样品催化(37 ℃)羧甲基纤维素生成的还原糖质量表示,酶活力单位为U/(h·g FW)。
1.4 数据统计分析
数据的统计计算采用Microsoft Excel 2007软件,数据的差异显著性分析采用SPSS 24.0软件,相关曲线的绘制采用Origin 2017软件。
2 结果与分析
2.1 草酸处理对采后银条硬度的影响
由图1可知,10 mmol/L草酸处理和对照组银条的硬度在贮藏前15 d下降较为缓慢,贮藏15~30 d期间下降迅速,草酸处理显著抑制了15~30 d银条硬度的快速下降(P<0.05)。贮藏30 d时10 mmol/L草酸处理组硬度是对照组的1.28倍,分别比第0天降低了27.33%和43.29%,说明10 mmol/L草酸对于抑制银条硬度下降效果显著。
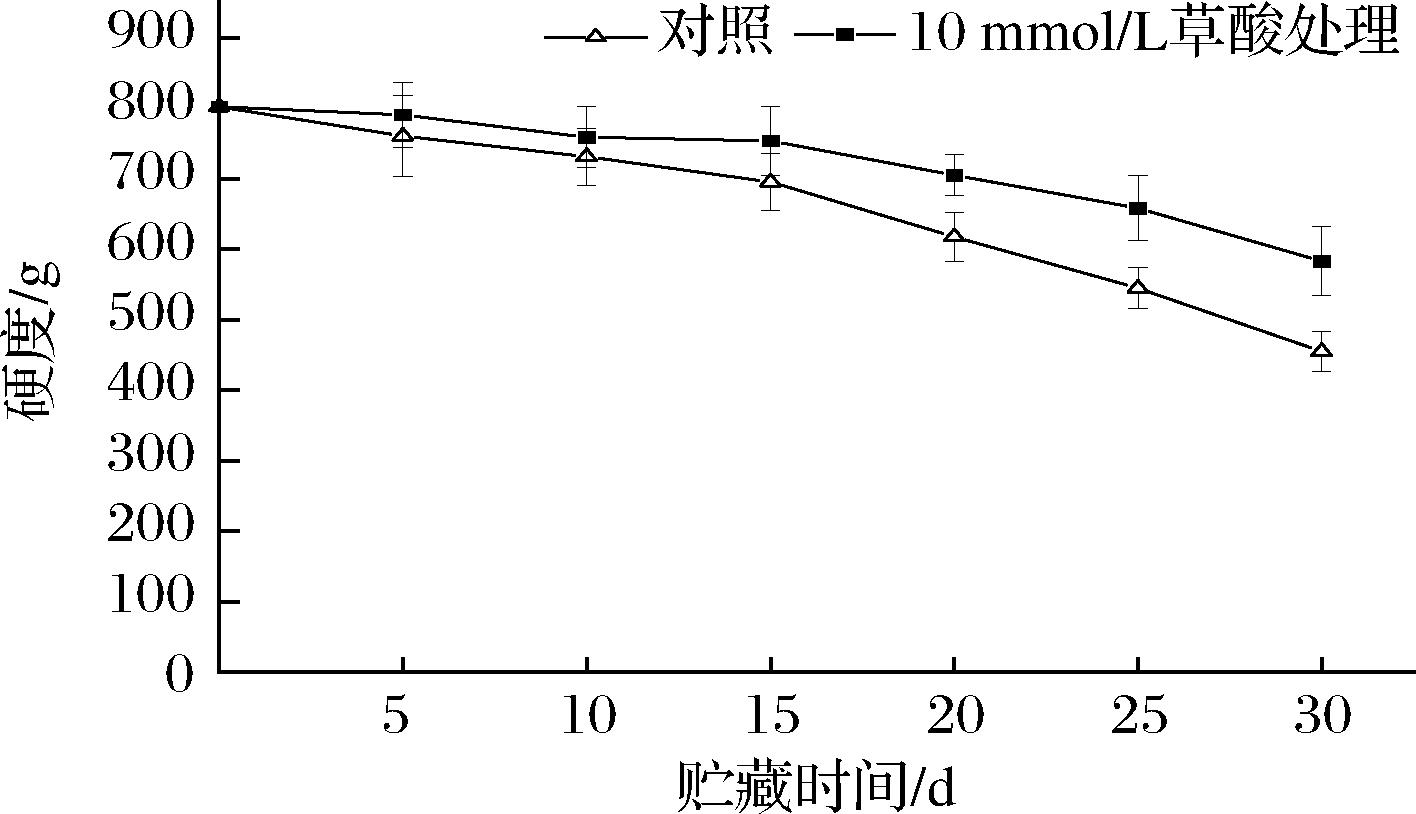
图1 草酸处理对采后银条硬度的影响
Fig.1 Effect of oxalic acid treatment on firmness of postharvest Stachys flordana Schuttl.ex Benth
2.2 草酸处理对采后银条失重率的影响
由图2可知,银条失重率在贮藏前15 d上升较慢,贮藏15 d后急剧升高,贮藏15~30 d对照和10 mmol/L草酸处理组具有显著性差异(P<0.05)。贮藏30 d后,对照银条失重率是草酸处理组的1.29倍,说明10 mmol/L草酸处理能有效控制银条贮藏后期(15~30 d)失水,对于维持银条质地具有重要作用。
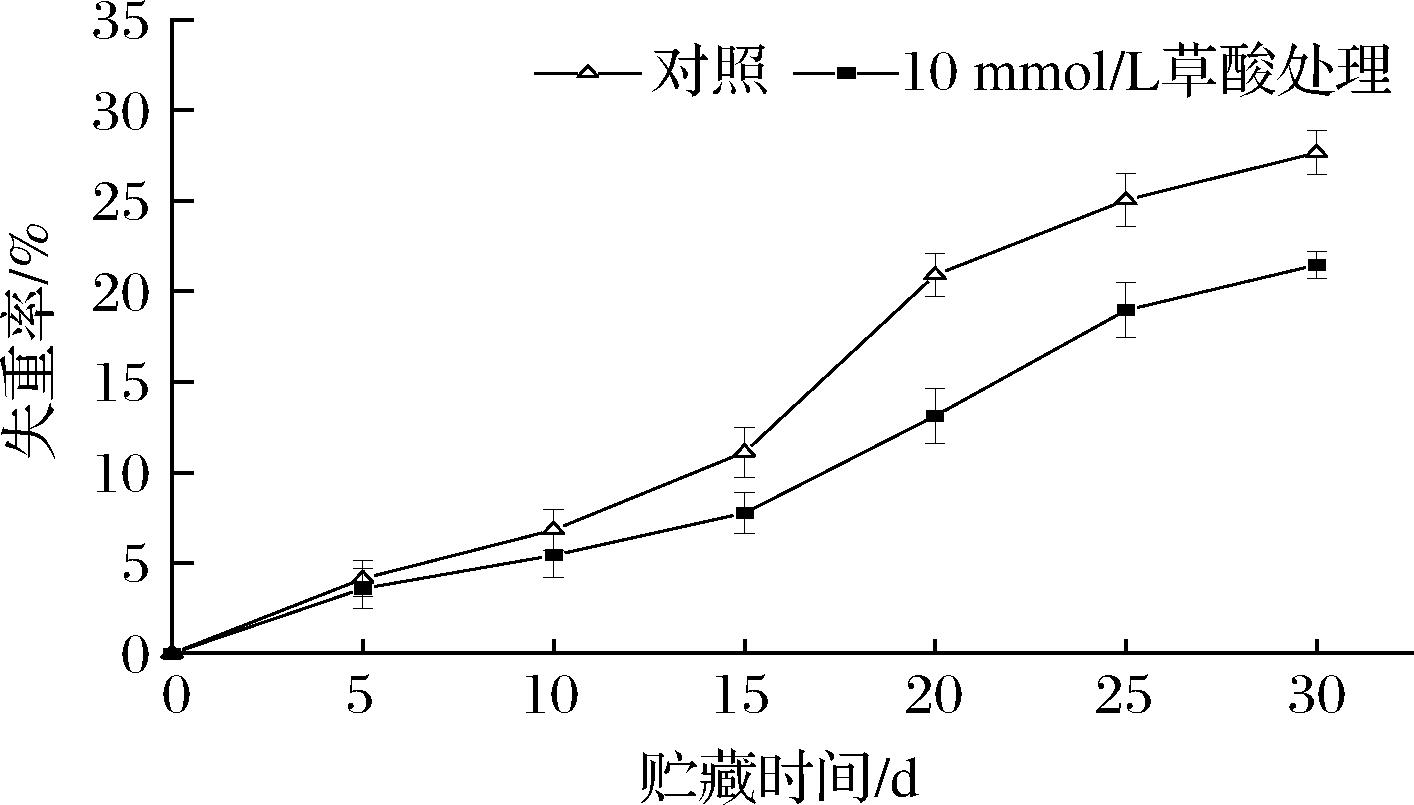
图2 草酸处理对采后银条失重率的影响
Fig.2 Effect of oxalic acid treatment on weight loss ratio of postharvest Stachys flordana Schuttl.ex Benth
2.3 草酸处理对采后银条SSC、TA和维生素C含量的影响
由图3-A可知,银条SSC在贮藏过程中变化较小,且10 mmol/L草酸处理和对照组之间没有显著性差异(P>0.05)。由图3-B和图3-C可知,银条TA和维生素C含量在贮藏前10 d基本维持在较稳定水平,贮藏10 d后银条TA和维生素C含量均急剧下降,贮藏15~30 d草酸处理组TA和维生素C含量均显著高于对照组(P<0.05)。贮藏30 d时,草酸处理组TA和维生素C含量分别是对照组的1.28倍和1.38倍,说明10 mmol/L草酸处理可维持银条贮藏后期较高TA和维生素C含量,保持其营养品质。

A-SSC含量;B-TA含量;C-维生素C含量
图3 草酸处理对采后银条SSC、TA和维生素C含量的影响
Fig.3 Effects of oxalic acid treatment on SSC, TA and vitamin C content of postharvest Stachys flordana Schuttl.ex Benth
2.4 草酸处理对采后银条原果胶、可溶性果胶、纤维素含量的影响
由图4可知,银条原果胶和纤维素含量在贮藏过程中均呈急剧下降趋势,10 mmol/L草酸处理显著抑制了15~30 d银条原果胶和纤维素含量的下降(P<0.05),贮藏30 d时10 mmol/L草酸处理原果胶、纤维素含量分别比对照组提高了39.93%和31.58%,说明10 mmol/L草酸可以维持银条中较高的原果胶和纤维素含量,这是草酸处理组银条硬度较对照组高的主要原因之一。
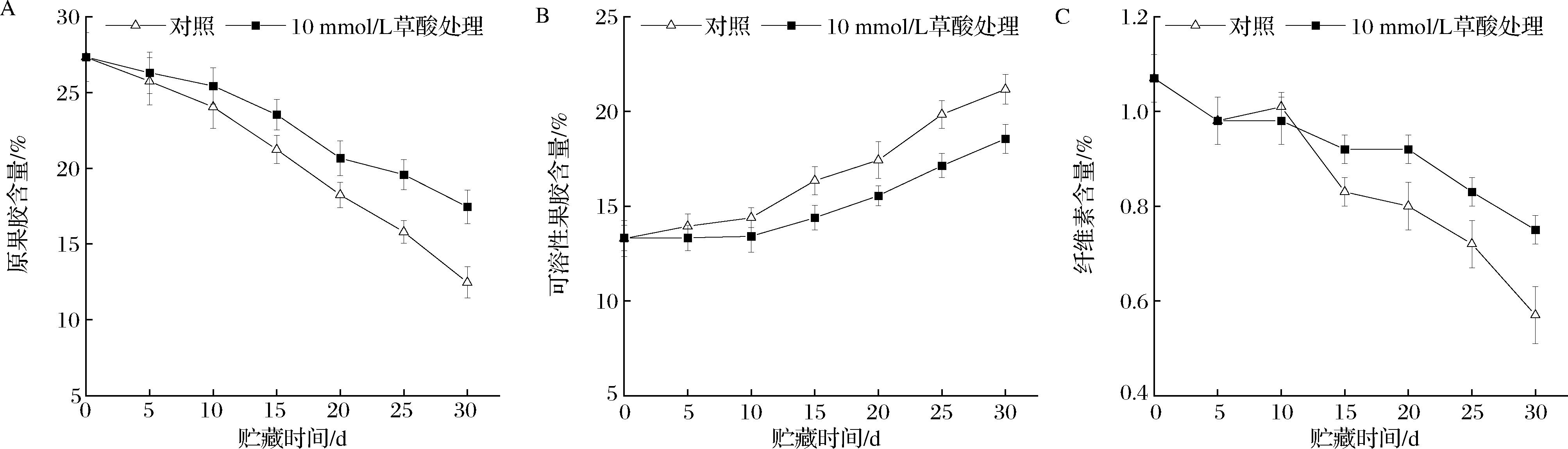
A-原果胶含量;B-可溶性果胶含量;C-纤维素含量
图4 草酸处理对采后银条原果胶、可溶性果胶和纤维素含量的影响
Fig.4 Effects of oxalic acid treatment on original pectin, soluble pectin and cellulose content of postharvest Stachys flordana Schuttl.ex Benth
银条可溶性果胶在贮藏中逐渐积累,在贮藏后期(15~30 d)10 mmol/L草酸处理组显著抑制了其上升速度(P<0.05),贮藏30 d时,10 mmol/L草酸处理组可溶性果胶含量比对照组减少了12.34%,说明10 mmol/L草酸处理能抑制银条可溶性果胶的积累。
2.5 草酸处理对采后银条PG、PME、β-Gal、β-Glu、α-L-Af和Cx活力的影响
由图5-A可知,对照组银条PG活力在前5 d基本不变,贮藏5~15 d急剧增加,第15天时达到高峰,之后活力下降,贮藏25 d后PG活力再次上升,而10 mmol/L草酸处理组PG活力在贮藏前10 d基本保持不变,10~15 d内迅速上升至高峰,之后PG活力基本保持稳定。10 mmol/L草酸处理组和对照组PG活力在贮藏15~30 d具有显著性差异(P<0.05),贮藏30 d时对照组是10 mmol/L草酸处理组的1.77倍,说明草酸抑制PG酶活力显著。
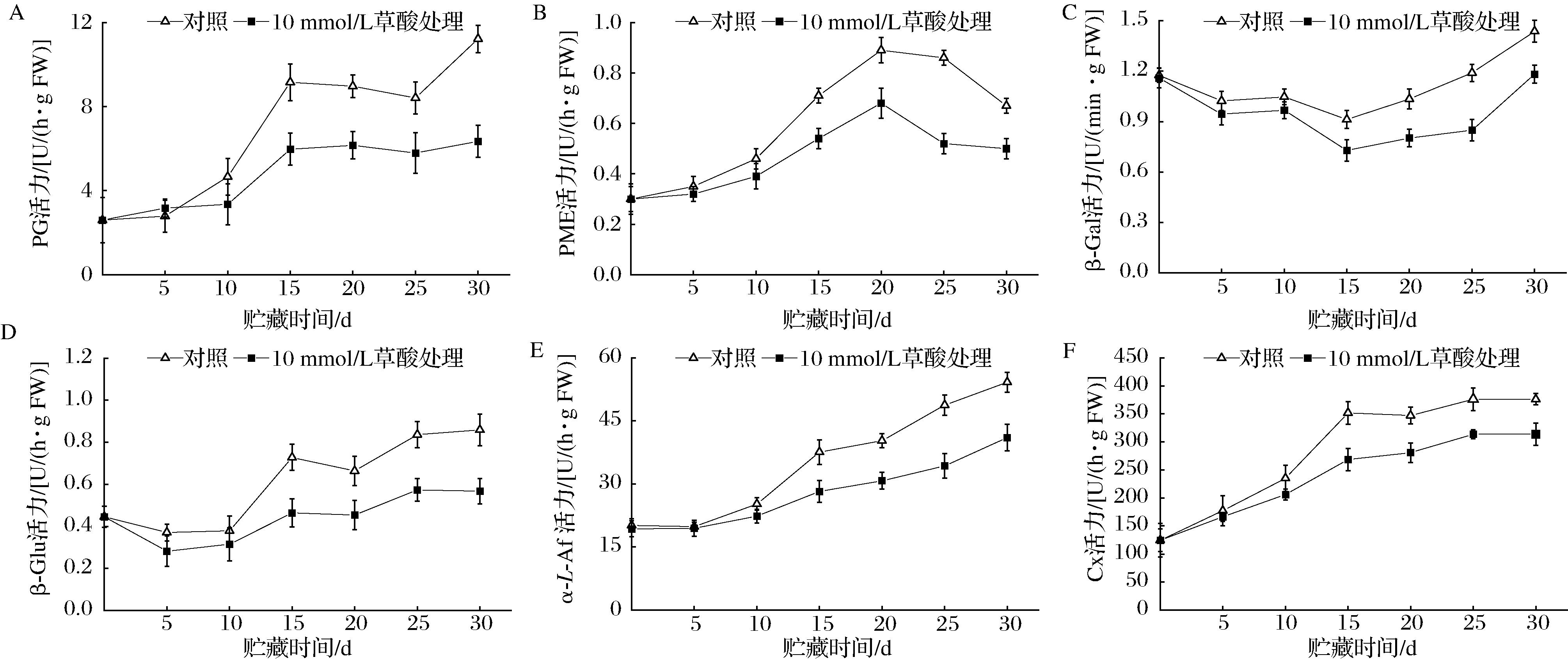
A-PG活力;B-PME活力;C-β-Gal活力;D-β-Glu活力;E-α-L-Af活力;F-Cx活力
图5 草酸处理对采后银条PG、PME、β-Gal、β-Glu、α-L-Af和Cx活性的影响
Fig.5 Effects of oxalic acid treatment on PG, PME, β-Gal, β-Glu, α-L-Af and Cx activities of postharvest Stachys flordana Schuttl.ex Benth
由图5-B可看出,银条PME活力呈先增后降趋势,活力高峰在第20天出现,此时10 mmol/L草酸处理组PME活力比对照降低了23.59%,贮藏20~30 d期间10 mmol/L草酸显著抑制了银条PME活力的下降(P<0.05),说明草酸处理能维持贮藏后期银条较低的PME活力。
由图5-C可知,贮藏前15 d银条β-Gal活力缓慢下降,贮藏第15天达到最低值,之后银条β-Gal活力急剧上升,10 mmol/L草酸处理银条β-Gal活力上升的速度显著较对照组缓慢(P<0.05),贮藏30 d时,对照组β-Gal活力是10 mmol/L草酸处理组的1.22倍,说明草酸能抑制贮藏后期银条β-Gal活力的上升。
图5-D显示,银条β-Glu活力在贮藏前10 d相对稳定,之后波动上升,10 mmol/L草酸处理显著抑制了贮藏15~30 d银条β-Glu活力的增加(P<0.05),贮藏末期10 mmol/L草酸处理β-Glu活力比对照降低了33.92%,表明银条对于抑制贮藏后期银条β-Glu活力效果显著。
由图5-E可知,银条α-L-Af活力在贮藏期间一直呈逐渐增加趋势,贮藏15~30 d草酸处理显著抑制了银条α-L-Af活力上升(P<0.05),贮藏30 d时,10 mmol/L草酸处理组α-L-Af活力比对照组降低了24.28%,表明草酸处理能抑制银条贮藏过程中α-L-Af活力的上升。
由图5-F可知,银条Cx活力在贮藏前15 d急剧上升,第15天时2组银条Cx活力差异最大,对照组Cx活力是草酸处理组的1.20倍,贮藏15~30 d 2组银条Cx活力差异显著(P<0.05),说明草酸处理对于抑制银条Cx活力效果明显。
2.6 相关性分析
表1结果显示,银条各指标与硬度的相关性依次为:可溶性果胶(-0.986)>原果胶(0.984)>α-L-Af(-0.972)>失重率(-0.971)>纤维素(0.968)>PG(-0.873)>Cx(-0.872)>β-Glu(-0.862)>PME(-0.739)>β-Gal(-0.519)。银条硬度与原果胶、纤维素呈极显著正相关(P<0.01),与失重率、可溶性果胶、PG、PME、β-Glu、α-L-Af、Cx呈极显著负相关(P<0.01);原果胶与纤维素呈极显著正相关(P<0.01),与可溶性果胶、PG、PME、β-Glu、α-L-Af、Cx活性呈极显著负相关(P<0.01);可溶性果胶与PG、PME、β-Glu、α-L-Af、Cx活性呈极显著正相关(P<0.01);纤维素与PG、PME、β-Glu、α-L-Af、Cx活力呈极显著负相关(P<0.01),这表明银条硬度下降与细胞壁降解酶及细胞壁组分密切相关。
表1 采后银条硬度与测定指标之间的相关性
Table 1 Pearson correlation between firmness and determination indexes in postharvest Stachys flordana Schuttl.ex Benth

指标硬度失重率SSCTA维生素C原果胶可溶性果胶纤维素PGPMEβ-Galβ-Gluα-L-AfCx硬度1 失重率-0.971∗∗1 SSC0.936∗∗-0.915∗∗1 TA0.982∗∗-0.957∗∗0.909∗∗1 维生素C0.950∗∗-0.982∗∗0.920∗∗0.949∗∗1 原果胶0.984∗∗-0.988∗∗0.921∗∗0.981∗∗0.984∗∗1 可溶性果胶-0.986∗∗0.972∗∗-0.903∗∗-0.966∗∗-0.958∗∗-0.985∗∗1 纤维素0.968∗∗-0.954∗∗0.881∗∗0.965∗∗0.943∗∗0.972∗∗-0.971∗∗1 PG-0.873∗∗0.863∗∗-0.858∗∗-0.916∗∗-0.915∗∗-0.904∗∗0.875∗∗-0.898∗∗1 PME-0.739∗∗0.794∗∗-0.811∗∗-0.765∗∗-0.868∗∗-0.789∗∗0.740∗∗-0.720∗∗0.879∗∗1 β-Gal-0.5190.333-0.450-0.447-0.270-0.3830.486-0.4080.2500.0281 β-Glu-0.862∗∗0.828∗∗-0.833∗∗-0.858∗∗-0.861∗∗-0.861∗∗0.901∗∗-0.860∗∗0.898∗∗0.787∗∗0.4581 α-L-Af-0.972∗∗0.960∗∗-0.905∗∗-0.979∗∗-0.967∗∗-0.982∗∗0.983∗∗-0.969∗∗0.938∗∗0.816∗∗0.4220.930∗∗1 Cx-0.872∗∗0.920∗∗-0.819∗∗-0.904∗∗-0.946∗∗-0.923∗∗0.886∗∗-0.899∗∗0.941∗∗0.896∗∗0.0950.837∗∗0.931∗∗1
注:*代表差异显著,P<0.05;**代表差异极显著,P<0.01。
2.7 银条硬度、细胞壁组分及降解酶活性之间的通径分析
采用通径分析可明确细胞壁代谢各指标对银条硬度影响的直接和间接作用,结果如表2所示。影响银条硬度的主要指标有原果胶、可溶性果胶、纤维素、PME、α-L-Af和Cx,通径分析中决定系数R2为0.996 58,剩余通径系数为0.032 42,表明上述指标决定了银条硬度变异的99.658%,由其他因素和试验误差引起的变异只占3.242%,说明已将影响银条硬度的主要因素考虑在内,模型分析结果可信。
表2 采后银条硬度与测定指标的通径分析
Table 2 Path analysis between firmness and determination indexes of postharvest Stachys flordana Schuttl.ex Benth
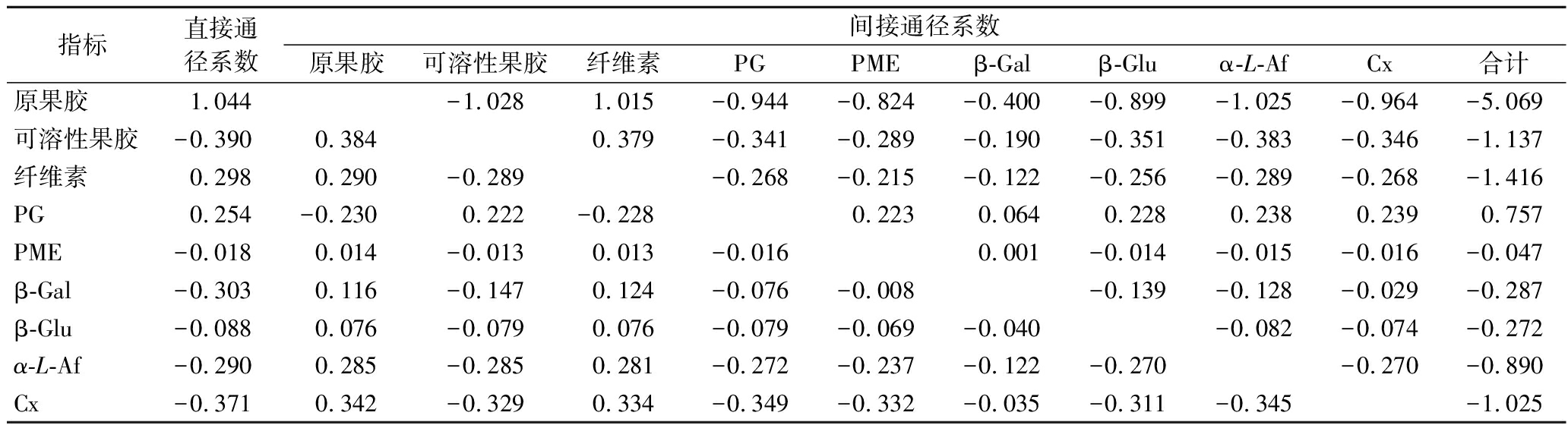
指标直接通径系数间接通径系数原果胶可溶性果胶纤维素PGPMEβ-Galβ-Gluα-L-AfCx合计原果胶1.044-1.028 1.015 -0.944 -0.824 -0.400 -0.899 -1.025 -0.964 -5.069 可溶性果胶-0.3900.384 0.379 -0.341 -0.289 -0.190 -0.351 -0.383 -0.346 -1.137纤维素0.2980.290 -0.289 -0.268-0.215 -0.122 -0.256 -0.289 -0.268 -1.416PG0.254-0.230 0.222 -0.228 0.223 0.064 0.228 0.238 0.239 0.757 PME-0.0180.014 -0.013 0.013 -0.016 0.001 -0.014 -0.015 -0.016 -0.047 β-Gal-0.3030.116 -0.147 0.124 -0.076 -0.008 -0.139 -0.128 -0.029 -0.287 β-Glu-0.0880.076 -0.079 0.076 -0.079 -0.069 -0.040 -0.082 -0.074 -0.272 α-L-Af-0.2900.285 -0.285 0.281 -0.272 -0.237 -0.122 -0.270 -0.270 -0.890 Cx-0.3710.342 -0.329 0.334 -0.349 -0.332 -0.035 -0.311 -0.345 -1.025
注:决定系数R2=0.996 58,剩余通径系数=0.032 42。
3 讨论
SSC、TA、维生素C含量能反映采后果蔬的营养品质,硬度能反映果蔬质地情况,与果蔬贮藏品质密切相关。本研究结果发现,10 mmol/L草酸处理能有效抑制银条TA、维生素C含量、硬度的下降及失重率的上升,对银条SSC含量的影响不大,10 mmol/L草酸能维持银条较好贮藏品质。这与草酸处理蓝莓[14]、竹笋等[5]研究结果一致。
果蔬硬度与果蔬细胞壁组分降解密切相关,原果胶、可溶性果胶、纤维素含量对果蔬硬度的维持起着关键作用[11,21]。延缓果蔬原果胶和纤维素等含量下降能维持较高硬度,提高果蔬贮藏品质[9,12]。果胶类物质能在果蔬细胞间起到黏合联结作用,随着果蔬成熟软化,原果胶降解使果蔬细胞松散,硬度降低[22]。纤维素对于果蔬细胞壁骨架起到支撑作用,纤维素降解会导致果蔬细胞壁变薄,硬度下降[22]。本研究结果发现,银条贮藏15 d后硬度快速下降,伴随着银条原果胶、纤维素含量的急剧下降以及可溶性果胶含量的快速上升,相关性分析表明银条原果胶、纤维素与硬度呈极显著正相关(相关系数分别为0.984、0.968),可溶性果胶含量与银条硬度呈极显著负相关(-0.986),表明银条硬度的维持与原果胶、可溶性果胶、纤维素含量密切相关,这与LIU等[23]采用钙处理杏、MI等[24]采用冷激处理辣椒的研究结果类似。贮藏15~30 d,10 mmol/L草酸处理能维持银条组较高的原果胶和纤维素含量及较低的可溶性果胶含量,这是草酸维持银条较高硬度的主要原因,本研究结果与张琴等[13]采用草酸处理蜂糖李果实的研究结论一致。
果蔬细胞壁组分(原果胶、纤维素等)在细胞壁降解酶作用下发生水解,破坏细胞壁结构,导致果蔬硬度下降[21,25-26]。PG主要水解果蔬细胞壁中多聚半乳糖醛酸而导致果蔬质地软化[2]。PME能降低果蔬中果胶甲酯化程度,产生水溶性果胶酸,为PG提供水解底物[15]。β-Glu能改变果蔬果胶分子相互作用,破坏细胞壁结构的完整性[15]。本研究结果显示,10 mmol/L草酸能抑制贮藏后期银条体内多种细胞壁降解酶活力而延缓原果胶降解,保持银条较高硬度,这与CAO等[20]、YAN等[27]研究苹果、覆盆子的结果类似。银条PG、PME、β-Glu活力高峰出现的时间与银条硬度快速下降的时间大体一致,且银条PG、PME、β-Glu均与硬度呈极显著负相关(P<0.01),说明银条PG、PME、β-Glu对银条软化的贡献较大,是引起银条硬度下降的关键酶。β-Gal能降解细胞壁多糖组分,水解具有支链的多聚半乳糖醛酸[18]。10 mmol/L草酸显著抑制了银条β-Gal活力上升,但它与硬度之间没有显著相关性(P>0.05),推测银条β-Gal对银条硬度下降的贡献较小,不是引起银条硬度下降的主要酶类,这与宁密密等[18]研究结果类似。α-L-Af主要作用于细胞壁支链中阿拉伯糖苷残基,促进果胶物质降解[13,19]。本研究发现10 mmol/L草酸显著抑制了银条贮藏10 d后α-L-Af活力的增加,且α-L-Af与银条硬度呈极显著负相关(P<0.01),说明α-L-Af对银条硬度也有显著影响,这与张琴等[13]采用草酸处理蜂糖李的结果类似。Cx能分解纤维素而破坏细胞壁结构,减缓果蔬软化[28-29]。本研究中,银条Cx活力在贮藏后期一直维持在较高水平,导致纤维素降解加剧,相关性分析显示Cx和纤维素的相关性达到-0.899,说明Cx活力增加也会导致银条硬度降低。10 mmol/L草酸能显著抑制银条Cx活力上升,减轻纤维素降解,从而维持银条较高硬度,CHEN等[30]在研究柚子时也有类似结果。
通径分析可明确细胞壁降解各指标对银条硬度的作用,表2中直接通径系数显示各因素对银条硬度影响的大小顺序为:原果胶(1.044)>可溶性果胶(-0.390)>Cx(-0.371)>β-Gal(-0.303)>纤维素(0.298)>α-L-Af(-0.290)>PG(0.254)>β-Glu(-0.088)>PME(-0.018),这表明银条原果胶和可溶性果胶对银条硬度的影响较大,可溶性果胶、Cx、β-Gal、α-L-Af、PG、β-Glu、PME对银条硬度下降均起促进作用,而原果胶、纤维素则会延缓银条硬度下降。相关性分析结果表明,银条硬度与可溶性果胶、原果胶、纤维素、α-L-Af、Cx、PG、β-Glu、PME具有极显著相关性(P<0.01),这也说明了银条硬度下降与细胞壁组分及细胞壁降解酶活力密切相关。表2中原果胶间接通径系数总和最高(-5.069),其次是纤维素和可溶性果胶(分别为-1.416和-1.137),原果胶主要是通过可溶性果胶、α-L-Af、纤维素对银条硬度产生了间接影响,其中原果胶→可溶性果胶→硬度的负向效应最大(-1.028);可溶性果胶主要通过影响原果胶、纤维素和α-L-Af对银条硬度产生了间接影响,可溶性果胶→原果胶→硬度的正向效应最大(0.384);纤维素主要是通过原果胶、可溶性果胶和α-L-Af对银条硬度产生间接影响,纤维素→原果胶→硬度的正向效应最大(0.290),这表明银条原果胶、纤维素、可溶性果胶通过其他指标对银条硬度产生的间接作用较强。
4 结论
10 mmol/L草酸处理能显著抑制银条硬度下降,明显抑制失重率上升,维持较高的TA和维生素C含量而保持银条较高营养品质,显著抑制银条细胞壁组分(原果胶、纤维素等)含量下降,抑制可溶性果胶含量上升,降低贮藏15~30 d银条PG、PME、β-Gal、β-Glu、α-L-Af和Cx活力。相关性分析表明,细胞壁组分和细胞壁降解酶是影响银条硬度的主要因素,β-Gal 对银条硬度下降的贡献较原果胶、可溶性果胶、纤维素、PG、PME、β-Glu、α-L-Af和Cx小。通径分析表明Cx、β-Gal、α-L-Af、PG对银条硬度产生负向作用,原果胶、可溶性果胶、纤维素则起正向作用,各指标中银条原果胶、纤维素、可溶性果胶通过其他指标对银条硬度产生的间接作用较强。总之,10 mmol/L草酸处理可抑制贮藏后期(15~30 d)银条细胞壁降解酶活力而减轻细胞壁组分降解,维持银条较高硬度,提高银条贮藏品质。
[1] 焦镭, 蒋小锋, 魏楠, 等.银条面包的研制及工艺优化[J].粮食与油脂, 2020, 33(10):46-51.JIAO L, JIANG X F, WEI N, et al.Development and process optimization of Stachys floridana Schuttl.ex Benth bread[J].Cereals and Oils, 2020, 33(10):46-51.
[2] 党东阳, 李佩艳, 刘建学, 等.不同贮藏温度对银条褐变及细胞壁降解的影响[J].食品与发酵工业, 2023, 49(4):88-96.DANG D Y, LI P Y, LIU J X, et al.Effects of different storage temperatures on browning and cell wall degradation of Stachys flordana Schuttl.ex Benth[J].Food and Fermentation Industries, 2023, 49(4):88-96.
[3] 李佩艳, 尹飞, 苏娇, 等.草酸处理减轻采后果蔬冷害机制研究进展[J].食品与发酵工业, 2022, 48(24):319-326.LI P Y, YIN F, SU J, et al.Research progress on the mechanism of oxalic acid treatment to reduce chilling injury of postharvest fruits and vegetables[J].Food and Fermentation Industries, 2022, 48(24):319-326.
[4] MART NEZ-ESPL
NEZ-ESPL A, GARCIA-PASTOR M E, ZAPATA P J, et al.Preharvest application of oxalic acid improves quality and phytochemical content of artichoke (Cynara scolymus L.) at harvest and during storage[J].Food Chemistry, 2017, 230:343-349.
A, GARCIA-PASTOR M E, ZAPATA P J, et al.Preharvest application of oxalic acid improves quality and phytochemical content of artichoke (Cynara scolymus L.) at harvest and during storage[J].Food Chemistry, 2017, 230:343-349.
[5] ZHENG J, LI S G, XU Y H, et al.Effect of oxalic acid on edible quality of bamboo shoots (Phyllostachys prominens) without sheaths during cold storage[J].LWT-Food Science and Technology, 2019, 109:194-200.
[6] RAZAVI F, HAJILOU J.Enhancement of postharvest nutritional quality and antioxidant capacity of peach fruits by preharvest oxalic acid treatment[J].Scientia Horticulturae, 2016, 200:95-101.
[7] ZHU Y Y, YU J, BRECHT J K, et al.Pre-harvest application of oxalic acid increases quality and resistance to Penicillium expansum in kiwifruit during Postharvest storage[J].Food Chemistry, 2016, 190:537-543.
[8] LI P Y, ZHENG X L, LIU Y, et al.Pre-storage application of oxalic acid alleviates chilling injury in mango fruit by modulating proline metabolism and energy status under chilling stress[J].Food Chemistry, 2014, 142:72-78.
[9] SUN Y H, LI M Y, JI S J, et al.Effect of exogenous melatonin treatment on quality and softening of jujube fruit during storage[J].Journal of Food Processing and Preservation, 2022, 46(7):e16662.
[10] LI L, TU M Y, LI W X, et al.Elevated oxygen atmosphere maintains antioxidant capacity and inhibits cell wall metabolism in postharvest jujube[J].Postharvest Biology and Technology, 2023, 199:112301.
[11] KUMAR N, TOKAS J, RAGHAVENDRA M, et al.Impact of exogenous salicylic acid treatment on the cell wall metabolism and ripening process in postharvest tomato fruit stored at ambient temperature[J].International Journal of Food Science &Technology, 2021, 56(6):2961-2972.
[12] LI S S, QIU C Y, YANG M J, et al.Effect of gibberellic acid on cell wall degradation and softening in postharvest okras[J].LWT-Food Science and Technology, 2023, 186:115223.
[13] 张琴, 林欣, 彭俊森, 等.外源草酸对采后‘蜂糖李’果实软化和细胞壁降解的影响[J].食品与发酵工业, 2023, 49(6):64-70.ZHANG Q, LIN X, PENG J S, et al.Effects of exogenous oxalic acid on fruit softening and cell wall degrading of Fengtang plum[J].Food and Fermentation Industries, 2023, 49(6):64-70.
[14] RETAMAL-SALGADO J, ADAOS G, CEDENO-GARCIA G, et al.Preharvest applications of oxalic acid and salicylic acid increase fruit firmness and polyphenolic content in blueberry (Vaccinium corymbosum L.)[J].Horticulturae, 2023, 9(6):639.
[15] 刘佳欣, 李灿婴, 蒋超男, 等.外源褪黑素对‘南果梨’果实贮藏品质和细胞壁降解酶的影响[J].食品科学, 2022, 43(13):155-162.LIU J X, LI C Y, JIANG C N, et al.Effects of exogenous melatonin on storage quality and cell wall-degrading enzymes of ‘Nanguo’ pears[J].Food Science, 2022, 43(13):155-162.
[16] 向妙莲, 吴帆, 李树成, 等.褪黑素处理对梨果实采后黑斑病及贮藏品质的影响[J].中国农业科学, 2022, 55(4):785-795.XIANG M L, WU F, LI S C, et al.Effects of melatonin treatment on resistance to black spot and postharvest storage quality of pear fruit[J].Scientia Agricultura Sinica, 2022, 55(4):785-795.
[17] 石玲, 吴斌, 敬媛媛, 等.一氧化氮熏蒸处理对甜瓜采后细胞壁代谢及黑斑病控制的影响[J].食品科学, 2019, 40(23):239-245.SHI L, WU B, JING Y Y, et al.Effects of nitric oxide fumigation on cell wall metabolism and black spot control of postharvest melon[J].Food Science, 2019, 40(23):239-245.
[18] 宁密密, 张群, 舒楠, 等.不同形式SO2保鲜剂处理对'阳光玫瑰'葡萄贮藏期间果实硬度和细胞壁代谢的影响[J].食品与发酵工业, 2022, 48(19):169-177.NING M M, ZHANG Q, SHU N, et al.Effects of different forms of SO2 preservative on fruit firmness and cell wall metabolism of ‘Shine Muscat’ grape during storage[J].Food and Fermentation Industries, 2022, 48(19):169-177.
[19] ZHAO Y T, ZHU X, HOU Y Y, et al.Effects of nitric oxide fumigation treatment on retarding cell wall degradation and delaying softening of winter jujube (Ziziphus jujuba Mill.cv.Dongzao) fruit during storage[J].Postharvest Biology and Technology, 2019, 156:110954.
[20] CAO S, QU G F, MA C, et al.Effects of melatonin treatment on the physiological quality and cell wall metabolites in kiwifruit[J].Food Science and Technology, 2022, 42:e85421.
[21] NG J K T, SCHRODER R, SUTHERLAND P W, et al.Cell wall structures leading to cultivar differences in softening rates develop early during apple (Malus×domestica) fruit growth[J].BMC Plant Biology, 2013, 13:183.
[22] 王雪, 李乾, 刘彩红, 等.NO熏蒸处理对冷藏枸杞鲜果细胞壁代谢的影响[J].食品工业科技, 2022, 43(9):334-340.WANG X, LI Q, LIU C H, et al.Effects of NO fumigation on cell wall metabolism in Lycium barbarum fresh fruit under cold storage[J].Science and Technology of Food Industry, 2022, 43(9):334-340.
[23] LIU H, CHEN F S, LAI S J, et al.Effects of calcium treatment and low temperature storage on cell wall polysaccharide nanostructures and quality of postharvest apricot (Prunus armeniaca)[J].Food Chemistry, 2017, 225:87-97.
[24] MI S, LI T, SHI Q Y, et al.Cold shock precooling improves the firmness of chili pepper during postharvest storage and the molecular mechanisms related to pectin[J].Food Chemistry, 2023, 419:136052.
[25] 杨静慧, 邱雪, 张海红, 等.灵武长枣贮藏过程中细胞壁成分及其相关酶活性的变化[J].食品与发酵工业, 2022, 48(8):64-69;75.YANG J H, QIU X, ZHANG H H, et al.Changes in cell wall components and its related enzyme activities during the storage of Lingwu long jujube[J].Food and Fermentation Industries, 2022, 48(8):64-69;75.
[26] NJIE A, DONG X Q, LIU Q G, et al.Melatonin treatment inhibits mango fruit (Cv.‘Guiqi’) softening by maintaining cell wall and reactive oxygen metabolisms during cold storage[J].Postharvest Biology and Technology, 2023, 205:112500.
[27] YAN R, HAN C, FU M R, et al.Inhibitory effects of CaCl2 and pectin methylesterase on fruit softening of raspberry during cold storage[J].Horticulturae, 2021, 8(1):1.
[28] 程圣, 靳苗苗, 何欣遥, 等.外源乙烯处理对甘薯裂果及细胞壁代谢的影响[J].食品与发酵工业, 2020, 46(18):161-166.CHENG S, JIN M M, HE X Y, et al.Effects of exogenous ethylene on the cracking and cell wall metabolism of sweet potato[J].Food and Fermentation Industries, 2020, 46(18):161-166.
[29] HE M Y, WU Y F, WANG Y, et al.Valeric acid suppresses cell wall polysaccharides disassembly to maintain fruit firmness of harvested ‘Waizuili’ plum (Prunus salicina Lindl)[J].Scientia Horticulturae, 2022, 291:110608.
[30] CHEN C Y, HUANG Q, PENG X, et al.Alleviatory effects of salicylic acid on postharvest softening and cell wall degradation of ‘Jinshayou’ pummelo (Citrus maxima Merr.):A comparative physiological and transcriptomic analysis[J].Food Chemistry, 2023, 424:136428.