功能性便秘(functional constipation,FC)是一种常见的胃肠疾病,在罗马Ⅳ标准分类中,功能性便秘属于慢性难治性疾病[1],在普通人群中的流行率为16%[2],且便秘对于患者的生活质量和心理健康都有严重的影响。目前,功能性便秘的病理机制与病因多样[3],临床治疗方法以易产生副作用和依赖性的药物治疗为主[4-5]。因此,找到一种温和且有效的治疗方法,能大大改善便秘患者的身心健康。临床研究表明,便秘患者肠道内存在严重的菌群失调[6]。因此,目前该领域研究的新思路是通过益生菌调节肠道局部的微生态环境,从而治疗便秘[7]。苹果醋是一种以苹果为原料,加入酵母菌、醋酸菌等进行发酵形成的果醋[8],可以为人体提供所需微量元素和有机酸[9]。苹果醋中富含维生素、有机酸、果胶等多种生理活性成分[10],对预防肥胖、心血管疾病等方面都有积极作用[11-13]。
目前研究显示,苹果醋对金黄色葡萄球菌、大肠杆菌等肠道有害细菌有抑制作用[14],在肠道内提供了良好的益生菌培养基质。苹果醋所含的丰富的氨基酸也可刺激胃肠分泌消化液,促进肠胃消化吸收[15]。在日常生活中发现,苹果醋对于便秘症状有一定的缓解作用,然而国内外针对苹果醋对功能性便秘肠道菌群的影响仍未可知。本研究拟利用盐酸洛哌丁胺诱导的小鼠便秘模型研究苹果醋粉对于肠道菌群的影响,解析苹果醋粉对便秘小鼠的影响。本研究深挖了苹果醋这一传统发酵食品的药用价值,进一步丰富了食源性治疗便秘的科学方法,同时也为后续肠道菌群方向的研究以及相关产品的研发奠定了基础。
1 材料与方法
1.1 动物、材料与试剂
BALB/c雄性小鼠,7周龄,体重(20±2) g,SPF级,购于江苏集萃药康生物科技股份有限公司。所有实验动物和实验研究均经本校伦理委员会(No20221015b0701120[431])批准,并符合标准。小鼠饲养于本校实验动物中心屏障环境,实验期间小鼠自由饮水及摄食。动物房12 h光照循环,温度恒定控制在20~26 ℃,相对湿度保持在40%~70%。所用饲料均为普通饲料。
苹果醋粉,绿杰股份有限公司;盐酸洛哌丁胺胶囊,西安杨森制药有限公司;血管活性肠肽(vasoactive intestinal peptide,VIP)、P物质(substance P,SP)、胃动素(motilin,MTL)、生长抑素(somatostatin,SS)、血清素(serotonin,5-HT)的ELISA试剂盒,上海酶联生物科技有限公司;羧甲基纤维素钠,上海泰坦科技股份有限公司;活性炭,国药集团化学试剂有限公司。
1.2 仪器与设备
冷冻干燥机,北京照生行仪器设备有限公司;1150H石蜡包埋机,德国徕卡公司;M2245手动轮转切片机,德国徕卡公司;Multiskan GO全波长酶标仪,美国Thermo Fisher Scientific公司;3Dhistech Pannoramic Scan数字玻片扫描系统。
1.3 实验方法
1.3.1 实验动物分组设计
小鼠进驻后适应7 d后,小鼠随机分为对照组、模型组、低剂量苹果醋造模组(low-dose apple cider vinegar model group,AVPLM)和高剂量苹果醋造模组(high-dose apple cider vinegar model group,AVPHM),每组各10只小鼠,所有实验小鼠均按SPF级标准饲养。如图1所示,对照组和造模组每天灌胃0.1 mL无菌水,AVPLM组每天灌胃162.5 mg/(kg·bw) AVP,AVPHM组每天灌胃325 mg/(kg·bw) AVP,干预2周,AVP浓度依据实验室前期研究。在干预1周后,第8~14天,模型组、AVPLM组和AVPHM组每天均灌胃4 mg/(kg·bw)盐酸洛哌丁胺进行便秘造模,对照组每天灌胃0.1 mL等量无菌水。第14天完成灌胃后,所有小鼠过夜禁食不禁水。实验结束后,使用异氟烷(诱导浓度:2%~3%,维持浓度:1%~1.5%,体积分数)对小鼠进行吸入式麻醉,随后进行眼眶取血并辅以颈椎脱臼法处死小鼠,取其粪便、血液、结肠、胃及内容物。
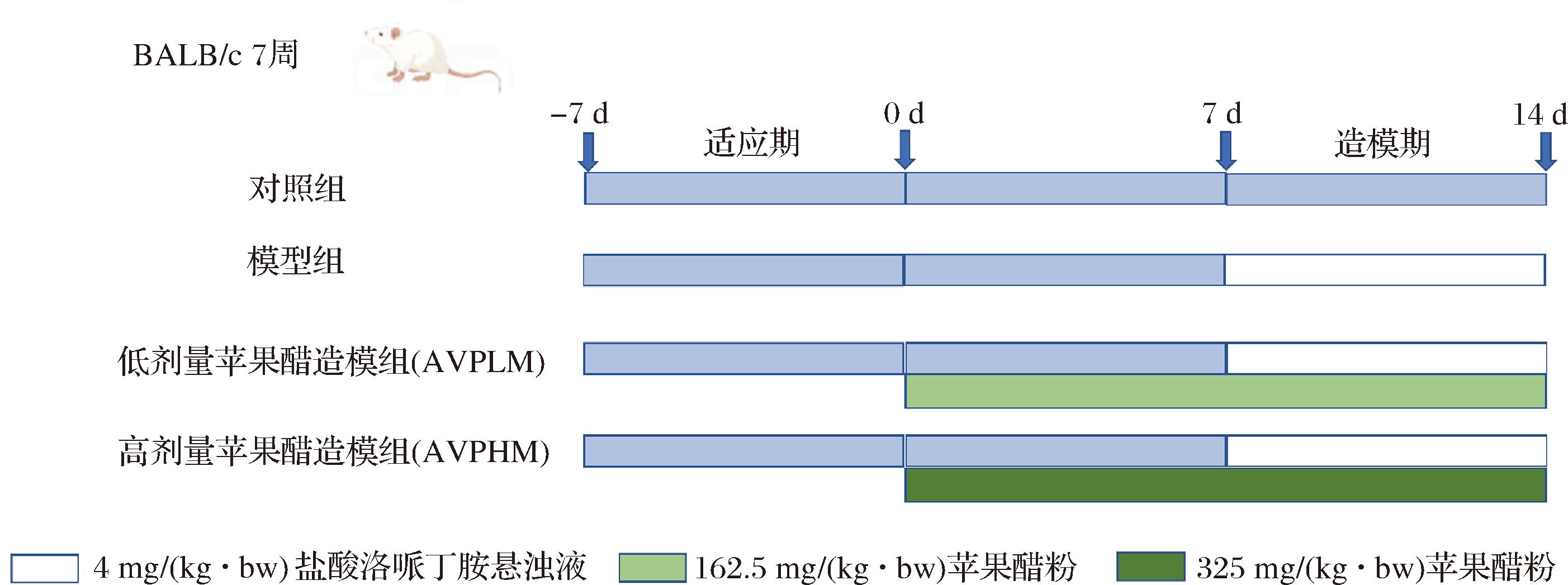
图1 动物实验流程
Fig.1 Animal experiment schedule
1.3.2 粪便含水量的测定
将小鼠分别放入笼盒中,收集4 h粪便于已称重的离心管中,称量并计算出小鼠的粪便湿重。真空冷冻干燥后封口称重,计算粪便干重[16]。粪便含水量计算如公式(1)所示:
粪便含水量![]()
(1)
1.3.3 首粒排黑便时间的测定
在实验第14天,对照组小鼠灌胃0.1 mL无菌水,模型组、AVPLM组和AVPHM组均灌胃0.1 mL 4 mg/(kg·bw)溶于无菌水的盐酸洛哌丁胺悬浊液。1 h后,所有小鼠灌胃0.2 mL 5%炭末混悬液墨水(5 g 活性炭+1 g羧甲基纤维素钠+100 mL水),再单独放入干净笼盒中,开始计时。排出第一颗黑便为结束时间,首粒黑便时间为2次时间的间隔[16]。
1.3.4 小肠推进率的测定
所有小鼠禁食不禁水12 h后,对照组小鼠灌胃0.1 mL 无菌水,模型组、AVPLM组和AVPHM组均灌胃0.1 mL 4 mg/(kg·bw)溶于无菌水的盐酸洛哌丁胺悬浊液。1 h后,所有小鼠灌胃0.2 mL 5%炭末混悬液。30 mins后按照1.3.1节方法进行麻醉处死。将胃肠道取出,用米尺测量出活性炭溶液前端推进的距离与小肠总长度[16]。小肠推进率计算如公式(2)所示:
小肠推进率![]()
(2)
1.3.5 血清胃肠活性肽和血清素的测定
使用ELISA试剂盒来检测小鼠血清胃肠活性肽MTL、SP、SS、VIP和血清素5-HT的含量。绘制标准曲线来计算浓度。
1.3.6 组织病理学
小鼠处死后,将结肠用4%多聚甲醛固定24 h,石蜡包埋,切片(4 mm),对结肠组织进行H&E染色,使用3Dhistech Pannoramic Scan数字玻片扫描系统进行扫描。观察结肠组织病理损伤情况,并记录组织病理学评分,具体评分标准见表1。
表1 结肠组织病理学评分标准
Table 1 Histopathological scoring criteria of the colon

得分炎症细胞浸润组织损伤深度0无 无1轻微黏膜层2中度黏膜与黏膜下层3严重黏膜肌层
1.3.7 苹果醋粉16S rRNA基因扩增子测序
提取结肠内容物样本总DNA后进行16S rRNA基因扩增子高通量测序,将得到的原始数据预处理后,得到物种DNA序列。将reads拼接成Tags;然后聚成OTU(operational taxonomic unit),再与数据库比对后进行物种注释;将结果用于分析样品物种的复杂度和组间的物种差异等。
1.4 数据统计分析
利用One-way ANOVA来处理实验数据并进行方差显著性分析,实验结果以平均值±标准差来表示,以P<0.05作为差异显著性的标准,采用GraphPad Prism 8.0软件绘图。
2 结果与分析
2.1 苹果醋粉对便秘指标的影响
为了进一步探讨不同剂量的苹果醋在小鼠肠道中发挥的作用,设计小鼠便秘模型,评价不同剂量的苹果醋对便秘小鼠的粪便含水量、首粒黑便时间、肠道推进率即肠道蠕动功能的影响。
如图2所示,和空白组相比,模型组小鼠的粪便含水量显著减少,首粒黑便时间显著延长,小肠推进率一定程度减缓,造模成功。和模型组相比,AVPLM组和AVPHM组均能够显著提高粪便含水量(P<0.05),降低首粒黑便时间(P<0.01),同时能提高小肠推进率(P<0.01),以上数据表明苹果醋有一定的缓解便秘效果,可能和促进肠蠕动有关。
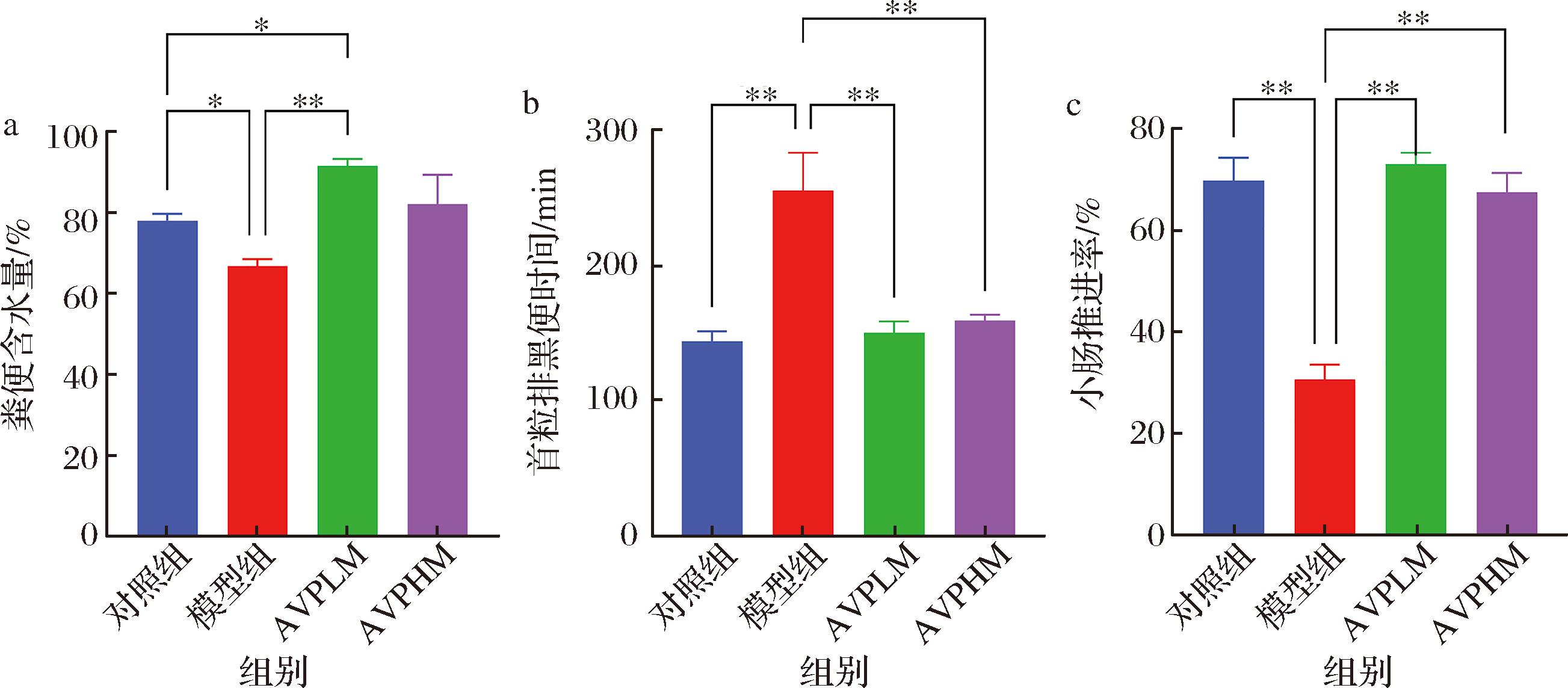
图2 小鼠便秘相关指标
Fig.2 Constipation-related indicators in mice
注:*表示P<0.05,**表示P<0.01(下同)。
2.2 苹果醋粉对血清胃肠活性肽和血清素的影响
胃肠活性肽主要包括兴奋型与抑制型两大类[17-18],MTL和SP属于兴奋型胃肠活性肽,SS和VIP属于抑制型胃肠活性肽[19]。本实验主要通过研究胃肠活性肽含量和血清素的变化,探究苹果醋是否会通过影响宿主体内肽类激素的含量来恢复肠道功能。
结果如图3所示,模型组血清中MTL和SP含量与空白组相比有所下降,SP下降显著(P<0.05);而模型组血清中SS和VIP含量与空白组相比都有所升高。说明便秘会引起胃肠活性肽含量的变化,释放神经递质,影响肠道平滑肌的收缩与舒张,抑制肠道蠕动[16]。与模型组相比,AVPLM组和AVPHM组均能够使MTL含量增加,有利于释放胃蛋白酶和收缩十二指肠,促进小肠蠕动[20]。与模型组相比,AVPLM组和AVPHM组均能够使SP含量显著增加(P<0.01);AVPLM组和AVPHM组可能刺激了SP的分泌从而刺激肠肌,引起收缩,增强肠道蠕动能力。与模型组相比,AVPLM组的血清中SS的含量显著下降(P<0.01),可能是因为减少兴奋神经元的抑制,增加神经递质释放,促进肠道蠕动[21]。此外,AVPLM组也能明显降低血清中VIP的含量(P<0.01)来抑制平滑肌舒张[21]。模型组小鼠血清中5-HT含量较空白组有所下降,AVPLM组和AVPHM组便秘小鼠血清中5-HT的含量上升了,而5-HT可以促进肠道蠕动,说明AVP干预后可以恢复便秘小鼠的肠道蠕动能力。
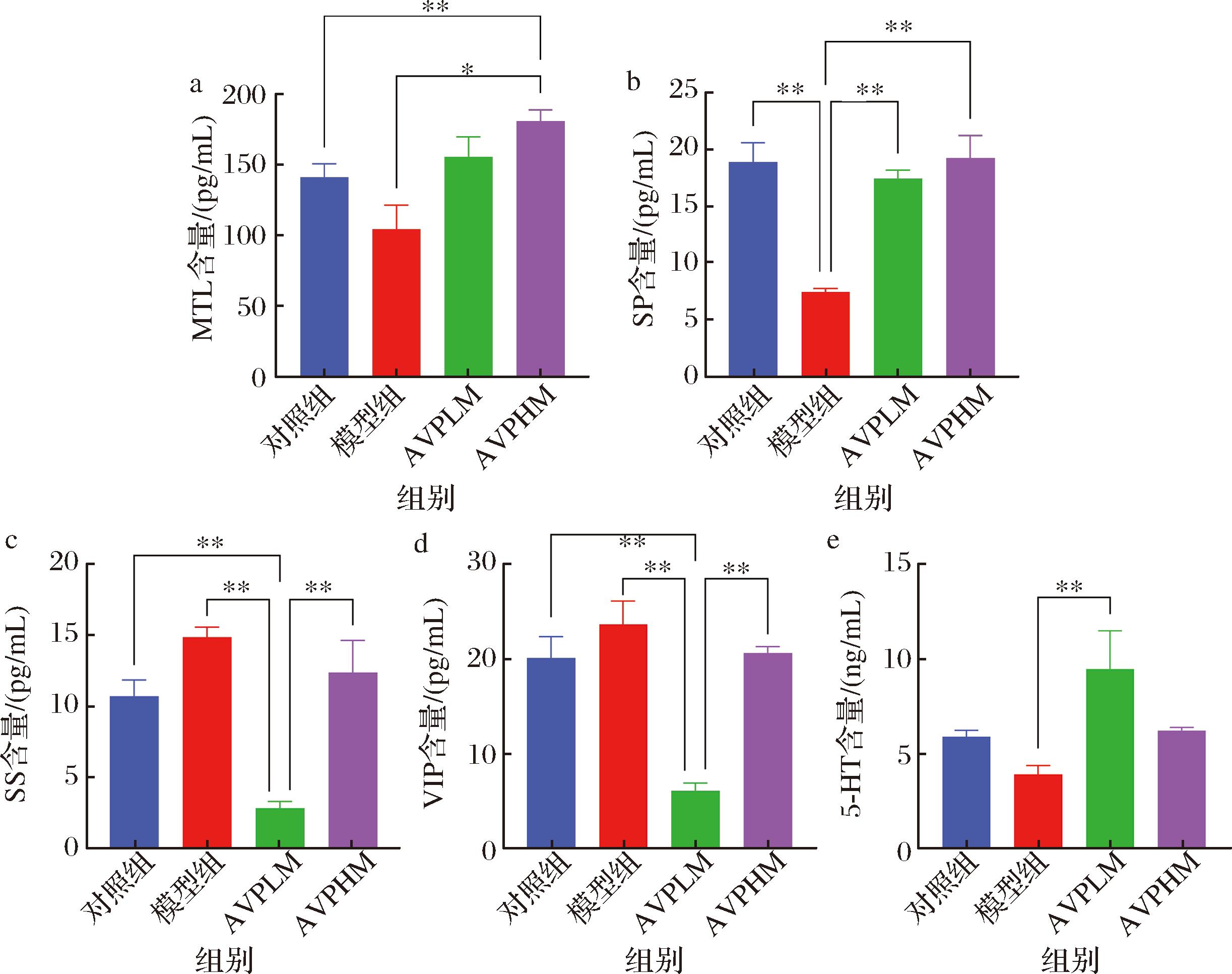
a-MTL含量;b-SP含量;c-SS含量;d-VIP含量;e-5-HT含量
图3 小鼠胃肠活性肽和血清素的差异
Fig.3 Difference of gastrointestinal active peptides and serotonin in mice

a-空白组;b-造模组;c-AVPLM组;d-AVP组;e-组织病理学评分
图4 小鼠结肠组织病理切片和组织病理学评分(n=10)
Fig.4 Pathological section and histopathological score of mouse colon(n=10)
2.3 苹果醋粉对结肠病理的影响
便秘的形成机制复杂,H&E染色可以帮助我们了解结肠组织的结构和形态变化,从而判断苹果醋是否对肠道病理损伤有修复作用。如图4所示,便秘小鼠的结肠组织的隐窝缩短,杯状细胞的数量有所下降。杯状细胞可以合成、分泌黏蛋白,形成保护防止致病菌入侵[22]。因此,便秘导致的肠道病理损伤会对机体产生不利影响。
总体来看,AVP干预后增加了隐窝长度、肠道肌层厚度和杯状细胞数量。以上表明苹果醋对便秘导致肠道的病理损伤有一定修复作用。
2.4 苹果醋粉对对小鼠肠道菌群的影响
现有研究发现便秘的发生与肠道菌群紊乱有关。恢复肠道菌群[23]和保持稳态有利于缓解便秘[6,24]。
2.4.1 小鼠肠道微生物多样性分析
首先利用Sobs、Chao1、Shannon和Simpson指数,如图5所示,这些α-多样性分析指数表征了小鼠在第14天粪便样品中肠道微生物的α-多样性。如图5所示,Shannon指数在AVPHM组中最高,其次为AVPLM组、对照组及模型组,说明高剂量AVP调节便秘小鼠肠道物种丰富度和均匀度的能力强于低剂量AVP。模型组和AVPLM组 Simpson指数高于对照组,说明2组α-多样性降低,2组肠道优势物种具有集中趋势。Chao1与Sobs指数由高到低依次为AVPHM组、AVPLM组、对照组及模型组。
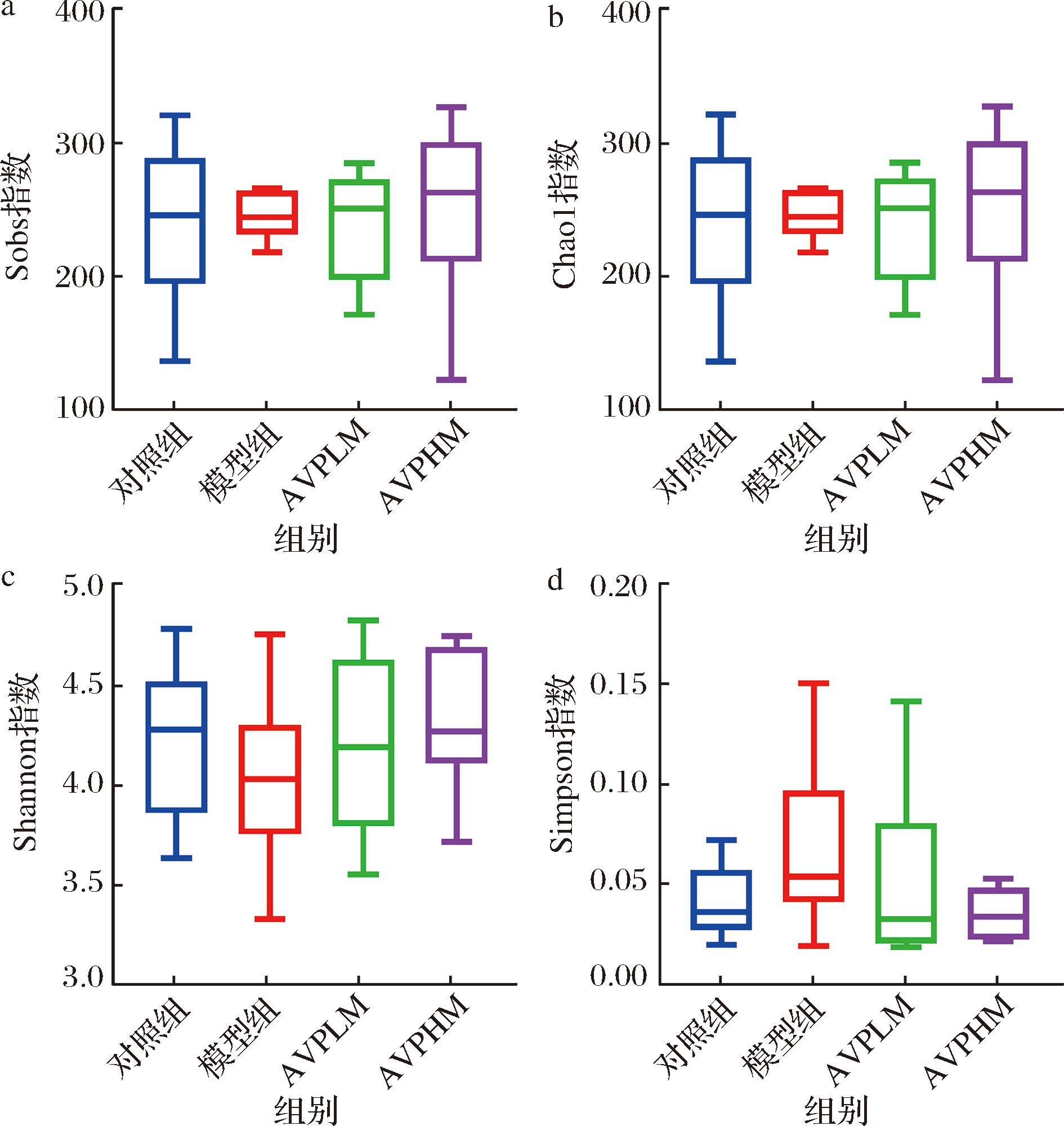
a-Sobs指数;b-Chao1指数;c-Shannon指数;d-Simpson指数
图5 第14天小鼠肠道微生物的α-多样性
Fig.5 α-Diversity of intestinal microbes in mice on day 14
进而利用偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)方法研究了小鼠第14天肠道菌群的β-多样性来探究肠道微生物组成结构的相似性。如图6所示,在第14天时5组小鼠的肠道微生物在组内具有相似性,而组间差异较大。说明便秘模型组小鼠的肠道菌群和正常小鼠存在组成结构的差异,而AVP对于肠道菌群也有一定影响。
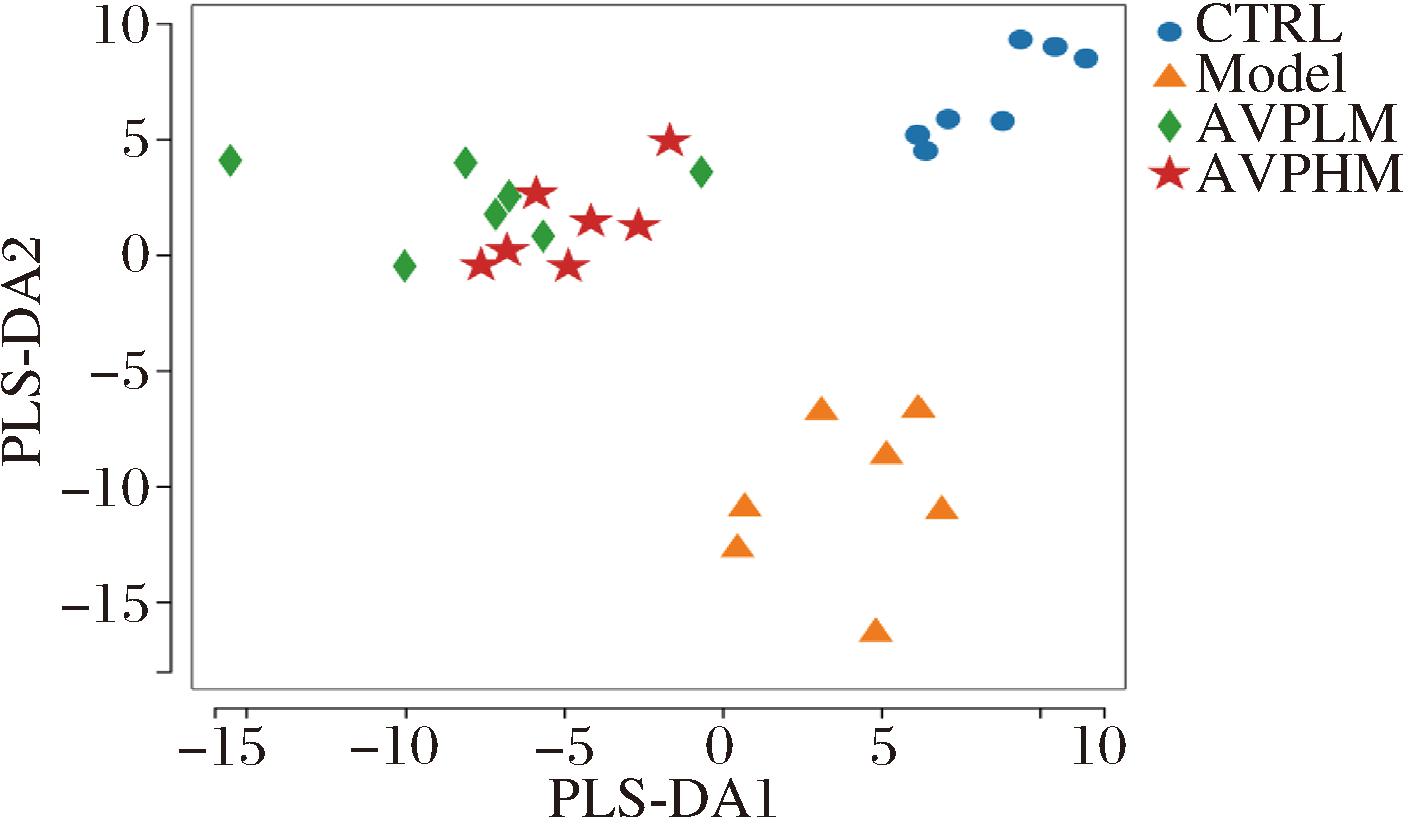
图6 第14天小鼠肠道微生物的PLS-DA
Fig.6 PLS-DA of intestinal microbes in mice on day 14
2.4.2 小鼠肠道微生物的在门和属水平上的物种丰度分析
本文统计了第14天小鼠肠道微生物在门和属水平上细菌的相对丰度并制作了物种丰度柱状图(物种丰度在所有样品均低于0.5%的物种全部被合并成others)来研究第14天空白组、模型组、AVPLM组和AVPHM组小鼠肠道微生物的组成和差异。如图7所示,在门水平上,厚壁菌门(Firmicutes)是丰度最高的菌门,相对丰度为70%~95%;与空白组相比,模型组显著降低了厚壁菌门的相对丰度(P<0.01),显著增加了疣微菌门(Verrucmoicrobiota)的相对丰度(P<0.01)。与空白组相比,AVPHM组显著增加了厚壁菌门的相对丰度(P<0.05)。与模型组相比,显著降低了疣微菌门的相对丰度(P<0.01)。如图8所示,在属水平上,相对于空白组,模型组显著增加了嗜黏蛋白阿克曼菌(Akkermansia muciniphil)(P<0.01),模型组、AVPLM组和AVPHM组显著降低了Monoglobus的相对丰度(P<0.001)。相对于模型组,AVPHM组显著降低了嗜黏蛋白阿克曼菌(P<0.05)。
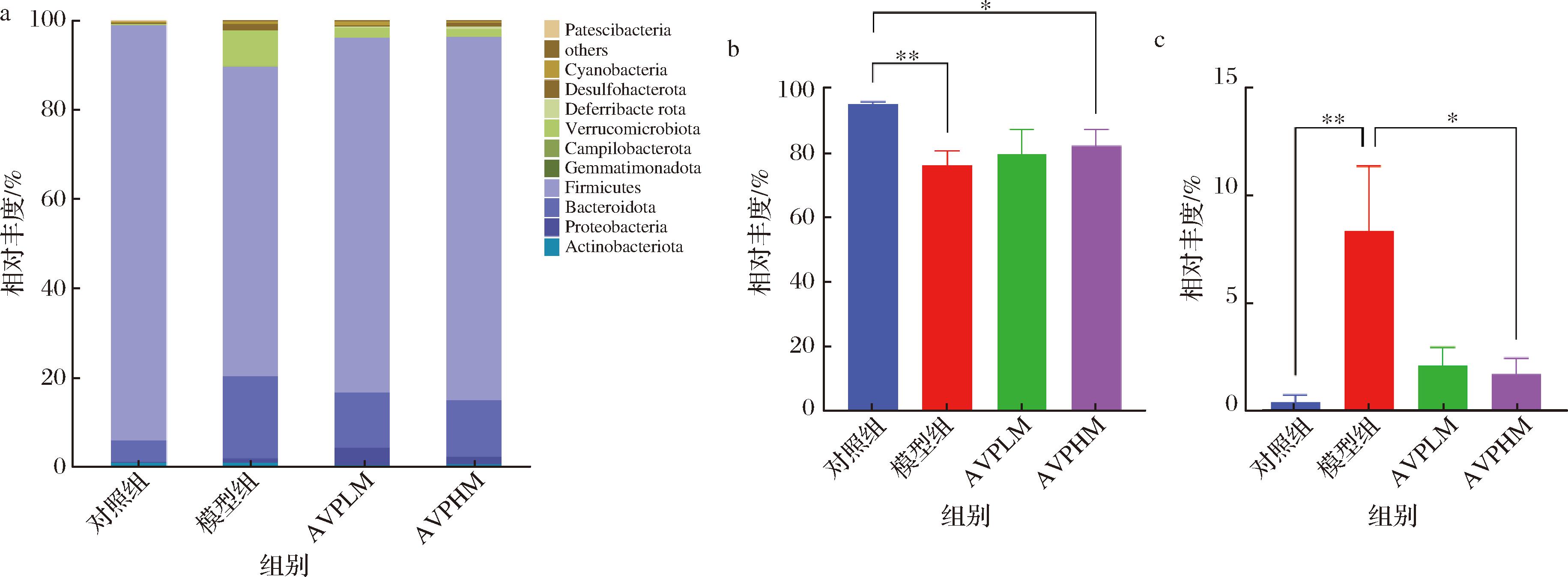
a-门水平丰度柱状图;b-门水平Firmicutes丰度柱状图;c-门水平Verrucmoicrobiota丰度柱状图
图7 不同样本细菌在门水平上的分布
Fig.7 Distribution of bacteria in different samples at phylum level
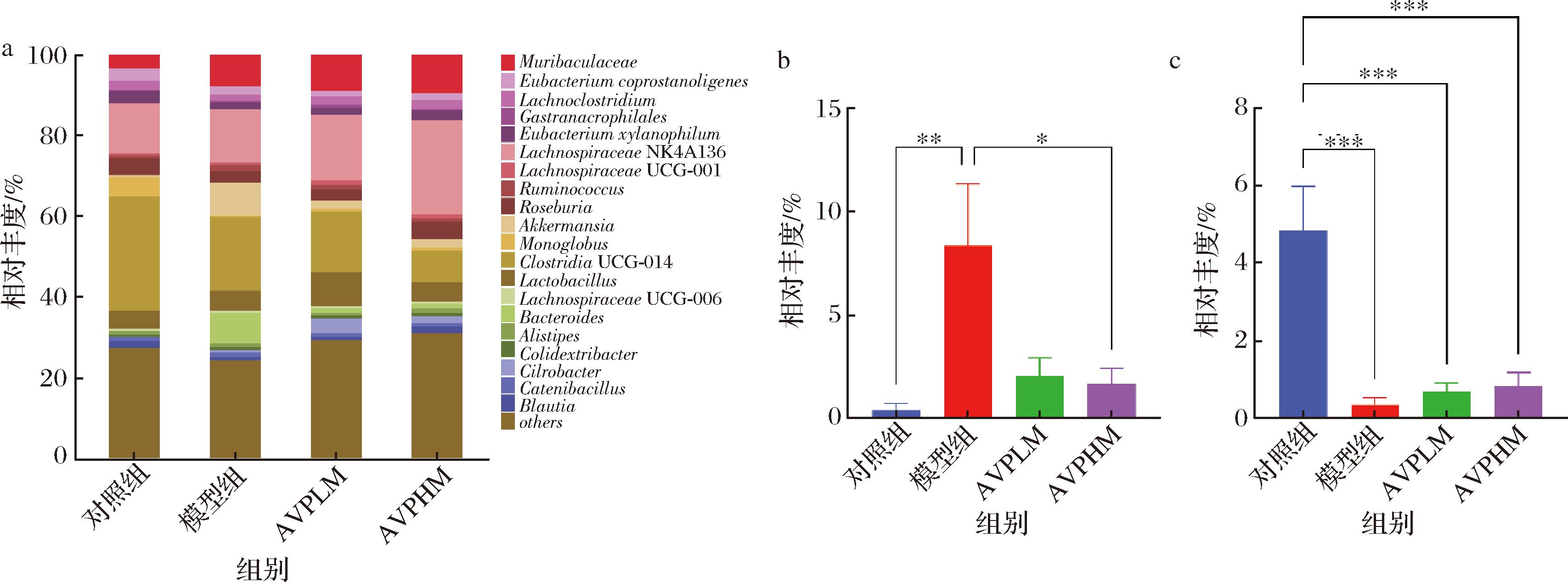
a-属水平丰度柱状图;b-属水平Akkermansia丰度柱状图;c-属水平Monoglobus丰度柱状图
图8 不同样本细菌在属水平上的分布
Fig.8 Distribution of bacteria in different samples at genus level
注:***表示P<0.001。
3 结论
功能性便秘作为一种常见的慢性难治性胃肠疾病,在临床治疗上易产生副作用和依赖性,需要温和且有效的能够改善患者满意度的方法。本实验中,首先通过预实验发现AVP增加小鼠排便量现象。而在之后的实验中,AVP干预后有缓解便秘,能够显著降低首粒黑便时间、增加粪便含水量和增加小肠推进率。血清数据表明,AVP干预后能够使便秘小鼠的MTL、SP和5-HT含量增加,SS和VIP含量降低,有利于促进胃蛋白酶的释放以及十二指肠的收缩,表现出对小肠蠕动的促进作用。进而对小鼠肠道菌群进行16S rRNA基因扩增子测序分析,发现AVP对盐酸洛哌丁胺诱导的便秘小鼠肠道菌群有一定调节作用。本实验发现AVP能缓解小鼠的便秘症状,但目前这仅限于动物实验,是否能用于临床预防和缓解还是未知的,需要进一步研究。
综上所述,AVP具有一定的缓解便秘的功效。本研究的实验结果对后续肠道菌群方向的研究具有积极意义,为临床治疗以及相关产品研发提供科学依据与借鉴。
[1] AZIZ I, WHITEHEAD W E, PALSSON O S, et al.An approach to the diagnosis and management of Rome Ⅳ functional disorders of chronic constipation[J].Expert Review of Gastroenterology &Hepatology, 2020, 14(1):39-46.
[2] HIGGINS P D R, JOHANSON J F.Epidemiology of constipation in north america:A systematic review[J].The American Journal of Gastroenterology, 2004, 99(4):750-759.
[3] OHKUSA T, KOIDO S, NISHIKAWA Y, et al.Gut microbiota and chronic constipation:A review and update[J].Frontiers in Medicine, 2019, 6(1):1-19.
[4] SCOTT S M, SIMRÉN M, FARMER A D, et al.Chronic constipation in adults:Contemporary perspectives and clinical challenges.1:Epidemiology, diagnosis, clinical associations, pathophysiology and investigation[J].Neurogastroenterology and Motility, 2021, 33(6):e14050.
[5] VRIESMAN M H, KOPPEN I J N, CAMILLERI M, et al.Management of functional constipation in children and adults[J].Nature Reviews Gastroenterology &Hepatology, 2020, 17(1):21-39.
[6] GE X L, ZHAO W, DING C, et al.Potential role of fecal microbiota from patients with slow transit constipation in the regulation of gastrointestinal motility[J].Scientific Reports, 2017, 7(1):441.
[7] YANG W H, HE T, ZHANG W J, et al.Effectiveness and safety of lactobacilli in children with functional constipation Study protocol for a meta-analysis and systematic review[J].Medicine, 2019, 98(20):e15675.
[8] GUINÉ R P F, BARROCA M J, COLDEA T E, et al.Apple fermented products:an overview of technology, properties and health effects[J].Processes, 2021, 9(2):223.
[9] KALABA V, ![]() BALABAN Ž, KALABA D.Antibacterial activity of domestic apple cider vinegar[J].AGROFOR International Journal, 2019, 4(1):24-31.
BALABAN Ž, KALABA D.Antibacterial activity of domestic apple cider vinegar[J].AGROFOR International Journal, 2019, 4(1):24-31.
[10] EL ABDALI Y, SAGHROUCHNI H, KARA M, et al.Exploring the bioactive compounds in some apple vinegar samples and their biological activities[J].Plants, 2023, 12(22):3850.
[11] TEHRANI S D, KESHANI M, ROUHANI M H, et al.The effects of apple cider vinegar on cardiometabolic risk factors:A systematic review and meta-analysis of clinical trials[J].Current Medicinal Chemistry, 2023, 31:1-18.
[12] SINGH A S, SINGH A, VELLAPANDIAN C, et al.GC-MS based metabolite profiling, antioxidant and antiurolithiatic properties of apple cider vinegar[J].Future Science Oa, 2023, 9(4):FSO855.
[13] JAFARIRAD S, ELAHI M-R, MANSOORI A, et al.The improvement effect of apple cider vinegar as a functional food on anthropometric indices, blood glucose and lipid profile in diabetic patients:A randomized controlled clinical trial[J].Frontiers in Clinical Diabetes and Healthcare, 2023, (4):1288786.
[14] YAGNIK D, SERAFIN V, SHAH A J.Antimicrobial activity of apple cider vinegar against Escherichia coli,Staphylococcus aureus and Candida albicans;downregulating cytokine and microbial protein expression[J].Scientific Reports, 2018, 8 (1):1732.
[15] 卢丙俊. 苹果醋的加工[J].现代农业, 2011, (5):28-29.LU B J.Processing of apple cider vinegar[J].Modern Agriculture, 2011, (5):28-29.
[16] 柴茂. 双歧杆菌对便秘的缓解作用及其机制分析[D].无锡:江南大学,2021.CHAI M.Analysis of the alleviation effects on constipation by Bifidobacterium and its mechanisms[D].Wuxi:Jiangnan University, 2021.
[17] MU J F, ZHAO X, ZALAN Z, et al.Lactobacillus plantarum KFY02 enhances the relieving effect of gardenoside on montmorillonite induced constipation in mice[J].RSC Advances, 2020, 10(17):10368-10381.
[18] CHEN J Q, LI D W, CHEN Y Y, et al.Elucidating dosage-effect relationship of different efficacy of rhubarb in constipation model rats by factor analysis[J].Journal of Ethnopharmacology, 2019, 238:111868.
[19] QIAN Y, SONG J L, YI R K, et al.Preventive effects of Lactobacillus plantarum YS4 on constipation induced by activated carbon in mice[J].Applied Sciences, 2018, 8(3):363.
[20] FEIGHNER S D, TAN C P, MCKEE K K, et al.Receptor for motilin identified in the human gastrointestinal system[J].Science, 1999, 284(5423):2184-2188.
[21] LIU B H, YANG X, GUO L J, et al.Inhibitory Effect of Lactobacillus plantarum CQPC02 Isolated from Chinese Sichuan pickles (Paocai) on constipation in mice[J].Journal of Food Quality, 2019(15):1-13.
[22] WANG J Y, XIONG K, ZHAO S L, et al.Long-term effects of multi-drug-resistant tuberculosis treatment on gut microbiota and its health consequences[J].Frontiers in Microbiology, 2020, 11:53.
[23] YARULLINA D R, SHAFIGULLIN M U, SAKULIN K A, et al.Characterization of gut contractility and microbiota in patients with severe chronic constipation[J].PLoS One, 2020, 15(7):e0235985.
[24] SIMRÉN M.Manipulating the gut microbiome as a treatment strategy for functional gastrointestinal disorders[J].Gastroenterology, 2018, 155(4):960-962.