色氨酸是人体必需氨基酸之一,其代谢途径广泛而多样,因此色氨酸代谢产物已成为许多疾病的药理学靶点[1]。吲哚乙酸(indole-3-acetic acid,IAA)是色氨酸代谢产物之一,具有广泛的生物学活性。TINTELNOT等[2]的研究表明,IAA可以增强胰腺癌的化疗效果。JI等[3]对高脂小鼠持续腹腔注射一定剂量的IAA后发现,高脂小鼠肝脏的单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)与TNF-α的表达水平均出现显著下降,表明IAA减弱了高脂小鼠的炎症反应。除了体内研究外,IAA还被发现可以降低RAW264.7巨噬细胞的炎症水平[4]。然而目前在神经炎症调控方面的研究还相对有限。
神经炎症是小胶质细胞与星形胶质细胞等免疫细胞释放炎症介质而引发的先天性和适应性免疫反应[5]。虽然短期的神经炎症被认为具有保护作用,有助于恢复受损的神经元细胞,但长期的神经炎症却是许多神经系统疾病恶化的关键因素。阿尔兹海默症[6]、帕金森病[7]和脑血管疾病[8]都与长期神经炎症密切相关。最近的研究指出,当小胶质细胞受到β-淀粉样蛋白(amyloid-β,Aβ)的刺激时,会释放出促炎细胞因子,这些因子进一步刺激淀粉样前体蛋白的生成,导致Aβ水平的增加和神经退行性病变的加剧[9]。另外,帕金森病中黑质致密部的多巴胺神经元丧失与神经炎症之间存在紧密的关联。这是由于小胶质细胞激活后释放的炎症因子会进一步加剧神经元的变性过程[10]。此外,神经炎症还能增加NADPH氧化酶的表达和活性,从而营造一个高度氧化的环境[11],大量的活性氧会进一步加重氧化应激,导致神经炎症进一步恶化,产生不利影响。因此,神经炎症被视为多种疾病的靶点,并成为广泛研究的对象[12],缓解神经炎症对调控脑健康具有重要意义。
核因子κB(NF-κB)在细胞的炎症反应、免疫应答等过程中扮演了关键角色。NF-κB的经典激活途径一般是通过激活后的NF-κB抑制蛋白激酶(inhibitor of kappa B kinase,IKK)磷酸化NF-κB抑制蛋白(inhibitor of NF-κB,IκB)实现的。NF-κB通路的激活与多种疾病的发生和发展紧密相关,包括各种炎症和癌症[13]。研究表明,肿瘤坏死因子受体超家族成员25(tumor necrosis factor receptor superfamily 25,Tnfrsf25)在体外可直接诱导NF-κB的激活和细胞凋亡过程[14]。
前期研究表明,吲哚乙酸可以降低高脂小鼠脑部Tnfrsf25的表达,为了验证吲哚乙酸对神经炎症的调控作用及其中的机制,本研究利用脂多糖(lipopolysaccharide,LPS)诱导建立了SH-SY5Y细胞炎症模型,并利用免疫蛋白印迹(Western blot)验证IAA对Tnfrsf25/IKK/NF-κB炎症信号通路的调控作用。
1 材料与方法
1.1 材料与试剂
IAA,国药集团化学试剂有限公司;SH-SY5Y细胞,中国科学院细胞库;LPS、Cell Counting Kit-8试剂盒、BCA蛋白浓度测定试剂盒(增强型)、极超敏ECL化学发光试剂盒、全反式维甲酸、SDS-PAGE蛋白上样缓冲液(5X)、Western及IP裂解液、彩色预染蛋白质分子质量标准(10~180 kDa)、辣根过氧化物酶标记山羊抗鼠IgG(H+L)、辣根过氧化物酶标记山羊抗兔IgG(H+L)、鼠抗GAPDH、兔抗IκB /p-IκB,上海碧云天生物技术有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO),北京索莱宝科技有限公司;Hanks液,天津市灏洋生物制品科技有限责任公司;青霉素-链霉素原液、DEME-F12培养基、胰酶、非必需氨基酸,赛默飞世尔科技有限公司;胎牛血清,上海博升生物科技有限公司;兔抗TNF-α/IL-1β/IKK/p-IKK/NF-κB/p-NF-κB,江苏亲科生物研究中心有限公司;兔抗Tnfrsf25,北京博奥森生物技术有限公司。
1.2 仪器与设备
SIM-F140BDL雪花制冰机,松下冷链(大连)有限公司;组织研磨仪,天根生化科技有限公司;冷冻高速离心机,赛默飞世尔科技有限公司;Synergy HTX多功能酶标仪,美国Berten;TS-100脱色摇床,海门市其林贝尔仪器制造有限公司;电泳仪,北京六一生物科技有限公司;WH-861涡旋混合器,太仓华立达公司;ChemiDocTM Imaging System 凝胶成像系统,美国BIO-RAD公司;MCO-20AIC型CO2细胞培养箱,PHCbi公司;BSC-1300IIA2型超净工作台,江苏净化设备有限公司。
1.3 实验方法
1.3.1 SH-SY5Y神经细胞的培养
细胞复苏后,将其置于含10%胎牛血清(fetal bovine serum,FBS)、DMEM-F12不完全培养基、双抗与非必需氨基酸的完全培养基中进行培养,根据实验所需细胞数量选择传代次数。SH-SY5Y细胞培养在温度为37 ℃、湿度为95%和CO2浓度为5%(体积分数)的培养箱中。
1.3.2 吲哚乙酸与对细胞活力的影响
将全反式维甲酸以10 μmol/L的浓度添加到完全培养基中。在96孔板中加入100 μL完全培养基,再加入100 μL细胞悬液,保证每孔细胞数量约为105个,孔板的最外侧应加入与孔内溶液等体积的Hanks液。细胞培养2 d,待贴壁后移除旧的培养液,并用Hanks液进行清洗。随后,分别向孔板中加入(0、25、50、100、200、400 μg/mL)IAA与(0、25、50、100、200 μg/mL)LPS。使用DMEM-F12不完全培养基来溶解IAA和LPS。孵育48 h,每孔中加入10 μL的CCK-8试剂。培养一定时间,使用酶标仪测定450 nm处的吸光度,每组实验设置6个平行样本以确保结果的准确性。
1.3.3 LPS诱导的炎症模型建立与分组
细胞共分为4组,分别为对照组(CON)、脂多糖组(LPS)、脂多糖+低剂量吲哚乙酸组(LPS+LI)与脂多糖+高剂量吲哚乙酸组(LPS+HI)。在6孔板的每个孔中加入1.5 mL含有全反式维甲酸的完全培养基,每孔加入500 μL细胞悬液,培养箱培养48 h。移液枪小心吸去旧培养基,Hanks液清洗2遍,每孔中加入2 mL 50 μg/mL的LPS溶液。孵育24 h后加入2 mL IAA,终质量浓度为25、50 μg/mL,加入LPS溶液,保持其浓度不变,继续培养12 h。
1.3.4 Western blot测定蛋白表达水平和磷酸化水平
采用Western blot测定炎症因子的表达。细胞孵育完成后,使用组织裂解液提取细胞蛋白,蛋白浓度配平后按体积比1∶4加入蛋白上样缓冲液,随后在金属浴中煮沸5 min即可。使用SDS-PAGE分离蛋白质,分离胶浓度为12%(体积分数),浓缩胶浓度为5%(体积分数)。其电压分别为80 V与120 V,时间为40 min与80 min。电泳结束后,于冰水浴中将胶上的蛋白转到聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上(200 mA,80 min)。转膜完成后,将PVDF膜置于封闭液中,室温静置2 h封闭,一抗4 ℃孵育过夜。TNF-α、IL-1β、IKK、p-IKK、NF-κB、p-NF-κB以体积比1∶1 000稀释;GAPDH、IκB、p-IκB以体积比1∶1 000稀释。用加入吐温20的Tris 盐缓冲液(Tris buffered saline with Tween-20, TBST)洗膜,共4次,每次5 min。根据一抗选择对应的二抗并按1∶5 000 稀释,室温孵育2 h。TBST洗4次,每次15 min,加入ECL试剂进行显色,使用凝胶成像系统进行显影,Image J分析软件计算每个条带的灰度值用于分析结果。
1.4 数据统计及分析
所有实验结果次数均不少于3次,数据结果以“平均值±标准误(standard error of measurement,SEM)”表示,使用Graphpad Prism 8.0对实验数据进行处理及分析,当P<0.05时,其结果被认为是显著的。
2 结果与分析
2.1 IAA对SH-SY5Y细胞存活率的影响
SH-SY5Y细胞系,源自SK-N-SH神经母细胞瘤细胞系的亚克隆,是研究神经退行性病变的常用体外神经元模型。为了使SH-SY5Y细胞获得更多神经元样特性,如神经元突起和形态变化,通常使用全反式维甲酸进行诱导分化[15]。LPS作为革兰氏阴性菌外膜的主要成分,其不仅具备免疫刺激等多种生物学功能,还能使细胞合成并释放多种细胞因子和炎症介质[16],是常用的炎症模型诱导剂[17]。
为深入探究IAA对脑部炎症的调控机制,本研究构建了LPS诱导的SH-SY5Y细胞炎症模型。首先通过细胞存活率的检测对LPS的诱导浓度进行筛选,实验结果表明,25 μg/mL的LPS就可以引起SH-SY5Y细胞存活率的降低(P<0.05),而更高的作用质量浓度(50、100、200 μg/mL)对细胞存活率的影响更显著,但不同浓度组的细胞存活率并无明显差异(图1-a)。因此,在后续的实验中以50 μg/mL作为LPS的工作浓度。继而本研究探究了IAA对细胞存活率的影响,利用不同浓度的IAA处理SH-SY5Y细胞的结果显示,当IAA的质量浓度为25、50、100 μg/mL时,细胞存活率无明显变化,说明该浓度下IAA并未对细胞产生明显的毒性作用。然而,当质量浓度增加至200、400 μg/mL时,细胞存活率显著降低(P<0.05)(图1-b)。因此,后续实验中选择25、50 μg/mL作为IAA的工作质量浓度。
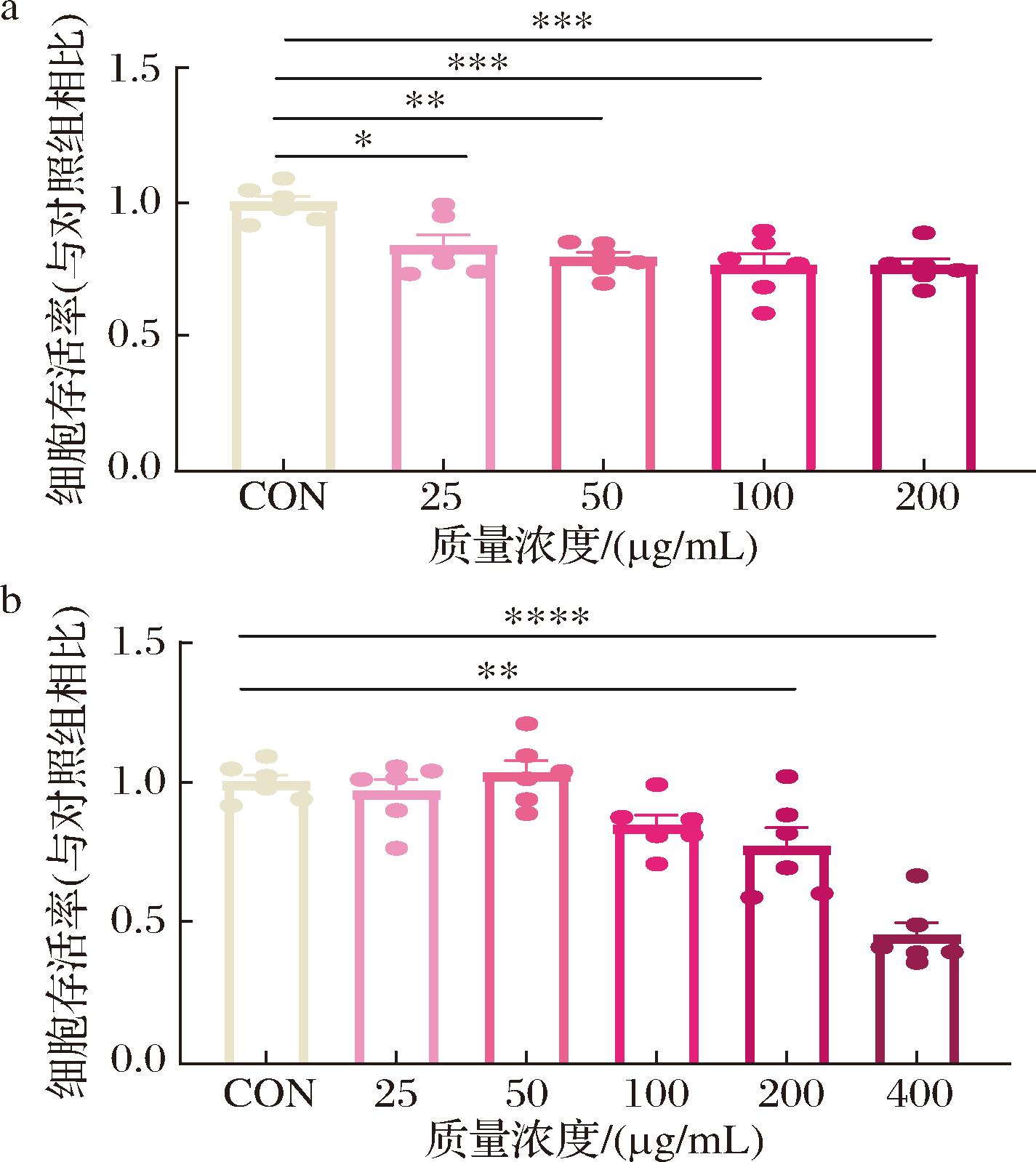
a-LPS对细胞存活率的影响;b-IAA对细胞存活率的影响
图1 不同浓度吲哚乙酸与脂多糖浓度对细胞存活率的影响
Fig.1 Effects of different concentrations of IAA and LPS on cell viability
注:*表示P<0.05,**表示P<0.01,***表示P<0.001, ****表示P<0.000 1(下同)。
2.2 IAA对SH-SY5Y细胞炎症因子表达的影响
白细胞介素,作为一种由白细胞分泌的细胞因子,在细胞间起着重要的调节作用,对于免疫细胞的激活等关键功能具有不可或缺的作用[18]。它呈现出促炎和抗炎的双重特性[19]。IL-1β已被广泛用作衡量机体炎症水平的标志物,同时被认为与某些神经退行性疾病的发病过程紧密相关[20]。TNF-α在诸多慢性炎症过程中同样扮演着举足轻重的角色[21]。因此,通过测定这2种炎症因子的水平,可以有效地评估机体的炎症状态。
本研究将LPS与IAA共同作用于SH-SY5Y后,检测了细胞中TNF-α与IL-1β的蛋白表达水平。实验结果(图2)显示,LPS诱导SH-SY5Y后,细胞中TNF-α与IL-1β的表达水平明显上升。然而,当细胞与LPS共同孵育,并加入任意浓度的吲哚乙酸时,这2个炎症因子的蛋白表达量均显著降低(P<0.05)。这一结果表明,吲哚乙酸能够显著降低SH-SY5Y细胞的炎症水平,从而发挥了一定的保护作用。这个发现为深入研究吲哚乙酸的神经保护机制提供了有力支持。进一步的研究将有助于揭示吲哚乙酸如何影响炎症,并探索其在治疗神经系统疾病中的潜在应用价值。
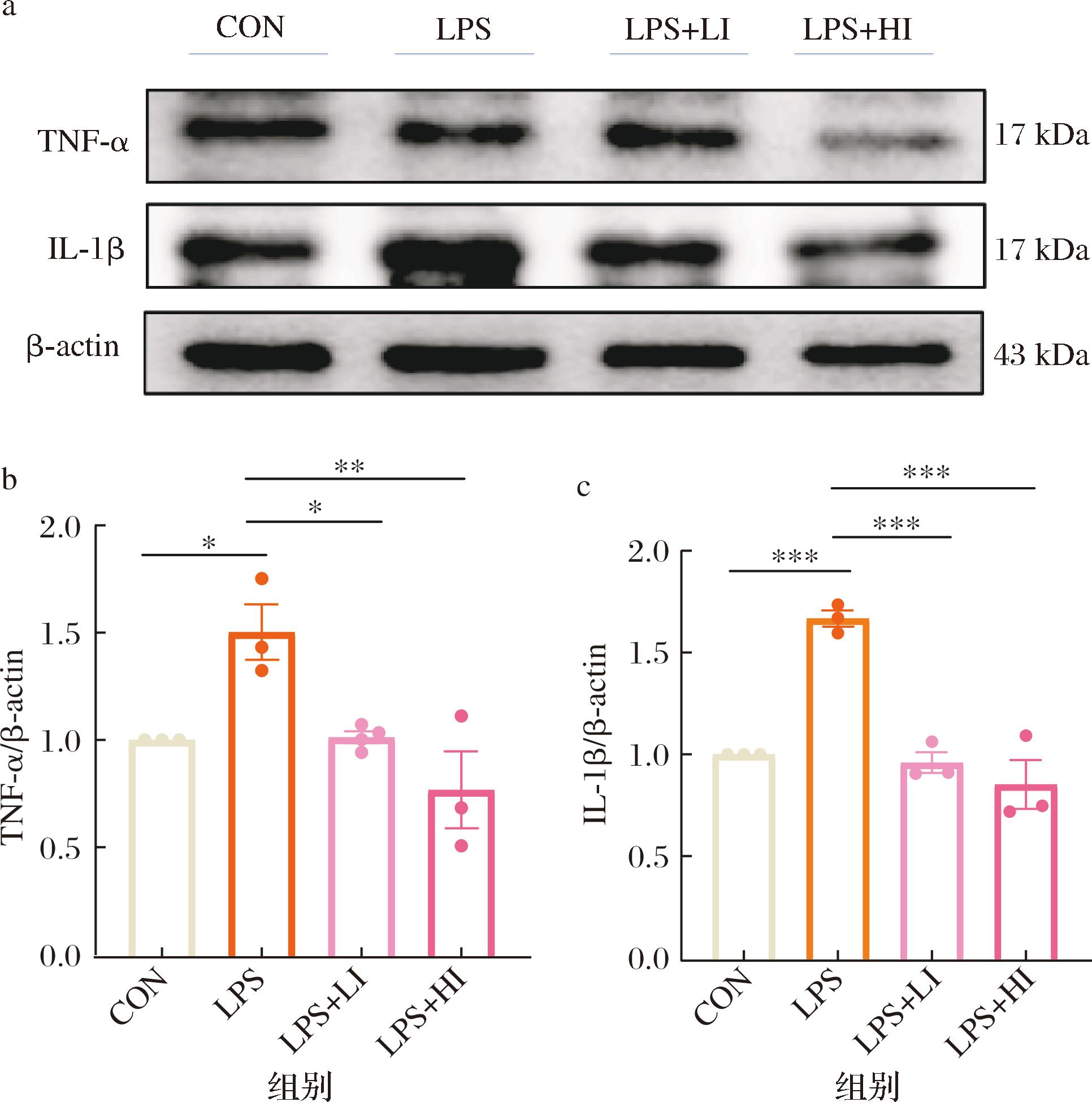
a-Western blot结果图;b-TNF-α定量结果;c-IL-1β定量结果
图2 IAA对细胞炎症因子表达的影响
Fig.2 Effects of IAA on the expression of cellular inflammatory factors
2.3 IAA对Tnfrsf25/IKK/NF-κB信号通路的调控作用
TNF-α等细胞因子的表达受到NF-κB信号通路的调控。NF-κB在细胞内以异源二聚体的形式存在,由p50/p52和p65等蛋白组成,并与IκB结合形成复合物,从而处于失活状态。当细胞受到来自于细胞外的刺激,例如细胞因子对细胞表面受体的激活时,级联信号导致IKK被激活。当IKK被激活后,它会磷酸化IκB。这一磷酸化过程触发了IκB的泛素化,最终导致其降解。由此,原本被IκB蛋白所遮蔽的NF-κB 得以释放,并迁移至细胞核内,与DNA结合并促进一些特定的靶基因的转录和表达。这些靶基因广泛参与炎症反应、细胞增殖及凋亡等复杂生物过程[22],包括TNF-α、IL-1β、IL-6和IL-2等基因,而这些炎症因子的释放又会重新激活NF-κB,形成一个循环,从而进一步加重疾病的发病过程。
现有研究表明,LPS可通过激活肿瘤坏死因子超家族成员15(tumor necrosis factor superfamily member 15,Tnfsf15)来释放炎症因子[23],从而增加机体的炎症水平。本研究为了进一步阐明IAA调控神经炎症的分子机制,对Tnfrsf25/IKK/NF-κB信号通路的关键调控蛋白的激活情况进行了检测,结果如图3所示。在LPS诱导后,SH-SY5Y细胞的Tnfrsf25蛋白表达水平明显上升,说明LPS造成了Tnfrsf25/IKK/NF-κB信号通路的激活。然而,当加入25或50 μg/mL的IAA干预后,SH-SY5Y细胞中Tnfrsf25蛋白表达水平以及IKK和IκB的磷酸化程度均显著降低,但只有50 μg/mL的IAA显著降低了NF-κB的磷酸化程度,表明IAA可通过抑制Tnfrsf25/IKK/NF-κB信号通路的激活调控神经炎症,具体机制如图4所示。
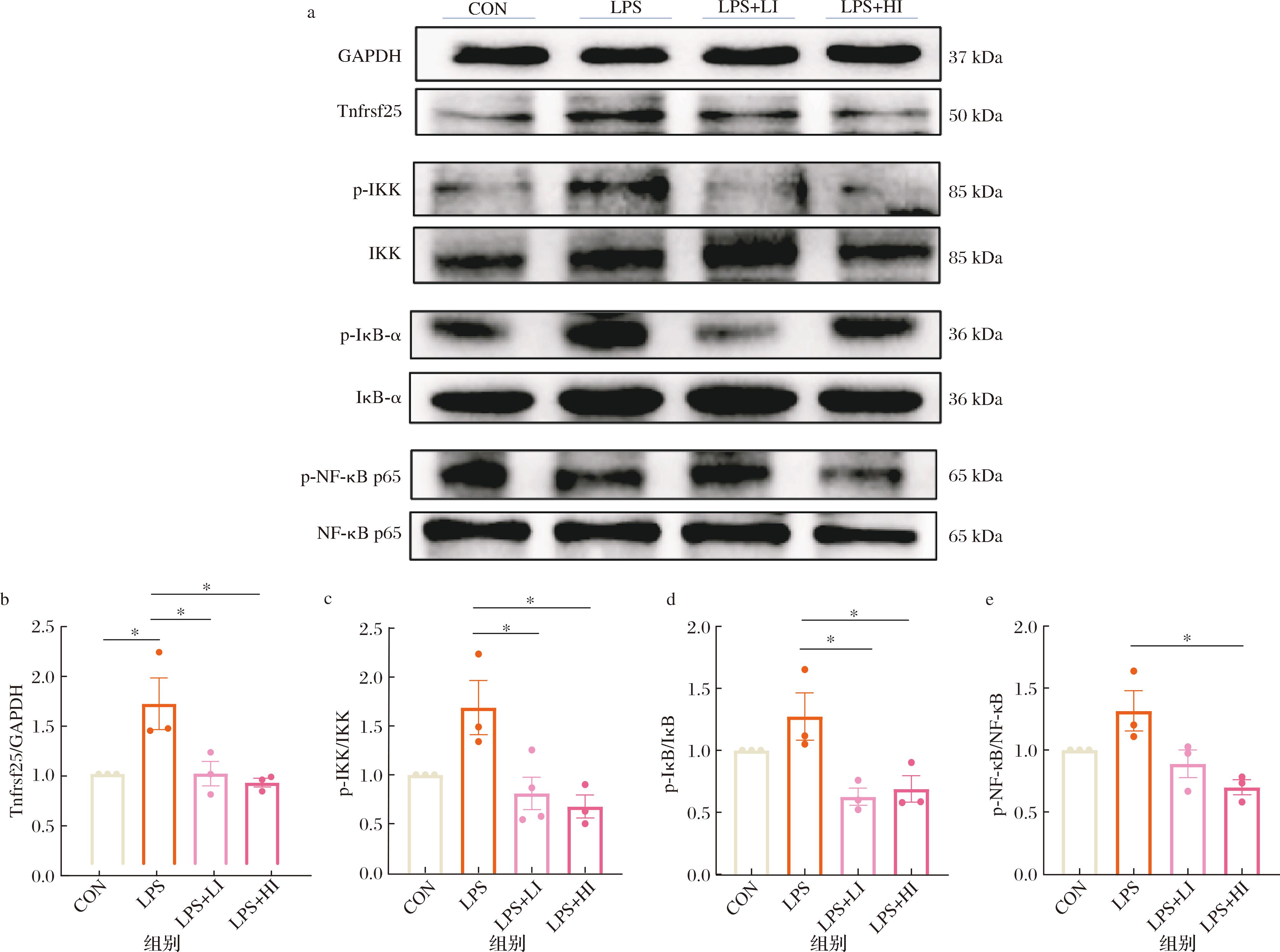
a-Western blot结果图;b-Tnfrsf25定量结果;c-p-IKK定量结果;d-p-IκB定量结果;e-p-NF-κB定量结果
图3 Tnfrsf25/IKK/NF-κB信号通路激活情况
Fig.3 The activation status of the Tnfrsf25/IKK/NF-κB signaling pathway
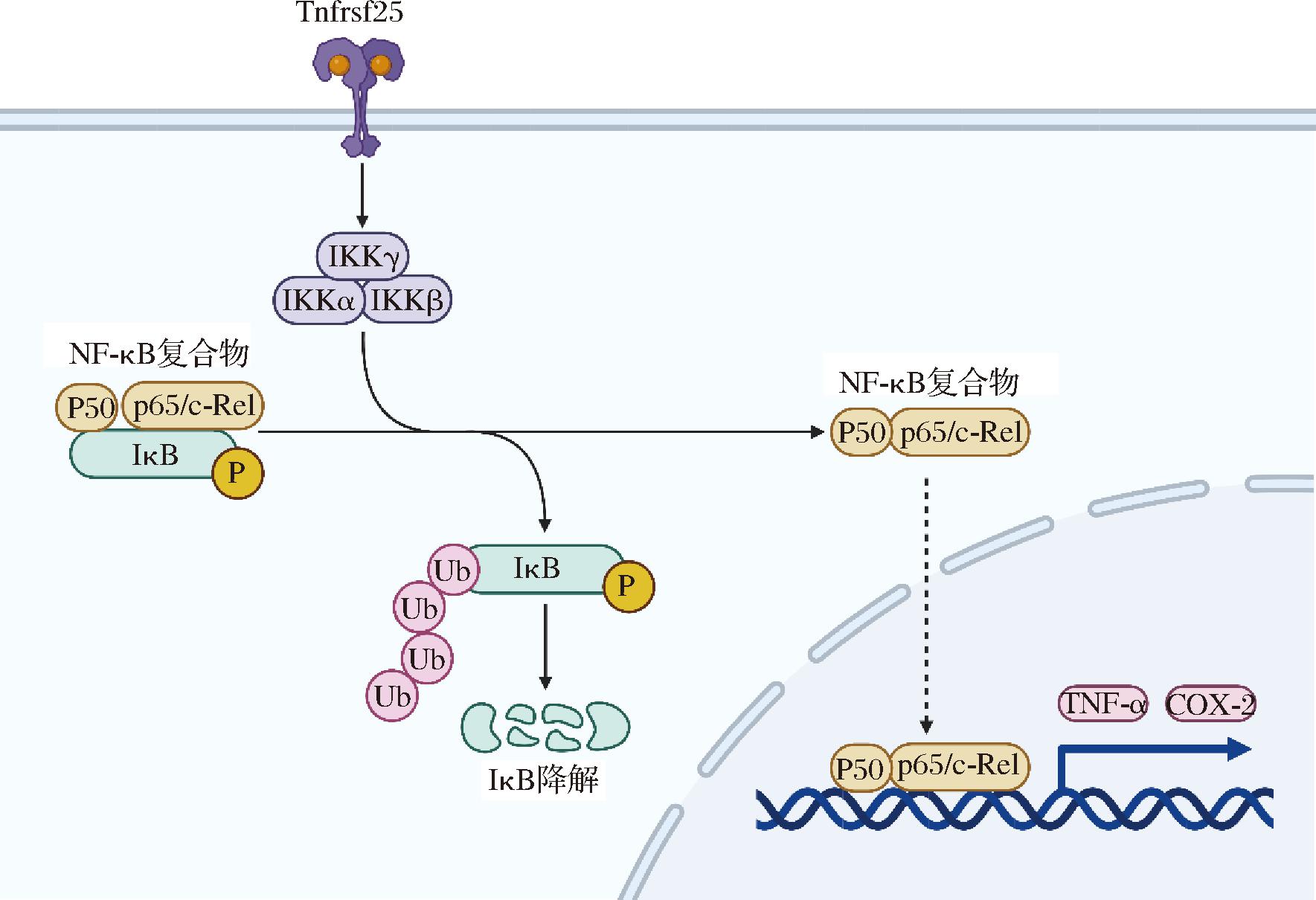
图4 Tnfrsf25/IKK/NF-κB信号通路机制图
Fig.4 A mechanism diagram of the Tnfrsf25/IKK/NF-κB signaling pathway
3 结论与讨论
长期存在的神经炎症会造成线粒体的损伤[24],增加血脑屏障的通透性[25],进而导致神经疾病的恶化。因此,降低机体内神经炎症水平是缓解疾病进程的可行策略。其中通过活性物质特别是食品活性物质或其代谢产物对神经炎症的直接调控是研究的重要方向之一。作为一种色氨酸代谢物,IAA在抑制炎症方面具有良好活性。SHEN等[26]的研究证明,IAA可缓解小鼠的强直性脊柱炎,同时显著改善了肠黏膜屏障功能。此外,IAA对线粒体也有一定调节作用。研究结果表明,IAA具有提升肝脏过氧化物酶体增殖物激活受体γ共激活因子1表达水平的能力,这一作用有助于改善线粒体呼吸功能[27]。然而,目前关于IAA调控神经炎症的研究尚无详细报道,极大地限制了其在调控神经炎症的应用。
本研究通过SH-SY5Y细胞炎症模型,明确了低剂量IAA对细胞生长无不利影响,并且可以显著抑制LPS诱导的细胞炎症因子TNF-α与IL-1β表达的升高,进一步对分子机制的研究发现IAA可以显著降低Tnfrsf25的蛋白水平和p-IKK、p-IκB以及p-NF-κB的水平,证明IAA通过抑制Tnfrsf25/IKK/NF-κB信号通路调节神经炎症。本研究为IAA等色氨酸代谢物在调控神经炎症改善脑健康方面的应用提供了理论基础。
[1] PLATTEN M, NOLLEN E A A, RÖHRIG U F, et al.Tryptophan metabolism as a common therapeutic target in cancer, neurodegeneration and beyond[J].Nature Reviews. Drug Discovery, 2019, 18(5):379-401.
[2] TINTELNOT J, XU Y, LESKER T R, et al.Microbiota-derived 3-IAA influences chemotherapy efficacy in pancreatic cancer[J].Nature, 2023, 615(7950):168-174.
[3] JI Y, GAO Y, CHEN H, et al.Indole-3-acetic acid alleviates nonalcoholic fatty liver disease in mice via attenuation of hepatic lipogenesis, and oxidative and inflammatory stress[J]. Nutrients, 2019, 11(9):2062.
[4] JI Y, YIN W Z, LIANG Y, et al.Anti-inflammatory and anti-oxidative activity of indole-3-acetic acid involves induction of HO-1 and neutralization of free radicals in RAW264.7 cells[J] International Journal of Molecular Sciences, 2020, 21(5):1579.
[5] CHASAIDE C N, LYNCH M A.The role of the immune system in driving neuroinflammation[J].Brain and Neuroscience Advances, 2020, 4:2398212819901082.
[6] ZHANG F J, JIANG L L.Neuroinflammation in Alzheimer’s disease[J].Neuropsychiatric Disease and Treatment, 2015, 11:243-256.
[7] LEE J K, TRAN T, TANSEY M G.Neuroinflammation in Parkinson’s Disease[J].Journal of Neuroimmune Pharmacology, 2009, 4(4):419-429.
[8] HOU X, LIANG X, CHEN J F, et al.Ecto-5′-nucleotidase (CD73) is involved in chronic cerebral hypoperfusion-induced white matter lesions and cognitive impairment by regulating glial cell activation and pro-inflammatory cytokines[J].Neuroscience, 2015, 297:118-126.
[9] OZBEN T, OZBEN S.Neuro-inflammation and anti-inflammatory treatment options for Alzheimer’s disease[J].Clinical Biochemistry, 2019, 72:87-89.
[10] WANG Q Q, LIU Y J, ZHOU J W.Neuroinflammation in Parkinson’s disease and its potential as therapeutic target[J].Translational Neurodegeneration, 2015, 4:19.
[11] FABISIAK T, PATEL M.Crosstalk between neuroinflammation and oxidative stress in epilepsy[J].Frontiers in Cell and Developmental Biology, 2022, 10:976953.
[12] CRAFT J M, WATTERSON D M, VAN ELDIK L J.Neuroinflammation:A potential therapeutic target[J].Expert Opinion on Therapeutic Targets, 2005, 9(5):887-900.
[13] YU H, LIN L B, ZHANG Z Q, et al.Targeting NF-κB pathway for the therapy of diseases:Mechanism and clinical study[J].Signal Transduction and Targeted Therapy, 2020, 5(1):209.
[14] XU W D, LI R, HUANG A F.Role of TL1A in inflammatory autoimmune diseases:A comprehensive review[J].Frontiers in Immunology, 2022, 13:891328.
[15] 梁辰, 邓子辉, 张金英, 等.瘦素降低全反式维甲酸诱导的SH-SY5Y细胞tau蛋白过度磷酸化[J].解放军医学院学报, 2013, 34(5):495-497.LIANG C, DENG Z H, ZHANG J Y, et al.Leptin attenuates all-trans retinoic acid-induced tau protein hyperphosphorylation in SH-SY5Y cells[J].Academic Journal of Chinese PLA Medical School,2013, 34(5):495-497.
[16] SUN Y, HUANG W M, TANG P C, et al.Neuroprotective effects of natural cordycepin on LPS-induced Parkinson’s disease through suppressing TLR4/NF-κB/NLRP3-mediated pyroptosis[J].Journal of Functional Foods, 2020, 75:104274.
[17] XIAO K, HE W X, GUAN W, et al.Mesenchymal stem cells reverse EMT process through blocking the activation of NF-κB and Hedgehog pathways in LPS-induced acute lung injury[J].Cell Death &Disease, 2020, 11(10):863.
[18] MOORLAG S J C F M, RÖRING R J, JOOSTEN L A B, et al.The role of the interleukin-1 family in trained immunity[J].Immunological Reviews, 2018, 281(1):28-39.
[19] AKDIS M, AAB A, ALTUNBULAKLI C, et al.Interleukins (from IL-1 to IL-38), interferons, transforming growth factor β, and TNF-α:Receptors, functions, and roles in diseases[J].Journal of Allergy and Clinical Immunology, 2016, 138(4):984-1010.
[20] NG A, TAM W W, ZHANG M W, et al.IL-1β, IL-6, TNF- α and CRP in elderly patients with depression or Alzheimer’s disease:Systematic review and meta-analysis[J].Scientific Reports, 2018, 8(1):12050.
[21] HORIUCHI T, MITOMA H, HARASHIMA S-I, et al.Transmembrane TNF-α:Structure, function and interaction with anti-TNF agents[J].Rheumatology, 2010, 49(7):1215-1228.
[22] DOLCET X, LLOBET D, PALLARES J, et al.NF-kB in development and progression of human cancer[J].Virchows Archiv, 2005, 446(5):475-482.
[23] SIAKAVELLAS S I, BAMIAS G.Tumor necrosis factor-like cytokine TL1A and its receptors DR3 and DcR3:Important new factors in mucosal homeostasis and inflammation[J].Inflammatory Bowel Diseases, 2015, 21(10):2441-2452.
[24] DI FILIPPO M, CHIASSERINI D, TOZZI A, et al.Mitochondria and the Link Between Neuroinflammation and Neurodegeneration[J].Journal of Alzheimer’s Disease, 2010, 20(Suppl 2):S369-S379.
[25] PETTY M A, LO E H.Junctional complexes of the blood-brain barrier:Permeability changes in neuroinflammation[J].Progress in Neurobiology, 2002, 68(5):311-323.
[26] SHEN J, YANG L J, YOU K, et al.Indole-3-acetic acid alters intestinal microbiota and alleviates ankylosing spondylitis in mice[J].Frontiers in Immunology, 2022, 13:762580.
[27] ZHANG C, FU Q S, SHAO K, et al.Indole-3-acetic acid improves the hepatic mitochondrial respiration defects by PGC1a up-regulation[J].Cellular Signalling, 2022, 99:110442.