结直肠肿瘤是消化道恶性肿瘤之一,其发生发展是一个长期的病理过程。根据具体的发病机制可将其分为散发性结直肠肿瘤和结肠炎相关结直肠肿瘤(colitis-associated colorectal cancer, CAC)两大类。肠道相关炎症促进了炎症向癌症的转化导致CAC的发生,包括溃疡性结肠炎和克罗恩病在内的炎症性肠病是CAC重要的风险因素。长期的慢性炎症会使肠黏膜上皮细胞发生异型增生,高级别的异型增生会突破基底膜发展成为浸润性肿瘤,这一过程被称为CAC发生的“炎症-异型增生-癌”通路[1-2]。
色氨酸(tryptophan, Trp)属于芳香族氨基酸,是人体八大必需氨基酸之一,不能由宿主内源性合成,必须经由食物补充。色氨酸代谢是一个多途径过程。除了用于合成蛋白质的部分外,进入肠道的色氨酸通过3种主要途径代谢:犬尿氨酸途径、血清素途径以及吲哚及其衍生物途径。约4%~6%的色氨酸转运到达大肠并被肠道微生物降解[3]。在菌群的作用下,色氨酸可被转化为吲哚及其衍生物,包括吲哚、吲哚-3-甲醛(indole-3-aldehyde, IAld)、吲哚丙烯酸(indole acrylic acid, IA)、吲哚乳酸(indole-3-lactic acid, ILA)、色胺、吲哚乙酰胺(indole-3-acetamide, IAM)、吲哚丙酸(indole-3-propionic acid, IPA)、以及吲哚乙酸(indole acetic acid, IAA)等[4-5]。
在过去的几年里,吲哚及其衍生物已被证明具有良好的抗炎能力。具体表现为:促进肠道屏障功能;调节宿主免疫反应;增强宿主抗氧化能力。其中,体外结果表明,富含IAld的鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)的培养上清液,在干预结肠淋巴细胞时表现出缓解炎症的有益作用[6-7]。IAld干预能够在结肠炎期间抑制NF-κB信号通路,缓解小鼠肠道炎症[8]。作为结直肠肿瘤的风险因素和发生的主要原因之一,慢性炎症在CAC的发生发展过程中起到对肿瘤的促进作用;另一方面,肿瘤发展过程中慢性炎症持续存在[9]。因而,吲哚类物质可能具有缓解结直肠肿瘤进程中肠道炎症的潜力。使用微生物制剂或其产品可能预防或抑制肿瘤。例如,在临床研究中,补充乳杆菌通过多种途径表现出抗结直肠肿瘤的潜力[10];口服副干酪乳酪杆菌(Lacticaseibacillus paracasei)降低了中度或高度增生性肿瘤的发生率[11]。越来越多的证据表明,除了在肿瘤进展中的作用外,肠道微生物群能够介导化疗和免疫疗法的疗效和毒性。肠道微生物可以使肿瘤治疗受益,能够用作生物标志物来预测治疗反应或不良反应,同时进行调节以改善肿瘤治疗和患者预后反应。本实验室前期研究结果[12]表明,动物双歧杆菌乳亚种(Bifidobacterium animalis subsp.lactis)SHXXA4M1(A4)能够高产IAld(462.9 ng/mL),而同为动物双歧杆菌乳亚种的JSZJ4M1T81(J4)产IAld水平极低(4.8 ng/mL)。因此,通过补充益生菌提高IAld水平进而影响结直肠肿瘤进展过程中的肠道炎症,具有很好的应用价值和研究前景。
1 材料与方法
1.1 实验动物
5周龄C57BL/6 J小鼠(无特定病原体级),中国浙江维通利华实验动物技术有限公司。所有小鼠均被安置在江南大学SPF屏障设施中(温度为20~26 ℃,湿度为40%~70%,12 h光照/黑暗交替),自由摄食及饮水。所用小鼠饲料为Co60辐照实验鼠生长繁殖饲料。采用氧化偶氮甲烷(azoxymethane,AOM)/葡聚糖硫酸钠(dextran sodium sulfate,DSS)法诱发原位CAC小鼠模型。在实验第8天给予模型组和干预组小鼠腹腔注射1次10 mg/kg AOM,从第3周开始给予小鼠含有2.5% DSS的饮用水1周,随后恢复普通饮用水2周,此3周为1个循环,重复此循环2次。第3个循环结束后,小鼠再饮用普通水2周。
1.2 材料与试剂
Fast DNA Spin Kit for Feces粪便DNA提取试剂盒,美国MP Biomedicals公司;2×Taq master mix,江苏康为世纪生物科技有限公司;胶回收试剂盒,杭州倍沃医学科技有限公司;琼脂糖、Qubit dsDNA BR reagent染料、Qubit dsDNA BR buffer,美国Life Invitrogen公司;商品化mGAM培养基粉末、氯化血红素、维生素K溶液,青岛日水生物技术有限公司;色谱级甲醇、牛肉浸膏、胰蛋白胨等,国药集团化学试剂有限公司;ZO-1等引物,生工生物工程(上海)股份有限公司;AOM,美国Sigma公司;DSS(MW 36~50 kDa),美国MP Biomedicals公司;BCA(bicinchoninic acid assay)蛋白浓度定量试剂盒、RIPA(radio-immunoprecipitation assay)裂解液、哺乳动物用蛋白酶和磷酸酶抑制剂、4%多聚甲醛固定液,上海碧云天生物技术有限公司;qPCR预混液,南京诺唯赞生物科技股份有限公司;细胞因子IL-10等Elisa试剂盒,美国R&D Systems公司。
1.3 仪器与设备
ME3002E电子分析天平,梅特勒-托利多仪器(上海)有限公司;SW-CJ-1FD洁净工作台,苏州安泰空气技术有限公司;5424R高速离心机,艾本德(上海)国际贸易有限公司;DG250厌氧工作站,英国Don Whitley Scientific公司;Vanquish超高效液相色谱仪和Q-Exactive Plus质谱仪,美国Thermo Fisher公司;ACQUIRE UPLC BEH C18色谱柱(1.7 m,2.110 0 mm),美国Waters公司;CFX96实时定量PCR仪,美国Bio-Rad公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技有限公司;T100 PCR仪,伯乐生命医学产品(上海)有限公司;1510 Multiscan GO全波长酶标仪,美国Thermo Fisher公司。
1.4 实验方法
1.4.1 益生菌菌液的制备
严格按照说明书操作配制mGAM培养基。配制MRSc培养基(g/L):胰蛋白胨10,牛肉浸膏5,乙酸钠5,酵母粉4,葡萄糖20,柠檬酸氢二铵2,MgSO4 0.2,MnSO4 0.05,K2HPO4 2,吐温80 1 mL,半胱氨酸1,pH 6.2±0.2。
将于-80 ℃保存的菌株取出,以4%的接种量用5 mL MRSc液体培养基活化2代,整个过程中在厌氧工作站中操作。菌株第3代长到对数期时取出,3 000 r/min离心10 min后弃去上清液,双歧杆菌菌泥经过无菌生理盐水清洗3次。6 000 r/min,3 min再次离心后得到菌泥和上清液,上清液用于靶向色氨酸代谢组学检测。获得的菌泥利用预冷的30%(体积分数)的蔗糖溶液重悬,计数,贮存于-80 ℃冰箱备用,菌株干预前使用无菌生理盐水配制菌液(活菌数为1×108 CFU/mL)。
1.4.2 益生菌干预CAC小鼠
动物实验共计13周。小鼠在屏障内适应7 d后被随机分为4组∶1)空白组(n=6);2)模型组(n=8);3)动物双歧杆菌乳亚种SHXXA4M1(A4)组(n=8);4)动物双歧杆菌乳亚种JSZJ4M1T81(J4)组(n=8)。A4和J4组小鼠每2 d口服1次对应益生菌菌液(>1×108 CFU/mL)0.2 mL。实验过程中密切记录小鼠每周的体重变化并观察小鼠粪便性状的改变及血便情况;记录小鼠死亡时间及死亡数量。在实验第91天收集小鼠粪便,后安乐死小鼠,收集小鼠脾脏和结肠组织。所有实验程序按照规定进行并经江南大学实验动物管理与动物福利伦理委员会批准,伦理编号为JN.No20230615c1061130[270]。
1.4.3 结肠肿瘤组织上清液细胞因子水平的测定
提取小鼠结肠肿瘤组织上清液。根据说明书测定BCA总蛋白浓度。参照说明书利用ELISA试剂盒测定组织匀浆液中IL-10、IL-1β、IL-17A和IFN-γ水平,最终结果表示为细胞因子浓度/总蛋白浓度(pg/mg蛋白)。
1.4.4 实时荧光定量PCR(real-time quantitative polymerase chain reaction, qPCR)分析实验
通过RNA提取试剂盒提取小鼠总RNA,再根据说明书进行mRNA逆转录获得cDNA,所用引物如表1所示。采用qPCR法测定相关mRNA表达水平,反应具体程序为:1)95 ℃,30 s;2)95 ℃,10 s;3)60 ℃,30 s。重复2)、3)步骤40次循环,采集信号;4)95 ℃,15 s;5)60 ℃,60 s;6)25 ℃,15 s。采集信号,用以分析溶解曲线。
表1 qPCR反应体系所用引物名称和序列
Table 1 The table of primer name and sequence used in qPCR reaction
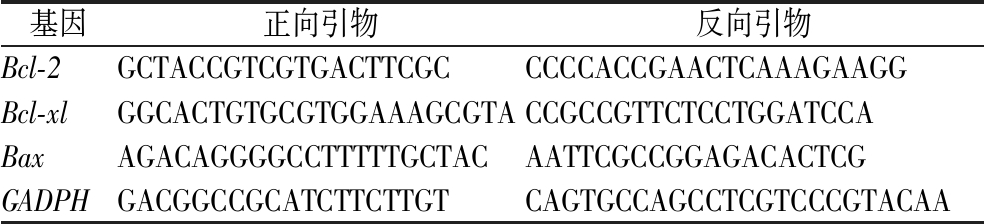
基因正向引物反向引物Bcl-2GCTACCGTCGTGACTTCGCCCCCACCGAACTCAAAGAAGGBcl-xlGGCACTGTGCGTGGAAAGCGTACCGCCGTTCTCCTGGATCCABaxAGACAGGGGCCTTTTTGCTACAATTCGCCGGAGACACTCGGADPHGACGGCCGCATCTTCTTGTCAGTGCCAGCCTCGTCCCGTACAA
1.4.5 靶向色氨酸代谢组学
将100 μL发酵上清液与400 μL预冷的甲醇充分混合,-20 ℃静置30 min。为了去除蛋白质及其他五级杂质,将混合物以20 000×g离心15 min。之后,将400 μL的上清液在45 ℃下真空干燥。将获得的干物质重悬于100 μL的20%甲醇稀释液[V(水)∶V(甲醇)=4∶1]中,并通过0.22 μm微孔滤膜过滤。
称取20 mg小鼠结肠内容物冷冻干燥后与900 μL甲醇混合并在65 Hz下均化3 min,在-20 ℃下放置10 min后混合液于4 ℃下以15 000×g离心10 min。取400 μL上清液在45 ℃下真空干燥,并重悬于100 μL的20%甲醇稀释液中,经过0.22 μm的微孔滤膜过滤后用于上样。
使用Vanquish UHPLC Q-Exactive Plus MS定量结肠内容物中的色氨酸代谢物。具体测定方法参考文献[12]。
1.4.6 粪便16S rRNA测序分析
按照说明书操作利用粪便DNA提取试剂盒提取小鼠粪便菌群DNA。使用特异性引物对16S rRNA V3~V4区进行PCR扩增,并对琼脂糖凝胶电泳得到的目的条带进行纯化和DNA浓度测定。利用Illumina MiSeq高通量测序平台进行测序,使用Qiime2对数据进行分析,具体操作流程参考文献[13]。
1.5 数据处理及分析
多组间的差异显著性采用One-way ANOVA检验,并采用非参数Kruskal-Wallis检验,结果采用平均值±标准误差(mean±SEM)表示。P<0.05时被认为存在显著性差异,具有统计学意义。
2 结果与分析
2.1 高产IAld的动物双歧杆菌A4干预对CAC小鼠肠道炎症的缓解作用
2.1.1 动物双歧杆菌A4的干预对小鼠粪便菌群的影响
为了探究益生菌干预对结直肠癌小鼠肠道菌群物种组成的影响,选取每组相对丰度位于前15的菌属做百分比堆积图。由图1可知,与对照组相比,AOM/DSS造模后,小鼠粪便菌群中双歧杆菌属和瘤胃菌科(Ruminococcaceae)未分类属相对丰度降低,此外丰度降低的还有小鼠肠道优势菌之一的Muribaculaceae科未分类属。同时,模型组粪便菌群中致病菌丰度增加,包括埃希氏菌属(Escherichia)、志贺菌属(Shigella)和Lachnoclostridium属。

图1 动物双歧杆菌干预影响CAC小鼠粪便菌群
Fig.1 Bifidobacterium animalis intervention affected fecal microbiota in CAC mice
注:A4代表高产IAld的动物双歧杆菌SHXXA4M1;J4代表低产IAld的动物双歧杆菌JSZJ4M1T81(下同)。
小鼠的肠道菌群物种组成在A4干预后与模型组相比明显不同,动物双歧杆菌、Eubacterum_xylanophilum_group、乳杆菌属(Lactobacillus)、罗姆布茨菌属(Romboutsia)丰度明显升高。与模型组相比,动物双歧杆菌A4干预后小鼠粪便中双歧杆菌的相对丰度由0.61%显著升高到9.79%(P<0.05);J4干预后双歧杆菌的丰度同样增加,为5.17%(图2)。对小鼠粪便菌群的测定结果说明,口服动物双歧杆菌能够经受胃酸、胆盐等挑战顺利而到达肠道。
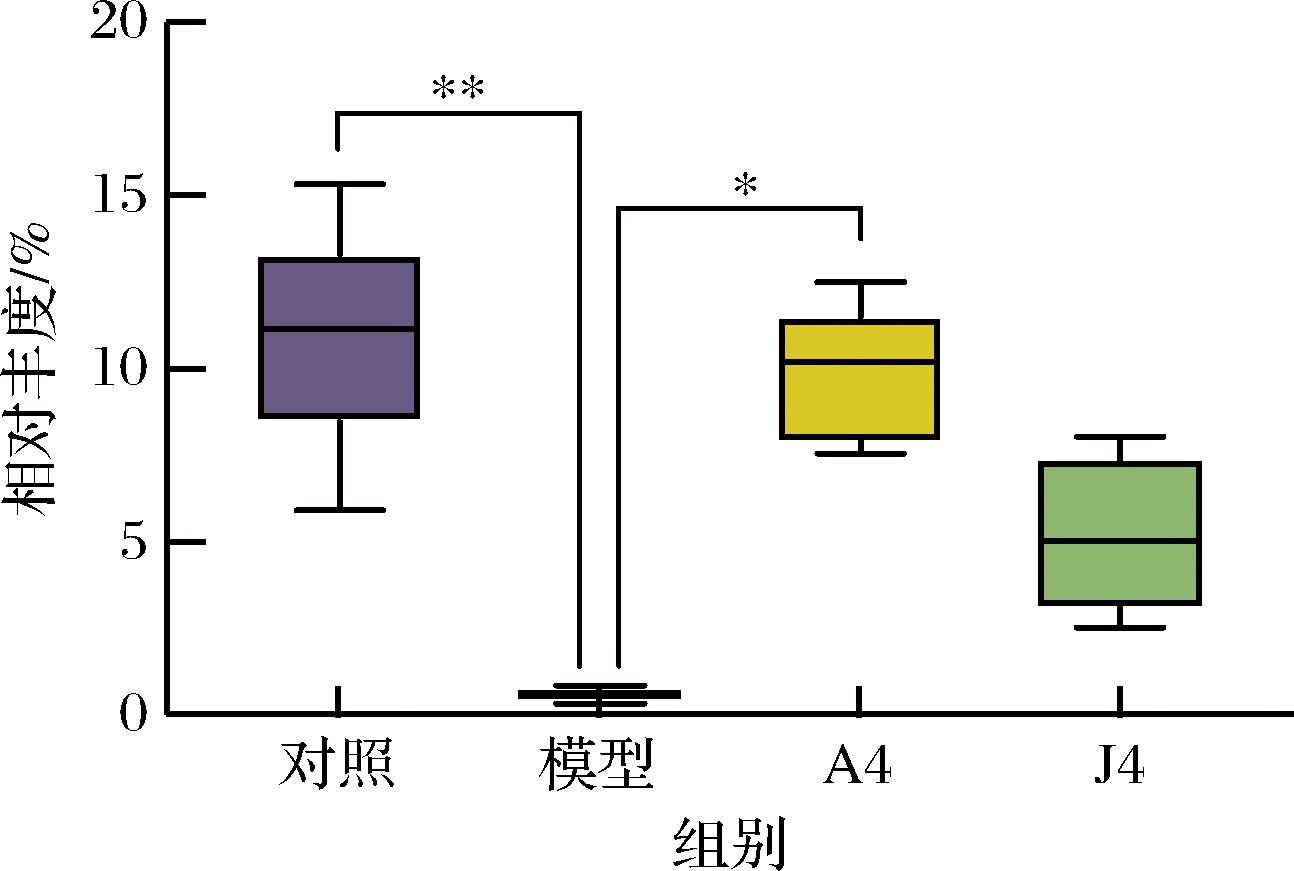
图2 双歧杆菌在CAC小鼠粪便菌群中的相对丰度
Fig.2 Relative abundance of Bifidobacterium in CAC mice fecal microbiota
注:*:P<0.05;**:P<0.01(下同)。
2.1.2 动物双歧杆菌A4的干预对小鼠肠道色氨酸吲哚类代谢物水平的影响
通过靶向代谢组学对小鼠结肠内容物中Trp及吲哚类物质含量的测定结果如图3所示。对照组的Trp中位数值为11 644.131 ng/mL,经过AOM/DSS造模后,小鼠肠道Trp水平较对照组显著下降(P<0.05),表明两组小鼠色氨酸代谢水平存在明显差异。动物双歧杆菌A4干预后,CAC小鼠肠道内色氨酸恢复到与对照组相似水平,中位数含量为10 970.708 ng/mL。IAld在模型组小鼠结肠中的中位数值为18.572 ng/mL,显著低于对照组(151.835 ng/mL,P<0.05);经过口服动物双歧杆菌A4后,IAld水平显著升高至与对照组相似水平157.346 ng/mL(P<0.05);而J4的干预并不能提高CAC小鼠肠道IAld的含量。对于其他吲哚衍生物,仅IAA在J4干预后出现显著变化。结合前期对小鼠菌群结构的分析结果,无论是作为定植菌或“过路菌”,动物双歧杆菌A4的干预被认为能够提高CAC小鼠肠道内IAld的产量。
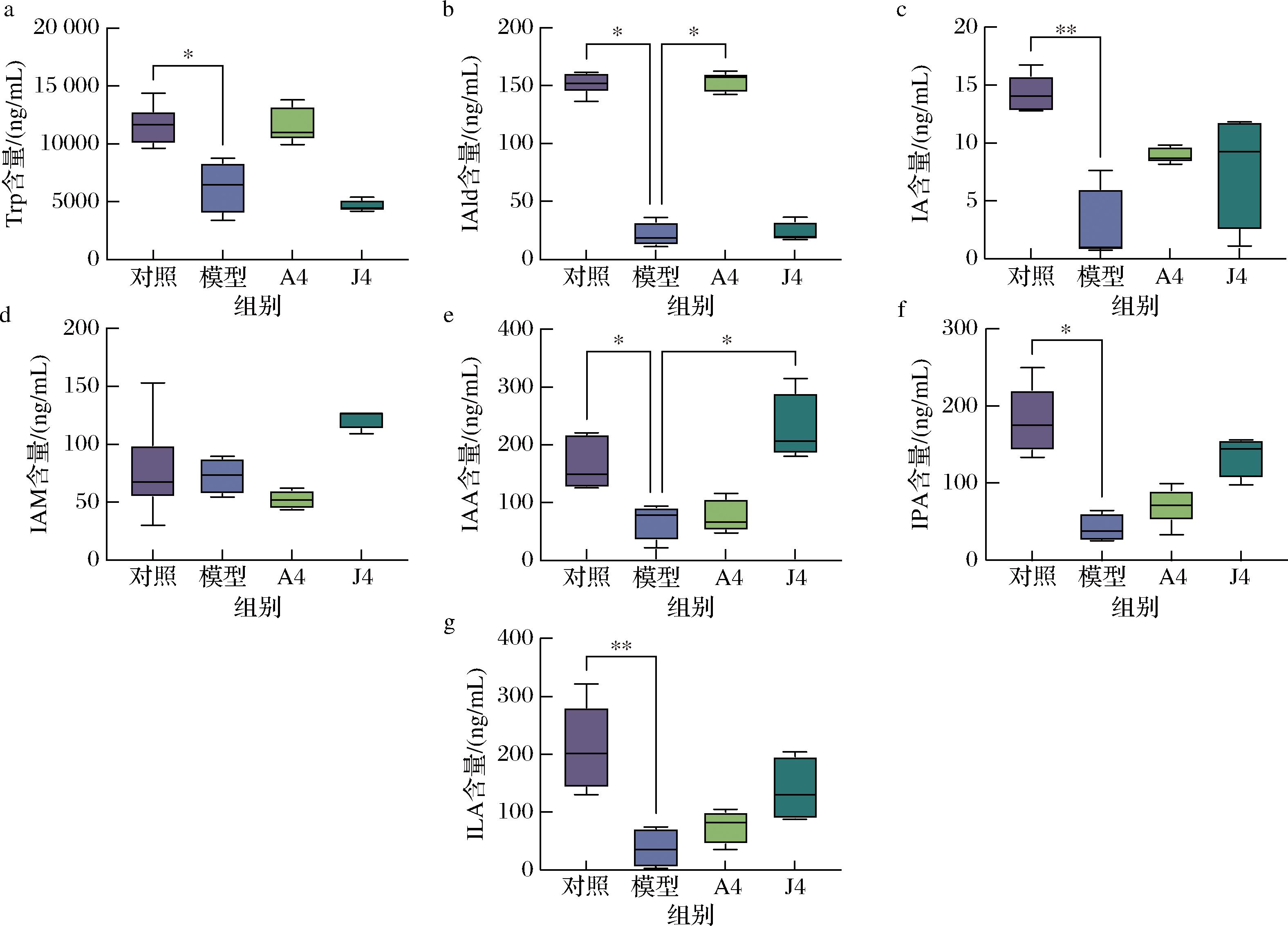
a-Trp含量;b-IAld含量;c-IA含量;d-IAM含量;e-IAA含量;f-IPA含量;g-ILA含量
图3 动物双歧杆菌干预影响CAC小鼠色氨酸吲哚代谢产物
Fig.3 Bifidobacterium animalis intervention affected tryptophan indole metabolites in CAC mice
2.1.3 动物双歧杆菌A4干预对CAC小鼠表观指标的影响
实验期间,对照组小鼠体重持续稳定增长(图4-a)。在每次DSS饮水期间,每组小鼠体重均出现下降,替换正常饮用水后小鼠体重逐渐恢复。第91天时,模型组小鼠平均体重为(24.33±0.51) g (P<0.001,与对照组相比),动物双歧杆菌A4干预使小鼠的平均体重增加至(26.35±0.48) g,而J4组小鼠的平均体重为(25.13±0.34) g,与模型组相比无差异,表明不具备高产IAld能力的菌株干预对小鼠体重减轻无明显改善。此外,益生菌A4的干预缓解了实验过程中小鼠的便血情况。整体存活率也有所提高(图4-b)。相较于对照组,模型组小鼠的结肠组织长度显著缩短(P<0.001,图4-c);而动物双歧杆菌A4干预后,小鼠的结肠长度显著恢复(P<0.05);不具备高产IAld能力的益生菌菌株J4则不能明显恢复小鼠结肠长度的缩短。脾脏作为重要的免疫器官常随着结肠炎相关结直肠癌的发展而出现肿大。对每组小鼠的脾脏指数进行分析发现(图4-d),模型组的平均脾脏指数为0.010,与空白组相比该指数显著升高(P<0.01)。动物双歧杆菌A4干预后能够在一定程度上降低CAC小鼠的脾脏指数,而J4组小鼠脾脏指数与模型组水平相似。以上结果说明,高产IAld的动物双歧杆菌干预CAC小鼠能够减轻因炎症加重所导致的小鼠体重损失、结肠长度缩短、便血严重和脾脏指数升高等情况,同时口服动物双歧杆菌还有利于肿瘤小鼠整体存活率的提高。
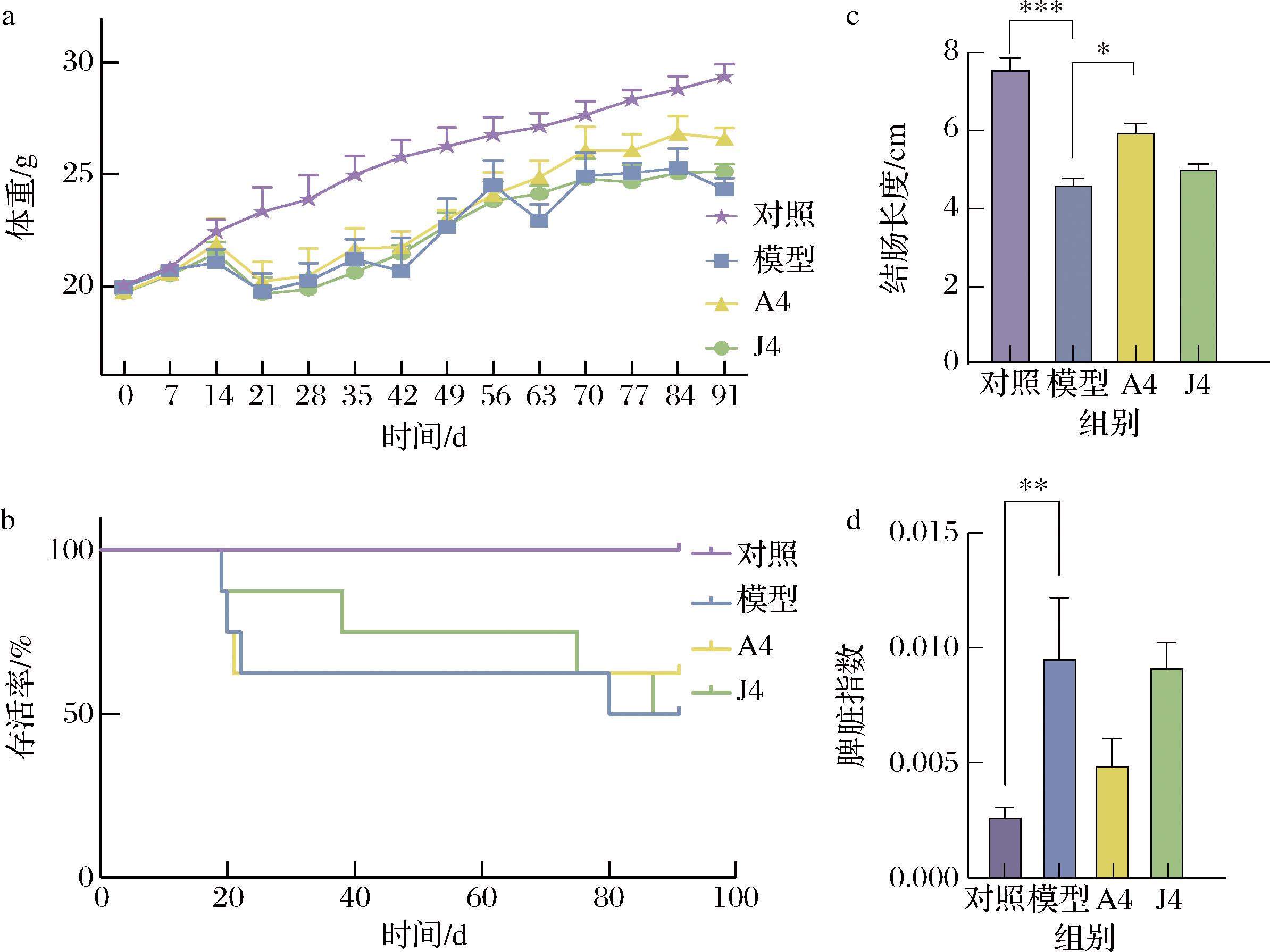
a-小鼠体重;b-小鼠存活率;c-小鼠结肠长度;d-小鼠脾脏指数
图4 动物双歧杆菌干预影响CAC小鼠表观指标
Fig.4 Bifidobacterium animalis intervention affected the apparent index of CAC mice
注:***:P<0.001(下同)。
2.2 动物双歧杆菌A4对CAC小鼠的免疫调节作用
通过ELISA测定促炎因子IL-1β、IL-17A、IFN-γ和抗炎因子IL-10在CAC小鼠结肠肿瘤组织上清液中的含量(图5)。结果发现,模型组小鼠3种炎症因子IL-1β、IL-17A和IFN-γ的表达水平较对照组显著升高(P<0.001),而IL-10的含量低于对照组。与模型组相比,口服A4菌液能够不同程度地降低小鼠结肠IL-1β、IL-17A和IFN-γ的表达水平,同时还能增加IL-10在肠道的含量。以上结果表明,高产IAld的动物双歧杆菌A4能够调节小鼠结肠免疫环境,通过降低炎症因子、提高抗炎因子的表达水平,缓解小鼠肿瘤进程中的炎症反应。
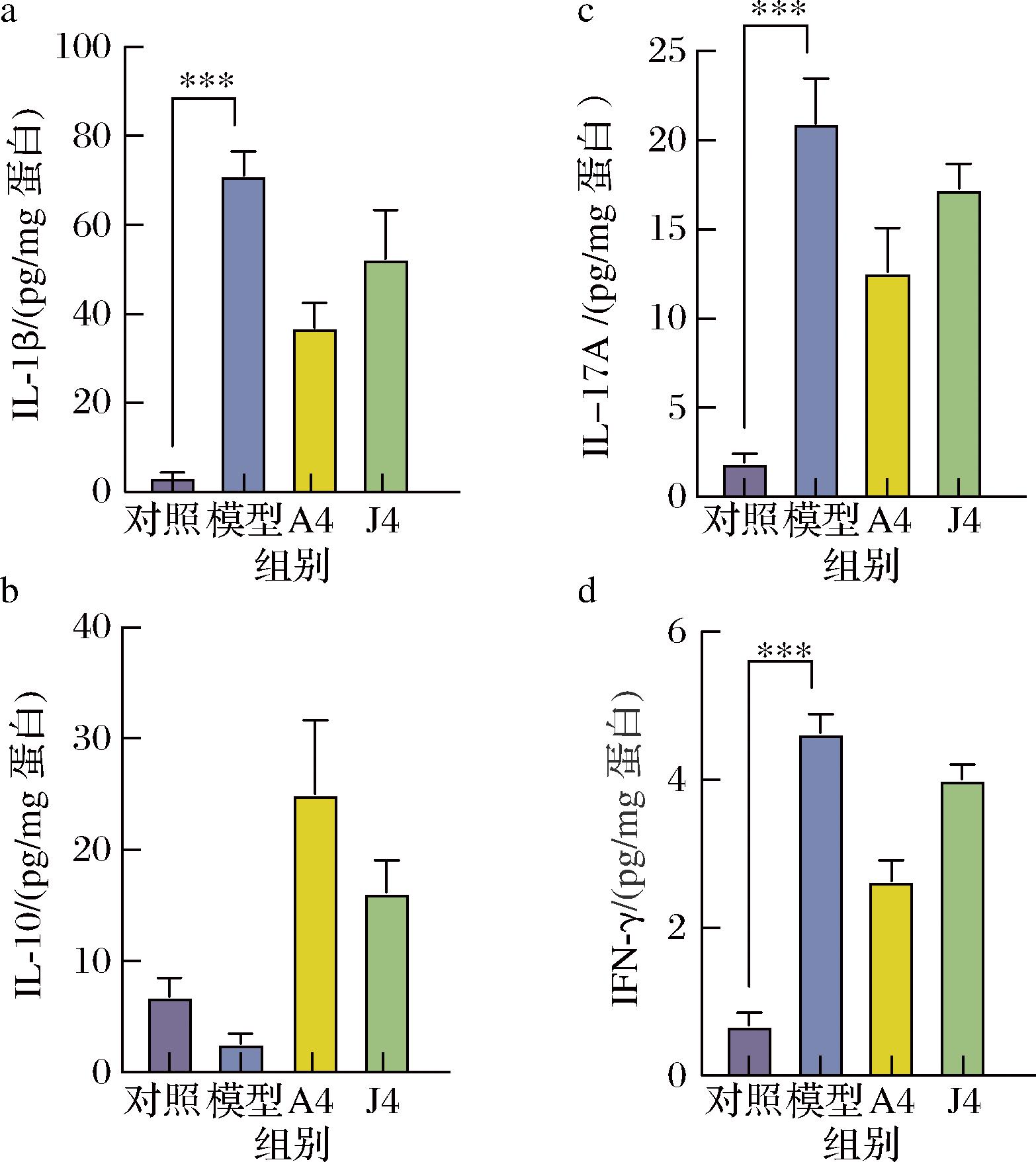
a-IL-1β含量;b-IL-10含量;c-IL-17A含量;d-IFN-γ含量
图5 动物双歧杆菌干预影响CAC小鼠结肠细胞因子水平
Fig.5 Bifidobacterium animalis intervention affected the level of cytokines in CAC mice colon
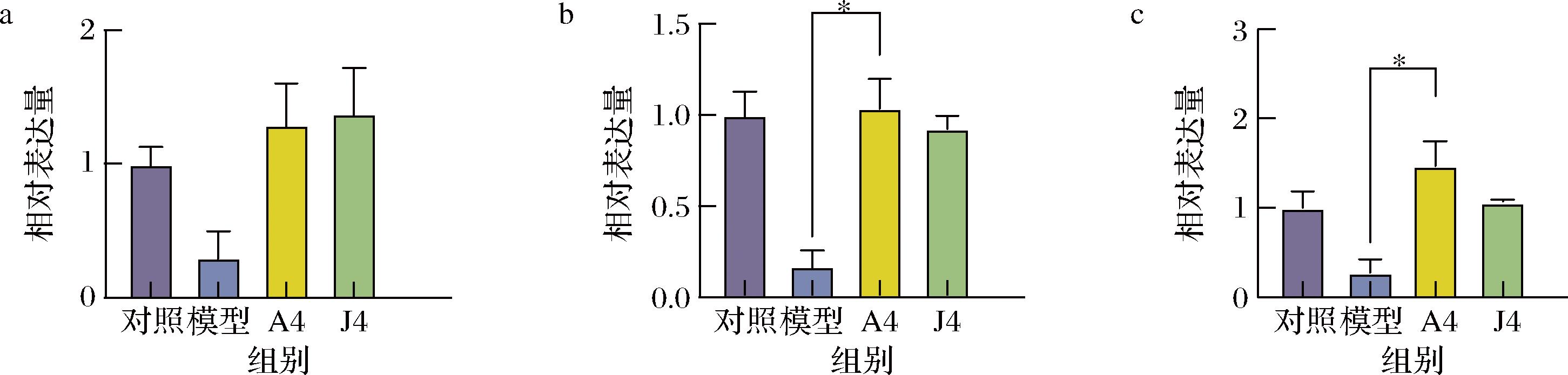
a-Claudin-1相对表达量;b-ZO-1相对表达量;c-Muc2相对表达量
图6 动物双歧杆菌干预影响CAC小鼠肠道屏障相关基因mRNA表达
Fig.6 Bifidobacterium animalis affected the expression of genes related to intestinal barrier in CAC mice
2.3 动物双歧杆菌A4干预对小鼠肠道屏障相关基因mRNA的影响
肠道屏障的完整性在肠道内环境稳定和抑制炎症反应中发挥着重要作用,而结直肠肿瘤的发展过程往往伴随着肠道屏障的损伤。紧密连接蛋白和黏液层蛋白相关基因的表达水平可以评价肠道屏障的损伤情况。如图6所示,与对照组相比,模型组小鼠肠细胞紧密连接蛋白Claudin-1、ZO-1和黏液层蛋白Muc2的mRNA表达量降低。与模型组相比,动物双歧杆菌A4和J4干预均能提高Claudin-1的表达量,ZO-1的相对表达量在A4干预后分别由0.17显著提高至1.03(P<0.05),Muc2的相对表达量也在A4干预后由0.28显著提升至1.47(P<0.05);而口服不具备高产IAld能力的J4对ZO-1和Muc2的表达量增加并无显著效果。以上结果说明,补充高产IAld的动物双歧杆菌能够促进小鼠肠屏障相关基因的表达,维持屏障功能以减轻肿瘤发展过程中的炎症反应。
3 结论
炎症是结直肠肿瘤的重要风险因素。肿瘤相关巨噬细胞、T细胞、自然杀伤细胞和树突状细胞等免疫细胞是肿瘤相关免疫应答的重要成分,其释放的细胞因子在启动和发挥抗肿瘤保护性免疫作用中具有关键作用[14]。结直肠肿瘤患者具有黏膜溃疡、隐窝细胞凋亡、炎症浸润等多种炎症相关的临床病理学特征,因此,能够抵抗慢性炎症和组织损伤而存活的细胞对于CAC的发生发展极为关键[15]。黏液层是维持肠道屏障功能的物理屏障,杯状细胞产生的黏蛋白对形成这种保护层至关重要,而在结直肠肿瘤患者中往往表现出黏蛋白的缺乏。由L.acidophilus、B.bifidum和B.infantum组成的益生菌混合物已被发现可以增强Muc2、紧密连接蛋白ZO-1和occludin的表达[16]。本研究同样发现动物双歧杆菌SHXXA4M1提高了CAC小鼠结肠组织中Muc2、ZO-1和Claudin-1的mRNA相对表达量。
已有研究表明,结直肠肿瘤患者的粪便代谢物中犬尿氨酸/Trp比例增加,但总吲哚/Trp比例降低[17],表明产生吲哚衍生物微生物的减少和/或产生犬尿氨酸代谢物的微生物增加。近年来,越来越多的研究表明,使用微生物制剂或其相关产品可以使肿瘤治疗受益。因此,通过益生菌干预以调节机体各类代谢物水平被认为是一种具有前景的CAC治疗策略。据报道,补充包括罗伊氏乳杆菌在内的3种乳杆菌被发现能够通过提高IAA水平激活芳香烃受体信号通路减轻结肠炎小鼠炎症[18]。植物乳杆菌也被证明能够提高ILA的产量通过调节CD8+T细胞的功能减轻结直肠肿瘤发展过程中的肠道炎症[19]。对于动物双歧杆菌在结肠炎相关肿瘤小鼠疾病进程中对肠道炎症的影响研究相对缺乏。
综上所述,动物双歧杆菌SHXXA4M1的干预显著提高了结肠炎相关肿瘤小鼠结肠内IAld的水平。服用该益生菌不仅使小鼠体重的损失得到恢复、总体存活率提高,还能减轻结肠长度缩短情况并提高脾脏指数,表现出缓解肠道炎症的有益效果。补充高产IAld的动物双歧杆菌后通过调节免疫反应,提高抗炎因子、降低促炎因子水平,改善小鼠的炎症反应。SHXXA4M1还可通过促进紧密连接蛋白和黏蛋白基因表达的增加,维护CAC小鼠肠道机械屏障的完整性。本研究为色氨酸微生物吲哚类代谢物IAld及益生菌动物双歧杆菌在缓解结直肠肿瘤发展过程中的炎症提供了一定的参考,在今后的研究中,可进一步通过敲除IAld生成途径中的相关基因验证IAld的抗炎潜力,对于具体的作用机制也值得进一步深入挖掘。
[1] WALDNER M J, NEURATH M F.Mechanisms of immune signaling in colitis-associated cancer[J].Cellular and Molecular Gastroenterology and Hepatology, 2015, 1(1):6-16.
[2] LASRY A, ZINGER A, BEN-NERIAH Y.Inflammatory networks underlying colorectal cancer[J].Nature Immunology, 2016, 17(3):230-240.
[3] YE X W, LI H Y, ANJUM K, et al.Dual role of indoles derived from intestinal microbiota on human health[J].Frontiers in Immunology, 2022, 13:903526.
[4] LIU Y F, PEI Z M, PAN T, et al.Indole metabolites and colorectal cancer:Gut microbial tryptophan metabolism, host gut microbiome biomarkers, and potential intervention mechanisms[J].Microbiological Research, 2023, 272:127392.
[5] AGUS A, PLANCHAIS J, SOKOL H.Gut microbiota regulation of tryptophan metabolism in health and disease[J].Cell Host Microbe, 2018, 23(6):716-724.
[6] LEI C, MU J Y, TENG Y, et al.Lemon exosome-like nanoparticles-manipulated probiotics protect mice from C.diff infection[J].iScience, 2020, 23(10):101571.
[7] TENG Y, REN Y, SAYED M, et al.Plant-derived exosomal microRNAs shape the gut microbiota[J].Cell Host Microbe, 2018, 24(5):637-652.
[8] SCOTT S A, FU J, CHANG P V.Microbial tryptophan metabolites regulate gut barrier function via the aryl hydrocarbon receptor[J].Proceedings of the National Academy of Sciences, 2020, 117(32):19376-19387.
[9] HAN S W, ZHUANG J, WU Y H, et al.Progress in research on colorectal cancer-related microorganisms and metabolites[J].Cancer Management and Research, 2020, 12:8703-8720.
[10] KONISHI H, FUJIYA M, TANAKA H, et al.Probiotic-derived ferrichrome inhibits colon cancer progression via JNK-mediated apoptosis[J].Nature Communications, 2016, 7:12365.
[11] ISHIKAWA H, AKEDO I, OTANI T, et al.Randomized trial of dietary fiber and Lactobacillus casei administration for prevention of colorectal tumors[J].International Journal of Cancer, 2005, 116(5):762-767.
[12] 潘童. 肠道微生物色氨酸代谢特征解析与数据库的构建及应用[D].无锡:江南大学, 2022.
PAN T.Construction and application of the database on tryptophan metabolism characteristics of gut microbes[D].Wuxi:Jiangnan University, 2022.
[13] 方志锋. 双歧杆菌缓解特应性皮炎的作用及机制研究[D].无锡:江南大学, 2020.
FANG Z.Effects and mechanisms of Bifidobacterium on alleviation of atopic dermatitis[D].Wuxi:Jiangnan University, 2020.
[14] JOYCE J A.Therapeutic targeting of the tumor microenvironment[J].Cancer Cell, 2005, 7(6):513-520.
[15] BOPANNA S, ANANTHAKRISHNAN A N, KEDIA S, et al.Risk of colorectal cancer in Asian patients with ulcerative colitis:A systematic review and meta-analysis[J].The Lancet Gastroenterology &Hepatology, 2017, 2(4):269-276.
[16] WANG T, WANG P P, GE W P, et al.Protective effect of a multi-strain probiotics mixture on azoxymethane/dextran sulfate sodium-induced colon carcinogenesis[J].Food Bioscience, 2021, 44:101346.
[17] VENKATESWARAN N, CONACCI-SORRELL M.Kynurenine:An oncometabolite in colon cancer[J].Cell Stress, 2020, 4(1):24-26.
[18] LAMAS B, RICHARD M L, LEDUCQ V, et al.CARD9 impacts colitis by altering gut microbiota metabolism of tryptophan into aryl hydrocarbon receptor ligands[J].Nature Medicine, 2016, 22(6):598-605.
[19] ZHANG Q Q, ZHAO Q, LI T, et al. Lactobacillus plantarum-derived indole-3-lactic acid ameliorates colorectal tumorigenesis via epigenetic regulation of CD8+ T cell immunity[J].Cell Metabolism, 2023, 35(6):943-960.