茶多酚(tea polyphenols,TP)是茶叶中的主要生物活性化合物,具有极佳的抑菌抗氧化性能,在食品工业中有着广泛的应用[1]。卵白蛋白(ovalbumin,OVA)是蛋清中含量最丰富的蛋白质,含有人体所需的所有必需氨基酸,并具有一定的抑菌抗氧化性能,是食品加工中一种良好的功能性成分[2]。但多酚的吸收率、生物利用度较低,大大增加了其在食品工业中应用的成本,而蛋白质是多酚的优良载体,人们往往通过将多酚与蛋白质进行相互作用,弥补多酚的不足。多酚与蛋白相互作用的研究较为广泛,YANG等[3]将扁豆蛋白与茶多酚进行互作,发现互作之后茶多酚的稳定性和功能特性显著提升,茶多酚的利用率大大提高。CHEN等[4]研究了卵白蛋白和阿魏酸之间的相互作用,确定了相互作用类型,且复合物相较于单一物质具有更好的溶解性、乳化性和抗氧化活性。刘丽莉等[5]通过光谱法和分子对接技术研究4种植物多酚与牛血清白蛋白相互作用及其对蛋白质结构的影响,探明不同植物多酚对牛血清白蛋白结构的影响,进而筛选出稳定的植物多酚-牛血清白蛋白复合物。然而,目前关于茶多酚与卵白蛋白复合物应用方面的研究较为缺乏。
为了保护食品免受外界影响,人们通常采用一定的包装来隔绝对食品有害的因子。近年来随着人们对食品安全要求的提高以及对环境的重视,可食膜逐渐取代传统的不可生物降解塑料薄膜,以提供更高质量和更长的保质期[6]。可食用薄膜最常见的基材有蛋白质、多糖、脂质或它们的混合物,通过不同聚合物间的相互作用制备成膜[7]。董轶群等[8]制备了茶多酚-溶菌酶多糖基复合膜用于团头鲂保鲜,复合膜液处理后,其pH值、挥发性盐基氮值和菌落总数的上升趋势较对照组更缓,宰后较佳食用时间延长了4 h左右,鲜度延长了约12 h。SUTHARSAN等[9]制备了以壳聚糖为基材制作可食膜,并添加儿茶素、槲皮素和木犀草素,3种薄膜均能抑制李斯特菌、鼠伤寒沙门氏菌、大肠杆菌和金黄色葡萄球菌的生长,并且在室温下抑制率更高。有效延长了牛肉的保质期,提升了色泽品质。
在应用微生物学的背景下,建模已经成为拓宽对微生物生长的理解的重要工具,此类模型有助于人们在食品安全领域做出科学的决策,以提高新鲜食品的安全性和质量[10]。但现阶段的研究中,使用微生物生长模型的某些参数对微生物状况进行评价的研究极少。
本文拟制备茶多酚-卵白蛋白(TP-OVA)可食膜用于猪肉的保鲜,通过测定猪肉的品质及菌落总数的变化,建立猪肉中微生物的生长模型,结合模型参数研究可食膜的保鲜性能,以期为肉品保鲜方面提供新的思路。
1 材料与方法
1.1 材料与试剂
新鲜猪里脊,河南洛阳大张超市;OVA(分析纯),上海源叶生物科技有限公司;TP(分析纯),上海泰坦科技股份有限公司;壳聚糖(分析纯),西安康诺化工有限公司;平板计数琼脂(生物试剂),北京奥博星生物技术有限责任公司。
1.2 仪器与设备
AMTD-4000电热恒温水浴锅,北京市永光明医疗仪器有限公司;AR214型电子天平,美国Mettler Toledo公司;HP-DSCI型差示扫描量热仪,费尔伯恩实业发展有限公司;DHR-2型流变仪,美国TA公司;BBS-V800型超净工作台,济南鑫贝西生物技术有限公司。
1.3 实验方法
1.3.1 复合膜制备
参考张金凤等[11]的方法,稍作修改。称取2 g OVA加入去离子水中,用磁力搅拌器密封搅拌30 min,制备质量分数为1%的卵白蛋白溶液;称取2 g壳聚糖溶于体积分数1%的乙酸溶液,用磁力搅拌器密封搅拌30 min,制备1%(质量分数)壳聚糖溶液。将二者按体积比1∶1混合,加入一定量的甘油增塑,用磁力搅拌器密封搅拌30 min。向其中加入OVA与壳聚糖总质量的0%、1%、2%、3%、4%(质量分数)的TP,磁力搅拌30 min。
1.3.2 猪肉样品处理
参考席小辉等[12]的方法,稍作修改。猪肉去掉多余脂肪和筋膜,切成约5 cm×4 cm×3 cm的方块,分别涂上不同浓度茶多酚的成膜液,空白组不做处理,均置于4 ℃下保存。
1.3.3 pH测定
参考KONUK TAKMA等[13]的方法测定肉样的pH值,每2 d测定1次,测定至第12天。
1.3.4 差示扫描量热仪测定
参考陈婷婷等[14]的方法,稍作修改。取不同猪肉样品绞碎,各取20 mg密封于坩埚中,放入样品池中,30 ℃下平衡2 min,从30 ℃开始以5 ℃/min的速度升温至100 ℃。
1.3.5 色差测定
参考KIM等[15]的方法,稍作修改。采用色差计于室温下测定不同处理后猪肉的L*、a*、b*值,每个样品重复测定3次,取平均值。
1.3.6 水分分布测定
弛豫时间测定参考罗程等[16]的方法,稍作修改。取3 g样品装入核磁瓶中放于核磁管底部。测试参数为:τ值(90°~180°脉冲)250 μs,重复间隔TR为3 000 ms,重复采样NS为32,回波数为10 000,弛豫时间用CPMG序列测定,每个样品测定3个平行。
核磁成像测定参照盖圣美等[17]的方法,稍作修改。取3 g样品装入核磁瓶中放于核磁管底部。具体参数设置为:中心频率22 MHz,信号采样点数400,采样频率20 kHz,重复采样等待时间1 000 ms,回波时间6 ms,采样层数1,采样厚度2 mm,重复采样次数3。
1.3.7 质构测定
参考赵立等[18]的方法,稍作修改。将猪肉切成1 cm×1 cm×1 cm的方块,采用TA.Plus物性分析仪进行质构,测定猪肉的硬度、弹性、内聚性、咀嚼性和胶黏性,探头型号为P/36,测试高度为20 mm,测试前及测试速度为1 mm/min,测试后速度为50 mm/min,每个梯度重复测定3次,取平均值。
1.3.8 微观结构测定
参考赵谋等[19]的方法,稍作修改。将样品切片,用2.5%(体积分数)戊二醛溶液浸泡固定48 h。用pH 7.4的磷酸盐缓冲液对样品漂洗3次。然后分别用30%、50%、90(体积分数)%乙醇溶液浸泡10 min,再用无水乙醇脱水3次,共脱水60 min。随后将样品冷冻干燥48 h。将干燥后的样品固定到样品台上,在5.0 kV的加速电压下,用扫描电镜在300×进行观察。
1.3.9 菌落总数计数
参考GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法测定肉样的菌落总数,每2 d测定1次,测定至第12天。
1.3.10 微生物生长模型构建
利用Origin非线性曲线拟合功能对微生物的修正Gompertz模型和Logistic模型进行拟合。
1.4 数据处理与统计分析
所涉及到的试验用Origin 2022软件作图,SPSS软件进行显著性分析。
2 结果与分析
2.1 猪肉pH变化
由表1可知,贮藏初期,不同试验组的猪背最长肌pH均有下降趋势,这是因为肌肉代谢活动减缓,无氧糖酵解途径被激活,导致乳酸与磷酸积累,使得肌肉的pH下降[20-21]。随着贮藏时间的增加,猪肉的pH逐渐增加。pH的增加量随着TP的加入呈现先增大后减小的趋势。其中,空白组相较于处理组pH上升幅度最大,第12天时pH值为6.73。壳聚糖(chitosan,CS)处理后的猪肉在第12天时pH值为6.45,低于空白组。而TP-OVA处理的猪肉在第12天仍处于次鲜肉范围。其中TP添加量为2%的膜液pH值仅为6.14,与空白组差异显著(P<0.05),说明TP-OVA膜液处理能够抑制微生物的生长和蛋白质的分解,减缓猪肉在贮藏过程中pH的上升,延长猪肉的保质期。
表1 贮藏过程中猪肉pH的变化
Table 1 Changes in pork pH during storage
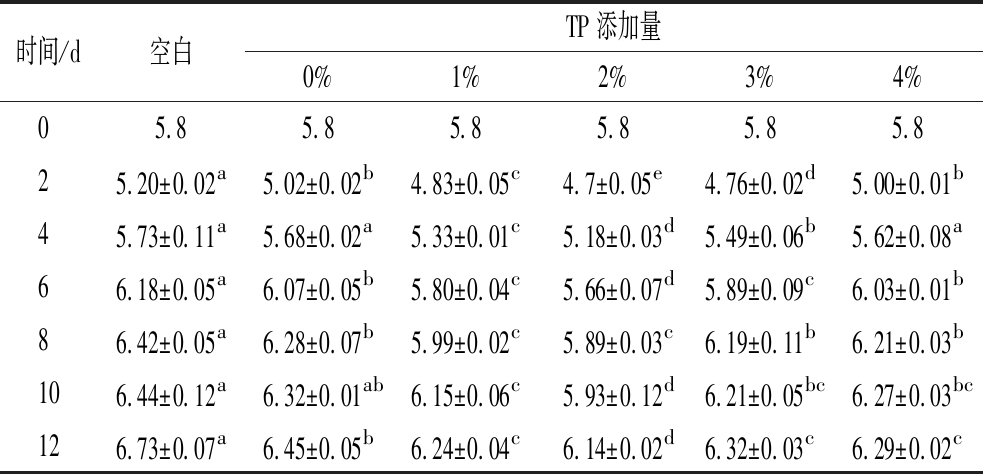
时间/d空白TP添加量0%1%2%3%4%05.85.85.85.85.85.825.20±0.02a5.02±0.02b4.83±0.05c4.7±0.05e4.76±0.02d5.00±0.01b 45.73±0.11a5.68±0.02a5.33±0.01c5.18±0.03d5.49±0.06b5.62±0.08a66.18±0.05a6.07±0.05b5.80±0.04c5.66±0.07d5.89±0.09c6.03±0.01b86.42±0.05a6.28±0.07b5.99±0.02c5.89±0.03c6.19±0.11b6.21±0.03b106.44±0.12a6.32±0.01ab6.15±0.06c5.93±0.12d6.21±0.05bc6.27±0.03bc126.73±0.07a6.45±0.05b6.24±0.04c6.14±0.02d6.32±0.03c6.29±0.02c
注:字母不同表示差异显著(P<0.05)(下同)。
2.2 猪肉热稳定性变化
如图1所示,除4%TP组之外,其他组均有2个峰。第一个热变性温度大小顺序为:空白(52.40 ℃)<3%(54.83 ℃)<0%(55.67 ℃)<1%(57.33 ℃)<2%(58.16 ℃),原因是TP-OVA具有良好的抗氧化性,减缓了猪肉中蛋白质的氧化分解,使得猪肉中的蛋白质具有更好的热稳定性,随着茶多酚添加量的增大,TP-OVA的抗氧化性逐渐增强,峰值向温度高的方向移动,而TP添加量为4%时第一个峰消失可能是因为过量的TP使猪肉中部分蛋白质完全变性,不再因加热出现结构的变化[22]。TP添加量为3%时猪肉的变性温度降低可能是因为过量TP的加入直接导致了猪肉中部分蛋白质结构的改变,使得蛋白的热稳定性下降;而第二个起始热相变温度大小顺序为:空白<3%<4%<0%<1%<2%,其原因与第一个热变性温度相似。
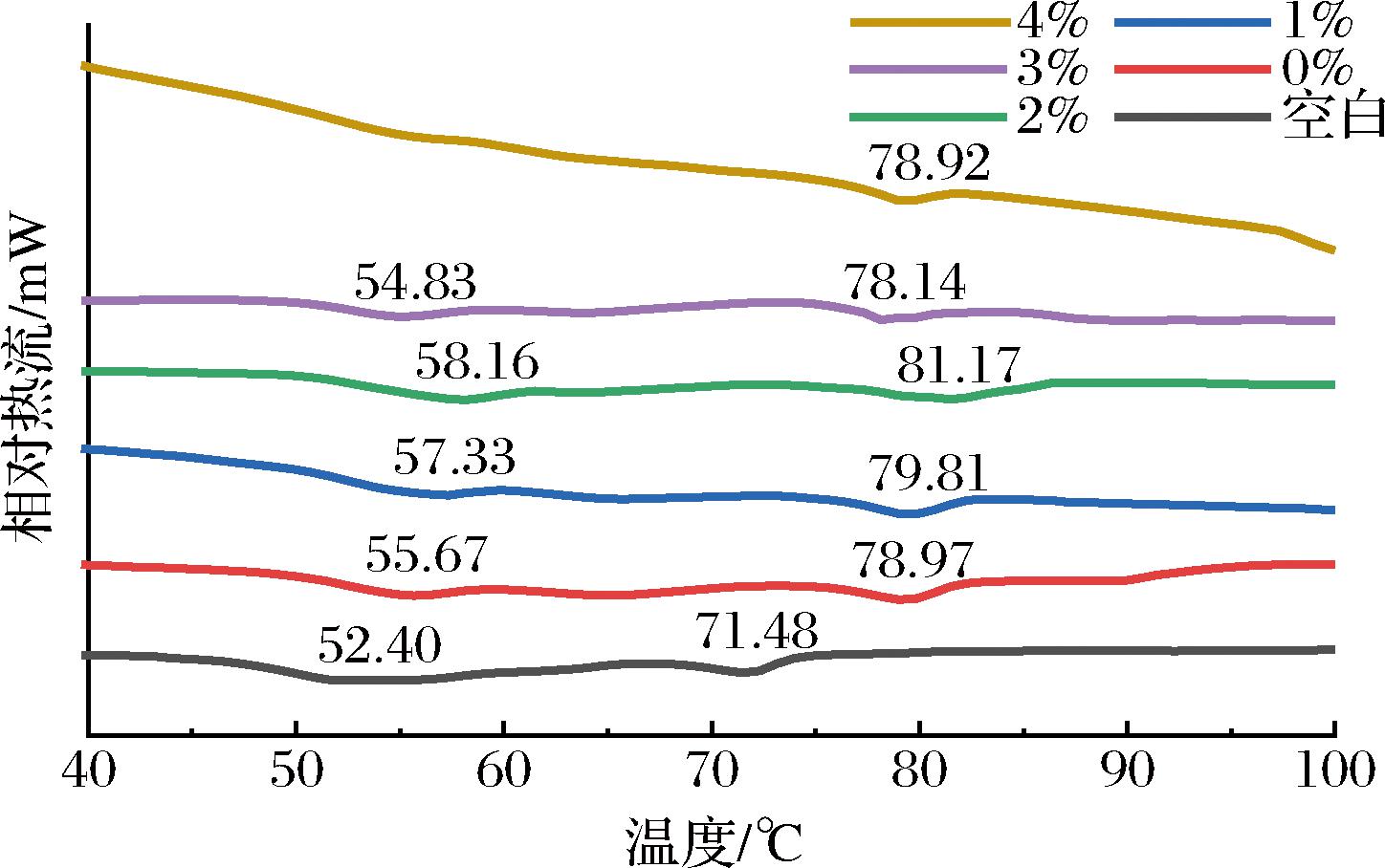
图1 贮藏12 d后猪肉热稳定性的变化
Fig.1 Thermal stability chenges of pork after 12 days of storage
2.3 猪肉色差变化
表2为不同膜液处理的猪肉在贮藏期间的色差值变化,猪肉在贮藏期间,L*值不断增大,主要原因是贮藏过程中猪肉由于自身失水以及微生物的呼吸作用不断有水分渗出,在其表面形成了一层折射层,导致L*值增大[23]。贮藏期间,添加2%TP的膜液处理的猪肉L*值分别为30.01±0.48、33.65±0.59、37.16±0.88、39.07±0.43,始终显著低于其他组(P<0.05),而同一天不同处理组的L*值随着TP添加量的增大呈现出先下降后上升的趋势,原因可能是适量TP的加入能有效抑制微生物的生长,并提升猪肉自身的保水性,但过量的TP会造成TP-OVA的抑菌效果减弱,并破坏猪肉的肌原纤维结构,导致水分流失。随着贮藏时间的延长,猪肉a*值不断减小,其原因是猪肉中的氧合肌红蛋白被氧化为高铁肌红蛋白,颜色由鲜红色转为褐色,导致a*值下降[24]。而贮藏12 d后猪肉的a*值分别为3.59±0.52、4.09±0.38、3.98±0.17、4.24±0.47、3.61±0.24、3.99±0.48,无显著差异(P≧0.05),原因可能是TP本身具有一定的颜色,膜液处理影响了猪肉的a*值,但添加2%TP的膜液处理的猪肉的a*值仍高于其他组,说明其具有良好的抗氧化性,这与周垚卿等[25]的研究结果一致。贮藏期间每组猪肉b*值均不断增加,但无显著差异(P≧0.05),且b*值不作为猪肉色泽的研究重点。
表2 不同膜液处理的猪肉贮藏期间色差变化
Table 2 Colour difference changes of pork during storage in different membrane fluid treatments
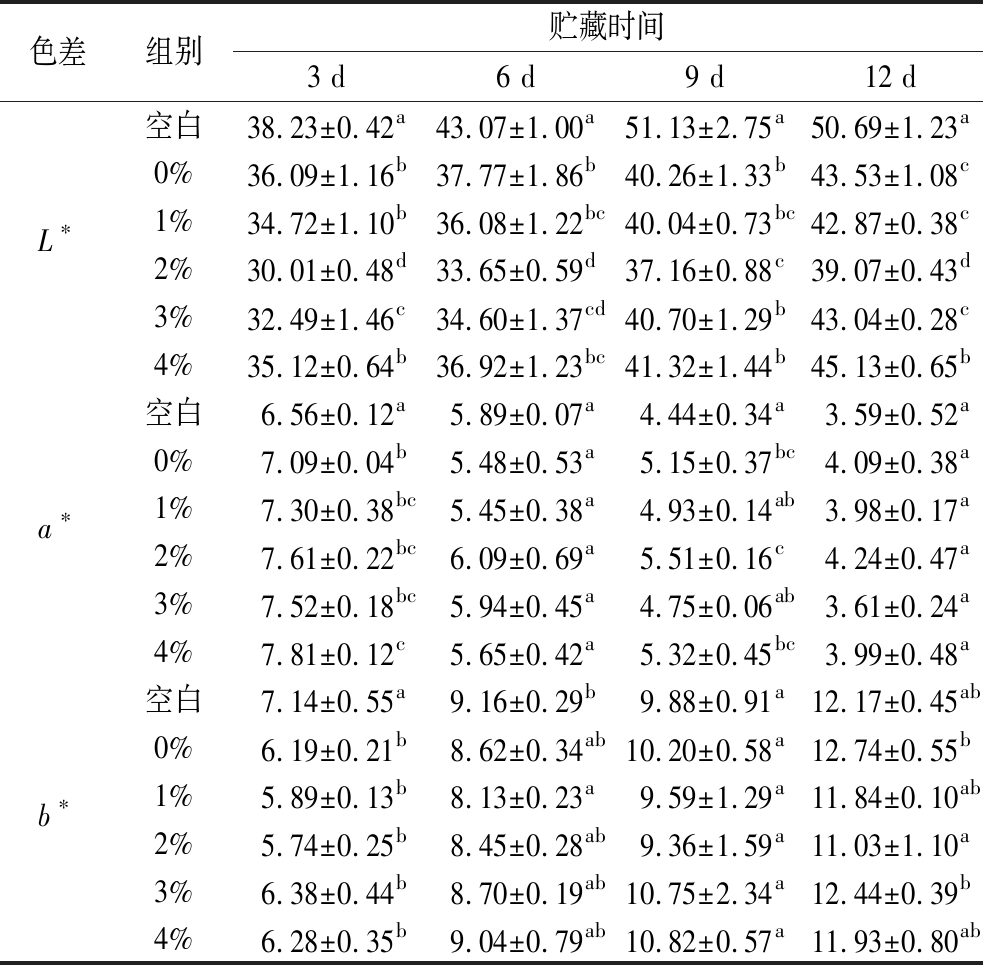
色差组别贮藏时间3 d6 d9 d12 d空白38.23±0.42a43.07±1.00a51.13±2.75a50.69±1.23a0%36.09±1.16b37.77±1.86b40.26±1.33b43.53±1.08cL∗1%34.72±1.10b36.08±1.22bc40.04±0.73bc42.87±0.38c2%30.01±0.48d33.65±0.59d37.16±0.88c39.07±0.43d3%32.49±1.46c34.60±1.37cd40.70±1.29b43.04±0.28c4%35.12±0.64b36.92±1.23bc41.32±1.44b45.13±0.65b空白6.56±0.12a5.89±0.07a4.44±0.34a3.59±0.52a0%7.09±0.04b5.48±0.53a5.15±0.37bc4.09±0.38aa∗1%7.30±0.38bc5.45±0.38a4.93±0.14ab3.98±0.17a2%7.61±0.22bc6.09±0.69a5.51±0.16c4.24±0.47a3%7.52±0.18bc5.94±0.45a4.75±0.06ab3.61±0.24a4%7.81±0.12c5.65±0.42a5.32±0.45bc3.99±0.48a空白7.14±0.55a9.16±0.29b9.88±0.91a12.17±0.45ab0%6.19±0.21b8.62±0.34ab10.20±0.58a12.74±0.55bb∗1%5.89±0.13b8.13±0.23a9.59±1.29a11.84±0.10ab2%5.74±0.25b8.45±0.28ab9.36±1.59a11.03±1.10a3%6.38±0.44b8.70±0.19ab10.75±2.34a12.44±0.39b4%6.28±0.35b9.04±0.79ab10.82±0.57a11.93±0.80ab
2.4 猪肉水分分布变化
低场核磁的测定结果如图2、图3所示,T2弛豫时间显示猪肉组织中存在3种水分:结合水(0 ms<T2b<10 ms)、不易流动水(10 ms<T21<100 ms)和自由水(100 ms<T22<1 000 ms)。随着T2弛豫时间的延长,水分子更易流动。各处理组猪肉中结合水、不易流动水的弛豫时间无明显变化。随着TP的加入自由水的比例呈现出先减小后增大的趋势,原因是TP可以抑制猪肉肌原纤维蛋白侧链基团的氧化,维持蛋白质的胶凝特性,降低猪肉蛋白质和肌肉组织破坏程度,提升猪肉的持水率。
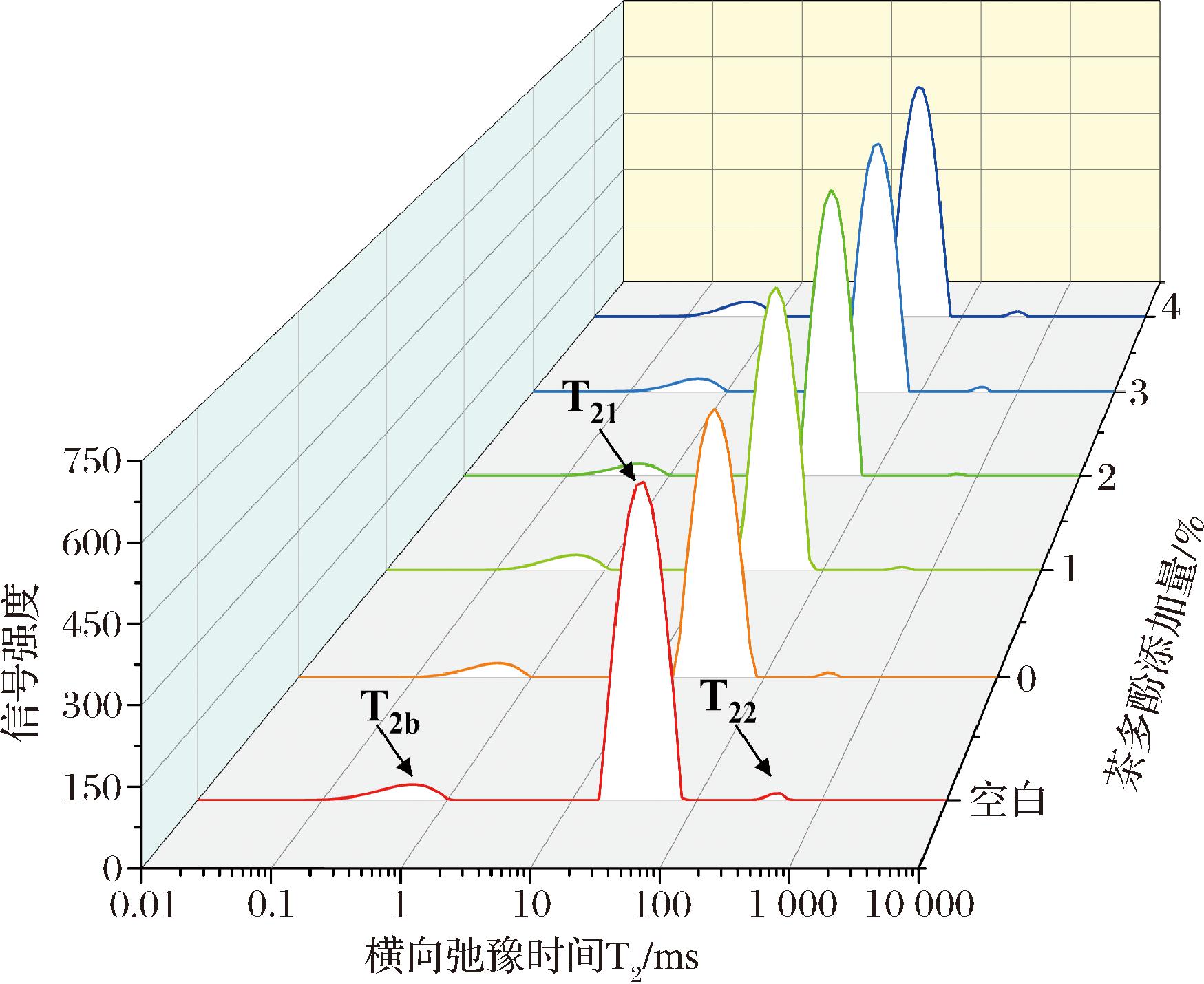
图2 贮藏12 d后猪肉水分弛豫时间的变化
Fig.2 Water relaxation time changes of pork after 12 days of storage
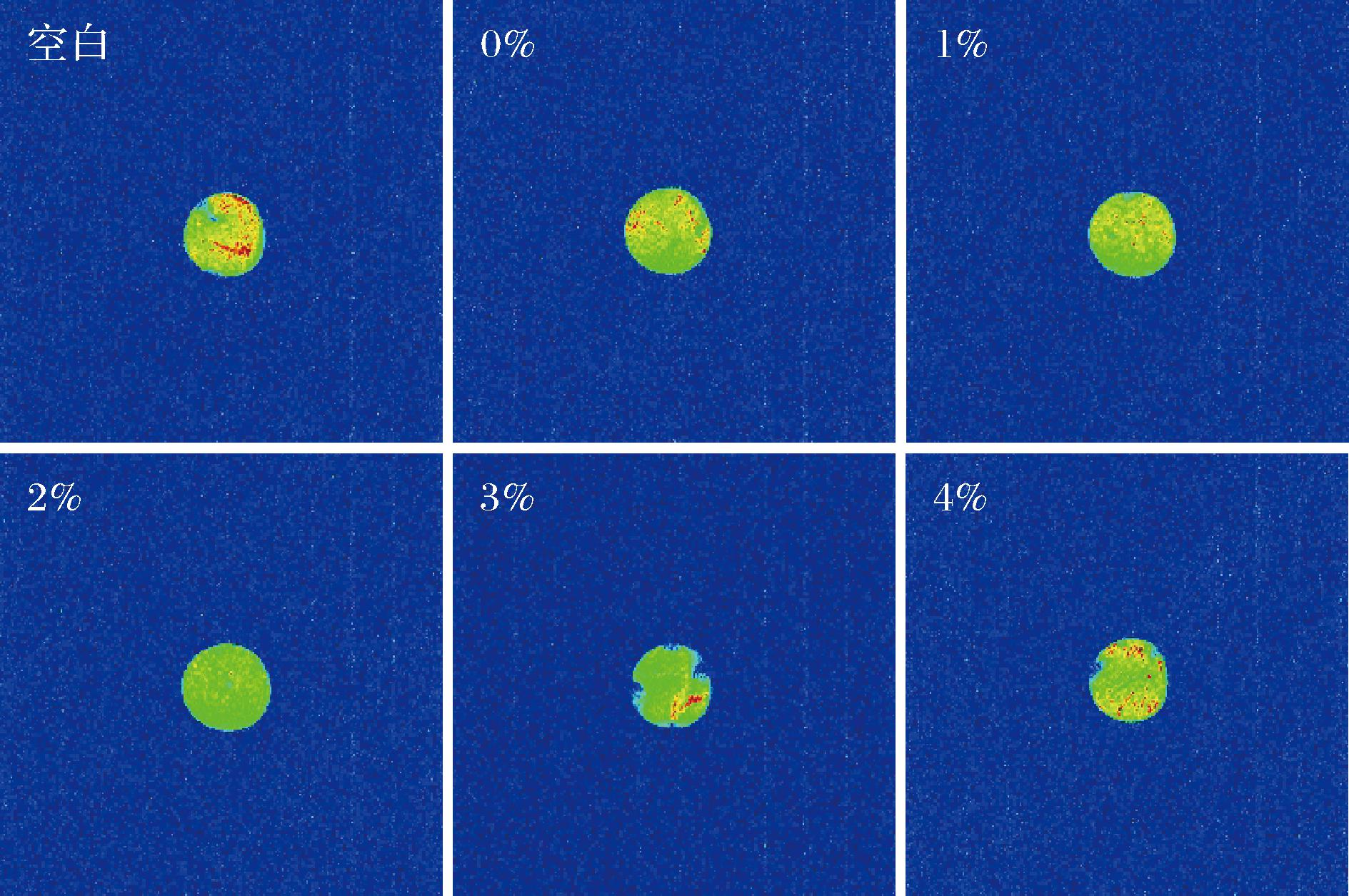
图3 贮藏12 d后猪肉核磁成像的变化
Fig.3 Magnetic resonance imaging imaging changes of pork after 12 days of storage
核磁成像中红色部分代表自由水,其结果与弛豫时间测定结果一致。原因可能是2%处理组延缓了猪肉的氧化,抑制了猪肉中微生物的生长,猪肉中的纤维结构较为完整,能够有效地提升猪肉的保水性。而TP添加量超过2%时,自由水的比例又逐渐增大,原因可能是过量的茶多酚破坏了猪肉的纤维结构,导致猪肉保水性下降。李玲等[26]发现向猪肉中添加茶多酚可以保护肌原纤维蛋白侧链结构,有效提升猪肉凝胶的保水性,增大自由水的比例,与本文结果相似。
2.5 猪肉质构特性变化
质构测定的结果如表3所示。猪肉在贮藏12 d后,猪肉的硬度、弹性、内聚性和咀嚼性随着TP添加量的增大呈现出先增大后减小的趋势。硬度下降主要原因是猪肉中微生物生长繁殖活跃,蛋白质被分解,结构被破坏,导致硬度下降,而TP-OVA的加入抑制了微生物的生长,猪肉的硬度显著上升,尤其是TP添加量在2%时,其硬度为4 139.979±180.828,显著高于其他组(P<0.05);而过量的TP破坏了蛋白质的结构,导致硬度下降[27]。TP添加量为2%时弹性和内聚性较好(0.812±0.073、0.566±0.012),与空白组以及4%组差异显著(P<0.05)。弹性和内聚性先上升后下降的原因与硬度类似。咀嚼性与硬度、弹性和内聚性相关,其变化规律相似。胶黏性呈现出先下降后上升的趋势,其变化主要与微生物在生长代谢的同时所分泌的黏液有关,微生物生长代谢越旺盛,分泌的黏液越多,猪肉的胶黏性也就越大[28],因此2%和3%(TP添加量)处理组表现了对于微生物的良好抑制作用(P<0.05)。
表3 不同膜液处理的猪肉贮藏12 d的质构特性
Table 3 Textural characteristics of pork stored for 12 days with different membrane liquid treatments

TP添加量/%硬度弹性内聚性咀嚼性胶黏性空白2 741.043±172.594a0.582±0.061a0.449±0.036a704.986±64.598a2 375.089±188.438c03 868.469±301.154c0.583±0.049a0.504±0.028bc1 137.158±205.276b1 941.551±240.937bc14 139.979±180.828cd0.763±0.028b0.536±0.016cd1 910.766±218.869cd1 979.758±352.026bc24 627.498±202.991e0.812±0.073b0.566±0.012d2 148.143±77.910d1 514.563±80.961ab33 195.574±141.722b0.718±0.019b0.492±0.023ab1 540.675±280.336bc1 162.646±212.585a42 379.414±155.818a0.529±0.040a0.467±0.022ab581.108±120.777a1 984.760±142.978bc
2.6 猪肉微观结构变化
贮藏12 d后各组猪肉肌纤维的微观结构变化如图4所示。空白组绝大部分肌纤维束结构破坏,肌束膜断裂、各肌束间间隙明显增大。随着TP的加入,肌纤维结构排列逐渐完整、清晰,肌束间贴合逐渐紧凑。当TP添加量为2%时,肌纤维微观结构最佳,说明此时肌肉的氧化程度最小。当TP添加量超过2%时,过量的TP破坏了肌纤维束的肌内膜,导致肌束结构遭到破坏不再完整,各肌束之间连接松散,缝隙增大甚至断裂,肌肉结构组织遭到严重破坏[29]。

图4 贮藏12 d后猪肉微观结构的变化(300×)
Fig.4 Microstructure changes of pork after 12 days of storage(300×)
2.7 菌落总数计数
贮藏过程中猪肉菌落总数的变化菌落总数是一种常用的评估食品卫生质量的指标,其增加通常表示食品中微生物数量增加,品质变差,符合国家标准GB/T 9959.2—2008《分割鲜、冻猪瘦肉》的菌落总数应小于6 lg CFU/g。从图5可以看出,与空白组相比,处理组的菌落总数增加速度更缓慢,空白组第8天的菌落总数为6.33 lg CFU/g,超出国家标准规定的可食用肉菌落总数范围。CS处理组第12天的菌落总数为5.52 lg CFU/g,膜液处理组的分别为5.16、5.08、5.11、5.06 lg CFU/g,均显著低于空白组(P<0.05)。这表明,TP-OVA可食膜能够抑制微生物的生长,延长保质期。
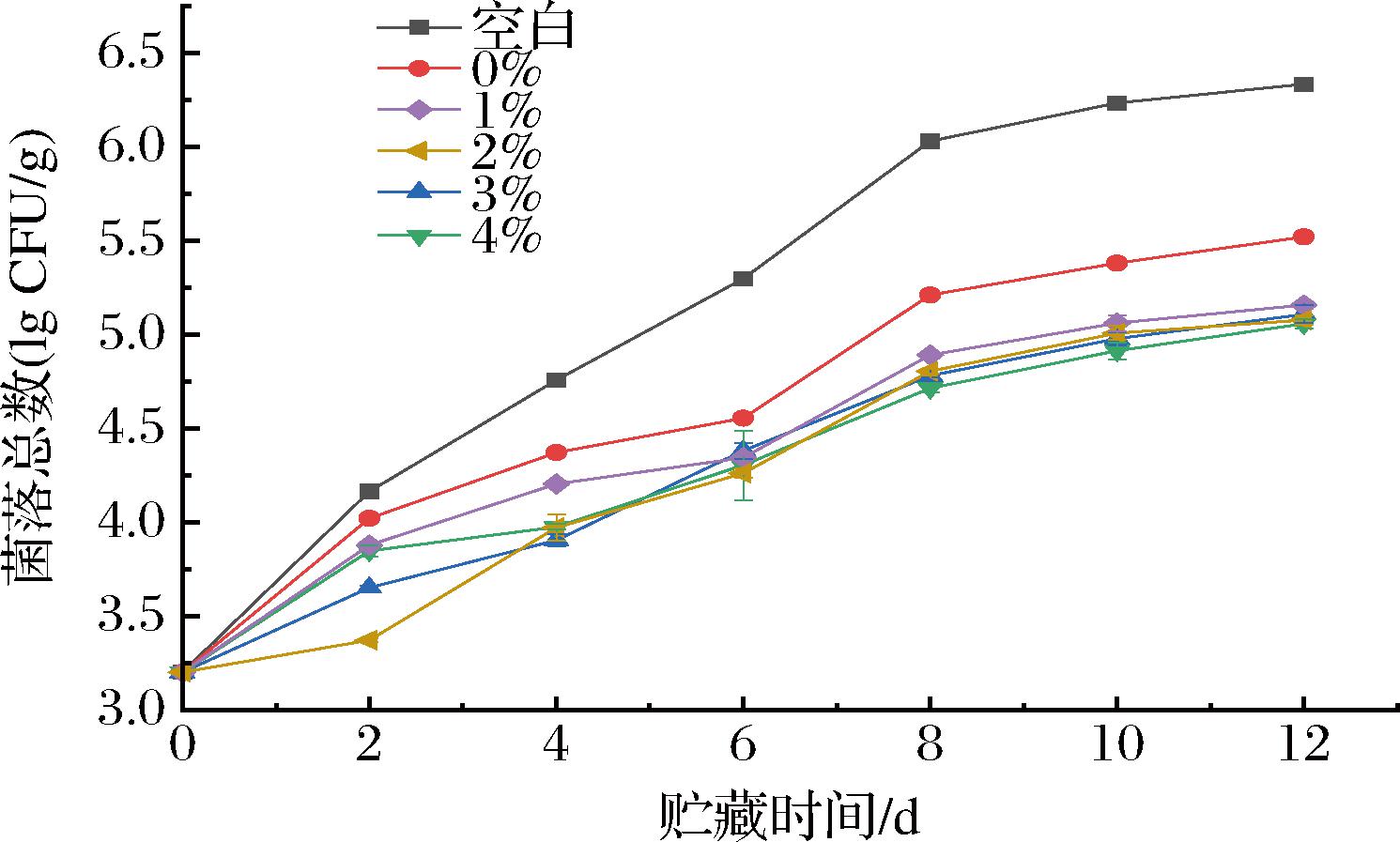
图5 贮藏过程中猪肉菌落总数的变化
Fig.5 Changes in the total number of colonies of pork during storage
2.8 猪肉中微生物的生长模型构建
Gompertz模型的应用最为广泛,在该模型的基础上构建了专门用来描述微生物生长变化的修正Gompertz模型,弥补了原始模型不能描述微生物生长速率以及延滞期的不足,其表达式如公式(1)所示:
lgNt=lgN0+Aexp{-exp[-B(t-M)]}
(1)
式中:Nt为微生物在时间t时的菌落数量,lg CFU/g;N0为t=-∞时的菌落数量(近似相当于t=0时的初始菌数),lg CFU/g;A为t=+∞时的lg(N/N0),即当N达到最大时所对应的值;M为达到相对最大生长速率所需要的时间,d;B为时间M时的相对最大生长速率,d-1。
Logistic模型具有断点性,可描述细菌生长或衰亡的迟滞期,模型拟合特征更加灵活。目前,Logistic模型已应用于各种微生物的生长或衰亡预测。Logistic模型表达式如公式(2)所示:
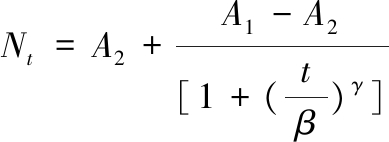
(2)
式中:Nt为t时间猪肉的菌落数量,lg CFU/g;A1为初始菌落数,lg CFU/g;A2为t无限大时的渐近线数值,细菌生长时为最大菌落数,细菌死亡时为最小菌落数,lg CFU/g;β为达到最大生长率或最大致死率所用的时间,h;γ为增长率或死亡率,lg CFU/(g·h)。
拟合结果如图6和表4所示。从拟合结果看,修正的Gompertz模型对各组拟合的相关性系数R2为0.94~0.98,均大于0.9;偏差因子Bf和精确度因子Af也接近于1,说明该模型对TP-OVA处理后猪肉中微生物的生长动力学模型的拟合效果很好。而Logistic模型无法对某些组别进行拟合,因此选择修正的Gompertz模型作为本文中微生物生长状况的研究对象。修正的Gompertz模型中B代表微生物的最大生长速率。由表4可知,随着TP添加量由0%增加至4%,微生物的最大生长速率B分别为0.32、0.28、0.28、0.24、0.27、0.35,呈现出先减小后增大的趋势,微生物生长受到的抑制作用先增强后减弱,进一步说明TP添加量为2%的TP-OVA对微生物生长的抑制效果最好,与前文的结论相一致。
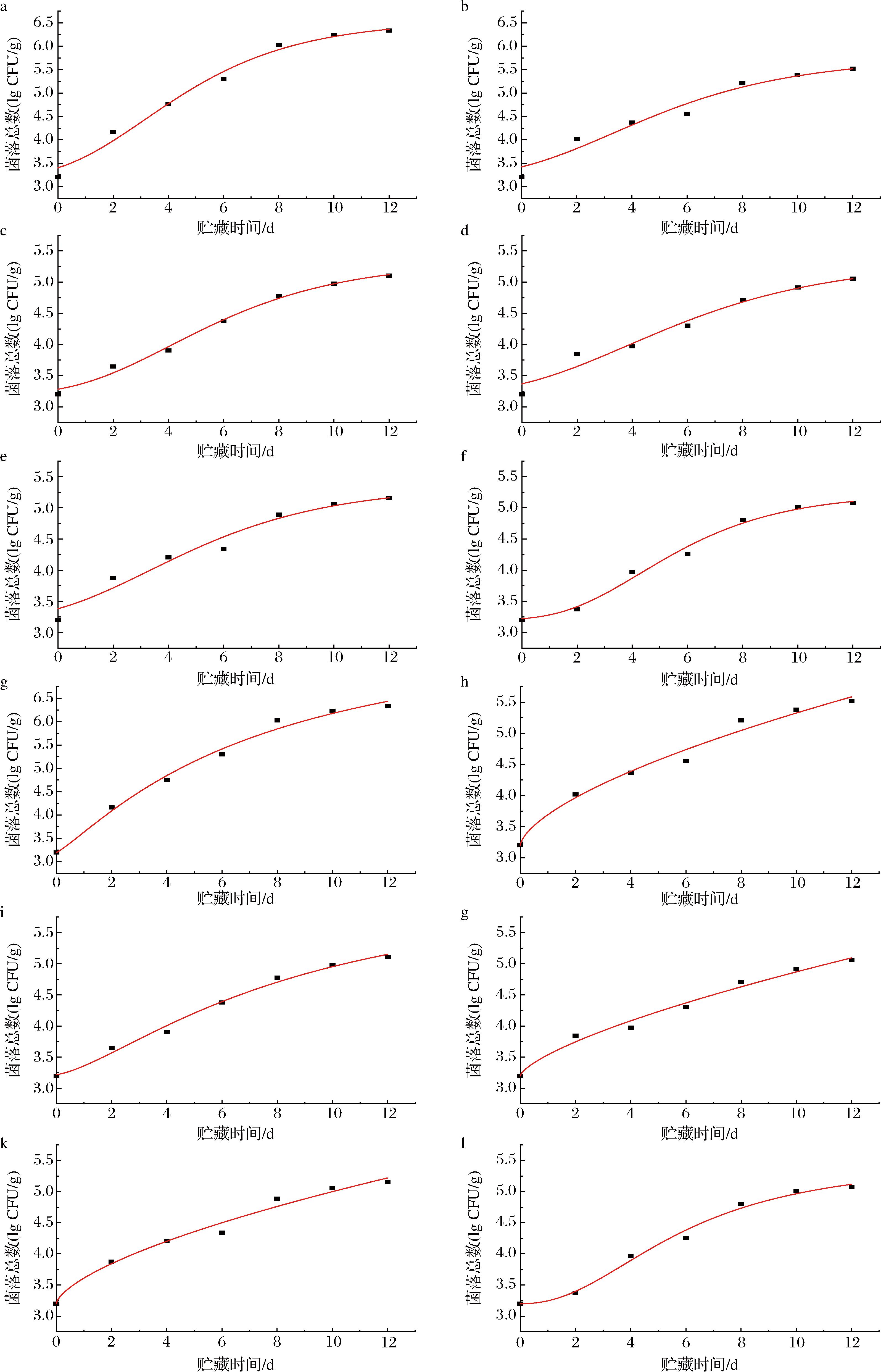
图6 修正的Gompertz模型和Logistic模型拟合的微生物生长模型曲线
Fig.6 Modified microbial growth model curves fitted to Gompertz model and Logistic model
表4 两种微生物生长模型的拟合方程
Table 4 Fitting equations for two microbial growth models

模型种类TP添加量微生物生长动力学模型相关性系数(R2)BfAf修正的Gompertz模型空白lgN(t)=3.2+3.34exp{-exp[-0.32(t-3.5)]}0.980.986 3 1.029 7 0%lgN(t)=3.2+2.55exp{-exp[-0.28(t-3.3)]}0.941.005 8 1.028 4 1%lgN(t)=3.2+2.13exp{-exp[-0.28(t-4.1)]}0.981.000 2 1.012 5 2%lgN(t)=3.2+2.13exp{-exp[-0.24(t-3.0)]}0.971.028 5 1.032 2 3%lgN(t)=3.2+2.14exp{-exp[-0.27(t-3.3)]}0.941.001 8 1.026 3 4%lgN(t)=3.2+2.02exp{-exp[-0.35(t-4.2)]}0.981.009 2 1.021 8 Logistic模型空白N(t)=8.30+(3.20-8.30)/[1+(t/7.52)1.18]0.98//0%////1%N(t)=6.36+(3.20-6.36)/[1+(t/8.62)1.43]0.98//2%////3%////4%N(t)=5.52+(3.20-5.52)/[1+(t/5.91)2.19]0.98//
3 结论
本文制备了一种TP-OVA可食膜液用于猪肉保鲜,通过猪肉品质的测定探究了不同TP添加量对TP-OVA可食膜液的抗氧化抑菌性能的影响,并建立了猪肉中微生物的生长模型对膜液的抑菌性能进行验证。结果表明,该可食膜能够较好地保持猪肉的品质,并且TP的质量分数对保鲜效果有明显影响,其中2%TP添加量的可食膜液的效果最好,能够显著降低猪肉的pH值(P<0.05);该膜液提高了猪肉蛋白质贮藏后的稳定性,蛋白质变性温度高于其他组。贮藏期间,2%TP添加量的可食膜液处理组猪肉的L*始终显著低于其他组(P<0.05),猪肉的硬度、弹性、内聚性和咀嚼性显著高于其他组(P<0.05),自由水含量最少,说明该膜液有效地保持了肌原纤维的网络结构,提升了质构特性和保水性,扫描电镜的结果也验证了这一结论。2%TP添加量的可食膜液处理显著降低了猪肉的菌落总数(P<0.05),通过模型拟合发现修正的Gompertz模型能够较好地模拟微生物的生长情况,2%TP处理组的微生物最大生长速率最小,说明微生物受到的抑制作用最强。综上,添加了2%TP的TP-OVA可食膜具有最佳的抗氧化抑菌性能,该研究能够为猪肉保鲜提供一条新思路。
[1] LI H, GUO H, LUO Q, et al.Current extraction, purification, and identification techniques of tea polyphenols:An updated review[J].Critical Reviews in Food Science and Nutrition, 2023, 63(19):3912-3930.
[2] 洪玉珠, 张佳乐, 张龙鑫, 等.玉米淀粉-卵白蛋白复合物替代小麦粉对纸杯蛋糕品质和消化特性的影响[J].食品工业科技, 2024, 45(10):77-83.
HONG Y Z, ZHANG J L, ZHANG L X, et al.Effects of corn starch-ovalbumin complex as substitution for wheat flour on the texture and digestive characteristics of cupcakes[J].Science and Technology of Food Industry, 2024, 45(10):77-83.
[3] YANG J, ZHAO Y J, SHAN B S, et al.Study on the interaction and functional properties of Dolichos lablab L.protein-tea polyphenols complexes[J].International Journal of Biological Macromolecules, 2023, 250:126006.
[4] CHEN Q, LIU Y H, LI Y, et al.Interaction and binding mechanism of ovalbumin with cereal phenolic acids:Improved structure, antioxidant activity, emulsifying and digestion properties for potential targeted delivery systems[J].Food Research International, 2024, 175:113726.
[5] 刘丽莉, 于影, 苏克楠, 等.植物多酚-牛血清白蛋白相互作用及对蛋白质结构的影响[J].农业工程学报, 2023, 39(13):290-298.
LIU L L, YU Y, SU K N, et al.Polyphenol-bovine serum albumin interaction and its influence on protein structure[J].Transactions of the Chinese Society of Agricultural Engineering, 2023, 39(13):290-298.
[6] RAHMA R A, PUTRI W D R, MEGATRI A A, et al.Optimisation of fish gelatin and red pitaya peel powder edible film production[J].International Journal of Food Science &Technology, 2023, 58(10):5578-5590.
[7] MOHAMMADI R, MOHAMMADIFAR M A, ROUHI M, et al.Physico-mechanical and structural properties of eggshell membrane gelatin- chitosan blend edible films[J].International Journal of Biological Macromolecules, 2018, 107:406-412.
[8] 董轶群, 罗鑫, 牛素敏, 等.复合保鲜剂对团头鲂尸僵过程中品质变化的影响[J].食品与发酵工业, 2022, 48(14):48-54.
DONG Y Q, LUO X, NIU S M, et al.Effect of compound preservative on quality of Megalobrama amblycephalala during rigor mortis[J].Food and Fermentation Industries, 2022, 48(14):48-54.
[9] SUTHARSAN J, BOYER C A, ZHAO J.Biological properties of chitosan edible films incorporated with different classes of flavonoids and their role in preserving the quality of chilled beef[J].Food Hydrocolloids, 2023, 139:108508.
[10] CHATURVEDI K, BASU S, SINGHA S, et al.Predictive microbial growth modelling for an effective shelf-life extension strategy of Chhana (Indian cottage cheese)[J].Food Control, 2023, 149:109697.
[11] 张金凤, 王艳文, 范恒军, 等.茶多酚-玉米胚芽粕蛋白膜制备及性能研究[J].粮食与饲料工业, 2023(3):46-51.
ZHANG J F, WANG Y W, FAN H J, et al.Preraration and property study of tea polyphenols and corn germ meal protein-membrane[J].Cereal &Feed Industry, 2023(3):46-51.
[12] 席小辉,胡瑜文,张升阳,等.肉豆蔻精油/羟丙基-β-环糊精包合物对冷鲜猪肉的保鲜效果[J].食品与发酵工业, 2024, 50(10):187-196.
XI X H, HU Y W, ZHANG S Y, et al.Preservation effect of nutmeg essential oil/HP-β-CD inclusion complex on chilled pork[J].Food and Fermentation Industries, 2024, 50(10):187-196.
[13] KONUK TAKMA D, KOREL F.Active packaging films as a carrier of black cumin essential oil:Development and effect on quality and shelf-life of chicken breast meat[J].Food Packaging and Shelf Life, 2019, 19:210-217.
[14] 陈婷婷, 崔泽恒, 包海蓉, 等.两种鱿鱼胴体肉热加工特性的研究[J].食品与发酵工业, 2023, 49(8):51-59.
CHEN T T, CUI Z H, BAO H R, et al.Study on thermal processing characteristics of two kinds of squid carcass meat[J].Food and Fermentation Industries, 2023, 49(8):51-59.
[15] KIM A N, LEE K Y, PARK C E, et al.Effect of heating under different vacuum levels on physicochemical and oxidative properties of beef sirloin[J].Foods, 2023, 12(7):1393.
[16] 罗程, 王缓, 陈银基, 等.魔芋胶对猪肉肌原纤维蛋白凝胶特性和保水特性的调控机制:基于相分离行为和水相稳定[J].中国农业科学, 2023, 56(9):1775-1786.
LUO C, WANG H, CHEN Y J, et al.The mechanism of effects of konjac gum on the gel property and water holding property of pork myofibrillar protein based on phase separation behavior and moisture stabilization[J].Scientia Agricultura Sinica, 2023, 56(9):1775-1786.
[17] 盖圣美, 游佳伟, 张雪娇, 等.利用低场核磁共振及成像技术鉴别注水肉糜[J].食品科学, 2020, 41(22):289-294.
GAI S M, YOU J W, ZHANG X J, et al.Discrimination of water-injected ground meat using low-field nuclear magnetic resonance and magnetic resonance imaging[J].Food Science, 2020, 41(22):289-294.
[18] 赵立, 邱慧敏, 廉嘉欣, 等.精氨酸低钠盐对猪肉品质的影响[J].中国食品学报, 2023, 23(11):137-146.
ZHAO L, QIU H M, LIAN J X, et al.Effects of arginine low-sodium salt on pork quality[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(11):137-146.
[19] 赵谋, 杨欢欢, 杨莉, 等.燕麦β-葡聚糖对低盐羊肉肉糜凝胶特性的影响[J].食品科学, 2023, 44(16):159-168.
ZHAO M, YANG H H, YANG L, et al.Effect of oat β-glucan on gel properties of low-salt mutton mince[J].Food Science, 2023, 44(16):159-168.
[20] WALID Y, MALGORZATA N, KATARZYNA R, et al.Effect of rosemary essential oil and ethanol extract on physicochemical and antibacterial properties of optimized gelatin-chitosan film using mixture design[J].Journal of Food Processing and Preservation, 2022, 46(1):e16059.
[21] KAYA G K.The effects of different packaging methods and sous vide cooking on chemical, sensory, and microbiological changes of marinated crayfish (Astacus leptodactylus Esch., 1823)[J].Journal of Food Processing and Preservation, 2022, 46(10):e16919.
[22] 伍梦婷, 郭娟娟, 许雄, 等.木薯变性淀粉对猪肉肌原纤维蛋白凝胶质构、流变及热力学特性的影响[J].食品工业科技, 2019, 40(8):49-53;60.
WU M T, GUO J J, XU X, et al.Effect of cassava modified starch on the gel textural, rheological and thermodynamic properties of pork myofibrillar protein[J].Science and Technology of Food Industry, 2019, 40(8):49-53;60.
[23] 张慧娟, 潘见.含CO的气调包装协同超高压对冷却猪肉杀菌护色效果的研究[J].食品研究与开发, 2021, 42(12):84-89.
ZHANG H J, PAN J.The synergistic effect of modified atmosphere packaging with CO and ultrahigh pressure on the sterilization and color protection of chilled pork[J].Food Research and Development, 2021, 42(12):84-89.
[24] 黄卉, 孙申宇, 魏涯, 等.红色肉贮藏期间肌红蛋白与肉色变化研究进展[J].南方水产科学, 2020, 16(3):119-124.
HUANG H, SUN S Y, WEI Y, et al.Research progress on color transformation of red meat during storage[J].South China Fisheries Science, 2020, 16(3):119-124.
[25] 周垚卿, 董静雯, 李学理, 等.茶多酚对不同肥瘦比猪肉的护色作用及差异机制研究[J].食品科技, 2020, 45(12):98-103.
ZHOU Y Q, DONG J W, LI X L, et al.Effect and mechanism of tea polyphenols on color of minced pork with different fat to muscle ratios[J].Food Science and Technology, 2020, 45(12):98-103.
[26] 李玲, 季慧, 康大成, 等.氧化条件下茶多酚对猪肉肌原纤维蛋白理化和凝胶特性的影响[J].食品科学, 2019, 40(2):12-17.
LI L, JI H, KANG D C, et al.Effect of tea polyphenols on physicochemical and gel properties of pork myofibrillar protein under oxidative conditions[J].Food Science, 2019, 40(2):12-17.
[27] 闫瑞, 唐敏, 陈东方, 等.白萝卜粉作为亚硝酸盐来源制备猪肉发酵干香肠[J].食品科学, 2023, 44(8):101-108.
YAN R, TANG M, CHEN D F, et al.Preparation of dry fermented pork sausage using radish powder as a source of nitrite[J].Food Science, 2023, 44(8):101-108.
[28] 周彬静, 刘小花, 彭菁, 等.荧光假单胞菌和热杀索丝菌对低温贮藏期间猪肉品质变化的影响[J].食品科学, 2022, 43(19):208-216.
ZHOU B J, LIU X H, PENG J, et al.Effects of Pseudomonas fluorescens and Brochothrix thermosphacta on quality changes of pork during low-temperature storage[J].Food Science, 2022, 43(19):208-216.
[29] 孙慧琳. 贮藏方式对牛肉的品质变化的影响[D].锦州:锦州医科大学, 2021:30-31.
SUN H L.Effect of storage methods on quality change of beef[D].Shenyang:Jinzhou Medical University, 2021:30-31.