红曲菌(Monascus)属于真菌门(Eumycophyta)、子囊菌纲(Eurotiomycetes)、真子囊菌亚纲(Eurotiomycetidae)、散子囊菌目(Eurotiales)、红曲科(Monascaceae)[1]。红曲菌作为经典药食两用菌种,广泛应用在我国红曲发酵食品,例如红曲米、红曲醋、红曲啤酒等[2],其产生的代谢产物有红曲色素、γ-氨基丁酸、莫纳克林K[3]等。据研究表明,具有抗菌、抗炎、降胆固醇和降血压等[4-6]作用。但部分红曲菌也会产生一种有害次级代谢物:桔霉素(citrinin, CIT)[7],严重限制了红曲食品的发展。BLANC等[8]通过定性、质谱和核磁共振等方法,首次从红曲菌中鉴定CIT结构并表明CIT是一种毒性物质。后续研究证实,CIT不仅具有肝脏毒性[9],还会产生生殖毒性、致突变性[10]、肾脏毒性[11]、细胞毒性[12]等。
目前,CIT的控制方法分为两类:传统控制方法和生物控制方法。传统控制方法主要通过调整培养基中的氮源种类、外源添加物及光照条件、温度等,改变微生物的生长条件,从而减少CIT的产量。KANG等[13]在培养基中以(NH4)2SO4为唯一氮源,探究不同氮源对红曲霉减少CIT的效果,结果表明,以(NH4)2SO4为氮源时,红曲菌完全不产生CIT。GU等[14]在培养基中添加乙二胺四乙酸或柠檬酸三铵,发现2种外源添加物均使米曲霉和黑曲霉不产生CIT。刘宏等[15]在不同光照条件培养红曲菌,结果说明CIT在红光条件产量显著低于黑暗条件。传统控制方法虽然能有效减少CIT产量,但受限于操作繁琐,无法应用在工业量产。生物控制方法主要有基因调控法、混菌发酵法等。基因调控法是通过敲除或不表达可能调控CIT的基因,达到减少CIT产量的一种方法。XU等[16]将色素相关基因pks1片段替代citrinin激活基因ctnA,成功将突变株CIT的产量较原始株减产42%。基因调控法是一种菌株低产CIT的有效方法,但仍存在敲除目的基因操作难、耗时长的问题。因此,针对减少CIT产量,需探究一种快速、绿色、可量产的新方法。混菌发酵是通过寻找与红曲菌相似生长条件的菌株混合培养,以期选定菌株对CIT产生降解或吸附作用,最终减少CIT产量的一种方法。相比其他生物控制方法,混菌发酵法具有绿色、环保、低成本、可量产等特点。MOGHADAM等[17]将酵母菌与红曲菌共培养,结果表明,混菌发酵法可降低CIT的含量,同时提升红曲霉色素的产量。但目前利用红曲菌和酵母菌混菌发酵,从而减少CIT产量的报道还较少。
新疆是我国最大的省级行政区,占全国国土面积的六分之一,具有多种多样的发酵产品如发酵酒、乳制品等[18]。酵母菌作为传统发酵产品的发酵菌种之一,有上千年的发酵历史,从发酵产品中保留下来的酵母菌多种多样。长期以来,利用拮抗微生物进行生物防治一直被认为是去除食品和饲料中霉菌毒素的很好选择之一[19]。在众多的微生物中,酵母菌因其生物学特性和无毒特性而成为最有效的生防菌之一,常用做混菌发酵降解毒素的菌种[20]。酿酒酵母(Saccharomyces cerevisiae)细胞壁部分占整个细胞干重的15%~30%,主要由多糖组成(80%~90%)[21]。在发酵过程中,酿酒酵母能够吸收细胞外壁表面的色素和毒素等分子,证明酿酒酵母细胞壁中的组分在吸附过程中是有效的[10,22]。
本研究以新疆托木尔峰酒业的酒醅、土壤样品和阿瓦提红葡萄为原料,筛选出一株降解CIT效果较好的酵母菌PT。通过形态学和分子生物学鉴定酵母菌PT为毕赤酵母菌(Pichia pastoris);进一步分离酵母菌的不同组分(细胞壁、胞内代谢物、胞外代谢物),确定酵母菌PT能有效降解CIT为各组分协同作用、共同降解的效果;为提升CIT的降解率,分别将酵母菌PT与酵母菌B、酵母菌C、酵母菌YC3菌液复合后探究其对CIT的降解效果,结果表明,不同酵母菌菌液复合并未产生明显的复合降解效果;随后,将酵母菌PT与物理吸附剂蒙脱土K-10结合探究其对CIT的降解效果,结果表明,物理吸附剂蒙脱土K-10可辅助提升酵母菌PT对CIT的降解能力。本研究为威胁人体健康的CIT提供了一种新的生物防治思路,筛选的酵母菌PT丰富了降解CIT的微生物菌库。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
新疆托木尔峰酒业酒醅、土壤及阿瓦提红葡萄。
1.1.2 主要试剂
CIT标准品,源叶生物科技有限公司;甲酸、甲醇、乙腈(均为色谱级),上海Thermo Fisher科技有限公司;酵母基因组DNA快速提取试剂盒,北京庄盟国际生物基因科技有限公司;DL 2000 DNA Marker、dNTP Mixture、Taq DNA聚合酶,TaKaRa公司;ITS1、ITS4引物,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
VCX-130型超声波破碎仪,美国Sonics公司;LC20A型高效液相色谱仪,日本岛津公司;金怡电热数显恒温水浴锅,江苏金怡仪器科技有限公司;GR85DR型全自动高压灭菌锅,南京爱施德实验设备有限公司;SW-CJ-2FD型双人超净工作台,苏州净化设备有限公司;PCR仪,北京东胜创新生物科技公司;光学显微镜,舜宇光学科技有限公司;ZF-268型全自动凝胶成像分析系统,绍兴上虞艾科仪器;Sub-Cell 96型水平电泳仪,伯乐生命医学产品(上海)有限公司;Phenomenex C18色谱柱,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 降解CIT菌株的活化与筛选
称取10 g样本,加入100 mL无菌生理盐水,混合均匀作为种子原液。采用稀释涂布法将不同稀释倍数的种子原液接种到PDA培养基上,于28 ℃恒温培养箱中培养3 d。将PDA培养基上生长的疑似酵母的菌株分别挑出,共挑选出63株疑似酵母菌,再在PDA培养基上采用平板划线法反复划线接种,纯化菌株,通过形态学鉴定最终确定其中的18株为酵母菌。将纯化好的菌株接种在保藏管中于-80 ℃保存。
1.3.2 CIT的提取与检测
参照徐素吟[23]的方法,取1 mL得到的红曲菌发酵液用等体积的甲苯-乙酸乙酯-甲酸(体积比7∶3∶1)试剂于12 000 r/min离心10 min,取上层有机相,水浴锅65 ℃进行挥干,加入80%(体积分数)的甲醇,经0.22 μm滤膜过滤后用高HPLC检测CIT含量。色谱条件:流动相A:乙腈,流动相B:0.1%(体积分数)甲酸水溶液,进样量为10 μL,流速为1 mL/min,柱温为40 ℃;检测条件:Ex=330 nm,Em=500 nm,梯度洗脱如表1所示。
表1 流动相梯度洗脱程序
Table 1 Mobile phase gradient elution procedure

时间/min流速/(mL/min)A/%B/%0.0~3.0110903.0~10.01703010.0~12.01901012.0~20.011090
1.3.3 菌株的鉴定及筛选
1.3.3.1 酵母菌的形态学鉴定
将筛选的63株疑似酵母菌培养2 d后,在PDA上观察菌落形态及显微形态。
1.3.3.2 降解CIT酵母菌的初筛
将分离出的18株酵母菌在YES培养基中培养2 d后,将含CIT经0.22 μm有机相滤膜过滤的菌液加入YES培养基中,28 ℃,180 r/min条件下共培养8 d,每隔2 d进行1次取样。
1.3.3.3 酵母菌的分子生物学鉴定
使用酵母基因组DNA快速提取试剂盒提取酵母菌基因组DNA,以提取的基因组DNA为模板,使用正向引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′),反向引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增。用2%琼脂糖凝胶对10 μL PCR扩增产物进行电泳检测并送至上海生工科技有限公司进行测序。将16S rDNA基因序列结果通过BLAST程序进行同源性分析,采用MEGA7.0软件构建系统发育进化树。
PCR反应体系(20 μL):ddH2O 14.7 μL,10×Taq buffer 2.0 μL,Taq DNA聚合酶0.1 μL,dNTP Mix 1.6 μL,Primer F 0.8 μL,Primer R 0.8 μL,模板1 μL。PCR反应条件:95 ℃预变性10 min;95 ℃变性0.5 min,58 ℃退火0.5 min,72 ℃延伸35 s,30个循环;72 ℃延伸10 min。
1.3.3.4 降解CIT酵母菌的复筛
挑选对CIT降解率排前6位的酵母菌作为复筛菌株,将6株酵母菌进行和初筛相同的试验操作,选出一株降解效果最好的酵母菌以供后续试验菌株,复筛试验为保证菌株降解的稳定性以及实验数据的准确性。
1.3.4 酵母菌细胞壁及胞内外代谢产物对CIT降解效果的影响
1.3.4.1 PT酵母菌生长曲线测定
挑取少许酵母菌PT接入YES培养基,25 ℃,180 r/min摇床培养2 d。使细胞达到良好的生长状态,再以1%的接种量将菌液接入YES培养基中,25 ℃,200 r/min摇床培养。并于4、8、12、16、24、32、48、72、96、120 h分别取样,测定菌液OD600值;并用无菌PBS对菌液按10倍梯度进行稀释,取40 μL均匀涂布于YES固体平板,28 ℃恒温培养2 d后,计算菌落数。
1.3.4.2 酵母菌PT胞内代谢产物对CIT降解效果的影响
细胞自溶处理:取5 mL浓度为2×108 CFU/mL的PT菌液,5 000 r/min离心15 min,弃上清液,加入等体积0.1 mol/L NaHCO3多次清洗菌体至无明显酒味。加入pH值为5.0、30 g/L NaCl溶液,配制为10%的菌体悬浮液,50 ℃,200 r/min摇床孵育24 h;对照组加入pH值为6.0的无菌PBS,配成10%的菌体悬浮液,50 ℃,200 r/min摇床孵育24 h。
超声破碎处理:细胞壁悬浮液于冰浴中超声破碎20 min,破碎细胞壁并释放杂蛋白。5 000 r/min离心15 min,弃上清液,等体积无菌水重悬,得到酵母细胞壁破碎液,再使用0.22 μm有机相膜过滤,将得到胞内代谢物加入1 mL CIT标准液(8 μg/mL)培养72 h,每隔12 h取1次样,再取上清液过滤后HPLC测定。
1.3.4.3 酵母菌PT胞外代谢物对CIT降解效果的影响
取上述离心的上清液,并合并上述多次离心的上清液。5 000 r/min离心15 min,反复操作2次,保证上清液中无酵母沉淀。再使用0.22 μm有机相膜过滤,再加入1 mL CIT标准液,共培养72 h,每隔12 h取1次样。
1.3.4.4 活细胞细胞壁对CIT的吸附作用
分别取5 mL 2×108 CFU/mL的PT酵母菌活细胞,对照组在同样条件下加入等量的无菌水,每个离心管中都添加CIT标准液,培养72 h,每隔12 h取1次样。
1.3.4.5 死细胞细胞壁对CIT的吸附作用
在活细胞处理组的基础上,将PT酵母菌活细胞用灭活的死PT酵母菌细胞代替。灭活处理的方式为:2×108 CFU/mL的PT酵母菌活细胞在沸水中煮10 min灭活,再加入1 mL CIT标准液,培养72 h,每隔12 h取1次样。
1.3.4.6 两种酵母菌混合培养对CIT降解效果的影响
取菌液为2×108 CFU/mL的PT酵母菌分别同B、C、YC3(酵母菌编号)混合均匀,混合体积比为0.5∶1.0、1.0∶1.0、0.5∶1.0。混合菌液于100 ℃水浴加热30 min加入1 mL CIT标准液做吸附试验,测定混合酵母菌的CIT吸附率,研究不同酵母混合后对CIT吸附效果的影响,培养72 h,每隔12 h取1次样。
1.3.4.7 酵母菌PT结合物理吸附剂对CIT的降解效果的影响
取菌液为2×108 CFU/mL的PT酵母菌菌液,于100 ℃水浴加热30 min后,按比例将菌体同物理吸附剂蒙脱土K-10混合,混合料液比分别为1∶0、1∶1、1∶2、1∶3、1∶4、1∶5、0∶5(mL∶mg)。再加入1 mL CIT标准液进行吸附实验,探究酵母菌PT与物理吸附剂共同作用对吸附效果的影响,共培养72 h,每隔12 h取1次样。
2 结果与分析
2.1 降解CIT酵母菌的筛选与鉴定
2.1.1 酵母菌的形态学鉴定
从样品中筛选的63株疑似酵母菌培养2 d后,观察PDA平板上的菌落形态上及光学显微镜下细胞形态。通过观察共得到18株酵母菌如图1所示,酵母菌菌落的表面光滑、湿润、质地均匀、颜色为乳白色,圆型凸起。单细胞形态为椭圆形或圆型,其中有些单细胞正在出芽繁殖,有些成串细胞。

图1 十八株酵母菌的菌落形态及在40×光学显微镜下的细胞形态
Fig.1 Colony morphology of 18 yeast strains and cell morphology under a 40× light microscope
注:图中字母(数字)为酵母菌编号。
2.1.2 降解CIT酵母菌的初筛
对从样品中筛选的18株酵母菌进行初筛,加入经过0.22 μm的有机相滤膜过滤的含一定浓度CIT的红曲菌菌液与18株酵母菌共培养,选取CIT降解效果较好的6株酵母菌分别是酵母菌B、C、PT、YC3、A4、JQ进行复筛详见表2。
表2 降解CIT酵母菌初筛结果
Table 2 Preliminary screening results of degraded CIT yeast
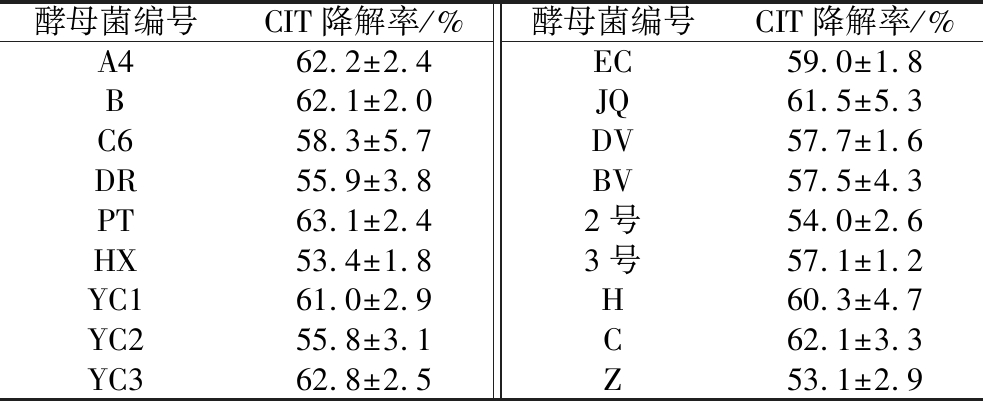
酵母菌编号CIT降解率/%酵母菌编号CIT降解率/%A462.2±2.4EC59.0±1.8B62.1±2.0JQ61.5±5.3C658.3±5.7DV57.7±1.6DR55.9±3.8BV57.5±4.3PT63.1±2.42号54.0±2.6HX53.4±1.83号57.1±1.2YC161.0±2.9H60.3±4.7YC255.8±3.1C62.1±3.3YC362.8±2.5Z53.1±2.9
2.1.3 酵母菌的分子生物学鉴定
将降解率前6株的酵母菌以ITS1和ITS4为模板进行PCR扩增,在500~750 bp处得到6条电泳条带(图2)。BLAST比对结果显示,酵母菌PT和酵母菌JQ属于毕赤酵母菌(Pichina属),酵母菌A4属于德氏圆酵母菌(Torulaspora属)、酵母菌YC3和酵母菌C属于假丝酵母菌(Candida属)、酵母菌B属于异常威克汉姆酵母菌(Wicherhamomyces属),经比对,6株酵母菌的ITS序列相似性都达到95%以上,并挑选6株酵母菌的相近ITS序列构建系统发育树(图3)。
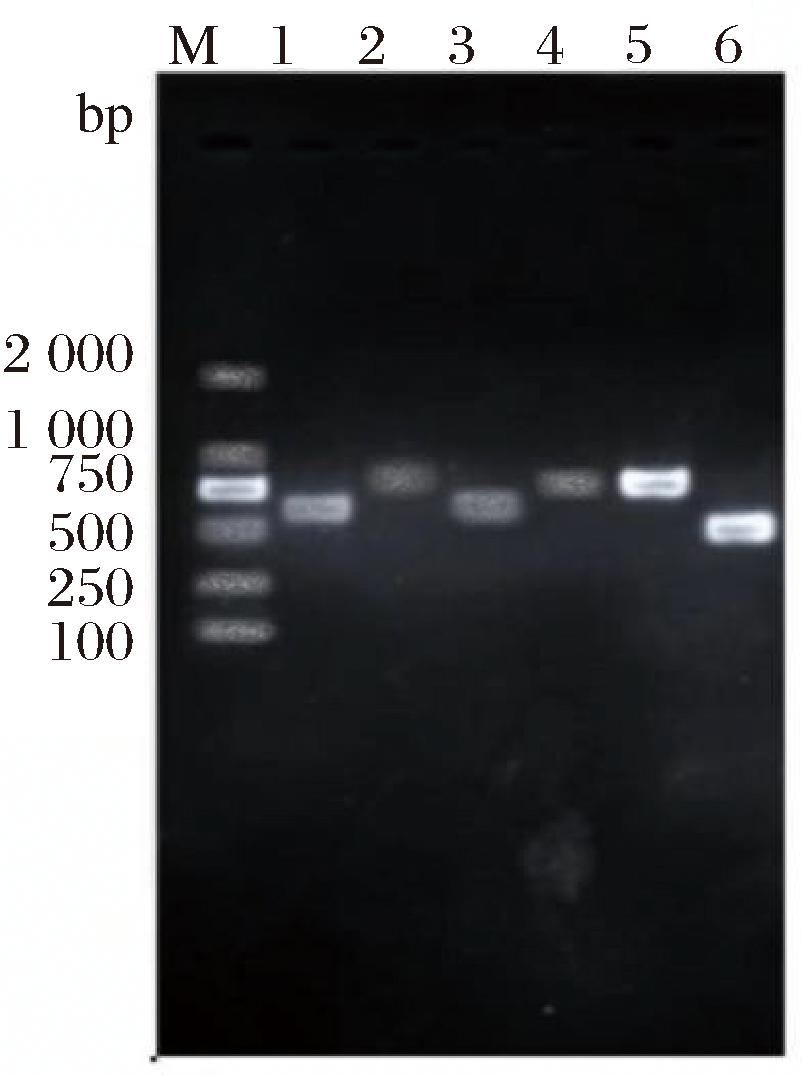
图2 六株酵母菌的ITS rDNA基因PCR产物电泳图谱
Fig.2 Electrophoresis of ITS rDNA gene PCR products of six yeast strains
注:通道1为B酵母菌,2为C酵母菌,3为YC3酵母菌,4为A4酵母菌,5为JQ酵母菌,6为PT酵母菌,M为Marker。
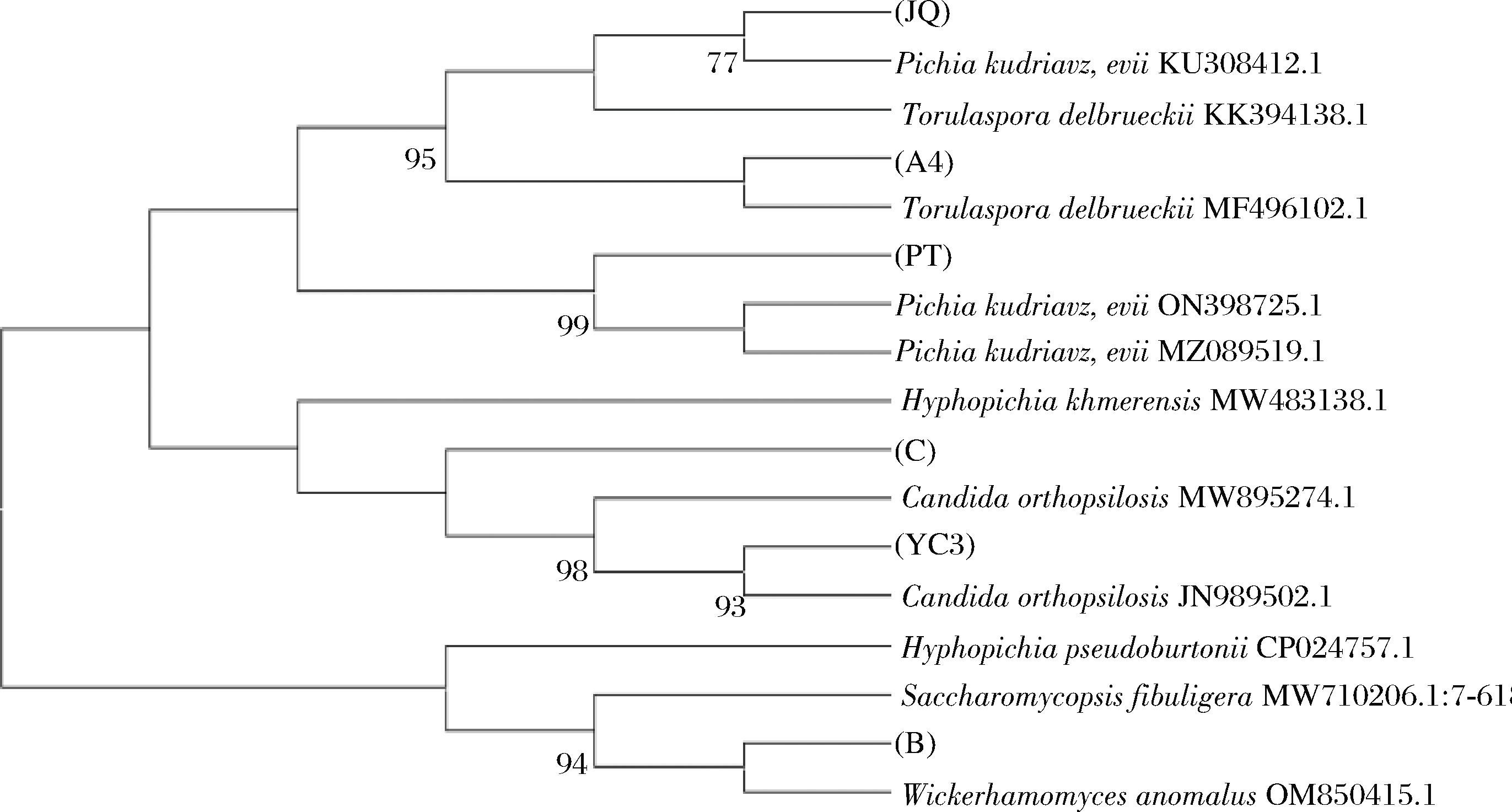
图3 六株酵母菌的系统发育树
Fig.3 Phylogenetic tree of six yeast strains
2.1.4 降解CIT酵母菌的复筛
选取18株酵母菌中对CIT降解率前6株酵母菌B、C、JQ、PT、YC3、A4进行复筛。复筛试验(表3)结果显示,酵母菌PT的降解率最高,达到65.7%。后续试验选择1株CIT降解效果最好的酵母菌PT继续研究,探究有效降解CIT的细胞组分。
表3 降解CIT酵母菌复筛结果
Table 3 Rescreening results of degraded CIT yeasts
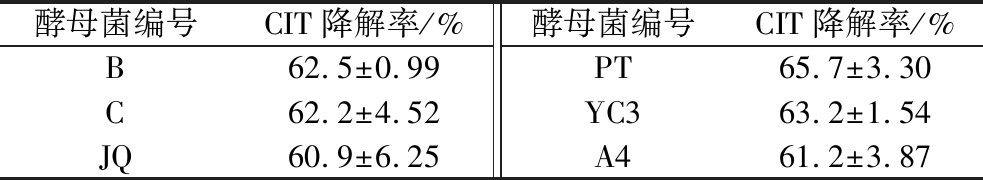
酵母菌编号CIT降解率/%酵母菌编号CIT降解率/%B62.5±0.99PT65.7±3.30C62.2±4.52YC363.2±1.54JQ60.9±6.25A461.2±3.87
2.2 酵母菌降解CIT机理初探
2.2.1 酵母菌PT生长曲线测定
酵母菌PT在28 ℃培养的生长曲线见图4,在0~4 h为迟缓期,生长速度较慢;4~16 h为对数生长期,生长速度最快,此时的OD600值为2.03。在32 h时达到最大活菌数(6.9×108 CFU/mL),同时32 h后酵母菌PT的生长进入稳定期。在32 h后,酵母菌逐渐死亡活菌数减少,但OD600值基本保持不变。随着新生酵母菌和衰老死亡的酵母菌达到稳定后,因培养基中的营养物质的减少,导致酵母菌的生长受到抑制,同时死亡酵母菌增多,因此活菌数越来越少。但因酵母菌菌体的存在,当培养基中酵母菌数量达到一定数值时,OD600值基本保持不再变化。
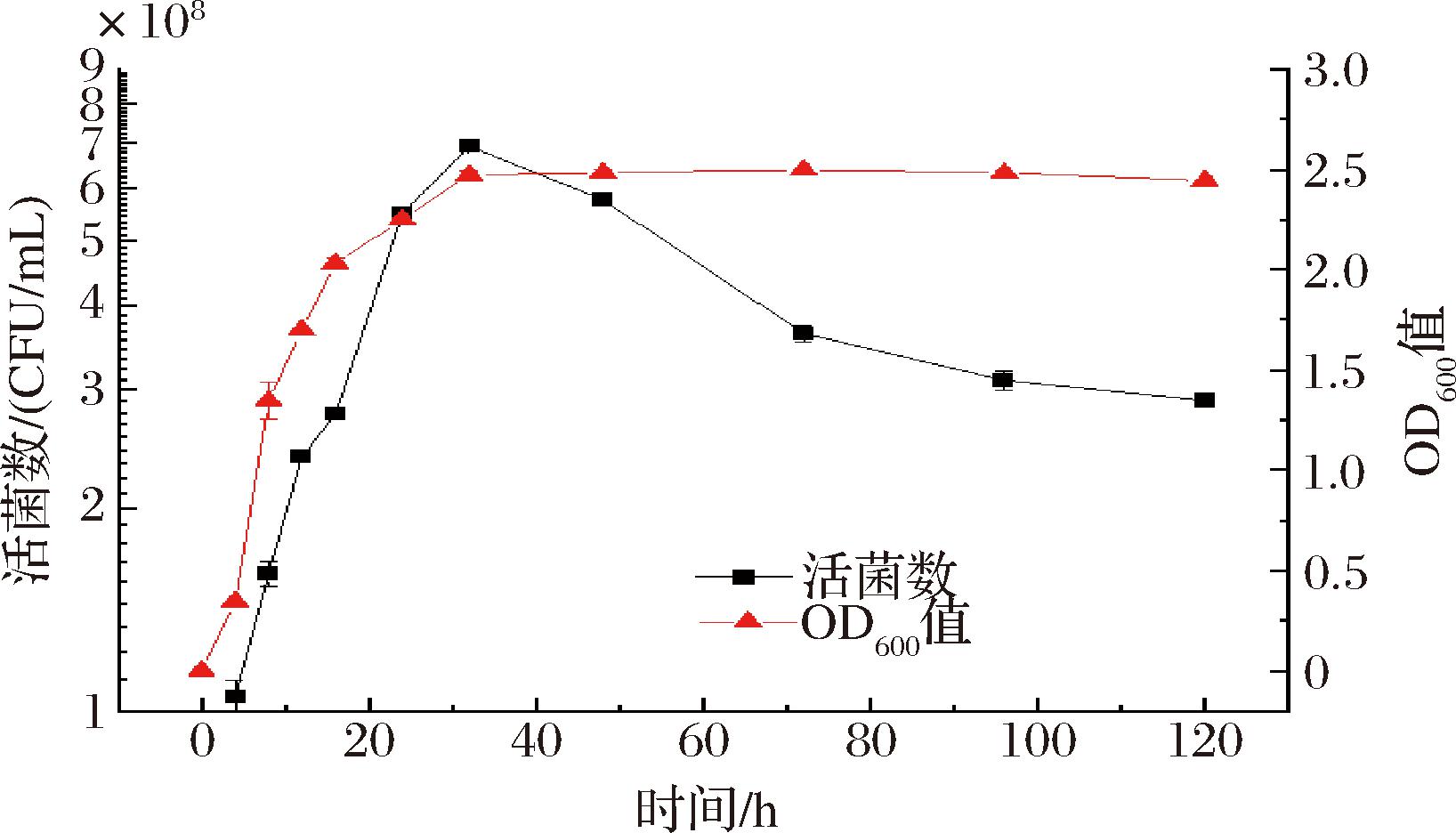
图4 酵母菌PT生长曲线
Fig.4 Growth curve of yeast PT
2.2.2 酵母菌胞内外代谢产物对CIT降解效果的影响
酵母菌PT的细胞壁、胞内代谢物及胞外代谢产物对CIT降解效果的影响如图5和图6所示,经72 h培养,活、死细胞试验组降解CIT质量浓度分别从8.0 μg/mL到6.4 μg/mL,8.0 μg/mL到6.3 μg/mL。降解率分别20.0%、21.2%。试验结果表明,活、死细胞对CIT的吸附作用基本没有差别,说明热灭活对CIT的吸附作用基本没有影响。MOHAMED等[24]从腐烂的蓝藻中分离出的一株酵母菌,利用活酵母和热灭活酵母2组实验组对微囊藻毒素进行吸附,结果表明活酵母细胞和热灭活酵母细胞表面均能吸附微囊藻毒素。KURODA等[25]利用酵母菌细胞壁表面的NikRm蛋白对铀酰离子的吸附作用进行试验。结果表明,经过串联融合后酵母细胞吸附体系可以回收铀酰离子,并对铀酰离子进行吸附。因此,酵母菌细胞壁对毒素具有吸附能力,但吸附效果不明显,故推测酵母菌降解CIT不是单一的吸附作用,还可能存在其他的有效组分可以降解CIT;将提取的胞内代谢物、胞外代谢物分别加入质量浓度为8.0 μg/mL的CIT标准溶液,在培养72 h后,胞内代谢物、胞外代谢物质量浓度分别下降到6.4 μg/mL、6.5 μg/mL,降解率分别为20.0%、18.8%。分析实验数据可得到,细胞内外代谢产物代的降解差距不大。因此,推测对CIT的降解可能是多组分共同作用的结果。
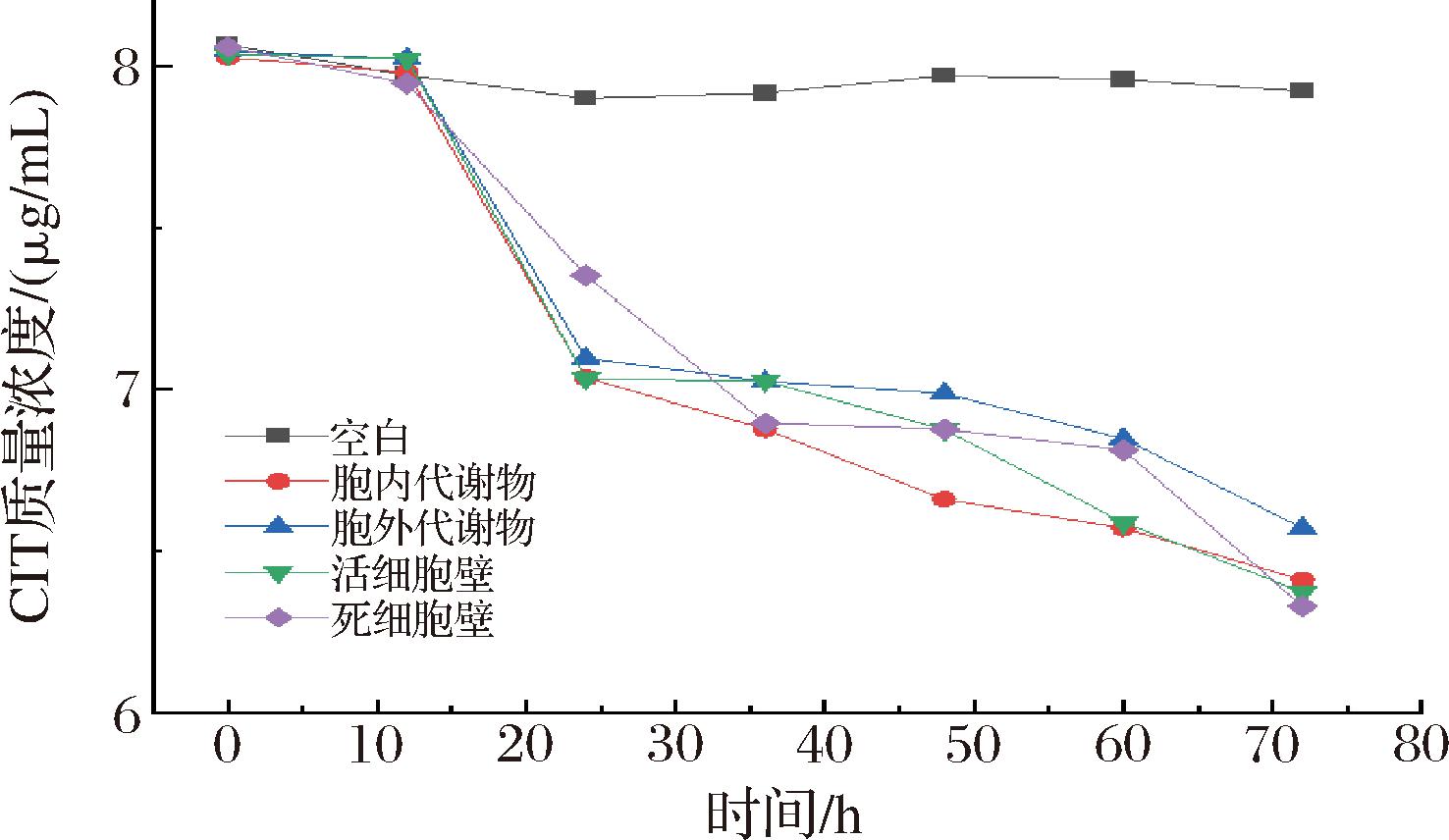
图5 酵母菌细胞壁及胞内、外代谢物对CIT降解效果的影响
Fig.5 Effects of yeast cell walls and intracellular and extracellular metabolites on CIT degradation
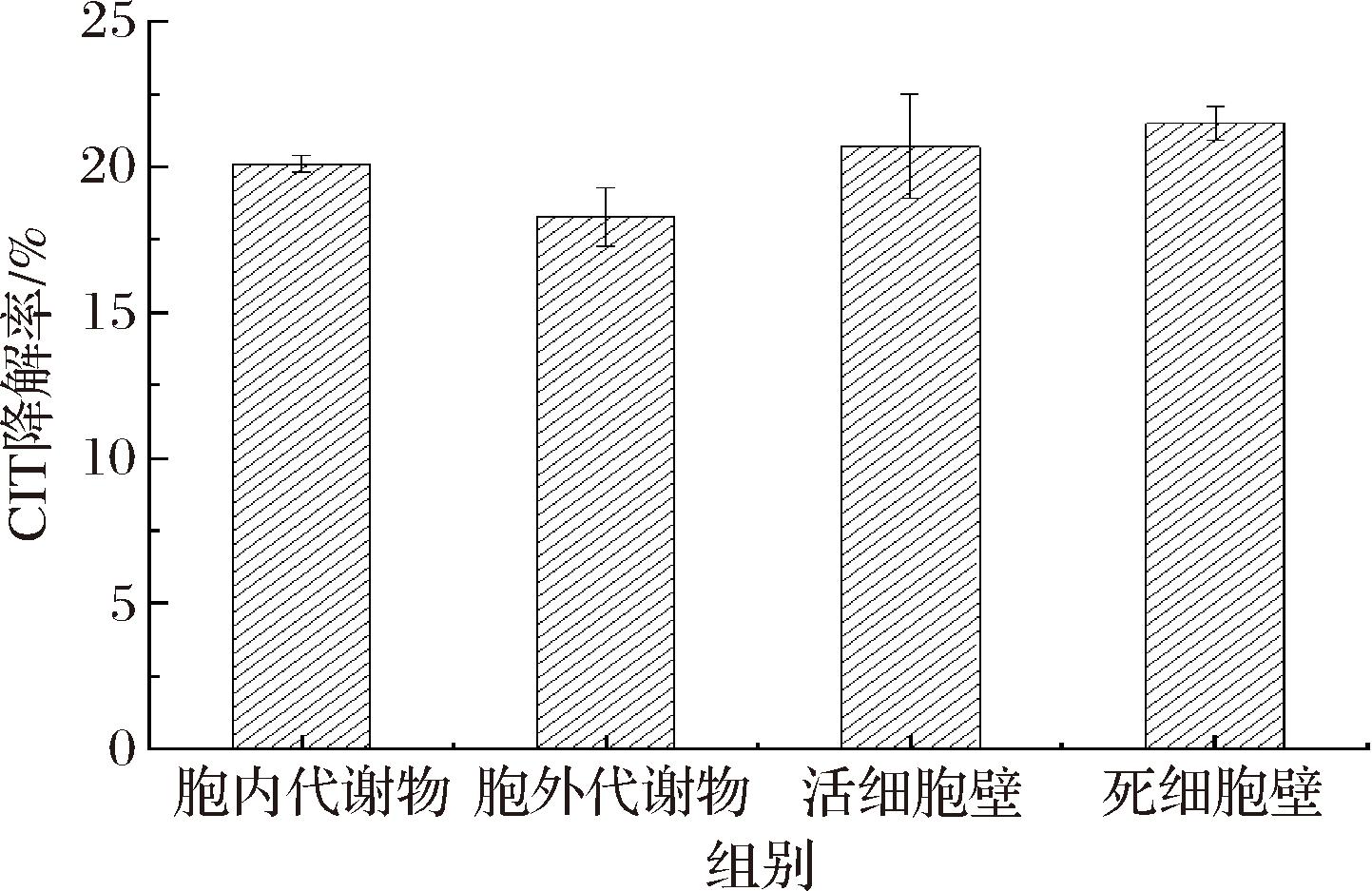
图6 酵母菌PT的细胞壁、胞内代谢物及胞外代谢产物对CIT降解效果的影响
Fig.6 Effects of cell wall, intracellular metabolites and extracellular metabolites of yeast PT on CIT degradation
2.2.3 两种酵母菌混合培养对CIT降解效果的影响
将酵母菌B、C、YC3分别与酵母菌PT混合,探究其对CIT降解效果的影响,结果如图7所示,酵母菌B、C、YC3分别与酵母菌PT菌液复合后,对CIT的降解效果同单一菌株PT无显著性差异。其原因可能是在所选菌株中,不同酵母菌复合吸附处理后没有形成明显的复合效应和联合拮抗作用[26]。常程程[27]从多种被黄曲霉毒素B1污染的谷物中,筛选分离出3株对黄曲霉毒素B1降解效果较好的芽孢杆菌,探究了3株芽孢杆菌不同混合比例对黄曲霉毒素B1的降解效果,结果显示,有些混合比例的菌群较单一菌株对黄曲霉毒素B1的降解效果无明显差异,可能是因为菌株之间存在竞争关系,竞争培养基中的营养成分用于菌株自身的生长发育。推测酵母菌B、C、YC3与酵母菌PT复合后,酵母菌之间产生竞争关系,争夺营养物质用于菌体生长发育,减弱了对CIT的降解效果。此外,当菌浓度提高到一定程度时,酵母细胞在体系中的扩散程度到达饱和,对CIT的吸附作用可达到恒定状态[28]。因此,复合酵母菌液在溶液中达到饱和状态后,对CIT的降解效果达到稳定状态,不会随酵母菌液体积的增加改变对CIT的降解效果。
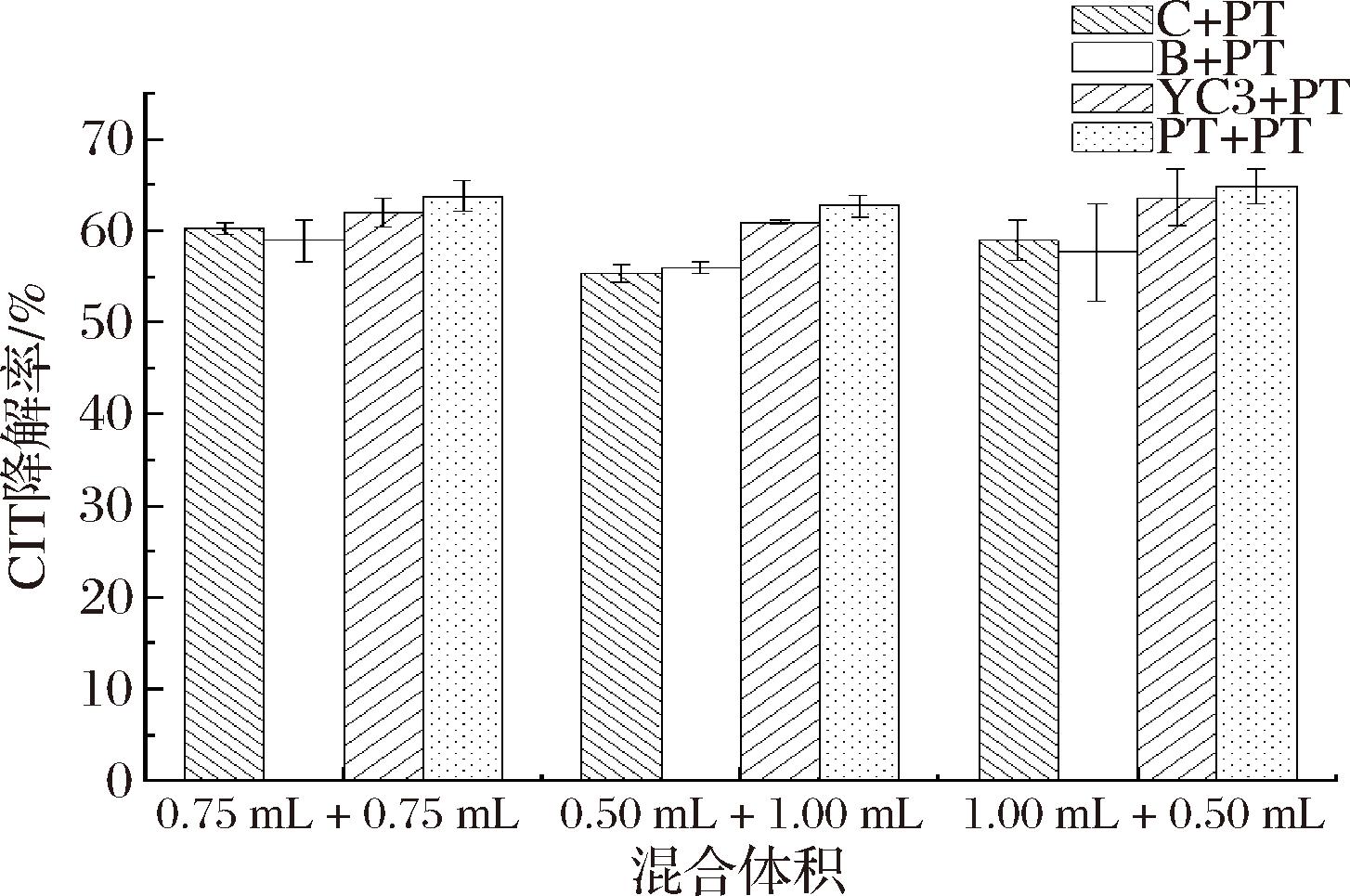
图7 两种酵母菌混合培养对CIT降解效果的影响
Fig.7 Effect of mixed culture of two yeasts on CIT degradation
2.2.4 酵母菌PT结合物理吸附剂对CIT降解效果的影响
将酵母菌PT结合物理吸附剂蒙脱土K-10,探究其对CIT降解效果的影响,结果如图8所示。将1 mg蒙脱土K-10加入CIT准液,其降解率为58.8%。另外,单独酵母菌PT降解CIT,其降解效果达到65.2%。对比酵母菌PT和蒙脱土K-10以不同比例混合和单独物理吸附剂蒙脱土K-10降解CIT的效果,发现CIT的降解率上升了13.4%,说明加入酵母菌PT显著提升了CIT的降解效果。同时,随着物理吸附剂蒙脱土K-10的增加,CIT降解率基本保持不变,并无显著性差异,这可能由于物理吸附剂蒙脱土K-10的溶解度达到饱和状态。杨慧莹[29]探究不同添加量蒙脱土对黄曲霉毒素B1的吸附效果,结果显示,随着蒙脱土添加量的增加,黄曲霉毒素B1的吸附效果保持不变。其原因为溶液中的蒙脱土溶解度达到饱和状态,饱和状态后的溶液体系稳定,对黄曲霉毒素B1的吸附效果趋于稳定。因此,物理吸附剂蒙脱土K-10作为酵母菌PT的辅助添加剂可提升对CIT的降解效果。
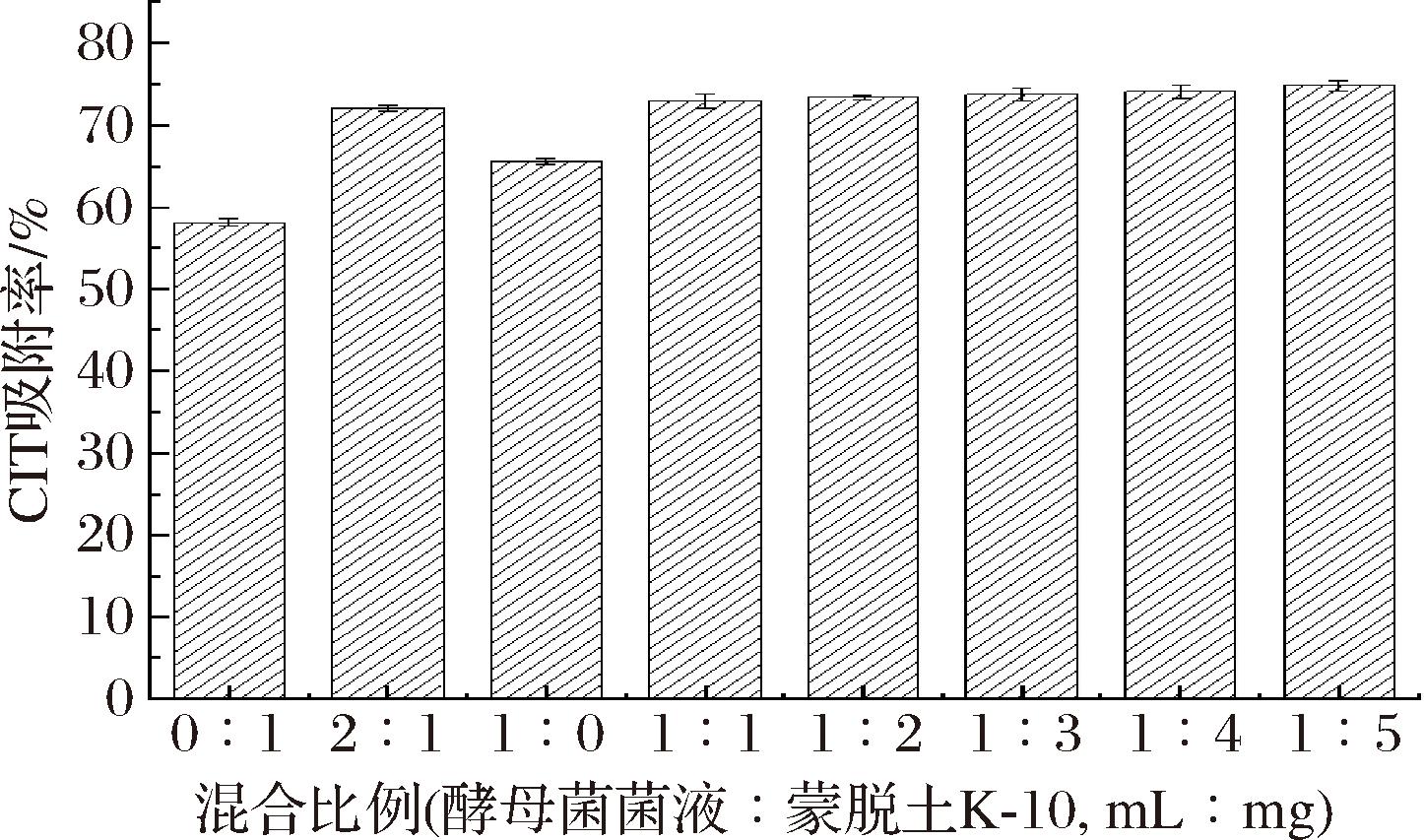
图8 酵母菌PT结合物理吸附剂蒙脱土K-10对CIT降解效果的影响
Fig.8 Effect of yeast PT combined with sorbent montmorillonite K-10 on CIT degradation
3 结论
本研究从实验室分离保藏的18株酵母菌中筛选出1株对CIT的降解效果最好的酵母菌PT,其对CIT降解率为65.7%。经过形态学和分子生物学鉴定,确定酵母菌PT为毕赤酵母菌(Pichia pastoris)。酵母菌PT降解CIT的细胞组分为胞内代谢物、胞外代谢物及酵母菌细胞壁,是多组分共同降解的作用。其中,胞内代谢物、胞外代谢物、细胞壁的CIT降解率分别为20.0%、18.8%、21.2%。将物理吸附剂蒙脱土K-10与酵母菌PT复合后,并探究其对CIT的降解效果,结果显示,酵母菌PT与物理吸附剂蒙脱土K-10(1∶1)联合对CIT的降解率为73.4%。本研究筛选出的毕赤酵母菌进一步扩大了生物降解菌的菌种库,为毕赤酵母菌降解CIT的研究提供了理论基础,为食品加工和贮藏过程中CIT污染带来的经济损失和粮食损耗提供了生物防治的新思路。现在尚不明确有效降解CIT的活性物质的具体成分,后续可进一步探究,并对降解过程中产生的降解产物及毒性等进行深入研究。
[1] 王丽玲. 红色红曲菌M7中光受体基因的功能研究[D].武汉:华中农业大学, 2017.
WANG L L.Functional analysis of photoreceptor gene in Monascus rubra M7[D].Wuhan:Huazhong Agricultural University, 2017.
[2] WANG J J, LEE C L, PAN T M.Improvement of monacolin K, gamma-aminobutyric acid and citrinin production ratio as a function of environmental conditions of Monascus purpureus NTU 601[J].Journal of Industrial Microbiology &Biotechnology, 2003, 30(11):669-676.
[3] LEE B H, PAN T M.Benefit of Monascus-fermented products for hypertension prevention:A review[J].Applied Microbiology and Biotechnology, 2012, 94(5):1151-1161.
[4] LIN Y L, WANG T H, LEE M H, et al.Biologically active components and nutraceuticals in the Monascus-fermented rice:A review[J].Applied Microbiology and Biotechnology, 2008, 77(5):965-973.
[5] FENG Y L, SHAO Y C, CHEN F S.Monascus pigments[J].Applied Microbiology and Biotechnology, 2012, 96(6):1421-1440.
[6] PATAKOVA P.Monascus secondary metabolites:Production and biological activity[J].Journal of Industrial Microbiology &Biotechnology, 2013, 40(2):169-181.
[7] 殷倩倩, 左勇.高产色素低产桔青霉素红曲霉菌筛选及发酵工艺优化研究[J].中国调味品, 2024, 49(2):62-68.
YIN Q Q, ZUO Y.Study on screening and fermentation process optimization of Monascus with high-yield pigment and low-yield citrinin[J].China Condiment, 2024, 49(2):62-68.
[8] BLANC P J, LAUSSAC J P, LE BARS J, et al.Characterization of monascidin A from Monascus as citrinin[J].International Journal of Food Microbiology, 1995, 27(2-3):201-213.
[9] WU D Y, YANG C L, YANG M R, et al.Citrinin-induced hepatotoxicity in mice is regulated by the Ca2+/endoplasmic reticulum stress signaling pathway[J].Toxins, 2022, 14(4):259.
[10] SUGIYAMA K I, FURUSAWA H, HONMA M.Detection of epigenetic effects of citrinin using a yeast-based bioassay[J].Mycotoxin Research, 2019, 35(4):363-368.
[11] BERNDT W O.Transport of citrinin by rat renal cortex[J].Archives of Toxicology, 1983, 54(1):35-40.
[12] DE OLIVEIRA FILHO J W G, ANDRADE T J A D S, DE LIMA R M T, et al.Cytogenotoxic evaluation of the acetonitrile extract, citrinin and dicitrinin-A from Penicillium citrinum[J].Drug and Chemical Toxicology, 2022,45(2):688-697.
[13] KANG B Y, ZHANG X H, WU Z Q, et al.Production of citrinin-free Monascus pigments by submerged culture at low pH[J].Enzyme and Microbial Technology, 2014, 55:50-57.
[14] GU S, CHEN Z Z, WANG F, et al.Characterization and inhibition of four fungi producing citrinin in various culture media[J].Biotechnology Letters, 2021, 43(3):701-710.
[15] 刘宏, 陈迪, 陈勉华, 等.不同单色光对紫色红曲霉生长、色素和桔霉素合成的影响[J].食品科学技术学报, 2019, 37(2):48-55.
LIU H, CHEN D, CHEN M H, et al.Effects of different monochromatic light on growth, pigments and citrinin biosynthesis of Monascus purpureus[J].Journal of Food Science and Technology, 2019, 37(2):48-55.
[16] XU M J, YANG Z L, LIANG Z Z, et al.Construction of a Monascus purpureus mutant showing lower citrinin and higher pigment production by replacement of ctnA with pks1 without using vector and resistance gene[J].Journal of Agricultural and Food Chemistry, 2009, 57(20):9764-9768.
[17] MOGHADAM H D, TABATABAEE YAZDI F, SHAHIDI F, et al.Co-culture of Monascus purpureus with Saccharomyces cerevisiae:A strategy for pigments increment and citrinin reduction[J].Biocatalysis and Agricultural Biotechnology, 2022, 45:102501.
[18] 秦艳婷. 新疆地区传统发酵乳制品中乳酸菌的分离鉴定及生物多样性分析[D]. 呼和浩特: 内蒙古农业大学, 2014.
QIN Y T. Isolation, identification and biodiversity analysis of lactic acid bacteria from traditional fermented dairy products in Xinjiang[D]. Hohhot: Inner Mongolia Agricultural University, 2014.
[19] SUHARNA N RAYA J.Production of non citrinin Chinese red yeast rice by using Monascus purpureus Skw2 co-cultured with Bacillus megaterium[J].International Journal of Advanced Research in Biological Sciences, 2015, 2(2):72-78.
[20] ARMANDO M R, PIZZOLITTO R P, DOGI C A, et al.Adsorption of ochratoxin A and zearalenone by potential probiotic Saccharomyces cerevisiae strains and its relation with cell wall thickness[J].Journal of Applied Microbiology, 2012, 113(2):256-264.
[21] AJDARI Z, EBRAHIMPOUR A, ABDUL MANAN M, et al.Nutritional requirements for the improvement of growth and sporulation of several strains of Monascus purpureus on solid state cultivation[J].Journal of Biomedicine &Biotechnology, 2011, 2011:487329.
[22] HE S S, WANG Y L, XIE J H, et al.1H NMR-based metabolomic study of the effects of flavonoids on citrinin production by Monascus[J].Food Research International, 2020, 137:109532.
[23] 徐素吟. 红色红曲菌M7中桔霉素生物合成的调控机制解析[D].武汉:武汉轻工大学, 2022.
XU S Y.Analysis on the regulation mechanism of citrinin biosynthesis in Monascus ruber M7[D].Wuhan:Wuhan Polytechnic University, 2022.
[24] MOHAMED Z A, ALAMRI S, HASHEM M, et al.Growth inhibition of Microcystis aeruginosa and adsorption of microcystin toxin by the yeast Aureobasidium pullulans, with no effect on microalgae[J].Environmental Science and Pollution Research Interational, 2020, 27(30):38038-38046.
[25] KURODA K, EBISUTANI K, IIDA K, et al.Enhanced adsorption and recovery of uranyl ions by NikR mutant-displaying yeast[J].Biomolecules, 2014, 4(2):390-401.
[26] 宋玉. 黄曲霉毒素B1脱除菌株的筛选及其特性与应用研究[D]. 南京: 南京理工大学, 2021.
SONG Y. Screening, characteristics and application of aflatoxin B1-removing strains[D]. Nanjing: Nanjing University of Science and Technology, 2021.
[27] 常程程. 大宗粮食黄曲霉毒素高效降解菌的筛选与机理初探[D]. 兰州: 兰州交通大学, 2023.
CHANG C C. Screening and mechanism of high-efficiency aflatoxin degrading bacteria in bulk grain[D]. Lanzhou: Lanzhou Jiatong University, 2023.
[28] 王玲. 复合酵母菌M3-1抑菌效果及机理、制剂制备及在黄桃保鲜上的应用[D]. 镇江: 江苏大学, 2021.
WANG L. Antibacterial effect and mechanism of compound yeast M3-1, preparation of preparation and its application in the preservation of yellow peaches[D]. Zhenjiang: Jiangsu University, 2021.
[29] 杨慧莹. 不同霉菌毒素吸附剂对黄曲霉毒素B1的吸附效果研究[D]. 长春: 吉林农业大学, 2023.
YANG H Y. Study on adsorption effect of different mycotoxin adsorbents on aflatoxin B1[D]. Changchun: Jilin Agricultural University, 2023.