胶原蛋白是一大类结构蛋白,具有良好的生物相容性和可降解性等优点,广泛应用于组织工程、医疗器械、制药工业和健康食品等领域[1-2]。根据来源不同,胶原蛋白可分为天然提取胶原和重组胶原[3]。天然提取胶原是通过酸碱水解或酶解等工艺从动物组织中提取,存在免疫原性、种间变异、批次间差异、宗教和动物伦理等问题[4]。重组胶原是将人源胶原DNA经合适的宿主表达并翻译的蛋白或类似胶原蛋白的多肽,相对于天然提取胶原,具有批次间稳定、组分可控、生物安全性高和可编辑修饰等优点[5]。但是,重组胶原具有较低的热稳定性,这限制了重组胶原的应用。
三螺旋结构是胶原蛋白的典型特征,与胶原的热稳定性密切相关[6-8]。FRANK等[9]尝试在胶原样肽C端添加T4 fibritin折叠结构域,设计出一种融合多肽(GlyProPro)10foldon并在大肠杆菌(Escherichia coli)中可溶性表达,对重组多肽表征发现,包含T4 fibritin的重组多肽形成了具有高度热稳定性的三聚体。T4 fibritin序列的修饰,使胶原样肽在表达过程中易形成三螺旋结构,热稳定性得到了提高。
目前已有的报道主要围绕T4 fibritin对胶原样肽稳定性的影响,而对重组人胶原稳定性影响的研究较少。本文旨在研究T4 fibritin对重组人胶原热稳定性的影响,选取人I型胶原蛋白α1链胶原域片段(1A1),在C末端添加T4 fibritin促折叠序列,构建融合蛋白基因1A1C。通过毕赤酵母(Pichia pastoris)表达系统表达得到类胶原蛋白1A1和1A1C,评估了其抗氧化活性、生物活性,并研究了1A1与1A1C的三螺旋水平及热稳定性,为制备良好热稳定性的重组胶原提供依据。
1 材料与方法
1.1 材料与试剂
毕赤酵母GS115及质粒载体pPIC9K,宝赛质粒菌株资源公司;人皮肤成纤维细胞(human skin fibroblasts, HSF),厦门逸漠生物科技有限公司;限制性内切酶EcoR I、Not I和Sac I、质粒抽提试剂盒、DNA Marker、6×Loading Buffer、蛋白质电泳Marker、Ni-NTA树脂、总抗氧化能力检测试剂盒,上海生工生物工程股份有限公司;蛋白上样缓冲液、细胞增殖-毒性检测试剂盒(cell counting kit-8,CCK-8),上海碧云天生物技术有限公司;酵母无氨基氮源培养基(yeast nitrogen base without amino acids,YNB),青岛高科技工业园海博生物技术有限公司;其他试剂为国产或进口分析纯;PCR引物合成及测序由北京擎科生物科技股份有限公司完成。
1.2 仪器与设备
Epoch酶标仪,美国博腾仪器有限公司;Chirascan V100圆二色谱仪(circular dichroism,CD),英国应用光物理公司;UV-1700紫外可见分光光度计,上海美析仪器有限公司;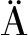 KTA pureTM 25蛋白纯化系统,Cytiva思拓凡;Micro Pulser电转仪,伯乐生命医学产品有限公司;FSU8020场发射扫描电子显微镜,日本日立。
KTA pureTM 25蛋白纯化系统,Cytiva思拓凡;Micro Pulser电转仪,伯乐生命医学产品有限公司;FSU8020场发射扫描电子显微镜,日本日立。
1.3 实验方法
1.3.1 重组表达载体的构建及验证
人I型胶原蛋白α1链177~355位氨基酸,经密码子优化后,两端添加EcoR I 和Not I酶切位点,在N端添加Kex2蛋白酶酶切位点和组氨酸标签,由北京擎科生物科技股份有限公司进行基因合成,经酵母胞内Kex2蛋白酶切割后可暴露出完整的组氨酸标签。将基因克隆至表达载体pPIC9K,命名为pPIC9K-1A1,并热转化大肠杆菌DH5α中,卡那霉素抗性筛选。挑取单菌落进行培养,使用质粒抽提试剂盒提取重组质粒pPIC9K-1A1。利用聚合酶链式反应在C端添加T4 fibritin序列,转化大肠杆菌DH5α,命名为pPIC9K-1A1C。2个重组质粒经测序验证,序列正确。图1为pPIC9K-1A1和pPIC9K-1A1C质粒图谱。将重组质粒pPIC9K-1A1和pPIC9K-1A1C经Sac I内切酶线性化后,电转化入毕赤酵母GS115中,最小葡萄糖培养基(minimal dextrose medium,MD)营养缺陷筛选。重组菌株分别命名为GS115/pPIC9K-1A1和GS115/pPIC9K-1A1C。
a-pPIC9K-1A1质粒图谱;b-pPIC9K-1A1C质粒图谱
图1 重组表达载体pPIC9K-1A1和pPIC9K-1A1C结构示意图
Fig.1 Structural diagram of the recombinant expression vector pPIC9K-1A1 and pPIC9K-1A1C
1.3.2 重组菌株培养
对于DH5α/pPIC9K菌株,使用LB培养基在37 ℃,220 r/min条件进行摇床培养。对于GS115/pPIC9K菌株,使用酵母浸出粉蛋白胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)在 30 ℃、260 r/min条件进行摇床培养。对于GS115/pPIC9K菌株的诱导培养,接种体积分数1%YPD液体培养基过夜培养的菌液至含缓冲甘油复合培养基(buffered minimal glycerol medium,BMGY)的摇瓶中,培养基体积不超过摇瓶容积的20%,双层纱布封口,同样条件培养至OD600为2~6。离心收集菌体,使用缓冲甲醇复合培养基(buffered methanol-complex medium,BMMY)重悬菌体至OD600为1.0,诱导培养72 h,每24 h补加甲醇至体积分数为1%。诱导结束后,5 000 r/min,离心10 min收集发酵上清液。
1.3.3 类胶原蛋白制备与检测
所有的纯化步骤均在冰水浴下进行,在1.3.2节中离心收集的发酵上清液中缓慢加入50%饱和硫酸铵并持续搅拌,待硫酸铵充分溶解后在冰水浴静置30 min。10 000×g离心15 min,弃去上清液,收集沉淀,使用结合缓冲液(20 mmol/L Tris-HCl,20 mmol/L咪唑,500 mmol/L氯化钠,pH 8.0)复溶得到初步浓缩液。
将复溶后的含组氨酸标签目的蛋白的初步浓缩液经0.45 μm滤膜过滤后上样,流速1.0 mL/min,柱体积为1 mL。使用结合缓冲液将基线洗平后进行线性梯度洗脱,0%~100%洗脱缓冲液(20 mmol/L Tris-HCl,500 mmol/L咪唑,500 mmol/L氯化钠,pH 8.0)15 min,每管1 mL收集洗脱液。监测波长280 nm紫外吸收,记录峰位置,蛋白样品经SDS-PAGE检测,考马斯亮蓝染色,采用BCA(bicinchoninic acid assay)法测定蛋白浓度。
1.3.4 紫外全波长扫描
利用紫外可见分光光度计对重组类胶原蛋白溶液进行紫外光谱扫描,扫描范围为190~400 nm,同时扫描Sigma I型鼠尾胶原作为对照。
1.3.5 类胶原蛋白的抗氧化活性分析
制备不同浓度的类胶原蛋白溶液,分别采用DPPH法和ABTS法检测类胶原蛋白总抗氧化能力,阳性对照为不同浓度维生素C溶液。自由基清除率计算如公式(1)所示:
自由基清除率![]()
(1)
式中:A0,空白管吸光度,a.u.;A,测定管吸光度,a.u.。
1.3.6 类胶原蛋白的形貌分析
将纯化后的类胶原蛋白透析24 h后,冷冻干燥得到类胶原蛋白粉末。将完全冻干的类胶原蛋白粉末喷铂40 s后,使用场发射扫描电子显微镜对类胶原蛋白粉末进行二次电子成像,以观察其微观结构。
1.3.7 圆二色光谱扫描
蛋白质生物大分子由手性亚基组成,当被近紫外和远紫外波长范围内的圆偏振光照射时,这些亚基会产生偏振信号,由此可推导蛋白质构象信息[10]。本研究通过检测重组类胶原圆二色光谱来分析其三螺旋水平。将冻干的类胶原蛋白粉末溶于50 mmol/L的pH 5.0的乙酸钠缓冲液中(0 h),在4 ℃放置48 h后进行热变温实验。升温变性实验在10~70 ℃温度范围内进行,升温步进为5 ℃,每个温度采样间隔时间为300 s以充分平衡[11]。升温结束后在70 ℃保持30 min,降温步进5 ℃进行复性实验,之后静置48 h,此时为96 h。在0、48和96 h对2种蛋白在20 ℃下进行圆二色光谱扫描,波长范围为190~260 nm,带宽1 nm,数据点采样时间为0.5 s。热变性温度(Tm值)通过Global3软件拟合求得,圆二色光谱测试所用蛋白质量浓度为0.05 mg/mL。
1.3.8 类胶原蛋白的生物相容性分析
称取冻干类胶原蛋白纯品,用磷酸盐缓冲液溶解配制成1 mg/mL类胶原蛋白溶液,稀释成不同质量浓度。调整HSF细胞密度,在96孔板中每孔接种2 000个细胞(100 μL/孔),在细胞培养箱中孵育24 h。吸出完全培养基,经100 μL磷酸盐缓冲液润洗后,加入90 μL不含血清的DMEM(Dulbecco’s modified eagle medium)培养基和10 μL不同质量浓度类胶原蛋白溶液,孵育24 h。每孔加入10 μL CCK-8溶液继续孵育2 h后,使用酶标仪测定波长450 nm吸光度。
2 结果与分析
2.1 类胶原蛋白在毕赤酵母中的诱导表达及纯化
2.1.1 重组质粒的验证
DH5α/pPIC9K-1A1和DH5α/pPIC9K-1A1C阳性克隆经北京擎科生物科技股份有限公司武汉分公司测序,比对确认序列正确,构建成功。
2.1.2 目的蛋白的表达纯化
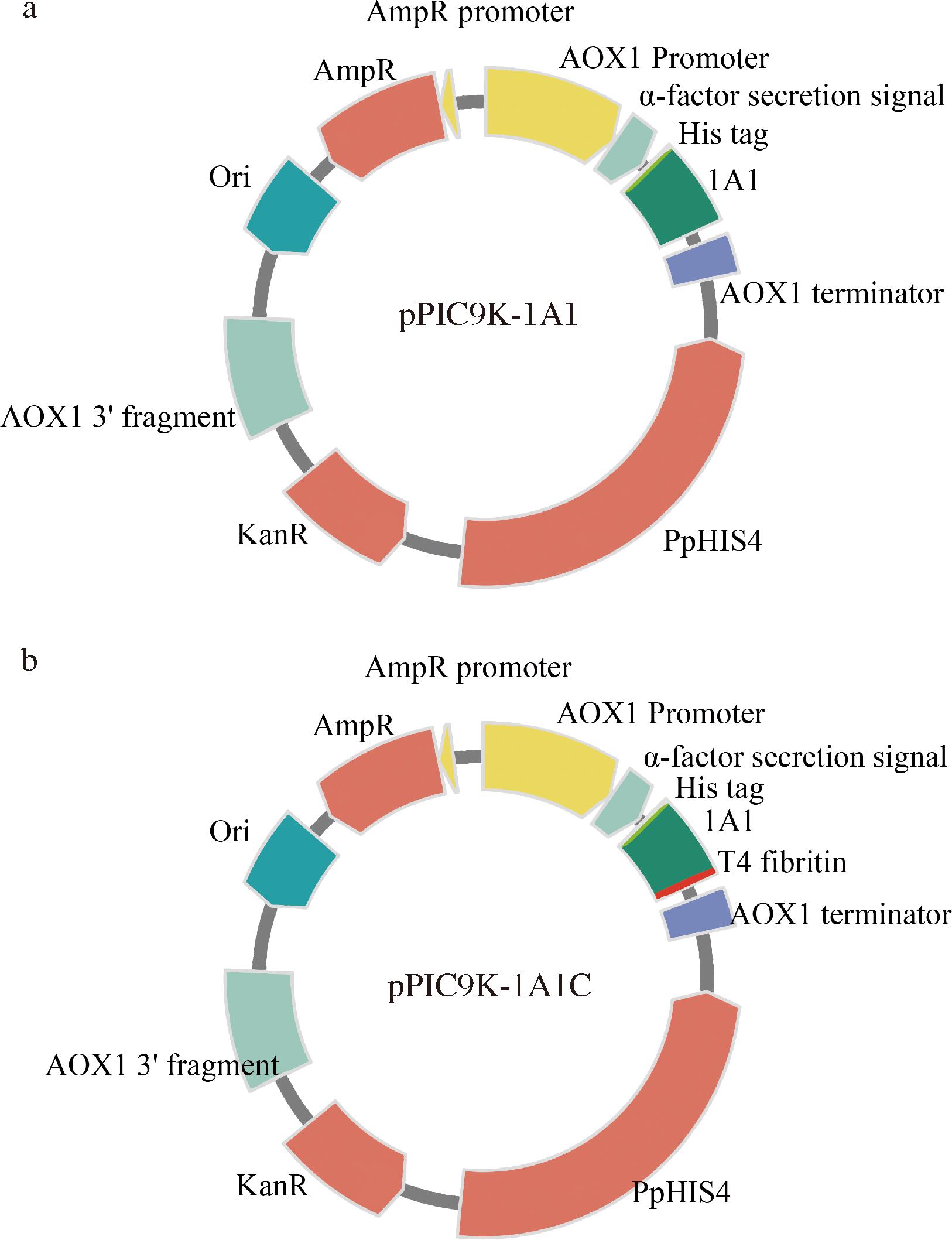
2种蛋白发酵原液及纯化流穿经SDS-PAGE电泳检测如图2所示。选用低浓度咪唑(20 mmol/L)可以降低非特异性吸附,使用线性洗脱(20~500 mmol/L咪唑)并收集洗脱液,咪唑浓度在200 mmol/L时出现紫外吸收峰,因此可用20 mmol/L咪唑淋洗以洗去杂蛋白,200 mmol/L咪唑洗脱目的蛋白。目的蛋白1A1分子质量为17 kDa,1A1C分子质量为20.1 kDa,电泳凝胶经成像扫描后采用ImageJ 1.54软件分析计算目的蛋白胞外分泌表达量分别约为17 mg/L 1A1和12 mg/L 1A1C。目的蛋白下面条带推测可能为目的蛋白被毕赤酵母释放的蛋白酶B、羧肽酶Y和氨肽酶Co等水解酶水解[12]。在发酵表达后期,pH值有所升高,部分酵母细胞自溶释放出的蛋白酶会造成胶原蛋白的水解,可通过缩短诱导时间、降低培养的pH值和加入酪蛋白氨基酸等方法降低酵母胞内水解酶对外源表达蛋白的影响。
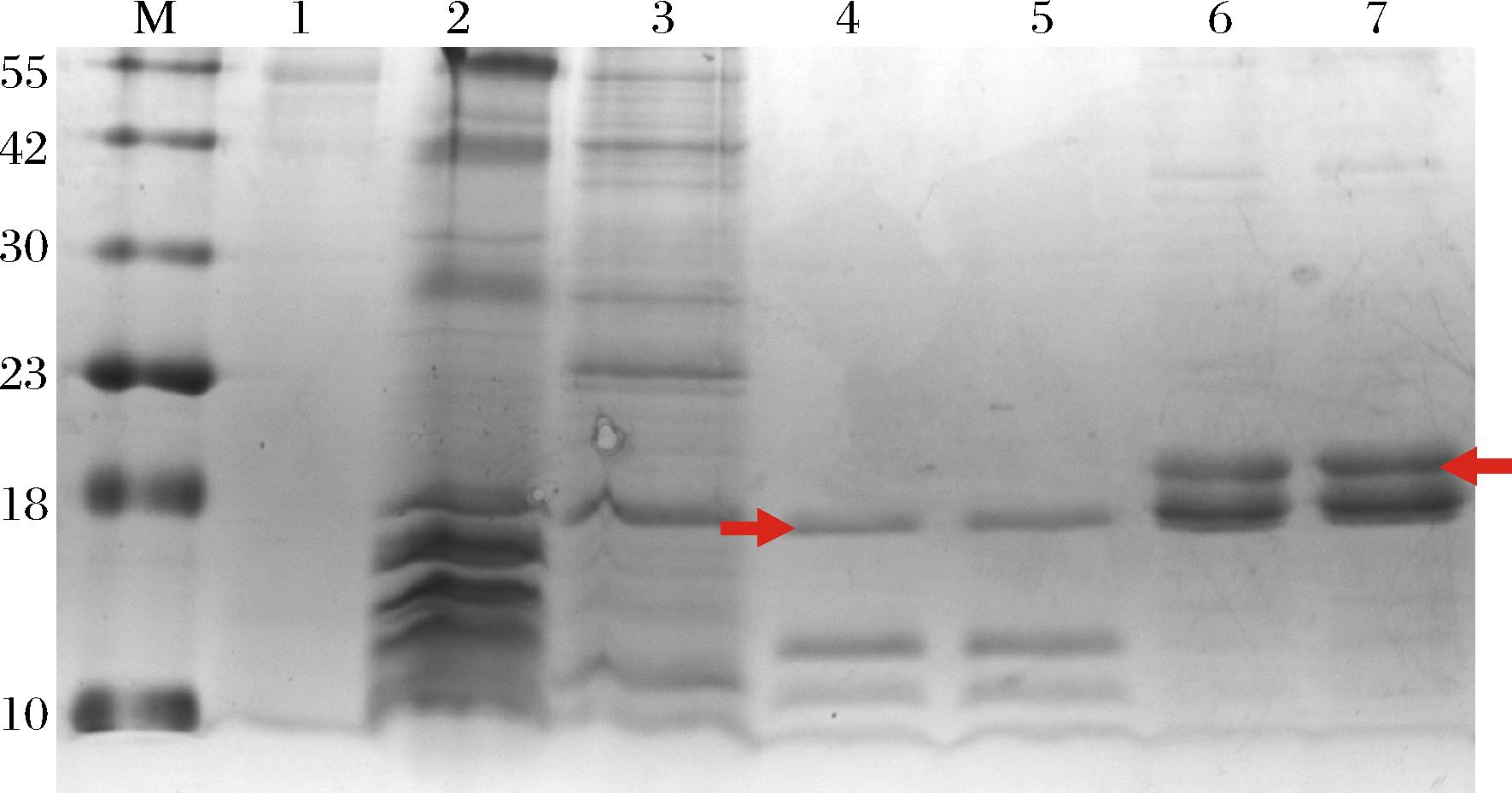
图2 重组类胶原蛋白的制备与检测
Fig.2 Preparation and detection of recombinant type I human-like collagen
注:M:蛋白质Marker;1:空质粒转化酵母对照;2:类胶原蛋白1A1发酵液;3:类胶原蛋白1A1C发酵液;4-5:类胶原蛋白1A1洗脱;6-7:类胶原蛋白1A1C洗脱。
2.1.3 发酵表达过程分析
使用BMGY培养基培养毕赤酵母至OD600值为2~6时,离心收集菌体,使用诱导培养基BMMY重悬细胞,使诱导起始OD600值为1.0,在摇瓶内培养,双层纱布封口。在诱导第4、12、24、48、72、96和120 h分别取样,检测OD600值、pH值和类胶原表达量,图3显示了毕赤酵母发酵过程相关参数变化。毕赤酵母在72 h之前生物量持续上升,72 h后生物量基本无变化,可认为此时毕赤酵母生长达到了稳定期。在72 h,上清液中类胶原表达量达到最高,而后上清液中类胶原蛋白水平有所下降,推测是因为类胶原被蛋白酶水解[12]。随着培养的进行,摇瓶内培养物pH值在48 h内基本稳定,在48 h后pH值升高,推测可能因为缓冲体系达到了最大缓冲能力,生物量的不断升高,导致氧气供应不足,酵母产生乳酸等酸性物质的能力下降,从而导致培养液pH值的升高[13]。
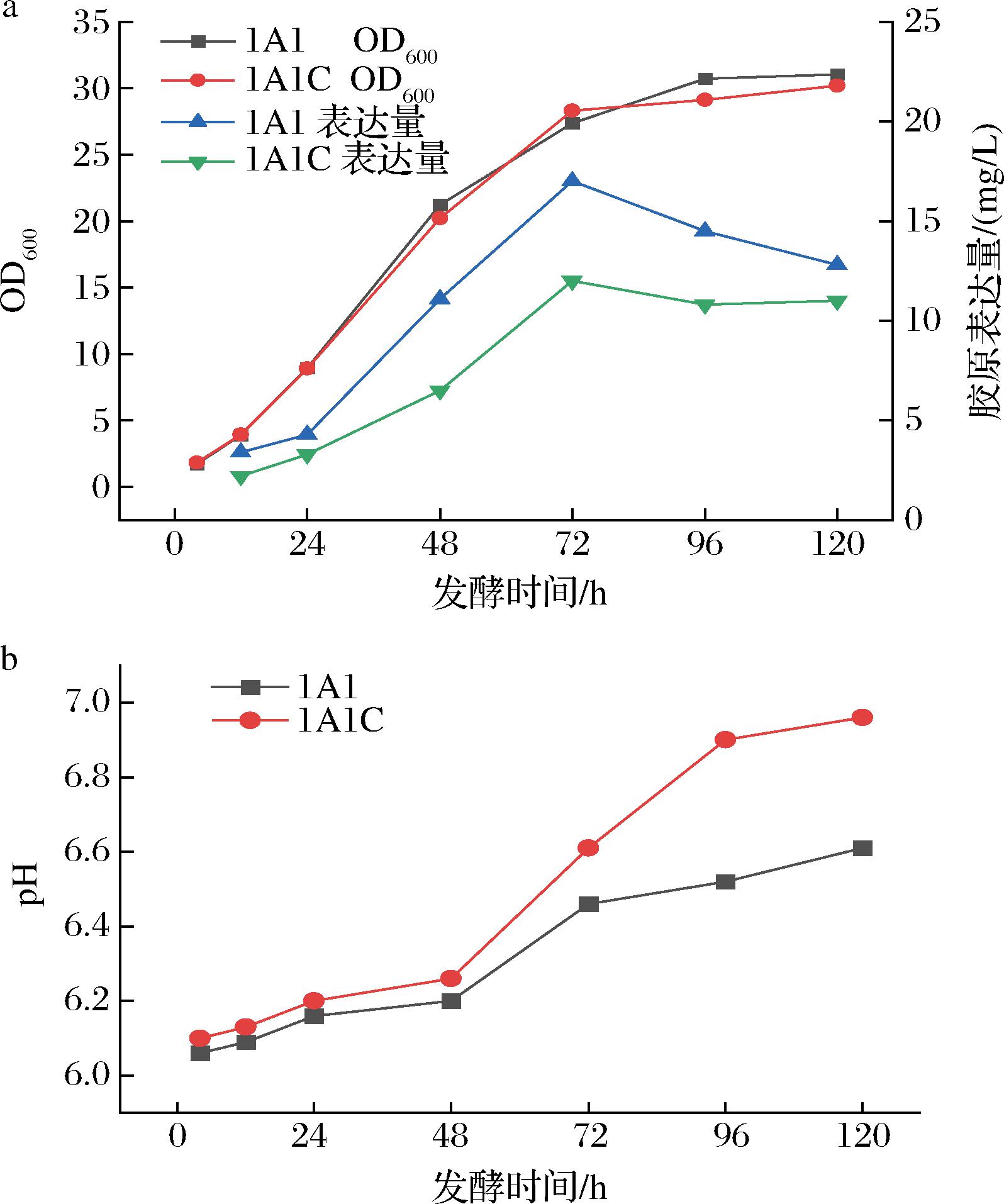
a-类胶原1A1和1A1C不同诱导时间的菌密度和表达量;b-类胶原1A1和1A1C不同诱导时间的pH值
图3 毕赤酵母摇瓶发酵过程参数变化
Fig.3 Changes of parameters during fermentation of Pichia pastoris in shake flask
2.2 重组胶原的性质研究
2.2.1 类胶原的紫外光谱扫描
胶原蛋白的肽链中含有生色基团,图4为类胶原1A1、1A1C和Sigma I型鼠尾胶原的紫外图谱,类胶原1A1在239 nm有吸收峰,类胶原1A1C在234和287 nm处有吸收峰,与Sigma I型胶原峰值一致,显示两者在结构上具有相似性[14]。250~300 nm的吸收峰是由色氨酸与酪氨酸的芳杂环残基π-π*跃迁导致,类胶原中这两种氨基酸含量较低,因而吸收峰较低[15]。而200~250 nm的吸收峰是由肽键羰基、羧基等基团的n→π*跃迁导致,肽链中含量较高,因而表现出较高吸收峰。
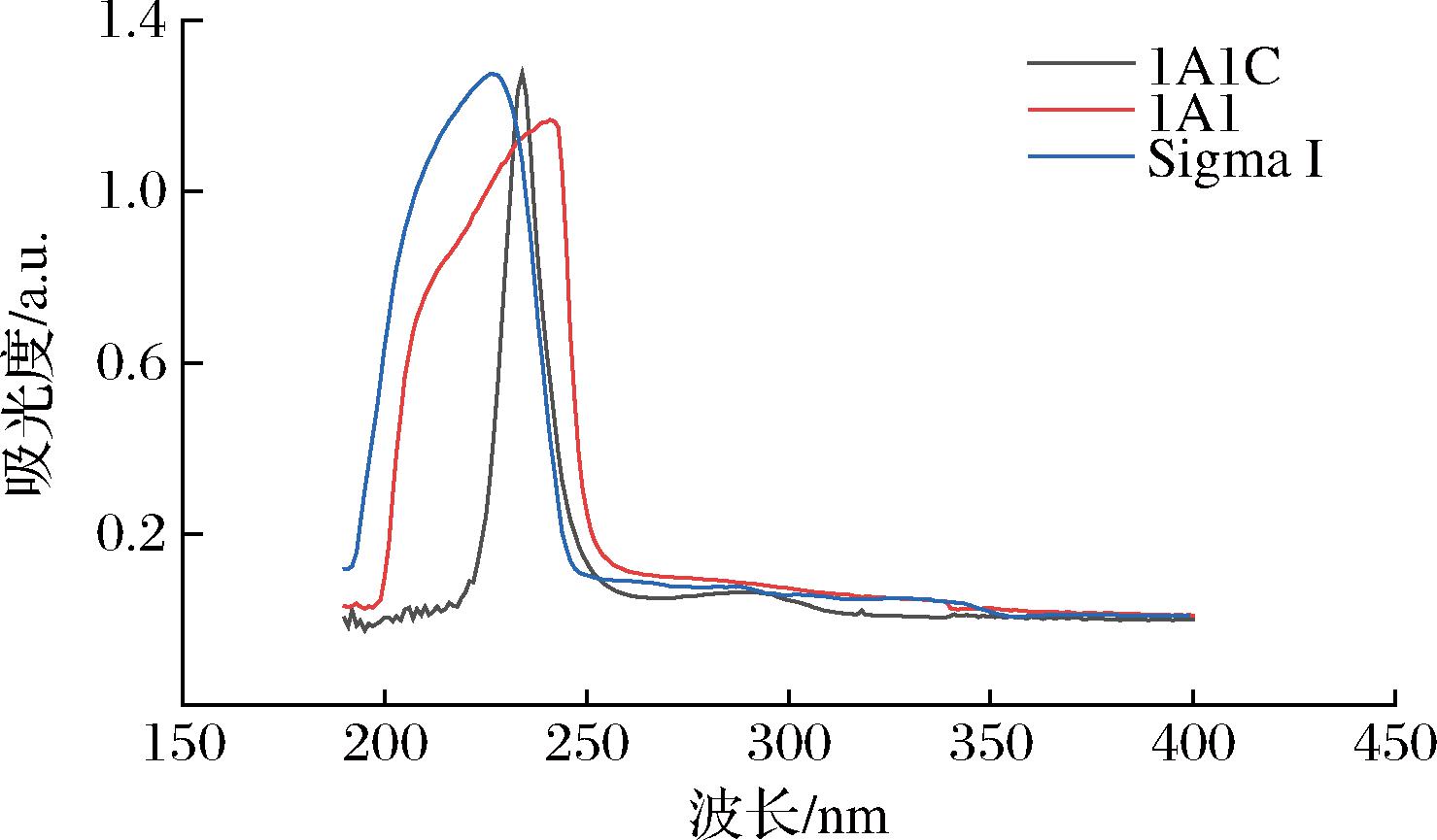
图4 重组类胶原的紫外图谱
Fig.4 Ultraviolet spectrum of recombinant type I human-like collagen
2.2.2 类胶原的抗氧化活性分析
图5显示了类胶原1A1、1A1C和维生素C的自由基清除实验结果。类胶原1A1在质量浓度1 mg/mL时,DPPH自由基和ABTS阳离子自由基清除率分别为7.4%和19.3%,当质量浓度升高到3 mg/mL时,类胶原1A1的DPPH自由基和ABTS阳离子自由基清除率分别为19.8%和40.0%,类胶原的自由基清除力表现出浓度依赖性。类胶原1A1C与1A1自由基清除力无显著差异,表明T4 fibritin对类胶原的抗氧化活性提升无显著影响。
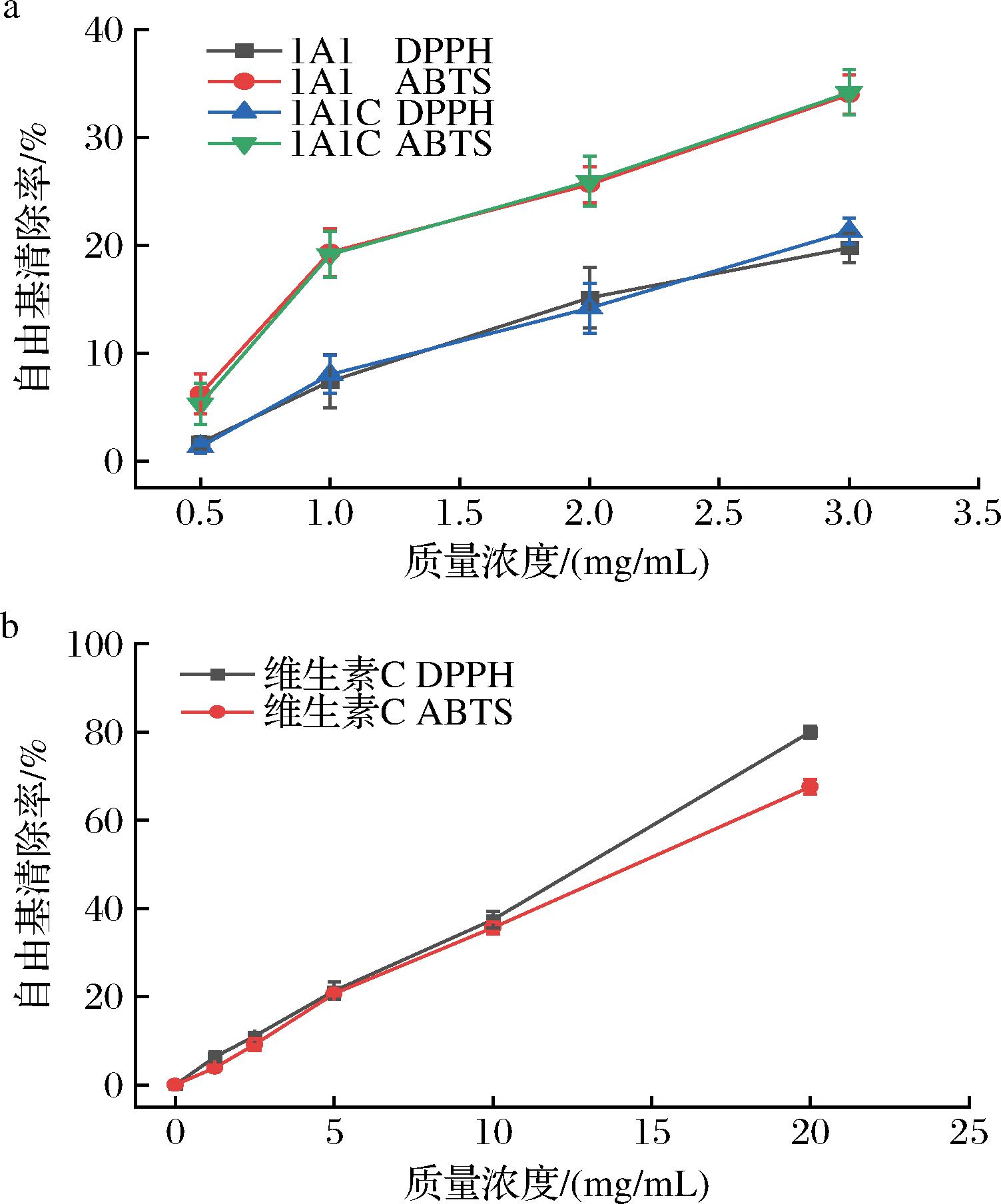
a-类胶原蛋白的自由基清除率曲线;b-阳性对照维生素C的自由基清除曲线
图5 重组类胶原抗氧化活性
Fig.5 Antioxidant activity of recombinant human-like collagen
胶原的抗氧化性主要来源于其所含有的一些氨基酸,如羟脯氨酸、羟赖氨酸和半胱氨酸等,且与分子质量大小有关[16-17]。LEON-LOPEZ等[17]通过DPPH自由基和ABTS阳离子自由基清除实验证实,从羊皮中提取的水解胶原(hydrolyzed collagen,HC)是一种天然抗氧化剂,具有良好的抗氧化活性,他们发现HC的抗氧化性能取决于分子质量的大小,肽的分子质量越低,提供电子或氢来稳定自由基的能力就越强,酶解4 h后得到HC,平均分子质量为5 kDa,处理效果最佳。类胶原1A1与1A1C自由基清除率远不及阳性对照,可以解释为以质量浓度做比较时,阳性对照为小分子纯品,而胶原分子质量相对较大且抗氧化成分占比较小[18]。
2.2.3 类胶原的CD扫描
胶原蛋白在198、225 nm处有特征吸收峰。在波长198 nm处出现负吸收峰是胶原分子构象中无规则卷曲结构的典型特征,225 nm处正吸收峰为左旋聚脯氨酸(P-II)构型肽链的典型特征[19]。胶原在225 nm处特征峰可以反映胶原蛋白三螺旋水平[7, 20]。图6显示了胶原在0 h,静置48 h,和热变温实验后静置48 h(第96 h)在20 ℃的CD图谱。冻干类胶原溶于50 mmol/L乙酸钠溶液后,0 h时,CD图谱显示在225 nm处无正吸收峰,表示类胶原没有形成三螺旋结构,为不成熟的胶原纤维。而在4 ℃静置48 h后,对类胶原进行测定发现,类胶原在198 nm负峰和225 nm正峰增强,表明类胶原在静置48 h内存在结构的变换,形成了高级的三螺旋结构,含有T4 fibritin的类胶原1A1C较1A1具有更显著的正峰,表示三螺旋水平更高。完成热变温实验后,正负峰均有所下降(图7),继续4 ℃静置48 h,类胶原蛋白1A1和1A1C的正负峰分别有所恢复,且含有T4 fibritin的1A1C在225 nm处的正峰基本恢复(图6-b),蓝线(96 h)与红线(48 h)基本重叠,表明类胶原在热变性后可以复性。
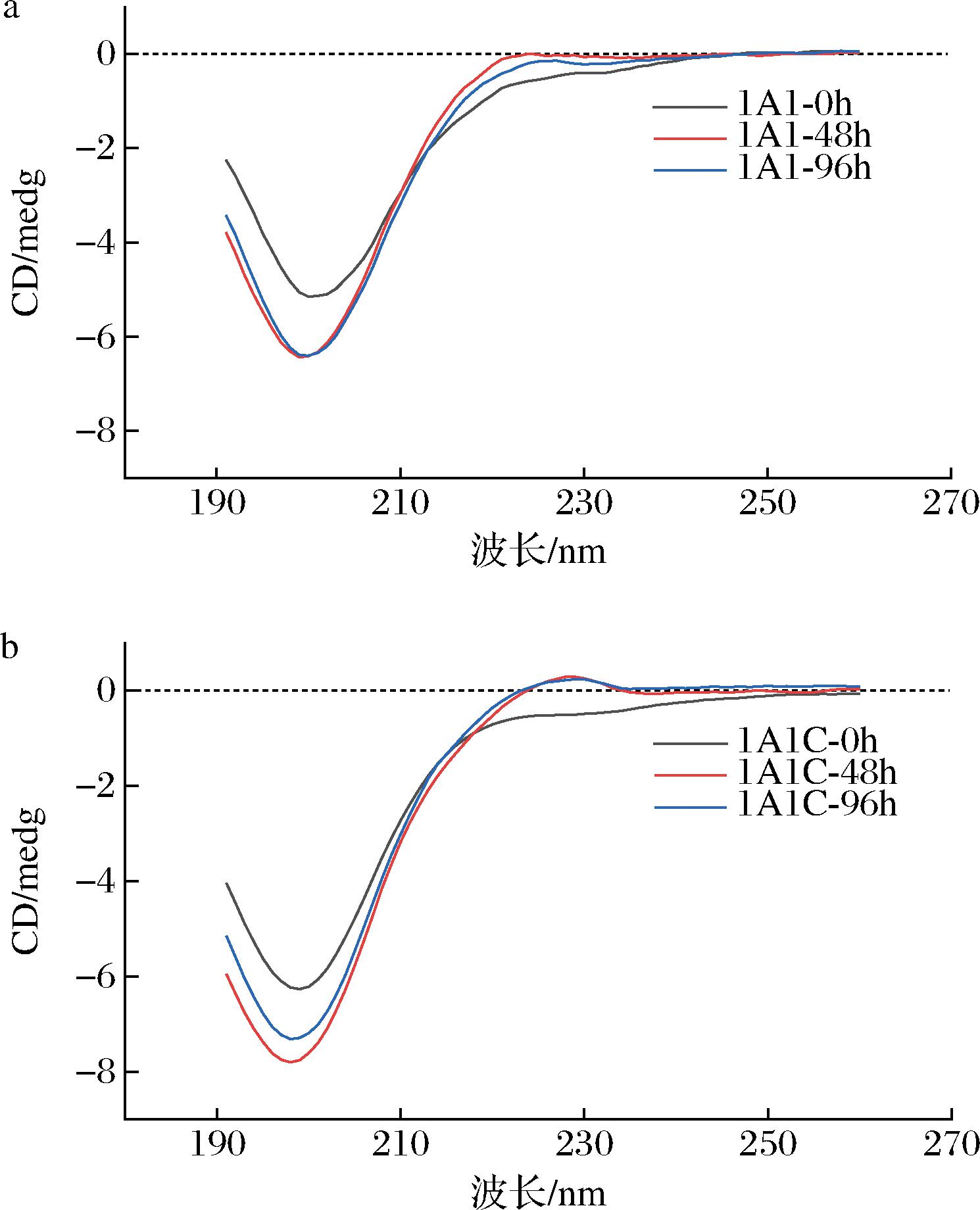
a-类胶原1A1不同时间CD图谱;b*类胶原1A1C不同时间CD图谱
图6 重组类胶原不同时间的圆二色图谱
Fig.6 Circular dichroism spectrum of recombinant type I human-like collagen at different time
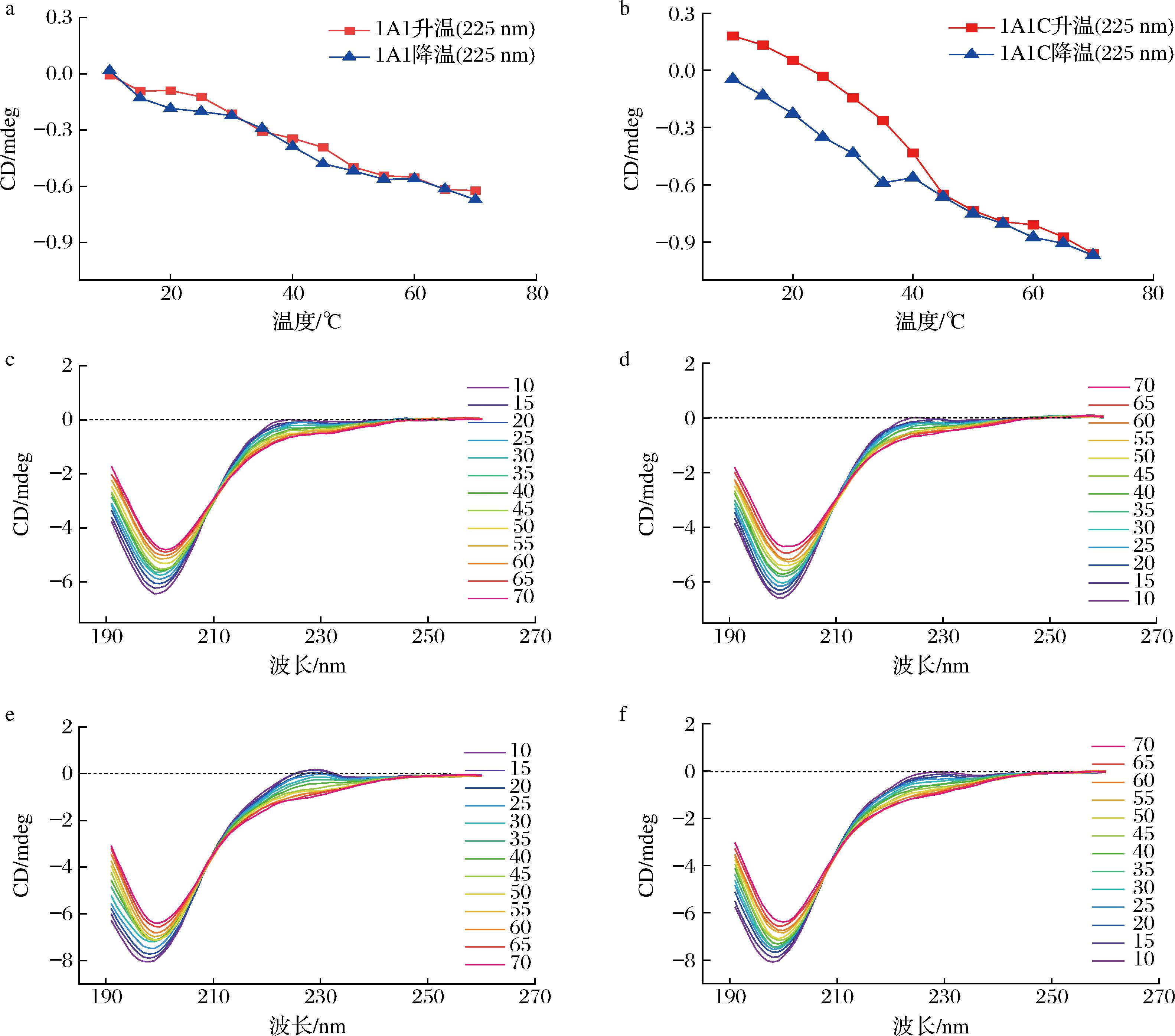
a-1A1在225 nm处CD值;b-1A1C在225 nm处CD值;c-1A1升温CD图谱;d-1A1降温CD图谱;e-1A1C升温CD图谱;f-1A1C降温CD图谱
图7 重组类胶原的变性和复性CD图谱
Fig.7 Circular dichroism spectrum of denaturation and renaturation of recombinant type I human-like collagen
已有研究表明,T4 fibritin可以促进纤维蛋白折叠,提高胶原模拟肽的热变性温度[9, 21-22],本研究通过重组技术将此序列融合到I型类胶原蛋白的末端。1A1和1A1C升温变性过程中CD图谱经Global3软件拟合,1A1的热变性温度Tm为(35.9±0.3) ℃,1A1C的热变性温度Tm为(39.9±0.2) ℃,含有T4 fibritin的胶原三螺旋水平更高,热变性温度提高了4 ℃,高于人体温度37 ℃,具有较大应用潜力。
图7为2种重组蛋白的热变温实验和降温复性实验CD图谱。胶原三螺旋的展开在加热时会显示出1个陡峭的转变,而复性则以较缓的方式进行[9, 23]。图7-a和图7-b为2种蛋白在225 nm处观测到的CD值,1A1C在升温过程40 ℃时有陡峭转变,这与Global3软件拟合出的Tm值(39.9±0.2) ℃相对应。图7-c、图7-d、图7-e、图7-f分别为1A1升温、降温和1A1C升温、降温的CD图谱,随着温度的升高,1A1和1A1C的图谱都出现特征峰强减弱,负峰峰位红移现象,而当温度降低时,1A1和1A1C的图谱都出现特征峰增强、负峰峰位蓝移现象,负峰峰位的移动显示了无规则卷曲结构百分比的变化,结果与经CDNN软件拟合出的二级结构相同。
2.2.4 类胶原的生物相容性分析
由于其良好的生物相容性和较弱的免疫原性,胶原蛋白已被广泛用于临床治疗和组织工程[24]。我们采用CCK-8方法评估类胶原对HSF细胞生长的影响,以此评价其生物相容性,结果如图8所示。与对照组相比,在类胶原作用HSF细胞24 h后,未表现出明显细胞毒性。在质量浓度为5 μg/mL,类胶原1A1C具有20%促进细胞增殖效果(P<0.05),类胶原1A1在实验浓度下则无明显促进作用。类胶原1A1和1A1C对HSF细胞生长影响的差异,可能来自于T4 fibritin短肽,也可能是短肽促进了三螺旋的形成,导致类胶原结构上的变化,从而提高了促细胞生长作用。结果表明,2种类胶原都未表现出明显细胞毒性,具有良好的生物相容性。
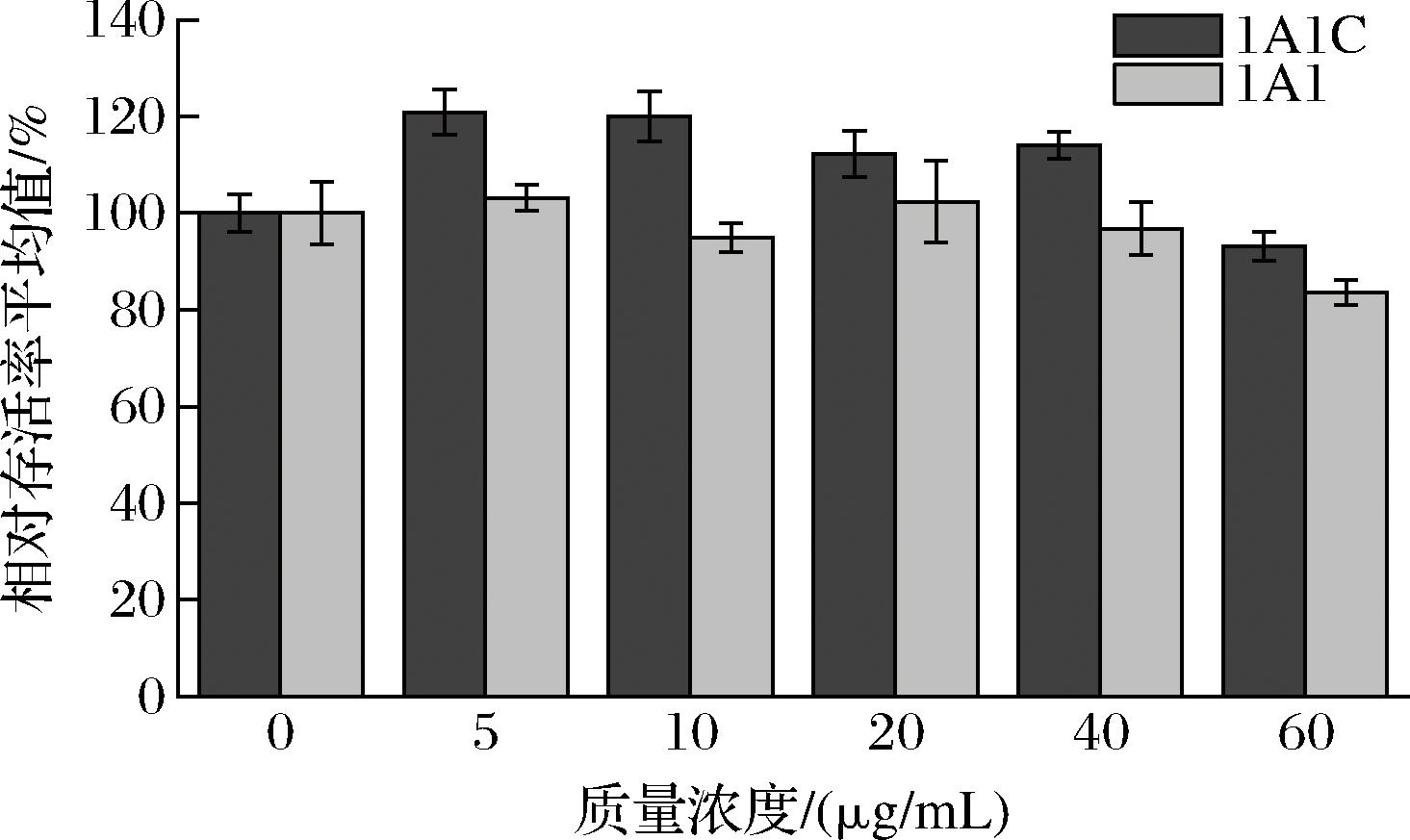
图8 重组类胶原对成纤维细胞影响
Fig.8 Effect of recombinant type I human-like collagen on fibroblasts
2.2.5 类胶原形貌分析
类胶原的形态结构分析表明,类胶原1A1和1A1C与Sigma I型鼠尾胶原同样具有层状结构。且2种蛋白都观察到了纤维状结构,纤维宽度约为1 μm,结构不规则(图9)。类胶原蛋白的层状及纤维结构,可用于伤口治疗,作为冻干胶原海绵在伤口愈合中发挥积极作用。

a-Sigma I型鼠尾胶原放大1 500倍;b-1A1放大1 500倍;c-1A1C放大1 500倍;d-Sigma I型鼠尾胶原放大3 000倍;e-1A1放大3 000倍;f-1A1C放大3 000倍
图9 重组类胶原的微观结构
Fig.9 Morphological structure of recombinant type I human-like collagen
3 结论
本研究采用毕赤酵母表达系统对人源胶原蛋白片段进行重组表达,对其热稳定性、生物活性等进行了研究。根据我们的研究结果,在C端添加T4 fibritin序列,可以提高胶原的热稳定性(Tm提高约4 ℃),且在4 ℃静置后重组类胶原能够自发折叠成三螺旋结构。对DPPH自由基和ABTS阳离子自由基清除率的研究,表明类胶原含有清除自由基的能力,但需要较高浓度,T4 fibritin对类胶原的抗氧化活性提升无显著影响。此外,类胶原1A1和1A1C都表现出良好的生物相容性,在低质量浓度(5~10 μg/mL),类胶原1A1C能够显著促进人皮肤成纤维细胞增殖,且在37 ℃稳定,揭示了其生物医用潜力。
[1] MYNGBAY A, MANARBEK L, LUDBROOK S, et al.The role of collagen triple helix repeat-containing 1 protein (CTHRC1) in rheumatoid arthritis[J].International Journal of Molecular Sciences, 2021, 22(5):2426.
[2] MRS M I A R, PHD M L S. Collagen:A review on its sources and potential cosmetic applications[J].Journal of Cosmetic Dermatology, 2018, 17(1):20-26.
[3] 叶滔, 项琪, 杨艳, 等.胶原蛋白的开发与应用研究进展[J].生物工程学报, 2023, 39(3):942-960.
YE T, XIANG Q, YANG Y, et al.Research, development and application of collagen:A review[J].Chinese Journal of Biotechnology, 2023, 39(3):942-960.
[4] FERTALA A.Three decades of research on recombinant collagens:Reinventing the wheel or developing new biomedical products?[J].Bioengineering (Basel), 2020, 7(4):155.
[5] SORUSHANOVA A, DELGADO L M, WU Z N, et al.The collagen suprafamily:From biosynthesis to advanced biomaterial development[J].Advanced Materials 2019, 31(1):1801651.
[6] GORDON M K, HAHN R A.Collagens[J].Cell and Tissue Research, 2010, 339(1):247-257.
[7] KIRKNESS M W, LEHMANN K, FORDE N R.Mechanics and structural stability of the collagen triple helix[J].Current Opinion in Chemical Biology, 2019, 53:98-105.
[8] MEGANATHAN I, PACHAIYAPPAN M, AARTHY M, et al.Recombinant and genetic code expanded collagen-like protein as a tailorable biomaterial[J].Materials Horizons, 2022, 9(11):2698-2721.
[9] FRANK S, KAMMERER R A, MECHLING D, et al.Stabilization of short collagen-like triple helices by protein engineering[J].Journal of Molecular Biology, 2001, 308(5):1081-089.
[10] MILES A J, JANES R W, WALLACE B A.Tools and methods for circular dichroism spectroscopy of proteins:A tutorial review[J].Chemical Society Reviews, 2021, 50(15):8400-8413.
[11] 程红, 王玲.圆二色和拉曼光谱法分析Ⅰ型胶原蛋白二级结构及热变性[J].实验室研究与探索, 2021, 40(5):31-35.
CHENG H, WANG L.Analysis of the secondary structure and thermal denaturation of type I collagen by CD and raman spectroscopy[J].Research and Exploration in Laboratory, 2021, 40(5):31-35.
[12] HONG H, FAN H B, CHALAMAIAH M, et al.Preparation of low-molecular-weight, collagen hydrolysates (peptides):Current progress, challenges, and future perspectives[J].Food Chemistry, 2019, 301:125222.
[13] BAGHBAN R, FARAJNIA S, RAJABIBAZL M, et al.Yeast expression systems:Overview and recent advances[J].Molecular Biotechnology, 2019, 61(5):365-384.
[14] 刘斌. 巴氏毕赤酵母基因工程菌高密度发酵表达重组人源胶原蛋白[D].南京:南京理工大学, 2012.
LIU B. Expression of recombinant human collagen by high-density fermentation of Pichia pastoris genetically engineered bacteria[D]. Nanjing: Nanjing University of Science and Technology, 2012.
[15] KRISHNAMOORTHI J, RAMASAMY P, SHANMUGAM V, et al.Isolation and partial characterization of collagen from outer skin of Sepia pharaonis (Ehrenberg, 1831) from Puducherry coast[J].Biochemistry and Biophysics Reports, 2017, 10:39-45.
[16] AGUIRRE-CRUZ G, LE N-L
N-L PEZ A, CRUZ-G
PEZ A, CRUZ-G MEZ V, et al.Collagen hydrolysates for skin protection:Oral administration and topical formulation[J].Antioxidants (Basel), 2020, 9(2):181.
MEZ V, et al.Collagen hydrolysates for skin protection:Oral administration and topical formulation[J].Antioxidants (Basel), 2020, 9(2):181.
[17] LEON-LOPEZ A, FUENTES-JIMENEZ L, HERNANDEZ-FUENTES A D, et al.Hydrolysed collagen from sheepskins as a source of functional peptides with antioxidant activity[J].International Journal of Molecular Sciences, 2019, 20(16):3931.
[18] MEDINA-MEDRANO J R, QUINO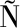 ES-MU
ES-MU OZ T A, ARCE-ORT
OZ T A, ARCE-ORT Z A, et al.Antioxidant activity of collagen extracts obtained from the skin and gills of Oreochromis sp[J].Journal of Medicinal Food, 2019, 22(7):722-728.
Z A, et al.Antioxidant activity of collagen extracts obtained from the skin and gills of Oreochromis sp[J].Journal of Medicinal Food, 2019, 22(7):722-728.
[19] 石服鑫, 曹慧, 徐斐, 等.不同来源Ⅱ型胶原结构及其免疫活性[J].食品与发酵工业, 2014, 40(2):22-26.
SHI F X, CAO H, XU F, et al.Study on structure and immunological activities of type II collagen from different cartilage[J].Food and Fermentation Industries, 2014, 40(2):22-26.
[20] 陆雪芹, 许时婴, 曹慧.鸡胸软骨粉中Ⅱ型胶原的提取及结构分析[J].食品科学, 2009, 30(4):76-80.
LU X Q, XU S Y, CAO H.Extraction of type II collagen from chicken sternal cartilage powder and its structural analysis[J].Food Science, 2009, 30(4):76-80.
[21] DU C L, WANG M Q, LIU J Y, et al.Improvement of thermostability of recombinant collagen-like protein by incorporating a foldon sequence[J].Applied Microbiology and Biotechnology, 2008, 79(2):195-202.
[22] LI Y, BAO X X, MATSUDA N, et al.Investigation of osteoblast-like MC3T3-E1 cells on a novel recombinant collagen-like protein surface with triple helix structure[J].Journal of Materials Science, 2011, 46(5):1396-1404.
[23] MASROURI M, QIN Z.Effects of terminal tripeptide units on mechanical properties of collagen triple helices[J].Extreme Mechanics Letters, 2023, 64:102075.
[24] MEYERKORT D, EBERT J R, ACKLAND T R, et al.Matrix-induced autologous chondrocyte implantation (MACI) for chondral defects in the patellofemoral joint[J].Knee Surgery, Sports Traumatology, Arthroscopy, 2014, 22(10):2522-2530.