酱油是起源于我国的一种传统调味品,除了具有鲜香的风味和较高的佐餐价值,还有抗癌、抗氧化、降血脂等功能特性[1]。酱油酿造是一个开放式的多菌种发酵过程,在霉菌、酵母及细菌的作用下,原料大豆和小麦中的大分子营养物质被一系列复杂的生化反应降解成多种呈味、呈香的小分子物质,从而形成酱油特有的风味[2]。酿造酱油的发酵工艺分为低盐固态发酵工艺和高盐稀态发酵工艺,由于后者相较于前者发酵时间更长,微生物降解原料更加充分,酿造的酱油风味优于前者,所以高盐稀态工艺成为酿造高品质酱油的首选[3]。然而,现代高盐稀态工艺多采用发酵罐等封闭式设备及连续化流程,阻碍了自然环境中有益风味菌的接种,因此,筛选风味菌并进行添加发酵有利于增加封闭式发酵罐中酿造菌群的丰富度、提升酱油的风味[4]。
酵母菌在酱醪发酵过程中主要起产生醇酯类物质的作用,对酱油香气影响比较显著[5]。随着“清洁标签”产品的热销,无防腐剂添加的酱油日益受到市场青睐,这对酱油的生产技术提出了更高的要求。为减少长周期酿造过程中污染微生物造成的腐败,酱油发酵过程中微生物产生的具有风味和防腐双重特性的乙醇、乳酸等物质逐渐得到了更高的关注。乙醇主要由酵母代谢产生,具有抑制杂菌生长、赋予酱油醇香、与有机酸类物质酯化形成乙酯提升酱油香气等作用。目前,酱油酿造风味酵母的研究主要集中在接合酵母属、球拟酵母属及假丝酵母属中,这些酵母与酱油中多种醇类、酯类、醛类等特征风味化合物密切相关[6]。近几年,在酸肉[7]、发酵蔬菜[8-9]及浓香型白酒大曲[10]中发现了柯达酵母,且本课题组利用高通量测序对华中地区酱醪微生物菌群结构开展研究,发现柯达酵母属为酱油酿造过程中的绝对优势真菌[11]。奥默柯达酵母(Kodamaea ohmeri)是柯达酵母属最主要的与发酵食品相关的菌株,对其的研究主要有大头菜发酵生香[9]以及白酒大曲降生物胺[10]等,酱油酿造领域的研究则鲜见报道。分类学研究显示,K.ohmeri为真菌界、子囊菌门、酵母菌纲、酵母菌目、梅奇酵母科、柯达酵母属、K.ohmeri种[12];有报道称K.ohmeri与季也蒙假丝酵母(Candida guilliermondii)是同一种酵母的有性形式和无性形式[13];还有报道将季也蒙假丝酵母的最新命名为季也蒙迈耶氏酵母(Meyerozyma guilliermondii)[14]。藏伟等[15]研究发现,C.guiliermondii NM218对葡萄酒中乙酸乙酯等多种香气物质有提升作用,WAH等[16]也研究了C.guiliermondii对泰式酱油中的多种醇酯类、呋喃酮类等香气物质含量的改善作用。因此,筛选产乙醇的K.ohmeri并研究其对酱油发酵的影响将丰富酱油酿造风味酵母资源,有助于提升酿造酱油品质。
1 材料与方法
1.1 材料与试剂
发酵3~4月的高盐稀态酱醪和成品曲,取自华中地区某酱油厂。
酵母基因组DNA提取试剂盒,北京索莱宝科技有限公司;酵母26S rDNA PCR试剂盒,生工生物工程(上海)股份有限公司;2-甲基-3-庚酮(内标物),德国Dr.Ehrenstorfer公司;其他药品试剂,国药集团化学试剂有限公司。
溶血性试验菌种:金黄色葡萄球菌(Staphylococcus aureus)、酿酒酵母(Saccharomyces cerevisiae),由湖南省调味品发酵工程技术研究中心保藏。
培养基(g/L):100、160 NaCl的豆芽汁培养基,100、160 NaCl的YPD培养基,脱纤维羊血培养基均参考文献[17]配制。
1.2 仪器与设备
E200型显微成像系统,尼康映像仪器(上海)有限公司;PE28型pH计,梅特勒-托利多仪器(上海)有限公司;722型分光光度计,上海精密科学仪器有限公司;VERITI型梯度PCR扩增仪,美国应用生物有限公司;DYY-12型电泳仪,北京市六一仪器厂;Champ Gel 5000 Plus型凝胶成像系统,北京赛智创业科技有限公司;Agilent ZORBAX Eclipse XDB-C18型色谱柱,安捷伦科技(中国)有限公司;436GC/EVOQ TQ/PAL型气质联用仪,美国Bruker Daltonics公司;50/30 μm DVB/CAR/PDMS型固相微萃取针,美国Supelco公司;DB-5MS型色谱柱,美国Agilent公司。
1.3 实验方法
1.3.1 生香酵母的筛选
发酵3~4月的高盐稀态酱醪梯度稀释后,涂布于含有100 g/L NaCl的豆芽汁固体平板上,30 ℃培养48~72 h,根据形态挑取酵母单菌落,稀释纯化3次,获得纯培养菌株,接种至豆芽汁培养基,30 ℃培养72 h,进行香气嗅闻。
1.3.2 生香酵母的鉴定
采用酵母基因组DNA提取试剂盒提取酵母模板DNA,PCR扩增,采用20 μL体系:模板DNA 1 μL,酵母通用引物NL-1(5′-GCATATCAATAAGCGGAAAAG-3′)和NL-4(5′-GGTCCGTGTTTCAAGACGG-3′)各2 μL,Taq聚合酶0.5 μL,MgCl2溶液1 μL,10×PCR buffer 1 μL,dNTP 0.5 μL,dd H2O补足至20 μL。PCR循环参数:95 ℃预变性1 min,95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸30 s,循环35次,72 ℃末端延伸7 min,4 ℃保存。扩增产物使用1%的琼脂糖凝胶电泳检测纯度。测序由生工生物工程(上海)股份有限公司完成,结果登录NCBI进行同源性比对,构建系统发育树。
1.3.3 K.ohmeri产乙醇能力测定
调整种子液浓度为106 CFU/mL,以1%(体积分数)接种量接种至豆芽汁培养基,培养7 d,测定乙醇含量。筛选产乙醇能力最高的3株K.ohmeri进行后续的发酵性能研究。
1.3.4 K.ohmeri溶血性实验
脱纤维羊血培养基冷却至50 ℃时添加5%的脱纤维羊血,摇匀后倒入无菌平板冷却备用。将活化菌无菌操作在平板上划S形曲线,阳性对照菌培养条件为37 ℃,24 h,测试菌及阴性对照菌培养条件为30 ℃,48 h。
1.3.5 菌种发酵性能研究
1.3.5.1 不同盐浓度下生长曲线
调整种子液OD560=1,以2%(体积分数)的接种量接种至不同盐浓度的豆芽汁液体培养基,每4 h取一次样测定发酵液OD560值,以培养时间为横坐标,OD560值为纵坐标绘制生长曲线。
1.3.5.2 最适生长温度
调整种子液OD560=1,以2%(体积分数)的接种量接种至对应盐浓度的YPD液体培养基,分别于24、28、30、32、34、37、40 ℃下培养24 h,以培养基为空白对照,测定发酵液OD560值。
1.3.5.3 最适生长pH值
调整种子液OD560=1,以2%(体积分数)的接种量接种至对应盐浓度的pH值为1~10的YPD液体培养基,于28 ℃培养24 h,取3 mL发酵液于5 mL离心管,10 000 r/min离心5 min,去除上清液,加入3 mL生理盐水重悬离心洗涤3次,以生理盐水为空白对照,测定OD560值。
1.3.5.4 三株K.ohmeri豆芽汁发酵液挥发性风味物质测定
将3株酵母菌分别挑取一环接种于160 g/L豆芽汁液体培养基中,在28 ℃静置培养7 d后,取菌体培养液置于2 mL的气质进样瓶中测定挥发性风味物质含量。
1.3.6 添加高盐稀态酱醪发酵应用
筛选发酵性能最强的K.ohmeri菌株进行添加酱醪发酵的应用。高盐稀态酱醪发酵采用300 g成品曲与230 g/L的盐水按料液比1∶2(g∶mL)混合,30 ℃发酵90 d,每日对酱醪进行搅拌通气。调整KD13种子液菌悬浓度为107 CFU/mL,于发酵第30天添加至酱醪,添加量为5%(体积分数)。以未额外添加风味菌的酱醪样为对照组,取不同发酵时间的酱醪经滤布过滤后获得酱油。
1.3.7 分析方法
1.3.7.1 酱油理化指标测定
乙醇含量的测定参考GB 5009.225—2016《酒中乙醇浓度的测定》中的密度瓶法。还原糖测定参照GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》,总酸、氨态氮测定参照国标GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》。
1.3.7.2 挥发性风味物质测定
参考JIANG等[18]固相微萃取-气相色谱-质谱联用(solid phase microextraction-gas chromatography-mass spectrometry ,,SPME-GC-MS)的方法对酱油的挥发性风味物质进行定性和定量分析。
1.3.7.3 酱油感官评定
参考JIANG[19]酱油感官评价的方法。
1.4 数据处理及绘图
利用Mega X绘制系统发育树;利用Excel进行平均值和标准差计算;利用Origin 2023进行数据可视化;利用SPSS Statistics 26进行差异显著性分析;利用Omicstudio绘制热图;利用SIMCA 14.1进行正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLA-DA)S.aureus、S.cerevisiae,所有的试验采用3个平行。
2 结果与分析
2.1 耐盐产乙醇K.ohmeri的筛选、鉴定及安全性
2.1.1 酱醪中耐盐生香酵母的筛选、分子生物学鉴定
由于柯达酵母属在酱油发酵的3~4月占比最高[11],因此选择发酵3~4月的高盐稀态酱醪采样,一共分离得到21株纯培养酵母菌株,其形态特征及豆芽汁发酵液嗅闻结果如表1所示。21株酵母的豆芽汁发酵液具有花果香、酒香、醇香等香气特征。对所分离的生香酵母进行26S rDNA D1/D2区测序并构建系统发育树。如图1所示,共获得4个种,分属4个属,柯达酵母数量最多(10株),且均为K.ohmeri,其余为鲁氏接合酵母(Zygosaccharomyces rouxii)(6株),埃切假丝酵母(Starmerella etchellsii)(4株)、多变拟威克酵母(Wickerhamiella versatilis)(1株)。
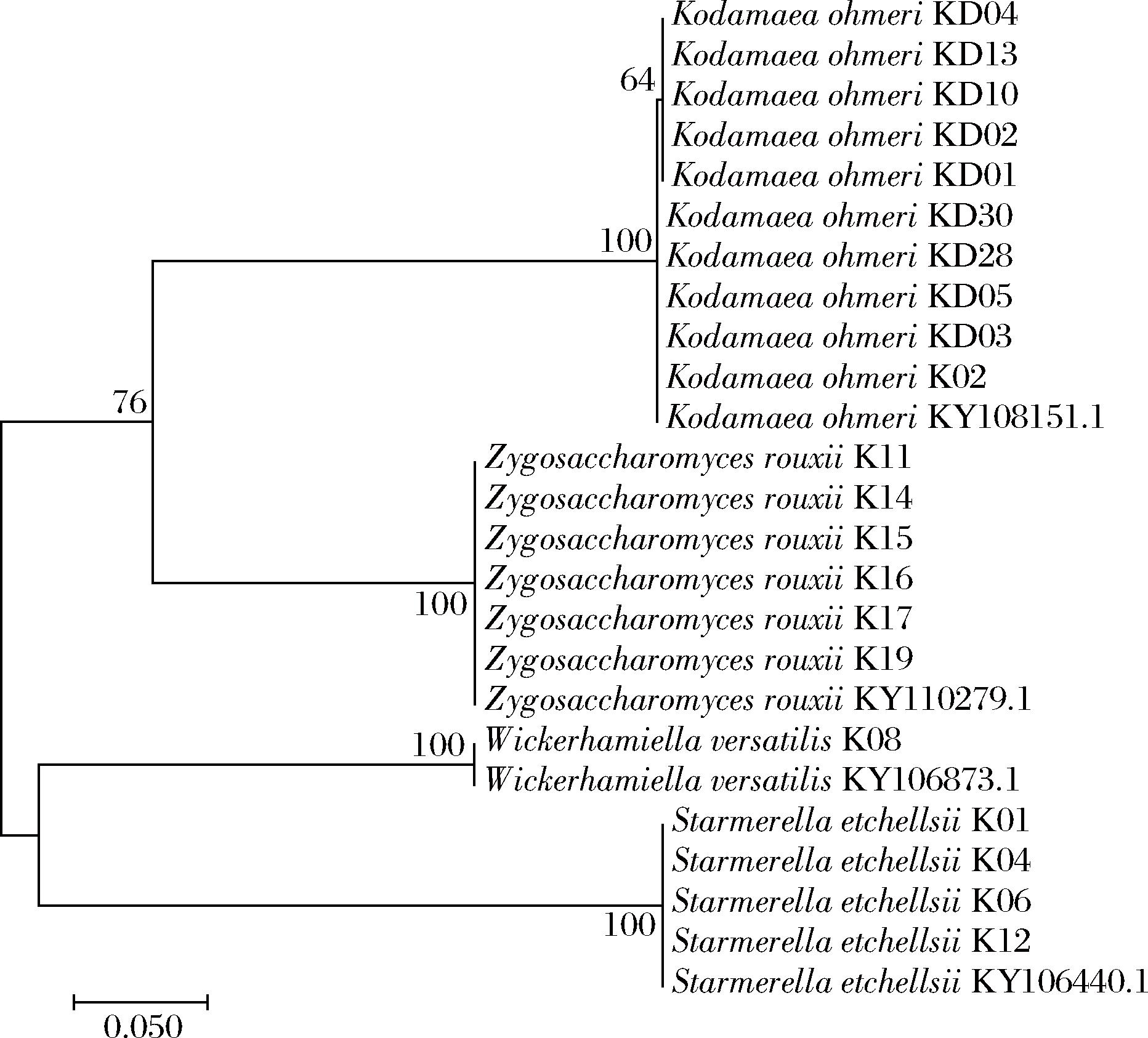
图1 基于酵母26S rDNA D1/D2区序列构建系统发育树
Fig.1 Phylogenetic tree of yeasts based on 26S rDNA D1/D2 region sequence
表1 生香酵母形态描述及香气嗅闻结果
Table 1 Morphological description and aromatic sniffing results of aromatic yeasts

菌株编号形态香气嗅闻结果K02、KD01、KD02、KD03、KD04、KD05、KD10、KD13、KD28、KD30单菌落呈白色,较厚,表面干燥有褶皱,边缘不平整,为花瓣状;细胞呈椭圆形,有假菌丝香气呈浓郁的花果香及酒香K11、K14、K15、K16、K17、K19单菌落呈乳白色,较厚,表面较干燥,边缘光滑呈圆形;细胞呈圆形或椭圆形香气呈较浓郁的花果香K08单菌落呈乳白色,表面湿润,边缘光滑呈圆形;细胞呈椭圆形香气较淡,有花果香K01、K02、K04、K06单菌落呈乳白色,表面湿润,边缘光滑呈圆形;细胞呈椭圆形香气淡,有花果香
2.1.2 K.ohmeri产乙醇能力比较
酱油中的醇类物质以乙醇为主,主要由耐盐酵母代谢产生。乙醇能赋予酱油愉悦的醇香,是形成乙酯的重要底物,且对酱油有一定的防腐作用。由于酱油发酵周期长,因此采用盐质量浓度为100 g/L的豆芽汁培养基替代酱醪发酵快速判断菌株的产乙醇能力。由图2可知,10株不同的K.ohmeri乙醇产量均大于1%(体积分数),KD13、KD28和K02产量较高,分别为1.30%、1.19%和1.19%。
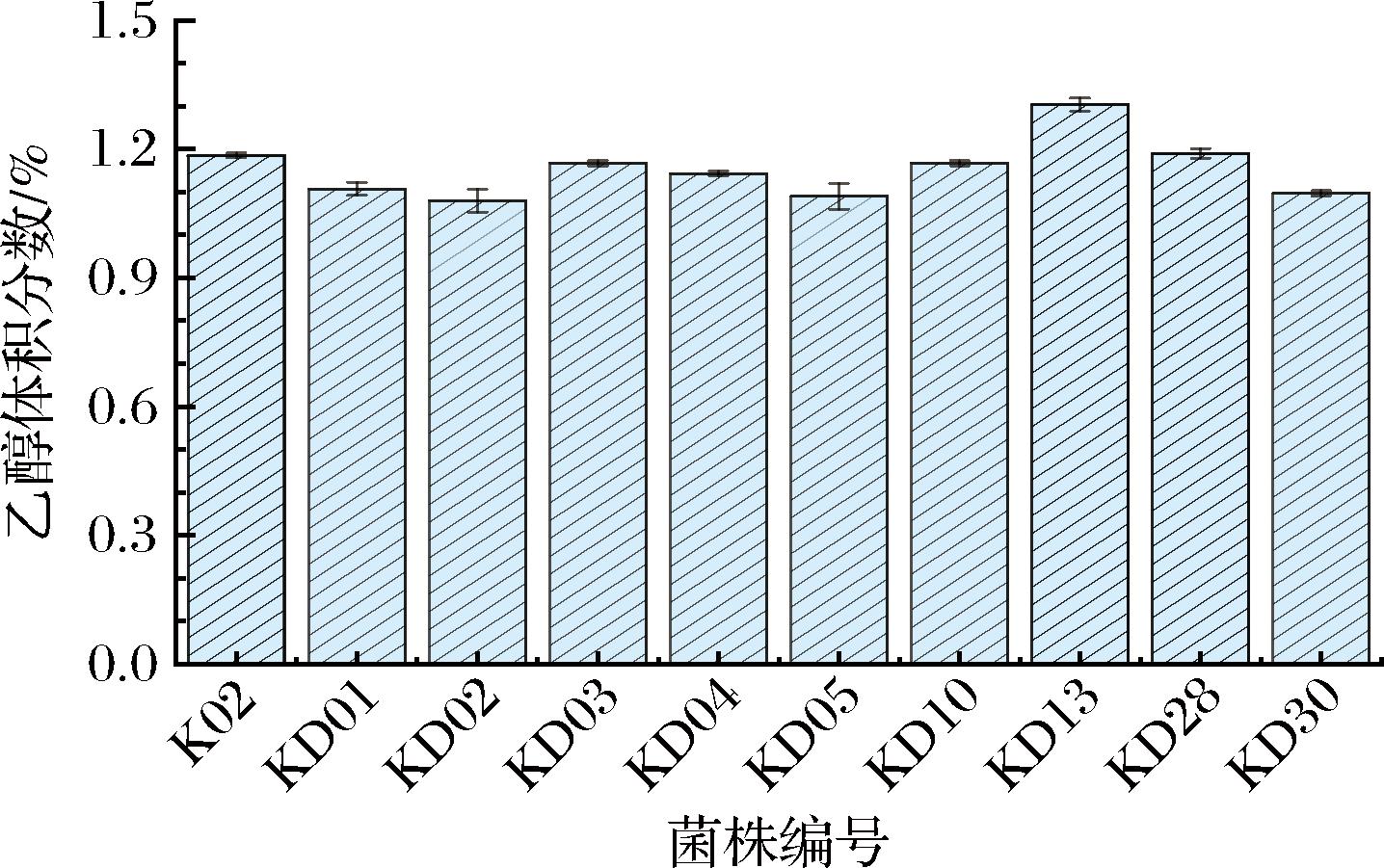
图2 K.ohmeri不同菌株的产乙醇能力
Fig.2 Ethanol-producing capacity of different strains of K.ohmeri
2.1.3 K.ohmeri的溶血性
发酵食品中的微生物若产生溶血毒素会对人体造成一定危害,因此必须对食品发酵菌株进行溶血安全性测试。刘爽等[20]对酱油发酵用菌Z.rouxii的安全性(溶血性)进行了研究。以S.aureus为阳性对照,S.cerevisiae为阴性对照,对10株K.ohmeri进行溶血性测试,结果如图3所示。10株菌均未产生草绿色色环(α溶血)或透明溶血环(β溶血),表明10株酵母均无溶血性,无溶血风险,可以进一步开展研究。
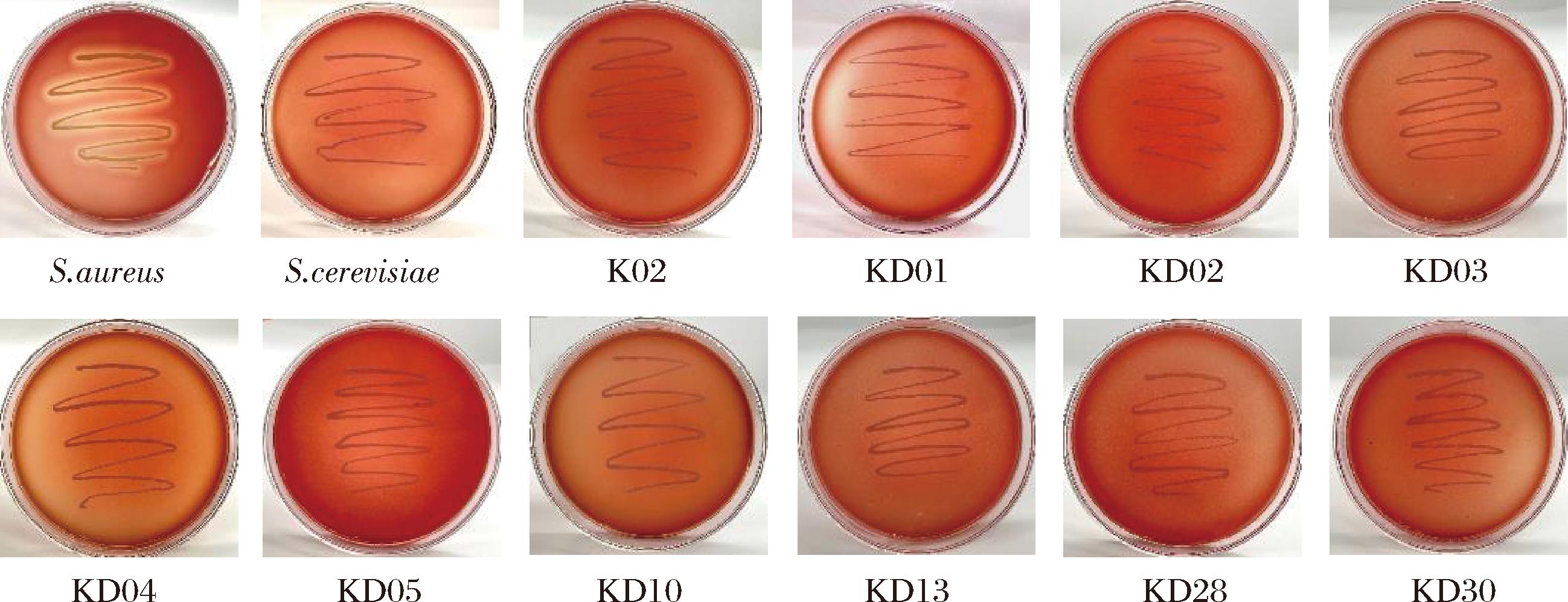
图3 十株K.ohmeri的溶血性结果
Fig.3 Hemolytic test results of the 10 strains of K.ohmeri
2.2 K.ohmeri的菌种性能
2.2.1 不同盐浓度下生长曲线
高盐稀态酱油发酵盐质量浓度一般≥160 g/L,而减盐发酵酱油的盐质量浓度则为100~120 g/L,为考察菌株在不同酱油生产中的生长特性,采取100 g/L和160 g/L盐质量浓度的豆芽汁培养3株K.ohmeri,结果如图4所示。3株菌在相同盐浓度下的生长曲线类似,100 g/L盐质量浓度下,3株菌对数期为16~44 h,44 h以后进入稳定期;而160 g/L盐质量浓度下,3株菌的对数期则延至36~64 h,64 h以后到达稳定期。160 g/L盐质量浓度下,3株酵母稳定期的ΔOD560的平均值为4.135,表明其在高盐环境下生长情况良好。
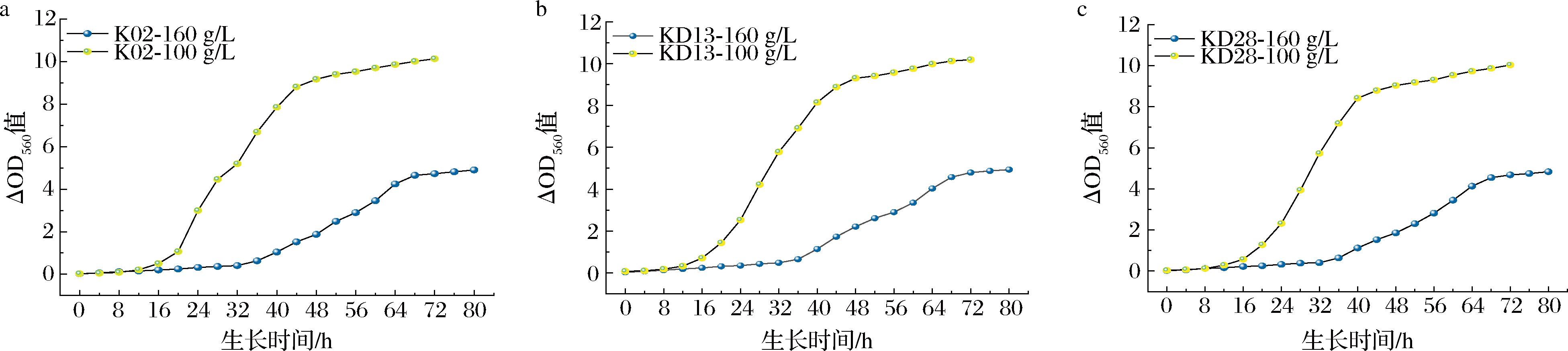
a-K02;b-KD13;c-KD28
图4 三株酵母在不同盐浓度下的生长曲线
Fig.4 Growth curve of the three yeast strains at different salt concentrations
a-K02;b-KD13;c-KD28
图5 三株酵母在不同培养温度下的生长情况
Fig.5 Growth of the three yeast strains at different incubation temperatures
a-K02;b-KD13;c-KD28
图6 三株酵母在不同pH值下生长情况
Fig.6 Growth of the three yeast strains at different pH value
注:图中不同小写字母代表差异显著(P<0.05)。

a-乙醇体积分数;b-挥发性风味物质总含量
图7 三株酵母高盐下产乙醇能力及豆芽汁发酵液挥发性风味物质总含量
Fig.7 Ethanol production capacity of three yeast strains at high salt concentration and the total content of volatile flavor compounds in fermentation broth of bean sprout juice
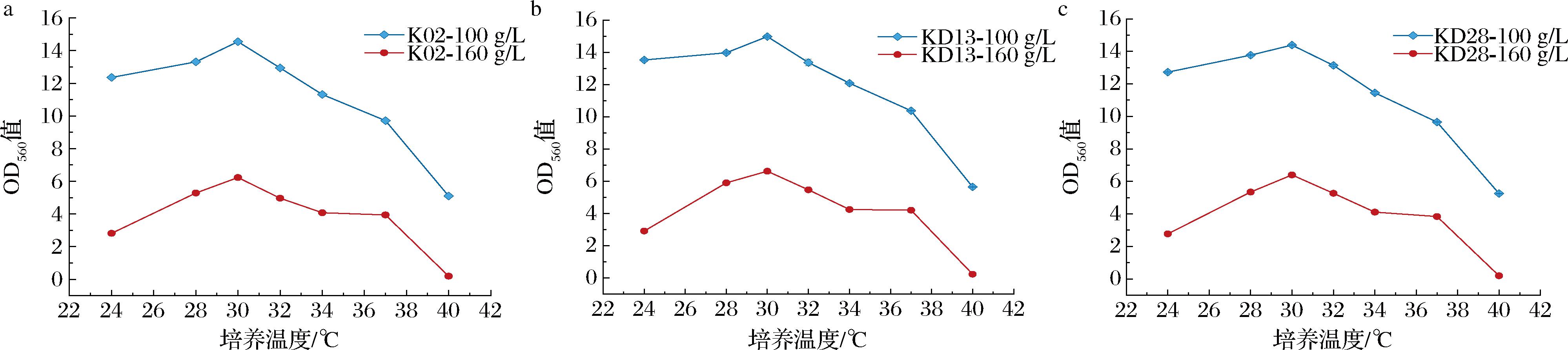
2.2.2 最适生长温度及pH值
温度是微生物生长的重要影响因素之一,最适生长温度有利于获得更多的发酵菌株[21]。对3株酵母在24~40 ℃的生长情况进行测定,结果如图5所示。3株菌在2种盐浓度下发酵液的OD560值随温度的升高呈现先升后降的趋势,30 ℃时OD560值最大,因此30 ℃是3株菌的最适生长温度。温度升至40 ℃时,160 g/L盐质量浓度的条件下,3株菌发酵液OD560值接近0,表明酵母在该条件下几乎不生长。
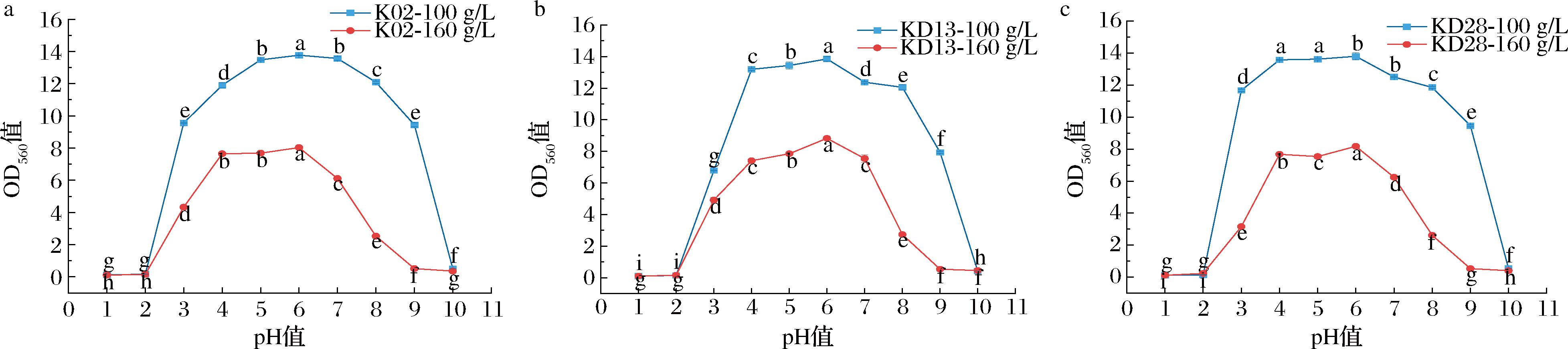
高盐稀态酱油酿造过程中,酱醪pH值一般为4~6[22]。采用初始pH值为1~10的培养基对3株酵母生长情况进行测定,结果如图6所示。100 g/L盐质量浓度下,pH值为3~9时,3株酵母都有一定的生长能力;pH值为4~6时,生长能力最好;而在pH值为1~2及10的条件下不可生长。160 g/L盐质量浓度下,3株酵母在相同pH值条件下的OD560值条件均低于100 g/L盐质量浓度,pH值为3~8时都有一定生长,其中pH值为4~6时,生长能力最好,pH值为1~2及9~10的条件下不可生长。
2.2.3 高盐下产乙醇能力及挥发性风味物质代谢能力
对3株酵母160 g/L盐质量浓度下的产乙醇能力进行测定,结果如图7-a所示。3株酵母豆芽汁发酵液中的乙醇体积分数均高于0.5%,其中KD13最高,达到0.573%。进一步分析豆芽汁发酵液挥发性风味物质,发现发酵液中存在多种香气成分,其中KD13发酵液总挥发性风味物质含量最高,为(997.54±88.15) μg/L(图7-b)。综合以上K.ohmeri发酵性能特点,选用KD13进行后续的添加发酵应用。
2.3 添加K.ohmeri KD13对酱油发酵的影响
2.3.1 高盐下产乙醇能力及挥发性风味物质代谢能力
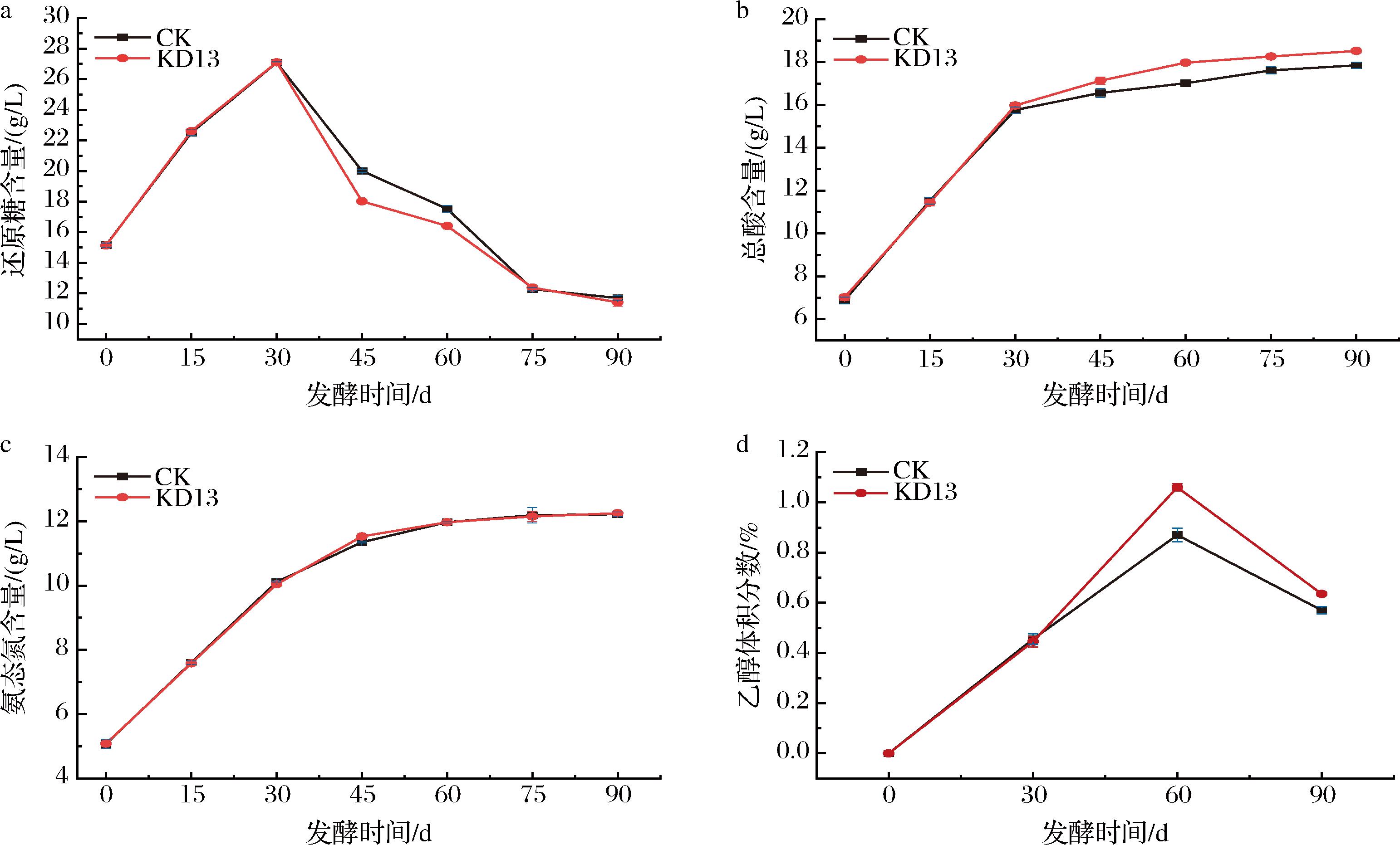
酱油的4个重要理化指标:还原糖、总酸、氨态氮、乙醇含量随发酵时间变化的趋势图如图8所示。由于酱油发酵第30天还原糖含量最高,可以给酵母提供丰富的碳源,因此在第30天添加KD13。由图8-a可知,添加KD13发酵后,还原糖含量下降速度略高于对照组。由图8-b可知,添加KD13发酵后,总酸含量大于对照组,可能是因为酵母在缺氧环境下可能会代谢生成酸性物质[23],发酵90 d,KD13组总酸含量为(18.52±0.09) g/L,小于国标中总酸的限定值(25 g/L)。氨态氮是酱油的分级标准[24],如图8-c所示,发酵第90天,KD13组氨态氮含量为(12.25±0.06) g/L,达到特级酱油的标准。前期证明了K.ohmeri的在豆芽汁培养基中具有一定的乙醇积累能力,但其对高盐稀态酱醪的影响还需要在实际应用中进一步研究。如图8-d所示,加入KD13发酵30 d后,添加KD13的酱油乙醇体积分数为1.06%,比对照组提升了约21.8%。在发酵第90天时,2种酱油的乙醇含量较60 d均有所降低,这可能是因为乙醇挥发速度大于乙醇的生成速度,并且有一部分乙醇参与了风味物质的合成,然而添加KD13的酱油中乙醇体积分数为0.64%,仍比对照组高出11.4%。由此可见,KD13在实际酱醪酿造过程中亦可以积累一定量的乙醇。
a-还原糖;b-总酸;c-氨态氮;d-乙醇体积分数
图8 高盐稀态酱油中理化指标变化
Fig.8 Variations in physical indicators during high-salt liquid-state fermentation of soy sauce
2.3.2 添加KD13对酱油挥发性风味物质的影响
为了研究添加KD13对酱油香气的影响,利用SPME-GC-MS的方法对发酵45、60、75、90 d的添加KD13和未添加KD13的2组酱油共计8个样品中的挥发性风味物质种类及含量进行分析鉴定。如表2所示,共检测到60种香气成分,其中酯类化合物12种、醇类化合物19种、醛类化合物8种、酮类化合物5种、酸类化合物5种、酚类化合物5种、杂环类化合物6种。KD13组挥发性风味物质总含量为(3 912.70±253.18) μg/L,比对照组高22.18%,其中KD13组挥发性酯类物质总含量为(383.06±26.90) μg/L,比对照组高97.62%,酚类物质总含量为(201.32±10.93) μg/L,比对照组高70.18%。
表2 酱油中挥发性风味物质种类及含量
Table 2 Types and contents of volatile flavor compounds in soy sauce

编号保留时间/minCAS挥发性风味物质含量/(μg/L)CKKD13提升率/%12.00141-78-6乙酸乙酯13.97±1.4512.52±1.2-10.40 24.61110-19-0乙酸异丁酯1.36±0.2831.72±2.392 234.55 35.7997-64-3乳酸乙酯76.43±4.28133.29±13.2974.40 47.716297-41-22-甲基戊丁酯0.87±0.040.56±0.01-35.63 58.09123-92-2乙酸异戊酯3.27±0.1422.01±0.18573.36 620.77106-32-1辛酸乙酯24.27±1.242.83±2.8876.46 722.74103-45-7乙酸苯乙酯9.74±0.1238.52±2.10295.29 828.13110-38-3癸酸乙酯1.74±0.156.21±0.36256.71 928.13627-90-7十一酸乙酯0.90±0.121.80±0.0899.18 1033.07106-33-2月桂酸乙酯10.82±1.293.20±0.10-70.46 1133.212177-86-82-甲基辛酸甲酯3.07±0.670.76±0.02-75.171239.6818281-05-5花生酸乙酯47.39±3.7489.65±4.2989.18酯类(12种)193.84±13.48383.06±26.9097.62131.4164-17-5乙醇229.82±15.21350.90±34.2352.68142.1178-83-1异丁醇83.74±4.2367.67±3.87-19.20152.4671-36-3正丁醇13.49±0.5371.39±2.67429.34163.67123-51-33-甲基-1-丁醇7.42±0.6910.39±1.2740.06173.75137-32-62-甲基丁醇191.69±13.29138.00±7.56-28.01183.8371-41-0正戊醇22.14±1.2825.16±1.8713.65197.96111-27-3正己醇247.75±13.2992.07±3.89-62.842012.05111-70-6正庚醇3.89±0.012.18±0.07-43.952112.28505-10-23-甲硫基丙醇98.35±4.45135.91±8.2338.202212.444798-44-11-己烯-3-醇659.87±42.82776.54±16.2217.682312.453391-86-41-辛烯-3-醇13.09±0.1822.95±2.8675.302412.4521964-44-31-壬烯-3-醇236.45±8.26253.74±4.087.312513.29598-32-33-丁烯-2-醇7.04±0.8616.13±1.82129.122613.5976-09-5凤梨醇86.67±9.9233.56±2.74-61.282714.41104-76-72-乙基己醇189.74±20.15196.66±28.973.652814.53100-51-6苯甲醇7.69±0.1324.52±2.58218.912917.6560-12-8苯乙醇13.00±0.3829.23±0.58124.773018.42616-25-11-戊烯-3-醇25.85±1.5524.57±0.51-4.953118.55924-41-41,5-己二烯-3-醇94.97±5.56109.98±5.2615.80醇类(18种)2232.65±142.812381.54±129.36.67321.7178-84-22-甲基丙醛23.69±2.1414.38±2.19-39.29336.45498-60-23-糠醛146.39±9.29170.39±14.2816.40346.4898-01-1糠醛4.91±0.084.67±0.17-4.91359.353268-49-33-甲硫基丙醛183.28±11.29198.81±17.298.473611.54100-52-7苯甲醛12.43±1.0213.65±1.289.813712.44996-12-32,2-二甲基己醛2.68±0.014.57±0.1270.613814.92122-78-1苯乙醛8.66±0.0731.84±1.56267.613923.414411-89-62-苯基巴豆醛9.99±0.027.33±0.97-26.61醛类(8种)392.03±23.92445.64±37.8613.68403.07513-86-03-羟基-2-丁酮0.78±0.031.21±0.0955.13414.213848-24-62,3-己二酮132.09±5.47204.74±18.5655.004210.571888-57-92,5-二甲基-3-己酮8.38±1.238.24±0.56-1.644318.70585-25-12,3-辛二酮5.93±1.26.99±0.2717.894418.71758-87-23-甲基-4-戊烯-2-酮7.33±1.214.84±0.13-33.90酮类(5种)154.50±9.14226.03±19.6146.29451.7964-19-7乙酸86.50±7.2684.88±9.78-1.88462.00507-09-5硫代乙酸4.20±0.084.58±0.129.05474.1379-31-2异丁酸10.89±0.039.47±0.78-13.05487.00503-74-2异戊酸0.47±0.010.67±0.0142.55497.96116-53-02-甲基丁酸8.97±0.112.59±0.12-71.17酸类(5种)111.03±7.49102.18±10.81-7.975016.5390-05-1愈创木酚20.27±2.6779.53±2.57292.345116.53150-76-54-甲氧基苯酚10.28±1.093.34±0.83-67.515219.6714938-35-34-戊基苯酚21.26±2.0922.72±1.286.885319.68123-07-94-乙基苯酚16.54±1.3613.80±0.98-16.605423.582785-89-94-乙基愈创木酚49.95±7.5481.94±5.2764.05酚类(5种)118.30±14.75201.32±10.9370.18
续表2

编号保留时间/minCAS挥发性风味物质含量/(μg/L)CKKD13提升率/%553.4528564-83-22,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮15.64±1.6538.65±3.29147.10569.56123-32-02,5-二甲基吡嗪2.15±0.063.92±0.1382.02579.56108-50-92,6-二甲基吡嗪27.85±0.3443.61±5.2356.625813.0513360-64-02-乙基-5-甲基吡嗪9.66±0.6613.29±1.2937.515913.0613925-03-62-乙基-6-甲基吡嗪17.98±0.9842.50±4.56136.306013.2014667-55-12,3,5-三甲基吡嗪32.64±1.0830.97±3.28-5.12杂环类(6种)105.92±4.77172.93±17.7863.26总含量3 202.35±202.453 912.70±253.1822.18
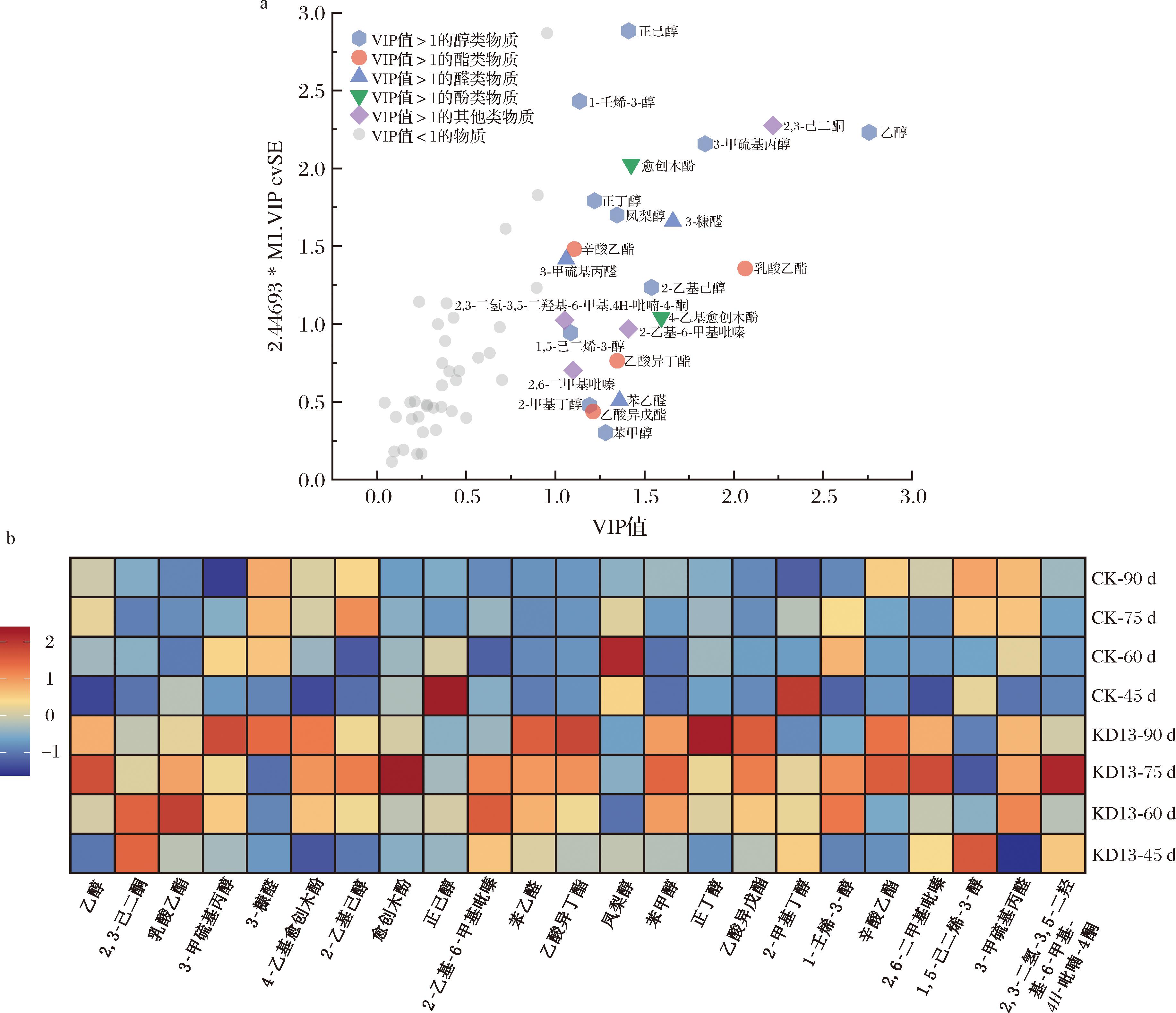
以表2中60种香气成分作为因变量,不同发酵时间的2组酱油作为自变量进行OPLS-DA分析,并计算预测变量重要性投影(variable importance in projection)。VIP值越大,因变量对样品区分度的贡献值就越大,若VIP值>1表明为关键因变量[25]。如图9-a所示,共筛选到23种VIP值>1的差异风味物质。其中酯类4种、醇类物质10种、酚类物质2种、醛类物质3种、其他类4种。对上述23种物质进行热图分析,由图9-b可以看出,KD13组多种香气物质含量比CK组多,其中包括酯类物质中的乳酸乙酯(奶油香)、辛酸乙酯(酒香)、乙酸异戊酯(花香)、乙酸异丁酯(花香);醇类物质中的乙醇(醇香)、正丁醇(葡萄酒香)、苯甲醇(花香);醛类物质中的苯乙醛(果香)、3-甲硫基丙醛(酱香);酚类物质中的4-乙基愈创木酚(烟熏香);杂环类物质中的2-乙基-6甲基吡嗪(可可香)、2,6-二甲基吡嗪(坚果香)、2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮(焦糖香)。以上分析表明,KD13不仅对酱油中乙醇含量有提升作用,同时对乙酯类等多种酱油特征风味物质有增益作用。
a-VIP值;b-差异风味物质热图
图9 酱油挥发性风味物质OPLS-DA分析
Fig.9 OPLS-DA analysis of volatile flavor compounds in soy sauce
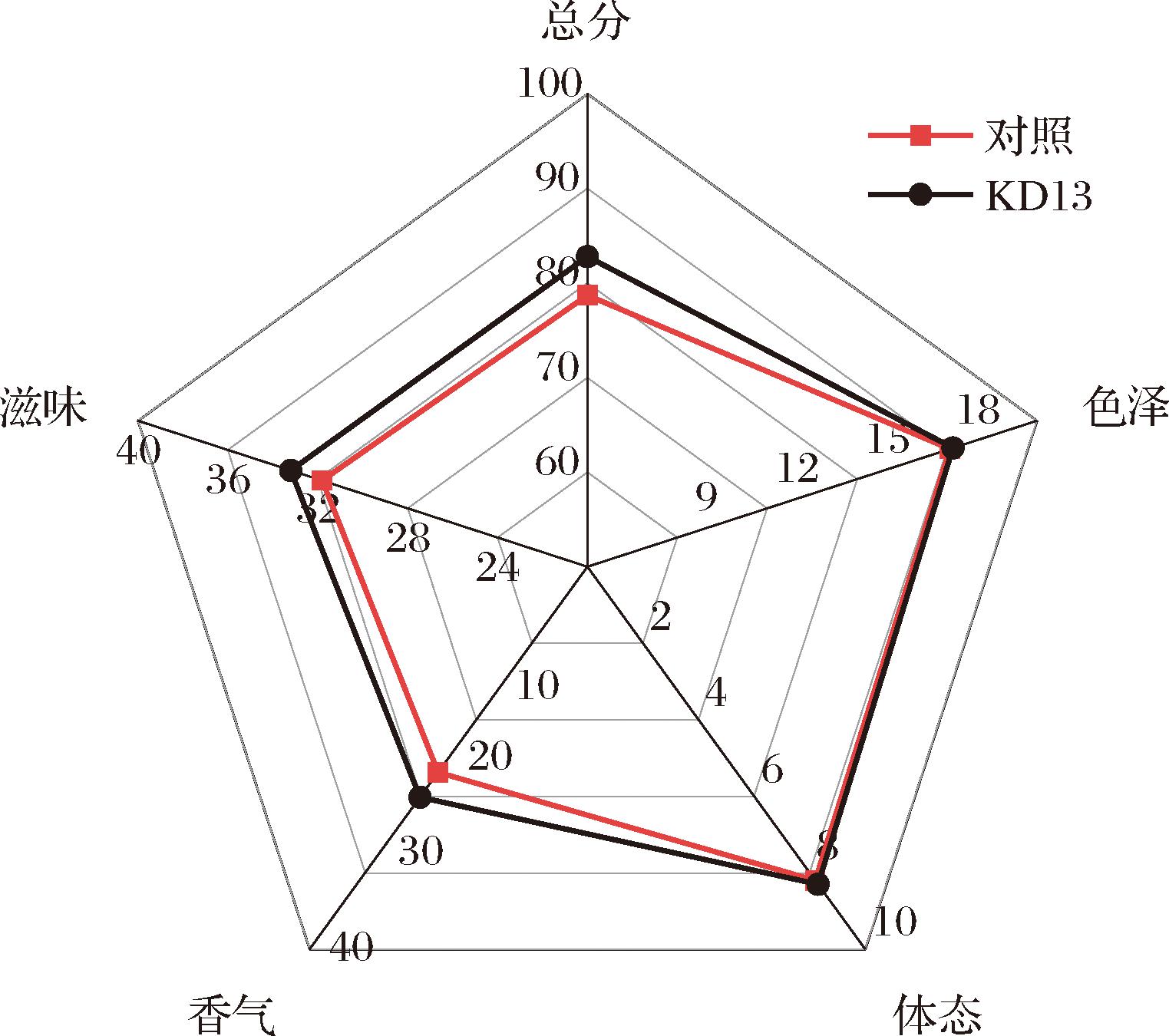
图10 酱油感官评价
Fig.10 Sensary evaluation of soy sauce
2.3.3 添加KD13对酱油挥发性风味物质的影响
酱油的感官评价可以从色泽、体态、滋味、香气4个方面进行评估。对照组及KD13组酱油的感官评分结果如图9所示。2组酱油的色泽和体态评分较为接近,而KD13组滋味评分高于对照组,可能是由于酵母菌体在后酵后期发生自溶,产生呈鲜味的核酸类物质。另外KD13组的香气评分也高于对照组,这和2.3.2节的研究结果一致。感官评价结果表明,添加KD13对酱油色泽体态无负面影响,并且对酱油的滋味和香气有提升作用。
3 结论
本研究从华中地区发酵3~4月的高盐稀态酱醪中分离筛选得到了10株K.ohmeri,10株菌均为溶血安全性菌株。对其中3株产乙醇能力较强的菌株进行菌种性能研究,发现3株菌在160 g/L盐质量浓度,温度为24~38 ℃,pH值4~6的环境下均生长良好,总体性能差异不大。由于在盐浓度为160 g/L的条件下,菌株KD13的乙醇及挥发性风味物质代谢能力最强,因此进一步将其添加到高盐稀态酱醪中发酵,发现KD13对酱油中的乙醇体积分数有提升作用,并且对酱油中多种乙酯类香气物质如乳酸乙酯、乙酸异戊酯、辛酸乙酯及一些酱油特征风味化合物如4-乙基愈创木酚、3-甲硫基丙醛等有增益作用。感官评价结果显示,添加KD13对酱油的色泽、体态无负面影响,对酱油的滋味和香气及总体评分有提升作用。综上所述,本研究分离筛选的耐盐K.ohmeri具有作为新型风味菌强化酱油发酵、提升风味的潜力。然而本研究中仅探究了K.ohmeri单一菌种添加发酵对酱油的影响,未来需进一步探明与其他优势风味菌的交互作用。
[1] 冯云子, 周婷, 吴伟宇, 等.酱油风味与功能性成分研究进展[J].食品科学技术学报, 2021, 39(4):14-28.
FENG Y Z, ZHOU T, WU W Y, et al.Research progress on flavor and functional components of soy sauce[J].Journal of Food Science and Technology, 2021, 39(4):14-28.
[2] ZHENG S, YE P, ZHAO X L, et al.Enhanced soy sauce stability and reduced precipitation by improving critical steps in the fermentation process[J].Food Research International, 2023, 174:113674.
[3] LIU H, CHEN X G, LU J, et al.Evaluation of the differences between low-salt solid-state fermented soy sauce and high-salt diluted-state fermented soy sauce in China:From taste-active compounds and aroma-active compounds to sensory characteristics[J].Journal of the Science of Food and Agriculture, 2024, 104(1):340-351.
[4] FENG Y Z, WU W Y, CHEN T, et al.Exploring the core functional microbiota related with flavor compounds in fermented soy sauce from different sources[J].Food Research International, 2023, 173:113456.
[5] WANG J W, ZHAO M M, XIE N Y, et al.Community structure of yeast in fermented soy sauce and screening of functional yeast with potential to enhance the soy sauce flavor[J].International Journal of Food Microbiology, 2022, 370:109652.
[6] 苗春雷, 朱娅媛, 黄卓权, 等.酵母菌对高盐稀态酱油风味强化研究进展[J].食品与发酵工业, 2023, 49(17):308-315.
MIAO C L, ZHU Y Y, HUANG Z Q, et al.Research advances of flavor enhancement of high-salt dilute soy sauce by yeast[J].Food and Fermentation Industries, 2023, 49(17):308-315.
[7] ZHONG A A, CHEN W, DUAN Y F, et al.The potential correlation between microbial communities and flavors in traditional fermented sour meat[J].LWT, 2021, 149:111873.
[8] XU X X, WU B B, ZHAO W T, et al.Shifts in autochthonous microbial diversity and volatile metabolites during the fermentation of chili pepper (Capsicum frutescens L.)[J].Food Chemistry, 2021, 335:127512.
[9] 黄鑫, 唐红梅, 唐青莲, 等.大头菜发酵过程中生香酵母的分离、筛选及鉴定[J].食品研究与开发, 2019, 40(18):198-203.
HUANG X, TANG H M, TANG Q L, et al.Isolation, screening and identification of key aroma-producing microorganisms in the process of kohrabi fermentation[J].Food Research and Development, 2019, 40(18):198-203.
[10] 曾玉雪, 罗惠波, 余东, 等.浓香型大曲中降解生物胺菌株的筛选及应用[J].食品与发酵工业, 2021, 47(8):145-151.
ZENG Y X, LUO H B, YU D, et al.Screening and application of biogenic amines degrading strain derived from Luzhou-flavor Daqu[J].Food and Fermentation Industries, 2021, 47(8):145-151.
[11] 阮志强, 董玺梅, 蒋雪薇, 等.高盐稀态酱油发酵优势真菌与风味物质相关性分析[J].食品科学, 2022, 43(10):172-179.
RUAN Z Q, DONG X M, JIANG X W, et al.Correlation between dominant fungi and variation of flavor compounds during high-salt liquid-state soy sauce fermentation[J].Food Science, 2022, 43(10):172-179.
[12] CLETUS P K, JACK W F, TEUN B, et al.The Yeasts[M].5th ed.London, 2011:483-490.
[13] WILCOCK J N, GALLAGHER A J, WENGENACK N L, et al.Candida guilliermondii/Kodamaea ohmeri endocarditis[J].Mycopathologia, 2023, 188(6):907-908.
[14] ZHENG X, ZHANG X, ZHAO J, et al. Meyerozyma guilliermondii promoted the deposition of GSH type lignin by activating the biosynthesis and polymerization of monolignols at the wounds of potato tubers[J]. Food Chemistry, 2023, 416: 135688.
[15] 藏伟, 刘叶, 刘宇, 等.本土季也蒙毕赤酵母在干红葡萄酒中试生产中的应用潜力[J].食品科学, 2023, 44(18):117-125.
ZANG W, LIU Y, LIU Y, et al.Application potential of native Meyerozyma guilliermondii in pilot production of dry red wine[J].Food Science, 2023, 44(18):117-125.
[16] WAH T T, WALAISRI S, ASSAVANIG A, et al.Co-culturing of Pichia guilliermondii enhanced volatile flavor compound formation by Zygosaccharomyces rouxii in the model system of Thai soy sauce fermentation[J].International Journal of Food Microbiology, 2013, 160(3):282-289.
[17] 沈萍, 陈向东.微生物学实验[M].4版.北京:高等教育出版社,2007.
SHEN P, CHEN X D.Microbiology Experiments[M].Forth Edition. Beijing:Higher Education Press, 2007.
[18] JIANG X W, PENG D, ZHANG W, et al.Effect of aroma-producing yeasts in high-salt liquid-state fermentation soy sauce and the biosynthesis pathways of the dominant esters[J].Food Chemistry, 2021, 344:128681.
[19] JIANG X W, ZHANG W, LI L L, et al.Characteristics of microbial community, taste, aroma of high-salt liquid-state secondary fortified fermented soy sauce[J].LWT, 2023, 182:114792.
[20] 刘爽, 张倩, 杜船, 等.酱油发酵用菌鲁氏接合酵母的安全性[J].食品与发酵工业, 2021, 47(3):66-71.
LIU S, ZHANG Q, DU C, et al.Safety analysis of Zygosaccharomyces rouxii used in soy sauce fermentation[J].Food and Fermentation Industries, 2021, 47(3):66-71.
[21] DU Q, YE D Q, ZANG X M, et al.Effect of low temperature on the shaping of yeast-derived metabolite compositions during wine fermentation[J].Food Research International, 2022, 162:112016.
[22] 王靖雯. 高盐稀态酱油风味功能酵母菌的筛选和应用研究[D].广州:华南理工大学, 2022.
WANG J W.Screening and application flavor functional yeast for high-salt liquid soy sauce[D].Guangzhou:South China University of Technology, 2022.
[23] 杜琳琳, 于鑫, 刘丽萍, 等.产香酵母的筛选及其在液态食醋酿造中的应用[J].食品与发酵工业, 2023,50(8):169-175.
DU L L, YU X, LIU L P, et al.Screening of aroma-producing yeast strain and its application in liquid vinegar brewing[J].Food and Fermentation Industries, 2023,50(8):169-175.
[24] 刘晓丽, 胡伊, 于泓鹏, 等.牡丹籽粕酱油发酵工艺优化及抗氧化活性研究[J].食品与机械, 2020, 36(6):157-161.
LIU X L, HU Y, YU H P, et al.Optimization of fermentation process and antioxidant activity of peony seed meal soy sauce[J].Food &Machinery, 2020, 36(6):157-161.
[25] 邵淑贤, 徐梦婷, 林燕萍, 等.基于电子鼻与HS-SPME-GC-MS技术对不同产地黄观音乌龙茶香气差异分析[J].食品科学, 2023, 44(4):232-239.
SHAO S X, XU M T, LIN Y P, et al.Differential analysis of aroma components of Huangguanyin oolong tea from different geographical origins using electronic nose and headspace solid-phase microextraction-gas chromatography-mass spectrometry[J].Food Science, 2023, 44(4):232-239.