益生菌被联合国粮农组织(Food and Agriculture Organization of the United Nations, FAO)和世界卫生组织(World Health Organization, WHO)定义为一种活的微生物,当摄入足够量时,可以给宿主带来健康益处。乳杆菌和双歧杆菌是最常用的益生菌[1],能够在人体肠道中竞争性定殖,促进机体消化吸收、调节和维持肠道菌群平衡和增强机体免疫功能等[2]。
母乳中除了宏量营养素、微量营养素以及生物活性化合物以外,还蕴含大量微生物。母乳是继产道出生后婴儿肠道菌群的第二主要来源,母乳喂养的婴儿每天摄入多达8×104~8×106个细菌[3],在配方乳粉中添加益生菌已成为改善婴幼儿健康的有效措施。然而,机体和肠道微生物之间具有特异的相互选择关系,当菌株的来源和其应用对象保持一致时,会显著增强菌株对机体益生功能的特异性和有效性[11],因此母乳和婴儿来源的益生菌在婴幼儿健康市场上有巨大的应用前景。母乳中的益生菌被证实可以促进婴儿的健康,其中发酵乳杆菌CECT 5716已在国内外广泛应用[3],并在我国获批成为可应用于婴幼儿食品的菌株[5],从母乳中分离潜在益生菌已成为研究热点[6]。
目前,我国允许应用到婴幼儿食品中的益生菌主要有:动物双歧杆菌Bb-12、短双歧杆菌M-16V、婴儿双歧杆菌R0033、瑞士乳杆菌R0052、罗伊氏乳杆菌DSM 17938和发酵乳杆菌CECT 5716等14种[7],其中仅有一株鼠李糖乳杆菌(Lactobacillus rhamnosus)MP108为我国自主研发[8]。本研究从母乳和婴儿粪便中分离并筛选乳酸菌菌株,评价其体外益生特性及安全性,以期为我国婴幼儿适用益生菌的开发提供优良的菌种资源。
1 材料与方法
1.1 实验菌株
菌株:L.rhamnosus GG(LGG),分离自百适滴双联益生菌滴剂;金黄色葡萄球菌(Staphylococcus aureus ATCC 6538)、枯草芽孢杆菌(Bacillus subtilis CMCC 63501)、蜡样芽孢杆菌(Bacillus cereus ATCC 11778)、鼠伤寒沙门氏菌(Salmonella typhimurium CMCC 50115)、铜绿假单胞菌(Pseudomonas aeruginosa CMCC 10104)、大肠埃希氏菌(Escherichia coli ATCC 25922),由江苏省乳品生物技术与安全控制重点实验室保存。
1.2 主要试剂
细菌基因组DNA快速抽提试剂盒、Taq酶、胃蛋白酶(1∶10 000)、胰蛋白酶(1∶250)、维生素B1、组氨酸、酪氨酸、赖氨酸、鸟氨酸盐酸盐、溴甲酚紫,生工生物工程(上海)股份有限公司;2×Taq Master Mix(Dye Plus)、DL 5000 DNA Marker,南京维诺赞生物科技有限公司;牛胆盐,北京索莱宝科技有限公司;碳酸钙、5-磷酸吡哆醛,上海麦克林生化科技有限公司;硫酸亚铁,国药集团化学试剂有限公司;药敏纸片,杭州滨和微生物试剂有限公司;MRS培养基、哥伦比亚血琼脂平板,青岛海博生物技术有限公司;MEM培养液、MEM非必需氨基酸溶液、丙酮酸钠溶液、谷氨酰胺添加剂,美国Gibco公司;胎牛血清,杭州四季青生物工程材料有限公司;0.25%胰酶细胞消化液、pH值7.2 PBS溶液,上海碧云天生物技术公司。
LB培养基(g/L):胰蛋白胨10、氯化钠5、酵母粉5,121 ℃灭菌15 min,冷却备用。
MEM完全培养液:77%(体积分数)MEM培养液、20%(体积分数)胎牛血清、1%(体积分数)MEM非必需氨基酸溶液、1%(体积分数)丙酮酸钠溶液、1%(体积分数)谷氨酰胺添加剂,4 ℃贮藏备用。
生物胺检测培养基(g/L):胰蛋白胨5、酵母粉5、牛肉膏5、氯化钠2.5、葡萄糖0.5、吐温-80 1 mL、硫酸镁0.2、硫酸锰0.05、硫酸亚铁0.04、磷酸氢二钾2、维生素B1 0.01、碳酸钙0.1、磷酸吡哆醛0.05、溴甲酚紫0.06、琼脂粉20,分别在生物胺检测培养基中加入10 g的对应前体氨基酸(酪氨酸、组氨酸、鸟氨酸、赖氨酸),调节pH值至5.3~5.5,115 ℃灭菌20 min,冷却备用。
1.3 仪器与设备
SPX-250B型生化培养箱,上海跃进医疗器械厂;JF-SX-500全自动灭菌锅,日本TOMY公司;SW-CJ-1FD型单人单面净化工作台,苏州净化设备有限公司;台式冷冻离心机5424R型、聚合酶链式反应(polymerase chain reaction, PCR)仪(Nexus+x2eco型),德国艾本德公司;凝胶图像分析系统(3026型),法国VILBER公司;CX41显微镜,日本OLYMPUS公司;HERACELL型二氧化碳培养箱,美国Thermo公司;IX2-ILL100荧光倒置显微镜,日本OLYMPUS公司。
1.4 实验方法
1.4.1 乳酸菌的分离纯化
43份母乳样品和27份婴儿粪便样品均采集自湖南地区。
将母乳样品稀释至10-2、10-3和10-4稀释度,婴儿粪便样品稀释至10-5、10-6和10-7稀释度,分别倾注于含0.3%溴甲酚紫的MRS琼脂培养基分离乳酸菌。每个平板选取3~4个形态不同、具有典型乳酸菌菌落形态特征且具有溴甲酚紫变色(变黄)反应的单菌落,随后在含溴甲酚紫的MRS琼脂培养基上进行纯化和产酸复筛,直至得到纯化的单菌落。经革兰氏染色后在显微镜下观察菌体形态,挑选出具有典型乳杆菌菌体形态的菌株。
1.4.2 胆盐耐受实验
乳酸菌活化至2代,取1.0 mL乳酸菌菌悬液分别接种至9.0 mL含相应胆盐浓度的MRS培养基中,于37 ℃厌氧培养,分别在0和3 h用平板计数法测定活菌数,其存活率(%)的计算如公式(1)所示:
存活率![]()
(1)
胆盐培养基配制方法:称取一定量的胆盐于MRS液体培养基中,使其胆盐质量浓度分别为0.75和1 g/L,调节pH值至6.5±0.2,121 ℃灭菌15 min,冷却备用。
1.4.3 乳酸菌分子鉴定
利用细菌基因组DNA快速抽提试剂盒提取菌株的基因组DNA,作为PCR的模板进行扩增,引物为通用引物(27F:AGAGTTTGATCCTGGCTCAG;1492R:GGTTACCTTGTTACGACTT)[9]。PCR产物经1%琼脂糖凝胶电泳检测后由上海生工生物工程技术服务有限公司进行测序,测序结果登录NCBI数据库进行BLAST同源性检索和比对分析。
以植物乳杆菌ATCC 14917、鼠李糖乳杆菌ATCC 7469、发酵乳杆菌ATCC 14931、干酪乳杆菌ATCC 393和副干酪乳杆菌ATCC 25302作为标准菌株,用MEGA-X软件进行多序列比对分析并采用邻域连接法构建系统发育树[10]。
1.4.4 模拟胃液耐受实验
乳酸菌活化至2代,取1.0 mL乳酸菌菌悬液接种至9.0 mL的pH值2.5人工胃液,于37 ℃厌氧培养,分别在0和3 h利用平板计数法测定活菌数,其存活率(%)的计算同公式(1)。
模拟胃液配制方法:分别取0.5 g NaCl和0.3 g胃蛋白酶溶解于去离子水中并定容至100 mL,用1.0 mol/L的盐酸调pH值至2.5,0.22 μm滤膜过滤除菌,4 ℃冰箱冷藏备用[11]。
1.4.5 模拟胃肠液耐受实验
乳酸菌活化至2代,8 000 r/min离心2 min收集菌体并重悬于pH 2.5的模拟胃液,37 ℃培养3 h后,8 000 r/min离心值2 min,再分别重悬于含1 g/L胰蛋白酶、0.75 g/L胆盐的模拟肠液1和含1 g/L胰蛋白酶、1 g/L胆盐的模拟肠液2中,37 ℃培养2 h,每次模拟胃肠液应激处理后选取合适的梯度利用平板计数法计算存活率,如公式(2)所示:
存活率![]()
(2)
模拟胃液配制方法同上。
模拟肠液配制方法[12]:称取1 g/L胰蛋白酶和0.75 g/L或1 g/L胆盐溶解于PBS,用0.1 mol/L NaOH调pH 值至8.0,0.22 μm滤膜过滤除菌,4 ℃冰箱冷藏备用。
1.4.6 Caco-2细胞黏附实验
调整细胞浓度为2×105cells/mL,接种于24孔培养板中,置于37 ℃、5%(体积分数)的CO2培养箱中培养。待细胞培养至单层,用PBS缓冲液漂洗细胞2次去除未贴壁细胞。参照1.4.5节方法选择模拟胃肠液两对活化后的乳酸菌进行消化应激,同时以未经消化应激处理的乳酸菌作为对照。用PBS洗涤菌体2次,然后用PBS重悬并调整菌液浓度至108 CFU/mL。将500 μL调整后的菌悬液加入细胞模型,37 ℃培养2 h后,用PBS洗涤3次去除未黏附的乳酸菌,然后加入150 μL胰酶细胞消化液,待细胞全部脱落后加入350 μL完全细胞培养液终止消化。最后收集细胞和菌体的混合悬液,利用平板计数法计算黏附率[13],如公式(3)所示:
黏附率![]()
(3)
1.4.7 抑菌能力测定
使用LGG作为对照菌株,采用琼脂扩散法检测乳酸菌的抑菌能力。将6种腐败菌和致病菌:大肠埃希氏菌、沙门氏菌、金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌和蜡样芽孢杆菌分别活化至2代,将菌液OD600值调整至0.5,然后梯度稀释100倍,取100 μL稀释后的致病菌菌液均匀涂布于30 mL已凝固的LB琼脂培养基表面,待菌液完全吸收,在LB培养基平板上打孔,并向孔中添加200 μL乳酸菌菌悬液,于18 ℃扩散12 h至发酵液吸收,随后转移至37 ℃培养18~24 h至出现抑菌圈,立即取出测量抑菌圈直径。
1.4.8 溶血能力测定
取活化2代的乳酸菌菌悬液划线于哥伦比亚血琼脂平板,37 ℃倒置培养48 h后观察单菌落周围颜色变化。以LGG作为对照菌株,若单菌落周围出现草绿色圈为α溶血,若单菌落周围出现透明圈则为β溶血,若菌落周围无颜色变化为γ溶血,即不溶血。
1.4.9 产生物胺检测
取活化2代的乳酸菌菌悬液分别划线于添加相应前体氨基酸的氨基酸脱羧酶检测培养基,37 ℃倒置培养48 h后观察平板颜色变化,若无颜色变化则结果为阴性,若平板变紫则结果为阳性。以LGG和金黄色葡萄球菌作为对照菌株。
1.4.10 耐药性评价
参照美国临床实验室标准化委员会(Clinical Laboratory Standard Institute, CLSI)推荐使用的纸片扩散(Kirby-Bauer, K-B)法[14]检测菌株对抗生素的敏感性,抗生素的种类及浓度见表1。吸取100 μL菌悬液(用无菌PBS调节OD600值至0.6)均匀涂布于20 mL已凝固的MRS琼脂培养基表面,待菌液完全吸收后,用无菌镊子将药敏纸片贴于培养基表面,静置30 min后转移至37 ℃倒置培养18~24 h,待抑菌圈出现后立即取出测量直径。使用LGG作为对照菌株。
表1 药敏纸片含药量及抗性判定标准
Table 1 Drug content and resistance determination criteria of drug-sensitive tablets
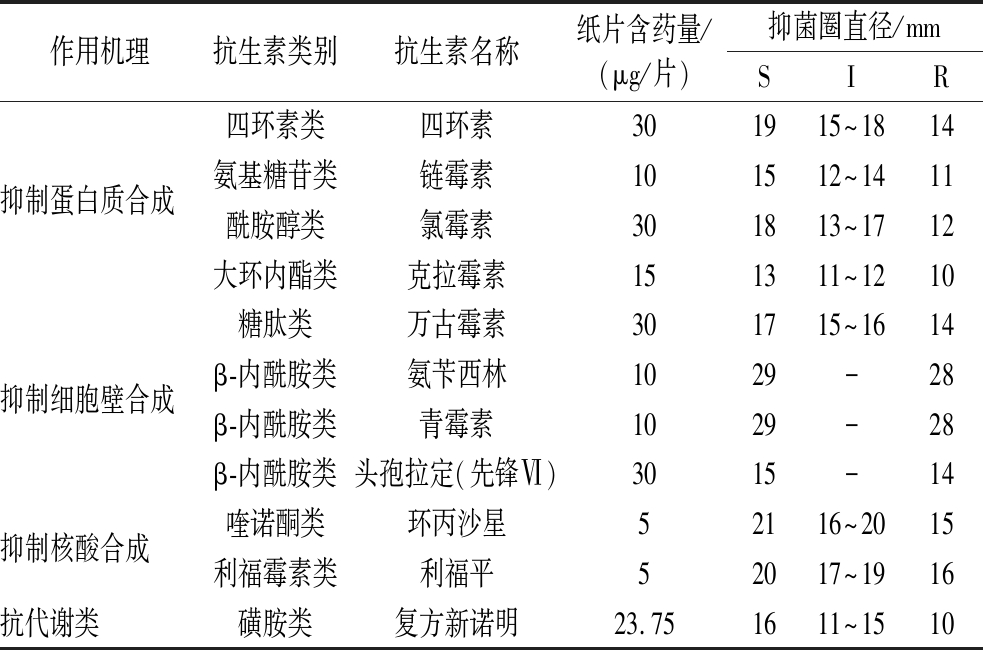
作用机理抗生素类别抗生素名称纸片含药量/(μg/片)抑菌圈直径/mmSIR抑制蛋白质合成四环素类四环素301915~1814氨基糖苷类链霉素101512~1411酰胺醇类氯霉素301813~1712大环内酯类克拉霉素151311~1210抑制细胞壁合成糖肽类万古霉素301715~1614β-内酰胺类氨苄西林1029-28β-内酰胺类青霉素1029-28β-内酰胺类头孢拉定(先锋Ⅵ)3015-14抑制核酸合成喹诺酮类环丙沙星52116~2015利福霉素类利福平52017~1916抗代谢类磺胺类复方新诺明23.751611~1510
注:S:敏感(sensitivity);I:中介(insensitive);R:耐药(resistant)。
1.5 数据处理
实验所得数据为3次重复试验结果的平均值。数据采用SPSS 19.0进行差异显著性分析。
2 结果与分析
2.1 菌株的筛选及鉴定结果
从母乳和婴儿粪便中共分离得到131株革兰氏阳性产酸菌株。胆盐具有抑菌作用,革兰氏阳性菌对胆盐较为敏感[15],因此胆盐耐受能力是衡量优良乳酸菌的一个重要指标,本研究利用胆盐耐受能力对分离到的菌株进行初筛。健康成年人的胆盐浓度为2.6~3.0 mmol/L,但消化过程中胆囊的分泌物可使十二指肠中的胆盐浓度增加至12~16 mmol/L[16]。足月婴儿的胆盐浓度为3.0 mmol/L,然而喂食后急剧下降至1.0 mmol/L[17],早产儿的胆盐浓度甚至更低[18]。母乳及婴儿来源乳酸菌胆盐耐受能力较弱,大多数菌株在0.3%(约7.34 mmol/L)胆盐中无法存活,而在0.1%(约2.45 mmol/L)胆盐中存活率极低,设置0.75和1 g/L 2个胆盐浓度较为适宜母婴来源益生菌的筛选。131株革兰氏阳性产酸菌株,在0.075%胆盐中,有44株菌株的耐受存活率<1%,有47株菌株的耐受存活率>10%。在1 g/L胆盐中,有78株菌株的耐受存活率<1%,有18株菌株的耐受存活率>10%。
经耐胆盐筛选获得4株优良菌株,其胆盐耐受存活率如表2所示,在0.75 g/L胆盐中,所有菌株的胆盐耐受存活率均大于90%。在1 g/L胆盐中,M621存活率达到80.00%,显著高于其余菌株(P<0.05),M664和M673次之,存活率为50%~60%,M678存活率最低,但达到了47.24%。本次筛选获得的4株菌株均具有一定的胆盐耐受能力,为其在胃肠道的成功定殖提供了保障。
表2 菌株胆盐耐受存活率
Table 2 Bile salt tolerance survival rate of strain
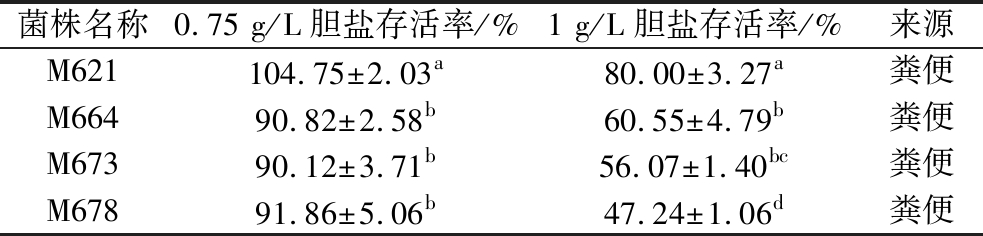
菌株名称0.75 g/L胆盐存活率/%1 g/L胆盐存活率/%来源M621104.75±2.03a80.00±3.27a粪便M66490.82±2.58b60.55±4.79b粪便M67390.12±3.71b56.07±1.40bc粪便M67891.86±5.06b47.24±1.06d粪便
注:同列数据肩标不同字母表示在P<0.05水平上差异显著(下同)。
4株菌的菌体形态如图1所示,均为杆状。经鉴定,4株菌均为植物乳杆菌。根据菌株的16S rDNA构建了系统发育树(图2),所筛选菌株与植物乳杆菌ATCC 14917在同一分支上,可进一步确定均为植物乳杆菌。
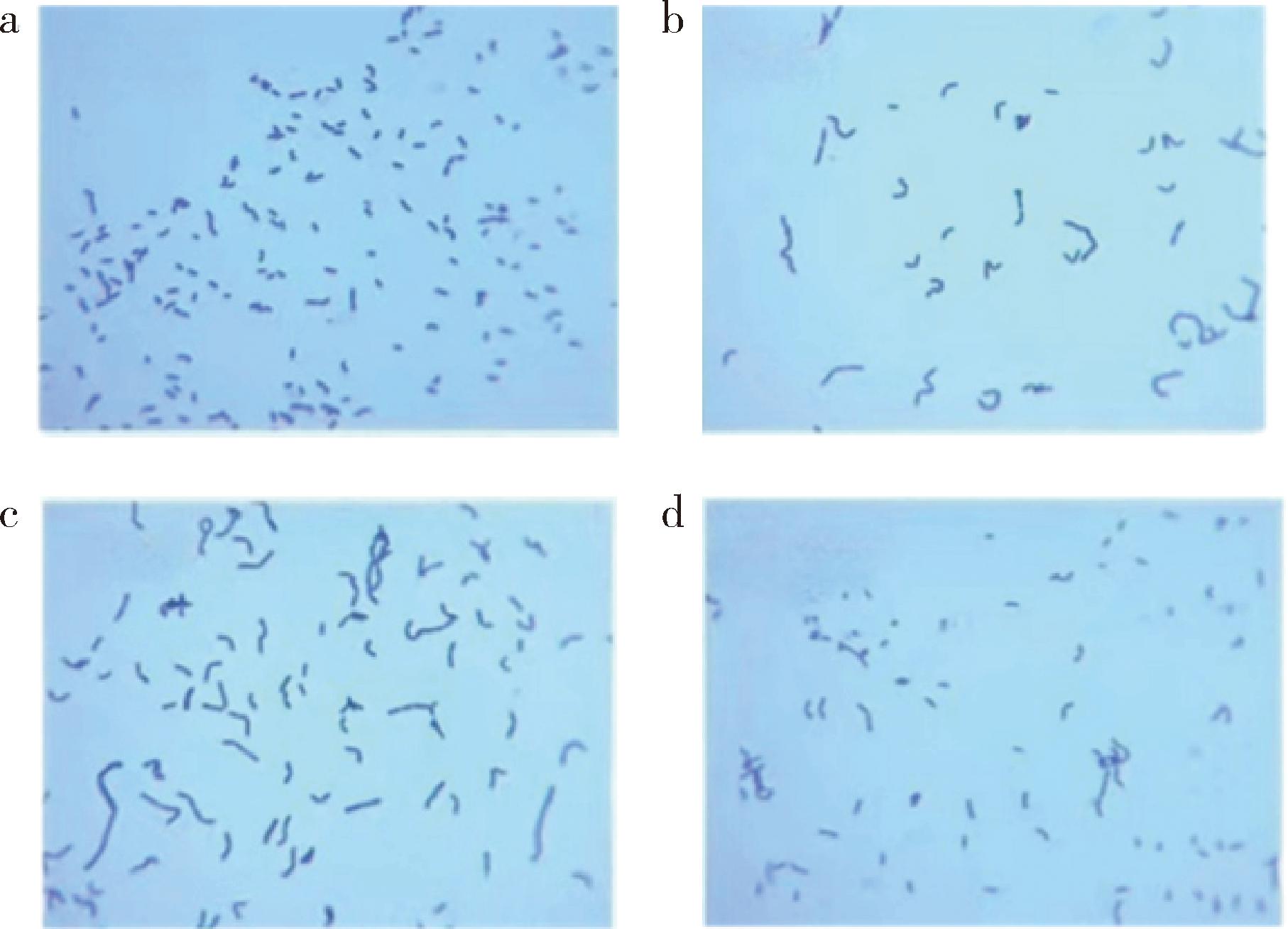
a-M621;b-M664;c-M673;d-M678
图1 菌株镜检(100×油镜)图片
Fig.1 Image of strain microscopy (100× oil microscope)
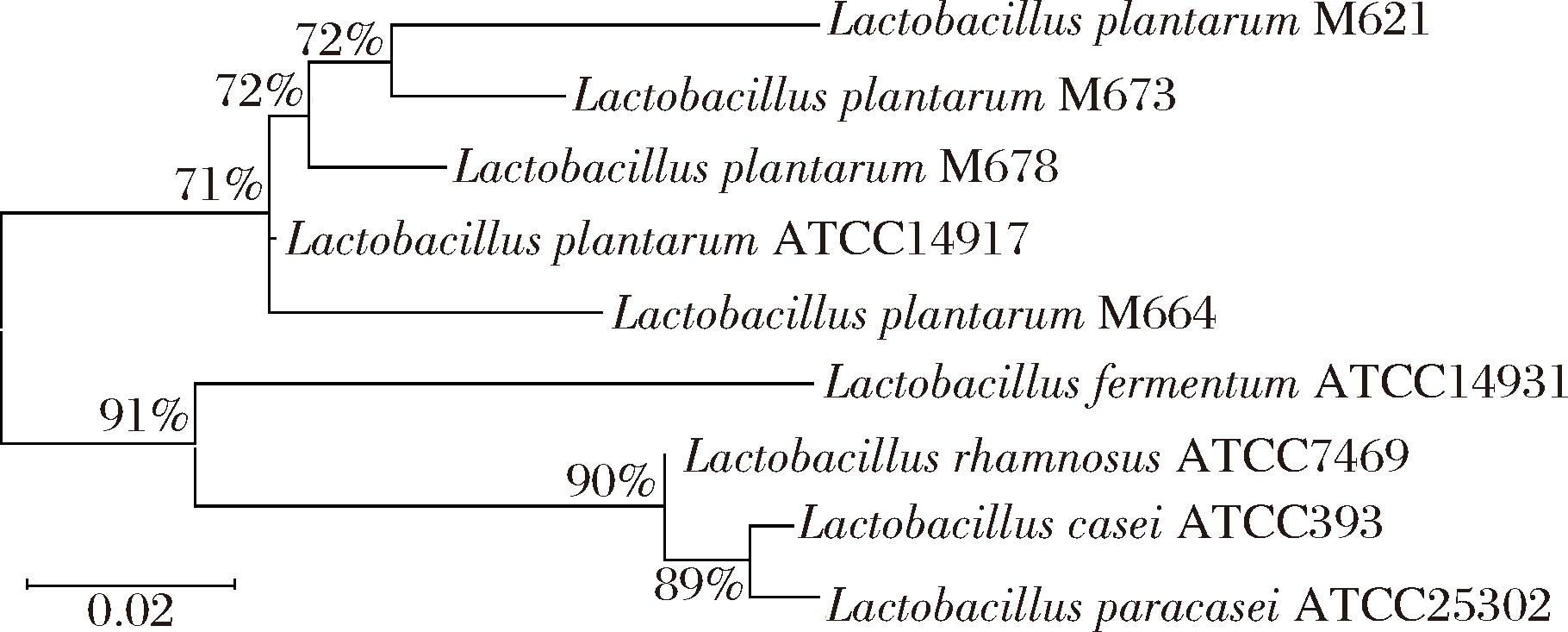
图2 菌株16S rDNA基因序列系统发育树
Fig.2 Phylogenetic tree of 16S rDNA gene sequence of strain
母乳中乳酸杆菌的种类取决于国家和饮食习惯[22],植物乳杆菌主要从东方膳食模式和地中海膳食模式国家的母乳中分离出来。LUZ等[19]从西班牙母乳中筛选到3株植物乳杆菌。JARA等[20]和DUBOS等[21]从智利(黄种人为主)母乳样品中也分离到植物乳杆菌,且发现植物乳杆菌为主要菌种。JAMYUANG等[22]从泰国母乳样品中分离得到植物乳杆菌。SHARMA等[23]从印度母乳中筛选到11株乳杆菌,分别为植物乳杆菌、戊糖乳杆菌和干酪乳杆菌。而西方膳食模式国家的母婴来源乳杆菌已发现有酵乳杆菌[24-25]、干酪乳杆菌、副干酪乳杆菌、嗜酸乳杆菌[26]、格氏乳杆菌[27]和唾液乳杆菌[28]等,鲜有植物乳杆菌的报道。由此可见,膳食模式对母乳和婴儿肠道的菌群产生重要影响,植物乳杆菌可能更适于中国人群的胃肠道,因此母婴来源植物乳杆菌的开发具有广阔前景。
2.2 菌株模拟胃液耐受能力
乳酸菌进入口腔后最先经历的是胃部酸性环境的考验,婴儿的胃酸分泌弱于成人,其胃内容物的pH在较长一段时间内呈轻度酸性,在消化的前2 h pH值从6下降至5,3 h后降至pH值3.3[29]。图3展示了4株植物乳杆菌对pH值2.5模拟胃液耐受3 h后的存活率,4株菌均具有较好的耐酸能力,存活率均大于50%,其中M673的存活率最高,达到79.45%,显著高于其余3株菌株(P<0.05)。高盛等[30]从母乳中分离得到一株L.rhamnosus,也展现了较强的耐酸能力。本研究中,乳酸菌较高的模拟胃液耐受能力为其在人体肠道成功定殖并发挥益生作用奠定了基础。
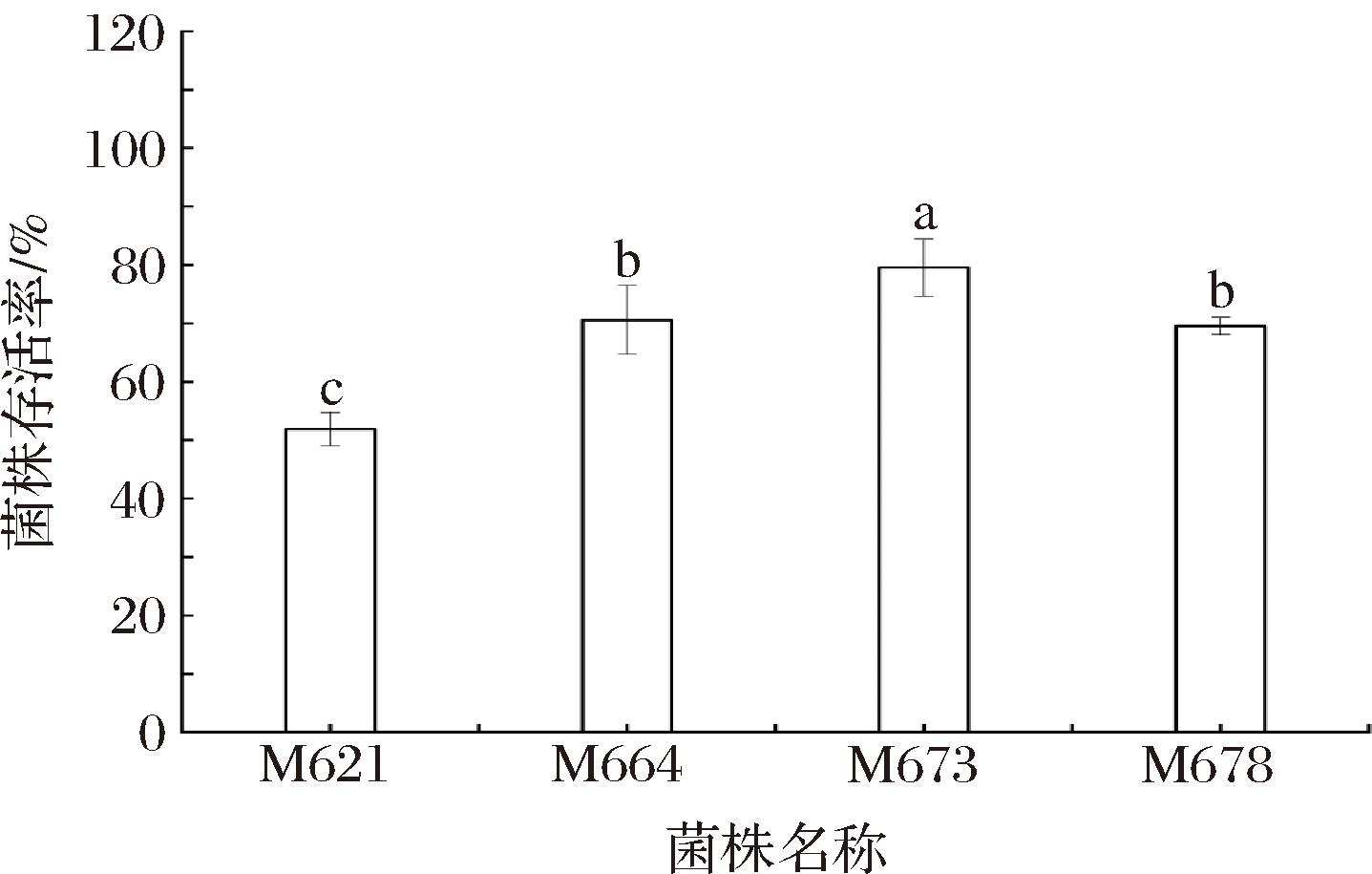
图3 菌株pH 2.5模拟胃液耐受存活率
Fig.3 Survival rate of strain under pH 2.5 simulated gastric juice tolerance
注:同一列不同上标字母表示有显著性差异(P<0.05)(下同)。
2.3 菌株模拟胃肠液耐受能力
乳酸菌在胃肠道的存活受到胃肠环境pH和各种酶以及无机盐的影响。食物通过胃的时间约1~3 h,通过小肠的时间约1.5 h[32],菌株的模拟胃肠液存活率一定程度上反映其经历消化后到达人体小肠的存活率。表3展示了4株植物乳杆菌和LGG的模拟胃肠液耐受存活率,在模拟胃肠液1中,M664的存活率高达95.89%,M678和M621次之,存活率均为30%~60%;在模拟胃肠液2中,M664的存活率仍然显著高于其他菌株(P<0.05),约50%,M621次之,为36.03%。KANG等[31]从母乳中分离到2株L.rhamnosus:LHL6和LHL7,其模拟胃肠液耐受存活率分别为7.13%和5.74%,展现了一定的胃肠道存活潜力。本研究4个植物乳杆菌的模拟胃肠液存活率均大于对照菌株LGG,也展现了良好的胃肠道环境耐受能力。
表3 菌株模拟胃肠液耐受存活率 单位:%
Table 3 Survival rate of simulated gastroenteric fluid
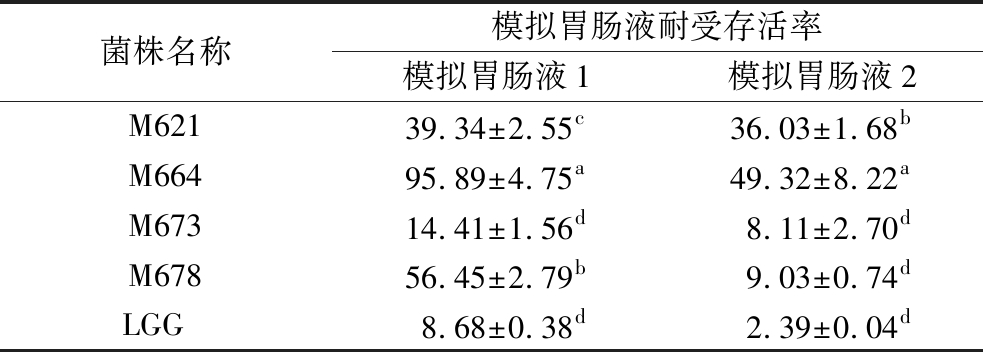
菌株名称模拟胃肠液耐受存活率模拟胃肠液1模拟胃肠液2M62139.34±2.55c36.03±1.68bM66495.89±4.75a49.32±8.22aM67314.41±1.56d8.11±2.70dM67856.45±2.79b9.03±0.74dLGG 8.68±0.38d2.39±0.04d
注:模拟肠液1含1 g/L胰蛋白酶、0.75 g/L胆盐;模拟肠液2含1 g/L胰蛋白酶、1 g/L胆盐。
2.4 菌株对Caco-2细胞的黏附能力
乳酸菌经胃肠道的消化应激后黏附定殖于肠道,从而发挥对机体的益生作用。图4展示了菌株在模拟胃肠液消化应激处理后和不作应激处理的条件下对Caco-2细胞的黏附能力,M678、M621和LGG的黏附率在应激处理前后不具有差异性(P>0.05),而M664、M673的黏附率在消化应激后显著降低(P<0.05)。此外,M678在消化应激后仍具有较高的黏附能力,为10.98%,高于对照菌株LGG(5.38%)。M621消化应激后的黏附率略低于LGG,为3.84%。M664和M673消化应激后的黏附率则较低,分别为1.43%和1.72%。陈春萌[13]的研究表明,经过模拟唾液-胃液-肠液1(1.5 g/L胆盐)的消化应激,植物乳杆菌S7的黏附率显著提高1.46倍,植物乳杆菌67无显著变化,而植物乳杆菌W198显著降低,黏附率由35%降至12.14%。表明消化应激对菌株黏附能力的影响具有菌株差异性,可能是由于应激导致部分乳酸菌分泌表层蛋白保护菌体免受环境伤害所致[33]。
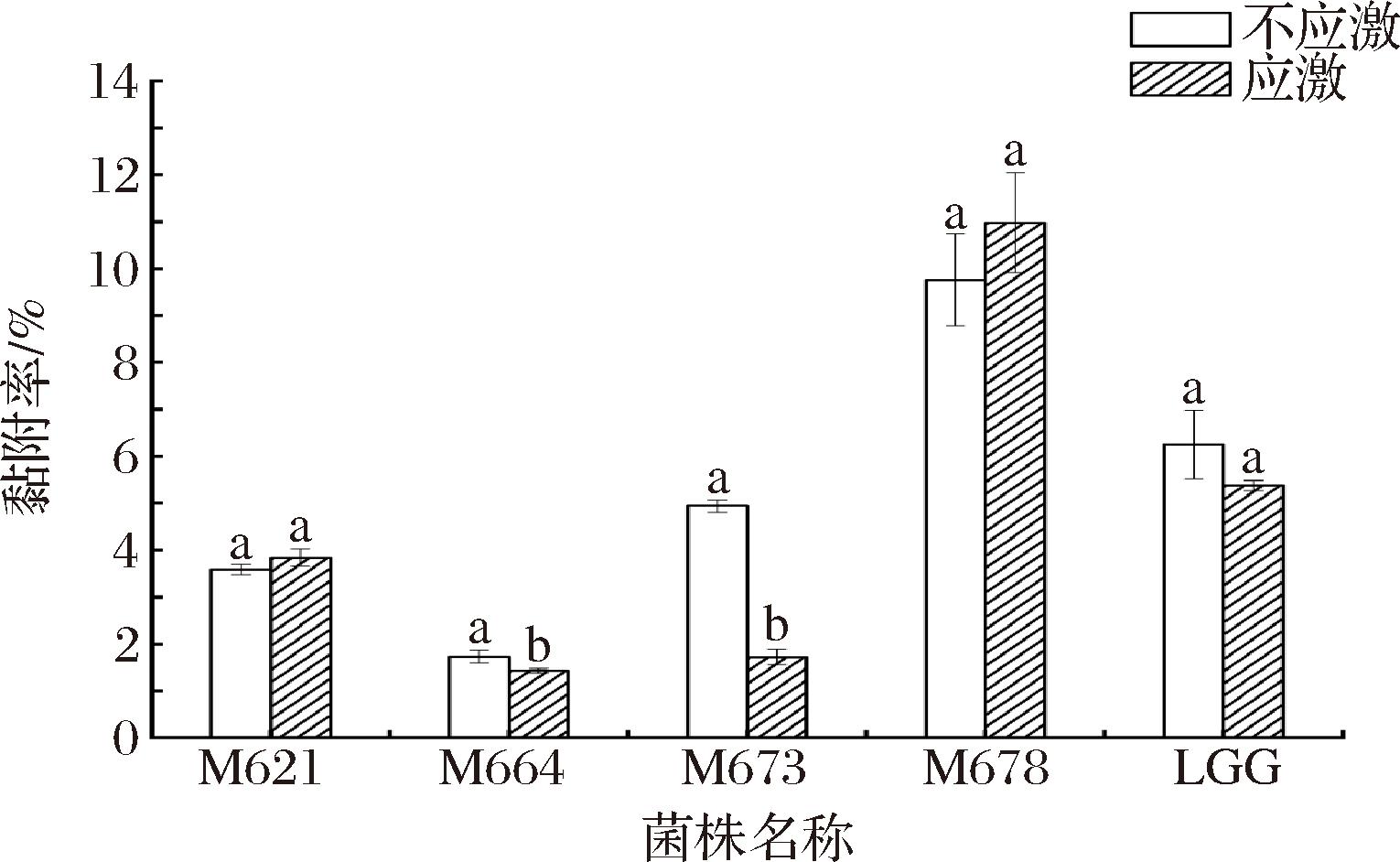
图4 菌株对Caco-2细胞的黏附能力
Fig.4 Adhesion of strains to Caco-2 cells
2.5 菌株抑菌能力
乳酸菌通过产生有机酸、细菌素等具有抑菌活性的代谢产物来抑制腐败菌和致病微生物的生长,因此抗菌活性也被认为是衡量潜在益生菌菌株的重要标准[23]。菌株对6种腐败菌和致病菌的抑制能力如表4所示,4株植物乳杆菌和对照菌株LGG对6种腐败菌和致病菌均具有较好的抑制效果,抑菌圈直径均大于16 mm。M664对除大肠埃希氏菌之外的5种致病菌的抑菌圈直径均大于20 mm,M678对除了大E.coli和P.aeruginosa之外的其余4株致病菌的抑菌圈直径>20 mm,LGG则对E.coli和B.cereus之外的其余4株致病菌的抑菌圈直径>20 mm,M621和M673的抑菌效果相比LGG较弱,仅对B.subtilis、B.cereus和P.aeruginosa 3种致病菌的抑菌圈直径>20 mm。尹春媚[34]研究发现植物乳杆菌R9对E.coli、单增李斯特氏菌、S.aureus、宋氏志贺氏菌、B.cereus、伤寒沙门氏菌、阪崎肠杆菌和肠炎沙门氏菌的抑菌直径均在20 mm以上。总体而言,本研究得到的M664和M678相比其余3株菌株具有更强的抑菌效果。
表4 菌株对腐败菌和致病菌的抑制能力
Table 4 Inhibition ability of the strains to spoilage bacteria and pathogenic bacteria
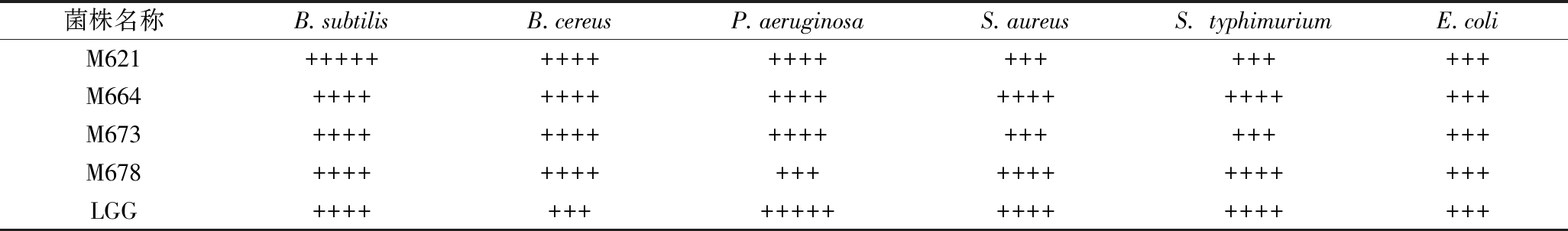
菌株名称B.subtilisB.cereusP.aeruginosaS.aureusS. typhimuriumE.coliM621++++++++++++++++++++++M664+++++++++++++++++++++++M673+++++++++++++++++++++M678++++++++++++++++++++++LGG+++++++++++++++++++++++
注:表中数据为抑菌圈直径,其中+:阳性(8-12 mm);++:12-16 mm;+++16-20 mm;++++:20-24 mm;+++++:>24 mm。
表5 菌株溶血性测定结果
Table 5 Results of hemolytic assay of strains

菌株名称溶血结果M621M664M673M678LGG不溶血S.aureusβ溶血
2.6 菌株溶血能力
溶血性是检测菌株安全性的重要指标之一,致病菌生长过程中会产生溶血素导致红细胞破裂从而产生溶血现象。4株植物乳杆菌的菌落周围未产生草绿色溶血圈(α溶血)或透明圈(β溶血),但菌落密集处有轻微变黑现象(与LGG相同)。有研究表明机体血乳酸水平与溶血病情明显相关[35],因此,推测该现象可能与菌株产酸能力较强引起乳酸堆积所致。4株菌株的溶血结果均为γ溶血即不溶血。
2.7 菌株产生物胺能力
部分乳酸菌具有氨基酸脱羧酶,能够将氨基酸转化为相应的生物胺,生物胺虽然发挥着重要的生理功能,但过量的生物胺会导致头痛、呼吸道疾病和心悸等症状[36]。菌株产生物胺检测结果如表6所示,阳性对照S.aureus菌产生尸胺、酪胺和腐胺,导致检测平板pH值增加,可以观察到相应的赖氨酸、酪氨酸和鸟氨酸脱羧酶检测平板均变紫。4株植物乳杆菌和LGG的检测平板保持黄色,即均不产生组胺、尸胺、酪胺和腐胺。
表6 菌株产生物胺测定结果
Table 6 Results of determination of amines produced by strains
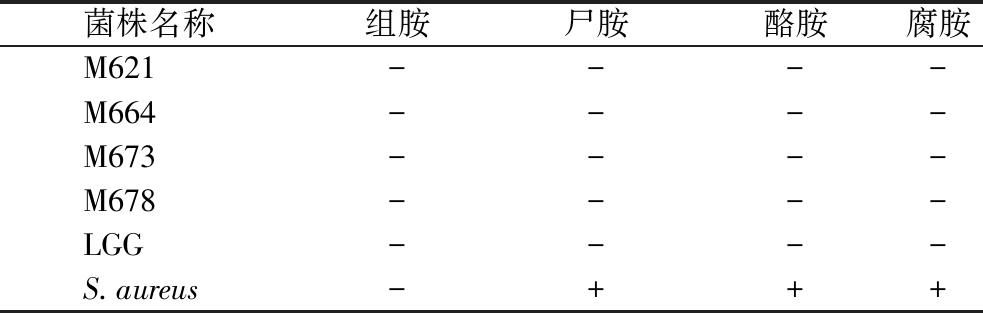
菌株名称组胺尸胺酪胺腐胺M621----M664----M673----M678----LGG----S.aureus-+++
注:-表示未检出;+表示检出。
2.8 菌株耐药性评价结果
乳酸菌另一个重要的安全指标即抗生素耐药性,耐药基因向致病菌转移会对宿主的安全造成威胁。菌株抗生素敏感性测定结果如表7所示,所有菌株对大部分抗生素都表现敏感,具有较高的安全性。值得注意的是,所有菌株都对万古霉素有耐药性,这与SALIBA等[37]的研究一致,有研究表明这种耐药性是许多乳酸菌种类所固有的,可能是由点突变而不是基因转移产生的,被认为是安全的[38]。此外,4株植物乳杆菌对环丙沙星表现耐药,而LGG表现中介;除M664和LGG以外,其余3株菌均对青霉素表现耐药;M621还表现出对利福平的耐药性,M678则和LGG一样表现出对氨苄西林的耐药性。乳酸菌对部分临床重要抗生素的耐药性使它们可以作为有效菌株与抗生素联合使用来治疗细菌感染[39]。但是考虑到耐药基因转移的安全问题,M664和M673耐抗生素种类更少,可能比LGG具有更好的安全性。
表7 菌株抗生素敏感性测定结果
Table 7 Results of antibiotic sensitivity determination of strains
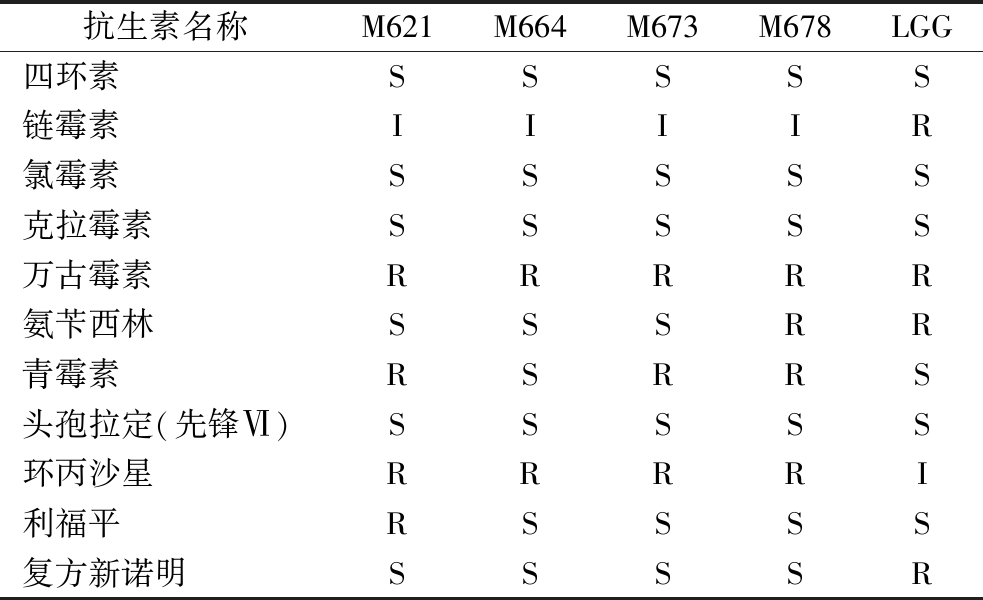
抗生素名称M621M664M673M678LGG四环素SSSSS链霉素IIIIR氯霉素SSSSS克拉霉素SSSSS万古霉素RRRRR氨苄西林SSSRR青霉素RSRRS头孢拉定(先锋Ⅵ)SSSSS环丙沙星RRRRI利福平RSSSS复方新诺明SSSSR
3 结论
本研究从母乳和婴儿粪便中分离到131株革兰氏阳性产酸菌株,经耐胆盐测试筛选得到4株植物乳杆菌,通过耐酸实验、模拟胃肠液耐受实验、黏附实验、抑菌实验、溶血能力测定、产生物胺检测及耐药性评价对其体外益生特性及安全性进行分析。4株菌在0.1%胆盐中的存活率均大于45%,在pH值2.5模拟胃液中的存活率均大于50%。M664和M621在模拟胃肠液中的存活率较高。经消化应激后,M678对Caco-2细胞的黏附率较高。4株菌株对6种腐败菌和致病菌的抑菌圈直径均大于16 mm,其中M664和M678更为出色。4株菌均不溶血、不产生物胺。在耐药性评价中,4株菌均对大多数抗生素表现敏感,尤其M664和M673展现了较好的安全性。
植物乳杆菌的代谢特征适于偏植物性饮食习惯的肠道环境,是中国人群中常见的人源乳杆菌。植物乳杆菌属于国家允许添加到食品中的菌种,但是尚未有菌株进入国家允许用于婴幼儿食品的菌株名单。本研究筛选到的植物乳杆菌M664有较强的胃肠道环境耐受能力、不溶血、不产生物胺、对大多数抗生素表现敏感;植物乳杆菌M678有更好的抑菌能力和细胞黏附能力,不溶血,不产生物胺,对大多数抗生素表现敏感,2株菌均分离自婴儿粪便,均表现出优良的益生特性和安全性评价,是优良的婴幼儿适用益生菌候补菌株,可供后续动物、人体和临床研究使用。
[1] LYONS K E, ANTHONY RYAN C, DEMPSEY E M, et al.Breast milk, a source of beneficial microbes and associated benefits for infant health[J].Nutrients, 2020, 12(4):1039.
[2] 张志焱, 刘红莲, 刘海涛, 等.乳酸菌发酵上清液对肉仔鸡生产性能和免疫功能的影响[J].中国畜牧杂志, 2013, 49(15):78-82.
ZHANG Z Y, LIU H L, LIU H T, et al.Effects of fermentation supernatant of lactic acid bacteria on performance and immune function of broilers[J].Chinese Journal of Animal Science, 2013, 49(15):78-82.
[3]  UBIECH K,
UBIECH K, ![]() M.Lactobacillus bacteria in breast milk[J].Nutrients, 2020, 12(12):3783.
M.Lactobacillus bacteria in breast milk[J].Nutrients, 2020, 12(12):3783.
[4] L PEZ-HUERTAS E.Safety and efficacy of human breast milk Lactobacillus fermentum CECT 5716.A mini-review of studies with infant formulae[J].Beneficial Microbes, 2015, 6(2):219-224.
PEZ-HUERTAS E.Safety and efficacy of human breast milk Lactobacillus fermentum CECT 5716.A mini-review of studies with infant formulae[J].Beneficial Microbes, 2015, 6(2):219-224.
[5] 国家卫生健康委员会. 关于发酵乳杆菌CECT5716等3个菌种的公告:卫生部公告(2016)6号[EB/OL].(2016-05-30)/[2023-12-13].https://zwfw.nhc.gov.cn/kzx/tzgg/xspylsp_225/202005/t20200526_1289.html.
[6] RIAZ RAJOKA M S, MEHWISH H M, SIDDIQ M, et al.Identification, characterization, and probiotic potential of Lactobacillus rhamnosus isolated from human milk[J].LWT, 2017, 84:271-280.
[7] 国家卫生健康委员会. 关于公布可用于婴幼儿食品的菌种名单的公告:卫生部公告(2011)25号[EB/OL].(2011-12-24)/[2023-12-13].http://www.nhc.gov.cn/sps/s7891/201111/a10fe4a0b1dd477c9884649220368cc 2.shtml.
[8] 国家卫生健康委员会. 关于β-1,3/α-1,3-葡聚糖等6种“三新食品”的公告:卫生部公告(2021)5号[EB/OL].(2021-04-15)/[2023-12-13].https://zwfw.nhc.gov.cn/kzx/tzgg/xspylsp_225/202104/t20210426_2094.html.
[9] 胡鹏钰, 于俊娟, 王鹏, 等.母乳来源益生菌的筛选及潜在益生特性研究[J].食品与发酵工业, 2021, 47(14):190-195.
HU P Y, YU J J, WANG P, et al.Screening of probiotics from breast milk and its potential probiotic characteristics[J].Food and Fermentation Industries, 2021, 47(14):190-195.
[10] SAITOU N, NEI M.The neighbor-joining method:A new method for reconstructing phylogenetic trees[J].Molecular Biology and Evolution, 1987, 4(4):406-425.
[11] 陈大卫. 辅助降血脂益生乳酸菌的筛选及其对高血脂大鼠肠道菌群的影响[D].扬州:扬州大学, 2015.
CHEN D W.Screening of probiotic lactic acid bacteria to help reduce blood lipid and its effect on intestinal flora in hyperlipidemia rats[D].Yangzhou:Yangzhou University, 2015.
[12] LIU W J, CHEN M X, DUO L N, et al.Characterization of potentially probiotic lactic acid bacteria and bifidobacteria isolated from human colostrum[J].Journal of Dairy Science, 2020, 103(5):4013-4025.
[13] 陈春萌. 消化应激对乳酸菌黏附能力的影响[D].扬州:扬州大学, 2021.
CHEN C M.Effect of digestive stress on adhesion of lactic acid bacteria[D].Yangzhou:Yangzhou University, 2021.
[14] Clinical and Laboratory Standards Institute (CLSI).Performance standards for antimicrobial susceptibility testing[S].Wayne:CLSI, 2017:64-67.
[15] 安浩然. 长双歧杆菌BBMN68抗胆盐胁迫反应机制及双组分系统在胆盐胁迫应答中的作用[D].北京:中国农业大学, 2014.
AN H R.Mechanism of Bifidobacterium longum BBMN68' s resistance to bile salt stress and the role of two-component system in bile salt stress response[D].Beijing:China Agricultural University, 2014.
[16] KALANTZI L, GOUMAS K, KALIORAS V, et al.Characterization of the human upper gastrointestinal contents under conditions simulating bioavailability/bioequivalence studies[J].Pharmaceutical Research, 2006, 23(1):165-176.
[17] GLASGOW J F, DINSMORE H, MOLLA A, et al.A comprehensive study of duodenal bile salts in newborn infants and their relationship to fat absorption[J].Irish Journal of Medical Science, 1980, 149(9):346-356.
[18] J RVENP
RVENP
 A L, RASSIN D K, KUITUNEN P, et al.Feeding the low-birth-weight infant.III.Diet influences bile acid metabolism[J].Pediatrics, 1983, 72(5):677-683.
A L, RASSIN D K, KUITUNEN P, et al.Feeding the low-birth-weight infant.III.Diet influences bile acid metabolism[J].Pediatrics, 1983, 72(5):677-683.
[19] LUZ C, CALPE J, MANUEL QUILES J, et al.Probiotic characterization of Lactobacillus strains isolated from breast milk and employment for the elaboration of a fermented milk product[J].Journal of Functional Foods, 2021, 84:104599.
[20] JARA S, S NCHEZ M, VERA R, et al.The inhibitory activity of Lactobacillus spp.isolated from breast milk on gastrointestinal pathogenic bacteria of nosocomial origin[J].Anaerobe, 2011, 17(6):474-477.
NCHEZ M, VERA R, et al.The inhibitory activity of Lactobacillus spp.isolated from breast milk on gastrointestinal pathogenic bacteria of nosocomial origin[J].Anaerobe, 2011, 17(6):474-477.
[21] DUBOS C, VEGA N, CARVALLO C, et al.Identification of Lactobacillus spp.in colostrum from Chilean mothers[J].Archivos Latinoamericanos de Nutricion, 2011, 61(1):66-68.
[22] JAMYUANG C, PHOONLAPDACHA P, CHONGVIRIYAPHAN N, et al.Characterization and probiotic properties of Lactobacilli from human breast milk[J].3 Biotech, 2019, 9(11):398.
[23] SHARMA C, SINGH B P, THAKUR N, et al.Antibacterial effects of Lactobacillus isolates of curd and human milk origin against food-borne and human pathogens[J].3 Biotech, 2017, 7(1):31.
[24] ![]() B, et al.Cultivable bacteria from milk from Slovenian breastfeeding mothers[J].Food Technology and Biotechnology, 2014, 52(2):242-247.
B, et al.Cultivable bacteria from milk from Slovenian breastfeeding mothers[J].Food Technology and Biotechnology, 2014, 52(2):242-247.
[25] KOZAK K, CHARBONNEAU D, SANOZKY-DAWES R, et al.Characterization of bacterial isolates from the microbiota of mothers' breast milk and their infants[J].Gut Microbes, 2015, 6(6):341-351.
[26] HAARMAN M, KNOL J.Quantitative real-time PCR analysis of fecal Lactobacillus species in infants receiving a prebiotic infant formula[J].Applied and Environmental Microbiology, 2006, 72(4):2359-2365.
[27] GARCIA-GUTIERREZ E, O’CONNOR P M, COLQUHOUN I J, et al.Production of multiple bacteriocins, including the novel bacteriocin gassericin M, by Lactobacillus gasseri LM19, a strain isolated from human milk[J].Applied Microbiology and Biotechnology, 2020, 104(9):3869-3884.
[28] SOTO A, MART N V, JIMÉNEZ E, et al.Lactobacilli and bifidobacteria in human breast milk:Influence of antibiotherapy and other host and clinical factors[J].Journal of Pediatric Gastroenterology and Nutrition, 2014, 59(1):78-88.
N V, JIMÉNEZ E, et al.Lactobacilli and bifidobacteria in human breast milk:Influence of antibiotherapy and other host and clinical factors[J].Journal of Pediatric Gastroenterology and Nutrition, 2014, 59(1):78-88.
[29] ROMAN C, CARRIERE F, VILLENEUVE P, et al.Quantitative and qualitative study of gastric lipolysis in premature infants:Do MCT-enriched infant formulas improve fat digestion?[J].Pediatric Research, 2007, 61(1):83-88.
[30] 高盛, 乔宇, 张宇微, 等.人母乳源乳酸菌的筛选、鉴定及益生活性的初步研究[J].食品工业科技, 2017, 38(10):205-210.
GAO S, QIAO Y, ZHANG Y W, et al.Isolation, identification and probiotic characterization of lactic acid bacteria in human breast milk[J].Science and Technology of Food Industry, 2017, 38(10):205-210.
[31] KANG W L, PAN L N, PENG C, et al.Isolation and characterization of lactic acid bacteria from human milk[J].Journal of Dairy Science, 2020, 103(11):9980-9991.
[32] 罗强, 张明, 刘巧, 等.产细菌素屎肠球菌SC-Y112的体外益生性及安全性评价[J].食品科学, 2021, 42(11):154-160.
LUO Q, ZHANG M, LIU Q, et al.Evaluation of in vitro probiotic and safety properties of Enterococcus faecium SC-Y112 producing bacteriocin[J].Food Science, 2021, 42(11):154-160.
[33] WU C D, HE G Q, ZHANG J.Physiological and proteomic analysis of Lactobacillus casei in response to acid adaptation[J].Journal of Industrial Microbiology &Biotechnology, 2014, 41(10):1533-1540.
[34] 尹春媚. 母乳源乳酸菌的筛选、鉴定及其益生特性研究[D].长春:吉林农业大学, 2020.
YIN C M.Screening, identification and probiotic characteristics of lactic acid bacteria from breast milk[D].Changchun:Jilin Agricultural University, 2020.
[35] 喻玲, 许柳, 才丽娜, 等.凝血功能、血乳酸与新生儿ABO溶血病相关性研究[J].华北理工大学学报(医学版), 2021, 23(4):258-261;267.
YU L, XU L, CAI L N, et al.Correlation between coagulation function, blood lactic acid and neonatal ABO hemolytic disease[J].Journal of North China University of Science and Technology (Health Sciences Edition), 2021, 23(4):258-261;267.
[36] 杨埔. 食源性乳酸菌的安全性评价[D].济南:山东大学, 2013.
YANG P.Safety evaluation of food-borne lactic acid bacteria[D].Jinan:Shandong University, 2013.
[37] SALIBA L, ZOUMPOPOULOU G, ANASTASIOU R, et al.Probiotic and safety assessment of Lactobacillus strains isolated from Lebanese Baladi goat milk[J].International Dairy Journal, 2021, 120:105092.
[38] OUWEHAND A C, FORSSTEN S, HIBBERD A A, et al.Probiotic approach to prevent antibiotic resistance[J].Annals of Medicine, 2016, 48(4):246-255.
[39] JI J F, YANG H.Using probiotics as supplementation for Helicobacter pylori antibiotic therapy[J].International Journal of Molecular Sciences, 2020, 21(3):1136.