莽草酸(shikimic acid)是一种具有六元碳环的天然有机化合物,广泛存在于多种植物与微生物中,具有抗氧化、抗菌、抗炎、抗血栓等生物活性[1],是合成抗流感药物磷酸奥司他韦的关键原料,也是芳香族氨基酸(苯丙氨酸、酪氨酸、色氨酸)与维生素K2、叶酸等芳香族化合物合成过程中必不可少的中间体,在医药健康领域具有重要的应用前景和商业价值[2]。随着对莽草酸研究的不断深入,莽草酸的市场需求量也在逐年上升。
莽草酸的主要生产方法包括植物提取、化学合成和微生物发酵法。其中,微生物发酵法相较于植物提取法和化学合成法来说更为高产、环保且安全,已成为当前研究热点。大肠杆菌具有遗传背景明确、生长周期短和基因组操作技术成熟等优点,是莽草酸生产的首选底盘细胞。目前,高产莽草酸的大肠杆菌工程菌的构建主要依靠代谢工程改造,主要策略包括提高前体物供给、强化莽草酸合成途径、切断莽草酸消耗途径等[3]。CHANDRAN等[4]在敲除ptsH的基础上,在质粒上过表达了aroFfbr、tktA、aroE等基因,并异源表达了来自运动发酵单胞菌的glf,合成莽草酸产量达87 g/L,产率达到了36%。LEE等[5]敲除了aroK、aroL、tyrR、ptsG、pykA和shiA,过表达aroB、aroD、aroF、aroG和aroE基因,在此基础上过表达了tktA基因并确认了shiA和ydiN基因的缺失可以影响莽草酸的产量,最终将莽草酸的产量提升到了101 g/L。LI等[6]在计算机的辅助下筛选出莽草酸合成相关基因位点,对aroE基因进行了突变,减少了副产物脱氢莽草酸的产生,采用动态调控策略控制使莽草酸产量达到了126.4 g/L。
对于莽草酸的生物合成菌株,其芳香族氨基酸合成途径缺失等因素易导致生长缓慢且在摇瓶规模下产量不理想,一定程度上阻碍了工程菌代谢网络优化的深入研究。发酵培养基是菌体生长和产物合成的基础,适宜的培养基配方具有补充必须营养物质、减少副产物的生成、缩短发酵时间、提高目标产物产率等优点;对莽草酸合成的发酵培养基和培养条件进行优化,可以提高摇瓶测试阶段工程菌的生产表现。孙晓宇等[7]分别探究了通气量、初始pH、培养温度和接种量等培养条件对莽草酸生产的影响,改良培养基后发酵48 h得到了3.43 g/L的莽草酸产量,是改良前的1.31倍。仲楠[8]利用摇瓶发酵和响应面分析对莽草酸培养基中的主要成分(酵母粉、蛋白胨、芳香族氨基酸)进行了优化,得到了705.32 mg/L的产量,是优化前的2.90倍。韩洪军等[9]对发酵培养基中碳氮源、金属离子进行了单因素优化,并通过正交实验优化了莽草酸发酵培养基,使产量提升了3.22倍。蔡灵芝[10]在色氨酸培养基的基础上使用单因素实验和正交实验进行氮源、碳源和金属离子的优化使莽草酸产量提高至5.75 g/L。本研究旨在通过理性设计从基因组层面对大肠杆菌的莽草酸合成代谢途径进行改造,获得高产莽草酸菌株;同时,对莽草酸在摇瓶规模发酵生产的培养基进行优化,在单因素实验的基础上采用Plackett-Burman(PB)实验筛选出对莽草酸产量有显著影响的因素,再使用响应面法对培养基进行优化,预测得到最佳发酵培养基配方。本研究成功构建了一株生产莽草酸的大肠杆菌工程菌,提高了摇瓶中的发酵生产能力,为莽草酸的生物合成基础研究和工业化生产提供参考依据。
1 材料与方法
1.1 实验材料
1.1.1 菌株
大肠杆菌(Esherichia coli)W3110由天津科技大学工业微生物菌种保藏室提供,其余菌株由本研究构建。本研究中构建的菌株与引物如表1、表2所示。
表1 本研究中涉及的菌株
Table 1 The strains involved in this study

菌株名称描述SA01E.coli W3110 ΔaroLSA02-1SA01,ygay::Ptrc-aroG(D146N)SA02-2SA01,ygay::Ptrc-aroG(D146N) rph::Ptrc-aroG(D146N)SA02-3SA01, ygay::Ptrc-aroG(D146N)rph::Ptrc-aroG(D146N)ilvg::Ptrc-aroG(D146N)SA03-1SA02-1, mbhA::PproD-tktASA03-2SA02-1, mbhA::PJ23101-tktASA03-3SA02-1, mbhA::Ptrc-tktASA03-4SA02-1, mbhA::PproA-tktASA04SA03-1,ycgh::Ptrc-ppsASA05SA04,yciq::Ptrc-aroE
表2 本研究使用的引物和gRNA靶序列
Table 2 Primers and gRNA target sequences used in this study

引物或gRNA序列(5′-3′)aroG-Ptrc-STCCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGACCATGAATTATCAGAACGACGATTTACGaroG-Ptrc-ACACCGACAAACAACAGATAAAACGAAAGGCCCAGTCTTTCGACTGAGCCTTTCGTTTTATTTGTTACCCGCGACGCGCTTaroGm-AATTGTGGGGTGATCATATTGAGAAACTCACCTGCaroGm-SGCAGGTGAGTTTCTCAATATGATCACCCCACAATygay-up-FCCTACAAACCACATCGCACATTygay-U-RAATTGTTATCCGCTCACAATTCCACACATTATACGAGCCGGATGATTAATTGTCAAACACCGAAGCAACCCAAAAGygay-D-FAAAGACTGGGCCTTTCGTTTTATCTGTTGTTTGTCGGTGAACGCTCTCCTGAGTAGGACAAATTTGCTTGCCGCTCCACCygaY-D-RGGAGTAGGGCTTTCCATAGAGTGTtktA-Ptrc-STCCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGACCATGAATTATCAGAACGACGATTTACGtktA-PJ23101-SCTCAGTCCTAGGTATTATGCTAGCAGGAAACAGACCATGTCCTCACGTAAAGAGCTTGCCtktA-part2-1TTGTCGACCACTACACCTACGCtktA-part2-2CGGATTCTTTCGCCTGGCCTGCTTCTTTCGCATCCCtktA-part2-3GGGATGCGAAAGAAGCAGGCCAGGCGAAAGAATCCGtktA-part-RAGTTGCTGGATTACTATGACCCTAGAAGAAATCAACCAGCGCATCAGAAAGTCTCCTGTGCATCTGCTTCTTTCGCATCCCmbhA-part-DFATGCACAGGAGACTTTCTGATGCGCTGGTTGATTTCTTCTAGGGTCATAGTAATCCAGCAACTGACCAAAAGTGCGTCCGATACtktA-ACCGACAAACAACAGATAAAACGAAAGGCCCAGTCTTTCGACTGAGCCTTTCGTTTTATTTGTTACAGCAGTTCTTTTGCTTTCGCAACAPproA-overlap-FCTATGAGTGGTTGCTGGATAACTTTACGGGCATGCATAAGGCTCGTAGGCTATATTCAGGGAGACCACAACGGTTTCCCTCTACAAAPproA-tktA-SCACAACGGTTTCCCTCTACAAATAATTTTGTTTAACTTTTACTAGAGAAAGAGGAGAAATACTAGTATGTCCTCACGTAAAGAGCTTGCPproD-overlap-FCTATGAGTGGTTGCTGGATAACTTTACGGGCATGCATAAGGCTCGTATAATATATTCAGGGAGACCACAACGGTTTCCCTCTACAAAPproD-tktA-SCACAACGGTTTCCCTCTACAAATAATTTTGTTTAACTTTTACTAGAGAAAGAGGAGAAATACTCATATGTCCTCACGTAAAGAGCTTGCmbhA-up-SGCCAGCACGAACATAATCCCmbhA-PJ23101-AGGTCTGTTTCCTGCTAGCATAATACCTAGGACTGAGCTAGCTGTAAACACGGTGGCAGGTTTTGGmbhA-Ptrc-ATCCTGTGTGAAATTGTTATCCGCTCACAATTCCACACATTATACGAGCCGGATGATTAATTGTCAACACGGTGGCAGGTTTTGGmbhA-PproD-AAGTTATCCAGCAACCACTCATAGACCTAGGGCAGCAGATAGGGACGACGTGGTGTTAGCTGTGCTCTAGAACACGGTGGCAGGTTTTGGmbhA-PproD-A2CTTATGCATGCCCGTAAAGTTATCCAGCAACCACTCATAGACCTAGGmbhA-down-SAGACTGGGCCTTTCGTTTTATCTGTTGTTTGTCGGTGAACGCTCTCCTGAGTAGGACAAATGACCAAAAGTGCmbhA-down-ACGGCGTAATCACAAACTGGCppsA-Ptrc-SGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGACCATGTCCAACAATGGCTCGTCppsA-AACAGATAAAACGAAAGGCCCAGTCTTTCGACTGAGCCTTTCGTTTTATTTGTTATTTCTTCAGTTCAGCCAGGCTTAACCAycgh-up-FTAAACTCGTCAGCGGCACAAycgh-U-RAATTGTTATCCGCTCACAATTCCACACATTATACGAGCCGGATGATTAATTGTCAAGGTAGGCGTTTCTGTTGATTCTGycgh-D-FAAAGACTGGGCCTTTCGTTTTATCTGTTGTTTGTCGGTGAACGCTCTCCTGAGTAGGACAAATGCGTGTCGGATTATCGTTCGycgh-D-RGATTCAGGTTGCCATTTACGCaroL-up-STTATTCGTACGCTGCGCGTCaroL-overlap-FGACCTATTGGGGAAAACCCACGGCGCCTATACTTAACGTTCATCCCaroL-overlap-RGGGATGAACGTTAAGTATAGGCGCCGTGGGTTTTCCCCAATAGGTCaroL-down-AGACGCACTCATTGTTCATCCACCaroE-trc-STCCGGCTCGTATAATGTGTGGAATTGTGAGCGGATAACAATTTCACACAGGAAACAGACCATGGAAACCTATGCTGTTTTTGG
续表2

引物或gRNA序列(5′-3′)aroE-ACACCGACAAACAACAGATAAAACGAAAGGCCCAGTCTTTCGACTGAGCCTTTCGTTTTATTTGTCACGCGGACAATTCCTCCYciq-up-FTTACTTGAAGCATTGGGCGAACYciq-up-RAATTGTTATCCGCTCACAATTCCACACATTATACGAGCCGGATGATTAATTGTCAACCAGTCAAGATGCCAGGGTTCYciq-D-FAAAGACTGGGCCTTTCGTTTTATCTGTTGTTTGTCGGTGAACGCTCTCCTGAGTAGGACAAATGTCTGACAAGAACCAGCAAATCCTGYciq-D-RATAGCTTCACCGTGGGCATAACgRNA-aroLTTGCCGATTCGCTTAACCGTgRNA-ygayCTCAACTACCCACAGTTGTTgRNA-mbhATACCGGGCATACCGATGCGAgRNA-ycghTATGCGTCTGAACGACCGTGgRNA-yciqAAACAACGTTTCTTGCCTCA
1.1.2 培养基配方
LB培养基(质量分数):蛋白胨1%,酵母粉0.5%,NaCl 1%;LB固体培养基额外添加琼脂粉2%。
莽草酸摇瓶发酵培养基(NBS培养基[11]):初始葡萄糖10 g/L,K2HPO4 5 g/L,KH2PO4 3.5 g/L,(NH4)2SO4 3.5 g/L,MgSO4·7H2O 1 mmol/L,磷酸甜菜碱 0.22 g/L,CaCl2·2H2O 15 mg/L,维生素B1 0.5 mg/L,微量元素混合液1 mL/L,苯酚红溶液2%(体积分数),pH值7.0~7.2。
微量元素混合液(g/L):FeSO4·7H2O 2.47,CoCl2·6H2O 0.3,CuSO4·5H2O 0.1,ZnCl2 0.196,H3BO5 0.075,MnSO4·H2O 0.4。
1.1.3 主要试剂和仪器
莽草酸(98%,CAS#138-59-0)标准品,上海阿拉丁生化科技股份有限公司;七水合硫酸镁 (AR)、磷酸氢二钾 (AR)、磷酸二氢钾 (AR)、硫酸铵 (AR),国药集团化学试剂有限公司。
1.2 仪器与设备
RePure-D(B)基因扩增仪,杭州柏恒科技有限公司;Eporator®电转化仪、台式高速离心机TGL-16G、微量台式高速离心机TG16-W,德国Eppendorf 公司;SBA-40ES生物传感仪,济南延和生物技术有限公司;制冰机SIM-F140ADL,日本Panasonic公司;振荡培养箱,上海旻泉有限公司。
1.3 实验方法
1.3.1 大肠杆菌工程菌构建
利用基于CRISPR(clustered regularly interspaced short palindromic repeats)/Cas9技术的多元质粒系统编辑方法对工程菌株进行基因改造[12-13]。该方法由双质粒共同介导可以在基因组上高效便捷地优化代谢途径。主要含有2个组成部分:pREDCas9质粒和pGRB质粒。其中pREDCas9质粒主要由Cas9蛋白、奇霉素抗性、λRed重组系统和pGRB质粒的消除系统组成(32 ℃培养)。pGRB质粒上主要承载了gRNA-Cas9蛋白结合区域和氨苄青霉素抗性基因(37 ℃培养)。Cas9蛋白结合pGRB转录出的gRNA形成复合物并识别到靶位点基因,对靶位点基因进行切割。同时,目的DNA片段与靶位点基因发生同源重组从而被整合到了基因组上,实现了目的基因的编辑。具体操作方法如下:在靶位点基因上选择合适的20 bp,通过同源重组将20 bp的双链DNA与线性化pGRB结合形成pGRB。然后使用Primer 5.0以目的基因与靶位点基因为模板设计引物,通过聚合酶链式反应(polymerase chain reaction,PCR)方法扩增目的基因及靶位点基因的上下游同源臂,再利用重叠PCR获得目的DNA片段。将pREDCas9质粒导入感受态细胞中,经菌落PCR筛选出阳性转化子后,将阳性菌株制备成新的电转感受态,在制备前加入0.1 mmol/L的异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)溶液诱导重组酶表达,将目的DNA片段与pGRB质粒加入制备好的感受态细胞中进行电转化,感受态细胞复苏2 h后取适量菌液涂布于含氨苄青霉素(工作质量浓度100 mg/L)和奇霉素(工作质量浓度50 mg/L)的LB固体培养基上,32 ℃过夜培养。随机挑选单菌落进行菌落PCR验证,筛选阳性转化子。筛选得到的阳性菌株接入含有0.2% 阿拉伯糖的LB液体培养基中培养12 h,诱导pREDCas9质粒上的pGRB质粒消除系统切割pGRB质粒,最后将带有pREDCas9质粒的菌株接入LB液体培养基中于42 ℃培养12 h,诱导温敏质粒pREDCas9消除后得到无质粒菌株。
1.3.2 菌株发酵
活化培养:吸取20~25 μL菌液至含有5 mL LB液体培养基的摇管中,220 r/min振荡培养12 h左右后使用消毒过的接种环伸入菌液中,在管壁敲掉环上的膜后在LB平板上划线。过夜培养后挑取板上单菌落接入装有50 ml LB液体培养基的500 mL圆底瓶中,37 ℃,220 r/min培养12 h,作为种子液。
摇瓶发酵培养:将种子液按照10%接种量接至装有25 mL发酵培养基的500 mL挡板瓶中,再加入30 μL IPTG溶液与2 mL质量分数为15%葡萄糖溶液,9层纱布封口,发酵过程中通过以补加氨水来维持pH在适宜范围内。以苯酚红做指示剂,发酵液颜色不再变化时即视为缺糖,缺糖时补加1 mL质量分数为60%葡萄糖溶液。37 ℃,220 r/min发酵24 h。
1.4 培养基优化实验设计
首先进行单因素实验筛选出对莽草酸产量有影响的培养基成分,同时确定各成分的较优浓度范围;再利用Plackett-Burman设计筛选出影响最为显著的3个因素,最后应用Box-Behnken响应面法和Design Expert 12软件对主要影响因素进行分析与优化设计。
1.4.1 单因素实验设计
以NBS培养基为基础,保持其他条件不变,分别添加不同质量浓度的葡萄糖(5、10、20、30 g/L),不同质量浓度的有机氮源蛋白胨(0、2、6、10 g/L)、酵母粉(0、3、6、10 g/L),不同浓度的MgSO4·7H2O(0、0.1、0.3、0.5、1 mmol/L),不同质量浓度的无机盐 (NH4)2SO4与K2HPO4(1、3、6、12 g/L)进行发酵培养,考察不同发酵培养基成分对莽草酸产量的影响。
1.4.2 Plackett-Burman实验设计
在单因素实验的基础上,以初始葡萄糖、酵母粉、蛋白胨、pH值、MgSO4·7H2O、(NH4)2SO4、K2HPO4这7个培养基参数为考察对象,以莽草酸发酵产量为响应值,采用两水平的Plackett-Burman实验设计(N=12)。每个因素在低浓度(-1)和高浓度(+1)两个水平上进行测试,评估各因素对莽草酸产量的影响,具体设计见表3。
表3 Plackett-Burman实验设计
Table 3 Design of Plackett-Burman experiment
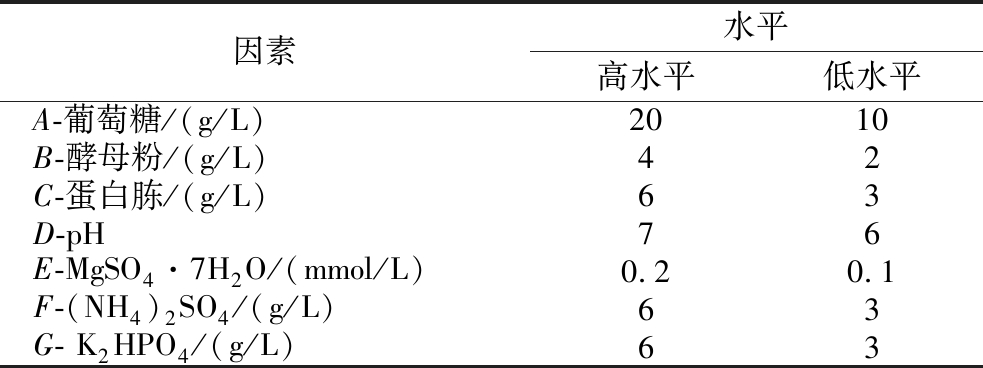
因素水平高水平低水平A-葡萄糖/(g/L)2010B-酵母粉/(g/L)42C-蛋白胨/(g/L)63D-pH76E-MgSO4·7H2O/(mmol/L)0.20.1F-(NH4)2SO4/(g/L)63G- K2HPO4/(g/L)63
1.4.3 Box-Behnken响应面法优化培养基配方
根据单因素实验和PB实验的结果,以莽草酸产量为响应值,根据Box-Behnken中心组设计进行响应面优化,拟合响应面模型,确定最佳发酵培养基,以进一步提高莽草酸的产量,实验设计见表4。
表4 Response surface methodology实验设计
Table 4 Design of response surface methodology

因素水平-101A-酵母粉/(g/L)123B-蛋白胨/(g/L)11.52C-MgSO4·7H2O/(mmol/L)0.10.20.3
1.5 数据处理与统计分析方法
所有实验数据为3次以上重复实验取均值,采用Excel 2010、SPSS Statistics、Origin、Design Expert 12进行实验数据的处理与统计分析。对于单因素实验数据,通过单向方差分析确定显著性差异,然后进行Dunnett’s多重比较检验。0.01<P<0.05表示差异有统计学意义,P<0.01表示差异极显著。
2 结果与分析
2.1 菌株构建
大肠杆菌中莽草酸合成途径如图1所示。为构建莽草酸生产菌株,首先需阻断莽草酸分解途径。根据文献报道,若同时敲除aroL和aroK基因会完全阻断芳香族氨基酸的合成,对菌体生长影响较大[14]。而aroK编码的莽草酸激酶Ⅰ的Km值较大[15],单独敲除aroK无法有效阻断莽草酸的进一步代谢,因此本研究仅敲除aroL基因得到菌株SA01,其发酵产量为0.60 g/L。莽草酸途径中,磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)和赤藓糖-4-磷酸(erythrose 4-phosphate,E4P)在3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸(3-deoxy-D-arabinogenose-7-phosphate,DAHP)合成酶作用下缩合生成DAHP是关键限速步骤,其中DAHP合成酶有3种同工酶,分别由aroG、aroF、aroH 3个基因编码,酶的活力分别受苯丙氨酸、酪氨酸、色氨酸的反馈抑制调节,限制了莽草酸途径的代谢流[16]。为解除关键酶的反馈抑制和验证DAHP合成酶不同表达水平对莽草酸合成的影响,本研究在菌株SA01的基因组上对aroGD146N基因分别进行单拷贝、双拷贝和三拷贝的整合,构建了菌株SA02-1、SA02-2和SA02-3。发酵结果如图2所示,SA02-1的产量为0.67 g/L,SA02-2的产量为0.48 g/L,SA02-3的产量为0.27 g/L。单拷贝aroGD146N菌株的产量明显高于双拷贝和三拷贝菌株,且多拷贝aroGD146N后生物量下降明显,这说明途径酶的过度表达可能会加重菌体的代谢负荷而影响细胞生长,综合比较后,选择SA02-1进行下一步实验。
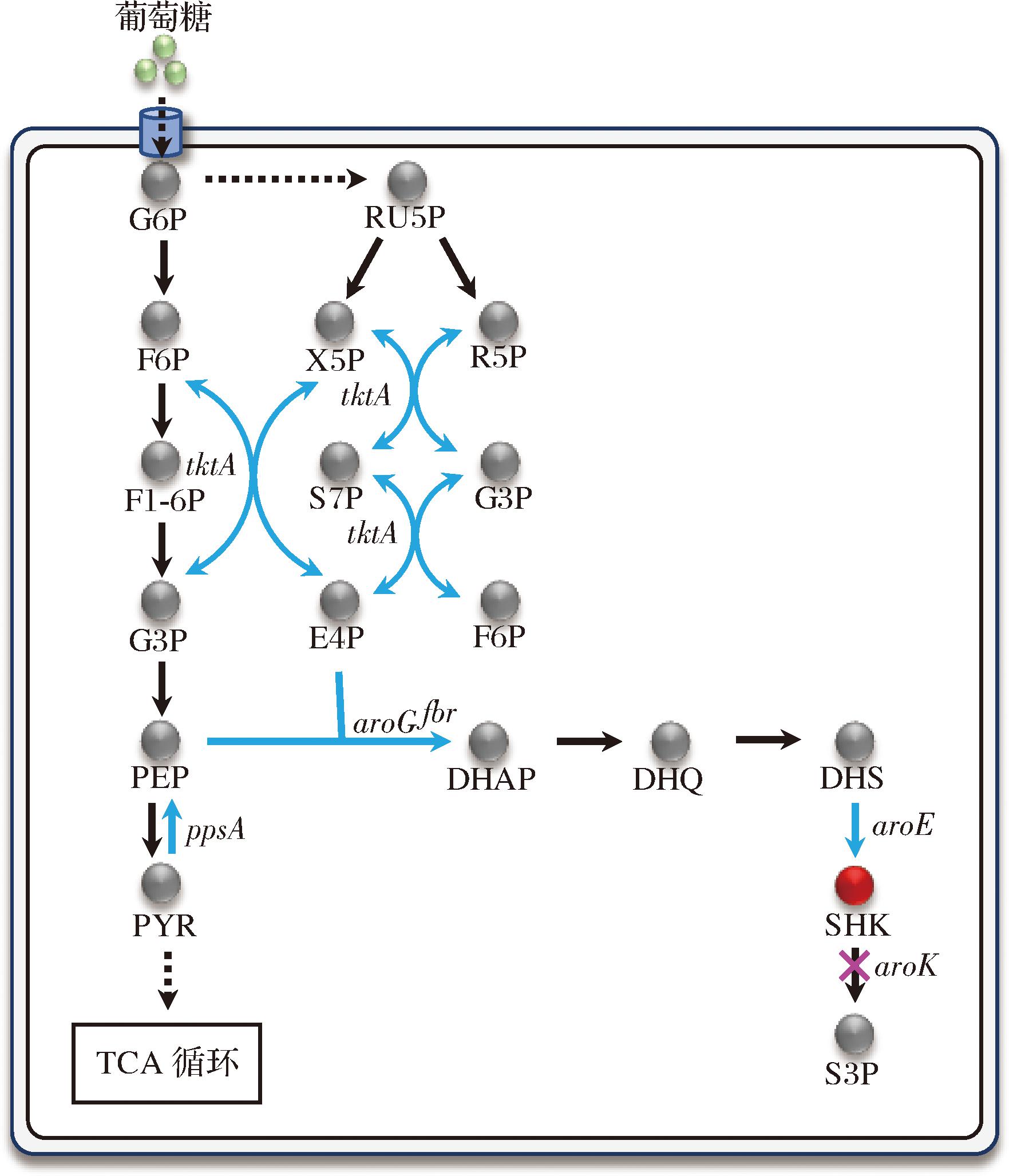
图1 大肠杆菌中的莽草酸合成途径以及本研究中使用的代谢工程策略
Fig.1 The shikimic acid synthesis pathway in Escherichia coli and the metabolic engineering strategy used in this study
注:G6P:葡萄糖-6-磷酸,glucose-6-phosphate;RU5P:核酮糖-5-磷酸,ribulose-5-phosphate;F6P:果糖-6-磷酸,fructose-6-phosphate;X5P:木酮糖-5-磷酸,D-xylulose 5-phosphate;R5P:核糖-5-磷酸,ribose 5-phosphate;F1-6P:1,6-二磷酸果糖,1,6-fructose diphosphate;S7P:景天庚酮糖-7-磷酸,D-altro-beptulose-7- phosphate;G3P:甘油醛-3-磷酸,glyceraldehyde-3-phosphate;E4P:赤藓糖-4-磷酸,erythrose 4-phosphate;PEP:磷酸烯醇式丙酮酸,phosphoenolpyruvate;DHAP:3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸,3-deoxy-D-arabino-heptulosonic acid 7-phosphate;DHQ:3-脱氢奎宁酸,3-dehydroquinic acid;DHS:3-脱氢莽草酸,3-dehydroshikimic acid;PYR:丙酮酸,pyruvic acid;SHK:莽草酸,shikimic acid;S3P:莽草酸-3-磷酸
shikimate-3-phosphate;tktA:编码转酮酶Ⅰ;ppsA:编码磷酸烯醇丙酮酸合成酶;aroGfbr:编码突变的3-脱氧-D-阿拉伯庚酮糖酸-7-磷酸(3-deoxy-D-arabino-heptulosonic acid 7-phosphate,DAHP)合成酶;aroE:编码莽草酸脱氢酶;aroK:编码莽草酸激酶Ⅰ。
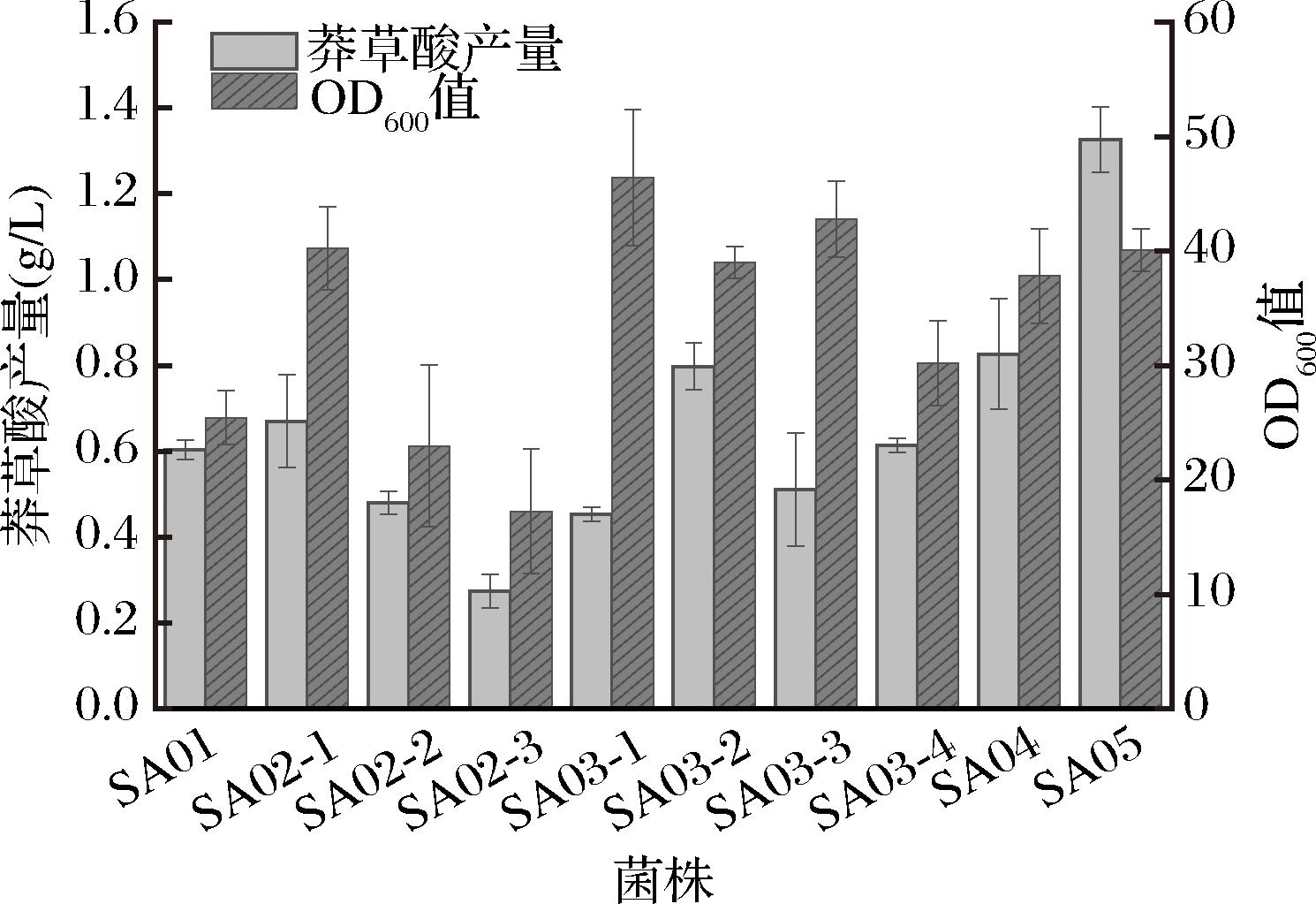
图2 代谢途径改造对莽草酸生产的影响
Fig.2 Effect of metabolic pathway modification on shikimic acid production
E4P和PEP是莽草酸合成的重要前体物质,增强前体物的供给有利于提高莽草酸的积累能力。为此,本研究对基因tktA(编码转酮酶Ⅰ)与ppsA(编码磷酸烯醇丙酮酸合成酶)进行适当强化,以提高E4P和PEP的供应量。首先用不同强度启动子控制tktA基因的表达[17](从强到弱分别为PproD、PJ23101、Ptrc和PproA),得到菌株SA03-1、SA03-2、SA03-3和SA03-4。发酵结果表明中等强度启动子PJ23101控制下增强tktA的表达可以提高莽草酸的生产能力,菌株SA03-2的莽草酸产量达到0.80 g/L,比SA02-1提高了约19%,同时生长未受到过多影响,其余3个菌株莽草酸产量呈不同程度降低,表明E4P的供给过量或不足均会导致代谢流分配不平衡而使产量不理想。为提高PEP的供给量,本研究强化ppsA基因的表达,在SA03-1的基础上过表达ppsA得到菌株SA04,然而其莽草酸产量并未显示出明显提高(产量0.83 g/L),这可能是由于PEP的合成受多条代谢途径调控,需要同时采取其他策略(如敲除丙酮酸激酶编码基因pykF、敲除磷酸烯醇式丙酮酸羧化酶编码基因ppc等)以提高其供给。然而这些策略可能会使PEP生成丙酮酸后进入三羧酸循环的代谢流减小,对菌体生长影响较大,因此本研究未对PEP供给进行继续强化,保留SA04进入下一步实验。
为了进一步提高莽草酸产量,在SA04的基础上对莽草酸途径代谢通量进行强化,减少中间产物积累。根据报道,莽草酸脱氢酶催化的由脱氢莽草酸到莽草酸的反应是该途径中较为重要的限速步骤[18],因此过表达其编码基因aroE得到SA05。如图2所示,发酵结果表明,SA05的莽草酸产量可达1.33 g/L,比SA04提高了约60%。这表明适度强化莽草酸脱氢酶的表达对于提高莽草酸产量具有积极作用且不影响菌体生长。至此,本研究构建出一株合成莽草酸的大肠杆菌用于后续研究。
2.2 单因素试验优化莽草酸发酵生产培养基
为进一步提高莽草酸产量,本研究对发酵培养基进行优化。侯建屾等[11]比较了同一菌株在M9、NBS、AM1和MM等无机盐培养基中的生产性能,最终确定了NBS培养基是最适合莽草酸发酵的无机盐培养。因此,本实验中的基础培养基选用NBS培养基。
2.2.1 初始碳源浓度对莽草酸生产的影响
葡萄糖因其廉价、易利用的优点常被用作大肠杆菌发酵生产中的碳源。然而初始碳源浓度并非越高越好,过高的浓度虽然在发酵初期可以促进菌体的大量繁殖,但会产生分解代谢物阻遏效应,且在发酵后期会使菌体代谢废物过多,产乙酸等副产物较多,发酵黏度增大,影响产物合成[19]。如图3-a所示,当初始葡萄糖质量浓度在10 g/L时,莽草酸的产量最高,随着葡萄糖浓度的进一步增加,虽然生物量呈上升趋势,但是莽草酸产量显著下降,因此选择最佳初始碳源质量质量浓度为10 g/L。

a-初始葡萄糖浓度;b-酵母粉添加量;c-蛋白胨添加量;d-MgSO4·7H2O添加量;e-(NH4)2SO4添加量;f-K2HPO4添加量
图3 不同培养基因素对莽草酸生产的影响
Fig.3 Effect of different factors in the culture medium on the production of shikimic acid
注:**说明该因素差异极为显著(P<0.01);*说明该因素差异显著(P<0.05)。
2.2.2 有机氮源浓度对莽草酸生产的影响
有机氮源富含氨基酸、维生素等重要的营养物质,对促进菌体生长与产物代谢具有重要的作用。赵现方等[20]测试了蛋白胨、牛肉膏、酵母膏等8种氮源对菌株生产莽草酸能力的影响,发现不同氮源对于莽草酸的生产存在明显差异,其中蛋白胨的积极影响最大[20]。本研究对蛋白胨和酵母粉添加的质量浓度进行测试。在培养基中分别添加0、3、6、10 g/L的酵母粉,如图3-b所示,随着酵母粉的质量浓度增加莽草酸的产量有一定提升,在添加3 g/L酵母粉时,莽草酸的产量达到了1.33 g/L。此后随着酵母粉质量浓度的增加,莽草酸的产量有所下降。发酵培养基中分别添加0、2、6、10 g/L的蛋白胨,对应的菌体生物量和莽草酸产量如图3-c所示,生物量随蛋白胨浓度的升高而升高,而莽草酸产量在2 g/L时达到了最高值,后续随着蛋白胨的浓度升高产量呈下降趋势。可见,蛋白胨和酵母粉的添加虽然有益于莽草酸生产,但添加量并不是越高越好,原因可能是过高的浓度造成菌体生长过剩,培养基中溶氧不足,导致菌株后期产莽草酸能力下降。
2.2.3 MgSO4·7H2O浓度对莽草酸生产的影响
Mg2+作是细胞生命活动必需的金属阳离子,是维持激酶活力的辅助因子,对次级代谢产物的合成也起到了重要作用[21-22]。在培养基中分别添加0、0.1、0.3、0.5、1 mmol/L的MgSO4·7H2O,莽草酸的发酵产量和生物量如图3-d所示,当MgSO4·7H2O浓度为0.1 mmol/L时,莽草酸产量达到最高值1.51 g/L,故选择0.1 mmol/L作为后续实验条件。
2.2.4 (NH4)2SO4浓度对莽草酸生产的影响
(NH4)2SO4是大肠杆菌最易利用的无机氮源之一,其铵根离子可以参与到细胞的一系列生命活动中[23],对于稳定和调节发酵过程中的pH有着重要作用。由图3-e可知,随(NH4)2SO4浓度的增加,莽草酸的产量先上升后下降,在3 g/L时莽草酸产量达到了最大值1.75 g/L,菌株的生物量也随着(NH4)2SO4质量浓度的增加呈上升趋势,在(NH4)2SO4达到6 g/L后,菌株生物量并无明显提高,所以选择3 g/L作为(NH4)2SO4的最佳浓度。
2.2.5 K2HPO4浓度对莽草酸生产的影响
磷酸盐的浓度可以影响大肠杆菌比生长速率,也对糖的代谢和细胞的呼吸产生调节作用[24]。在培养基中分别添加1、3、6、12 g/L的K2HPO4,发酵结果如图3-f所示,随着K2HPO4的浓度增加,莽草酸产量和生物量均呈先上升后下降趋势,当K2HPO4为3 g/L时,莽草酸的产量达到了最高值1.86 g/L,因此选取3 g/L进行后续实验。
2.3 Plackett-Burman实验
在单因素实验的基础上,选择葡萄糖、酵母粉、蛋白胨、pH、MgSO4·7H2O、(NH4)2SO4、K2HPO4这7个因素进行了两水平的PB实验设计,以考察两水平差异,确定因素显著性。实验结果和方差分析结果如表5及表6所示。利用软件Design Expert 12对数据进行回归分析,得到了回归方程如:
表5 Plackett-Burman 实验设计和结果
Table 5 Results of Plackett-Burman experiment

编号ABCDEFGSA产量/(g/L)1-1-11-1-1111.830 472-111-11111.003 8231-111-1-111.704 74411-1-1-11-11.393 81511-11-1111.499 316-11-111-111.879 4871-11111-12.165 428-1-1-1-1-1-1-12.070 049-1-1-1111-12.376 6210111-11-1-11.028 111-1111-1-1-10.856 553121-1-1-11-112.506 91
表6 Plackett Burman 实验结果方差分析
Table 6 Plackett Burman experimental results ANOVA
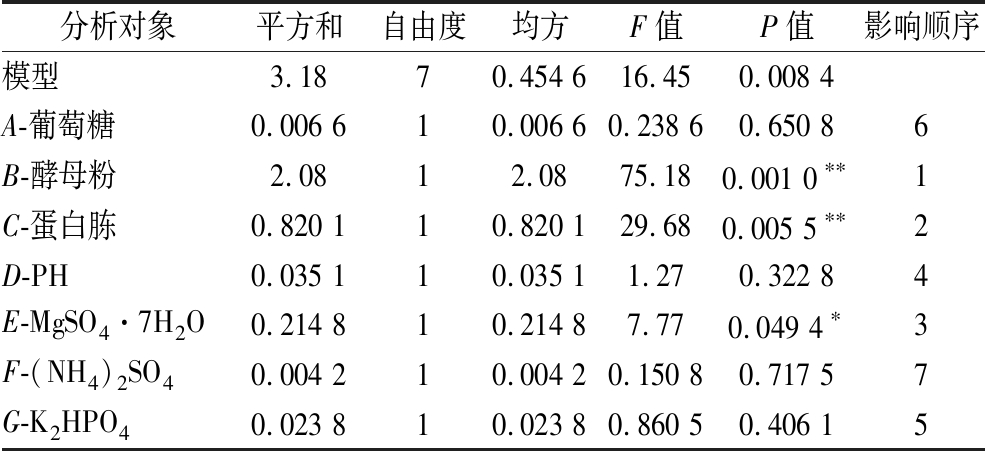
分析对象平方和自由度均方F值P值影响顺序模型3.1870.454 616.450.008 4A-葡萄糖0.006 610.006 60.238 60.650 86B-酵母粉2.0812.0875.180.001 0∗∗1C-蛋白胨0.820 110.820 129.680.005 5∗∗2D-PH0.035 110.035 11.270.322 84E-MgSO4·7H2O0.214 810.214 87.770.049 4∗3F-(NH4)2SO40.004 210.004 20.150 80.717 57G-K2HPO40.023 810.023 80.860 50.406 15
注:**说明该因素差异极为显著(P<0.01);*说明该因素差异显著(P<0.05)。
Y1=2.361 28+0.004 688×A-0.277 395×B-0.261 422×C+0.108 163×D+2.675 74×E+0.012 42×F+0.029 677×G。
该模型中的决定系数R2=0.966 4,即有96.64%试验数据的差异可用该模型解释;P=0.008 4,P<0.01说明该模型极显著。通过方差分析知,蛋白胨、酵母粉、MgSO4·7H2O的浓度3个因素的P<0.05,其中酵母粉和蛋白胨的P<0.01,说明MgSO4·7H2O的浓度对莽草酸产量影响显著,酵母粉和蛋白胨的浓度对莽草酸的产量影响极为显著,故选择这3个因素进行下一步优化实验;而葡萄糖、pH、(NH4)2SO4、K2HPO4在后续实验中选择单因素实验中效果最好的条件。此外,酵母粉和蛋白胨对菌株生产莽草酸呈负效应,MgSO4·7H2O呈正效应,因此在后续优化中设定酵母粉和蛋白胨浓度为负方向,MgSO4·7H2O为正方向。
2.4 Box-Behnken响应面实验
2.4.1 Box-Behnken优化设计结果
在PB实验的基础上,利用Box-Behnken响应面设计对酵母粉、蛋白胨和MgSO4·7H2O的浓度进行进一步优化,实验结果如表7所示。利用Design Expert 12软件对实验数据与响应值进行回归和方差分析,可得二次多元回归方程:
表7 Box-Behnken实验设计和结果
Table 7 Box-Behnken experimental design and results
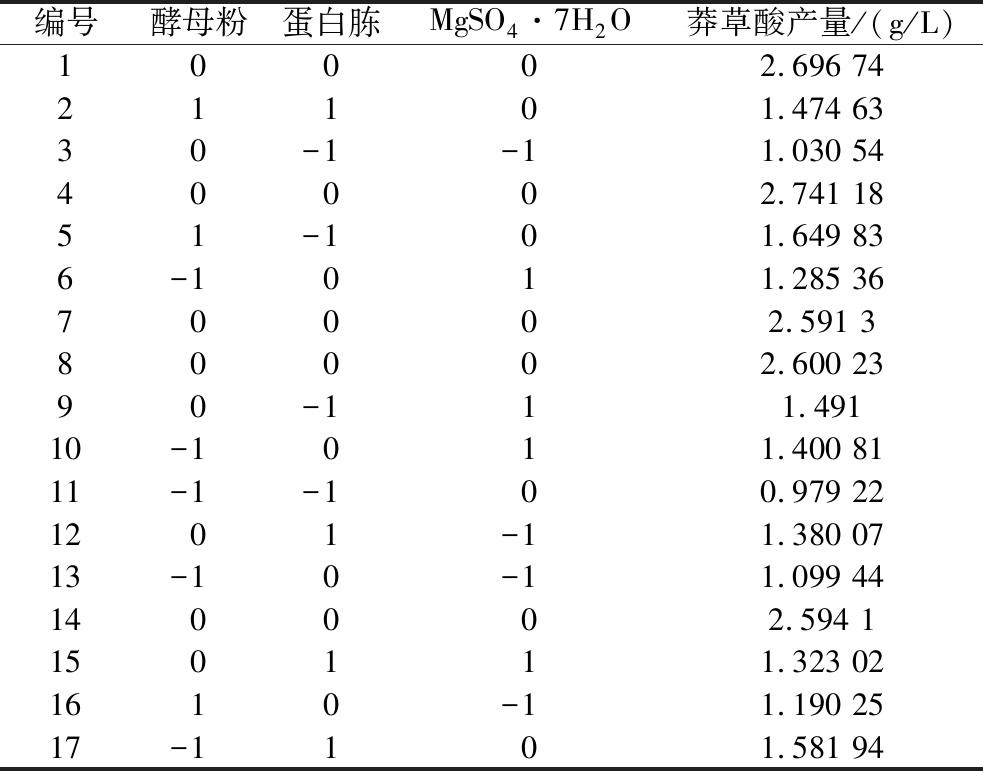
编号酵母粉蛋白胨MgSO4·7H2O莽草酸产量/(g/L)10002.696 7421101.474 6330-1-11.030 5440002.741 1851-101.649 836-1011.285 3670002.591 380002.600 2390-111.49110-1011.400 8111-1-100.979 221201-11.380 0713-10-11.099 44140002.594 1150111.323 021610-11.190 2517-1101.581 94
Y2=-10.722 55+3.238 31×A+8.414 37×B+35.077 84×C-0.388 960×AB+0.061 600×AC-2.587 55×BC-0.642 749×A2-2.322 23×B2-75.799 62×C2。式中:Y2为莽草酸产量(g/L);A为酵母粉(g/L);B为蛋白胨(g/L);C为MgSO4·7H2O(mmol/L)。
根据模型方差分析结果(表8),模型决定系数R2=0.993 6,校正系数![]() 表明该预测有99.36%的数据可以由该模型解释,剔除自变量个数对R2的影响后系数为0.985 3,该模型拟合度良好。模型概率值P<0.000 1,失拟项P=0.319 6>0.05,说明回归模型极显著,可以用于预测莽草酸的最大产量。交互项AB的P值0.001 6,交互项BC的P值为0.013,均小于0.05,显著。交互项AC的P值为0.879 4,不显著。
表明该预测有99.36%的数据可以由该模型解释,剔除自变量个数对R2的影响后系数为0.985 3,该模型拟合度良好。模型概率值P<0.000 1,失拟项P=0.319 6>0.05,说明回归模型极显著,可以用于预测莽草酸的最大产量。交互项AB的P值0.001 6,交互项BC的P值为0.013,均小于0.05,显著。交互项AC的P值为0.879 4,不显著。
表8 Box-Behnken实验方差分析
Table 8 Box-Behnken experimental analysis of variance
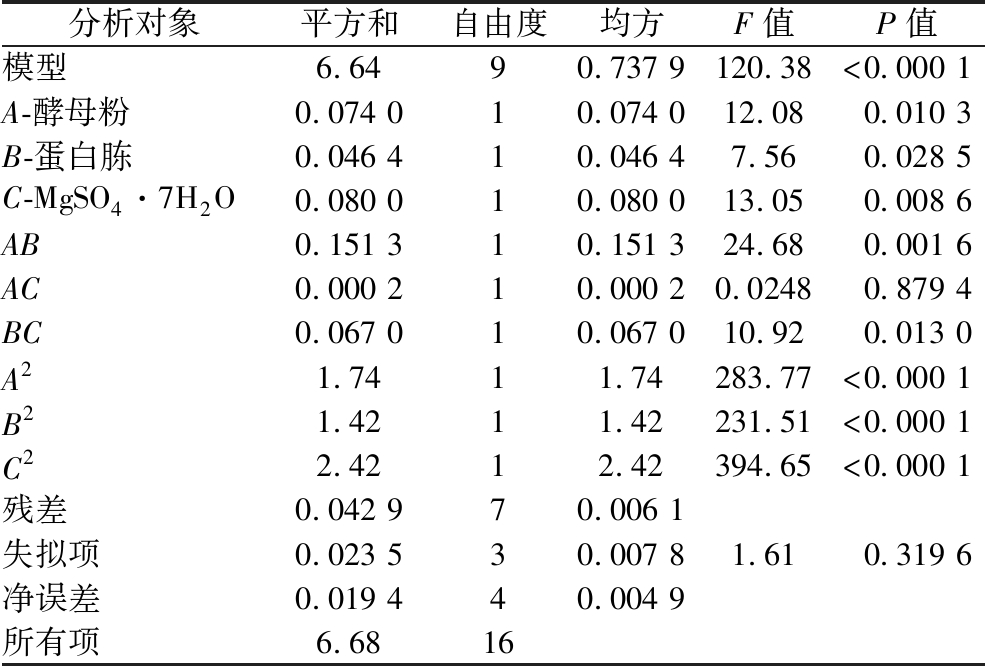
分析对象平方和自由度均方F值P值模型6.6490.737 9120.38<0.000 1A-酵母粉0.074 010.074 012.080.010 3B-蛋白胨0.046 410.046 47.560.028 5C-MgSO4·7H2O0.080 010.080 013.050.008 6AB0.151 310.151 324.680.001 6AC0.000 210.000 20.02480.879 4BC0.067 010.067 010.920.013 0A21.7411.74283.77<0.000 1B21.4211.42231.51<0.000 1C22.4212.42394.65<0.000 1残差0.042 970.006 1失拟项0.023 530.007 81.610.319 6净误差0.019 440.004 9所有项6.6816
2.4.2 回归模型的优化
交互项AC(P>0.05)对莽草酸产量影响不显著,故采用手动优化的方法去除交互项AC,优化后的莽草酸产量的二阶多项式方程:
Y3=-10.722 55+3.238 31×A+8.414 37×B+35.077 84×C-0.388 960×AB-2.587 55×BC-0.642 749×A2-2.322 23×B2-75.799 62×C2。
优化后的结果如表9所示,失拟项不显著(P=0.426 2>0.05),模型的P<0.001,表明模型高度显著。除此之外,模型决定系数R2=0.993 6,表明预测有99.36%的数据模型可以解释,校正系数![]() 表明该模型拟合度较高,实验误差小,综上所述,该模型适合代替真实点对实验结果进行预测分析。
表明该模型拟合度较高,实验误差小,综上所述,该模型适合代替真实点对实验结果进行预测分析。
表9 去掉交互项AC后的优化结果
Table 9 Optimization results after removing the interaction term AC
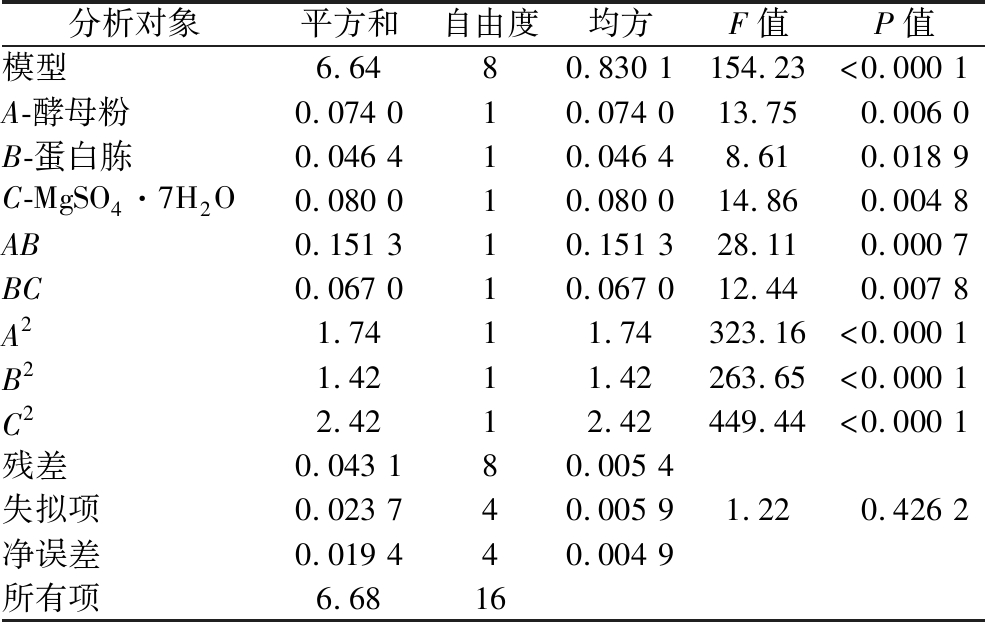
分析对象平方和自由度均方F值P值模型6.6480.830 1154.23<0.000 1A-酵母粉0.074 010.074 013.750.006 0B-蛋白胨0.046 410.046 48.610.018 9C-MgSO4·7H2O0.080 010.080 014.860.004 8AB0.151 310.151 328.110.000 7BC0.067 010.067 012.440.007 8A21.7411.74323.16<0.000 1B21.4211.42263.65<0.000 1C22.4212.42449.44<0.000 1残差0.043 180.005 4失拟项0.023 740.005 91.220.426 2净误差0.019 440.004 9所有项6.6816
根据显著性检验结果,酵母粉、蛋白胨和MgSO4·7H2O三因素对响应值都有显著影响,其影响程度为:MgSO4·7H2O>酵母粉>蛋白胨。交互项酵母粉与蛋白胨、蛋白胨与MgSO4·7H2O对响应值也具有显著影响。利用Design Expert 12对回归方程中的交互项绘制响应面分析图如图4所示,图4-a为在MgSO4·7H2O浓度为0.20 mmol/L的条件下,酵母粉和蛋白胨添加量的交互影响图,可见响应面曲面斜度较为陡斜,等高线偏椭圆形,说明交互作用显著。类似地由图4-b可知,在酵母粉质量浓度为2.06 g/L的条件下,响应面曲面呈钟罩型,等高线图呈规则的椭圆形,表明蛋白胨和MgSO4·7H2O的交互作用显著。综上所述,响应面最高点在模型设计范围内,说明此响应面选取的范围是合适的,可以用于后续分析。根据回归方程可预测出最佳理论条件,酵母粉、蛋白胨和MgSO4·7H2O分别为2.06 g/L、1.52 g/L和0.20 mmol/L时存在莽草酸最大产量为2.65 g/L。

a-酵母粉和蛋白胨添加量的交互影响;b-蛋白胨和MgSO4·7H2O添加量的交互影响
图4 各因素交互作用对大肠杆菌生产莽草酸的影响
Fig.4 Effects of the factors on shikimic ferentation in E.coli
2.4.3 最优条件的预测及验证
根据Design Expert 12软件得出的回归方程,莽草酸的发酵培养基最佳发酵条件为:2.06 g/L酵母粉、1.52 g/L蛋白胨、0.20 mmol/L MgSO4·7H2O(其他条件为初始葡萄糖10 g/L,K2HPO4 3 g/L,KH2PO4 3.5 g/L,(NH4)2SO4 3 g/L,磷酸甜菜碱 0.22 g/L,CaCl2·2H2O 15 mg/L,维生素B1 0.5 mg/L,微量元素混合液1 mL/L,pH 7.0~7.2)。在此条件下重复验证实验,莽草酸的产量达到了2.66 g/L,与理论值2.65 g/L基本一致,证明该模型能够较好地预测工程菌发酵生产莽草酸的产量。
3 结论
本研究对野生型大肠杆菌W3110进行代谢工程改造,采取减少产物消耗、强化产物合成通路代谢流、提高前体物供给等策略,通过敲除aroL并适当过表达基因aroGfbr、tktA、ppsA、aroE,构建了一株生产莽草酸的工程菌。基于NBS培养基,通过单因素实验和Plackett-Burman实验,筛选出酵母粉、蛋白胨和MgSO4·7H2O 3个因素对莽草酸产量影响最为显著;利用响应面分析法得出最佳培养基配方,并验证最优条件下莽草酸产量达到2.66 g/L,比优化前的1.33 g/L提高了1倍。本研究显著提高了莽草酸在摇瓶规模的生物合成效率,为大肠杆菌发酵生产莽草酸的进一步研究和工业化生产提供参考。
[1] PHD M B, HELENA ROTSZTEJN MD P.Shikimic acid in the light of current knowledge[J].Journal of Cosmetic Dermatology, 2022, 21(2):501-505.
[2] 吴凤礼, 王晓霜, 宋富强, 等.芳香族化合物微生物代谢工程研究进展[J].生物工程学报, 2021, 37(5):1771-1793.
WU F L, WANG X S, SONG F Q, et al.Advances in metabolic engineering for the production of aromatic chemicals[J].Chinese Journal of Biotechnology, 2021, 37(5):1771-1793.
[3] 吴凤礼, 彭彦峰, 徐毅诚, 等.代谢工程改造微生物生产芳香族化合物的研究进展[J].生物加工过程, 2017, 15(5):9-23.
WU F L,PENG Y F,XU Y C, et al.Advances in microbial metabolic engineering for producing aromatic chemicals [J].Chinese Journal of Bioprocess Engineering, 2017, 15(5):9-23.
[4] CHANDRAN S S, YI J, DRATHS K M, et al.Phosphoenolpyruvate availability and the biosynthesis of shikimic acid[J].Biotechnology Progress, 2003, 19:808-814.
[5] LEE H N, SEO S Y, KIM H J, et al.Artificial cell factory design for shikimate production in Escherichia coli[J].Journal of Industrial Microbiology &Biotechnology, 2021, 48(9-10):kuab043.
[6] LI Z D, GAO C, YE C, et al.Systems engineering of Escherichia coli for high-level shikimate production[J].Metabolic Engineering, 2023, 75:1-11.
[7] 孙晓宇, 韩丽萍, 沈卫荣, 等.莽草酸产生菌的筛选及发酵条件初步优化[J].陕西农业科学, 2010, 56(5):33-35.
SUN X Y, HAN L P, SHEN W R, et al.Screening of shikimic acid producing bacteria and preliminary optimisation of fermentation conditions[J].Shaanxi Journal of Agricultural Sciences, 2010, 56(5):33-35.
[8] 仲楠. 产莽草酸基因工程菌的构建及发酵研究[D].北京:北京化工大学, 2012.
ZHONG N.Construction of high-yielding E.coli strain for shikimic acid production and research in fermentation[D].Beijing:Beijing University of Chemical Technology, 2012
[9] 韩洪军, 张顺棠, 高立栋, 等.大肠杆菌生产莽草酸发酵培养基优化[J].发酵科技通讯, 2018, 47(1):33-37.
HANG H J, ZHANG S T, GAO L D, et al.Medium optimization for production of shikimate by Escherichia coli[J].Bulletin of Fermentation Science and Technology, 2018, 47(1):33-37.
[10] 蔡灵芝. 莽草酸基因工程菌构建与发酵工艺研究[D].天津:天津科技大学, 2015.
CAI L Z.Research on the construction and fermentation process of shikimic acid genetically engineered bacteria[D].Tianjin:Tianjin University of Science and Technology, 2015.
[11] 侯建屾, 高聪, 陈修来, 等.使用动态分子开关调控大肠杆菌生产莽草酸[J].生物工程学报, 2020, 36(10):2104-2112.
HOU J S, GAO C, CHEN X L, et al.Using dynamic molecular switches for shikimic acid production in Escherchia coli[J].Chinese Journal of Biotechnology, 2020, 36(10):2104-2112.
[12] 李一凡. 多元质粒工程技术及CRISPR-Cas9介导的基因组编辑技术的建立与应用[D].天津:天津大学, 2015.
LI Y F.Establishment and application of multiplex iterative plasmid engineering technology mediated genome editing technoogy mediated by CRISPR-Cas9[D].Tianjin:Tianjin University, 2015.
[13] LI Y F, LIN Z Q, HUANG C, et al.Metabolic engineering of Escherichia coli using CRISPR-Cas9 meditated genome editing[J].Metabolic Engineering, 2015, 31:13-21.
[14] JOHANSSON L, LINDSKOG A, SILFVERSPARRE G, et al.Shikimic acid production by a modified strain of E.coli (W3110.shik1) under phosphate-limited and carbon-limited conditions[J].Biotechnology and Bioengineering, 2005, 92(5):541-552.
[15] LØBNER-OLESEN A, MARINUS M G.Identification of the gene (aroK) encoding shikimic acid kinase I of Escherichia coli[J].Journal of Bacteriology, 1992, 174(2):525-529.
[16] DELEO A B, SPRINSON D B.Mechanism of 3-deoxy-D-arabino-heptulosonate 7-phosphate (DAHP) synthetase[J].Biochemical and Biophysical Research Communications, 1968, 32(5):873-877.
[17] DAVIS J H, RUBIN A J, SAUER R T.Design, construction and characterization of a set of insulated bacterial promoters[J].Nucleic Acids Research, 2011, 39(3):1131-1141.
[18] WU S J, CHEN W J, LU S J, et al.Metabolic engineering of shikimic acid biosynthesis pathway for the production of shikimic acid and its branched products in microorganisms:Advances and prospects[J].Molecules, 2022, 27(15):4779.
[19] 李民, 陈常庆.重组大肠杆菌高密度发酵研究进展[J].生物工程进展, 2000, 20(2):26-31.
LI M, CHEN C Q.Progress studies of high cell-density culture of recombinant Escherchia coli[J].China Biotechnology, 2000, 20(2):26-31.
[20] 赵现方, 王艳婕, 武忠伟, 等.莽草酸发酵培养基的最佳碳氮源筛选[J].河南科技学院学报(自然科学版), 2011, 39(6):16-18.
ZHAO X F, WANG Y J, WU Z W, et al.Screening of the optimal carbon and nitrogen source of the medium for shikimic acid fermentation[J].Journal of Henan Institute of Science and Technology (Natural Sciences Edition), 2011, 39(6):16-18.
[21] 隋雪. 大肠杆菌中戊二酸的生物合成及其发酵优化[D].无锡:江南大学, 2020.
SUI X.Biosynthesis of glutaric acid in E.coli and its fermentation optimization[D].Wuxi:Jiangnan University, 2020.
[22] 朱文龙. 甘露糖-6-磷酸的合成工艺研究[D].北京:北京化工大学, 2021.
ZHU W L.Study on synthesis technology of mannsoe-6-phosphate[D].Beijing:Beijing University of Chemical Technology, 2021.
[23] 郭谦. 代谢工程改造大肠杆菌生产L-蛋氨酸[D].无锡:江南大学, 2015.
GUO Q.Metabolic engineering transformation of Escherichia coli to produce L-methionine[D].Wuxi:Jiangnan University, 2015.
[24] 孙家凯, 吴晓娇, 王晶, 等.磷酸盐对大肠杆菌发酵异亮氨酸的影响[J].食品与发酵工业, 2012, 38(1):20-24.
SUN J K, WU X J, WANG J, et al.Effect of phosphate on the process of Escherichia coli L-isoleucine fermentation[J].Food and Fermentation Industries, 2012, 38(1):20-24.