我国经济淡水鱼资源丰富,其中建鲤(Cyprinus carpio Jian)作为公认的水产良种,约占我国鲤鱼养殖总产量的50%[1],且肉质好肉味鲜美。以建鲤加工冷藏鱼片具有广阔的市场前景。鱼肉片在冷藏期间易发生软化导致质构品质劣变,商品价值降低。
鱼类死后肉质软化、品质下降通常认为与其内源蛋白酶,尤其是组织蛋白酶具有直接的关联。组织蛋白酶(cathepsins,CTS)是一种存在于溶酶体中的热稳定性内源蛋白酶。有研究报道CTS B、L及L-like是鱼类死后肌肉中最活跃的溶酶体蛋白酶,是破坏肌细胞结构蛋白完整性、导致鱼肉片软化的关键蛋白酶[2]。另一方面,越来越多的研究表明动物宰后骨骼肌细胞发生的细胞凋亡在宰后肉质的形成具有重要的潜在关联[3-4]。细胞凋亡是程序性细胞死亡过程,动物宰后缺血缺氧状态启动凋亡。凋亡率越高,鱼肉的质构等品质下降越严重[5-6]。而近年的研究也发现组织蛋白酶不仅可以活化促凋亡因子或降解抗凋亡蛋白[7],还可以直接激活凋亡效应酶[8],参与多条细胞凋亡途径[9]。尽管CTS B水解肌原纤维的活性明显弱于CTS L[10],但其在细胞凋亡中却发挥了重要作用[11]。
同时,鱼宰杀后机体细胞进入非正常生命活动轨迹,有氧代谢受阻,缺血、缺氧、ATP耗尽等状态导致活性氧(reactive oxygen species,ROS)过量积累。ROS不仅可以直接攻击骨架蛋白,还可以通过脂质过氧化和非酶羰基化的产物导致蛋白质的氧化,从而影响鱼肉蛋白完整性[12]。鱼肉蛋白氧化变性程度越高,鱼肉质构品质越差[13],同时ROS还能够破坏溶酶体膜稳态[14],造成内源组织蛋白酶的释放。而组织蛋白酶的释放又将进一步促进ROS的产生[15]。研究发现CTS B活性与细胞ROS水平呈现相同的变化趋势[16];而且溶酶体CTS B、CTS L协同参与了鱼体死后肌肉细胞内的氧化等过程,与低温贮藏期间肌肉蛋白的氧化变性以及聚合等存在一定的相关性[17]。
然而ROS过量积累将破坏胞内稳态,能够诱导启动并调控细胞凋亡[18],且ROS氧化对组织蛋白酶活性具有调节作用[19],目前就二者与细胞凋亡以及畜禽宰后肉品质形成的关系进行了初步探索[20]。而组织蛋白酶与鱼肉片冷藏期间ROS氧化、肌肉细胞凋亡的潜在联系及其对鱼肉片品质形成的影响,鲜有报道。
本团队在前期对建鲤重组CTS B及其活性特征进行相关研究的基础上[21],首先以真核重组建鲤CTS B注射处理建鲤鱼肉片,监测了冷藏期间鱼肉ROS生成、蛋白氧化、鱼肉肌细胞凋亡情况及鱼肉品质的变化过程,通过与对照组的比较分析,探讨了CTS B活性与其之间可能的潜在关系。该探索性研究为进一步深入地从内源组织蛋白酶与氧化及诱导凋亡的角度阐释鱼肉片冷藏品质劣变的机理,提供实验基础。
1 材料与方法
1.1 材料与试剂
鲜活建鲤:(1 000±150) g/尾,购于雅安鑫禧水产市场,击晕后,30 min内用冰袋贮存至实验室。
真核重组CTS B:由四川农业大学食品学院水产加工实验室构建的重组工程菌株GS115-pPIC9K-cts b诱导表达,并纯化测活,纯度>95%,活性为2.57 U/mg。
Z-Arg-Arg-MCA,日本Peptide Research Institute公司;活性氧检测试剂盒,北京索莱宝科技有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)(分析纯),Sigma-Aldrich西格玛奥德里奇(上海)贸易有限公司;TUNEL细胞凋亡检测试剂盒(显色法),上海碧云天科技有限公司。
1.2 仪器与设备
Lumina荧光分光光度计、Varioskan las全波长酶标仪,美国Thermo公司;759S紫外可见分光光度计,上海棱光仪器有限公司;RM2135石蜡切片机,德国Leica;TA.XTPlus物性分析仪,英国Stable Microsystem公司。
1.3 实验方法
1.3.1 CTS B注射处理冷藏建鲤肉片
建鲤鱼肉片的加工及处理:新鲜宰杀(1 000±150) g的建鲤→前处理(去头尾、内脏、鳞片)→去皮→洗净→取背肌剖片、整形8 cm×6 cm×2 cm的规格(约为100 g)→注射处理→置于无菌聚丙烯材料食品保鲜盒→低密度聚乙烯食品保鲜膜封口→4 ℃冷藏5 d。每个实验组3个重复,分别在0、1、2、3、4、5 d同一时间点取样测定相应指标。
实验组中,按照每1 g鱼肉1.5 U的用量,将无菌水复溶并微滤除菌后的CTS B溶液用针尖外径为0.5 mm的无菌注射器按照2 cm等间距呈矩阵状(6个点)均匀缓慢注射于建鲤鱼肉片,注射深度为1 cm,注射体积控制在鱼肉质量的2%内,注射后轻轻揉动促进吸收。对照组则按照相同用量比例和方式均匀注射等量的无菌水。
1.3.2 建鲤肉片冷藏期间中CTS B的提取及活性测定
分别在各取样点取实验组与对照组建鲤肉冷藏,加入4倍体积的25 mmol/L乙酸钠缓冲液[含5 mmol/L半胱氨酸、0.3 mmol/L 苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF),pH 5.0],10 000×g均质30 s,4 ℃下12 000×g下离心20 min。上清液用4层纱布过滤,用于CTS B活性测定。即以荧光合成肽N-苄氧羰基-精氨酸-精氨酸-7-氨基-4-甲基香豆素(N-benzyloxycarbonyl-arginine-arginine-7-amido-4-methylcoumarin,Z-Arg-Arg-AMC)为底物,用荧光酶标仪于激发波长380 nm,发射波长460 nm下测定荧光强度。一个酶活单位定义为在反应条件(40 ℃,pH 6.8)下1 min内水解底物并释放出1 nmol 7-氨基-4-甲基香豆素(7-amino-4-methylcoumarin,AMC)产物的酶活性量(1 nmol AMC/min)。
1.3.3 CTS B对冷藏期间建鲤鱼片ROS相对含量的影响
在各取样点取实验组与对照组建鲤肉样,分别加入6倍体积的提取缓冲液(含0.1 mmol/L EDTA、0.8% NaCl、0.1 mmol/L蔗糖的15 mmol/L Tris-HCl,pH 7.4)匀浆(1 min,8 000×g),然后4 ℃,3 000×g离心15 min,取上清液用双缩脲法测定蛋白浓度。取100 μL上清液与试剂盒中100 μL反应缓冲液(即含10 μmol/L 2,7-二氯荧光素二乙酸酯(2,7-dichlorofluorescein diacetate,DCFH-DA)的提取缓冲液,pH 7.4)混合均匀,于37 ℃避光孵育30 min前后各测定一次荧光值,激发波长488 nm,发射波长525 nm。按照公式(1)计算ROS的相对含量:
ROS的相对含量![]()
(1)
式中:M1,孵育后荧光值;M2,孵育前荧光值;t,孵育时间;c,蛋白浓度。
1.3.4 CTS B对冷藏期间建鲤鱼片蛋白羰基含量的影响
根据OLIVER等[22]方法测定羰基含量,首先提取实验组与对照组各取样点的建鲤肌原纤维蛋白,并通过双缩脲法测蛋白浓度。然后,采用肌原纤维蛋白溶液与10 mmol/L DNPH溶液等体积混合并暗室下反应1 h(对照管则与等体积的2 mol/L HCl溶液混合)的方法370 nm处进行吸光值的测定,并根据公式(2)计算羰基含量:
羰基含量![]()
(2)
1.3.5 CTS B对冷藏期间建鲤鱼肉细胞凋亡的影响
取冷藏0~3 d的实验组与对照组建鲤鱼肉样,按照谭小千[23]的方法进行石蜡包埋及组织切片的制作和处理,并采用TUNEL试剂盒显色法进行细胞凋亡的检测。每组每个时间点选择至少5个视野拍照,通过image pro plus 6.0软件,检测计数TUNEL阳性点作为凋亡的细胞核数。利用凋亡细胞核数与总细胞核数之比指示凋亡率。
1.3.6 CTS B对冷藏期间建鲤鱼肉剪切力的影响
在各取样点取实验组和对照组的建鲤鱼肉切成5 cm×5 cm×5 cm的肉块,采用A/CKB型探头,垂直于肌肉纤维方向进行测试,探头下降速度为2 mm/s,触发力5 g;重复5次,取平均值。
1.3.7 CTS B对冷藏期间建鲤鱼肉持水力的影响
取实验组与对照组各取样点的建鲤鱼肉,统一切成(5±0.5) g,记录克重(m1),用双层滤纸包裹建鲤鱼肉块,置于离心管中,于4 ℃、5 000×g离心10 min,离心结束后记录克重(m2),根据公式(3)计算鱼肉汁液流失率:
汁液流失率![]()
(3)
1.4 数据处理与统计分析
实验数据运用Excel 2021整理;采用IBM SPSS Statistics 20进行统计分析;Origin 2024作图。每个实验3组平行,结果采用平均值±标准差表示。*P<0.05表示差异呈显著性。
2 结果与分析
2.1 建鲤肉片冷藏期间CTS B活性变化
在0~5 d的冷藏期间,实验组及对照组建鲤鱼肉CTS B活性均逐渐增强(图1),在冷藏前期增加缓慢,3 d后呈现快速上升的趋势,说明在此期间,鱼肌肉细胞溶酶体膜稳定性下降,逐渐释放或渗漏出更多的组织蛋白酶,该现象与其他相关研究报道[24]的结果一致。实验组注射的CTS B于4 ℃下在鱼肉组织内稳定并持续保持了活性,因此该组CTS B活性在冷藏期内一直显著高于对照组(P<0.05);同时发现实验组CTS B活性升高速度也明显快于对照组。CTS B可通过多种方式参与细胞的凋亡,而实验组中CTS B活性高及升高速度快,可能会促进该组鱼肉的肌细胞凋亡。
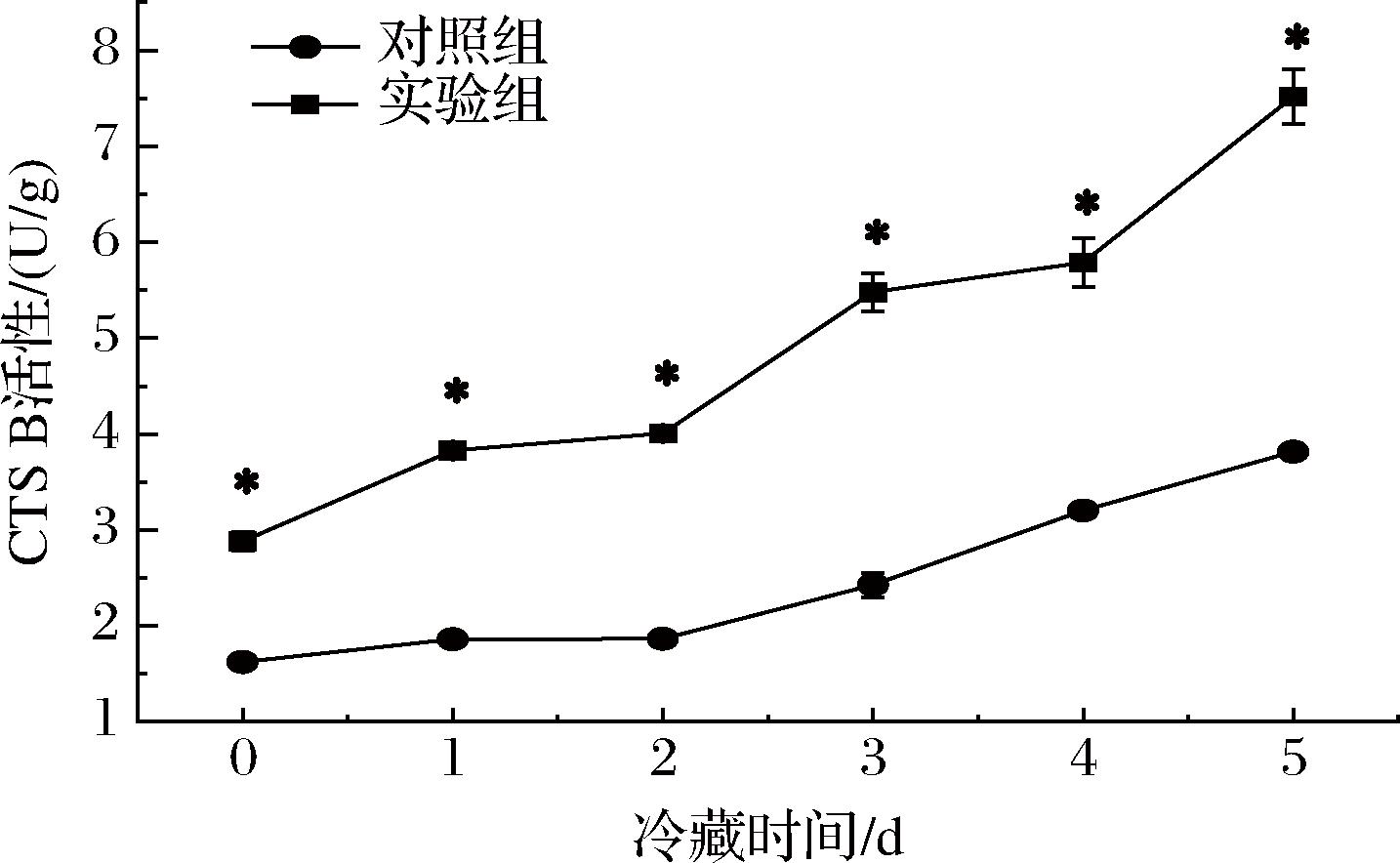
图1 建鲤肉片冷藏期内CTS B酶活性的变化
Fig.1 Changes in CTS B activity of Jian carp fillet during refrigeration storage
注:*表示差异显著(P<0.05)(下同)。
2.2 CTS B对冷藏期间建鲤鱼肉ROS相对含量的影响
如图2所示,ROS在冷藏期间一直呈上升趋势,该趋势与CTS B活性变化整体保持一致。在冷藏草鱼[5]、冷藏白斑狗鱼[25]的研究中也观察到ROS相对含量与CTS B活性呈现同步升高的变化趋势。相对于对照组,额外注射建鲤CTS B促进了冷藏建鲤鱼肉中ROS的产生并积累,加重了氧化;这与当CTS B活性被抑制时ROS产生量同时减少现象是类似的[5]。进一步分析发现,与CTS B冷藏初期变化平缓不同的是,在冷藏第1天时,实验组与对照组建鲤鱼肉片的ROS相对含量均开始表现出明显的升高,而CTS B是在3 d时明显升高。而![]() 等[26]指出ROS的积累能促使溶酶体膜的通透性增加,从而促使组织蛋白酶的释放;而组织蛋白酶的释放又将进一步促进ROS的产生[15]。因此,这一方面解释了实验组CTS B活性升高速度快的可能原因,同时也提示建鲤内源CTS B的活性量与其ROS的产生量之间存在某种潜在关联性。
等[26]指出ROS的积累能促使溶酶体膜的通透性增加,从而促使组织蛋白酶的释放;而组织蛋白酶的释放又将进一步促进ROS的产生[15]。因此,这一方面解释了实验组CTS B活性升高速度快的可能原因,同时也提示建鲤内源CTS B的活性量与其ROS的产生量之间存在某种潜在关联性。
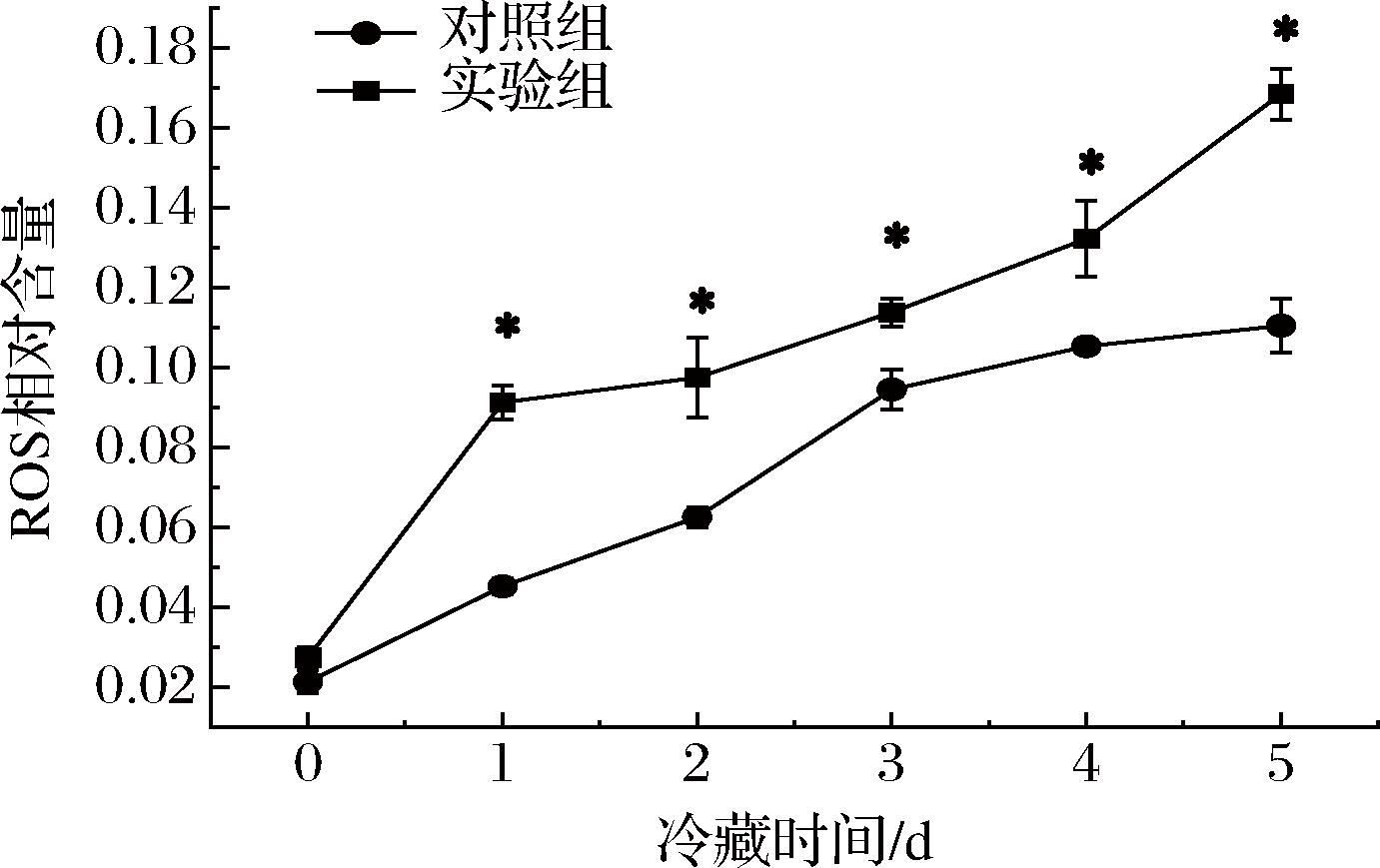
图2 建鲤肉片冷藏期内ROS相对含量的变化
Fig.2 Changes in relative ROS content of Jian carp fillet during refrigeration storage
2.3 CTS B对冷藏期间建鲤鱼片蛋白羰基含量的影响
多种形式的ROS攻击胞内蛋白产生羰基化合物,因此羰基化合物是蛋白质氧化的重要生物标记物之一。如图3所示,随着建鲤鱼肉片冷藏时间的延长,实验组和对照组建鲤鱼肉蛋白的羰基含量总体呈上升趋势,说明即使在低温贮藏下,肌原纤维蛋白的某些氨基酸残基仍然受到自由基的攻击,形成了羰基[27],鱼肉蛋白的氧化损伤在冷藏期间将愈加严重;而注射CTS B促使蛋白氧化加剧,实验组呈现了更高的碳基值。通常认为,酶解作用后的肌原纤维蛋白,由于氨基酸残基等化学和物理识别位点暴露等原因,更容易受到ROS的强氧化作用[28],从而导致更明显的蛋白质变性;此外,该结果还与ROS相对含量及CTS B在冷藏期间逐渐升高的整体趋势基本保持一致,这提示实验组羰基值的快速升高、蛋白氧化的加剧还可能与CTS B及ROS之间的协同作用有直接关系。HE等[29]的研究中也发现利用cathepsins抑制剂能显著改善鱼肉蛋白质的氧化,降低羰基含量。氧化变性的肌原纤维蛋白由于蛋白质分子结构松散,更容易被蛋白酶作用而发生水解[30],同时变性的鱼肉蛋白与腥味物质结合更加紧密[31],可见氧化对鱼肉的品质产生极大的负面影响。
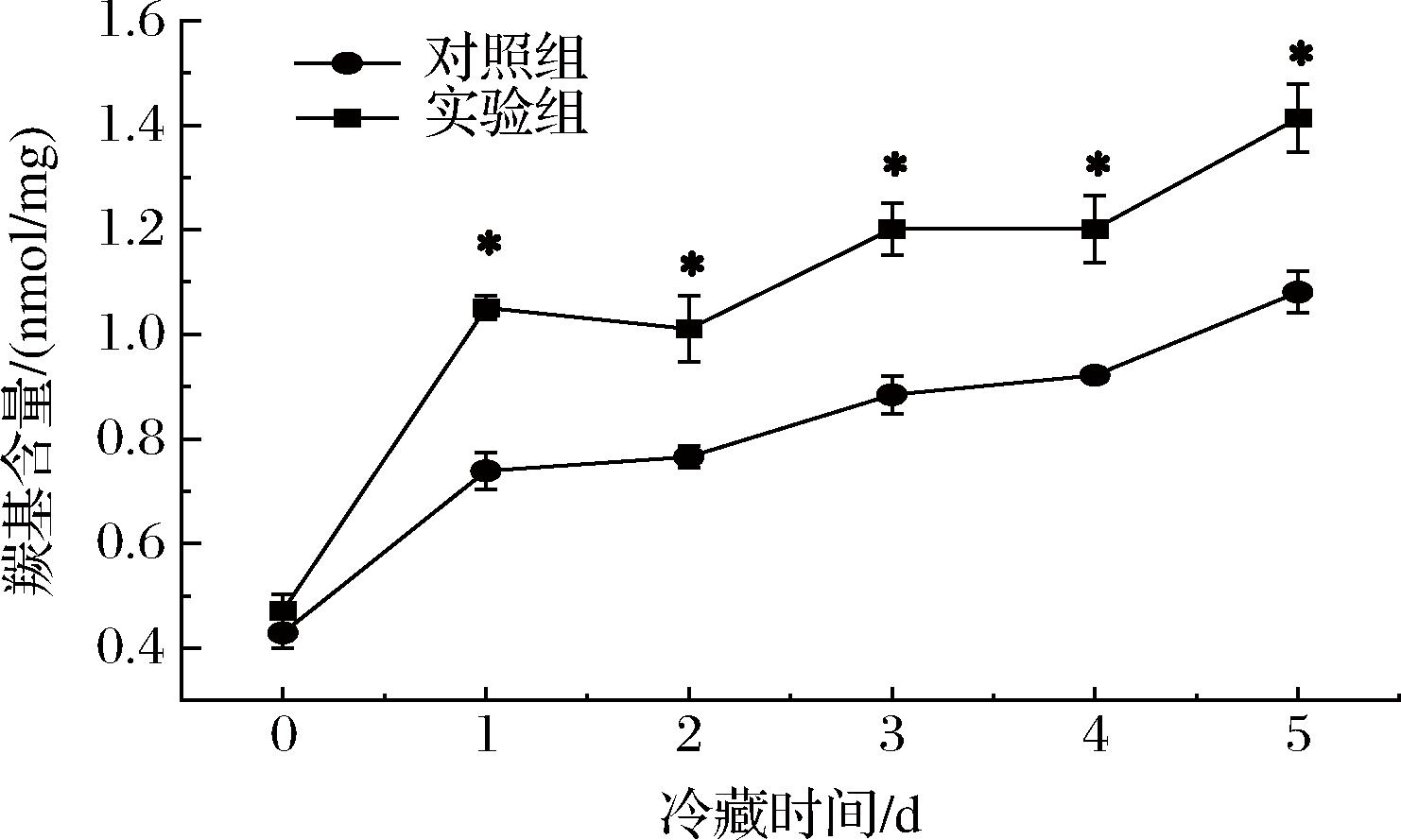
图3 建鲤肉片冷藏期内羰基含量的变化
Fig.3 Changes in carbonyl value of Jian carp fillet during refrigeration storage
2.4 CTS B对冷藏期间建鲤鱼肉肌细胞凋亡的影响
由图4可知,在冷藏期间,对照组和实验组建鲤鱼肉肌细胞都不同程度发生了中晚期的凋亡,阳性凋亡细胞的细胞核染色后呈棕黄色或棕褐色着染,而未发生凋亡的细胞其细胞核被苏木素复染成蓝色。由表1可知,鱼肉在4 ℃冷藏期间,2组建鲤鱼肉片的肌肉细胞凋亡率持续上升,在前2~3 d内升高极其迅速,且实验组显著高于对照,此期间绝大部分细胞都已经发生了凋亡,细胞边缘不及1 d时平滑整齐,细胞膜出现皱缩;在贮藏的第5天,二者凋亡率差异不显著,且细胞均出现了肌纤维溶解、断裂和缺失等明显坏死的表现。冷藏第1天时,建鲤鱼肉片肌肉细胞已经发生明显的凋亡,有报道[4]表明罗非鱼宰后在20 ℃贮藏时,肌肉细胞凋亡在20 h内开始发生;尤其实验组1 d时的凋亡率升高更加迅速,这与该组CTS B活性高,且ROS在1 d时升高迅速的趋势相符;此外,冷藏在3 d时伴随CTS B活性和ROS的同步快速升高,肌肉细胞凋亡率显著高于前2 d,实验组更是在3 d时达到90%以上的凋亡。上述结果可见CTS B促进了冷藏初期鱼肉肌细胞的凋亡。有研究证明向冷藏草鱼肉注射细胞凋亡酶抑制剂后,肌肉细胞凋亡被抑制的同时,CTS B的酶活性及ROS水平都被不同程度地抑制[5]。综上,提示CTS B活性量与死后ROS相对生成量和鱼宰后冷藏初期细胞凋亡之间存在内在关联。
表1 建鲤鱼肉片在冷藏过程中细胞凋亡结果
Table 1 The cell apoptosis of Jian carp fillet during refrigeration storage
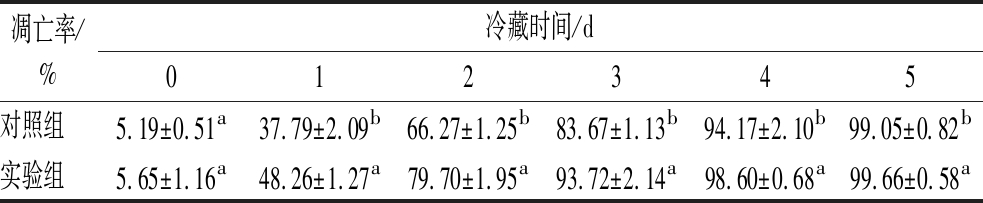
凋亡率/%冷藏时间/d012345对照组5.19±0.51a37.79±2.09b66.27±1.25b83.67±1.13b94.17±2.10b99.05±0.82b实验组5.65±1.16a48.26±1.27a79.70±1.95a93.72±2.14a98.60±0.68a99.66±0.58a
注:对照组、实验组之间不同小写字母表示样品间具有显著性差异(P<0.05)。
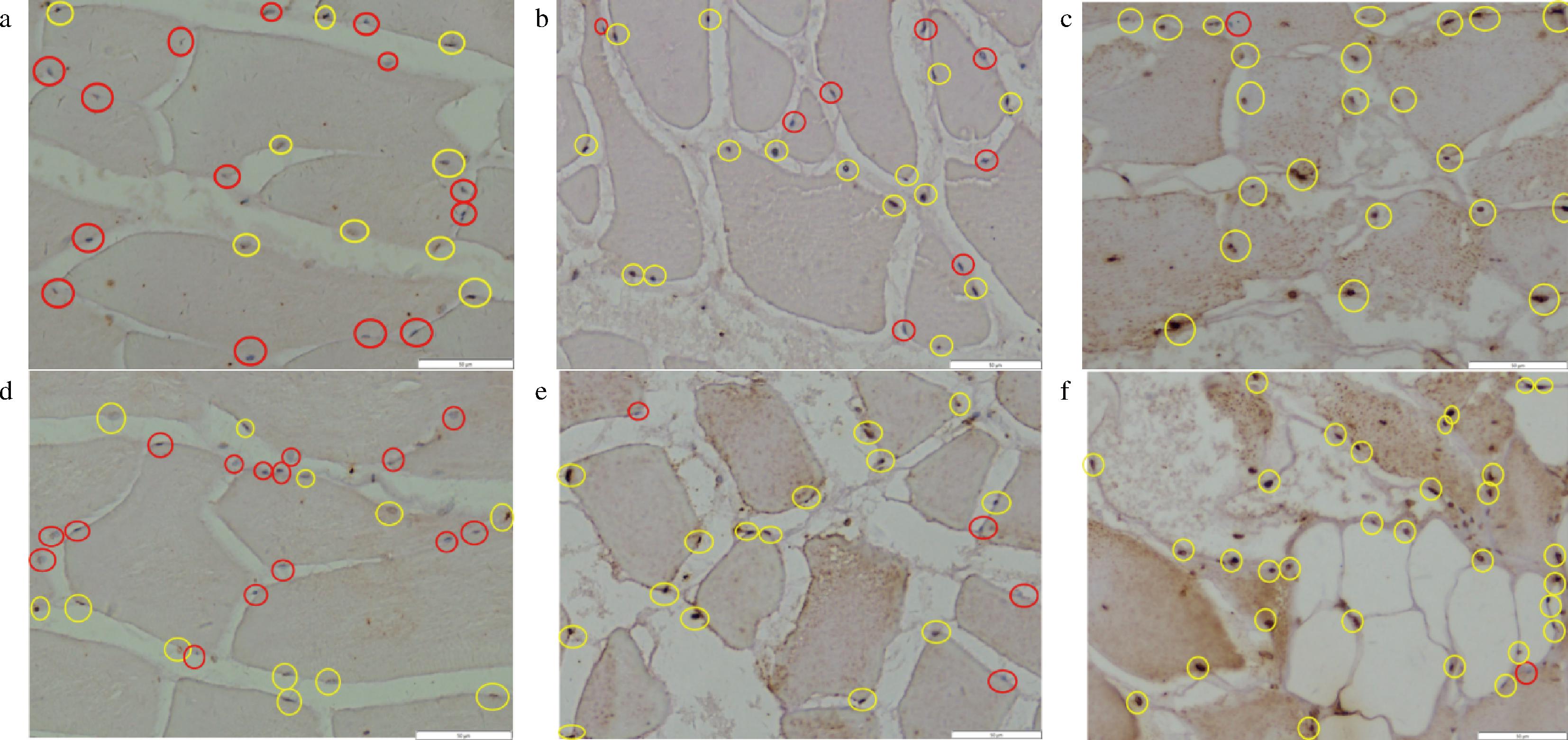
a-对照组贮藏1 d细胞凋亡情况;b-对照组贮藏2 d细胞凋亡情况;c-对照组贮藏5 d细胞凋亡情况;d-实验组贮藏1 d细胞凋亡情况;e-实验组贮藏2 d细胞凋亡情况;f-实验组贮藏5 d细胞凋亡情况
图4 建鲤肉片的冷藏期内细胞凋亡TUNEL染色
Fig.4 TUNEL staining of cell apoptosis of Jian carp fillet during refrigeration storage
注:黄色圈指示凋亡细胞、红色指示未凋亡的细胞核。
2.5 CTS B对冷藏期间建鲤鱼肉剪切力的影响
由图5可知,2组建鲤鱼片肉的剪切力值均在冷藏期间逐渐降低,且实验组的剪切力值均低于对照组,这一方面说明CTS B能够加快鱼肉蛋白的降解,致使肉片软化加速,与CTS B是鱼类死后主要的蛋白降解酶之一的结论相符。同时与cathepsins活性与鱼肉的剪切力成负相关的研究结果一致[32]。此外,冷藏1 d时,CTS B处理组剪切力值相较0 d下降尤为明显(P<0.05),这与实验组此时的ROS相对含量及羰基值增速最高,细胞凋亡率开始高于对照组的趋势一致。铁槐茂[5]研究发现鱼片冷藏期间细胞凋亡率和剪切力呈负相关,凋亡率越高,品质劣化越严重。死后早期凋亡被启动后,细胞皱缩,细胞骨架开始紊乱,最终在凋亡调控因子以及激活的凋亡效应酶Caspase 3,以及组织蛋白酶和Calpain等的协同作用下,肌细胞骨架蛋白逐渐被降解,促使肌肉组织结构完整性受到破坏进而表现为质构品质的下降[4, 33]。而在冷藏后期(4~5 d)剪切力的迅速下降,应该主要与各种内源蛋白酶对结构蛋白的大量水解、细胞坏死更为密切相关,因为此时绝大部分细胞均已发生中期凋亡,且凋亡率没有差异。作为组织整体的骨骼肌,内部细胞骨架蛋白的水解机制以及相应生化变化机制,并不是单一的,细胞坏死在宰后动物肌肉组织中也会因生理生化因素的动态变化而不同程度的发生[34]。
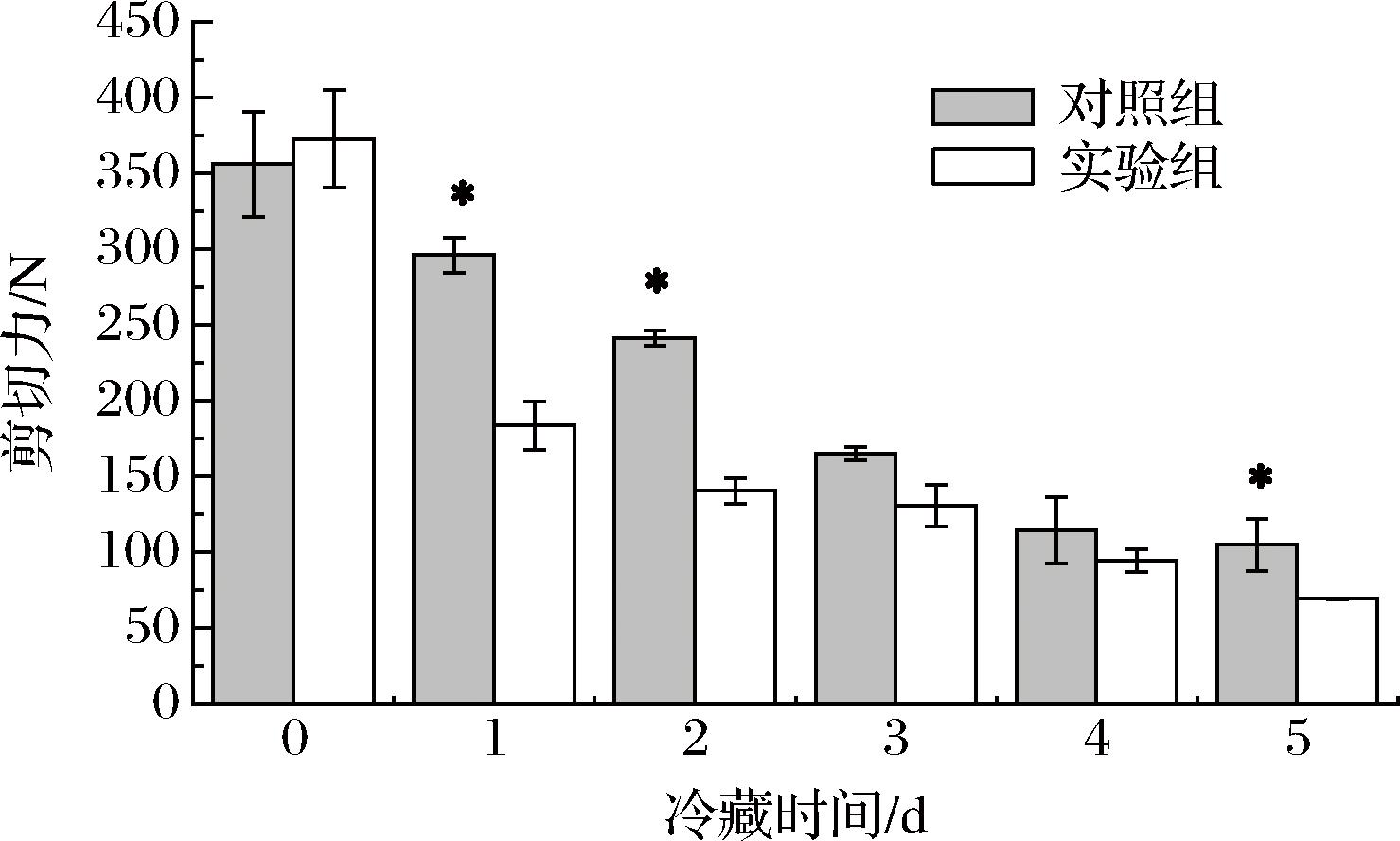
图5 建鲤肉片冷藏期内剪切力的变化
Fig.5 Changes in shear force of Jian carp fillet during refrigeration storage
2.6 CTS B对冷藏建鲤鱼肉汁液流失率的影响
冷藏建鲤鱼肉片的汁液流失率随着冷藏时间的延长呈现不断上升的趋势(图6),说明鱼肉的持水力持续发生劣化。从第1天开始实验组鱼肉的汁液流失率显著高于对照组(P<0.05)。肌原纤维氧化会降低肌肉本身的持水力[35],鱼肉蛋白氧化变性程度越高,鱼肉的质构和持水性越差[36]。本研究中CTS B处理后的鱼肉ROS生成量及蛋白羰基值,明显升高,说明肌原纤维蛋白氧化加剧,是使鱼肉的持水力下降的重要原因之一;同时推测冷藏期间,ROS与CTS B协同作用,促进鱼体肌细胞凋亡,加剧鱼肉细胞骨架蛋白降解,也会导致实验组汁液流失率显著高于对照组。有研究也表明草鱼冷藏期间,凋亡的发生与品质变化密切相关,凋亡率越高,持水率越低[5]。
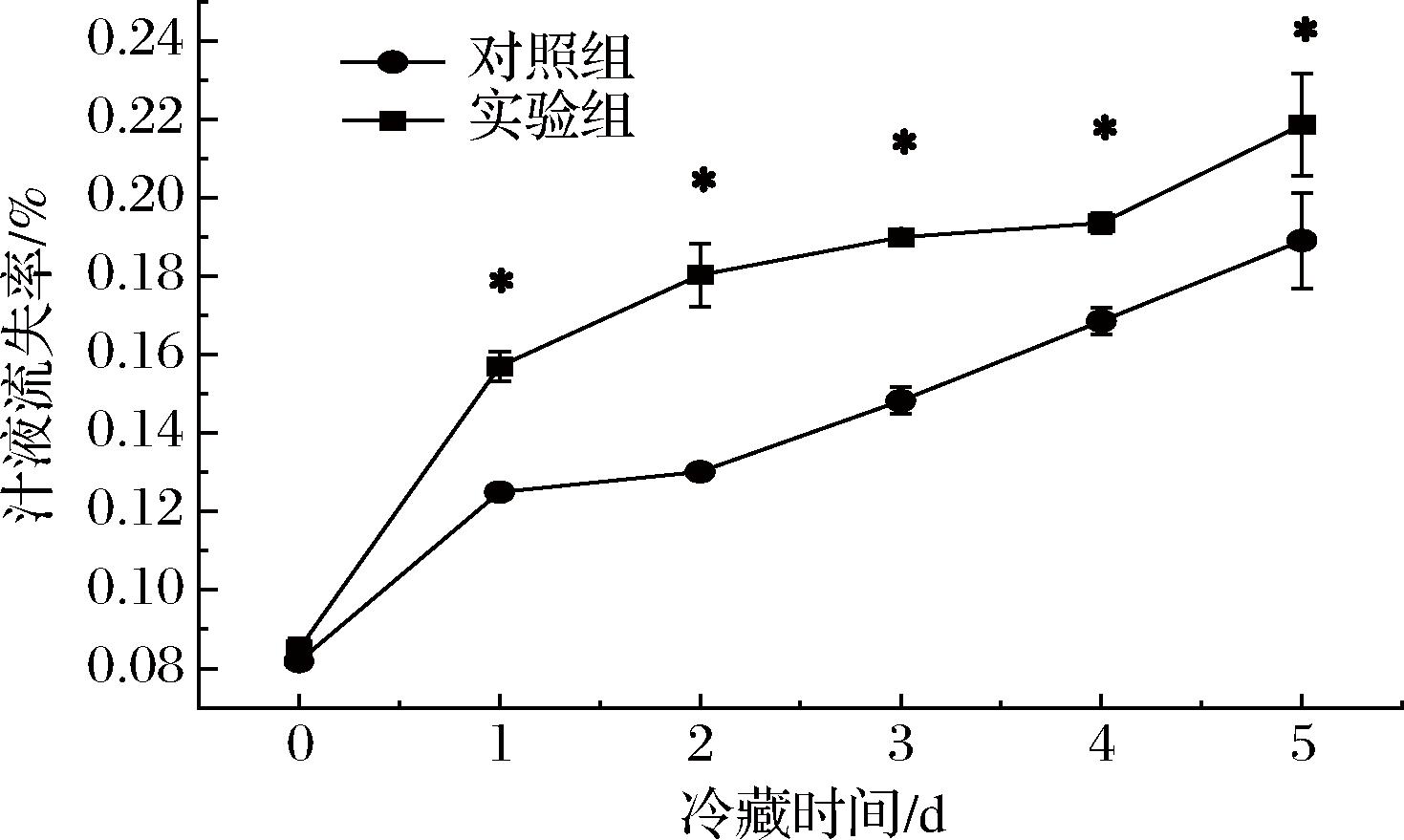
图6 建鲤肉片冷藏期内汁液流失率的变化
Fig.6 Changes in drip loss of Jian carp fillet during refrigeration storage
3 结论
本文利用真核重组建鲤CTS B注射处理建鲤鱼肉片并于4 ℃冷藏5 d,发现CTS B活性与冷藏前3 d期间建鲤鱼肉ROS生成量、肌原纤维蛋白氧化以及细胞凋亡发生之间,存在一定的协同性和相关性,并最终导致冷藏建鲤鱼片剪切力、汁液流失率显著降低;冷藏后2 d内品质劣变趋势则主要与CTS B活性及ROS生成量趋势基本一致。尽管CTS B本身具有水解肌原纤维的活性,但是本实验的结果提示了另一种可能性,即冷藏前期,CTS B可能通过与ROS协同调控肌细胞凋亡的方式,加速骨架蛋白的氧化及降解,促进冷藏鱼肉片品质的劣变,但其机制还有待深入探究。
[1] 朱健, 王建新.建鲤品种特性研究进展[J].浙江海洋学院学报(自然科学版), 2004, 23(1):52-55.
ZHU J, WANG J X.Status of the studies on the characteristics of Jian carp, Cyprinus carpio var.Jian[J].Journal of Zhejiang Ocean University (Natural Science), 2004, 23(1):52-55.
[2] AHMED Z, DONKOR O, STREET W A, et al.Calpains- and cathepsins-induced myofibrillar changes in post-mortem fish:Impact on structural softening and release of bioactive peptides[J].Trends in Food Science &Technology, 2015, 45(1):130-146.
[3] 薛盼盼. 宰后猪肉成熟过程中肌细胞凋亡和自噬对肉品质的影响及相关代谢产物的变化[D].扬州:扬州大学, 2021.
XUE P P.Effects of apoptosis and autophagy of muscle cells on meat quality and changes of related metabolites during postmortem pork maturation[D].Yangzhou:Yangzhou University, 2021.
[4] HE Y F, HUANG H, LI L H, et al.Changes in apoptosis factors and activation of caspase-3 in tilapia muscle during storage[J].International Journal of Food Properties, 2018, 21(1):1800-1810.
[5] 铁槐茂. 草鱼冷藏过程中肌细胞凋亡对品质变化的影响及其作用机制研究[D].无锡:江南大学, 2022.
TIE H M.Effects of apoptosis on the changes of flesh quality and the related mechanisms in postmortem grass carp (Ctenopharyngodon idella) muscle stored at 4 ℃[D].Wuxi:Jiangnan University, 2022.
[6] 何燕富. 三种内源性蛋白酶对罗非鱼贮藏品质的影响机理研究[D].南京:南京农业大学, 2018.
HE Y F.The effects of three endogenous proteases on storage quality of tilapia and its mechanism[D].Nanjing:Nanjing Agricultural University, 2018.
[7] DE CASTRO M G, BUNT G, WOUTERS F S.Cathepsin B launches an apoptotic exit effort upon cell death-associated disruption of lysosomes[J].Cell Death Discovery, 2016, 2:16012.
[8] WANG J P, ZHENG M Y, YANG X H, et al.The role of cathepsin B in pathophysiologies of non-tumor and tumor tissues:A systematic review[J].Journal of Cancer, 2023, 14(12):2344-2358.
[9] YU F F, CHEN Z Y, WANG B L, et al.The role of lysosome in cell death regulation[J].Tumour Biology, 2016, 37(2):1427-1436.
[10] BECHET D, TASSA A, TAILLANDIER D, et al.Lysosomal proteolysis in skeletal muscle[J].The International Journal of Biochemistry &Cell Biology, 2005, 37(10):2098-2114.
[11] CIRMAN T, ![]() K, MAZOVEC G D, et al.Selective disruption of lysosomes in HeLa cells triggers apoptosis mediated by cleavage of bid by multiple papain-like lysosomal cathepsins[J].Journal of Biological Chemistry, 2004, 279(5):3578-3587.
K, MAZOVEC G D, et al.Selective disruption of lysosomes in HeLa cells triggers apoptosis mediated by cleavage of bid by multiple papain-like lysosomal cathepsins[J].Journal of Biological Chemistry, 2004, 279(5):3578-3587.
[12] DOMíNGUEZ R, PATEIRO M, MUNEKATA P E S, et al.Protein oxidation in muscle foods:A comprehensive review[J].Antioxidants, 2021, 11(1):60.
[13] LI X, LIU P P, ZHAO Y F, et al.Oxidative stress contributes to cytoskeletal protein degradation of Esox lucius through activation of mitochondrial apoptosis during postmortem storage[J].Foods, 2022, 11(9):1308.
[14] XING T, GAO F, TUME R K, et al.Stress effects on meat quality:A mechanistic perspective[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18(2):380-401.
[15] BREZNIK B, ![]() A, LAH T T, et al.Cystatins in cancer progression:More than just cathepsin inhibitors[J].Biochimie, 2019, 166:233-250.
A, LAH T T, et al.Cystatins in cancer progression:More than just cathepsin inhibitors[J].Biochimie, 2019, 166:233-250.
[16] 朱伟宁. 十二指肠贾第虫组织蛋白酶B在贾第虫与宿主细胞互作过程中的功能探究[D].哈尔滨:东北农业大学, 2022.
ZHU W N.Functional study of Giardia doudenalis cathepsin B in the interaction between Giardia and host cells[D].Harbin:Northeast Agricultural University, 2022.
[17] 卢涵. 鳙鱼肉低温贮藏过程中蛋白氧化、组织蛋白酶活性与品质变化规律的研究[D].北京:中国农业大学, 2017.
LU H.Protein oxidation, cathepsins activity and the quality changes of bighead carp (Aristichthys nobilis) during low-temperature storage[D].Beijing:China Agricultural University, 2017.
[18] STOJNEV S, ![]() L.Reactive oxygen species, apoptosis and cancer[J].Vojnosanitetski Pregled, 2013, 70(7):675-678.
L.Reactive oxygen species, apoptosis and cancer[J].Vojnosanitetski Pregled, 2013, 70(7):675-678.
[19] LALMANACH G, SAIDI A, BIGOT P, et al.Regulation of the proteolytic activity of cysteine cathepsins by oxidants[J].International Journal of Molecular Sciences, 2020, 21(6):1944.
[20] 张佳莹. 线粒体通路信号介导细胞凋亡机制及对宰后牛肉嫩化影响[D].兰州:甘肃农业大学, 2020.
ZHANG J Y.The mechanism of effects of mitochondrial pathway signaling mediated apoptosis on bovine muscle tenderization during postmortem aging[D].Lanzhou:Gansu Agricultural University, 2020.
[21] LI S H, LI R, ZHONG H X, et al.Immunolocalization of Jian carp (Cyprinus carpio var.Jian) cathepsin B:Cloning, expression, characterization, and antibody preparation[J].Journal of Food Science, 2017, 82(5):1092-1100.
[22] OLIVER C N, AHN B W, MOERMAN E J, et al.Age-related changes in oxidized proteins[J].Journal of Biological Chemistry, 1987, 262(12):5 488-5 491.
[23] 谭小千. 鲢鱼重组 Cystatin 对冷藏乌鱼肉片保鲜作用的研究[D].雅安:四川农业大学, 2022.
TAN X Q.Effects of silver carp recombinant Cystatin on preservation of frozen mullet fillet[D].Ya'an:Sichuan Agricultural University, 2022.
[24] 沈妮. 带鱼低温贮藏蛋白氧化、组织蛋白酶活性及鱼肉质地结构的变化规律[D].杭州:浙江大学, 2019.
SHEN N. Protein oxidation, cathepsins activity, texture and structure of muscle changes of hairtail during low-temperature storage[D].Hangzhou:Zhejiang:Zhejiang University, 2019.
[25] QIU H H, GUO X, DENG X R, et al.The influence of endogenous cathepsin in different subcellular fractions on the quality deterioration of Northern Pike (Esox lucius) fillets during refrigeration and partial freezing storage[J].Food Science and Biotechnology, 2020, 29(10):1331-1341.
[26] HAFNER ![]() et al.Lysosomal pathways to cell death and their therapeutic applications[J].Experimental Cell Research, 2012, 318(11):1245-1251.
et al.Lysosomal pathways to cell death and their therapeutic applications[J].Experimental Cell Research, 2012, 318(11):1245-1251.
[27] ROKITA S E.Radical-mediated protein oxidation:From chemistry to medicine. Michael J. Davies, Roger T. Dean[J].The Quarterly Review of Biology, 1999, 74(1):114-115.
[28] 张玉林. 宰后活性氧簇(ROS)的形成对鹅肉品质影响机制的研究[D].宁波:宁波大学, 2014.
ZHANG Y L.The mechanism of the influence on meat quality of goose muscle caused by the generation of reactive oxygen species (ROS) after slaughter[D].Ningbo:Ningbo University, 2014.
[29] HE Y F, HUANG H, LI L H, et al.The effects of modified atmosphere packaging and enzyme inhibitors on protein oxidation of tilapia muscle during iced storage[J].LWT, 2018, 87:186-193.
[30] MORZEL M, GATELLIER P, SAYD T, et al.Chemical oxidation decreases proteolytic susceptibility of skeletal muscle myofibrillar proteins[J].Meat Science, 2006, 73(3):536-543.
[31] 徐永霞, 王瑞, 李学鹏, 等.热处理对鱼肌原纤维蛋白结构及腥味物质结合能力的影响[J].中国食品学报, 2020, 20(9):131-138.
XU Y X, WANG R, LI X P, et al.Effects of heat treatment on the structure of myofibrillar protein and binding ability with fishy odor compounds[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(9):131-138.
[32] 葛黎红. 内源蛋白酶在低温保鲜草鱼质构劣化中的作用与控制研究[D].无锡:江南大学, 2017.
GE L H.Study on correlation of endogenous proteases with texture deterioration of grass carp (Ctenopharyngodon idella) during chilled storage and quality control[D].Wuxi:Jiangnan University, 2017.
[33] SINGH A, BENJAKUL S.Proteolysis and its control using protease inhibitors in fish and fish products:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2018, 17(2):496-509.
[34] 曹锦轩. 宰后牛肉成熟过程中肌细胞死亡生理研究[D].南京:南京农业大学, 2012.
CAO J X.The research on the physiology of the death of myocytes in beef during postmortem conditioning[D].Nanjing:Nanjing Agricultural University, 2012.
[35] 刘泽龙. 蛋白质氧化对肉及肉制品持水与水合特性的影响机理研究[D].无锡:江南大学, 2012.
LIU Z L.Mechanism of the alterations of water-holding capacity and hydration in meat and meat products induced by protein oxidation[D].Wuxi:Jiangnan University, 2012.
[36] 卢涵. -20 ℃下鳙鱼肉中组织蛋白酶B及L对其肌纤维微结构及持水力的影响[J].华中农业大学学报, 2019, 38(5):122-129.
LU H.Effects of cathepsin B and L on myofibrillar microstructure and water-holding capacity of bighead carp (Aristichthys nobilis) fillets stored at -20 ℃[J].Journal of Huazhong Agricultural University, 2019, 38(5):122-129.